Bucky kinder-DRN’s
Uitgangsvraag
Welke diagnostische referentieniveaus moeten voor kinderen in Nederland aangehouden worden voor de beeldvormende modaliteit bucky?
Aanbeveling
Toets voor protocol bucky hoofd, bucky thorax, bucky abdomen, bucky bekken, bucky wervelkolom totaal, bucky wervelkolom cervicaal, bucky wervelkolom thoracaal en bucky wervelkolom lumbaal aan de vastgestelde DRN’s in onderstaande tabel 8 en neem eventueel maatregelen als de DRN niet gehaald wordt. *
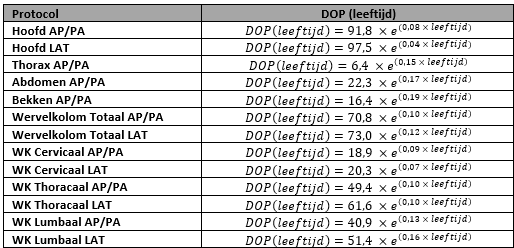
Tabel 8 Exponentiële functies voor de DRN-curves bucky protocollen – DOP (mGy x cm2)
Zie voor visuele curves figuren 4 en 5 in de overwegingen.
* aan de hand van de implementatietool (zie bijlagen “Gebruik implementatietool Bucky voor toetsing aan kinder-DRN’s” en “Implementatietool Bucky” van deze module)
Overwegingen
Voor- en nadelen van de diagnostische procedure en de kwaliteit van het bewijs
Literatuur
De studies in de literatuuranalyse zijn zeer divers in opzet en uitvoering en betreffen veel verschillende protocollen waardoor er niet makkelijk vergeleken kan worden. Voor het bepalen en rapporteren van een DRN per type onderzoek wordt vooral gebruik gemaakt van de 75e percentiel methode vanuit de Europese Commissie (EC) voor bepaalde leeftijdscategorieën en in nieuwere studies de curve-methode (European Commission, 2018).
Voor thoraxprotocollen varieert de DRN-waarde tussen 5 en 395 mGy x cm2. Voor buikprotocollen varieert de DRN-waarde tussen 20 en 1540 mGy x cm2. Voor bekkenprotocollen varieert de DRN-waarde tussen 10 en 917 mGy x cm2. Voor de overige protocollen varieert deze tussen 48 en 843 mGy x cm2. Sommige van de overige protocollen zijn voor de huidige DRN richtlijn van belang, zoals hersenprotocollen (AP varieert tussen 120 en 500 mGy x cm2, LAT varieert tussen 100 en 350 mGy x cm2) en lumbale wervelkolom protocollen (AP 10-15 jaar 418 mGy x cm2, LAT 10-15 jaar 843 mGy x cm2).
Methodiek vaststellen DRN – indeling in categorieën
Omdat kinderen qua lengte en gewicht veel van elkaar verschillen is een onderverdeling in categorieën nodig. Uit de literatuurstudie blijkt dat de gebruikte methoden om een kinder-DRN te bepalen weinig uniform is qua indeling voor de gebruikte categorie. De Europese richtlijn “Radiation protection No 185: European Guidelines on diagnostic reference levels for paediatric imaging” (PiDRL) (European Commission, 2018) voor DRN in kinderradiologie adviseert om gewichtscategorieën te gebruiken (vanwege de betere correlatie met dosiswaarden). In deze Europese PiDRL richtlijn wordt aangegeven dat een leeftijd-gebaseerde categorie-indeling gebruikt kan worden tot gewicht-gebaseerde dosisverzameling mogelijk is.
Hoewel gewicht het aanbevolen patiëntkenmerk is om DRN’s van lichaamsscans te classificeren in de EC-methode (European Commission, 2018), had alleen Paulo (2016) genoeg patiëntinformatie om DRN’s voor verschillende gewichtsklassen te berekenen. Paulo (2016) adviseerde gebruik van gewichtsklasse data voor DRN’s omdat gewicht de variatie in stralingsdosis beter verklaart dan leeftijd. Daarnaast gebruikte Almén (2021) een curve-methode om de DRN’s te bepalen. Het voordeel hiervan is dat minder metingen per leeftijd of gewichtsklasse nodig zijn voor het vaststellen van de DRN’s. Dit is van belang omdat studies die de EC-methode hanteren, soms geen DRN konden berekenen voor een bepaalde leeftijd of gewicht, omdat minder dan tien observaties beschikbaar waren.
De Europese richtlijn “Radiation protection No 185: European Guidelines on diagnostic reference levels for paediatric imaging” PiDRL (European Commission, 2018) geeft een relatie tussen de gewichtscategorieën en de leeftijd (tabel 7.2 in appendix F), op basis van een correlatie tussen gemiddeld gewicht per leeftijd. Hiermee is de DRN-waarde per gewichtscategorie [0>5 kg], [5>15 kg], [15,>30 kg], [30>50 kg], [50- 80 kg] om te zetten naar een DRN per leeftijdscategorie [0>1 maand], [1maand>4 jaar], [4-10>, [10-14>, [14-18]. In veel literatuurstudies wordt zowel voor hoofd als voor thorax en abdomen de volgende indeling in leeftijdsgroepen gebruikt: [0,1>, [1,5], [6,10], [11,15]. Voor hoofd onderzoeken is dit afwijkend van de EDRL, waarin vanaf >6 jaar slechts 1 EDRL gegeven is. Echter bij veel studies verschilt de DRN-waarde voor hoofd tussen de 6-10 jaar en 11- 15 jaar groep, waardoor het aan te raden is voor hoofd dezelfde leeftijdscategorieën voor DRN’s aan te houden als voor de andere lichaamsdelen.
Op basis van de literatuur en aanbevelingen in de Europese richtlijn stelt de werkgroep voor een DRN vast te stellen op basis van leeftijdscategorieën [0>1 maand], [1 maand>4 jaar]; [4-10>, [10-14>, [14-18] voor alle lichaamsdelen (inclusief hoofd).
Door een DRN per leeftijdscategorie te gebruiken wordt de toetsing voor ziekenhuizen relatief eenvoudig implementeerbaar. Ook maakt dit het mogelijk om de Nederlandse DRN-waarde met de DRN’s van andere landen te vergelijken.
Methodiek vaststellen DRN – DRN-bepaling
Om een landelijke DRN per leeftijdscategorie op te stellen zijn verschillende systematieken mogelijk. Als statistische methoden zijn er twee methoden: 1) bepalen van de 75e percentiel van de verdeling van de mediaanwaarden van alle ziekenhuizen, of, in het geval dat er weinig ziekenhuizen participeren, 2) bepalen van de 75e percentiel van de verdeling van alle waarden tezamen. Daarnaast is de curve-methodiek mogelijk.
Het opstellen van een landelijke DRN per leeftijdscategorie met de statistische methoden vereist per ziekenhuis een minimumaantal, te weten tien patiënten per procedure per leeftijdscategorie (European Commission, 2018). Omdat relatief weinig data beschikbaar is bij kinderen is de DRN-curve methodiek een goede methode. Hierbij wordt een DRN-curve gemaakt met gewicht of leeftijd op de x-as en dosisgrootheid op de y-as (European Commission, 2018). Een aantal studies in de literatuur past dit toe (Almén, 2021; Almén, 2022). Een voordeel van de curve-methode is dat met minder datapunten per leeftijd of gewichtsklasse een DRN bepaald kan worden, waardoor meer DRN’s betrouwbaar bepaald kunnen worden. Op basis hiervan wordt ervoor gekozen om in deze richtlijn een leeftijd-gebaseerde DRN vast te stellen op basis van de DRN-curve-methode, omdat deze in de Nederlandse praktijk makkelijker te implementeren is, aangezien in Nederland doorgaans wel leeftijd op de onderzoeksdatum, maar niet altijd een recent gewicht bekend is.
Methode dataverzameling Nederland ten behoeve van DRN bepaling
Na een landelijk uitgezette uitvraag hebben 23 ziekenhuizen data aangeleverd van röntgenonderzoeken uitgevoerd in de periode van 1‑1‑2017 tot 1-6-2021. Voor de modaliteit bucky is per onderzoek de dosisparameter dosis oppervlakte product (DOP) verzameld, daarnaast protocolnaam, leeftijd op de onderzoeksdatum of geboortedatum en onderzoeksdatum/tijd. De protocollen waarvan data is aangeleverd zijn Hoofd, Thorax, Abdomen, Bekken, Wervelkolom Totaal, Wervelkolom Cervicaal, Wervelkolom Thoracaal en Wervelkolom Lumbaal. Met behulp van de curve-methode zijn de DRN’s bepaald. Tevens zijn uit de DRN-curve DRN-waarden per leeftijdscategorie voor elk protocol vastgesteld. Voor details van de methode zie bijlage “Methodiek Bucky” van deze module.
Resultaten onderzoek
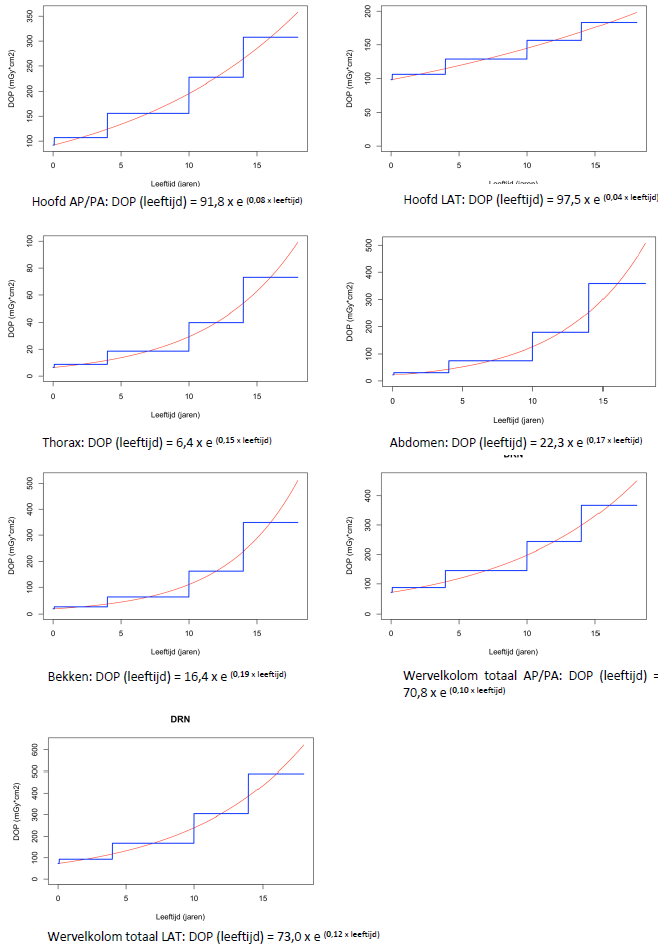
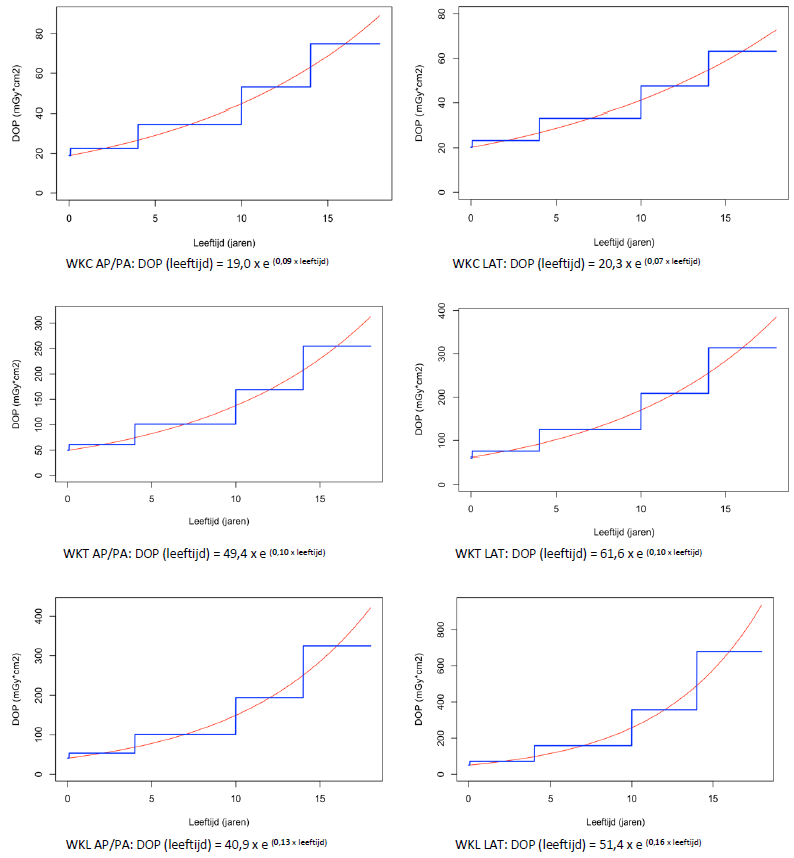
De resultaten van in totaal 23 centra zijn geanalyseerd op basis van de methodiek zoals beschreven in bijlage “Methodiek Bucky” van deze module. Voor de Bucky protocollen zijn de DRN-curves weergegeven in figuur 4 voor algemene protocollen en figuur 5 voor wervelkolom protocollen. Daarnaast zijn in tabel 6 voor algemene protocollen en tabel 7 voor specifieke wervelkolom protocollen DLP DRN-waardes gegeven per leeftijdscategorie, welke in dosisregistratiesystemen gebruikt kunnen worden. Meer details over de DRN-curves zijn te vinden in bijlage “Resultaten Bucky” van deze module.
Figuur 4 Vastgestelde DOP DRN-curves voor Bucky protocollen voor hoofd AP/PA (linksboven), hoofd LAT (rechtsboven), thorax AP/PA (2e rij links), abdomen AP/PA (2e rij rechts), bekken AP/PA (3e rij links), wervelkolom totaal AP/PA (3e rij rechts) en wervelkolom totaal LAT (linksonder). De rode lijn is de vastgestelde DRN (75e percentiel). De blauwe lijn de DRN per leeftijdscategorie.
Afkortingen: LAT = lateraal, AP/PA = anteroposterior (AP)/ posteroanterior (AP)
Figuur 5 Vastgestelde DOP DRN-curves voor Bucky protocollen voor WKC AP/PA (linksboven), WKC LAT (rechtsboven), WKT AP/PA (links midden), WKT LAT (rechts midden), WKL AP/PA (linksonder) en WKL LAT (rechtsonder). De rode lijn is de vastgestelde DRN (75e percentiel). De blauwe lijn de DRN per leeftijdscategorie.
Afkortingen: WKC= wervelkolom cervicaal, WKT = wervelkolom thoracaal, WKL= wervelkolom lumbaal, LAT = lateraal, AP/PA = anteroposterior (AP)/ posteroanterior (AP)
Tabel 6 Bucky protocollen; gerapporteerde DOP (mGy x cm2) DRN-waarden gebaseerd op mediane leeftijd per categorie
|
Leeftijd (mediaan) |
Hoofd AP/PA |
Hoofd LAT |
Thorax AP/PA |
Abdomen AP/PA |
Bekken AP/PA |
Wervelkolom Totaal AP/PA |
Wervelkolom Totaal LAT |
|
0-1mnd |
92,0 |
98,1 |
6,4 |
22,5 |
16,5 |
71,1 |
73,5 |
|
1mnd-4jr |
107,0 |
106,1 |
8,7 |
31,8 |
24,2 |
87,4 |
93,2 |
|
4-10jr |
155,8 |
128,8 |
18,6 |
75,2 |
62,5 |
145,5 |
168,2 |
|
10-14jr |
227,4 |
156,7 |
39,8 |
179,1 |
162,4 |
243,4 |
304,7 |
|
14-18jr |
307,8 |
183,2 |
73,1 |
358,7 |
348,7 |
367,2 |
490,3 |
|
Aantal Centra |
7 |
6 |
22 |
19 |
18 |
9 |
7 |
Afkortingen: LAT = lateraal, AP/PA = anteroposterior (AP)/ posteroanterior (AP)
Tabel 7 Bucky protocollen; gerapporteerde DOP (mGy x cm2) wervelkolom DRN-waarden gebaseerd op mediane leeftijd per categorie
|
Leeftijd (mediaan) |
WK Cervicaal AP/PA |
WK Cervicaal LAT |
WK Thoracaal AP/PA |
WK Thoracaal LAT |
WK Lumbaal AP/PA |
WK Lumbaal LAT |
|
0-1mnd |
19,0 |
20,3 |
49,6 |
61,5 |
41,1 |
51,7 |
|
1mnd-4jr |
22,5 |
23,4 |
60,9 |
75,5 |
53,2 |
71,4 |
|
4-10jr |
34,5 |
33,3 |
101,2 |
125,3 |
101,2 |
158,9 |
|
10-14jr |
53,1 |
47,5 |
169,0 |
208,8 |
193,5 |
356,0 |
|
14-18jr |
74,9 |
63,1 |
254,7 |
314,2 |
324,9 |
678,8 |
|
Aantal Centra |
12 |
13 |
14 |
14 |
14 |
14 |
Afkortingen: WK = wervelkolom, LAT = lateraal, AP/PA = anteroposterior (AP)/ posteroanterior (AP)
Interpretatie van resultaten
Voor abdomen-, thorax-, en bekkenonderzoeken zijn de data-analyse DRN-waarden redelijk in lijn met de literatuurwaarden.
Daarnaast laten datapunten waarop de curves zijn gebaseerd zien dat er binnen een leeftijdsgroep veel variatie kan zijn in de data. Indien in een ziekenhuis de leeftijd niet gelijk verdeeld is binnen een leeftijdscategorie kan dit leiden tot een relatief lagere of hogere dosisregistratiewaarde ten op zichtte van de DRN-waarde gebaseerd op mediane leeftijd (zie tabel 6 en 7), terwijl bij toetsing aan de DRN-curve wel aan de DRN’s voldaan zou worden.
Algemene overwegingen literatuur en onderzoek
Het is belangrijk dat ziekenhuizen eenvoudig hun dosisgegevens kunnen toetsen aan de landelijke DRN. Daarom is gekozen voor een methode die goed implementeerbaar is, bijvoorbeeld in ziekenhuizen met dosisregistratiesystemen, als ook toepasbaar is voor ziekenhuizen met een laag aantal kinder-onderzoeken.
Een tweeledige werkwijze past hier het best bij: 1) er wordt een leeftijdsafhankelijke DRN-curve opgesteld waarbij alle verzamelde data van de ziekenhuizen gebruikt kan worden, ook wanneer er voor een bepaalde leeftijdscategorie weinig gegevens zijn en 2) uit deze DRN-curve worden de te toetsen dosiswaardes van het eigen instituut per leeftijdscategorie afgeleid.
Door te kiezen voor deze aanpak kunnen 1) ziekenhuizen de DRN-curve gebruiken om bij handmatige verzameling of na export van dosisgegevens uit een dosisregistratiesysteem de verzamelde gegevens per leeftijd te plotten op de DRN-curve en/ of kunnen 2) ziekenhuizen de DRN-toets per leeftijdscategorie implementeren in het dosisregistratiesysteem. Ook kunnen Nederlandse DRN-waarden vergeleken worden met Europese DRN-waarden.
Vervolgonderzoek is nodig voordat een gewicht-gebaseerde categorie-indeling overwogen kan worden.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De patiënt vindt het belangrijk goed geïnformeerd te worden over de reden van het onderzoek, over wat er gaat gebeuren, over mogelijke risico’s van het onderzoek en het effect op zijn of haar dagelijkse leven op de korte zowel als op de lange termijn. Deze risico’s en de communicatie daarvan met de patiënt dienen te worden besproken met de aanvragend specialist en worden beschreven in de richtlijn Beeldvorming met ioniserende straling (NVKF, 2021). Voor de communicatie van risico’s van straling is er voor de patiënt en hun ouders/verzorgers informatie te vinden op thuisarts.nl. Om de risico’s van een onderzoek met röntgenstraling zo klein mogelijk te houden, wil de patiënt een zo laag mogelijke dosis röntgenstraling ontvangen. Daarentegen is het voor de patiënt wel van belang dat de beeldkwaliteit goed genoeg is om de beelden accuraat te kunnen beoordelen. Het is wenselijk om hierin een optimale balans te vinden conform het ALARA (as low as reasonably achievable) principe (United States Nuclear Regulatory Commission (USNRC), 2021; Bbs, 2017)).
Om als ziekenhuis te weten of optimale instellingen gebruikt worden, kan de stralingsdosis vergeleken worden met landelijke referentieniveaus (DRN’s). Voor kinderen is het extra belangrijk dat ze niet te veel dosis krijgen. Daarom zijn er referentiewaarden opgesteld voor de meest voorkomende beeldvormende onderzoeken met röntgenstraling bij kinderen. Dankzij DRN’s kunnen ziekenhuizen toetsen hoeveel dosis zij geven ten opzichte van het vastgestelde referentieniveau. Hierdoor kunnen zij de patiëntdosis optimaliseren en worden eventuele verschillen tussen ziekenhuizen in de hoeveelheid straling die nodig is per onderzoek geminimaliseerd (ICRP, 2017; European Commission, 2018). DRN’s zijn niet bedoeld als dosislimiet voor de individuele patiënt.
Patiënten en hun ouders/verzorgers kunnen worden geïnformeerd over het bestaan van DRN-waarden. Ziekenhuizen zijn verplicht hun eigen dosisgrootheden hieraan te toetsen.
Kosten (middelenbeslag)
Het aanpassen van de stralingsdosis zal niet leiden tot hogere kosten van het onderzoek. Het gebruik van een optimale stralingsdosis zal zorgen voor zo min mogelijk negatieve effecten van stralingsbelasting en/of herhaalde onderzoeken, waardoor de zorgkosten op langere termijn ook laag blijven.
Er is een minimale uitbreiding van de urenbesteding (minder dan een dagdeel) voor medewerkers die DRN’s toetsingen uitvoeren, nu er meer kinderDRN’s zijn ten opzichte van de vorige kinderDRN’s. Deze minimale uitbreiding is heel gemakkelijk te verantwoorden ten opzichte van de meerwaarde van het toetsen van DRN’s.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep verwacht geen problemen ten aanzien van de aanvaardbaarheid, haalbaarheid en implementatie van deze richtlijn voor kinder-DRN’s gezien de bereidheid die ziekenhuizen eerder hebben laten zien bij het toetsen van hun dosisgrootheden aan al bestaande DRN’s. DRN’s worden al jaren gebruikt en zijn algemeen geaccepteerd als dosisvergelijking/ optimalisatie tool. In de Nederlandse wet staat ook dat er periodiek getoetst moet worden ten opzichte van referentieniveaus. Juist omdat het nu mogelijk wordt ook bij zeer kleine aantallen toch aan de DRN-curve te toetsen is de verwachting dat meer ziekenhuizen kunnen deelnemen, bijvoorbeeld ziekenhuizen die in het verleden door de eis van minstens tien patiënten én de scherpe leeftijdscategorie niet voldoende patiënten hadden voor een periodieke toetsing. Voor de in deze richtlijn met behulp van de curve-methode opgestelde DRN is een tool (zie bijlagen “Gebruik implementatietool Bucky voor toetsing aan kinder-DRN’s” en “Implementatietool Bucky” van deze module) ontwikkeld die het controleren van de DRN’s mogelijk maakt voor ziekenhuizen die slechts enkele onderzoeken per jaar uitvoeren.
Voor de communicatie van risico’s van straling is er voor de patiënten en hun ouders/verzorgers informatie te vinden op thuisarts.nl.
Rationale van de aanbeveling: weging van argumenten voor en tegen de diagnostische procedures
In de wetgeving is opgenomen dat het toetsen aan DRN’s verplicht is. Er is dus een zeer sterke aanbeveling om de DRN’s te gebruiken. Hiervoor moeten wel adequate en passende DRN’s beschikbaar zijn. Deze richtlijn geeft waarden voor de DRN’s voor veelgebruikte kinderprotocollen bij bucky röntgenonderzoeken. De DRN’s zijn gebaseerd op data-analyse van 23 Nederlandse ziekenhuizen, waaronder enkele grote academische centra die veel kinderen onderzoeken.
Ziekenhuizen moeten periodiek toetsen of ze voldoen aan de DRN’s. Hiervoor kunnen ze een waarde of een curve gebruiken. Door deze tweeledige systematiek zal het voor ziekenhuizen makkelijker worden om te toetsen aan de kinder-DRN.
De voordelen van het gebruik van een landelijke DRN is dat er betere sturing op lage stralingsbelasting bij kinderen mogelijk is. De nieuwe DRN (die een bestaande Nederlandse kinder-DRN vervangt) is aangepast aan onderzoeken met moderne radiologische apparatuur en beter in lijn met werkelijk haalbare dosis. De nieuwe Nederlandse DRN is lager dan de Europese “Radiation protection No 185: European Guidelines on diagnostic reference levels for paediatric imaging” (PiDRL) (European Commission, 2018) en ook lager dan in veel wetenschappelijke studies. Het gebruik van de geadviseerde DRN’s gaat ervoor gaat zorgen, dat in Nederland gestuurd gaat worden op stralingszuinige instellingen bij kinderen.
Onderbouwing
Achtergrond
Uit de praktijk is bekend dat er variatie bestaat in de stralingsbelasting van de beeldvormende modaliteit bucky bij kinderen. Dit biedt ruimte voor verbetering in termen van meer uniformiteit tussen de ziekenhuizen, wat wenselijk is aangezien röntgenstraling schadelijk kan zijn. Zorgvuldig gebruik is daarom belangrijk. Daarnaast kan de kwaliteit van de beelden variëren, dit is onwenselijk voor de diagnostiek. Het is de taak van de klinisch fysicus, radioloog en radiodiagnostisch laborant om de beeldkwaliteit te optimaliseren tegen een zo laag als redelijkerwijs mogelijke stralingsbelasting voor de patiënt (as low as reasonably achievable (ALARA) (United States Nuclear Regulatory Commission (USNRC), 2021)) conform het “Besluit basisveiligheidsnormen stralingsbescherming” (Bbs) (Bbs, 2017). Er bestaat een aantal Europese referentiesniveaus, maar de Europese richtlijn “Radiation protection No 185: European Guidelines on diagnostic reference levels for paediatric imaging”(PiDRL) adviseert sterk om nationale diagnostische referentieniveau’s (DRN’s) te gebruiken (European Commission, 2018). Er bestaat een aantal Nederlandse kinder-DRN’s, maar deze zijn gebaseerd op sterk verouderde en niet volledig Nederlandse data (beschreven in het rapport ‘Stralingsbescherming in het ziekenhuis’ van de Nederlandse commissie voor stralingsdosimetrie (NCS) van juni 2012). Bovendien ontbreken DRN’s voor sommige protocollen die veelvuldig in de praktijk worden gebruikt, zoals wervelkolom opnames. In deze modules wordt getracht kinder-DRN’s te bepalen die beter aansluiten op de huidige Nederlandse praktijk en kinder-DRN’s te bepalen voor veel voorkomende protocollen waarvoor nog geen DRN gespecificeerd is.
Conclusies / Summary of Findings
|
- GRADE |
We could not apply the GRADE method for weighting the evidence and drawing conclusions about the literature because of the non-comparative study designs. |
Samenvatting literatuur
Description of studies
Table 1 describes the characteristics of the 8 conventional radiography studies included in the analysis. All studies report a DRL for the dose-area product (DAP) or an equivalent measure such as the kerma-area product (KAP or PKA). Six studies derive a national DRL, two a regional DRL (Almén, 2021; Almén 2022) and one a European DRL (Smans, 2008). Most DRLs were based on patient age (usually for age brackets), although DRLs based on weight (Almén, 2022; Paulo, 2016) or weight estimates based on age (Célier, 2020b; Schegerer, 2019) were given in four more recent publications. In terms of examination type, eight studies reported thorax DRLs, six studies reported abdomen DRLs, five studies reported pelvis DRLs, two studies reported brain DRLs and one study reported hips/joints DRLs.
To establish DRLs most studies used the third quartile values of the dose distribution for each type of examination and, if applicable, age or weight group of interest. Recent studies base their approach on the 2018 European Commission (EC) guidelines on diagnostic reference levels for paediatric imaging (PiDRL) (European Commission, 2018), while older studies refer to earlier EC documents (European Commission, 1996) or the International Commission on Radiological Protection (ICRP) recommendations (ICRP, 2017). One study (Almén, 2021) established DRLs using a curve method based on the Radiation and Nuclear Safety Authority in Finland, STUK guidelines (STUK S/4/2019, 2019). The basis is to fit an exponential curve to the collected dose indices for each examination type, with the dose indices as the dependent variable and patient weight as the independent variable. The exponential curve used by Almén (2021) was D(w) = a x e(k x w). “D” and “w” are the dose index and weight collected for each patient, “k” is the regression coefficient associated with the exponential increase of the dose indices and was derived for the different examinations. The a -value was calculated using D, w and k. The third quartile value (Dq3) for the “a -values” was used to define the DRL curve: DRL(w) Dq3 x e(k x w).
Table 1: Summary of characteristics of selected plain radiography studies
|
Reference |
Type of DRL |
DRL method |
No. of Scanners |
No. of hospitals |
No. of patients |
Reported by age or weight |
Body part studied |
|
Billinger 2010 |
Austrian national DRL |
75th percentile of average patient entrance doses. Average patient dose was derived per facility from an exponential regression formula. |
25 |
14 |
41 (abdomen), 549 (brain ap/pa), 429 (brain lat), 723 (thorax) |
Age |
Brain, thorax, abdomen |
|
Célier 2020b |
French national DRL |
75th percentile of the distribution of the median values per location. Only calculated if there were at least 10 patients. |
42 |
16 |
2249, minimum 10 patients per procedure |
Age and weight |
Thorax, abdomen, pelvis |
|
European Commission 2018 |
European DRL |
75th percentile of the distribution of the median values of all locations. |
- |
- |
- |
Age for head, weight for thorax, abdomen, pelvis |
Thorax, abdomen, pelvis |
|
Smans 2008 |
European DRL, including 13 countries |
75th percentile |
- |
14 |
Not reported |
Age |
Thorax |
|
Paulo 2016 |
Portuguese national DRL |
75th percentile of median values for age/weight brackets, 75th percentile of average values for specific weights |
- |
3 |
9935, minimum 10 patients per DRL. |
Age and weight |
Thorax, pelvis, abdomen |
|
Matthews 2014 |
Irish national DRL |
75th percentile of mean values for each examination in each age group in each location. |
- |
18 |
568, ranging 14-266 patients per examination. |
Age |
Thorax, pelvis, abdomen, spine |
|
Schegerer 2019 |
German national DRL |
EC guideline: 75th percentiles of the particular dose distributions. |
Unclear, combined multiple databases that rely on data from >100 hospitals |
Unclear, minimum 50 per DRL |
Weight plus age |
Thorax, abdomen, pelvis |
|
|
Almén 2022 |
Nordic regional DRL, including Denmark, Iceland, Norway, and Sweden |
EC guideline: 75th percentile of the distribution of the median values per location. |
- |
31 |
1438, minimum 15 patients |
Weight |
Thorax, abdomen, pelvis, hips/joints |
|
Almén 2021 |
Nordic regional DRL, including Denmark, Iceland, Norway, and Sweden |
Curve with exponential fit |
- |
29 |
1394 |
Weight |
Thorax, abdomen, pelvis, hips/joints |
DRLs=Diagnostic reference levels
Results
DRLs for specific age or weight brackets are described in table 2 for thorax examinations, table 3 for abdomen examinations, table 4 for pelvis examinations and table 5 for other types of examinations. The studies are very diverse in design and implementation. Therefore, it was not possible to perform a meta-analysis or calculate summary statistics for the data from tables 2-5. In terms of the method used to derive DRLs, there were differences between studies in weight-based vs age-based diagnostic reference levels and use of the curve method.
Weight-based versus age-based diagnostic reference levels
Billinger (2010), Matthews (2014) and Smans (2008) calculated DRLs for different age brackets. Almén (2022) only reported weight based DRLs. Paulo (2016) calculated DRLs for different age and weight classes. The authors recommended using DRLs based on weight brackets because weight better explains the variation in radiation dose. The European Commission (2018) reported age based DRLs for head and weight based DRLs for other body parts. In addition, two studies also reported weight brackets for DRLs for other body parts, but the weights were estimated based on the patient’s age instead of being based on actual weight measures from patients (Célier, 2020a; Schegerer, 2019). These two studies reported both the age bracket and weight bracket (estimated based on age) for each DRL. In both studies, weight was only measured in a small subset of patients per location. Therefore, both studies verified per location that the median values based on weight from actual measurements corresponded to the median values based on weight estimated from patient age.
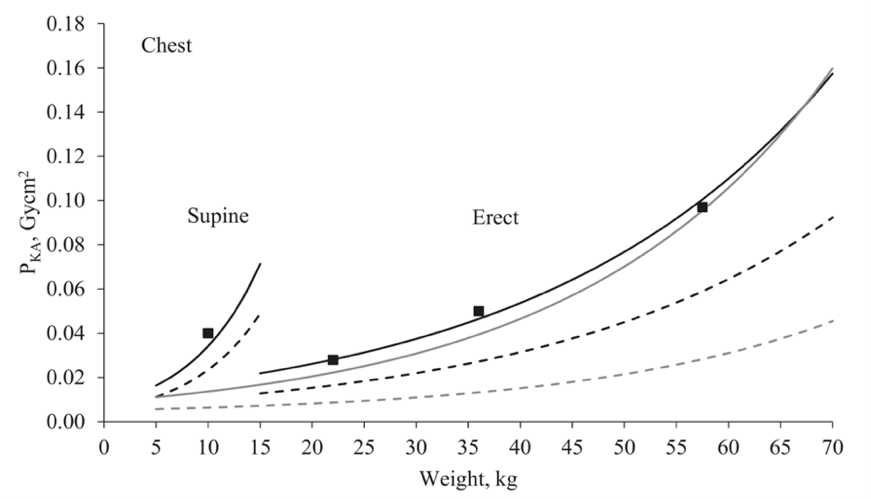
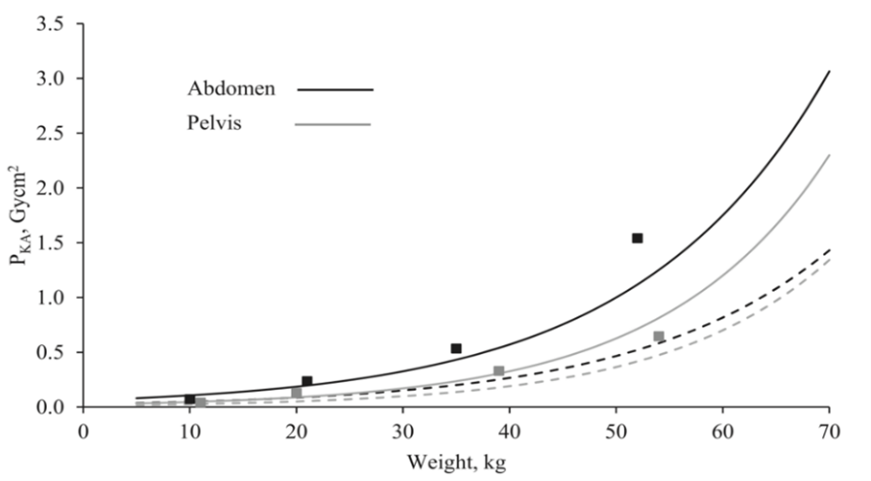
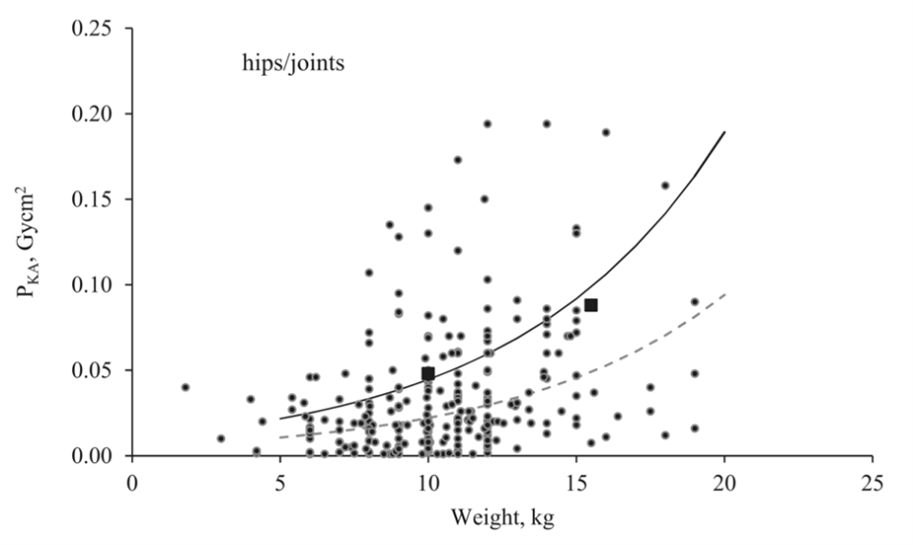
Curve method
The DRLs from the one study (Almén, 2021) using a curve method to establish DRLs are described in figure 1 for thorax, figure 2 for abdomen and figure 3 for pelvis examinations.
Table 2: Plain radiography diagnostic reference levels (dose area product (DAP) in mGy x cm2) for thorax examinations.
|
Schegerer 2019 |
Billinger 2010* |
Paulo 2016 |
|||||||
|
Examination (age and weight equivalent bracket) |
DAP |
Age (years) |
DAP |
Age bracket (years) |
DAP |
Weight (kg) |
DAP |
Weight bracket (kg) |
DAP |
|
Thorax AP/PA (3 – <5 kg; 0 – < 3 months) |
5 |
0 |
17 |
< 1 |
11 |
5 |
12 |
< 5 |
11 |
|
Thorax AP/PA (5 – < 10 kg; 3 – < 12 months) |
10 |
1 |
23 |
1-< 5 |
17 |
10 |
14 |
5-< 15 |
14 |
|
Thorax AP/PA (10 – < 19 kg; 1 – < 5 years) |
20 |
5 |
26 |
5-< 10 |
29 |
20 |
20 |
15-< 30 |
22 |
|
Thorax AP/PA (19 – < 32 kg; 5 – < 10 years) |
35 |
10 |
37 |
10-< 16 |
78 |
30 |
33 |
30-< 50 |
56 |
|
Thorax LAT (10 – < 19 kg; 1 – < 5 years) |
25 |
15 |
73 |
16- 18 |
77 |
40 |
54 |
>50 |
96 |
|
Thorax LAT (19 – < 32 kg; 5 – < 10 years) |
50 |
|
|
|
|
50 |
77 |
|
|
|
|
|
|
|
|
|
60 |
83 |
|
|
|
Célier 2020b |
Matthews 2014 |
Almén 2022*** |
Smans 2008 |
EC 2018 (PiDRL) |
|||||
|
Examination (age and weight equivalent bracket) |
DAP |
Age (years) |
DAP |
Examination (weight bracket) |
DAP |
Age (years) |
DAP |
Examination (weight bracket) |
DAP |
|
Thorax neonatal respiratory distress (< 1 month, < 5 kg) |
8.3 |
0-1 |
9 |
Thorax, supine (< 5kg) |
13 |
<1 |
88 |
Thorax AP/PA (<5 kg) |
15 |
|
Thorax suspicion of pneumonia (1 month ≤ 4 years, 5-15 kg) |
15 |
1-5 |
15 |
Thorax, supine (5-<15kg) |
40 |
1-2 |
136 |
Thorax AP/PA (5-< 15 kg) |
22 |
|
Thorax suspicion of pneumonia (10≤ 14 years, 30-50kg) |
35 |
5-10 |
21 |
Thorax, erect (15–<30 kg) |
28 |
2-3 |
189 |
Thorax AP/PA (15-< 30 kg) |
50 |
|
|
|
10-15 |
41 |
Thorax, erect (30–<50 kg) |
50 |
3-8 |
233 |
Thorax AP/PA (30-< 50 kg) |
70 |
|
|
|
|
|
Thorax, erect (50–<70 kg) |
97 |
8-12 |
395 |
Thorax AP/PA (50-< 80 kg) |
87 |
Abbreviations: dose area product in mGy x cm2 (DAP), anteroposterior (AP), posteroanterior (AP), lateral (LAT).
* Billinger 2010 originally reported µGy∙m2, these values were converted to mGy x cm2 by multiplying with 10.
**Matthews 2014, Schegerer 2019 and Smans 2008 originally reported cGy x cm2, these values were converted to mGy x cm2 by multiplying with 10.
*** Almén 2022 originally reported Gy x cm2, these values were converted to mGy x cm2 by multiplying with 1000.
Table 3: Plain radiography diagnostic reference levels (dose area product (DAP) in mGy x cm2) for abdomen examinations.
|
Célier 2020b |
Billinger 2010 |
Paulo 2016 |
||||||||
|
Examination (age and weight equivalent bracket) |
DAP |
Age (years) |
DAP |
Age bracket (years) |
DAP |
Weight (kg) |
DAP |
Weight bracket (kg) |
DAP |
|
|
|
Abdomen (1 month ≤ 4 years, 5-15 kg) |
60 |
0 |
60 |
< 1 |
25 |
5 |
27 |
< 5 |
23 |
|
|
Abdomen (4 ≤ 10 years, 15-30 kg) |
220 |
1 |
90 |
1-< 5 |
84 |
10 |
32 |
5-< 15 |
34 |
|
|
|
|
5 |
200 |
5-< 10 |
137 |
20 |
115 |
15-< 30 |
123 |
|
|
|
|
10 |
500 |
10-< 16 |
410 |
30 |
141 |
30-< 50 |
248 |
|
|
|
|
15 |
700 |
16- 18 |
979 |
40 |
270 |
>50 |
1266 |
|
|
|
|
|
|
|
|
50 |
586 |
|
|
|
|
|
|
|
|
|
|
60 |
510 |
|
|
|
|
Schegerer 2019 |
Almén 2022*** |
Matthews 2014 |
EC 2018 (PiDRL) |
|
|||||
|
Examination (age and weight equivalent bracket) |
DAP |
Weight (kg) |
DAP |
Age (years) |
DAP |
Examination (weight bracket) |
DAP |
|||
|
Abdomen AP/PA (3 – <5 kg; 0 – < 3 months) |
20 |
5–<15 |
73 |
0-1 |
10 |
Abdomen AP (<5 kg) |
45 |
|||
|
Abdomen AP/PA (5 – < 10 kg; 3 – < 12 months) |
50 |
15–<30 |
237 |
1-5 |
116 |
Abdomen AP (5-< 15 kg) |
150 |
|||
|
Abdomen AP/PA (10 – < 19 kg; 1 – < 5 years) |
100 |
30–<50 |
534 |
5-10 |
326 |
Abdomen AP (15-< 30 kg) |
250 |
|||
|
Abdomen AP/PA (19 – < 32 kg; 5 – < 10 years) |
200 |
50–<70 |
1540 |
10-15 |
504 |
Abdomen AP (30-< 50 kg) |
475 |
|||
|
|
|
|
|
|
|
Abdomen AP (50-< 80 kg) |
700 |
|
||
Abbreviations: dose area product (DAP), anteroposterior (AP), posteroanterior (AP)
* Billinger 2010 originally reported µGy∙m2, these values were converted to mGy x cm2 by multiplying with 10.
** Matthews 2014 and Schegerer 2019 originally reported cGy x cm2, these values were converted to mGy x cm2 by multiplying with 10.
*** Almén 2022 originally reported Gy x cm2, these values were converted to mGy x cm2 by multiplying with 1000.
Table 4: Plain radiography diagnostic reference levels (dose area product (DAP) in mGy x cm2) for pelvis examinations.
|
Célier 2020b |
Paulo 2016 |
||||||
|
Examination (age and weight equivalent bracket) |
DAP |
Age bracket (years) |
DAP |
Weight (kg) |
DAP |
Weight bracket (kg) |
DAP |
|
Pelvis (4 - < 10 years, 15-30 kg) |
110 |
< 1 |
23 |
5 |
22 |
< 5 |
10 |
|
Pelvis (10-< 14 years, 30-50kg) |
580 |
1-< 5 |
67 |
10 |
28 |
5-< 15 |
32 |
|
|
|
5-< 10 |
109 |
20 |
86 |
15-< 30 |
97 |
|
|
|
10-< 16 |
539 |
30 |
116 |
30-< 50 |
275 |
|
|
|
16- 18 |
816 |
40 |
250 |
>50 |
917 |
|
|
|
|
|
50 |
591 |
|
|
|
|
|
|
|
60 |
840 |
|
|
|
Schegerer 2019* |
Almén 2022** |
Matthews 2014* |
EC 2018 (PiDRL) |
||||
|
Examination (age and equivalent weight bracket) |
DAP |
Weight bracket (kg) |
DAP |
Age (years) |
DAP |
Examination (weight bracket) |
DAP |
|
Pelvis AP/PA (10 – < 19 kg; 1 – < 5 years) |
120 |
5–<15 |
41 |
0-1 |
22 |
Pelvis AP (15-< 30 kg) |
180 |
|
Pelvis AP/PA (19 – < 32 kg; 5 – < 10 years) |
250 |
15–<30 |
130 |
1-5 |
50 |
Pelvis AP (30-< 50 kg) |
310 |
|
|
|
30–<50 |
330 |
5-10 |
141 |
|
|
|
|
|
50–<70 |
646 |
10-15 |
174 |
|
|
Abbreviations: dose area product (DAP), anteroposterior (AP), posteroanterior (AP)
* Matthews 2014 and Schegerer 2019 originally reported cGy x cm2, these values were converted to mGy x cm2 by multiplying with 10.
** Almén 2022 originally reported Gy x cm2, these values were converted to mGy x cm2 by multiplying with 1000.
Table 5: Plain radiography diagnostic reference levels (dose area product (DAP) in mGy x cm2) for brain, spine and hip/joints examinations.
|
Billinger 2010* |
Schegerer 2019** |
EC 2018 (PiDRL) |
|||
|
Examination (age) |
DAP |
Examination (age bracket) |
DAP |
Examination (age bracket) |
DAP |
|
Brain AP/PA (0 year) |
150 |
Brain AP (3 – < 12 months) |
120 |
Brain AP/PA (3 months -< 1 year) |
215 |
|
Brain AP/PA (1 year) |
250 |
Brain AP (1 – < 5 years) |
240 |
Brain AP/PA (1 -< 6 years) |
295 |
|
Brain AP/PA (5 year) |
350 |
Brain LAT (3 – < 12 months) |
100 |
Brain AP/PA (≥ 6 years) |
350 |
|
Brain AP/PA (10 year) |
450 |
Brain LAT (1 – < 5 years) |
200 |
Brain LAT (3 months -< 1 year) |
200 |
|
Brain AP/PA (15 year) |
500 |
|
|
Brain LAT (1 -< 6 years) |
250 |
|
Brain LAT (0 year) |
100 |
|
|
|
|
|
Brain LAT (1 year) |
200 |
|
|
|
|
|
Brain LAT (5 year) |
250 |
|
|
|
|
|
Brain LAT (10 year) |
300 |
|
|
|
|
|
Brain LAT (15 year) |
350 |
|
|
|
|
|
Matthews 2014** |
Almén 2022*** |
||||
|
Examination (age bracket) |
DAP |
Examination (weight bracket) |
DAP |
||
|
AP lumbar spine (10-15 year) |
418 |
Hips/joints (5–<15 kg) |
48 |
||
|
Lateral lumber spine (10-15 year) |
843 |
Hips/joints (15–<30 kg) |
88 |
||
Abbreviations: dose area product (DAP), anteroposterior (AP), posteroanterior (AP), lateral (LAT).
* Billinger 2010 originally reported µGy∙m2, these values were converted to mGy x cm2 by multiplying with 10.
**Matthews 2014 and Schegerer 2019 originally reported cGy x cm2, these values were converted to mGy x cm2 by multiplying with 10.
*** Almén 2022 originally reported Gy x cm2, these values were converted to mGy x cm2 by multiplying with 1000.
Figure 1: Plain radiography diagnostic reference levels (originally reported as the kerma-area product, but for the purposes of the literature comparison equated to the dose area product (DAP)) for thorax examinations. Black solid lines are regional DRLs calculated by Almén (2021). The line characteristics for thorax erect are k = 0.036 and Dq3 = 0.0128 Gy x cm2 valid for weight interval 15–70kg. The line characteristics for thorax supine are k = 0.143 and Dq3 = 0.0078 Gy x cm2 valid for weight interval 5–15kg. Grey solid lines are national DRLs from Finland. The squares are DRLs for weight groups. Dotted lines are achievable dose level curves from Almén (2021) (black dotted lines) and Finland (grey dotted line). Copied from Almén (2021).
Figure 2: Plain radiography diagnostic reference levels (originally reported as the kerma-area product, but for the purposes of the literature comparison equated to the dose area product (DAP)) for abdomen (black line) and pelvis (grey line) examinations. The line characteristics for abdomen are k = 0.056 and Dq3 = 0.0608 Gy x cm2 valid for weight interval 5–70kg. The line characteristics for pelvis are k = 0.065 and Dq3 = 0.0243 Gy x cm2 valid for weight interval 5–70kg. The squares are DRLs for weight groups. Dotted lines are achievable dose level curves for abdomen (black dotted lines) and pelvis (grey dotted line). Copied from Almén (2021).
Figure 3: Plain radiography diagnostic reference levels (originally reported as the kerma-area product, but for the purposes of the literature comparison equated to the dose area product (DAP)) for hip/joints examinations. The solid line is regional DRLs, squares are DRLs for weight groups and the dotted line is the achievable dose level curve. The line characteristics for hips/joints are k = 0.144 and Dq3 = 0.0105 Gy x cm2 valid for weight interval 5–15kg. Copied from Almén (2021)
Level of evidence of the literature
Because of the non-comparative study designs, we could not apply the GRADE method for weighting the evidence.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
In the current international literature, what DRLs have been established for children aged 0-18 years for radiological examination with ionizing radiation?
| Population: | Children aged 0-18 years (exclusion: preterm infants/ neonatal intensive care units (NICU) population) |
| Intervention: | Radiological examinations with digital detector / flatpanel detector radiography (exclusion: nuclear diagnostics/radiotherapy/dental recording) |
| Comparison: | Not applicable |
| Outcome: |
Diagnostic Reference Level (DRL), dose-age/weight distribution |
Relevant outcome measures
The guideline development group considered Diagnostic Reference Level (DRL) as a critical outcome measure for decision making and dose-age/weight distribution as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above, but used the definitions used in the studies.
Search and select (Methods)
The databases Embase.com and Ovid/Medline were searched with relevant search terms from 01-01-2002 until 07-04-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 471 hits. Studies for this module were selected based on the following criteria:
- systematic reviews (searched in at least two databases, and detailed search strategy, risk of bias assessment and results of individual studies available), guidelines/protocols or other studies on diagnostic reference levels for digital detector / flatpanel detector radiography;
- full-text English language publication;
- children aged ≤ 18 years;
- studies according to the PICO (Population-Intervention-Comparison-Outcome).
109 studies were initially selected based on title and abstract screening. After reading the full text, 101 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 8 studies were included. Since the “Radiation protection No 185: European Guidelines on diagnostic reference levels for paediatric imaging” (PiDRL) (European Commission, 2018) is a landmark publication that contains European DRLs, this was also included as a study reporting DRLs.
Results
9 studies were included in the analysis of the literature. We could not apply the GRADE method for weighting the evidence because of the non-comparative study designs.
Referenties
- Almén A, Guðjónsdóttir J, Heimland N, Højgaard B, Waltenburg H, Widmark A. Establishing paediatric diagnostic reference levels using reference curves - A feasibility study including conventional and CT examinations. Phys Med. 2021 Jul;87:65-72. doi: 10.1016/j.ejmp.2021.05.035. Epub 2021 Jun 9. PMID: 34118729.
- Almén A, Guðjónsdóttir J, Heimland N, Højgaard B, Waltenburg H, Widmark A. Paediatric diagnostic reference levels for common radiological examinations using the European guidelines. Br J Radiol. 2022 Feb 1;95(1130):20210700. doi: 10.1259/bjr.20210700. Epub 2021 Dec 13. PMID: 34898256; PMCID: PMC8822550.
- Bbs: Besluit Basisveiligheidsnormen Stralingsbescherming. (2017, 23 oktober). Geraadpleegd van https://wetten.overheid.nl/ BWBR0040179.
- Billinger J, Nowotny R, Homolka P. Diagnostic reference levels in pediatric radiology in Austria. Eur Radiol. 2010 Jul;20(7):1572-9. doi: 10.1007/s00330-009-1697-7. Epub 2010 Jan 22. PMID: 20094888.
- Célier D, Roch P, Etard C, Ducou Le Pointe H, Brisse HJ. Multicentre survey on patient dose in paediatric imaging and proposal for updated diagnostic reference levels for France. Part 2: plain radiography and diagnostic fluoroscopy. Eur Radiol. 2020 Feb;30(2):1182-1190. doi: 10.1007/s00330-019-06406-2. Epub 2019 Sep 16. PMID: 31529249.
- European Commission. Radiation protection No 185: European Guidelines on diagnostic reference levels for paediatric imaging. Luxembourg: Publications Office of the European Union, 2018. Rapport. ISBN 978-92-79-89876-1 ISSN 2315-2826 doi:10.2833/486256 MJ-XA-18-002-EN-N. Beschikbaar via http://www.eurosafeimaging.org/wp/wp-content/uploads/2018/09/rp_185.pdf.
- European Commission, European guidelines on quality criteria for diagnostic radiographic images in paediatrics. Publications Office of the European Union, 1996. Rapport. ISBN 92-827-7843-6. Beschikbaar via: https://op.europa.eu/en/publication-detail/-/publication/47eb62b0-698d-4166-bc34-cc3f8d07d2e3
- ICRP, 2017. Diagnostic reference levels in medical imaging. ICRP Publication 135. Ann. ICRP 46(1).
- Matthews K, Brennan PC, McEntee MF. An evaluation of paediatric projection radiography in Ireland. Radiography [Internet]. 2014;20(3):18994. Available from: https://www.sciencedirect.com/science/article/pii/S1078817413001168
- NVKF 2021. Richtlijn Beeldvorming met ioniserende straling. Beoordeeld: 13-10-2021. Link: https://richtlijnendatabase.nl/richtlijn/beeldvorming_met_ioniserende_straling_risico_s_communicatie_en_afscherming/startpagina_-_beeldvorming_met_ioniserende_straling.html
- Paulo G, Vaño E, Rodrigues A. Diagnostic reference levels in plain radiography for paediatric imaging: A Portuguese study. Radiography [Internet]. 2016;22(1):e349. Available from: https://www.sciencedirect.com/science/article/pii/S1078817415000863
- Schegerer A, Loose R, Heuser LJ, Brix G. Diagnostic Reference Levels for Diagnostic and Interventional X-Ray Procedures in Germany: Update and Handling. Rofo. 2019 Aug;191(8):739-751. English, German. doi: 10.1055/a-0824-7603. Epub 2019 Jan 21. PMID: 30665250.
- Smans K, Vaño E, Sanchez R, Schultz FW, Zoetelief J, Kiljunen T, Maccia C, Järvinen H, Bly R, Kosunen A, Faulkner K, Bosmans H. Results of a European survey on patient doses in paediatric radiology. Radiat Prot Dosimetry. 2008;129(1-3):204-10. doi: 10.1093/rpd/ncn031. Epub 2008 Feb 29. PMID: 18310099.
- STUK S/4/2019. Radiation and nuclear safety authority regulation on justification assessment and optimisation of radiation protection in medical exposure. 2019 Apr 5. Geraadpleegd van https://www.stuklex.fi/fi/STUK-S-4-2019_annex.pdf.
- United States Nuclear Regulatory Commission (USNRC), Title 10, Section 20.1003, of the Code of Federal Regulations. 24 Mar 2021. Link: https://www.nrc.gov/reading-rm/doc-collections/cfr/part020/part020-1003.html
Evidence tabellen
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Afzalipour, 2019 |
wrong radiology modality |
|
Al-Haj, 2016 |
wrong publication, conference abstract |
|
Alkhorayef, 2020 |
wrong radiology modality |
|
Anna, 2017 |
wrong radiology modality |
|
Ataç, 2015 |
wrong radiology modality |
|
Benmessaoud, 2020 |
wrong radiology modality |
|
Bijwaard, 2015 |
wrong outcome - no DRL |
|
Bijwaard, 2016 |
wrong outcome - no DRL |
|
Bouaoun, 2018 |
wrong outcome - no DRL |
|
Brat, 2019 |
wrong design |
|
Célier, 2020a |
wrong radiology modality |
|
Compagnone, 2021 |
wrong outcome - no DRL |
|
Dabin, 2014 |
wrong population |
|
De Monte, 2020 |
wrong outcome - no DRL |
|
Deevband, 2021 |
wrong radiology modality |
|
Farah, 2018 |
updated Forbes 2021 |
|
Forbes, 2022 |
wrong radiology modality |
|
Fukushima, 2012 |
wrong radiology modality, updated Takei 2016 |
|
Goske, 2011 |
wrong design |
|
Goske, 2012 |
wrong design |
|
Goske, 2014 |
wrong publication |
|
Goske, 2014 |
wrong design |
|
Goske, 2014 |
wrong design |
|
Granata, 2012 |
wrong publication, poster abstract |
|
Hammond, 2021 |
wrong publication |
|
Hart, 2009 |
wrong radiology modality |
|
Hayton, 2016 |
wrong radiology modality, updated Anna 2017 |
|
Hull, 2017 |
wrong design |
|
Hwang, 2021 |
wrong radiology modality |
|
Jackson, 2015 |
wrong outcome - no DRL |
|
Janbabanezhad-Toori, 2016 |
wrong outcome - no DRL |
|
Järvinen, 2011 |
wrong radiology modality |
|
Järvinen, 2015 |
wrong radiology modality |
|
Jung, 2014 |
wrong design |
|
Kanal, 2021 |
wrong radiology modality, updated Kanal 2022 |
|
Kanal, 2022 |
wrong radiology modality |
|
Kharita, 2010 |
wrong population, based on phantom instead of clinical data |
|
Kiljunen, 2007 |
missing outcome data, refers to external website |
|
Kiljunen, 2009 |
wrong outcome - no DRL |
|
Kim, 2012 |
wrong design |
|
Kim, 2017 |
wrong radiology modality |
|
Kim, 2019 |
wrong radiology modality |
|
Korir, 2014 |
wrong radiology modality |
|
Korir, 2016 |
wrong radiology modality |
|
Kottou, 2018 |
wrong design |
|
Kritsaneepaiboon, 2012 |
wrong radiology modality |
|
Matsunaga, 2015 |
wrong radiology modality, updated Matsunaga 2019 |
|
Matsunaga, 2019 |
wrong radiology modality |
|
Miyazaki, 2014 |
wrong population |
|
Mobini, 2014 |
wrong publication, conference abstract |
|
Mohiy, 2012 |
wrong outcome |
|
Mokubangele, 2020 |
wrong radiology modality |
|
Moorin, 2013 |
wrong design |
|
Niiniviita, 2018 |
wrong design |
|
Paulo, 2016 |
wrong radiology modality, same data Paulo 2016 |
|
Paulo, 2019 |
wrong radiology modality, same data Paulo 2016 |
|
Priyanka, 2021 |
wrong publication |
|
Rawashdeh, 2019 |
wrong radiology modality |
|
Sage, 2021 |
wrong outcome |
|
Santos, 2014 |
wrong radiology modality |
|
Saravanakumar, 2017 |
wrong radiology modality |
|
Satharasinghe, 2021 |
wrong publication |
|
Satharasinghe, 2021 |
duplicate |
|
Seuri, 2014 |
wrong radiology modality, updated Jarvinen 2015 |
|
Seuri, 2017 |
wrong radiology modality, updated Almen 2022 |
|
Sonawane, 2011 |
wrong population, based on phantom instead of clinical data |
|
Strauss, 2014 |
wrong publication |
|
Strauss, 2017 |
wrong outcome |
|
Súkupová L, 2008 |
wrong language |
|
Sulieman, 2015 |
wrong radiology modality |
|
Tahmasebzadeh, 2020 |
wrong design |
|
Takei, 2016 |
wrong radiology modality |
|
Thiele, 2016 |
wrong design |
|
Thomas, 2016 |
wrong radiology modality, updated Anna 2017 |
|
Thomas, 2019 |
wrong outcome - no DRL |
|
Tonkopi, 2016 |
wrong publication, conference abstract |
|
Ubeda, 2012 |
wrong design |
|
Ubeda, 2015 |
wrong design |
|
van der Merwe, 2020 |
wrong radiology modality |
|
Vassileva, 2015 |
wrong radiology modality |
|
Verdun, 2008 |
wrong radiology modality |
|
Vitta, 2009 |
wrong design |
|
Wagner, 2018 |
wrong radiology modality |
|
Wardlaw, 2016 |
wrong radiology modality |
|
Westra, 2014 |
wrong publication |
|
Westra, 2014 |
wrong design |
|
Worrall, 2022 |
wrong radiology modality |
|
Yakoumakis, 2009 |
wrong population, based on phantom instead of clinical data |
|
Yakoumakis, 2013 |
wrong population, based on phantom instead of clinical data |
|
Yamada, 2015 |
wrong population |
|
Zamani, 2021 |
wrong radiology modality |
|
Zhou, 2019 |
wrong outcome - no DRL |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-06-2025
Beoordeeld op geldigheid : 04-02-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij het aanvragen en verslaan (radioloog), uitvoeren (laborant) en optimaliseren van dosis/beeldkwaliteit (klinisch fysicus) van röntgenonderzoeken bij kinderen.
Werkgroep
- Ir. A.J. (Lida) Dam-Vervloet, klinisch fysicus, Isala, voorzitter, NVKF
- Dr. C. (Cecile) Jeukens, klinisch fysicus, Maastricht UMC, NVKF
- Dr. ir. C. (Carola) van Pul, klinisch fysicus, Maxima Medisch Centrum, NVKF
- Dr. ir. G. (Geert) Streekstra, klinisch fysicus, Amsterdam UMC, NVKF
- Dr. M.J.W. (Marcel) Greuter, klinisch fysicus, UMC Groningen, NVKF
- Ir. J. E.(Jenny) Siegersma, klinisch fysicus, Martini Ziekenhuis, NVKF
- Ir. G.O. (Goswin) Croes, klinisch fysicus in opleiding, Isala, NVKF
- Dr. G. (Gitta) Bleeker-Swart, radioloog, OLVG, NVvR
- Dr. M.F. (Martijn) Boomsma, radioloog, Isala, NVvR
- Mw. A. (Alie) Vegter, medisch beeldvormings- en bestralingsdeskundige (MBBer), Refaja, NVMBR
Meelezers:
- Dhr. C. (Casper) Smit (Klinisch fysicus), klinisch fysicus, Medisch Spectrum Twente, NVKF
- Mw. E. (Esen) Cingir - Doganer, projectmanager/ beleidsmedewerker, Stichting Kind en Ziekenhuis (vanaf juni 2023)
- Mw. A. (Anne) Ziel-Weenink, junior projectmanager/ beleidsmedewerker, Stichting Kind en Ziekenhuis (vervanging zwangerschapsverlof, juni 2023 tot augustus 2023)
Met ondersteuning van:
- K. (Kristie) Venhorst, adviseur, Kennisinstituut van Medisch Specialisten (tot januari 2022)
- M. (Marlies) Verhoeff, adviseur, Kennisinstituut van Medisch Specialisten (januari-mei 2022)
- Dr. J.C. (José) Maas, adviseur, Kennisinstituut van Medisch Specialisten (vanaf mei 2022)
- Dr. L.C. (Lotte) Houtepen, adviseur, Kennisinstituut van Medisch Specialisten (vanaf mei 2022)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Alie Vegter |
Toezichthoudend medewerker stralingsbescherming |
Geen |
Geen |
Geen restrictie |
|
Carola van Pul |
klinisch fysicus in Maxima Medisch Centrum |
Deeltijd Universitair Hoofd Docent TU Eindhoven |
Aangevuld 28-6-2023: Luxisens, NWO: Project HASTA op het ontwikkelen van een bewegingssensor voor thuismonitoring (rol: ls promotor van 1 promovendus) Beiden zijn niet gerelateerd aan röntgensystemen. |
Geen restrictie |
|
Cecile Jeukens |
Klinisch Fysicus, Coördinerend deskundige, |
Geen |
Geen |
Geen restrictie |
|
Geert Streekstra |
Klinisch Fysicus (50%) - betaald |
Geen |
Extern gefinancierd onderzoeken, maar projecten zijn niet gerelateerd aan het opstellen van kinder DRN. |
Geen restrictie |
|
Gitta Bleeker-Swart |
Nucleair radioloog, OLVG Amsterdam |
Wetenschappelijk onderzoek PMC - Tytgat groep - neuroblastomen en beeldvorming. |
Geen |
Geen restrictie |
|
Jennifer Siegersma-Schaar |
Klinisch Fysicus bij Martini Ziekenhuis Groningen. Betaald. |
Geen |
Geen |
Geen restrictie |
|
Lida Dam (voorzitter) |
- klinisch fysicus Isala |
Geen |
Geen |
Geen restrictie |
|
Marcel Greuter |
Klinisch fysicus, UMCG, 1.0 fte |
Lid METc Groningen, betaald |
Extern gefinancierd onderzoek Siemens Healthineers - |
Geen restrictie |
|
Martijn Boomsma |
Medisch specialist |
Beeldbeschikbaarheid NEN |
Geen |
Geen restrictie |
|
Goswin Croes |
Klinisch fysicus in opleiding |
Geen |
Meeschrijven aan publicaties t.a.v. kinderDRN’s (op basis van deze richtlijn) |
Geen restrictie |
|
Lotte Houtepen |
Adviseur kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restrictie |
|
José Maas |
Adviseur kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restrictie |
|
Klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Esen Doganer |
Junior projectmanager en beleidsmedewerker Stichting Kind en Ziekenhuis |
Geen |
Geen |
Geen restrictie |
|
Anne Ziel-Weenink |
Tijdelijk junior Projectmanager en beleidsmedewerker Stichting Kind en Ziekenhuis |
Geen |
Geen |
Geen restrictie |
|
Casper Smit |
Lid klankbordgroep |
Geen |
Geen |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van afgevaardigde van Stichting kind en ziekenhuis in de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de moduleteksten en overwegingen (zie Waarden en voorkeuren van patiënten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting kind en ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Bucky |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten rondom kinder-DRN’s binnen het werkveld door middel van presentaties en overleg met de commissie straling van de NVKF. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodules is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
GRADE working group. https://www.gradeworkinggroup.org (geraadpleegd September 2023)
Bbs: Besluit Basisveiligheidsnormen Stralingsbescherming. (2017, 23 oktober). Geraadpleegd van https://wetten.overheid.nl/ BWBR0040179.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Federatie Medisch Specialisten. https://richtlijnendatabase.nl/werkwijze/wkkgz.html (geraadpleegd september 2023)
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Richtlijn: Kinder DRN |
|
|
Uitgangsvraag: Welke diagnostische referentieniveaus moeten in Nederland aangehouden worden voor de 3 radiologische modaliteiten CT, bucky en doorlicht apparatuur? |
|
|
Database(s): Ovid/Medline, Embase.com (Clinical Key + Trip database) |
Datum: 07-04-2022 |
|
Periode: 2002 - heden |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Miriam van der Maten |
|
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
13 |
6 |
13 |
|
Guideline en protocollen |
184 |
81 |
181 |
|
Overige studies |
270 |
188 |
313 |
|
Totaal |
467 |
275 |
507 |
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#12 |
#9 OR #10 OR #11 |
467 |
|
#11 |
#6 NOT (#9 OR #10) |
270 |
|
#10 |
#6 AND #8 NOT #7 |
184 |
|
#9 |
#6 AND #7 |
13 |
|
#8 |
'practice guideline'/de OR guideline*:ti,ab,kw OR recommendation*:ti,ab,kw OR cpg:ti,ab,kw OR protocol*:ti,ab,kw |
1928194 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
814860 |
|
#6 |
#1 AND (#2 OR #3 OR #4) AND #5 AND [2002-2022]/py NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
467 |
|
#5 |
'diagnostic reference level'/exp OR 'diagnostic reference level*':ti,ab,kw OR drl*:ti,ab,kw OR (((dosage OR dose) NEAR/3 'reference level*'):ti,ab,kw) OR (((dosage OR dose) NEAR/2 age):ti,ab,kw) |
7593 |
|
#4 |
'fluoroscopy'/exp OR fluoroscop*:ti,ab,kw OR ((fluorescence NEAR/3 (radiation OR scan*)):ti,ab,kw) OR fluorophotograph*:ti,ab,kw OR photofluoroscop*:ti,ab,kw |
80090 |
|
#3 |
'ionizing radiation'/exp OR 'radiodiagnosis'/de OR 'radiography'/de OR 'x ray'/exp OR bucky:ti,ab,kw OR roentgen:ti,ab,kw OR rontgen:ti,ab,kw OR röntgen:ti,ab,kw OR xray*:ti,ab,kw OR 'x-ray*':ti,ab,kw OR radiophotograph*:ti,ab,kw OR radiograph*:ti,ab,kw |
1063771 |
|
#2 |
'computer assisted tomography'/exp OR 'cat scan':ti,ab,kw OR ((compute* NEAR/3 tomograph*):ti,ab,kw) OR ct:ti,ab,kw OR cts:ti,ab,kw |
1544778 |
|
#1 |
'adolescent'/exp OR 'baby'/exp OR 'boy'/exp OR 'child'/exp OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR infan*:ti,ab,kw OR newborn*:ti,ab,kw OR 'new born*':ti,ab,kw OR perinat*:ti,ab,kw OR neonat*:ti,ab,kw OR baby*:ti,ab,kw OR babies:ti,ab,kw OR toddler*:ti,ab,kw OR minors*:ti,ab,kw OR boy:ti,ab,kw OR boys:ti,ab,kw OR boyfriend:ti,ab,kw OR boyhood:ti,ab,kw OR girl*:ti,ab,kw OR kid:ti,ab,kw OR kids:ti,ab,kw OR child*:ti,ab,kw OR children*:ti,ab,kw OR schoolchild*:ti,ab,kw OR adolescen*:ti,ab,kw OR juvenil*:ti,ab,kw OR youth*:ti,ab,kw OR teen*:ti,ab,kw OR pubescen*:ti,ab,kw OR pediatric*:ti,ab,kw OR paediatric*:ti,ab,kw OR peadiatric*:ti,ab,kw OR school:ti,ab,kw OR school*:ti,ab,kw OR 'fetus'/exp OR fetus:ti,ab,kw OR fetal:ti,ab,kw |
5278649 |
|
# |
Searches |
Results |
|
12 |
9 or 10 or 11 |
275 |
|
11 |
6 not (9 or 10) |
188 |
|
10 |
(6 and 8) not 9 |
81 |
|
9 |
6 and 7 |
6 |
|
8 |
exp Practice Guideline/ or (guideline* or recommendation* or cpg or protocol*).ti,ab,kf. |
1186774 |
|
7 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
557229 |
|
6 |
1 and (2 or 3 or 4) and 5 |
269 |
|
5 |
exp Diagnostic Reference Levels/ or 'diagnostic reference level*'.ti,ab,kf. or drl*.ti,ab,kf. or 'dose reference level*'.ti,ab,kf. or ((dosage or dose) adj2 age).ti,ab,kf. |
4859 |
|
4 |
exp fluoroscopy/ or fluoroscop*.ti,ab,kf. or (fluorescence adj3 (radiation or scan*)).ti,ab,kf. or fluorophotograph*.ti,ab,kf. or photofluoroscop*.ti,ab,kf. |
46456 |
|
3 |
exp X-Rays/ or exp Radiography/ or exp Radiation, Ionizing/ or bucky.ti,ab,kf. or roentgen.ti,ab,kf. or r?ntgen.ti,ab,kf. or xray*.ti,ab,kf. or 'x-ray*'.ti,ab,kf. or radiophotograph*.ti,ab,kf. or radiograph*.ti,ab,kf. |
1742916 |
|
2 |
exp Tomography, X-Ray Computed/ or (cat scan* or ct or cts).ti,ab,kf. or (compute* adj3 tomograph*).ti,ab,kf. |
792499 |
|
1 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or juvenile? or fetus or fetal).tw. |
2729924 |