Behandeling gedragsontregeling intoxicaties
Uitgangsvraag
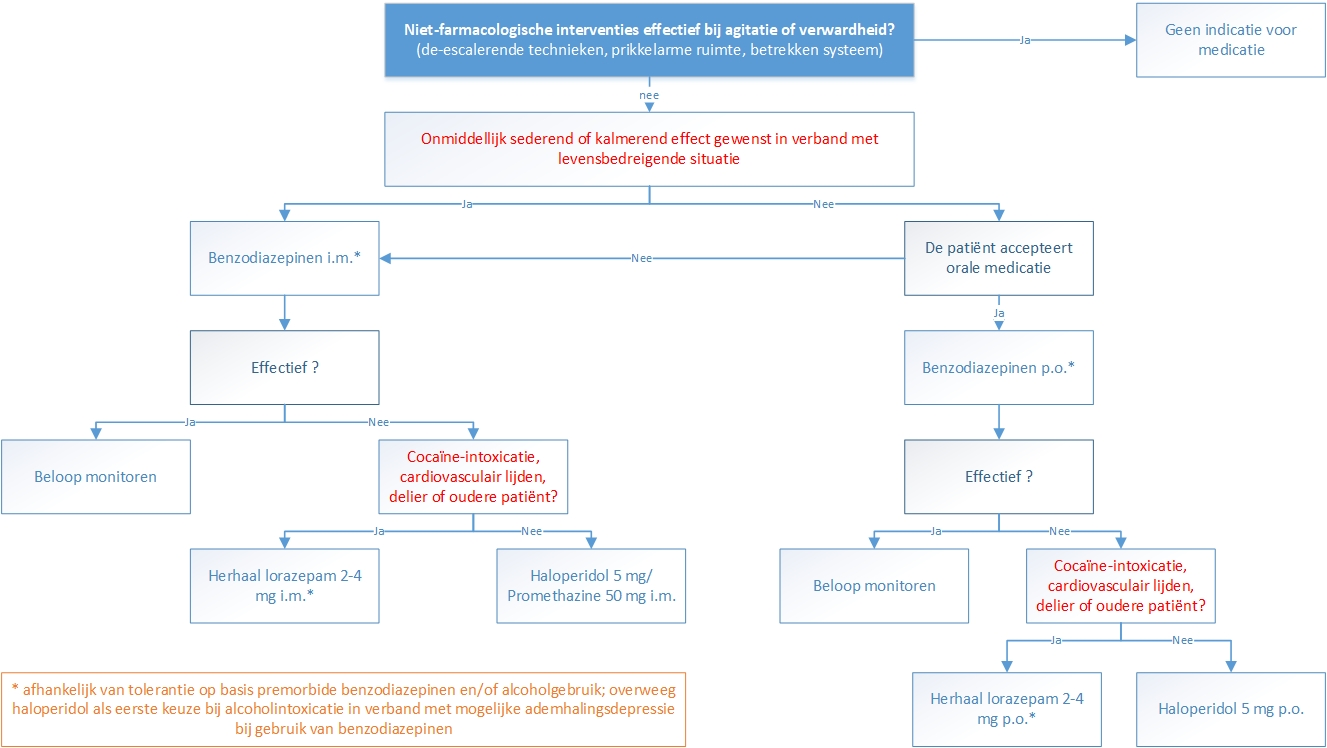
Medicamenteuze behandeling van gedragsontregeling bij patiënten met een intoxicatie op de SEH
Aanbeveling
- Benzodiazepinen zijn in de acute fase het middel van eerste keuze, in het bijzonder bij (verdenking op) middelenmisbruik, intoxicatie met cocaïne, (geagiteerd) delier van onbekende origine of Excited Delirium Syndrome en cardiovasculaire aandoeningen of comedicatie die geassocieerd is met QTc-verlenging. Houdt er rekening mee dat er bij patiënten met benzodiazepine/alcoholmisbruik sprake kan zijn van tolerantie, waardoor een hoge dosis nodig kan zijn voor effect.
- Haloperidol 5 mg is het middel van tweede keuze indien lorazepam in een adequate dosering, en na herhaling, ineffectief blijkt. De beoogde gewenste effecten van haloperidol worden bij elke geïntoxiceerde patiënt gewogen tegen de ongewenste en potentieel gevaarlijke effecten daarvan. In verband met het risico op acute dystonie heeft haloperidol gecombineerd met promethazine (25-50 mg p.o./i.m.) de voorkeur. Het risico op QTc-tijdverlenging en torsade de pointes bij deze combinatie moet goed afgewogen worden.
- Promethazine dient te worden vermeden bij ouderen en delirante patiënten in verband met sterke anticholinerge eigenschappen.
- Droperidol kan als sneller alternatief antipsychoticum overwogen worden. Dit middel is in Nederland niet geregistreerd voor de behandeling van agitatie, maar is in de literatuur uitgebreid bekend voor deze patiëntengroep.
- Het toepassen van ketamine, propofol, clonidine en dexmedetomidine dient te worden beperkt tot therapieresistente agitatie die gepaard gaat met (zeer) gevaarlijke gedragsontregeling en/of een (potentieel) levensbedreigende somatische toestand.
- Het ECG dient in principe bij elke gedragsontregelde geïntoxiceerde patiënt te worden verricht en in ieder geval wanneer haloperidol i.m. of i.v. wordt toegediend of wordt toegepast bij (verdenking op) een intoxicatie met stimulantia of Excited Delirium Syndrome.
- Vrijheidsbeperkende interventies conform de WGBO dienen overwogen te worden indien het verrichten van een ECG onmogelijk is in verband met agitatie.
- Bij GHB-onttrekking dient zo snel mogelijk gestart te worden met toediening van (medicinaal) GHB, waarbij de dosis vervolgens iedere 2 à 3 uur getitreerd dient te worden op geleide van het klinisch beeld.
- Methadon en buprenorfine kunnen worden toegepast bij duidelijke opiatenonthouding terwijl clonidine kan worden overwogen als alternatief bij slechts lichte symptomen. De doseringen zullen afhankelijk zijn van het premorbide gebruik waardoor titratie naar een optimale dosering nodig zal zijn.
- De behandeling van gedragsstoornissen als gevolg van een acute alcoholintoxicatie bestaat primair uit ondersteuning, de-escalatie, glucose en thiamine. Indien een medicamenteuze interventie desondanks noodzakelijk is, gaat de voorkeur uit naar haloperidol onder voorwaarde dat de vitale functies van de patiënt voldoende gemonitord worden.
|
Middel |
Toedienings-weg |
Dosering |
Werkt na |
T1/2 |
Herhalen na |
Bijwerkingen |
|
Lorazepam |
i.m. |
0,5-2 mg |
15-30 min |
10-20 uur |
30-60 min |
Hypoventilatie |
|
i.v. |
0,5-2 mg |
Binnen 10 min |
10-20 uur |
10-20 min |
Hypoventilatie |
|
|
i.n |
0,1 mg/kg, max 4 mg |
Binnen 10 min |
10-20 uur |
10-20 min |
Hypoventilatie |
|
|
Midazolam |
i.m. |
2,5-5 mg |
Binnen 10 min |
1-1,5 uur |
3-5 min |
Hypoventilatie |
|
i.v. |
2,5-5 mg |
Binnen 10 min |
1-1,5 uur |
3-5 min |
Hypoventilatie |
|
|
i.n. |
5 mg |
Binnen 10 min |
1-1,5 uur |
3-5 min |
Hypoventilatie |
|
|
Haldol |
i.m. |
5 mg |
30-60 min |
15-25 uur |
30 min |
QT-tijd verlenging |
|
i.v. |
5 mg |
30-60 min |
15-25 uur |
30 min |
QT-tijd verlenging |
|
|
Droperidol |
i.m. |
2,5-5 mg |
Binnen 10 min |
1-1,5 uur |
15 min |
QT-tijd verlenging |
|
i.v. |
2,5-5 mg |
Binnen 10 min |
1-1,5 uur |
15 min |
QT-tijd verlenging |
Overwegingen
Er bestaat ruime klinische ervaring met haloperidol als acute farmacologische interventie bij gedragsontregeling in de psychiatrie en op spoedeisendehulpafdelingen. De effectiviteit van haloperidol voor acute gedragsontregeling wordt door de literatuur ondersteund en geldt voor zowel psychiatrische opname afdelingen als de SEH. In de acute setting heeft haloperidol het voordeel dat het, afhankelijk van de dosering, een kalmerend effect kan hebben zonder dat het (overmatig) sedeert en een behandelgesprek dus nog mogelijk kan blijven. Deze data zijn echter afkomstig uit onderzoeken naar gedragsontregeling waarbij intoxicatie van (zeer) beperkte invloed was op het klinische beeld. Deze gegevens zijn daarom niet direct te extrapoleren naar een populatie van geïntoxiceerde patiënten die zich in een algemeen ziekenhuis presenteren, wat vragen over de veiligheid of bijwerkingen oproept. In dit verband is het optreden van acute dystonie als gevolg van haloperidol problematisch, met name voor de geïntoxiceerde patiënt met een psychiatrische aandoening die na ontslag van de SEH mogelijk een antipsychoticum moet gebruiken. De meeste behandelaren in de acute setting zijn eveneens vertrouwd en ervaren met het gebruik van BZD’s voor acute sedatie. Voordelen van BZD’s zijn het snelle, aspecifieke inhibitoire effect en het brede therapeutische venster. [Farmacotherapeutisch Kompas] Daarnaast beïnvloeden de BZD’s de hartgeleiding niet, veroorzaken zij geen bewegingsstoornissen en vertonen ze juist anti-epileptogene effecten. Ook worden lorazepam en oxazepam primair geconjugeerd waardoor zij kunnen worden toegepast bij leverfunctiestoornissen zonder dosisaanpassingen. In verband met farmacologische tolerantie bij patiënten met een intoxicatie die premorbide BZD’s gebruiken, of kruistolerantie met andere GABA-erge middelen (bijvoorbeeld alcohol en valproïnezuur) kan de dosisselectie bij patiënten op de SEH soms ingewikkeld zijn. Uit angst voor oversedatie wordt bij tolerante patiënten echter juist vaak ondergedoseerd. Daarnaast zullen patiënten die geïntoxiceerd zijn met stimulantia op zichzelf al relatief hoge dosering BZD’s nodig hebben. Goede observatie van de effecten na een BZD testdosering kunnen de voorschrijver leiden in het omhoogtitreren tot het gewenste effect is bereikt. Indien bovenstaande medicamenteuze behandelopties onvoldoende blijken en de onrust van de patiënt noodzakelijke diagnostiek of behandeling in de weg staat, kan in overleg met de anesthesioloog worden overwogen om sederende middelen (bijvoorbeeld ketamine, propofol, clonidine en dexmedetomidine) toe te passen. Hierbij houdt men altijd rekening met de juridische principes proportionaliteit, subsidiariteit en doelmatigheid.
Gamma-hydroxyboterzuur (GHB) afhankelijkheid leidt bij onthouding van GHB binnen enkele uren tot agitatie en vervolgens een potentieel ernstig onttrekkingsdelier. [NISPA, 2013] De ervaring leert dat een dergelijk onttrekkingsbeeld niet tot nauwelijks reageert op conventionele behandeling met bijvoorbeeld benzodiazepinen. De farmacologische verklaring is relatief specifieke affiniteit van GHB voor de GABA-B-receptor terwijl de benzodiazepinen overwegend GABA-A-receptoragonisten zijn. De Wetenschappelijke Adviesraad GHB-monitor heeft om deze reden een behandelprotocol gepubliceerd met praktische adviezen voor de behandeling van acute GHB-onthouding in het ziekenhuis. [NISPA, 2013] Het kernadvies van dit protocol is in voorkomende gevallen zo snel als mogelijk te starten met medicinale GHB volgens een titratieschema waarbij de startdosis afhankelijk is van het gerapporteerde gebruik en vervolgdoseringen iedere 2 à 3 uur worden toegediend en aangepast aan het klinisch effect. Bij GHB-onttrekking is behandeling met BZD over het algemeen niet effectief. Gezien de ernst van het ziektebeeld dient daarom al op de SEH gestart te worden met een titratieschema op basis van medicinaal GHB. Wanneer geen medicinaal GHB voorhanden is en patiënten eigen GHB hebben meegenomen, valt – opnieuw op basis van de ernst van het ziektebeeld – te overwegen om patiënten eigen GHB in te laten nemen totdat medicinaal GHB beschikbaar is. Het beloop van een opiatenonthouding is afhankelijk van de farmacologische eigenschappen van het gestaakte opiaat en het behandelen daarvan vraagt om het herstarten van een opiaat of clonidine. De medicamenteuze behandeling van gedragsstoornissen door acute alcoholintoxicatie wordt voor zowel benzodiazepinen als haloperidol ondersteund door beperkt bewijs. Ook kunnen deze middelen in de acute situatie interacteren met metabole veranderingen (zoals hypoglycemie, acidose, hypokaliëmie, hypomagnesiëmie, hypocalciëmie en hypofosfatiëmie) als gevolg van een ernstige alcoholintoxicatie. Daarnaast is het onderscheid tussen alcoholintoxicatie en alcoholonttrekking tijdens een acute presentatie niet altijd goed te maken, waardoor het soms nodig zal zijn om beide middelen toe te passen. Hoewel een risico op ademhalingsonderdrukking is vermeld bij het gebruik van zowel benzodiazepinen als haloperidol, heeft haloperidol vanwege een matig sederend effect vergeleken met benzodiazepinen theoretisch een gunstiger farmacologisch profiel.
Er is geen gerandomiseerd onderzoek verricht naar de farmacologische behandeling van het Excited Delirium Syndrome (EDS). De risico’s verbonden aan psychofarmaca moeten daarom op indivuele basis worden gewogen tegen de voordelen van acute sedatie. In verband met extreme agressie en autonome hyperactivatie kan het toepassen van VBI’s zonder sederende middelen bij deze patiëntengroep mogelijk tot een verslechtering van de somatische toestand leiden. Zodra de patiënt met EDS tot bedaring is gebracht wordt deze somatisch ondersteund door middel van intraveneuze rehydratie en het corrigeren van eventuele metabole acidose en hyperthermie.
Onderbouwing
Achtergrond
Gedragsontregeling bij geïntoxiceerde patiënten kan het gevolg zijn van de intoxicatie op zichzelf maar ook door eventuele somatische complicaties daarvan (bijvoorbeeld onrust bij hypoxie). Daarnaast dienen differentiaal diagnostisch somatische en psychiatrische comorbiditeit en onttrekking van verslavende middelen zoals GHB of opiaten te worden overwogen. [Taylor, 2015; Calver, 2013] De presenterende symptomen zijn daarom leidend in de keuze voor een medicamenteuze interventie. Acute medicamenteuze interventies, oftewel ‘noodmedicatie’ of ‘ingrijpmedicatie’, hebben dus bij voorkeur een snel, effectief en breed, maar veilig farmacologisch profiel omdat zij primair gericht zijn op het beheersbaar maken van een potentieel gevaarlijke situatie of het mogelijk maken van een behandelrelatie, somatische diagnostiek en/of een eventuele behandeling. [Janicak, 2011]
Psychofarmaca kunnen voor toepassing bij patiënten met een intoxicatie op basis van hun farmacodynamische (PD) effecten grofweg in twee groepen worden verdeeld: enerzijds de sedativa (zoals benzodiazepinen (BZD’s) en promethazine) en anderzijds de antipsychotica. [Taylor, 2015] In het algemeen kan worden gesteld dat sedativa een breed dempend effect hebben door de prikkelbaarheid van neuronen te verminderen en angst en (fysiologische) stress ten gevolge van autonome activatie te onderdrukken, terwijl antipsychotica neurotransmitters moduleren die betrokken zijn bij psychotische symptomen, stemmingsontregeling en impulscontrole in het cortico-meso-limbisch systeem. [Janicak, 2011] De BZD’s zijn positief allosterische modulatoren (PAM’s) van de centrale BZD-receptor: zij versterken hierdoor het fysiologische effect van endogeen gamma-aminoboterzuur (GABA) waardoor zij non-selectieve inhibitoire effecten op het centraal zenuwstelsel hebben. Er bestaan geen noemenswaardige verschillen in termen van PD tussen individuele BZD’s: zij hebben zonder uitzondering dosisafhankelijke, centraal remmende effecten, waarbij bij oplopende doseringen anxiolyse, spierrelaxatie, amnesie, overmatige sedatie, coma en ademhalingsonderdrukking optreden. De combinatie van BZD’s, alcohol en centraal dempende medicatie kan het sederende effect van de BZD’s versterken. Er zijn belangrijke verschillen in termen van farmacokinetiek (PK) tussen de BZD’s onderling. [Janicak, 2011] Promethazine is een sederend antihistaminicum op basis van sterke affiniteit voor de centrale histamine-1-receptor (H1), met sterke (centrale en perifere) anticholinerge effecten. [Farmacotherapeutisch Kompas] Haloperidol is een eerstegeneratie antipsychoticum met een sterke affiniteit voor de postsynaptische dopamine-2-receptor (D2) in de centrale dopaminerge pathways waar het als antagonist optreedt. Daarnaast heeft het bescheiden (centrale en perifere) anticholinerge, antihistaminerge en anti-adrenerge effecten. [Farmacotherapeutisch Kompas, College ter Beoordeling van Geneesmiddelen]
De keuze voor een psychofarmacon als noodmedicatie bij patiënten met een intoxicatie zal primair afhangen van de aard van de (verdachte) intoxicatie en eventueel comorbide somatische ziekten. Daarnaast dienen het farmacodynamisch profiel, inclusief nadelige effecten (bijvoorbeeld vertroebeling van het neurologisch beeld, cardiovasculaire effecten, oversedatie), en farmacokinetische overwegingen (Tmax, T1/2, metabolieten) in overweging te worden genomen.
Bij onttrekkingsverschijnselen in het geval van GHB- en opiatenafhankelijkheid, zijn bovenstaande psychofarmaca over het algemeen weinig effectief. [NISPA, 2013] Gezien de ernst en mogelijke complicaties van het onttrekkingssyndroom bij deze middelen zijn specifieke behandeladviezen voor GHB- en opiatenonttrekking in de richtlijn opgenomen. [NISPA, 2013]
Het Excited Delirium Syndrome (EDS) is een relatief zeldzaam toestandsbeeld dat gekenmerkt wordt door extreem agressief of gewelddadig gedrag bij een veranderde bewustzijnstoestand. Het klinische beeld manifesteert zich als een opwindingsdelier met autonome disregulatie, dat gepaard gaat met tachypneu, tachycardie en hypertensie, en waarbij hyperthermie, metabole acidose en rhabdomyolyse kunnen optreden. Daarnaast zijn patiënten met een EDS buitengewoon onrustig, opgewonden, prikkelbaar of angstig, transpireren zij sterk en zijn zij ongevoelig voor pijnprikkels en onvermoeibaar ondanks buitengewone fysieke inspanning (bijvoorbeeld vechten met politie of hulpverleners). Ook is communicatie met de patiënt vaak niet mogelijk, kunnen patiënten zich aangetrokken voelen tot hard geluid of fel licht en zijn zij geneigd om glazen voorwerpen te vernielen. EDS kan leiden tot plotselinge dood, waarschijnlijk als gevolg ventriculaire ritmestoornissen door een combinatie van stimulantiagebruik en autonome hyperactivatie. Data wat betreft de incidentie van EDS zijn beperkt, mede doordat er geen consensus bestaat over de precieze symptomatologie en pathofysiologie. Desondanks heeft het American College of Emergency Physicians (ACEP) EDS inmiddels als diagnostische entiteit geaccepteerd.[ACEP, 2009] De pathofysiologie van EDS is waarschijnlijk multifactorieel van aard en de individuele risicofactoren voor het ontwikkelen daarvan zijn vooralsnog onbekend. Wel zijn er aanwijzingen dat EDS relatief vaak voorkomt in de context van een intoxicatie met stimulerende middelen in het algemeen en (meth)amfetaminen en cocaïne in het bijzonder.
Conclusies / Summary of Findings
- Er is beperkt systematisch onderzoek verricht naar de effectiviteit van psychofarmaca voor gedragsstoornissen bij patiënten met een intoxicatie in de SEH-setting.
- De veiligheid van psychofarmaca is in deze context evenmin systematish onderzocht. Bij de keuze voor een psychofarmacon dient daarom in ieder geval rekening te worden gehouden met interacties tussen psychofarmaca en toxidromen, intoxicaties met alcohol en/of drugs en comorbide somatische pathologie en comorbide geneesmiddelengebruik.
- Haloperidol is effectief bij acute opwindingstoestanden, maar geeft een verhoogd risico van acute dystonie als bijwerking na intramusculaire (i.m.) toediening. De combinatie van haloperidol met promethazine leidt tot een lagere incidentie van acute dystonie. Haloperidol kan een QTc-verlenging geven.
- Lorazepam is mogelijk minder effectief dan de combinatie haloperidol en promethazine voor opwindingstoestanden, maar het middel van eerste keuze bij cardiovasculaire aandoeningen en (verdenking op) een middelenintoxicatie of delier.
- Midazolam werkt sneller dan lorazepam, maar geeft een iets hogere kans op respiratoire depressie.
- Combinatietherapie van een benzodiazepine met een anti-psychoticum lijkt effectief te zijn en kan oversedatie met een benzodiazepine voorkomen.
- Promethazine dient bij ouderen, delirante patiënten en patiënten met cardiovasculair lijden te worden vermeden in verband met anticholinerge effecten en risico op QTc-interval verlenging.
- Er is geen gerandomiseerd onderzoek verricht naar de farmacologische behandeling van Excited Delirium Syndrome (EDS) en data over de effectiviteit en veiligheid van ketamine, propofol, clonidine en dexmedetomidine bij geïntoxiceerde patiënten met ernstige gedragsontregeling op de SEH zijn beperkt.
- GHB-onttrekking reageert niet tot nauwelijks op benzodiazepinen en is een in potentie ernstig ziektebeeld dat zonder vertraging behandeld moet worden.
- De behandeling van opiatenonthouding bestaat uit het (re)introduceren van opiaatagonisten of clonidine.
- Bij gedragsstoornissen als gevolg van een acute alcoholintoxicatie kan toediening van benzodiazepinen aanleiding geven tot ademhalingsonderdrukking.
Samenvatting literatuur
Gedragsstoornissen bij patiënten met een intoxicatie gaan relatief vaak gepaard met wilsonbekwaamheid. Betrouwbaar, gerandomiseerd onderzoek naar de effectiviteit en veiligheid van psychofarmaca is daarom beperkt. De bewijslast berust dan ook op een combinatie van beperkt systematisch onderzoek, ervaring/expert opinion en (theoretische) farmacologische overwegingen. [Taylor, 2015]
De Britse National Institute for Health and Clinical Excellence (NICE) beveelt het gebruik van lorazepam i.m. of haloperidol gecombineerd met promethazine i.m. aan voor situaties waarin snelle sedatie noodzakelijk is en de-escalatie interventies onsuccesvol waren. [NICE, 2015] Bij de keuze voor een noodmiddel dient rekening te worden gehouden met comorbide somatische aandoeningen en/of zwangerschap, eerdere respons op een specifiek middel, eerdere bijwerkingen op een specifiek middel, eventuele geneesmiddelinteracties en de eventuele voorkeur van de patiënt. Waar deze informatie ontbreekt of als een patiënt eerder nooit een antipsychoticum heeft gehad, wordt geadviseerd enkel gebruik te maken van lorazepam i.m.. Alleen wanneer lorazepam niet effectief blijkt, eventueel na een herhaalde gift, wordt geadviseerd haloperidol toe te passen. De combinatie haloperidol en promethazine wordt afgeraden bij aanwijzingen voor cardiovasculaire aandoeningen (inclusief een verlengd QTc interval; zo mogelijk wordt vooraf een ECG gemaakt), of bij het ontbreken van een ECG. In dat geval wordt alleen lorazepam aanbevolen. In alle gevallen dienen patiënten nauw (ieder half uur) te worden gemonitord op bijwerkingen, bloeddruk en hartslag, ademhalingsfrequentie, temperatuur, uitdrogingsverschijnselen en bewustzijn. Indien hoge doseringen noodzakelijk waren voor sedatie, de patiënt (over)gesedeerd is, of de patiënt drugs en/of alcohol gebruikt heeft wordt een observatiefrequentie van 15 minuten aanbevolen.
Er zijn een aantal relatief grote RCT’s uitgevoerd die verschillende medicamenteuze interventies bij ‘real-life’ patiënten in de acute setting hebben onderzocht. Met sedatie als primaire uitkomstmaat werden de volgende medicamenteuze interventies onderzocht:
- olanzapine 5 mg i.v. + midazolam 2,5–5 mg i.v. en droperidol 5 mg i.v. + midazolam i.v. vs midazolam i.v. 2,5–5 mg, n=336 [Chan, 2013]
- midazolam i.m. (7,5–15 mg) vs. haloperidol 5–10 mg i.m. + promethazine 50 mg i.m. (TREC1), n=151 [Huf, 2007]
- olanzapine 10 mg i.m. vs. haloperidol 5–10 mg i.m. + promethazine 25-50 mg i.m. (TREC1), n=300 [TREC, 2003]
- haloperidol 5–10 mg i.m. + promethazine 50 mg i.m. vs. haloperidol 5–10 mg i.m.; n=311 [Raveendran, 2007]
- haloperidol 10 mg + promethazine 15–50 mg i.m. vs lorazepam 4 mg i.m. (TREC2), n=200 [Alexander, 2004]
- Droperidol 2,5-5mg i.v. vs midazolam 2,5-5mg i.v. [Knott, 2006]
- Droperidol 10 mg i.m. vs midazolam 10mg i.m. vs beide (5 + 5 mg) i.m. [Ibsister, 2010]
In deze serie 1) leidde midazolam tot snellere maar korter durende sedatie dan de combinatie haloperidol en promethazine, 2) was olanzapine even sederend als de combinatie haloperidol en promethazine, maar was de duur van de sedatie korter en 3) was de combinatie haloperidol en promethazine effectiever dan haloperidol of lorazepam alleen en was de incidentie van acute dystonie bij haloperidol alleen relatief hoog. Tot slot waren doseringen van meer dan 10 mg haloperidol en/of midazolam niet effectiever dan lagere doseringen en werden zij geassocieerd met een hogere incidentie van hypotensie en zuurstofdesaturatie.
Een recente systematische review naar effectiviteit en veiligheid van benzodiazepinen of anti-psychotica alleen versus een combinatietherapie onder geagiteerde patienten op de eerste hulp suggereert dat patiënten sneller gesedeerd zijn bij een combinatietherapie versus een monotherapie; benzodiazepinen alleen gaven de meeste adverse events [Korczak, 2016].
De Cochrane Collaboration voerde recent een systematische review uit naar de effectiviteit van haloperidol via de intramusculaire route (i.m.) voor ‘rapid tranquillization’ oftewel acute sedatie. [Powney, 2012] De groep includeerde 32 randomized controlled trials (RCT’s) met patiënten die gediagnosticeerd waren met schizofrenie, schizo-affectieve stoornis, bipolaire stoornis of een psychotische stoornis zonder duidelijke oorzaak (n=3877). De diagnose delier en/of psychotische stoornis door een middel of een somatische aandoening werd in een minderheid van de geïncludeerde patiënten gesteld, waardoor de bevindingen van de review wellicht niet (direct) te extrapoleren zijn naar een populatie van geïntoxiceerde patiënten op de SEH. Desondanks geven deze data een indruk van de effectiviteit en potentiële bijwerkingen van haloperidol in de SEH-setting. Haloperidol alleen werd vergeleken met placebo, haloperidol gecombineerd met promethazine, lorazepam, zuclopentixol en de tweedegeneratie antipsychotica aripiprazol en ziprasidon. Gemiddelde haloperidoldoseringen werden in de geïncludeerde studies niet (altijd) duidelijk vermeld: in de meeste studies werd haloperidol 10 mg i.m. toegediend, hoewel sommige studies de mogelijkheid boden om de dosering tot 20 mg i.m. te verhogen. De uitkomstmaten in de verschillende studies waren niet uniform: zowel tijdsduur tot sedatie, het aantal slapende patiënten na vastgestelde momenten en de Agitated Behaviour Scale (ABS) werden gebruikt. In termen van veiligheid werden extrapyramidale verschijnselen systematisch in een aantal studies beoordeeld middels de Barnes Akathisia Scale (BAS) en Simpson-Angus Scale (SAS). Haloperidol i.m. was effectief: vergeleken met placebo sliepen significant meer mensen 2 uur na een gift haloperidol (2 RCT’s, n = 220, risk ratio (RR) 0,88, 95% betrouwbaarheidsinterval (BI) 0,82-0,95). Drie RCT’s (n = 205) vergeleken haloperidol met lorazepam 4 a 6 mg p.o./i.m.: 1 uur na een gift haloperidol was er vergeleken met lorazepam geen significant verschil in termen van het aantal patiënten dat sliep (1 RCT, n = 60, RR 1,05, 95%BI 0,76-1,44) terwijl 3 uur na een gift wel significant meer patiënten in de lorazepamgroep sliepen in vergelijking met de haloperidolgroep (1 RCT, n = 66, RR 1,93, 95%BI 1,14-3,27). Acute dystonie kwam relatief vaker voor bij patiënten die alleen met haloperidol werden behandeld (2 RCT’s, n = 477, RR 6,63, 95%BI 1,52-28,86). Het effect van promethazine-additie aan haloperidol werd in één grote RCT onderzocht (n = 316): 20 minuten na de gift van de combinatie waren significant meer patiënten rustig vergeleken met haloperidol alleen (RR 1,60, 95%BI 1,18-2,16); daarnaast kwam acute dystonie dusdanig vaak voor in de haloperidol monotherapiegroep dat de RCT na de interimanalyse werd stopgezet (RR 19,48, 95%BI 1,14- 331,92). De reviewgroep concludeert dan ook dat haloperidol i.m. altijd zou moeten worden gecombineerd met promethazine i.m..
In verband met blokkade van het humane ether-a-go-go-related-gene (hERG) kanaal in de hartmyocyten wordt haloperidol verder geassocieerd met een doseringsafhankelijke verlenging van het QTc-interval. [Noord, 2010] Het risico op QTc-verlenging is het grootst na intramusculaire of intraveneuze toediening van hoge (> 10 mg) doseringen, in combinatie met andere risicofactoren voor QTc-verlenging. [Beach, 2013] Voorbeelden van dergelijke risicofactoren die relevant zijn bij patiënten met een intoxicatie op de SEH zijn gebruik van andere QTc-verlengende middelen, myocardiale ischemie al dan niet als gevolg van cocaïnegebruik, autonome hyperactivatie door stimulantia en elektrolytstoornissen. [Taylor, 2015] Tot slot kan haloperidol epileptische insulten uitlokken bij geïntoxiceerde patiënten die middelen hebben gebruikt die de insultdrempel verlagen.
De Cochranegroep voerde ook een systematische review uit naar de effectiviteit van verschillende benzodiazepinen voor acute sedatie in 21 RCT’s (waaronder lorazepam 2 a 5 mg p.o./i.m.; midazolam 10 à 15 mg i.m.) bij patiënten met psychotische stoornissen (n=1968). [Gillies, 2013] Ondanks beperkte data, waren BZD’s op groepsniveau even effectief als antipsychotica, waardoor de auteurs concludeerden dat het combineren van een antipsychoticum en een BZD geen duidelijk voordeel heeft boven één van de groepen farmaca alleen.
Gerandomiseerd onderzoek naar de medicamenteuze behandeling van EDS ontbreekt. Het American College of Emergency Physicians (ACEP) adviseert op basis van consensus het gebruik van intraveneuze benzodiazepinen of ketamine, intramusculaire ketamine of intranasale midazolam voor snelle controle van gevaarlijk gedrag.[ACEP, 2009] Hoewel ketamine een snelle werking kent en geen ademhalingsonderdrukking veroorzaakt, kan bloeddrukverandering problematisch zijn wanneer ketamine bij EDS wordt toegepast. Een recente review rapporteert ook het gebruik van zowel klassieke als tweedegeneratieantipsychotica bij EDS.[Hopper, 2015] Hierbij werd echter opgemerkt dat dergelijke middelen in de context van EDS (stimulantiagebruik, autonome hyperactivatie) werden geassocieerd met het ontstaan van QTc-intervalverlenging/ventriculaire ritmestoornissen en hyperthermie/maligne antipsychotica syndroom. Het gebruik van antipsychotica is daarom niet zonder risico bij EDS en dient alleen te worden toegepast indien ECG-controle direct na toediening kan worden geïnitieerd en er adequate somatische ondersteuning mogelijk is.
In de praktijk worden ook alternatieve middelen zoals ketamine, propofol, clonidine en dexmedetomidine toegepast bij geïntoxiceerde patiënten met ernstige gedragsontregeling op de SEH. Systematisch onderzoek naar de veiligheid en effectiviteit van dergelijke middelen in de acute setting is echter schaars. Het gebruik van deze middelen dient daarom te worden beperkt tot patiënten met agitatie die niet reageren op de eerder genoemde middelen en waarbij de agitatie gepaard gaat met (zeer) gevaarlijke gedragsontregeling en/of een (potentieel) levensbedreigende somatische toestand.
Opiatenonthouding kan symptomen zoals hypertensie, tachycardie, maagkrampen, misselijkheid, braken, diarree, spierkrampen, gewrichtspijn, slapeloosheid, prikkelbaarheid en onrust, wijde pupillen, zweten, koorts, tranenvloed, rinorroe, geeuwen en pilo-erectie tot gevolg hebben. [Taylor, 2015; Farmacotherapeutisch Kompas] Bij plotselinge onthouding (‘cold-turkey’) van heroïne beginnen symptomen na gemiddeld 4 tot 6 uur, bereiken zij een piek 32 tot 72 uur na de laatste dosering en kunnen de symptomen tot 5 dagen duren. [Taylor, 2015] In verband met de lange halfwaardetijd van methadon, bereikt een onbehandelde methadononthouding een piek in symptomen na 4 tot 6 dagen en kunnen deze symptomen tot 10 tot 12 dagen aanhouden. Onthouding van buprenorfine kan tot 10 dagen lang symptomen geven. [Taylor, 2015] Het behandelen van opiatenonthouding bestaat primair uit het (re)introduceren van opiaatagonisten, in aflopende dosering, zoals methadon of een partiële agonist buprenorfine (alleen wanneer al sprake is van onthoudingsverschijnselen); bij lichte symptomen kan clonidine gegeven worden. [Taylor, 2015]
Het bewijs voor de effectiviteit en veiligheid van medicamenteuze interventies voor agitatie en gedragsstoornissen bij patiënten met een acute alcoholintoxicatie is beperkt. [Vonghia, 2008] De-escalatie technieken zijn hierbij de interventie van eerste keuze, en alleen indien deze niet effectief zijn, kunnen medicamenteuze interventies worden overwogen. In ieder geval dient glucose intraveneus te worden toegediend indien er sprake is van hypoglycemie en wordt parenterale thiamine gestart bij comateuze patiënten om een Wernicke encefalopathie te voorkomen. Voor gedragsstoornissen worden zowel haloperidol als benzodiazepinen in de praktijk toegepast: dit is echter onderwerp van debat omdat ademhalingsonderdrukking voor beide middelen bij deze patiëntengroep is beschreven maar niet systematisch is onderzocht. [Vonghia, 2008]
Referenties
- Alexander J, Tharyan P, Adams C, John T, Mol C, Philip J. Rapid tranquillisation of violent or agitated patients in a psychiatric emergency setting. Pragmatic randomised trial of intramuscular lorazepam v. haloperidol plus promethazine. Br J Psychiatry 2004; 185: 639.
- American College of Emergency Physicians (ACEP). White Paper Report on Excited Delirium Syndrome ACEP Excited Delirium Task Force, 2009.
- Beach SR, Celano CM, Noseworthy PA, Januzzi JL, Huffman JC. QTc prolongation, torsades de pointes, and psychotropic medications. Psycho-somatics 2013; 54: 1-13.
- Calver L, Drinkwater V, Isbister GK. A prospective study of high dose sedation for rapid tranquilisation of acute behavioural disturbance in an acute mental health unit. BMC Psychiatry 2013; 13: 225.
- Chan EW, Taylor DM, Knott JC, Phillips GA, Castle DJ, Kong DC. Intravenous droperidol or olanzapine as an adjunct to midazolam for the acutely agitated patient: a multicenter, randomized, double-blind, placebo-controlled clinical trial. Ann Emerg Med 2013; 61: 7281.
- College ter Beoordeling van Geneesmiddelen. Summary of Product Characteristics (SmPC) haloperidol. www.cbg-meb.nl.
- Farmacotherapeutisch Kompas, www.farmacotherapeutischkompas.nl.
- Gillies D, Sampson S, Beck A, Rathbone J. Benzodiazepines for psychosis-induced aggression or agitation. Cochrane Database Syst Rev 2013; 9.
- Hopper AB, Vilke GM, MD, Castillo EM, Campillo A, Davie T, Wilson MP; Ketamine Use for Acute Agitation in the Emergency Department. J Emerg Med 2015; 48: 712-9.
- Huf G, Coutinho ES, Adams CE; TREC Collaborative Group. Rapid tranquillisation in psychiatric emergency settings in Brazil: pragmatic randomised controlled trial of intramuscular haloperidol versus intramuscular haloperidol plus promethazine. Brit Med J 2007; 335: 869.
- Isbister GK, Calver LA, Page CB, Stokes B, Bryant JL, Downes MA. Randomized controlled trial of intramuscular droperidol versus midazolam for violence and acute behavioral disturbance: the DORM study. Ann Emerg Med 2010; 56:392.
- Janicak PG, Marder SR, Pavuluri MN. Principles and Practice of Psychopharmacotherapy 5th edition; Lippincott Williams & Wilkins; Philadelphia 2011.
- Knott JC, Taylor DM, Castle DJ. Randomized clinical trial comparing intravenous midazolam and droperidol for sedation of the acutely agitated patient in the emergency department. Ann Emerg Med 2006; 47:61.
- Korczak S, Kirby A, Gunja N. Chemical Agents for the Sedation of Agitated Patient in the ED: A Systematic Review. Am Journal of Emerg Med 2016. (34); 2426-2431
- National Institute for Health and Care Excellence. Violence and aggression: short-term management in mental health, health and community settings. NICE, 2015.
- NISPA (Nijmegen Institute for Scientist-Practitioners in Addiction). Protocollen GHB. http://www.nispa.nl/onderzoek/ghb/protocollen, 2013.
- Nobay F, Simon BC, Levitt MA, Dresden GM. A prospective, double-blind, randomized trial of midazolam versus haloperidol versus lorazepam in the chemical restraint of violent and severely agitated patients. Acad Emerg Med 2004; 11:744.
- Noord C van, Eijgelsheim M, Stricker BH. Drug- and non-drug-associated QT interval prolongation. Br J Clin Pharmacol 2010; 70: 16-23.
- Powney MJ, Adams CE, Jones H. Haloperidol for psychosis-induced aggression or agitation (rapid tranquillisation). Cochrane Database Syst Rev 2012;11.
- Raveendran NS, Tharyan P, Alexander J, Adams CE; TREC-India II Collaborative Group. Rapid tranquillisation in psychiatric emergency settings in India: pragmatic randomised controlled trial of intramuscular olanzapine versus intramuscular haloperidol plus promethazine. Brit Med J 2007; 335: 865.
- Taylor D, Paton C, Kapur S. The Maudsley Prescribing Guidelines in Psychiatry 12th edition; Wiley Blackwell; Oxford 2015.
- TREC Collaborative Group. Rapid tranquillisation for agitated patients in emergency psychiatric rooms: a randomised trial of midazolam versus haloperidol plus promethazine. Brit Med J 2003; 327: 70813.
- Vonghia L, Leggio L, Ferrulli A, Bertini M, Gasbarrini G, Addolorato G; Alcoholism Treatment Study Group. Acute alcohol intoxication. Eur J Intern Med 2008; 19: 561-7.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 18-12-2017
Jaarlijks wordt door de commissie richtlijnen van de Nederlandse Internisten Vereniging bepaald of actualisatie van de richtlijn nodig is. Indien actualisatie gewenst is, spant de Nederlandse Internisten Vereniging zich om de hiervoor noodzakelijke voorwaarden (bijvoorbeeld financiering, samenstelling werkgroep) te realiseren. Nieuwe of nog niet behandelde knelpunten kunnen aanleiding zijn tot actualisatie van de richtlijn.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en ondersteund door het bureau van de Nederlandse Internisten Vereniging en PROVA.
Doel en doelgroep
Doel
Het doel van deze richtlijn is de kwaliteit van zorg en patiëntveiligheid van patiënten met een acute intoxicatie te waarborgen en waar mogelijk te verbeteren. In deze richtlijn worden aanbevelingen geformuleerd die professionals in de zorg hiertoe de handvaten geven.
Doelgroep
De doelgroep van deze richtlijn zijn professionals die zich bezig houden met de opvang van patiënten, na een acute intoxicatie, in het ziekenhuis. Hieronder worden in ieder geval verstaan: spoedeisende hulp artsen, internisten (inclusief subspecialisaties zoals internisten acute geneeskunde en intensivisten op de intensive care), anesthesiologen, cardiologen, psychiaters en ziekenhuisapothekers. Maar, ook anderen kunnen deze richtlijn gebruiken.
Samenstelling werkgroep
Voor de ontwikkeling van deze richtlijn is een werkgroep geformeerd, onder voorzitterschap van dr. Kees Kramers, internist-klinisch farmacoloog. In de werkgroep hadden gemandateerde vertegenwoordigers van de belangrijkste beroepsverenigingen die te maken hebben met de opvang van patiënten met een acute intoxicatie zitting. Ook was een vertegenwoordiger van het Nationaal Vergiftigingen Informatie Centrum lid van de werkgroep. Om het patiëntenperspectief in de werkgroep te waarborgen, is de werkgroep aangevuld met een beleidsadviseur werkzaam bij Patiëntenfederatie Nederland. Tijdens de commentaarronde is een vertegenwoordiger van de Nederlandse Vereniging voor Anesthesiologie aan de werkgroep toegevoegd en is commentaar van de Nederlandse Vereniging voor Anesthesiologie toegevoegd. De werkgroep werd procedureel en methodologisch ondersteund door PROVA en logistiek door het bureau van de Nederlandse Internisten Vereniging. De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget door de Stichting Kwaliteitsgelden Medisch Specialisten.
- Dhr. dr. C. Kramers, internist - klinisch farmacoloog, Radboud Universitair Medisch Centrum, Nijmegen, namens de Nederlandse Internisten Vereniging, voorzitter
- Mw. drs. M.K. Tuut, epidemioloog, PROVA, Varsseveld, secretaris
- Dhr dr. H.J. van Leeuwen, Internist-intensivist, Ziekenhuis Rijnstate, Arnhem, namens de Nederlandse Vereniging voor Intensive Care
- Dhr. drs. D. Dekker, internist acute geneeskunde – klinisch farmacoloog, Universitair Medisch Centrum, Utrecht, namens de DAM, beroepsvereniging van internisten acute geneeskunde
- Mw. drs. G.D. van Dijken, SEH-arts KNMG, St. Antonius Ziekenhuis, Nieuwegein, namens de Nederlandse Vereniging voor Spoedeisende Hulp Artsen
- Dhr. drs. J. Benedictus, Patiëntenfederatie Nederland, Utrecht, namens Patiëntenfederatie Nederland
- Dhr. dr. D. W. de Lange, intensivist - toxicoloog, Universitair Medisch Centrum Utrecht, namens het Nationaal Vergiftigingen Informatie Centrum (NVIC) van het UMC Utrecht
- Dhr. drs. S.J.C. ten Napel, SEH-arts KNMG, Ziekenhuis Rijnstate, Arnhem, namens de Nederlande Vereniging van Spoedeisende Hulp Artsen
- Dhr. dr. R.E.J.H. Sentjens, cardioloog - intensivist, Flevo Ziekenhuis, Almere, namens de Nederlandse Vereniging voor Cardiologie
- Dhr. dr. F. Jansman, ziekenhuisapotheker - klinisch farmacoloog, Deventer Ziekenhuis, Deventer, en Universiteit Groningen, namens de Nederlandse Vereniging van Ziekenhuis Apothekers
- Dhr. dr. G.E. Jacobs, psychiater - klinisch farmacoloog, Vrije Universiteit Medisch Centrum, Amsterdam en Centre for Human Drug Research, Leiden, namens de Nederlandse Vereniging voor Psychiatrie
- Mw. dr. I.R.A.M. Mertens zur Borg, anesthesioloog, MMT arts, defensie arts, Erasmus Medisch Centrum Rotterdam, namens de Nederlandse Vereniging voor Anesthesiologie, sinds december 2016
Met medewerking van
- Lieve Knarren
- Marjolein Kremers
- Peter Wierenga
- Marjon Verschueren
- Paul Brussee
- Ylonne Sensen
Meelezers
- Prof. dr. D.J. Touw
- Mw. drs. M.E.C. Leenders
Belangenverklaringen
|
Naam |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Douwe Dekker |
Internist acute geneeskunde - klinisch farmacoloog |
geen |
geen |
geen |
Aanspreekpunt voor toxicologische onderwerpen binnen Dutch Acute Medicine (DAM, beroepsvereniging voor acute interne geneeskunde) |
Diabetes Fonds; 2007-2010, AGIKO salaris |
Registratie patent voor gebruik van atazanavir als bilirubineverhogend geneesmiddel met anti-inflammatoire, anti-oxidante effecten, publicatie 31-03-2011 |
geen |
|
Dylan de Lange |
Internist-intensivist, UMC Utrecht |
Nationaal Vergiftigingen Informatie Centrum, UMC Utrecht |
Geen conflicterende belangen |
Geen conflicterende belangen |
Geen (conflicterende) belangen |
Geen (conflicterende) belangen |
Geen (conflicterende) belangen |
Geen (conflicterende) belangen |
|
Frank Jansman |
Ziekenhuisapotheker |
Docent en onderzoeker Afdeling Farmacotherapie, Epidemiologi en Economie, Universiteit Groningen; lid METC Isala Zwolle; lid METC Stichting Bebo Assen |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
|
Gabriel Jacobs |
Psychiater - klinisch farmacoloog, VU Medisch Centrum, 0,6 FTE |
Klinisch onderzoeker, Centre for Human Drug Research, 0,4 FTE |
geen |
geen |
geen |
Gesponsord geneesmiddelenonderzoek, 2013 - heden, Stichting Centre for Human Drug Research, salaris |
geen |
geen |
|
Henk van Leeuwen |
Internist-intensivist |
|
|
|
|
|
|
|
|
Ingrid Mertens zur Borg |
Anesthesioloog, MMT-arts, defensie anesthesioloog |
Forensisch arts in opleiding |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
|
Jan Benedictus |
Beleidsmedewerker Patiëntenfederatie NPCF |
geen |
geen |
n.v.t. |
geen |
geen |
n.v.t. |
geen |
|
Kees Kramers |
Internist-klinisch farmacoloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Mariska Tuut |
Eigenaar PROVA (advies-bureau evidence-based richtlijnontwikkeling) |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Roel Sentjens |
|
|
- |
- |
- |
- |
- |
- |
|
Sieuwert Jan ten Napel |
SEH-arts KNMG |
Opleider Spoedeisende Geneeskunde Rijnstate Ziekenhuis Arnhem |
geen |
geen |
geen |
geen |
geen |
geen |
|
Trudy van Dijken |
SEH-arts KNMG St Antonius Ziekenhuis |
|
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
De inbreng van het patiëntenperspectief werd gewaarborgd door de afvaardiging van een beleidsadviseur van Patiëntenfederatie Nederland in de richtlijnwerkgroep (zie ook de module 'Patiëntenperspectief en nazorg bij intoxicaties').
Methode ontwikkeling
Evidence based
Implementatie
Gedurende het hele proces van richtlijnontwikkeling is rekening gehouden met implementatie van de richtlijn in de praktijk, bijvoorbeeld bij de samenstelling van de werkgroep, de brede knelpunteninventarisatie en de uitgebreide commentaarronde.
Na autorisatie van de richtlijn wordt deze ten minste op de website van de Nederlandse Internisten Vereniging gepubliceerd. Ook andere deelnemende partijen zijn vrij de richtlijn op hun website te publiceren. De richtlijn wordt ter publicatie aangeboden aan www.richtlijnendatabase.nl. Daarnaast wordt getracht samenvattingen van de richtlijn in Nederlandse tijdschriften te publiceren, om zo de implementatie van de richtlijn te bevorderen. De informatie uit deze richtlijn vormt de input voor de herziening van het Acute Boekje van de Nederlandse Internisten Vereniging.
Werkwijze
Knelpuntenanalyse
De richtlijnwerkgroep heeft in de eerste werkgroepvergadering knelpunten in de opvang van patiënten met een acute intoxicatie geïnventariseerd. Daarbij is uitgegaan van het ABCDE-systeem als ‘kapstok’, aangevuld met overige knelpunten. Deze knelpuntenlijst is ter commentaar en aanvulling in een schriftelijke ronde voorgelegd aan de volgende stakeholders:
- Nationaal Vergiftigingen Informatie Centrum
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging voor Ziekenhuisapothekers
- Nederlandse Vereniging voor Psychiatrie
- Nederlandse Vereniging voor Cardiologie
- Nederlandse Vereniging voor Spoedeisende Hulp Artsen
- Nederlandse Vereniging voor Intensive Care
- Nederlands Huisartsen Genootschap
- Patiëntenfederatie Nederland
- Koninklijke Nederlandse Maatschappij ter Bevordering der Pharmacie
- Nederlandse Vereniging van Medisch managers Ambulancezorg / Ambulancezorg Nederland
- Verpleegkundigen & Verzorgenden Nederland
- Event Medical Service
- Nederlandse Vereniging van Ziekenhuizen
- Nederlandse Federatie van Universitair Medische Centra
- Zorgverzekeraars Nederland
- Nefarma
- Inspectie voor de Gezondheidszorg
- Zorginstituut Nederland
- Nederlandse Zorgautoriteit
- Toxicologie.org
De richtlijnwerkgroep heeft de input vanuit de knelpunteninventarisatie geanalyseerd en in de tweede werkgroepvergadering de knelpunten en uitgangsvragen vastgesteld.
Methode richtlijnontwikkeling
De knelpunten en uitgangsvragen zijn uitgewerkt door de verschillende werkgroepleden. Uit explorerend literatuuronderzoek bleek, en dit werd bevestigd door de inhoudelijke experts uit de richtlijnwerkgroep, dat er voor veel knelpunten geen goede evidence voorhanden zou zijn. Het uitvoeren van bewijzend klinisch onderzoek voor deze knelpunten zou in veel gevallen ook een onhaalbare kaart zijn, gezien de vele verstorende en onbekende variabelen die bij acute intoxicaties een rol kunnen spelen.
Derhalve heeft de werkgroep een beperkt aantal vragen aangewezen waarvoor uitgebreid en systematisch literatuuronderzoek heeft plaatsgevonden (verlaagde EMV-score en intubatie, naloxon of intubatie bij opiatenintoxicatie, gebruik flumazenil, behandeling hyperthermie). Bij de uitwerking van deze uitgangsvragen door de richtlijnmethodoloog is uitdrukkelijk aangegeven op welke wijze naar literatuur is gezocht en hoe dit is beoordeeld. Ook na het uitgebreide literatuuronderzoek bleek de beschikbare evidence mager en moest veelal op mechanistische argumenten en klinische redeneringen worden teruggevallen voor het formuleren van aanbevelingen in deze paragrafen. Vanwege de forse kans op vertekening van de resultaten van het literatuuronderzoek, zijn zowel de conclusies als de aanbevelingen niet gegradeerd. De werkgroep constateert dat de evidence over het algemeen van zeer lage kwaliteit is, wanneer gekeken wordt volgens de GRADE criteria (bijvoorbeeld vanwege risk of bias en indirecte studiepopulaties).
Ook bij knelpunten waarvan op voorhand werd verwacht dat er geen evidence zou zijn, en waarbij geen systematisch literatuuronderzoek is uitgevoerd, bleek behoefte aan richtinggevende aanbevelingen. Hierbij is gebruik gemaakt van diverse bronnen (bijvoorbeeld aanpalende evidence) en de mening van experts. Deze knelpunten zijn telkens voorbereid door één of enkele werkgroepleden, waarna door middel van discussie in de richtlijnwerkgroep consensus werd bereikt over het te voeren beleid. Enkele knelpunten zijn door experts van buiten de richtlijnwerkgroep voorbereid. Deze experts zijn genoemd bij de samenstelling van de werkgroep.
De richtlijnwerkgroep is 7 maal bijeen geweest, waarbij conceptteksten werden bediscussieerd en de conceptrichtlijn werd vastgesteld.
Procedure voor commentaar en autorisatie
De conceptrichtlijn is ter commentaar aangeboden aan alle NIV-leden en de (deelspecialistische) verenigingen die bij de ontwikkeling van de richtlijn betrokken zijn. Daarnaast is de conceptrichtlijn ter commentaar verstuurd aan alle partijen die bij de knelpunteninventarisatie om input gevraagd zijn, evenals aan de KNMG-afdeling juridische zaken. Het binnengekomen commentaar is door de werkgroep beoordeeld en verwerkt in de richtlijn. Tijdens de commentaarronde is de werkgroep uitgebreid met een gemandateerde vertegenwoordiger van de Nederlandse Vereniging voor Anesthesiologie.
Daarna is de richtlijn ter autorisatie voorgelegd aan de partijen die in de werkgroep vertegenwoordigd zijn. De richtlijn is geautoriseerd door de Nederlandse Internisten Vereniging, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, de Nederlandse Vereniging van Ziekenhuisapothekers, de Nederlandse Vereniging voor Cardiologie, de Nederlandse Vereniging voor Intensive Care, de Nederlandse Vereniging voor Psychiatrie en de Nederlandse Vereniging voor Anesthesiologie, en heeft tevens de goedkeuring van de Patiëntenfederatie Nederland.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op evidence en consensus gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'. Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Referenties
- Duineveld C, Vroegop M, Schouren L, Hoedemakers A, Schouten J, Moret-Hartman M, et al. Acute intoxications: differences in management between six Dutch hospitals. Clin Toxicol 2012; 50: 120-8.
- Lanting LC, Stam C, den Hertog PC. Hoe vaak komt zelf toegebracht letsel voor en hoeveel mensen sterven eraan? In: Volksgezondheid toekomst verkenning. Nationaal Kompas Volksgezondheid. http://www.nationaalkompas.nl/gezondheid-en-ziekte/ziekten-en-aandoeningen/letsels-en-vergiftigingen/zelftoegebracht-letsel/omvang/
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
