Anti-TNF alpha therapie
Uitgangsvraag
Wanneer dienen biologicals te worden overwogen bij kinderen met de ziekte van Crohn?
Deze uitgangsvraag bevat de volgende deelvragen:
- Wat is de plaats van biologicals (anti-TNFα, anti-α4ß7 integrine) in de behandeling van kinderen met de ziekte van Crohn?
- Wat is het beleid ten opzichte van monotherapie versus combinatietherapie bij kinderen met de ziekte van Crohn?
- Wat is de rol van monitoring bij kinderen met de ziekte van Crohn?
Aanbeveling
Deelvraag 1 Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met de ziekte van Crohn vergeleken met conventionele behandelstrategieën?
Geef anti-TNFα therapie alleen in een centrum waar kinderartsen MDL werkzaam zijn die ervaring hebben met IBD op kinderleeftijd.
Evalueer voor het starten met anti-TNFα of de patiënt doorgemaakte of latente infecties heeft (TBC, Hepatitis B en Hepatitis C).
Start geen anti-TNFα-therapie bij een strictuur of stenose zonder actieve ziekte van Crohn.
Start geen anti-TNFα indien er sprake is van een abces.
Intensiveer de behandeling door anti-TNFα toe te voegen bij kinderen met actieve ziekte van Crohn wanneer onvoldoende effect wordt bereikt met azathioprine of methotrexaat onderhoudstherapie, of wanneer er sprake is van intolerantie voor deze immuunmodulatoren.
Start met primaire anti-TNFα behandeling indien er sprake is van actieve perianale fistelende ziekte.
Overweeg primaire behandeling met anti-TNFα in combinatie met een immunomodulator indien er sprake is van een risicopatiënt op basis van één van onderstaande voorspellende factoren voor een gecompliceerd ziektebeloop:
- diepe ulceraties in het colon bij endoscopie;
- uitgebreide (pan-enterische) ziekte;
- opvallende groei retardatie (lengte Z-score van -2.5 of lager);
- ernstige osteoporose;
- stenoserende of penetrerende ziekte bij diagnose.
Laat de keuze voor het type anti-TNFα afhangen van beschikbaarheid, manier van toediening en de voorkeuren van de patiënt na goede voorlichting over de voor- en nadelen van ieder type medicatie.
Doseer infliximab volgens het volgende schema; 5 mg/kg per infusie in week 0, 2 en 6. Continueer onderhoudstherapie middels een infusie elke 8 weken en intensiveer frequentie en/of dosering bij onvoldoende respons, bij voorkeur op geleide van dalspiegelbepaling (en wanneer deze sterk verlaagd is, een antistofbepaling).
Doseer subcutane adalimumab injecties volgens het volgende schema:
- Kinderen <40 kg: 80 mg bij de eerste s.c. toediening, 40 mg na 2 weken en vervolgens 20 mg elke 2 weken.
- Kinderen >40 kg: 160 mg bij de eerste s.c. toediening, 80 mg na 2 weken en vervolgens 40 mg elke 2 weken.
Overweeg wekelijkse injecties bij onvoldoende respons, bij voorkeur op geleide van spiegelbepaling en antistofbepaling.
Maak gebruik van Therapeutic Drug Monitoring (TDM) en optimalisatie van toedieningsschema’s om langdurige effectiviteit van anti-TNFα behandeling te waarborgen in het kader van onderhoudstherapie.
Overweeg bij aanvang van anti-TNFα therapie vanuit kostenaspect het voorschrijven van een biosimilar.
Hanteer de volgende voorwaarden bij het (vanuit kostenaspect) overstappen naar een biosimilar:
- geinformeerde toestemming van patiënt en ouders
- klinische remissie
- therapeutische (dal)spiegel zonder antistofvorming tegen anti-TNFα.
Overweeg behandeling met off-label vedolizumab indien er sprake is van falen van anti-TNFα therapie.
Overleg met en verwijs bij voorkeur naar een academisch centrum met expertise op gebied van kinderen met IBD, indien vedolizumab behandeling wordt overwogen.
Meld de patient die gaat starten met vedolizumab aan bij de kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK), zodat er een prospectief register kan worden bijgehouden van dit off-label medicament.
Deelvraag 2: Wat is het beleid ten opzichte van monotherapie versus combinatietherapie bij kinderen met de ziekte van Crohn?
Start anti-TNFα bij voorkeur in combinatie met een immuunmodulator.
Continueer de bestaande behandeling met een immuunmodulator wanneer anti-TNFα therapie wordt gestart.
Streef vanaf 6 maanden na het starten met combinatietherapie naar het staken van de immuunmodulator, indien er sprake is van klinische remissie.
Deelvraag 3: Wat is de rol van monitoring bij kinderen met de ziekte van Crohn?
Zie de module Biologicals bij colitis ulcerosa.
Overwegingen
Deelvraag 1 Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met de ziekte van Crohn vergeleken met conventionele behandelstrategieën?
Indicatie & Effectiviteit
In 2014 werd de consensus richtlijn gepubliceerd door ECCO/ESPGHAN over de behandeling van de ziekte van Crohn (ZvC) bij kinderen (Ruemmele, 2014). Hierin wordt aangegeven dat behandeling met anti-TNFα als inductie- en onderhoudsbehandeling de voorkeur heeft bij actieve perianale fistelende ziekte na de juiste medische (antibiotica) en chirurgische behandeling van de perianale laesies volgens de daarvoor bestemde richtlijnen. Ook in geval van ernstige extra-intestinale manifestaties zoals ernstige artritis of pyoderma gangrenosum moet anti-TNFα vroeg in de behandeling worden overwogen. Indien er aanwezigheid is van één van de volgende factoren komt de patiënt in aanmerking voor een primaire behandeling met anti-TNFα op basis van de ECCO/ESPGHAN richtlijn:
- diepe ulceraties in het colon bij endoscopie;
- uitgebreide (pan-enterische) ziekte;
- opvallende groeiretardatie (lengte Z-score van -2.5 of lager);
- ernstige osteoporose;
- ziekte volgens het B2 en/of B3 type bij diagnose.
Secundaire behandeling met anti-TNFα vindt plaats wanneer er sprake is van persisterend ernstige ziekte ondanks adequate inductietherapie. Naast de effectiviteit in verschillende studies met volwassen IBD-patiënten (Targan, 1997; Hanauer, 2006; Sandborn, 2007) is ook bij kinderen met ZvC de effectiviteit van inductietherapie met anti-TNFα aangetoond (Hyams, 2007; Ruemmele, 2009). De ECCO/ESPGHAN richtlijn vermeldt dat meerdere studies bij kinderen met de ziekte van Crohn een sterk corticosteroïd-sparend effect van infliximab hebben aangetoond. Een studie bij volwassenen vergeleek in een retrospectief cohort onderzoek een groep anti-TNFα naïeve patiënten behandeld met infliximab (n=100) met een groep behandeld met adalimumab (n=100). Zij vonden geen verschil in het percentage patiënten met klinische respons (62% in de adalimumab-groep versus 65% in de infliximab-groep na één jaar) (Kestens, 2013). In kinderen zijn geen vergelijkende studies beschikbaar. Wanneer data uit de beschikbare studies vergeleken worden (IMAGINE-I, Hyams, 2012 en de REACH trial, Hyams, 2007) is het aantal anti-TNFα naïeve patiënten dat in corticosteroïd-vrije remissie is na één jaar vergelijkbaar in beide studies (45.1% versus 55.8% respectievelijk), echter is dit niet zonder limitaties. De ECCO/ESPGHAN richtlijn (Ruemmele, 2014) stelt dat de werkzaamheid van infliximab en adalimumab voor kinderen die eerder niet zijn blootgesteld aan anti-TNFα therapie als vergelijkbaar kan worden verondersteld. (Ruemmele, 2014) De werkgroep adviseert dan ook de keuze voor het type anti-TNFα, na goede voorlichting over de voor- en nadelen van elk, af te laten hangen van de voorkeuren van de patiënt en/of ouders.
Sinds de publicatie van de Richtlijn Inflammatoire darmziekten bij kinderen in 2008 werd de effectiviteit van zowel i.v. infliximab als s.c. adalimumab in verschillende studies bij kinderen met ZvC onderzocht (Church, 2014; Cozijnsen, 2015; Nobile, 2014).
De lange termijn effectiviteit van infliximab werd onderzocht in een retrospectief cohort waarin 157 patiënten met ZvC die ≤21 jaar waren op het moment van starten met infliximab. Van de 150 patiënten die reageerden op inductietherapie had 41% (n=61) remissie bereikt met standaard onderhoudstherapie (5 mg/kg elke 7 tot 8 weken) op het laatste follow-up moment (mediaan 20 maanden (IQR 18 tot 48)) (Vahabnezhad, 2014).
Church (2014) onderzocht in een retrospectief cohort van 195 kinderen de lange termijn effecten van infliximab en toonden aan dat een verlaagde Z-score van de lengte bij diagnose binnen 0 tot 3 jaar na start van de therapie verbeterde indien de eerste dosis infliximab gegeven werd binnen 18 maanden na de diagnose (Church, 2014).
In een prospectieve studie van een groep van 29 kinderen ondervond 84% van de kinderen één jaar na starten met infliximab klinisch effect (36% complete remissie, 48% verbetering van symptomen), verbeterden de endoscopische scores in 44.4% en trad in 22.2% herstel van de mucosa op (Nobile, 2014). In deze studie werd eveneens het effect beoordeeld van adalimumab bij 12 kinderen met ZvC, waarvan het merendeel eerder was blootgesteld aan infliximab. Eén jaar na de eerste adalimumab injectie was er bij 50% sprake van endoscopische verbetering (gedefinieerd als een significante reductie in aanwezige laesies, maar niet volledig verdwijnen van laesies) en bij 25% mucosaal herstel.
Cozijnsen (2015) observeerde in 15 verschillende Nederlandse centra het klinisch beloop van in totaal 53 kinderen met ZvC die behandeld werden met adalimumab na eerdere behandeling met infliximab. Na 3,3 maanden (mediaan) was 64% van de kinderen in remissie waarvan weer 50% remissie behield tot 24 maanden. Adalimumab was minder effectief bij kinderen die primaire non-responders waren hadden op infliximab dan bij degenen die eerder effect hadden gehad van infliximab maar later niet meer reageerden, de secundaire non-responders (Cozijnsen, 2015).
Om primair falen van de behandeling vast te stellen is het van belang de behandeling met anti-TNF na 6 weken (dus na de 3e dosis) te evalueren (Ruemmele, 2014).
Naast infliximab en adalimumab wordt in enkele academische centra (off-label) ook vedolizumab (een α4β7 integrine antagonist) toegediend aan kinderen die niet reageren op anti-TNF therapie. Vergelijkende studies (tussen infliximab of adalimumab en vedolizumab) vedolizumab zijn tot nu toe niet verricht bij kinderen met IBD. Singh (2016) beschreef in een retrospectieve multicenter studie een groep van 52 kinderen met IBD (58% ZvC), waarvan 90% geen effect had ondervonden van ≥1 anti-TNFα middel. In de groep kinderen met ZvC (n=26) waren bij week 0, 6 en 14 respectievelijk 2, 9 en 10 patiënten in remissie (gedefinieerd als een wPCDAI <12.5) (Singh, 2016). Een multicenter studie verricht door de PIBD Porto Group includeerd e retrospectief 64 kinderen met IBD (mediane follow-up 24 weken (IQR 14 tot 38)), waaronder 23 met ZvC, allen eerder behandeld met anti-TNFα. Na 14 weken had 14% van de kinderen met ZvC corticosteroïdvrije remissie bereikt en bij het laatste moment van follow-up was dit 24%. Er traden drie milde aan medicatie gerelateerde adverse events op (Ledder, 2017). De auteurs concluderen dat vedolizumab veilig en effectief was in dit cohort kinderen met refractaire IBD, hetgeen overeenkomt met aanbevelingen uit studies over vedolizumab bij volwassenen met IBD (Dulai, 2016).
Vedolizumab wordt in momenteel in Nederland in uitzonderingsgevallen gegeven aan kinderen met de ziekte van Crohn (en colitis ulcerosa), wanneer er sprake is van chronisch actieve ziekte met steroïd-afhankelijkheid ondanks anti-TNFα therapie. Gezien de geringe ervaring met vedolizumab, wordt dit middel tot op heden alleen off-label toegediend in specifieke centra die meerdere patiënten (jonger dan 18 jaar) met vedolizumab behandelen.
Dosering van anti-TNF medicatie
Twee belangrijke gerandomiseerde gecontroleerde trials onderzochten zowel de optimale dosering (REACH trial, Hyams, 2007) als het effect van een geschematiseerd onderhoudsinterval voor infliximab (Ruemmele, 2009). Deze studies, in combinatie met een aantal niet-gerandomiseerde studies hebben geleid tot het huidige doseringsbeleid van infliximab (Ruemmele, 2014). Infliximab wordt standaard intraveneus gedoseerd op 5 mg/kg en wordt gedurende de inductiefase over een periode van 6 weken toegediend bij 0, 2 en 6 weken. Hierna wordt overgegaan op de onderhoudsbehandeling en wordt infliximab elke 8 weken toegediend. Hogere doseringen tot bijvoorbeeld 10 mg/kg danwel kortere intervallen kunnen overwogen worden indien de patiënt geen effect laat zien op de therapie of wanneer de infliximab dalspiegel te laag is. In het geval van remissie of wanneer de laagst gemeten dalspiegel niet onder de 8 tot 10 microgram/ml komt kan een lagere dosering of een intervalverlenging worden overwogen. Vahabnezhad (2014) liet in een retrospectieve analyse (n=157) zien dat 82% van de kinderen met ZvC, behandeld met infliximab gedurende 5 jaar op onderhoudstherapie met infliximab bleef met intensivering van de dosis of aanpassing van de frequentie van de infusen. Kelsen (2014) toonde (met Physician Global Assessment (PGA)) in een klein retrospectief cohort aan dat infliximab bij kinderen met IBD ≤7 jaar minder effectief is dan bij kinderen van 8 jaar of ouder. Van de 20 kinderen ≤7 jaar met ZvC in dit cohort had 10% na 1 jaar nog klinisch effect van de infliximabtherapie. Over alle leeftijden kinderen met IBD in dit cohort (n=33) was er bij 58% sprake van noodzaak tot intensivering van de dosis of verkleinen van het dosisinterval (Kelsen, 2014).
Grover (2014) vond dat in een cohort van 47 kinderen die i.v.m. luminale ZvC behandeld werden met infliximab, bij 40% (n=19) loss of respons optrad na een mediane periode van 11 maanden. Hiervan kwamen 7 kinderen alsnog in remissie na succesvolle re-inductie. Verlies van respons was geassocieerd met een BMI Z-score <-2 op het moment van diagnose (p=0.04), lage lengte Z-scores voorafgaand aan het starten van inductietherapie (p =0.04), een CRP > 5mg/L na inductie (p=0.007) en gelijktijdig gebruik van immunomodulatoren na inductietherapie (p=0.02) (Grover, 2014).
De huidige internationale richtlijn adviseert adalimumab als inductie therapie te doseren op 2.4 mg/kg (maximaal 160 mg) bij het starten en 1.2 mg/kg (maximaal 80 mg) bij week 2. Hierna wordt 0.6 mg/kg (maximaal 40 mg) om de week geadviseerd als onderhoudsbehandeling. Wanneer de adalimumab dalspiegel te laag (<5 µg/mg) is kunnen wekelijkse injecties worden overwogen (Ruemmele, 2014). In de IMAgINE 1 trial (Hyams, 2012) werden kinderen met matige tot ernstige ZvC na de remissie inductie gerandomiseerd naar een hoge (40 mg of 20 mg voor een gewicht van ≥40 kg or <40 kg; n=93) of lage subcutane onderhoudsdosering adalimumab (20 mg of 10 mg voor een gewicht van ≥40 kg or <40 kg; n=95). Dit onderzoek toonde aan dat een hoger aantal kinderen na één jaar in remissie was in de groep met de hoge dosering (31/93 (33.3%) versus 22/95 (23.2%), p=0.100). In een subcohort van de IMAgINE 1 trial werd de veiligheid en effectiviteit van wekelijkse doseringen adalimumab veilig en effectief bevonden in kinderen die niet reageerden op een dosering om de week op basis van de PCDAI-score. Geen respons op therapie op basis van spiegels of antistoffen werd hier buiten beschouwing gelaten (Dubinsky, 2016).
Zowel voor infliximab als adalimumab geldt dat bij geheel of gedeeltelijke vermindering van het effect van de therapie spiegels en antilichamen tegen het medicijn bepaald kunnen worden ter ondersteuning van besluitvorming rondom het aanpassen of stoppen van de behandeling. De huidige internationale richtlijnen bevatten geen informatie over het bepalen van dalspiegels op vaste momenten in de behandeling. Er zijn geen studies verricht die onderzoeken of het bepalen van dalspiegels in de onderhoudsfase op vaste momenten effectiever is dan op indicatie. De TAXIT-studie onderzocht deze vraagstelling in 253 volwassen IBD-patiënten (vande Casteele, 2015). Zij concludeerden dat dosering gebaseerd op serumspiegels van infliximab niet beter was dan dosering op basis van de klinische gegevens wanneer gekeken werd naar klinische en biochemische remissie na 1 jaar. Echter, tijdens de aan deze studie voorafgaande optimalisatie fase werd indien nodig bij patiënten de dosis aangepast om een dalspiegel tussen de 3 en 7 µg/ml te bereiken. Dit resulteerde in een hoger percentage patiënten met ZvC in remissie na optimalisatie dan voorafgaand aan de optimalisatie (88% vs 65%, p=0.020). In een retrospectieve studie van Dupont-Lucas (2016) werd in een cohort van 248 kinderen met ZvC middels multivariate regressie analyse aangetoond dat kinderen die niet in klinische remissie komen bij de eerste inductietherapie (dus niet met anti-TNFα) een grotere kans hebben op het later niet reageren op infliximab (HR 3.74; 95% CI 1.80 tot 7.80) (Dupont-Lucas, 2016). De rol van doseren van anti-TNF op basis van spiegels en/of antistoffen bij kinderen met IBD wordt uitgebreid besproken in deelvraag 3 van de module over biologicals bij CU.
Biosimilars
Biosimilars zijn een vrijwel identieke versie van het referentieproduct (de geregistreerde originator), gemaakt door een andere farmaceut nadat het patent van de originator verlopen is. Bij het uitkomen van de ECCO/ESPGHAN richtlijn in 2014 waren er nog geen studies verricht naar biosimilars bij kinderen met IBD. In 2015 gaf de European Medicine Agency (EMA) goedkeuring voor het gebruik van infliximab biosimilars (CT-P13) bij kinderen met IBD op basis van het extrapolatieprincipe. Momenteel beschikbare biosimilars zijn Remsima® en Inflectra®. Deze middelen worden op dezelfde wijze in de dezelfde dosering toegediend als de originator (Remicade®).
Richmond (2018) verzamelden na goedkeuring van het gebruik van Remsima® prospectief gegevens van 40 kinderen in Engeland die startten met Remsima® (29 ZvC, 11 CU). Kinderen kregen routinematig hydrocortison (4 mg/kg) voorafgaand aan de infusie en 43% van de kinderen gebruikte oraal prednison op het moment van starten met Remsima®. Twaalf weken na start van de therapie werd een significante verbetering gevonden (allen p<0.01) in zowel klinische (wPCDAI) als biochemische parameters (bezinking, CRP, albumine en fecaal calprotectine). Twee kinderen ontwikkelden antilichamen waarvan één een acute infusie reactie ontwikkelde (1 per 190 infusies; 0.5%). Deze patiënt bleek zes jaar eerder al blootgesteld te zijn geweest aan Remicade® en had toen ook al een milde overgevoeligheidsreactie gehad. Op basis van de beschikbare data in kinderen kan geconcludeerd worden dat de biosimilar even effectief is als de originator en vergelijkbaar wat betreft veiligheid. De kostenbesparing bedroeg ongeveer 38% in vergelijking met het oorspronkelijke medicijn (Richmond, 2018).
In een prospectieve studie vervolgden Sieczkowska (2016) 39 patiënten die stopten met Remicade® onderhoudstherapie en startten met Remsima®, in 3 verschillende Poolse academische centra (n=32 ZvC, n=7 CU). Tussen de laatste dosis Remicade® en de eerste dosis Remsima® waren 22 patiënten met ZvC in remissie (69%), 10 hadden milde of matige ziekteactiviteit (31%) en 3 patiënten hadden pas 4 doses Remicade® gehad. Remissie werd gedefinieerd als een PCDAI <10 of <7.5 zonder het scoren van de punten voor lengte. Evaluatie van de therapie na 2 doses Remsima® toonde een lagere gemiddelde PCDAI (p<0.05). Na een gemiddelde follow-up duur van 8 maanden waren de patiënten die eerder in remissie waren nog steeds in remissie en waren 7 van de 10 patiënten met milde tot matige ziekte ook in remissie (totaal 28 van de 32 patiënten met ZvC). Het aantal adverse events kwam overeen met het aantal wat gerapporteerd wordt bij studies met Remicade® (Sieczkowska 2016).
Naast de CT-P13 biosimilars is in mei 2016 ook SB2 (Flixabi®) goedgekeurd als biosimilar bij kinderen met IBD. (https://www.ema.europa.eu/en) Aangezien ook het patent van adalimumab (Humira®) in juni 2017 is verlopen in Europa komen er naar verwachting binnenkort naast meerdere infliximab biosimilars ook adalimumab biosimilars op de markt.
Hoewel het aantal studies dat de effecten van een biosimilar bij kinderen met IBD onderzocht summier is en vergelijkende studies met de oorspronkelijke biological ontbreken, is het niet noodzakelijk de effectiviteit van het medicijn aan te tonen aangezien het in feite om hetzelfde middel gaat. Extrapolatie kan plaatsvinden op basis van de richtlijnen van de WHO aangezien de farmacokinetische en farmacodynamische eigenschappen reeds zijn aangetoond in zowel in vitro als in vivo studies (Guidelines on Evaluation of Similar Biotherapeutic Products. Geneva: World Health Organization; 2009). Studies waarin het gebruik van biosimilars bij kinderen met IBD wordt onderzocht bevestigen dat dit middel vergelijkbaar is met de originele biological.
Veiligheid en bijwerkingen
Een bijwerking die kan optreden bij gebruik van anti-TNFα is het vormen van antilichamen tegen het medicijn. Naast een lage serumdalspiegel of het verliezen van respons, kan dit ook leiden tot een acute infusiereactie of vertraagde overgevoeligheidsreactie. De meest voorkomende symptomen van een acute infusiereactie zijn kortademigheid, plotseling roodheid van het gezicht en de hals, misselijkheid, hoofdpijn, hypoxemie en tachycardie. In een gepoolde analyse van 18 studies trad een acute infusiereactie op bij 168 van de 1100 patiënten (16%). Vertraagde overgevoeligheidsreacties presenteren zich met gewrichtspijn en –zwelling mogelijk in combinatie met koorts en/of uitslag (Ruemmele, 2014).
Biologicals zijn evenals corticosteroïden, thiopurines, methotrexaat en calcineurine inhibitoren geassocieerd met een verhoogd risico op infecties. Het risico op opportunistische infecties is verhoogd bij het gebruik van combinatietherapie en ondervoeding. De ECCO consensus richtlijn uit 2014 (Rahier, 2014) stelt dat in verband met het risico op opportunistische infecties bij gebruik van anti-TNFα het van belang is de patiënt te testen op latente tuberculose middels een X-thorax, Mantoux-test en/of Quantiferon-test (Rahier, 2014; Ruemmele, 2014). Tevens is het van belang de patiënt bij diagnose te testen op Hepatitis B middels bepaling van HBsAg, anti-HBAbs en anti-HBcAb en op Hepatitis C middels bepaling van anti-HCV. Indien er onduidelijkheid is over het wel of niet hebben doorgemaakt van de waterpokken moet het bloed onderzocht worden op het varicella zoster virus (VZV IgG). Het screenen op EBV en CMV-infectie moet eveneens overwogen worden voor het starten van therapie met een immunomodulator en/of anti-TNFα (Rahier, 2014). De ECCO/ESPGHAN richtlijn beschrijft op basis van gepoolde analyse dat 3% (49/1483) van de kinderen behandeld met IFX ernstige infecties ontwikkelt (onder andere sepsis, meningitis, longontsteking, infecties met herpes zoster of varicella, EBV-geassocieerde hemofagocytaire lymfohistiocytose en opportunistische schimmelinfecties) (Ruemmele, 2014). Dulai (2014) beschrijft na een systematische literatuursearch dat het risico op een ernstige infectie bij kinderen met IBD die anti-TNFα therapie gebruiken significant lager is dan in kinderen die steroïden gebruiken (SIR 0.48; 95% CI: 0.40 tot 0.58). Ernstige infecties werden zo gedefinieerd als ze door de onderzoekers als zodanig werden geclassificeerd of wanneer zij resulteerden in opname in het ziekenhuis, het onderbreken van therapie of overlijden (Dulai, 2014).
Naast het verhoogde risico op infecties is er ook een potentieel risico op maligniteiten beschreven, waarbij met name lymfomen en colonkanker in de literatuur omschreven worden. Peneau (2013) vervolgden 698 kinderen met IBD en vonden een 3 keer verhoogd risico op het optreden van maligniteiten in vergelijking met de regionale populatie (SIR 3.0; 95% CI: 1.3 tot 5.9) (Peneau, 2013). In de wereldwijde lange termijn registry-studie (DEVELOP) werd onder andere het optreden van twee zeldzame bijwerkingen onderzocht; lymfomen en hemofagocytaire lymfohistiocytose (HLH) (Hyams, 2017). Hierbij werden in totaal 5766 kinderen met IBD prospectief gevolgd gedurende een mediane follow-up duur van 4.7 jaar. In het totale cohort ontwikkelden 5 kinderen HLH en 15 een lymfoom. Van de 15 kinderen met een maligniteit waren er 10 blootgesteld aan infliximab, waarvan 9 in combinatie met thiopurine. In de groep kinderen die HLH ontwikkelde was geen van allen blootgesteld aan een biological of methotrexaat, maar ze gebruikten wel allemaal thiopurine. De incidentie van lymfomen werd vergeleken tussen de groep met kinderen die blootgesteld waren aan infliximab (al dan niet in combinatie met andere therapie) met de groep die nooit aan een biological was blootgesteld. Zij vonden geen verhoogd risico op het optreden van maligniteit in de groep met infliximab in vergelijking met de kinderen die niet blootgesteld waren aan infliximab.
In verband met de zeldzaamheid van deze complicaties zijn onderzoeksresultaten in het kader van IBD- of aan IBD-behandeling gerelateerde maligniteiten beperkt. Op basis van de beschikbare literatuur is er geen reden om aan te nemen dat behandeling met anti-TNFα een verhoogd risico op het ontwikkelen van een maligniteit geeft.
Verschillende studies vergeleken het optreden van het aantal adverse events bij top-down-therapie in vergelijking met step-up-therapie (Kim Lee, 2010; Lee, 2012; Lee, 2015; Lee, 2015). Geen van deze studies vond statistisch significante verschillen in het optreden van adverse events.
Samengevat zijn er verschillende specifieke risico’s verbonden aan het behandelen met anti-TNFα. Daar er met veel verschillende aspecten rekening moet worden gehouden voorafgaand aan het starten van anti-TNFα en het monitoren van de veiligheid en effectiviteit van anti-TNFα complex is, adviseert de werkgroep anti-TNFα therapie alleen aan kinderen (<18 jaar) toe te dienen in een centrum dat expertise heeft voor IBD op de kinderleeftijd. Voorwaarde is een setting waar ervaring is met het intraveneus of subcutaan toedienen van anti-TNFα bij kinderen, het behandelen van eventuele infusiereacties bij kinderen, het monitoren van het effect en de late bijwerkingen en waar de kinderen die met anti-TNFα worden behandeld in een database worden geregistreerd zodat er lange termijn follow-up kan plaatsvinden. Het spreekt vanzelf dat dit een centrum betreft waar kinderartsen MDL werkzaam zijn die ervaring hebben met IBD op de kinderleeftijd.
Deelvraag 2: Wat is het beleid ten opzichte van monotherapie versus combinatietherapie bij kinderen met de ziekte van Crohn?
In een gerandomiseerde en placebogecontroleerde studie (SONIC-trial) werd de effectiviteit van combinatietherapie met infliximab en azathioprine bij volwassen IBD-patiënten onderzocht ten opzichte van behandeling met elk van de twee afzonderlijke middelen voor het induceren en behouden van klinische remissie bij de ZvC (Colombel, 2010). De grootste effectiviteit werd gezien bij patiënten behandeld met combinatietherapie. Er werden geen relevante verschillen gevonden in het aantal bijwerkingen, met inbegrip van ernstige infecties, tussen de verschillende behandelgroepen in het eerste jaar (Colombel, 2010; Siegel, 2012). In de in 2014 gepubliceerde consensus richtlijn door ECCO/ESPGHAN over de behandeling van de ziekte van Crohn (ZvC) bij kinderen (Ruemmele, 2014) wordt aangegeven dat er onvoldoende bewijs is in kinderen om iets te kunnen zeggen over het voordeel van mono- danwel combinatie therapie bij kinderen met ZvC, echter stellen zij wel dat combinatietherapie gedurende de eerste 6 maanden geassocieerd lijkt te zijn met een lagere kans op het ontwikkelen van antilichamen en verlies van respons en daarom afgewogen moet worden tegen het verhoogde risico op lymfomen bij het gebruik van thiopurines (Ruemmele, 2014).
Effectiviteit
Vijf retrospectieve cohortstudies (totaal n=512) tonen geen verschil wat betreft het percentage patiënten wat in remissie komt of niet meer op de therapie reageert wanneer mono- en combinatietherapie vergeleken worden (Cozijnsen, 2015). In een andere retrospectieve studie vonden Russell (2011) bij 72 kinderen met IBD (70 met ZvC) die behandeld werden met adalimumab een hoger percentage kinderen in remissie als ze tevens behandeld werden met een immunomodulator (74% versus 37%; p=0.003) (Russell, 2011).
Church (2014) onderzocht in een retrospectieve studie de lange termijn effecten van infliximab in 195 kinderen met ZvC en vond dat gelijktijdig gebruik van een immunomodulator gedurende 30 weken of langer een vermindering gaf in het verliezen van effect van de infliximab therapie (HR 0.25; 95% CI 0.08 tot 0.76; p=0.014) (Church, 2014).
Een eerder beschreven prospectieve studie van Nobile (2014) onderzocht de effectiviteit van biologicals bij 29 kinderen met infliximab en vond een neiging tot het vaker bereiken van mucosaal herstel (mucosal healing) bij kinderen die gelijktijdig azathioprine gebruikten (p=0.058) (Nobile, 2014).
In een prospectieve studie van een groep van 29 kinderen ondervond 84% van de kinderen één jaar na starten met infliximab klinisch effect (36% complete remissie, 48% verbetering van symptomen), verbeterden de endoscopische scores in 44.4% en trad in 22.2% herstel van de mucosa op (Nobile, 2014). In deze studie werd eveneens het effect beoordeeld van adalimumab bij 12 kinderen met ZvC, waarvan het merendeel eerder was blootgesteld aan infliximab. Eén jaar na de eerste adalimumab injectie was er bij 50% sprake van endoscopische verbetering (gedefinieerd als een significante reductie in aanwezige laesies, maar niet volledig verdwijnen van laesies) en bij 25% mucosaal herstel.
Bijwerkingen en complicaties
Het gebruik van meerdere immunosuppressiva lijkt het risico op ernstige infecties te verhogen, met name wanneer gelijktijdig corticosteroïden gebruikt worden (Day, 2017). Toruner (2008) toonde in een studie met volwassen IBD-patiënten aan dat het individueel gebruik van anti-TNFα, thiopurine of een corticosteroïd verhoogd risico gaf (OR 2.9; 95% CI 1.5 tot 5.3) maar wanneer 2 of 3 van deze medicijnen in combinatie werden gebruikt werd dit risico 5 keer zo hoog (OR 14.5; 95% CI 4.9 tot 43). Studies over het infectierisico van combinatietherapie bij kinderen zijn echter schaars (Toruner, 2008).
Ook het risico op maligniteiten zou mogelijk verhoogd zijn bij het gebruik van combinatietherapie. Studies in volwassenen laten echter zien dat de incidentie van lymfomen variëren tussen 2.1 en 19.1 per 10.000 patiënten wat suggereert dat het absolute risico op het ontwikkelen van lymfomen laag is. (Day, 2017) De eerder omschreven studie van Hyams (2017) beschrijft IFX alleen niet geassocieerd is met een verhoogd risico op maligniteit, maar omschrijft wel een significant verhoogd risico voor patiënten die een biological en een thiopurine hadden gebruikt (Hyams 2017).
Deelvraag 3: Wat is de rol van monitoring bij kinderen met de ziekte van Crohn?
Zie de module Biologicals bij colitis ulcerosa.
Onderbouwing
Achtergrond
Biologicals worden in de dagelijkse praktijk gebruikt als inductie- en onderhoudstherapie bij kinderen met inflammatoire darmziekten (Inflammatory bowel disease, IBD), zowel bij de ziekte van Crohn (ZvC) als colitis ulcerosa (CU). Biologicals worden met name gestart wanneer de ziekte therapieresistent is voor de conventionele therapieën, bestaande uit exclusieve enterale voeding of corticosteroïden als inductietherapie, gecombineerd met een immunomodulator (azathioprine, mercaptopurine of metrotrexaat) als onderhoudstherapie. De eerste op de markt gebrachte biologicals voor IBD blokkeren het cytokine Tumor Necrosis Factor alpha (TNFα). In Nederland is infliximab (Remicade®) geregistreerd als anti-TNFα therapie voor kinderen en adolescenten met ZvC en colitis ulcerosa en is adalimumab (Humira®) alleen geregistreerd voor kinderen met ZvC (https://www.ema.europa.eu/en). Voor kinderen met colitis ulcerosa wordt adalimumab wel als off-label medicatie vergoed. Recentelijk zijn biosimilars van zowel infliximab als adalimumab goedgekeurd als therapie voor kinderen met IBD. Bij falende anti-TNF behandeling worden kinderen (< 18 jaar) momenteel off-label en in onderzoeksverband behandeld met vedolizumab (Entyvio®), een medicijn dat bindt aan het darm specifieke eiwit α4β7-integrine waardoor de passage van leukocyten van de bloedbaan naar de darm voorkomen wordt.
De huidige nationale richtlijnen voor de behandeling van kinderen met IBD omvatten nog geen duidelijke handvatten over de plaats en effectiviteit van biologicals. Het is daarom van belang in kaart te brengen wanneer behandeling met biologicals geïndiceerd is en wat er in de literatuur bekend is over de effectiviteit maar ook wat de mogelijke bijwerkingen en complicaties kunnen zijn. Daarnaast bestaan er relevante vragen over het gebruik van de biologicals, met name of dit in de vorm van monotherapie moet plaatsvinden of juist als combinatietherapie (een biological gecombineerd met een immunomodulator). Tevens is het van belang in kaart te brengen wat de plaats en effectiviteit is van Therapeutic Drug Monitoring (TDM). Een laatste vraag betreft de stopcriteria van de biologicals. Hier ontbreken studies bij kinderen, waardoor dit onderwerp niet verder in deze richtlijn wordt besproken.
Conclusies / Summary of Findings
Deelvraag 1 Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met de ziekte van Crohn vergeleken met conventionele behandelstrategieën?
|
Zeer laag GRADE |
Het aantal kinderen in remissie één jaar na de start van inductietherapie met anti-TNFα is hoger bij kinderen die behandeld worden met top-down-therapie in vergelijking met kinderen die behandeld worden met step-up-therapie.
Bronnen (Lee, 2010; Lee, 2012; Lee YL, 2015) |
|
Zeer laag GRADE |
De frequentie van het optreden van een opvlamming één jaar na de start van inductietherapie met anti-TNFα is lager bij kinderen die behandeld worden met top-down-therapie in vergelijking met kinderen die behandeld worden met step-up-therapie.
Bronnen (Lee, 2010; Lee, 2012; Lee YL, 2015) |
|
Zeer laag GRADE |
Het aantal kinderen met mucosaal herstel één jaar na de start van inductietherapie met anti-TNFα is hoger bij kinderen die behandeld worden met top-down (anti-TNFα)-therapie in vergelijking met step-up-therapie.
Bronnen (Kang, 2016) |
|
Zeer laag GRADE |
Toediening van anti-TNFα-therapie als inductietherapie binnen 90 dagen na diagnose van de ziekte van Crohn op kinderleeftijd leidt mogelijk tot een verminderd risico op het ontwikkelen van fistelende ziekte (B3) vergeleken met behandeling met de conventionele step-up therapie.
Bronnen (Kugathasan, 2017) |
|
Zeer laag GRADE |
Het aantal kinderen met de ziekte van Crohn met een fecaal calprotectine ≤ 50 µg/g na 8 weken is hoger in de groep met kinderen die anti-TNFα-inductietherapie ontvangt in vergelijking met exclusieve enterale voedingstherapie.
Bronnen (Lee D, 2015) |
|
Zeer laag GRADE |
Het behandelen met step-up- of top-down (anti-TNFα)-therapie maakt geen verschil voor het effect op gewichtstoename. Geen van de studies vindt significante resultaten.
Bronnen (Diamanti, 2009; Kang, 2016; Walters, 2014) |
|
Zeer laag GRADE |
Het effect van behandelen met top-down (anti-TNFα)-therapie op de lengtegroei is onduidelijk op basis van de beschikbare vergelijkende studies met step-up-therapie.
Bronnen (Diamanti, 2009; Kang, 2016; Walters, 2014) |
|
Zeer laag GRADE |
Het behandelen met step-up- of top-down (anti-TNFα)-therapie maakt geen verschil voor het effect op BMI. Geen van de studies vindt significante resultaten.
Bronnen (Diamanti, 2009; Kang, 2016; Walters, 2014) |
|
Zeer laag GRADE |
Het verschil in optreden van ernstige adverse events is onduidelijk op basis van beschikbare vergelijkende studies met tussen step-up- of top-down (anti-TNFα)-therapie bij kinderen met de ziekte van Crohn.
Bronnen (Hyams, 2017; Lee, 2010; Lee, 2012; YM Lee, 2015; Kim, 2011) |
Deelvraag 2: Wat is het beleid ten opzichte van monotherapie versus combinatietherapie bij kinderen met de ziekte van Crohn?
|
Laag GRADE |
Er lijkt geen verschil in SES-CD-score na één jaar follow up wanneer het kind met de ziekte van Crohn behandeld met combinatietherapie in vergelijking met monotherapie.
Bronnen (Kierkus, 2015) |
|
Zeer laag GRADE |
Het aantal kinderen met klinische remissie (gedefinieerd als een PCDAI ≤10) is niet significant verschillend wanneer monotherapie en combinatietherapie vergeleken worden in de behandeling van kinderen met de ziekte van Crohn.
Bronnen (Nuti, 2016) |
|
Laag GRADE |
De gemiddelde PCDAI na 1 jaar is niet significant verschillend wanneer monotherapie en combinatietherapie vergeleken worden in de behandeling van kinderen met de ziekte van Crohn.
Bronnen (Kierkus, 2015) |
|
Zeer laag GRADE |
Het aantal kinderen met compleet en gedeeltelijk mucosaal herstel (gedefinieerd als respectievelijk een SES-CD van 0 tot 1 en 50% vermindering van de SES-CD bij diagnose) één jaar na het starten van therapie is niet significant verschillend bij kinderen die behandeld worden met combinatietherapie in vergelijking met monotherapie.
Bronnen (Nuti, 2016) |
|
Zeer laag GRADE |
De kans op het kunnen blijven gebruiken van infliximab 5 jaar na het starten van dit medicijn wordt verhoogd door het >6 maanden gelijktijdig gebruiken van een immuunmodulator.
Bronnen (Grossi, 2015) |
|
Zeer laag GRADE |
De kans op het ontwikkelen van antilichamen tegen infliximab verlaagd is bij gebruik van combinatietherapie in vergelijking met infliximab monotherapie.
Bronnen (Kansen, 2017) |
Samenvatting literatuur
Deelvraag 1 Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met de ziekte van Crohn vergeleken met conventionele behandelstrategieën?
Beschrijving studies
Er zijn in totaal 10 studies gevonden die een vergelijking maken tussen behandeling met een biological (anti-TNFα, zijnde infliximab of adalimumab) en conservatieve therapie. Het merendeel betrof observationele cohortstudies (n=8) waarvan 6 studies prospectief data verzamelden (Kang, 2016; Kugathasan, 2017; Lee D, 2015; Yoo Min Lee, 2015; Hyams, 2017; Walters, 2014) en 4 retrospectief (Diamanti, 2009; Kim, 2011; Lee, 2010; Lee, 2012). Het observationele karakter van de studies is een beperking van de validiteit van de resultaten. In alle studies wordt een vergelijking gemaakt tussen twee verschillende manieren van behandeling; enerzijds conventionele therapie met corticosteroïden of voedingstherapie als inductietherapie en een thiopurine of methotrexaat als onderhoudstherapie waarbij overgestapt wordt naar anti-TNFα bij onvoldoende effect (step-up), anderzijds het primair starten van anti-TNFα (top-down) zonder eerdere blootstelling aan andere therapieën. Het observationele karakter is hierin een beperking van deze studies, daar de patiëntengroepen veelal verschillen in uitgangswaarden. Twee studies, welke het grootste aantal patiënten omvatten (Kugathasan, 2017; Walters, 2014), maakten gebruik van ‘’propensity’’-scores waarbij middels een statistisch proces de groepen op basis van relevante confounders worden afgestemd om zo een gebalanceerde verdeling van de confounders tussen de groepen te creëren waardoor de vergelijkbaarheid tussen de groepen vergroot wordt.
Resultaten
Effect op remissie van ziekte
In een grote cohortstudie (Walters, 2014, n= 552) werd de mate van remissie tussen drie verschillende groepen kinderen met ZvC <17 jaar onderzocht. De eerste groep (n=68) startte anti-TNFα therapie in de eerste drie maanden na de initiële diagnose, de tweede groep (n=248) ontving monotherapie met een immunomodulator, de laatste groep (n=236) ontving geen immunotherapie gedurende de eerste drie maanden na de diagnose. Met behulp van ‘’propensity’’-scores werden drie zo vergelijkbaar mogelijke groepen op baseline karakteristieken (onder andere PCDAI, leeftijd, groei, perianale ziekte, ziekte locatie en endoscopische bevindingen) geanalyseerd (n=68 per groep). Evaluatie van corticosteroïd vrije remissie (gedefinieerd als een PCDAI <10) na één jaar toonde dat 85% van de kinderen met anti-TNFα in remissie was, vergeleken met 60% in de groep met alleen een immunomodulator en 54% in de groep zonder therapie (p = 0.0003). Het relatieve risico op het bereiken van corticosteroïd vrije remissie was 1.41 keer hoger in de groep kinderen die behandeld werd met anti-TNF therapie vergeleken met kinderen die behandeld werden met een immunomodulator (RR 1.41; 95% CI 1.14 tot 1.76; p-waarde=0.0017).
Kim (2011) vergeleek in een retrospectief onderzoek kinderen die behandeld werden volgens de step-up strategie (n=11) met kinderen die infliximab kregen zonder eerder gebruik van corticosteroïden of immunomodulatoren (top-down, n=18). Zij vonden dat het aantal kinderen in remissie (PCDAI <10) in de top-down-groep (15/18) hoger was dan in de step-up-groep (3/11, p-waarde= 0.048).
Drie verschillende studies (Lee, 2012; Lee, 2010; Lee D, 2015) publiceerden resultaten van verschillende kleine groepen kinderen met ZvC waarbij eveneens step-up met top-down anti-TNFα therapie vergeleken werd (n= 28, n=36 en n= 51 en=49 respectievelijk) na 1 jaar follow-up. In de eerstgenoemde studie werden na 1 jaar opvlammingen (PCDAI >10) vastgesteld bij 3 van de 18 patiënten (17%) in de top-down groep en bij 5 van de 10 patiënten (50%) in de step-up-groep (p-waarde=0.091).
Een tweede studie (Lee, 2010) waarin 13 kinderen met ZvC met infliximab en azathioprine behandeld werden (top-down) en 23 met mesalamine en prednison (n=10) of azathioprine en prednison (n=13), toonde wel een significant verschil in het aantal opvlammingen in de top-down-groep (3/13, 23.1% (95%CI 0.2 tot 46.0)) na één jaar wanneer dit vergeleken werd met de groep die behandeld werd met mesalamine en Prednison (8/10, 80.0% (95%CI 55.2 tot 100.0), p=0.012) alsook wanneer vergeleken werd met de groep die behandeld werd met azathioprine en Prednison (8/13, 61.5% (95%CI 35.1 tot 88.0), p-waarde=0.047). De derde studie van Lee (2015) vond een significant verschil in het percentage patiënten zonder opvlammingen (PCDAI >10); 83.9% (95% CI 0.66 tot 0.93) in de top-down groep versus 45.0 (95% CI 0.23 tot 0.65) in de step-up-groep (p-waarde=0.0094). In totaal waren 26 van de 31 patiënten (84%) in de top-down groep en 9 van de 20 patiënten (45%) in de step-up-groep in klinische remissie (PCDAI <10). Diepe remissie op basis van endoscopie werd bereikt in, respectievelijk, 81% (25/31) en 40% (8/20, p-waarde=0.0006). Tevens was de duur van remissie langer in de top-down groep (p-waarde=0.005).
In de prospectieve studie van Kang (2016) werden twee groepen patiënten met een PCDAI ≥30 beiden behandeld met azathioprine en mesalazine, waarbij de ene groep tevens werd behandeld met infliximab (n=48) en de ander groep met corticosteroïden (n=28). In de groep behandeld met infliximab trad mucosaal herstel (mucosal healing) in week 14 op bij 24 van de 47 kinderen (51%) versus 8 van de 25 kinderen (32%) in de groep behandeld met corticosteroïden (p=0.121). Dezelfde vergelijking in week 54 liet een significant verschil in het percentage patiënten met mucosaal herstel zien (p=0.007; respectievelijk 74% (35/47) en 42% (10/24). Er werden echter geen significante verschillen gevonden in het aantal patiënten in remissie op basis van klinische ziekte activiteitscores en laboratoriumwaardes.
Eén prospectieve studie (Lee, 2015) vergeleek kinderen en jong volwassenen (tot 22 jaar) met ZvC die anti-TNFα (n= 51 infliximab, n=1 adalimumab) ontvingen met een vergelijkbare groep die partiële (n=16) of exclusieve (n=22) voedingstherapie ontving. Acht weken na de start van therapie werd in alle groepen een significante daling van de PCDAI ten opzichte van de uitgangswaarde gezien (p<0.05 in alle drie de groepen) welke niet significant verschillend was tussen de drie groepen (p=0.43). Er werd een trend gezien in het percentage patiënten waarbij klinische verbetering optrad. Klinische verbetering (gedefinieerd als PCDAI ≤10 of een vermindering van de PCDAI met ≥15 punten) trad op bij 9 patiënten (64%) die gedeeltelijke voedingstherapie ontving, 15 patiënten (88%) die volledige voedingstherapie ontvingen en 41 patiënten (84%) die anti-TNFα ontvingen (p=0.08). Tevens was het percentage patiënten met een fecaal calprotectine ≤50 mcg/kg hoger in de groep die anti-TNFα therapie ontving (30% versus 5%; p=0.03), eveneens duidend op een hoger percentage patiënten met mucosaal herstel.
Effecten op groei
Een aantal van de hierboven beschreven studies onderzochten verschillende variabelen van groei als uitkomstmaat. De grootste cohortstudie van Walters (2014) vergeleek het verschil in lengte tussen twee groepen kinderen met ZvC met vergelijkbare lengte op baseline op basis van propensity score matching (n=68 per groep). Zij toonden aan dat de gemiddelde lengte Z-score na één jaar met 0.14 toenam in de anti-TNFα groep, terwijl deze nagenoeg gelijk bleef in de groep met een immunomodulator of zonder therapie (-0.02 en -0.06 respectievelijk, p=0.039). De gewichtstoename in de anti-TNFα groep was eveneens hoger (0.85 versus 0.60 en 0.62 respectievelijk; p=0.044). Er werd geen significant verschil gevonden in de toename van Body Mass Index (BMI).
Diamanti (2009) onderzocht een klein cohort van 28 kinderen met ZvC (gediagnosticeerd <18 jaar) waarvan 14 patiënten behandeld met mesalazine, azathioprine en infliximab vergeleken werden met 14 patiënten die eenzelfde behandeling kregen zonder infliximab. Na een mediane follow-up duur van 10 maanden waren de verschillen van lengte, gewicht en BMI ten opzichte van het gewicht bij uitgang in beide groepen niet significant verschillend. Kang (2016) toonde eveneens geen verschil in Z-scores van gewicht voor leeftijd tussen kinderen met infliximab (n=47) en zonder infliximab (n=24) na één jaar follow-up (0.82 ± 0.64 versus 0.75 ± 0.89; p=0.248). Ook de verschillen in Z-scores van lengte voor leeftijd (0.11 ± 0.23 versus 0.10 ± 0.37; p=0.653) en BMI voor leeftijd (0.96 ± 0.74 versus 0.89 ± 0.88; p=0.381) waren niet significant verschillend.
Lee YM (2015) evalueerde Z-scores van gewicht, lengte en BMI voor leeftijd na een follow-up van 3 jaar. Zij vonden geen significante verschillen tussen de groep die step-up therapie had gekregen (n=20) en de groep met top-down therapie (n=31). Het verschil in Z-scores van gewicht voor lengte drie jaar na het starten van therapie was echter wel significant (top-down 1.190 ± 0.956 versus step-up 0.424 ± 1.422; p=0.0424).
Lee D (2015) vond dat toename in Z-scores voor gewicht na 8 weken significant hoger was in zowel de partiële voedingstherapie groep (0.76 ± 0.66) als de volledige voedingstherapie groep (0.70 ± 0.57) in vergelijking met de patiënten die anti-TNFα kregen (0.38 ± 0.40; p=0.03). Samenvattend, laat de studie met het grootste patiënten aantal en correctie voor confounders een significante verbetering van de lengte Z-score en gewichtstoename zien na één jaar infliximab in vergelijking met immunomodulatoren of geen therapie (Walters, 2014). Van de overige kleinere studies toonde geen enkele studie significante verschillen wanneer gekeken werd naar Z-scores van lengte, gewicht of BMI voor leeftijd na één jaar.
Complicaties
Kugathasan (2017) vergeleek in een grote cohortstudie anti-TNFα monotherapie (n=191) met het gebruik van standaardtherapie (n=191), waarbij ze door middel van ‘’propensity’’-scores zo vergelijkbaar mogelijke groepen patiënten samenstelden op basis van leeftijd, etniciteit, geslacht, ziekte locatie, perianale ziekte, lengte, gewicht en PCDAI-score bij diagnose. De groep kinderen die anti-TNFα therapie kreeg was vroeg blootgesteld aan deze therapie, wat inhield dat therapie zonder complicaties kon worden opgestart binnen 90 dagen na de diagnose en de inductiedoses en minimaal één onderhoudsdosis succesvol konden worden toegediend. Zij onderzochten of het ontstaan van stricturen (B2) of abcessen en/of fistels (B3) verschillend was in de twee groepen gedurende een mediane follow-up duur van ≥40 maanden. Totaal ontwikkelden 4/191 kinderen die anti-TNFα kregen ziekte fenotype B3 vergeleken met 11/191 in de groep kinderen die standaardtherapie ontving (p=0.07). Analyse van de resultaten in een risicomodel toonde dat vroege anti-TNFα therapie niet geassocieerd was met en vermindering van fenotype B2, maar wel met een vermindering van type B3 (HR 0.30, 95%CI 0.10 tot 0.89; p=0.0296).
Bewijskracht van de literatuur
Bij het bepalen van de bewijskracht voor de uitkomstmaat werd uitgegaan van lage bewijskracht gezien de observationele opzet van de studies. De bewijskracht van alle uitkomsten maten, met uitzondering van het ontwikkelen van stricturerende of fistelende ziekte, is met 1 niveau verlaagd gezien er in het merendeel van de artikelen sprake was van beperkingen in de onderzoeksopzet (risk of bias) en een enkele keer sprake was van tegenstrijdige resultaten (inconsistentie), extrapoleerbaarheid (bias ten gevolge van indirectheid) of een te gering aantal patiënten (imprecisie).
Deelvraag 2: Wat is het beleid ten opzichte van monotherapie versus combinatietherapie bij kinderen met de ziekte van Crohn?
Beschrijving studies
Er zijn in totaal 4 studies gevonden die een vergelijking maken tussen behandeling met monotherapie met een biological versus combinatietherapie (een biological en een immunomodulator) bij kinderen met de ziekte van Crohn (ZvC). Eén studie betreft een gerandomiseerde open-label trial (Kierkus, 2015), de twee andere studies zijn prospectieve observationele cohortstudies (Nuti, 2016; Grossi, 2015; Kansen, 2017).
Resultaten
Remissie van ziekte
Kierkus (2015) includeerde 99 kinderen van 7 tot 17 jaar met matig tot ernstige ziekte (PCDAI >30) die niet reageerden op eerder gegeven medicatie en nooit eerder een biological hadden gehad. Bij alle kinderen werd gestart met infliximab en azathioprine of methotrexaat waarna zij na 10 weken inductietherapie werden gerandomiseerd. De ene groep stopte de immunomodulator na 26 weken (n=39), de andere groep ging hier mee door tot 54 weken (n=45). Het gebruik van combinatietherapie gedurende 6 of 12 maanden maakte geen verschil in PCDAI-score of SES-CD. Beiden groepen hadden bij endoscopische en klinische evaluatie na 54 weken een gemiddelde PCDAI <10, en een lage SES-CD-score en ook was er binnen beide groepen geen significant verschil tussen deze uitkomsten bij 10 en 54 weken. Ook de noodzaak tot intensivering van therapie (gedefinieerd als dosisverhoging van medicatie en de noodzaak tot corticosteroïden of operatie) was niet verschillend tussen de groepen (29% versus 28%).
In een observationeel prospectief cohort onderzocht Nuti (2016) 37 kinderen die op 6 tot 18-jarige leeftijd gediagnostiseerd waren met ZvC en tussen 2009 en 2012 gestart waren met anti-TNFα therapie. Zij vergeleken kinderen die anti-TNFα ontvingen in combinatie met azathioprine of methotrexaat (n=23) met kinderen die anti-TNFα monotherapie ontvingen (n=14). De endoscopie na 9 tot 12 maanden toonde dat in beide groepen de SES-CD-score significant gedaald was ten opzichte van de score voor start van anti-TNFα. Een vergelijking in SES-CD-score tussen de twee groepen werd niet gerapporteerd. Het percentage patiënten met compleet herstel van de mucosa (mucosal healing), gedefinieerd als een SES-CD-score tussen 0 en 1, was vergelijkbaar in beide groepen (37.5% versus 33%; p=0.0853). Het percentage patiënten zonder herstel van de mucosa was aanzienlijk hoger in de groep die monotherapie ontving (18.75% versus 46.6%). Er was geen statistisch verschil in het percentage patiënten dat klinische remissie op basis van de PCDAI-score (74% versus 64%).
Grossi (2015) analyseerde de prospectief verzamelde gegevens van 502 kinderen gediagnosticeerd met ZvC <16 jaar. Hierbij werd onderscheid gemaakt tussen drie groepen kinderen; een groep gebruikte langer dan 6 maanden een immunomodulator (azathioprine of methotrexaat) naast infliximab (n=194), één groep gebruikte korter dan 6 maanden een immunomodulator naast infliximab (n=144) en de laatste groep gebruikte geen immunomodulator gedurende infliximab therapie (n=135). Middels cox regressie analyse toonden zij aan dat kinderen die langer dan 6 maanden een immunomodulator gebruikten naast infliximab een significant hogere kans hadden om de infliximabtherapie te continueren (HR 0.45; 95% CI, 0.30 tot 0.69; P<0.001). Ook wanneer specifiek naar thiopurines werd gekeken werd een significant verschil gevonden in het voordeel van de patiënten die >6 maanden thiopurine gebruikten gedurende de eerste 3 jaar (p<0.01) maar dit verschil werd hierna kleiner. Er werd geen significant verschil gevonden tussen de groepen wat betreft noodzaak tot verhoging van dosis of frequentie van de therapie. In de groep kinderen die een verhoging van dosis of frequentie nodig hadden was echter wel een significant verschil aanwezig tussen de groepen wanneer gekeken werd naar het aantal jaren tot de benodigde escalatie van therapie (geen immunomodulator (IM) 1.00 ± 1.17 jaar; IM ≤6 maanden 0.99 ± 0.92 jaar; en IM >6 maanden 1.41 ± 1.41 jaar (p<0.05). (Grossi, 2015).
In een in Nederland verrichte observationele retrospectieve multicenter studie door Kansen (2017) werd bij 162 kinderen met ZvC vorming van antilichamen gemeten en vergeleken in verschillende groepen; infliximab monotherapie, infliximab in combinatie met een immuunmodulator gedurende de gehele follow up periode (mediaan 32 maanden) en infliximab gecombineerd met een immuunmodulator gedurende de eerste 6.2 maanden (mediaan). In deze groepen ontwikkelden respectievelijk 42% (8/19), 10% (6/62) en 14% (11/81) antilichamen tegen infliximab. Dit verschil was significant voor zowel continue combinatietherapie (n=86; p=0.003) als voor de groep met vroege combinatietherapie (n=115; p=0.008). De noodzaak tot intensiveren van therapie was niet significant verschillende tussen de drie groepen (Kansen, 2017).
Bewijskracht van de literatuur
Bij het bepalen van de bewijskracht voor alle uitkomstmaten behoudens endoscopische verbetering (op basis van SES-CD) en klinische verbetering (op basis van PCDAI) werd uitgegaan van lage bewijskracht gezien de observationele opzet van de studies. De bewijskracht voor de uitkomstmaten klinische remissie, mucosaal herstel, duurzaamheid van infliximab en het vormen van antilichamen tegen infliximab is met vervolgens met nog 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); tegenstrijdige resultaten (inconsistentie); extrapoleerbaarheid (bias ten gunste van indirectheid); het geringe aantal patiënten (imprecisie); publicatiebias. Bij de overige twee uitkomstmaten voorkomend uit RCT’s endoscopische verbetering (op basis van SES-CD) en klinische verbetering (op basis van PCDAI) werd de bewijskracht met 2 niveaus verlaagd op basis van beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvragen te kunnen beantwoorden is er een systematische literatuuranalyse verricht. In verband met mogelijk grote overlap in studies betreffende kinderen met de ziekte van Crohn (ZvC) en colitis ulcerosa (CU) werden beiden ziektebeelden meegenomen in één search. De systematische literatuur analyse werd verricht naar de volgende zoekvraag (vragen):
1) Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met de ziekte van Crohn vergeleken met conventionele behandelstrategieën?
P: kinderen met de Ziekte van Crohn of colitis ulcerosa <18 jaar;
I: biological;
C: huidige behandelstrategieën;
O: klinische verbetering, endoscopische verbetering, behouden van remissie, duur van remissie, aantal opvlammingen, bijwerkingen.
2) Wat zijn de gunstige en ongunstige effecten van combinatietherapie ten opzichte van monotherapie met biologicals bij de behandeling van kinderen <18 jaar met de ziekte van Crohn?
P: kinderen met de Ziekte van Crohn of colitis ulcerosa <18 jaar;
I: combinatietherapie; een biological in combinatie met een immuunmodulator;
C: monotherapie; gebruik van alleen een biological zonder immuunmodulator;
O: klinische verbetering, endoscopische verbetering, behouden van remissie, duur van remissie, aantal opvlammingen, bijwerkingen.
3) Hoe dient monitoring van biologicals plaats te vinden bij behandeling van kinderen <18 jaar met de ziekte van Crohn en colitis ulcerosa?
P: kinderen met de Ziekte van Crohn of colitis ulcerosa <18 jaar;
I: monitoring;
C: geen monitoring;
O: vorming van antilichamen, verlies van respons, behouden van remissie, duur van remissie, complicaties, veiligheid, bijwerkingen.
Relevante uitkomstmaten
Betreffende uitgangsvragen 1 en 2 achtte de werkgroep behoud van remissie van ziekte en het optreden van ernstige complicaties voor de besluitvorming kritieke uitkomstmaten; en mucosaal herstel (mucosal healing, MH), endoscopische en klinische verbetering, duur van remissie en het aantal opvlammingen voor de besluitvorming belangrijke uitkomstmaten.
Betreffende uitgangsvraag 3 achtte de werkgroep vorming van antilichamen en verlies van respons als kritieke uitkomstmaten; en duur van remissie, complicaties, veiligheid en bijwerkingen voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
Er werden twee verschillende zoekacties verricht; de eerste ter beantwoording van deelvraag 1 en 2 en de tweede ter beantwoording van deelvraag 3. Alle zoekacties werden verricht in de volgende databases; Medline (via OVID), Embase (via Embase.com), Cochrane Central, Web of Science and Google Scholar. De 1e en 2e zoekactie werden verricht op respectievelijk 29 mei 2017 en 7 juli 2017. De zoekverantwoording van beide zoekacties is weergegeven onder het tabblad Verantwoording.
De literatuurzoekactie leverde 4138 treffers op voor wat betreft uitgangsvraag 1 en 2 en de vergelijkbare deelvragen over colitis ulcerosa. Na verwijderen van de duplicaten bedroeg het aantal resterende studies 3064. Studies werden geselecteerd op grond van de volgende selectiecriteria: het volledige artikel was beschikbaar, Engelstalig en geïncludeerde patiënten in de studie waren kinderen en/of adolescenten. Op basis van titel en abstract werden in eerste instantie 193 studies voor uitgangsvraag 1 voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 183 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 10 studies definitief geselecteerd.
Flowchart uitgangsvraag 1
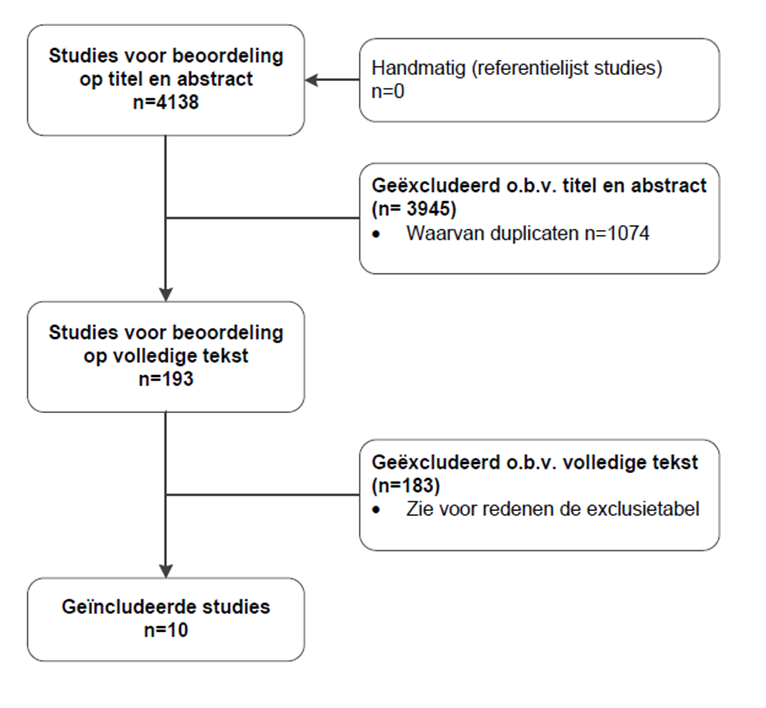
Betreffende uitgangsvraag 2 werden op basis van titel en abstract in eerste instantie 194 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 190 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 4 studies definitief geselecteerd.
Flowchart uitgangsvraag 2
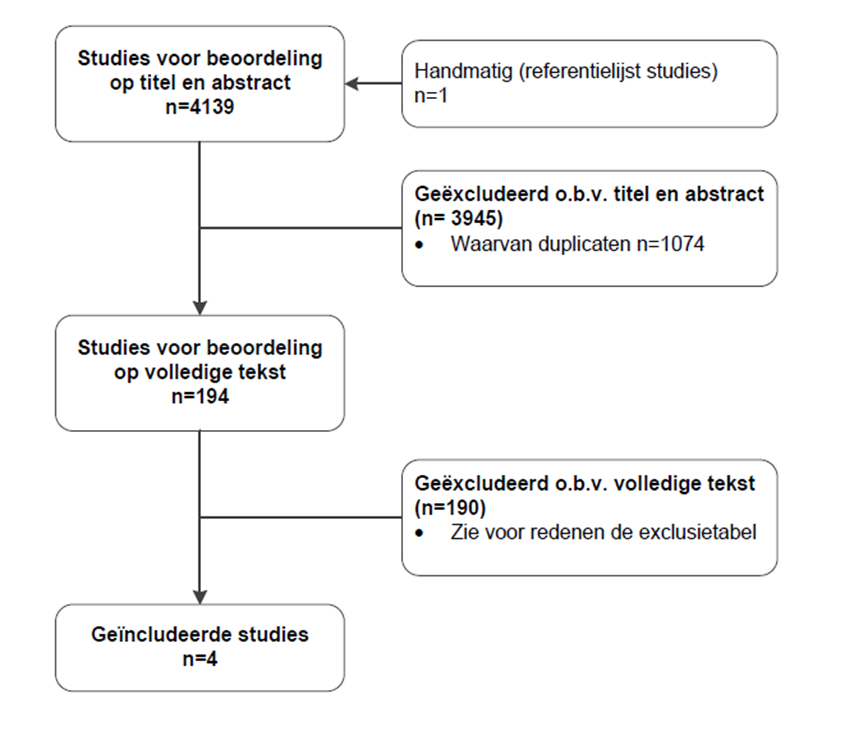
Voor beantwoording van deelvraag 1 en 2 zijn respectievelijk 10 en 4 onderzoeken opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Vande Casteele N, Ferrante M, Van Assche G, et al. Trough concentrations of infliximab guide dosing for patients with inflammatory bowel disease.Gastroenterology. 2015;148(7):1320-9.e3. doi: 10.1053/j.gastro.2015.02.031. Epub 2015 Feb 24. PubMed PMID: 25724455.
- Church PC, Guan J, Walters TD, et al. Infliximab maintains durable respons and facilitates catch-up growth in luminal pediatric Crohn's disease. Inflamm Bowel Dis. 2014;20(7):1177-86. doi: 10.1097/MIB.0000000000000083. PubMed PMID: 24865777.
- Colombel JF, Sandborn WJ, Reinisch W, et al. Infliximab, azathioprine, or combination therapy for Crohn's disease. N Engl J Med. 2010;362(15):1383-95. PMID: 20393175.
- Cozijnsen M, Duif V, Kokke F, et al. Adalimumab therapy in children with Crohn disease previously treated with infliximab. J Pediatr Gastroenterol Nutr. 2015;60(2):205-10. doi: 10.1097/MPG.0000000000000589. PubMed PMID: 25286063.
- Cozijnsen MA, Escher JC, Griffiths A, et al. Benefits and risks of combining anti-tumor necrosis factor with immunomodulator therapy in pediatric inflammatory bowel disease. Inflamm Bowel Dis. 2015;21(4):951-61. doi: 10.1097/MIB.0000000000000245. Review. PubMed PMID: 25723615.
- Day AS, Gulati AS, Patel N, et al. The Role of Combination Therapy in Pediatric Inflammatory Bowel Disease: A Clinical Report from the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018;66(2):361-368. doi: 10.1097/MPG.0000000000001850. PubMed PMID: 29210919.
- Diamanti A, Basso MS, Gambarara M, et al. Positive impact of blocking tumor necrosis factor alpha on the nutritional status in pediatric Crohn's disease patients. Int J Colorectal Dis. 2009;24(1):19-25. doi: 10.1007/s00384-008-0578-x. Epub 2008 Sep 17. PubMed PMID: 18797887.
- Dubinsky MC, Rosh J, Faubion WA Jr, et al. Efficacy and Safety of Escalation of Adalimumab Therapy to Weekly Dosing in Pediatric Patients with Crohn's Disease. Inflamm Bowel Dis. 2016;22(4):886-93. doi: 10.1097/MIB.0000000000000715. PubMed PMID: 26950307; PubMed Central PMCID: PMC4794130.
- Dulai PS, Singh S, Jiang X, et al. The Real-World Effectiveness and Safety of Vedolizumab for Moderate-Severe Crohn's Disease: Results From the US VICTORY Consortium. Am J Gastroenterol. 2016;111(8):1147-55. doi: 10.1038/ajg.2016.236. Epub 2016 Jun 14. PubMed PMID: 27296941.
- Dulai PS, Thompson KD, Blunt HB, et al. Risks of serious infection or lymphoma with anti-tumor necrosis factor therapy for pediatric inflammatory bowel disease: a systematic review. Clin Gastroenterol Hepatol. 2014;12(9):1443-51; quiz e88-9. doi: 10.1016/j.cgh.2014.01.021. Epub 2014 Jan 22. Review. PubMed PMID: 24462626.
- Dupont-Lucas C, Sternszus R, Ezri J, et al. Identifying Patients at High Risk of Loss of Respons to Infliximab Maintenance Therapy in Paediatric Crohn's Disease. J Crohns Colitis. 2016;10(7):795-804. doi: 10.1093/ecco-jcc/jjw038. Epub 2016 Jan 28. PubMed PMID: 26822611.
- Grossi V, Lerer T, Griffiths A, et al. Concomitant Use of Immunomodulators Affects the Durability of Infliximab Therapy in Children With Crohn's Disease. Clin Gastroenterol Hepatol. 2015;13(10):1748-56. doi: 10.1016/j.cgh.2015.04.010. Epub 2015 Apr 21. PubMed PMID: 25911120.
- Grover Z, Biron R, Carman N, et al. Predictors of respons to Infliximab in children with luminal Crohn's disease. J Crohns Colitis. 2014;8(8):739-46. doi: 10.1016/j.crohns.2013.12.017. Epub 2014 Jan 18. PubMed PMID: 24445015.
- Hyams J, Crandall W, Kugathasan S, et al. Induction and maintenance infliximab therapy for the treatment of moderate-to-severe Crohn's disease in children. Gastroenterology. 2007;132(3):863-73; quiz 1165-6. Epub 2006 Dec 3. PubMed PMID: 17324398.
- Hyams JS, Dubinsky MC, Baldassano RN, et al. Infliximab Is Not Associated With Increased Risk of Malignancy or Hemophagocytic Lymphohistiocytosis in Pediatric Patients With Inflammatory Bowel Disease. Gastroenterology. 2017;152(8):1901-1914.e3. doi: 10.1053/j.gastro.2017.02.004. Epub 2017 Feb 11. PubMed PMID: 28193515.
- Hyams JS, Griffiths A, Markowitz J, et al. Safety and efficacy of adalimumab for moderate to severe Crohn's disease in children. Gastroenterology. 2012;143(2):365-74.e2. doi: 10.1053/j.gastro.2012.04.046. Epub 2012 May 2. PubMed PMID: 22562021.
- Kang B, Choi SY, Kim HS, et al. Mucosal Healing in Paediatric Patients with Moderate-to-Severe Luminal Crohn's Disease Under Combined Immunosuppression: Escalation versus Early Treatment. J Crohns Colitis. 2016;10(11):1279-1286. Epub 2016 Apr 19. PubMed PMID: 27095752.
- Kansen HM, van Rheenen PF, Houwen RHJ, et al. Kids with Crohn's, Colitis (KiCC) Working Group for Collaborative Paediatric IBD Research in the Netherlands. Less Anti-infliximab Antibody Formation in Paediatric Crohn Patients on Concomitant Immunomodulators. J Pediatr Gastroenterol Nutr. 2017;65(4):425-429. doi: 10.1097/MPG.0000000000001551. PubMed PMID: 28945207.
- Kelsen JR, Grossman AB, Pauly-Hubbard H, et al. Infliximab therapy in pediatric patients 7 years of age and younger. J Pediatr Gastroenterol Nutr. 2014;59(6):758-62. doi: 10.1097/MPG.0000000000000533. PubMed PMID: 25419596.
- Kestens C, van Oijen MG, Mulder CL, et al. Dutch Initiative on Crohn and Colitis (ICC). Adalimumab and infliximab are equally effective forvCrohn's disease in patients not previously treated with anti-tumor necrosis factor-a agents. Clin Gastroenterol Hepatol. 2013;11(7):826-31. doi: 10.1016/j.cgh.2013.01.012. Epub 2013 Jan 29. PubMed PMID: 23376000.
- Kierkus J, Iwanczak B, Wegner A, et al. Monotherapy with infliximab versus combination therapy in the maintenance of clinical remission in children with moderate to severe Crohn disease. J Pediatr Gastroenterol Nutr. 2015;60(5):580-5. doi: 10.1097/MPG.0000000000000684. PubMed PMID: 25564804.
- Kim MJ, Lee JS, Lee JH, et al. Infliximab therapy in children with Crohn's disease: a one-year evaluation of efficacy comparing 'top-down' and 'step-up' strategies. Acta Paediatr. 2011;100(3):451-5. doi: 10.1111/j.1651-2227.2010.01938.x. PubMed PMID: 20626362.
- Kugathasan S, Denson LA, Walters TD, et al. Prediction of complicated disease course for children newly diagnosed with Crohn's disease: a multicentre inception cohort study. Lancet. 2017;389(10080):1710-1718. doi: 10.1016/S0140-6736(17)30317-3. Epub 2017 Mar 2. PubMed PMID: 28259484; PubMed Central PMCID: PMC5719489.
- Ledder O, Assa A, Levine A, et al. Vedolizumab in Paediatric Inflammatory Bowel Disease: A Retrospective Multi-Centre Experience From the Paediatric IBD Porto Group of ESPGHAN. J Crohns Colitis. 2017;11(10):1230-1237. doi: 10.1093/ecco-jcc/jjx082. PubMed PMID: 28605483.
- Lee D, Baldassano RN, Otley AR, et al. Comparative Effectiveness of Nutritional and Biological Therapy in North American Children with Active Crohn's Disease. Inflamm Bowel Dis. 2015;21(8):1786-93. doi: 10.1097/MIB.0000000000000426. PubMed PMID: 25970545.
- Lee JS, Lee JH, Lee JH, et al. Efficacy of early treatment with infliximab in pediatric Crohn's disease. World J Gastroenterol. 2010;16(14):1776-81. PubMed PMID: 20380012; PubMed Central PMCID: PMC2852828.
- Lee YM, Kang B, Lee Y, et al. Infliximab "Top-Down" Strategy is Superior to "Step-Up" in Maintaining Long-Term Remission in the Treatment of Pediatric Crohn Disease. J Pediatr Gastroenterol Nutr. 2015;60(6):737-43. doi: 10.1097/MPG.0000000000000711. PubMed PMID: 25564801.
- Lee YS, Baek SH, Kim MJ, et al. Efficacy of Early Infliximab Treatment for Pediatric Crohn's Disease: A Three-year Follow-up. Pediatr Gastroenterol Hepatol Nutr. 2012;15(4):243-9. doi: 10.5223/pghn.2012.15.4.243. Epub 2012 Dec 31. PubMed PMID: 24010094; PubMed Central PMCID: PMC3746055.
- Nobile S, Gionchetti P, Rizzello F, et al. Mucosal healing in pediatric Crohn's disease after anti-TNF therapy: a long-term experience at a single center. Eur J Gastroenterol Hepatol. 2014;26(4):458-65. doi: 10.1097/MEG.0000000000000045. PubMed PMID: 24445727.
- Nuti F, Civitelli F, Bloise S, et al. Prospective Evaluation of the Achievement of Mucosal Healing with Anti-TNF-a Therapy in a Paediatric Crohn's Disease Cohort. J Crohns Colitis. 2016;10(1):5-12. doi: 10.1093/ecco-jcc/jjv126. Epub 2015 Jul 17. PubMed PMID: 26188350.
- Peneau A, Savoye G, Turck D, et al. Mortality and cancer in pediatric-onset inflammatory bowel disease: a population-based study. Am J Gastroenterol. 2013;108(10):1647-53. doi: 10.1038/ajg.2013.242. Epub 2013 Aug 13. PubMed PMID: 23939626.
- Rahier JF, Magro F, Abreu C, et al. European Crohn's and Colitis Organisation (ECCO). Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis. 2014;8(6):443-68. doi: 10.1016/j.crohns.2013.12.013. Epub 2014 Mar 6. PubMed PMID: 24613021.
- Richmond L, Curtis L, Garrick V, et al. Biosimilar infliximab use in paediatric IBD. Arch Dis Child. 2018;103(1):89-91. doi: 10.1136/archdischild-2017-313404. Epub 2017 Oct 7. PubMed PMID: 28988215; PubMed Central PMCID: PMC5754881.
- Ruemmele FM, Lachaux A, Cézard JP, et al. Efficacy of infliximab in pediatric Crohn's disease: a randomized multicenter open-label trial comparing scheduled to on demand maintenance therapy. Inflamm Bowel Dis. 2009;15(3):388-94. doi: 10.1002/ibd.20788. PubMed PMID: 19023899.
- Ruemmele FM, Veres G, Kolho KL, et al. European Crohn's and Colitis Organisation; European Society of Pediatric Gastroenterology, Hepatology and Nutrition. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn's disease. J Crohns Colitis. 2014;8(10):1179-207. doi: 10.1016/j.crohns.2014.04.005. Epub 2014 Jun 6. PubMed PMID: 24909831.
- Russell RK, Wilson ML, Loganathan S, et al. A British Society of Paediatric Gastroenterology, Hepatology and Nutrition survey of the effectiveness and safety of adalimumab in children with inflammatory bowel disease. Aliment Pharmacol Ther. 2011;33(8):946-53. doi: 10.1111/j.1365-2036.2011.04603.x. Epub 2011 Feb 22. PubMed PMID: 21342211.
- Sandborn WJ, Hanauer SB, Rutgeerts P, et al. Adalimumab for maintenance treatment of Crohn's disease: results of the CLASSIC II trial. Gut. 2007;56(9):1232-9. Epub 2007 Feb 13. PubMed PMID: 17299059; PubMed Central PMCID: PMC2701613.
- Sieczkowska J, Jarzebicka D, Banaszkiewicz A, et al. Switching Between Infliximab Originator and Biosimilar in Paediatric Patients with Inflammatory Bowel Disease. Preliminary Observations. J Crohns Colitis. 2016;10(2):127-32. doi: 10.1093/ecco-jcc/jjv233. Epub 2015 Dec 30. PubMed PMID: 26721942.
- Siegel CA, Finlayson SR, Sands BE, et al. Adverse events do not outweigh benefits of combination therapy for Crohn's disease in a decision analytic model. Clin Gastroenterol Hepatol. 2012;10(1):46-51. doi: 10.1016/j.cgh.2011.09.017. Epub 2011 Oct 1. PubMed PMID: 21963958; PubMed Central PMCID: PMC3495170.
- Singh N, Rabizadeh S, Jossen J, et al. Multi-Center Experience of Vedolizumab Effectiveness in Pediatric Inflammatory Bowel Disease. Inflamm Bowel Dis. 2016;22(9):2121-6. doi: 10.1097/MIB.0000000000000865. PubMed PMID: 27542130.
- Targan SR, Hanauer SB, van Deventer SJ, et al. A short-term study of chimeric monoclonal antibody cA2 to tumor necrosis factor alpha for Crohn's disease. Crohn's Disease cA2 Study Group. N Engl J Med. 1997;337(15):1029-35. PubMed PMID: 9321530.
- Toruner M, Loftus EV Jr, Harmsen WS, et al. Risk factors for opportunistic infections in patients with inflammatory bowel disease. Gastroenterology. 2008;134(4):929-36. doi: 10.1053/j.gastro.2008.01.012. Epub 2008 Jan 11. PubMed PMID: 18294633.
- Vahabnezhad E, Rabizadeh S, Dubinsky MC. A 10-year, single tertiary care center experience on the durability of infliximab in pediatric inflammatory bowel disease. Inflamm Bowel Dis. 2014;20(4):606-13. doi: 10.1097/MIB.0000000000000003. PubMed PMID: 24552827; PubMed Central PMCID: PMC5330671.
- Walters TD, Kim MO, Denson LA, et al. Increased effectiveness of early therapy with anti-tumor necrosis factor-a versus an immunomodulator in children with Crohn's disease. Gastroenterology. 2014;146(2):383-91. doi: 10.1053/j.gastro.2013.10.027. Epub 2013 Oct 23. PubMed PMID: 24162032.
Evidence tabellen
Evidence-tabel deelvraag 1
Wat is de plaats van biologicals (anti-TNFα, vedolizumab) in de behandeling van kinderen met de ziekte van Crohn?
|
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|||||||
|
Diamanti 2009 |
Type of study: Retrospective observational study, study period: 1999-2005
Setting: Tertiary center for IBD treatment
Country: Italy
Source of funding: |
Inclusion criteria: < 18 years, with CD
Exclusion criteria: (1) those who did not take 5-aminosalicylic-acid compounds and immunomodulators simultaneously; (2) those who had had steroid therapy during 3 months preceding the beginning of the study; (3) those who had only a single infliximab infusion; (4) those who tried new therapies during the study period; and (5) those with fever, abscess, or draining fistula during the last week preceding the study start-up.
N total at baseline: Intervention: 14 Control: 14 (matched for gender and age)
Groups comparable at baseline: No significant differences were found between the two groups as regards clinical features or previously administered therapies. But comparison regarding PCDAI at baseline in the two groups is not shown. |
Describe intervention (treatment/procedure/test):
Patients treated with infliximab, group A: patients received mesalazine (30 mg/kg/day) and azathioprine (2 mg/kg/day) and 5 mg/kg infliximab. I.V. infliximab was given at week 0, week 4 and then every 8 weeks.
Indications for adding infliximab to conventional therapy were refractoriness to steroids in eight patients and dependency on steroids in the remaining six.
|
Describe control (treatment/procedure/test):
Patients treated with traditional therapy, group B: received mesalazine (30 mg/kg/day) and azathioprine (2 mg/kg/day). |
Length of follow-up: Median treatment duration was 10 months (5.5-28) in group A. No further information available on duration of follow up.
Loss-to-follow-up: Two patients from group A were lost to follow-up because they were moved to an adult IBD care centre.
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Primary outcomes: changes in linear growth and nutritional status (weight, BMI): Weight (kg): 39.7 ± 13.1 at baseline versus 42.6 ± 13.2 final in group A (p <0.03). 42.1 ± 11.8 at baseline vs 44.1 ± 12.0 at final in group B (NS).
BMI (kg/m2): 17.9 ± 3.3 at baseline vs 18.9 ± 3.1 at final in group A (p<0.05). 18.7 ± 2.6 at baseline vs 19.5 ± 2.4 at final (NS).
Differences in height were non-significant in both treatment groups.
Secondary outcomes: Median PCDAI (IQR): 23.5 (10-56) at baseline vs 10 (5-17.5) at final in group A. 17.5 (12.5-26.25) at baseline vs 20 (13.75-22.5) at final in group B.
No significant differences for Resting energy expenditure, basal metabolic rate, caloric intake and protein intake.
|
Aim of this study: to assess the effects of IFX as compared with those of standard therapy on growth and nutritional status.
Comments: No p-values are described for the comparison of group A and B. So no statistical testing on the treatment effect in group A vs group B. |
||||||
|
Hyams 2017 |
Type of study: Prospective observational study
Setting: Multicenter 2007- june 2016
Country: 56 sites in North America and 26 sites in the EU (UK, Belgium, The Netherlands, France, Germany, Denmark, and Italy).
Source of funding: Janssen Biotech, Inc. (manufacturer of IFX) |
Inclusion criteria: < 17 years of age in North America, and 6 years to less than 17 years of age in the EU.
Exclusion criteria: Patients were ineligible to participate in the study if they had a history of other IBD-like conditions associated with genetic diseases (ie, glycogen storage disease 1b)
N total at baseline: total 5766 Intervention: IFX group: 2396 Control: 2942 (=non-biologic)
Groups comparable at baseline: Significant differences for age, median duration of disease, modified PCDAI an partial Mayo score. |
Describe intervention (treatment/procedure/test):
IFX group (exposure to IFX as the only biologic in the presence or absence of exposure to non-biologics)
Biologic group (exposure to any biologic, including IFX) |
Describe control (treatment/procedure/test):
Non-biologic (exposure to 5-aminosalicylates, corticosteroids, thiopurines, methotrexate, antibiotics or other non-biologic IBD therapies, in the absence of exposure to any biologics). |
Length of follow-up: Median follow up: 4.7 years
Loss-to-follow-up: Attrition rate of 20.1% for the total study population
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Primary outcomes: 8/15 malignancies was leukemia or lymphoma. 5 HLH events were observed.
Unadjusted incidence rates: no increased risk of malignancy (0.46/1000 patientyears) or HLH (0.0/1000 patient-years) in patients exposed to IFX as the only biologic vs those unexposed to biologics (malignancy: 1.12/1000 patient-years; HLH: 0.56/1000 patient-years).
SIRs : no increased risk of malignancy among patients exposed to IFX (SIR, 1.69; 95% CI, 0.46–4.32) vs patients not exposed to a biologic agent (SIR, 2.17; 95% CI, 0.59–5.56), even when patients were stratified by thiopurine exposure.
Secondary outcomes: |
Aimed to compare unadjusted incidence rates of malignancy and HLH in pediatric patients with IBD exposed to infliximab (IFX) with patients not exposed to biologics and calculated standardized incidence ratios (SIRs). |
||||||
|
Kang 2016 |
Type of study: Prospective observational study
Setting: Medical center, jan 2011 –dec 201.
Country: Korea
Source of funding: Unknown |
Inclusion criteria: Paediatric patients with moderate-to-severe luminal CD of non-penetrating, non-stricturing behaviour. Moderate-to-severe CD at diagnosis was defined as a score of 30 points or greater according to the Pediatric Crohn’s Disease Activity Index (PCDAI)
Exclusion criteria: Patients of indeterminate- type IBD, mild disease activity at diagnosis, penetrating or stricturing disease behaviour, previous history of bowel surgery, IFX indicated for the treatment of refractory perianal fistulas, and age at IFX baseline of 18 years or over were excluded.
N total at baseline: 76 Intervention: 48 Control: 28
Important prognostic factors2: See logistic regression in outcome measures.
Groups comparable at baseline There were no significant differences between the two groups except for the duration from initial diagnosis to IFX infusion (median 8.1 months vs 0.7 months; p < 0.001).
|
Describe intervention (treatment/procedure/test):
Early combined immunosuppression group (group B); Treatment was initiated within 1 month from diagnosis with intravenous IFX together with oral AZA and mesalazine. Mesalazine was given concomitantly with AZA to improve treatment respons and reduce thiopurine-related toxicity by increasing the levels of 6-thioguanine nucleotides (6-TGN).
Partial exclusive nutrition (PEN) was given both during CS induction in those who were allocated to the step-up group, and also during induction with IFX in groups A and B.
IFX was administered according to the scheduled induction regimen of 5 mg/kg at weeks 0, 2, and 6, and no dose adjustments were allowed during this period. Scheduled IFX was repeated every 8 weeks starting from week 14. |
Describe control (treatment/procedure/test):
Escalated combined immunosuppression group (group A); Started with oral CS at a dose of 1 mg/kg/day (maximum 60 mg/kg/day) and was tapered over 8 weeks. Oral AZA and mesalazine was also started with oral CS. When treatment respons was refractory to or dependent on CS, IFX was started with no changes in the treatment with AZA and mesalazine.
Partial exclusive nutrition (PEN) was given both during CS induction in those who were allocated to the step-up group, and also during induction with IFX in groups A and B.
IFX was administered according to the scheduled induction regimen of 5 mg/kg at weeks 0, 2, and 6, and no dose adjustments were allowed during this period. Scheduled IFX was repeated every 8 weeks starting from week 14. |
Length of follow-up: Unclear
Loss-to-follow-up: Intervention (group B): N =3 due to primary non-respons (10.7%) at week 14.
Control (group A): N =1 due to primary non respons (0.02%)
Incomplete outcome data: See above, no further description.
|
Outcome measures and effect size (include 95%CI and p-value if available):
* Mucosal healing was defined as a SES-CD score of zero.
Primary outcome: Mucosal healing at week 14 from baseline IFX: MH rates were higher in group B than in group A, but NS (32% versus 51%, p=0.121).
Logistic regression analysis: treatment group B was positively associated with MH at week 14 from baseline IFX (OR = 4.271, 95% CI = 1.249–14.605, p = 0.02), and ‘upper gastrointestinal tract involvement’ was negatively associated with MH at week 14 from baseline IFX (OR = 0.156, 95% CI = 0.041–0.589, p = 0.006).
Mucosal healing at week 54 from baseline IFX: MH rates were significantly higher in group B than in group A (42% vs 74%; p=0.007).
Logistic regression analysis: ‘group B’ and a ‘healed mucosa status at week 14 from baseline IFX’ were positively associated with MH at week 54, and ‘upper gastrointestinal tract involvement’ and ‘presence of perianal fistulas’ were negatively associated with MH at week 54.
Secondary outcome:
Tertiary outcome: Delta Z-scores of weight, height and BMI for age between baseline and week 54: Weight: 0.75 ± 0.89 for group A and 0.82 ± 0.64 for group B (p=0.248). Height: 0.10 ± 0.37 for group A and 0.11 ± 0.23 for group B (p = 0.653) BMI: 0.89 ± 0.88 for group A and 0.96 ± 0.74 for group B (p = 0.381) |
Aimed to compare the efficacy of combined immunosuppression: escalated combined immunosuppression vs early combined immunosuppression. |
||||||
|
Kim 2011 |
Type of study: Retrospective study
Setting: Two centers in Korea, period: march 2001-august 2008
Country: Korea
Source of funding: Unknown |
Inclusion criteria: Pediatric patients with CD (based on Porto criteria).
Exclusion criteria: Infectious disease such as tuberculosis.
N total at baseline: 29 Intervention: 18 Control: 11
Important prognostic factors2: I: includes patients with moderate or severe CD. C: includes eight patients with steroid-resistant CD and 3 with steroid dependent CD.
Number of patient with incurable fistulas: I: n=12 (66.6%) C: n=11 (54.5%)
Groups comparable at baseline No significant differences, except for the duration from initial diagnosis to IFX infusion (0.8 ± 0.6 versus 11.5 ± 7.4 months; p= <0.001). |
Describe intervention (treatment/procedure/test):
Top-down group: Patients had not been treated previously with other medications such as corticosteroids or other immunomodulators.
|
Describe control (treatment/procedure/test):
Step-up group: oral corticosteroids (prednisolone, 1–2 mg⁄ kg ⁄ day), were used for induction therapy. Mesalamine (Pentasa, 50–80 mg⁄ kg ⁄ day) or azathioprine (Imuran, 2–3 mg⁄ kg ⁄ day) was provided for maintenance therapy as the conventional treatment. Infliximab (5 mg⁄ kg) was administered by intravenous infusion at weeks zero, two and six, in combination with daily azathioprine, and this course was repeated every 8 weeks for 10 months thereafter. |
Length of follow-up: At least 12 months
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Disease remission = PCDAI less than 10 points. Moderate to severe disease is > 30 points.
Remission rate at week 8: 3/11 in step-up group versus 16/18 in top-down group (p=0.001). Remission rate at 1 year: 5/11 in step-up group versus 15/18 in top-down group (p=0.048).
ESR significantly higher in Step-up group at 8 weeks: 51.5 ± 38.4 versus 17.1 ± 15.0; p=0.002, and also at 1 year: 44.9 ± 38.1 versus 21.3 ± 17.8; p=0.031 Albumin significantly lower in step-up group at 8 weeks 3.8 ± 0.4 versus 4.2 ± 0.3; p=0.019, and also at 1 year: 3.9 ± 0.4 4.3 ± 0.3 0.013. Weight gain: Step up group 9.4 ± 7.1 vs 11.7 ± 6.0 in the top-down group; no significant difference. Fistula closure assessment: 12/12 (100%) fistulas completely closed in top-down group compared to 3/6 (50%) in step-up group after one year. At 8 weeks this was 58.3% and 16.7% respectively.
Severe adverse events; Patients treated with mesalamine had three adverse events (two patients with anorexia and one with pancreatitis). Of patients treated with azathioprine, seven were found to have adverse events (one with anorexia, one with pancreatitis and five with leukopenia). For patients treated with infliximab, one patient in the ‘step-up’ group had an adverse event: dyspnea and tachycardia following the third infusion. |
Aim: to evaluate the efficacy of top-down versus step-up strategies.
Comments: |
||||||
|
Kugathasan 2017 |
Type of study: Prospective inception cohort study
Setting: Multicenter, 28 sites. Nov 2008 – June 2012.
Country: USA, Canada
Source of funding: Crohn’s and Colitis Foundation of America, Cincinnati Children’s Hospital Research Foundation Digestive Health Center. |
Inclusion criteria: Newly diagnosed CD patients < 18 years.
Exclusion criteria: IBD other than CD. Patient with incomplete information on disease location, patients who experienced complications either at or within 90 days at diagnosis, an those who did not attend at least one follow up visit.
N total at baseline: Intervention: 191 (180 IFX, 11 adalimumab) Control: 191 (from the same cohort, matched by propensity-score matching).
Important prognostic factors2:
|
Describe intervention (treatment/procedure/test):
Patients with early anti-TNFa exposure.
Early anti-TNFa exposure was defined as complication free initiation of therapy within 90 days of diagnosis and successful completion of both induction doses (three doses of infliximab and two doses of adalimumab) and at least one maintenance dose |
Describe control (treatment/procedure/test):
Patient who did not receive early anti-TNF treatment, matched
Propensity of early anti-TNFα exposure was modeled by regressing the effects of baseline factors affecting anti-TNFα use (age, race, sex, disease location, perianal disease, height, Z-score, weight Z-score, PCDAI score at diagnosis, any deep ulcer on colonoscopy, and interaction between age and PCDAI) on early anti-TNFα use. Scores representing the propensity of early anti-TNFα exposure were computed and used to match each of the patients who received early anti-TNFα with a patient who did not. |
Length of follow-up: Not specifically mentioned for the total cohort or for the propensity matched groups. But median (IQR) for the following groups: B1 (n=835); 47 (36-55)
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Progression to stricturing behaviour (B2): 14 / 191 in the early anti-TNFa group versus 12 /191 in the controls (p > 0.75)
Progression to penetrating behaviour (B3): 4 / 191 versus 11 / 191 (p=0.07)
Following competing risk model: Patients who received early anti-TNFα therapy were less likely to have penetrating complications (hazard ratio (HR) 0.30, 95% CI 0.10–0.89; p=0.0296) but not stricturing complication (1.13, 0.51–2.51; 0.76) than were those who did not receive early anti-TNFα therapy. |
Aim: To derive a risk-stratification model based on clinical, host biology and microbial factors defined at diagnosis, and treatments including anti-TNF therapy.
|
||||||
|
Lee 2010 |
Type of study: Retrospective chart analysis
Setting: Single center (Samsung Medical Center), march 2001 – feb 2007
Country: Korea
Source of funding: Unknown |
Inclusion criteria: Newly diagnosed CD patients based on Porto criteria. Patients had not been treated with agents such as corticosteroids, mesalamine or IFX. Patients were followed for at least 24 months.
Exclusion criteria: Infectious diseases such as tuberculosis.
N total at baseline: 36 Intervention: 13 Control: 23 (subdivided in 2 groups of n=10 and n=13)
Groups comparable at baseline Only median age, duration of follow up and mean PCDAI were compared between the 3 groups, no significant differences.
|
Describe intervention (treatment/procedure/test):
Patients received infliximab and azathioprine for induction and maintenance therapy for the first year, and were treated with azathioprine after 1 year (group C, n=13).
IFX was administered by intravenous infusion at weeks 0, 2 and 6, in combination with daily azathioprine and subsequently every 8 wk for 10 mo. This group was not previously treated with other medications.
|
Describe control (treatment/procedure/test):
Patients were treated with mesalamine after induction therapy with prednisolon (group A, n=10) or were treated with azathioprine after induction therapy with prednisolon (group B, n=13). |
Length of follow-up: Mean: 51.9 months (range 24-101)
Loss-to-follow-up: Four lost to follow up, not specified in which group.
Incomplete outcome data: Three patients did not respond to induction regimen, 2 did not stop corticosteroid and one patient did not respond to three infusions of infliximab for induction.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Opvlamming rate (opvlamming = PCDAI >10): The opvlamming rate at 1 year was 23.1% (95% confidence interval (CI): 0.2%-46.0%) in group C (3 /13 patients), 61.5% (95% CI: 35.1%-88.0%) in group B (8 /13 patients) and 80.0% (95% CI: 55.2%-100.0%) in group A (8 / 10 patients). At 1 year, the absolute difference between groups C and B was 38.5% (95% CI: 3.5%-73.4%) and 56.9% (95% CI: 23.2%-90.7%) between groups C and A. Significant difference between each of the groups (P = 0.047 for B vs C, P = 0.012 for A vs C). This remained significant at 2 years of follow up.
Adverse events: Patients treated with mesalamine had three adverse events. Five patients treated with azathioprine were found to have adverse events. Only one patient had dyspnea and tachycardia after the third infusion of infliximab |
Aim: to evaluate the efficacy of the early use of IFX, compared to conventional treatments, at 1 and 2 years of follow-up.
Periods in which patients were treated differed (group A mainly 2001-2003 and group C mainly 2005-2007)
Partly the same data as in Kim 2011 (adverse events are exactly the same) |
||||||
|
YS Lee 2012 |
Type of study: Retrospective chart analysis
Setting: Single centre (Samsung Medical Centre), 1998-2009.
Country: Korea
Source of funding: Unknown |
Inclusion criteria: Patients diagnosed with CD according to Porto criteria.
Exclusion criteria: Patients with infectious disease, such as tuberculosis.
N total at baseline: 28 Intervention: 10 Control: 18
Important prognostic factors2: Median age I: mean 10.2 ± 5.4 C: mean 14.4 ± 1.3 p-value: 0.010
PCDAI at prior 1st IFX infusion: I: mean 40.4 ± 10.2 C: mean 30.5 ± 14.9 p-value: 0.069
Groups comparable at baseline? No, as mentioned above. Also, duration from the initial diagnosis to infliximab infusion is significantly different (p 0.001)
|
Describe intervention (treatment/procedure/test):
Step-up group: 10 patients refractory to conventional therapy, including eight with steroid-resistant CD and two with steroid dependent CD who received infliximab.
They received infliximab and azathioprine for induction and maintenance therapy for the first year, and were treated with azathioprine after 2 years.
|
Describe control (treatment/procedure/test):
Top-down group: Eighteen patients with moderate-to-severe CD were assigned to the ‘top-down’ group.
They had not been previously treated with other medication. Infliximab (5 mg/kg) was administered by intravenous infusion at weeks 0, 2, and 6 in combination with daily azathioprine, and this course was repeated every 8 weeks for 10-12 months thereafter. |
Length of follow-up: At least 36 months
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Opvlamming rate at 1 year: 16.7% in ‘top-down’ group (3 /18 patients), 50% in ‘step-up’ group (5/10 patients). At 1-year, the absolute difference between two groups was 33.3%. There was not a significant difference between the groups (p=0.091).
Opvlamming rate at 2-year follow-up: in ‘top-down’ group 50% (9 /18 patients) and 90% in the ‘step-up’ group (9/ 10 patients). At 2 years, the absolute difference between two groups was 40%. There was a significant difference between the groups (p=0.048).
Opvlamming rate at 3-year follow-up: 61.1% and 90% respectively. There was no significant difference (p=0.194)
Adverse events: Two patients treated with mesalamine had anorexia. Eleven patients treated with azathioprine experienced adverse events (leukopenia in nine and pancreatitis in two). For patients treated with infliximab, only one patient in the ‘step-up’ group had an adverse event, consisting of dyspnea and tachycardia that occurred after the third infusion. |
Aim: To evaluate the efficacy of the top-down strategy compared to the step-up strategy at 1,2 and 3 years of follow-up.
Comments: Again the same adverse events, so probably same cohort. This time also the same outcome measure. |
||||||
|
Lee D 2015 |
Type of study: Prospective observational cohort study
Setting: multicenter
Country: Canada, USA
Source of funding: |
Inclusion criteria: Children and young adults < 22 years of age. Needing treatment of active CD (PCDAI >10)
Exclusion criteria: Presence of an ostomy, treatment with probiotics within 2 weeks of initiating EN, treatment with anti-TNF therapy within 8 weeks of starting EN, or treatment with EN within 1 week of initiating anti-TNF therapy
N total at baseline: 90 Intervention: n=52 Control: n= 16 PEN, 22 EEN
Important prognostic factors2: All baseline variables with a p-value <0.25 were included in a disease risk score using a backward selection procedure. Adjustments for the disease risk score were made in the analysis.
Groups comparable at baseline? Median disease duration was shorter in the EN groups (P = 0.001; PEN 0.11 yr, EEN 0.03 yr, and anti-TNF 0.72 yr), and percentage male was also greater in the EN therapy groups. Baseline PCDAI was lowest in the anti-TNF group but similar in the PEN and EEN groups (30.2 ± 12.0, 37.6 ± 19.3, and 38.8 ± 11.0, respectively; P = 0.01). |
Describe intervention (treatment/procedure/test):
Patients receiving anti-TNFa (all infliximab, one adalimumab)
|
Describe control (treatment/procedure/test):
Patients receiving PEN or EEN. |
Length of follow-up: 8 weeks
Loss-to-follow-up: Intervention: N=0 (0%)
Control: N =4 (10%); one in PEN group, 3 in EEN group. Three due to poor tolerance of therapy and 2 either because of loss of interest or the decision to stop EEN as therapy.
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Fecal calprotectine at week 8 after start of therapy: The percentage of patients with FCP ≤50 mg/g was significantly higher in the anti-TNF group compared to the EEN group (30 versus 5%; p = 0.03). The proportion of subjects achieving FCP ≤50 mg/g, FCP ≤250 mg/g, and >50% reduction in FCP again displayed a trend toward increasing rates of success from PEN to EEN to anti-TNF (P = 0.01, P = 0.001, and P = 0.03, respectively)
Over 8 weeks, all 3 treatment groups had a significant decrease in PCDAI and FCP (P , 0.05 for all comparisons). After adjusting for the disease risk score, a trend of increasing proportion of subjects achieving clinical respons was seen from PEN to EEN to anti-TNF (adjusted P = 0.08).
Weight Z-scores were significantly higher in the PEN group (0.76 ± 0.66 versus 0.38 ± 0.40 in anti-TNF group; p=0.04) and in the EEN group (0.70 ± 0.75 versus 0.38 ± 0.40 in anti-TNF group; p=0.03).
BMI Z-scores were significantly higher in the PEN group (1.24 ± 1.36 versus 0.48 ± 0.56 in anti-TNF group; p=0.07) and in the EEN group (1.13 ± 0.96 versus 0.48 ± 0.56 in anti-TNF group; p=0.002)
With additional adjustment for clinical remission status at week 8, systemic symptoms improved more with EEN than with anti-TNF (P = 0.01); |
Aim: CD. As part of a larger study on the impact of EEN, PEN, and anti-TNF therapy on the composition of the gut microbiota, clinical outcomes, mucosal healing, and QOL were assessed for the different treatment groups.
Comments: EEN was used at the 2 Canadian sites, and PEN with an unrestricted diet was used in Philadelphia
Outcomes are adjusted for disease risk score. |
||||||
|
Yoo Min Lee 2015, |
Type of study: Retrospective review of a prospective cohort
Setting: Single center, sept 2008- may 2012 (Samsung Medical Center)
Country: Korea
Source of funding: Unknown |
Inclusion criteria: Paediatric patients diagnosesd as having moderate to severe CD (based on Porto criteria, PCDAI > 30), who received infliximab.
Exclusion criteria:
N total at baseline: Intervention: 31 Control: 20
Groups comparable at baseline? No significant difference between the 2 groups other than the duration from the initial diagnosis to infliximab infusion (10.8 ± 9.0 months vs 1.0 ±0.5 months; P<0.0001)
|
Describe intervention (treatment/procedure/test):
Top-down (group A): early infliximab therapy. Patients received treatment with infliximab, azathioprine, and mesalazine for induction and maintenance therapy for the first year. Oral corticosteroids, azathioprine, and mesalazine were started after diagnosis, and oral corticosteroids were stopped after a tapering period of 8 weeks.
|
Describe control (treatment/procedure/test):
Step-up (group B): patients receiving infliximab after proved to be refractory to conventional treatment. No changes in treatment with azathioprine and mesalazine were made. |
Length of follow-up: 3 years
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
After 1 year of treatment of infliximab: 26 patients in group A (84%) and 9 patients in group B (45%) were in clinical remission. 25 patients in group A (81%) and 8 patients in group B (40%) had achieved deep remission (P=.0.0006) based on colonoscopy.
The opvlamming-free rates at 1, 2, and 3 years were 83.9% (95% CI 0.655–0.930), 58.1% (95% CI 0.390–0.731), and 35.5% (95% CI 0.194–0.519), respectively, in group A and 45.0% (95% CI 0.231–0.647), 20.0% (95% CI 0.062–0.393), and 15.0% (95% CI 0.037–0.335), respectively, in group B (P.0.0094).
The overall remission period in group A (33.2 ± 2.6 months) was longer than in group B (28.2 ± 6.0 months) (P=0.005).
Z-scores of weight-, height-, and body mass index for-age, and weight-for-height at the start of infliximab treatment and 3 years after infliximab initiation did not show statistical significance between the 2 groups. Delta z scores of weight-for height between the 2 periods, however, were significantly higher in group A compared with those in group B (1.190 ± 0.956 vs 0.424 ± 1.422; P=0.0424)
Among the adverse events, leukopenia was most frequently observed with 6 patients in group A and 3 patients in group B. Nausea and vomiting was observed in 4 patients in group A and 1 patient in group B. Pancreatitis was observed in 3 patients: 1 in group A and 2 in group B. Rash was observed in 1 patient in group A. There was no significant difference in adverse events between the 2 groups (P=0.9718). |
Aim: to compare the efficacy of remission maintenance between infliximab ‘‘top-down’’ and ‘‘step-up’’ strategies in moderate to severe pediatric Crohn disease during 3 years.
Comments: At one year colonoscopy was performed and patients were allocated to treatment again based on the findings. Not described how they took this into account in the analysis. |
||||||
|
Walters 2014 |
Type of study: Retrospective analysis of Prospective, observational cohort study
Setting: Data from RISK trial (Kugathasan 2017), 28 centers, nov 2008-jan 2012
Country: USA, Canada
Source of funding: See above |
Inclusion criteria: Children < 17 year of age, newly diagnosed with inflammatory CD.
Exclusion criteria: Stricturing or penetrating disease. Patients receiving both anti-TNFa and IM in the first 3 months (combination therapy; n = 12) were not included in this analysis.
N total at baseline: Intervention: 68 (early anti TNFa) Control: 248 (early IM mono), 236 (late therapy)
Important prognostic factors2: Patients receiving early anti-TNFa therapy tended to have a greater likelihood of PCDAI greater than 30 at presentation (p=0.0047) and a greater likelihood of deep ulcers at endoscopy (p=0.0018). They were less likely to receive CS in the first 3 months (p=0.001). Patients < 10 years of age were less likely to receive early anti-TNFa therapy compared with other approaches (0.017). Propensity matched controls were used (for every patient with early anti-TNF) to increase comparability.
|
Describe intervention (treatment/procedure/test):
Three groups: First group: Early anti-TNFa monotherapy; defined as the treatment administered within 3 months of the initial diagnosis without the other, respectively.
Patients could receive various other treatments (CS, mesalamine, exclusive enteral nutrition) at the discretion of their physician. |
Describe control (treatment/procedure/test):
Second group: Early IM monotherapy; defined as the treatment administered within 3 months of the initial diagnosis without the other, respectively.
Third group: Late therapy (no early immunotherapy) was defined as therapy started between 3 and 12 months.
Patients could receive various other treatments (CS, mesalamine, exclusive enteral nutrition) at the discretion of their physician. |
Length of follow-up: Minimum of 1 year
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Primary outcome: Looking at the whole cohort: CS-free clinical remission (PCDAI ≤10) at 1 year after diagnosis: 58 of 68 (85%) patients treated with early anti- TNFa only, 152 of 248 (61%) patients treated with early IM only, and 129 of 236 (55%) patients not treated with either anti-TNFa or IM within the first 3 months (P < .0001).
When looking at the propensity matched groups: The remission rate with early anti-TNFa therapy (85%) was significantly greater than with either early IM (60%) or no early immunotherapy (54%) (P = 0.0003). Remission at 1 year did not differ when comparing patients receiving early IM or no early immunotherapy (P = .49).
Relative risk for 3 treatment groups to achieve CS-free remission: Anti-TNF only versus IM only: RR 1.41 (1.14-1.76), p-value 0.0017. Anti-TNF vs no early immunotherapy: RR 1.157 (1.23-1.99) p-value 0.0002.
*Including late additional therapy as a covariate and accounting for its effect did not change the results.
Secondary outcome in propensity matched group by one year: Height: Within the early anti-TNFa–exposed group, the mean height z-score increased by 0.14, whereas for the other 2 groups the height z-score remained unchanged (-0.02 in IM group and -0.06 in the late therapy group; P =0.039). Weight: Within the early anti-TNFa–exposed group, the mean weight z-score increased by 0.85, which was a higher increase than in the other two groups (0.60 in IM group and 0.62 in the late therapy group; P =0.044). BMI: Within the early anti-TNFa–exposed group, the mean BMI z-score increased by 1.11, which was a higher increase than in the other two groups (0.87 in IM group and 0.91 in the late therapy group; P =0.3). |
Aims: to compare the effectiveness of early (≤ 3 mo after diagnosis) treatment with an anti–tumor necrosis factor TNFa with that of an immunomodulator in attaining clinical remission and facilitating growth of pediatric patients.
Comments: |
||||||
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Lee, 2016 |
Type of study: Retrospective cohort study
Setting: Data obtained from Truven Health MarketScan Commercial Claims and Encounters (CCAE) databases containing health care claims for about 180 million people, 2009-2013
Country: US Source of funding: Unknown |
Inclusion criteria: Children and young adults < 24 years of age, newly diagnosed with IBD. At least 6 months of enrolment after the date of diagnosis in the registry and patients had have received at least one IBD medication during the follow-up period.
Exclusion criteria: Patients with a history of tuberculosis and/or medications for tuberculosis.
N total at baseline: Intervention: 1298 Control: 2002
Important prognostic factors2: Not assessed
Groups comparable at baseline? Not assessble |
Describe intervention (treatment/procedure/test):
“top-down”: was defined as TNFa inhibitor initiation within 30 days of the first medication prescription for IBD (i.e., 5-aminosalicylates, systemic corticosteroids, thiopurines, and/or immunosuppressants)
|
Describe control (treatment/procedure/test):
The conventional “step-up” approach was defined as TNFa inhibitor initiation more than 30 days after the first IBD medication prescription. |
Length of follow-up: Not clearly described
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Patients who received top-down treatment were less likely to use corticosteroids (32.5% versus 94.2%, P= 0.0001), 5-aminosalicylates (17.3% versus 75.1%, P = 0.0001), methotrexate (7.2% versus 14.6%, P = 0.0001), or thiopurines (13.5% versus 54.8%, P = 0.0001) compared with step-up patients. No difference in switching between different types of TNFa (5,7% vs. 7.4%, P = 0.0581). |
Aims:
Comments: Not real clinically relevant outcomes for our research question |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Evidence-tabel deelvraag 2
Wat is het beleid ten opzichte van monotherapie versus combinatietherapie bij kinderen met de ziekte van Crohn?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Grossi |
Type of study: Prospective observational cohort study
Setting: Multi center
Country: Not specified (the pediatric IBD registry by the IBD Collaborative Research Group)
Source of funding: Unknown |
Inclusion criteria: Newly diagnosed Crohn’s disease < 16 years of age.
Exclusion criteria: Patients who received treatment with another biologic agent or resectional surgery before initiating infliximab, as well as episodic infliximab therapy, were excluded. Patients for whom infliximab was used primarily for perirectal disease only were excluded. N total at baseline: 502 Intervention: 338 Control: 135
Groups comparable at baseline? There were no significant clinical differences between patients who did not receive concomitant IM, patients with concomitant IM for 6 months or less, or patients with concomitant IM for more than 6 months with the exception that non-B1 behavior at infliximab initiation was 13%, 20%, and 8% in the 3 groups, respectively (P < .01). |
Describe intervention (treatment/procedure/test):
Combination therapy: infliximab plus azathioprine or methotrexate, subdivided in : - concomitant IM for > 6 mo
A total of 231 subjects received only thiopurines (126 male, 105 female), and 81 received only methotrexate (60 male, 21 female). Twenty-six patients were excluded from the IM-specific analysis because they used both methotrexate and a thiopurine at different times during their infliximab therapy. |
Describe control (treatment/procedure/test):
Monotherapy: infliximab only. |
Length of follow-up: The median follow-up period from diagnosis was 4.5 years, and was 2.75 years from infliximab initiation.
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Kaplan–Meier analysis comparing the concomitant IM use groups for all patients showed that patients in the >6 m group were more likely to remain on infliximab compared with those in the >6 m or no-IM groups (P < .001 overall for males, and P < .01 for females).
The probability of remaining on infliximab at 5 years after infliximab start in patients with more than 6 months of concomitant IM use was 0.70 ± 0.04 (0.73 ±0.05 for males, 0.65 ± 0.07 for females) compared with 0.48 ± 0.08 (0.41± 0.11 for males, 0.59± 0.08 for females) in patients with no IM and 0.55± 0.06 (0.59± 0.07 for males, 0.49± 0.09 for females) for those in the <6 month group (p <0.01). IM use before infliximab therapy had no effect on subsequent durability independent of IM use during infliximab therapy. No change in results was noted when non-B1 patients were excluded from this analysis.
Cox proportional hazards analysis : longer-term use (>6 mo) of any IM was associated significantly with increased durability of infliximab when compared with patients who did not receive concomitant IM therapy (hazard ratio, 0.45; 95% CI, 0.30–0.69; P <0.001). The hazard ratio for thiopurines was 0.62 (95% CI, 0.40–0.97; P <0 .05), and for methotrexate was 0.09 (95% CI, 0.02–0.37; P < 0.001).
There was no significant difference between the 3 treatment groups in the probability of requiring escalation of therapy by either dose or frequency by 1 or 3 years. However, among those patients with dose or frequency escalation there was a significant difference between treatment groups in the time (years) to the first escalation: no IM, 1.00 ± 1.17 years; IM <6 months, 0.99± 0.92 years; and IM >6 months, 1.41 ± 1.41 years (P <0 .05).
Safety: There was 1 malignancy and 2 deaths (1x following HLH & sesis, 1x cardiac arrhythmia considered unrelated to therapy in a patient with a history of prolonged QT interval) in the study population during the follow-up period. The frequency of infusion reactions was similar in all 3 IM groups. |
Aims: To investigate how immunomodulatory treatment affects the durability of infliximab therapy.
|
|
Kansen 2017 |
Type of study: Retrospective observational study
Setting: Multicenter (five tertiary paediatric university hospitals and one general hospital)
Country: The Netherlands
Source of funding: |
Inclusion criteria: Patients diagnosed with CD based on clinical, endoscopic, radiologic and histologic standards and had started infliximab (IFX; Remicade®) before the age of 18 years.
Exclusion criteria: Patients were ineligible if they were diagnosed as IBD-unclassified or if follow-up was less than 3 months after initiation of infliximab treatment.
N total at baseline: 229 Intervention: 201 (115 on early combined immunosuppression (ECI), 86 on continuous combined immunosuppression (CCI)) Control: 28
ATI measurement in 162 (81 ECI, 62 CCI, 19 IFX mono)
Groups comparable at baseline? * There were 21 patients treated with alternating combination and monotherapy and those patients were included in the analysis of group ECI. *Comparison of baseline characteristics performed but results of statistical testing not described.
|
Describe intervention (treatment/procedure/test):
Patients in the CCI group continued IM during IFX treatment throughout the observation period. In the ECI group IFX had been combined with IM for a median of 6.2 months (IQR 4-15).
118 patients received thiopurines (115 azathioprine, 3 mercatpopurine), 25 received methotrexate. |
Describe control (treatment/procedure/test):
IFX monotherapy |
Length of follow-up: Median: 32 months (IQR 18.3 – 53.9)
Loss-to-follow-up: Not described.
Incomplete outcome data:
|
Outcome measures and effect size (include 95%CI and p-value if available):
Primary endpoint: Six out of 62 patients in the CCI group developed ATIs (10%), 11 of 81 in the ECI group (14%), and 8 of 19 in the IFX group (42%). Kaplan-Meier analysis comparing the incidence of ATI formation showed significantly higher probability of developing ATIs in patients in the IFX monotherapy group compared with those in the CCI (P=0.003) and the ECI group (P=0.008), log-rank overall 0.002.
In the ECI group, all 11 positive ATI patients developed ATIs in the IFX monotherapy period as immunomodulatory therapy had been stopped at least 4 months before positive titres were measured.
75).
The need for treatment escalation was not different between the groups, with respectively 40 out of 86 patients (46.5%) in CCI, 65 out of 115 (56.5%) in ECI, and 18 out of 28 (64.3%) in the IFX group. |
Aim: The primary study end point was defined as the formation of positive antibodies (>12 AE/mL). Loss of respons was a secondary outcome parameter. Additional secondary end points included need for treatment escalation, time to both antibody formation and loss of respons and adverse events. |
|
Kierkus 2015 |
Type of study: Randomized open-label trial
Setting: Multicenter (15 tertiary academic institutions)
Country: Poland
Source of funding: |
Inclusion criteria: 7 to 17 year old patients. Patients with moderate to severely active CD (defined by PCDAI > 30), and lacked or lost respons to previously given paharmacotherapy other than biological therapy.
Exclusion criteria: Patients who had received any biological agent within 8 weeks before or during the trial.
N total at baseline: 99 Intervention: 45 Control: 39
Groups comparable at baseline? No significant differences at baseline between groups. Also no significant difference at moment of randomization.
|
Describe intervention (treatment/procedure/test):
Group I: Patients in which IFX and immunomodulatory agent were continued up to week 54
*Induction: all patients (in both groups) received IFX (5 mg/kg) along with an immunomodulatory agent (azathioprine 1.5-3 mg/kg, methotrexate 10-25 mg/week).
|
Describe control (treatment/procedure/test):
Group 2: Patients in which immunomodulatory agent was discontinued after 26 weeks. |
Length of follow-up: 54 weeks
Loss-to-follow-up: Intervention: N = 0
Control: N = 0
Incomplete outcome data: Intervention: N=2 (4%) due to loss of clinical respons.
Control: N=2 (5%) due to loss of clinical respons. |
Outcome measures and effect size (include 95%CI and p-value if available):
Primary endpoint: Clinical remission defined as PCDAI ≤ 10 points after one year of maintenance therapy. Mean PCDAI in group I at 54 weeks was 8.48 (median 5, IQR 0-15) compared with 8.31 (median 5, IQR 0-15) in group II; non-significant. Mean SES-CD at 54 weeks was 5.56 (median 1, IQR 0-9) in group I compared with 3.82 (median 3, IQR 0-6) in group 2; non-significant.
No significant differences were documented between mean PCDAI and SES-CD scores determined at the end of induction (10th week) and maintenance (54th week) phases in both groups.
SAE’s: 5 SAE’s in group 2 )3x activation of EBV infection, 1x psoriatic lesions, 1x diarrhea.
Secondary endpoints: Necessity of intensifying/modifying maintenance therapy, such as surgical treatment: surgery (4/45 in group I vs 1/39 in group II); NS
Increased dose of the immunomodulatory agent or IFX: 13 of 45 (29%) and 11 of 39 (28%) patients of groups I and II, respectively; NS Steroid reimplementation: 3 of 45 (6.7%) and 3 of 39 (7.7%) patients of groups I and II, respectively |
Aim: to compare the efficacy and safety of maintenance therapy with IFX and continuation of the immunomodulator versus withdrawal of the immunomodulator.
Comments: Four SAE’s in group I occurred during induction phase, those were withdrawn from the study.
|
|
Nuti 2016 |
Type of study: Prospective observational cohort study
Setting: Single center
Country: Italy
Source of funding: Unknown |
Inclusion criteria: Diagnosed with CD at 6-18 years of age, who started therapy with an anti-TNF agent between Jan 2009 and Oct 2012.
Exclusion criteria: The need for immediate surgery, symptomatic stenosis or ileal or colonic strictures with prestenotic dilatation, and the presence of bacterial or viral infection.
N total at baseline: 37 Intervention: 23 Control: 14
Groups comparable at baseline? Unclear; this was a subanalysis, no characteristics per group described.
|
Describe intervention (treatment/procedure/test):
Combination therapy: anti-TNFa plus azathioprine or methotrexate
The duration of such combinations was 8 ± 3.8 months (range 1–17 months). |
Describe control (treatment/procedure/test):
Monotherapy: anti-TNFa only. |
Length of follow-up: 9-12 months
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
In both groups SES-CD values decreased significantly at follow-up, but reduction was more significant in the combination therapy group (p = 0.0002 vs p = 0.033).
No difference in the achievement of complete MH (p = 0.835). For complete plus partial MH as the outcome, the combination therapy group had significantly better results (p = 0.035) The rates of complete MH were similar in the two groups, combination therapy vs monotherapy, (37.5 vs 33%) but the rate of no MH was considerably higher in the monotherapy one (18.75 vs 46.6%). *complete MH = SES-CD of 0 or 1
The rates of clinical remission according to PCDAI values at follow-up did not differ statistically (combination, 74%; monotherapy, 64%).
The rate of non-respons at follow up was 13% in the combination group and 21% in the monotherapy one (not significant). |
Aims: To assess the efficacy of biologics in obtaining mucosal healing in paediatric CD. The secondary aims were: (1) to assess respons based on early or late treatment introduction and on combination therapy with IMM versus biologics alone; and (2) to evaluate clinical outcome 2 years after the second endoscopy.
Comments: Limited data because of subgroupanalysis.
|
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Falaiye, 2014 |
Type of study: Retrospective cohort
Setting: hostilatized patients
Country: U.S.
Source of funding: none |
Inclusion criteria: anti-TNF naïve patients 2–20 years with refractory colitis-predominant IBD (UC, CD, or IBD-U), initiated on infliximab
Exclusion criteria:
N total at baseline: Intervention: 9 Control:20
Important prognostic factors2: Not specified
Groups comparable at baseline? unknown |
Describe intervention (treatment/procedure/test):
immunomodulator + IFX
|
Describe control (treatment/procedure/test):
IFX
|
Length of follow-up: 923 days (range 133-1952)
Loss-to-follow-up: Not specified
Incomplete outcome data: Not specified
|
Outcome measures and effect size (include 95%CI and p-value if available):
Dose escalation of IFX (increase IFX dose or reduction in the infusion interval from the standard (5 mg/kg at 0, 2, and 6 weeks induction; maintanace 8-week): associated with monotherapy (combi 2/9 (22%) vs mono 16/20 (80%)) (OR 0.71 [95% CI 0.01,0.49], p=0.01)
IFX failure (cessation of infliximab for inefficacy or adverse reaction, or total colectomy): not associated with monotherapy (combi 2/9 (22%) vs mono 16/20 (80%)) (combi 78% vs. mono 55%; OR 2.86 [95% CI 0.47,17.35], P = 0.41)
|
Geen onderscheid tussen CD 15 (52%), UC 12 (41%) en IBD-U 2 (7%): all patients had inflammation of the colon |
|
McGinnis, 2008 |
Type of study: Retrospective cohort
Setting: outpatient clinic
Country: U.S.
Source of funding: none |
Inclusion criteria: children with steroid-resistant and dependent UC who received IFX in a 36-month interval
Exclusion criteria:
N total at baseline: Intervention: 20 Control:19
Important prognostic factors2: Not specified
Groups comparable at baseline? unknown |
Describe intervention (treatment/procedure/test):
IFX + Azathioprine or mercaptopurine
|
Describe control (treatment/procedure/test):
IFX |
Length of follow-up: Mean 18.5 months (range 1-36)
Loss-to-follow-up: Four patients (10%) were lost to follow-up. Not specific intervention versus control.
Incomplete outcome data: See loss to follow-up
|
Outcome measures and effect size (include 95%CI and p-value if available):
Respons (posttreatment recategorization into Truelove and Witts ‘‘mild’’ category or better):
No difference in respons combi (15/20) vs. mono (12/19), p=0.50
|
|
|
Hyams, 2010 |
Type of study: prospective, multicenter, inception cohort study
Setting: hospitalized and outpatient
Country: U.S.
Source of funding: none |
Inclusion criteria: Children < 16 years with UC started on IFX
Exclusion criteria:
N total at baseline: Intervention: 32 Control: 20
Important prognostic factors2: Not specified
Groups comparable at baseline? unknown |
Describe intervention (treatment/procedure/test):
Azathioprine or mercaptopurine +IFX (at start IFX, at 3, 6, 12 ,24 months)
|
Describe control (treatment/procedure/test):
IFX |
Length of follow-up: Median 30 months
Loss-to-follow-up: Not specified
Incomplete outcome data: Not specified
|
Outcome measures and effect size (include 95%CI and p-value if available):
Lower colectomy rate in combi therapy at: - combi vs mono 3 months - combi vs mono 6 months 25% vs 36% - combi vs mono 12 months 26% vs 50% - combi vs mono 24 months , 47% vs 78%
|
Geen p-waarde gegeven voor mono vs combi op 3, 6, 12, 24 maanden |
|
Hyams, 2012 |
Type of study: prospective, multicenter, inception cohort study
Setting: hospitalized and outpatient
Country: U.S.
Source of funding: Janssen Research & Development
|
Inclusion criteria: Patients (6–17 years old) with active UC (Mayo scores of 6–12; endoscopic subscores 2) not responded to or tolerated conventional treatment start on IFX
Exclusion criteria:
N total at baseline: Intervention: 28 Control: 32
Important prognostic factors2: Not specified
Groups comparable at baseline? unknown |
Describe intervention (treatment/procedure/test):
IFX + AZA, 6-MP, MTX at baseline
|
Describe control (treatment/procedure/test):
IFX |
Length of follow-up: 8 weeks for nonreponders, 52 week for responders
Loss-to-follow-up: 7 (30.4%) discontinued treatment because of an adverse event, 3 (13.0%) for unsatisfactory therapeutic effect,and 1 (4.3%) for other reasons. Groups not specified.
Incomplete outcome data: Not specified
|
Outcome measures and effect size (include 95%CI and p-value if available):
clinical respons: decrease in the Mayo score by 30% and 3 points, with a decrease in the rectal bleeding subscore of 1 or a rectal bleeding subscore of 0 or 1.
clinical remission: as defined by a mayo score ≤2 with no individualsubscore >1
mucosal healing: Mayo endoscopy subscore of 0 or 1
Week 8 combi (n=32) vs mono (n=28): no differences 23 (71.9%) vs 21 (75.0%) - mucosal healing 21 (65.6%) vs 20 (71.4%) Week 52 combi (n=11) vs mono (n=10): no differences |
Geen p-waarde gegeven voor mono vs combi |
|
Dan-Nielsen, 2014 |
Type of study: Retrospective cohort study
Setting: outpatient
Country: denmark
Source of funding: none |
Inclusion criteria: Children with UC < 15 years at diagnosis started on IFX
Exclusion criteria:
N total at baseline: Intervention: 29 Control: 15
Important prognostic factors2: Not specified
Groups comparable at baseline? unknown |
Describe intervention (treatment/procedure/test):
IFX + AZA/6MP initiated before first infusion
|
Describe control (treatment/procedure/test):
IFX + AZA/6MP initiated directly after first infusion
|
Length of follow-up:
Loss-to-follow-up: 8 of 45 (18%) patients did not complete the induction treatment. In 6 of 8 cases owing to lack of respons: 5 of those were colectomized, and 1 was bridged to AZA/6MP by leukocyte apheresis
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Clinical respons (not defined): AZA/6MP initiated before versus after initiation of IFX treatment) was associated with clinical remission (P = 0.49 |
AZA/6-MP voor of direct na 1e infusie, geen exacte definitie van clinical respons, geen exacte cijfers/percentages van monovs combi |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias deelvraag 1
Wat is de plaats van biologicals (anti-TNFα, Vedolizumab) in de behandeling van kinderen met de ziekte van Crohn?
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Diamanti, 2009 |
Likely (patients were treated with IFX for a reason, so likely to be a different type of patient) |
Likely (information on duration of follow up is scarce, only 10 months treatment duration mentioned in group A, which might be too short for assessment of growth parameters (especially height) |
Unlikely |
Likely (PCDAI at baseline not compared between the two groups). |
|
Hyams, 2017 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Kang, 2016 |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Kim, 2011 |
Likely (patients in the step-up therapy group had a longer disease duration and were resistant to other therapies already) |
Unlikely |
Unlikely |
Likely (no p-values for differences in groups at baseline mentioned, no MVA performed). |
|
Kugathasan, 2017 |
Unlike, derived from the same cohort in the same period. |
Unlikely |
Unlikely |
Unlikely, patients were matched pairwise using propensity scores. |
|
Lee, 2010 |
Likely (patients in the step-up therapy group had a longer disease duration and were resistant to other therapies already) |
Unlikely |
Unlikely |
Likely (only a few baseline characteristics were checked, not disease location, perianal disease or not etc.) |
|
Lee, 2012 |
Likely (patients in the step-up therapy group had a longer disease duration and were resistant to other therapies already) |
Unlikely |
Unlikely |
Likely (significant differences at baseline, so confounders) |
|
Dave Lee, 2015 |
Unlikely |
Unlikely |
Unlikely |
Unlikely (adjustment for confounders was performed) |
|
Yoo Min Lee, 2015 |
Likely (patients in the step-up therapy group had a longer disease duration and were resistant to other therapies already) |
Unlikely |
Unlikely |
Likely (no differences at baseline, but not described how reallocation of treatment was taken into account. |
|
Walters, 2014 |
Unlikely |
Unlikely |
Unlikely |
Unlikely, possible confounders were taken into account. Also propensity matched groups were created. |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Lee, 2016 |
Unlikely |
unclear |
unlikely |
likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Risk of bias deelvraag 2
Wat is het beleid ten opzichte van monotherapie versus combinatietherapie bij kinderen met de ziekte van Crohn?
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Nuti, 2016 |
Unlikely
|
Unlikely |
Unlikely |
Likely (no test for comparison of baseline characteristics used) |
|
Grossi, 2015 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Kansen, 2017 |
Unclear |
Unlikely |
Unlikely |
Unlikely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Hyams, 2010 |
likely |
unclear |
unlikely |
likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Kierkus, 2015 |
Open label randomization. Patients with the clinical respons on week 10 were centrally randomized into 2 different maintenance protocols. |
Likely (open-label) |
Likely (for clinical respons outcome measures like PCDAI because open-label, SES-CD not influenced) |
Likely (open-label) |
Likely (open-label) |
Unlikely |
Unlikely (Reported n=0 lost to follow up in both groups) |
Unlikely (ITT analysis was performed) |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 17-12-2018
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Biologicals bij ZvC |
NVK |
2019 |
5 jaar |
Iedere 5 jaar |
NVK |
Nieuwe publicaties over effectiviteit van biologicals bij ZvC bij kinderen |
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (https://www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om een effectieve en efficiënte diagnostiek en behandeling te realiseren bij kinderen met een inflammatoire darmziekte (de ziekte van Crohn of colitis ulcerosa (IBD, Inflammatory Bowel Disease).
Doelgroep
Deze richtlijn is bedoeld voor kinderartsen, kinderartsen-MDL, MDL-artsen, IBD-verpleegkundig specialisten, IBD-physician assistants en IBD-verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen en adolescenten met inflammatoire darmziekten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. Dr. J.C. Escher, kinderarts maag-darm-leverziekten, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK, voorzitter
- Drs. M.A. Aardoom MSc, arts-onderzoeker, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK
- Drs. G. van den Brink MSc, arts-onderzoeker, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK
- Dr. K. Diederen, MSc, onderzoeker binnen de kindergeneeskunde, werkzaam in het Academisch Medisch Centrum-Emma Kinderziekenhuis te Amsterdam, NVK
- M.A.C. van Gaalen, verpleegkundig specialist kinder-MDL, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, V&VN
- Drs. S. Haisma MSc, arts-onderzoeker, werkzaam in het Universitair Medisch Centrum-Beatrix Kinderkliniek te Groningen, NVK
- Dr. A. Kindermann, kinderarts maag-darm-leverziekten, werkzaam in het Emma Kinderziekenhuis-Emma Kinderziekenhuis te Amsterdam en in het Academisch Medisch Centrum te Amsterdam, NVK
- Drs. M. Oldenziel, klinisch psycholoog, werkzaam in het Gelre ziekenhuis te Apeldoorn, NIP
- Dr. P.F. van Rheenen, kinderarts maag-darm-leverziekten, werkzaam in het Universitair Medisch Centrum-Beatrix Kinderkliniek te Groningen, NVK
- Dr. L. de Ridder, kinderarts maag-darm-leverziekten, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK
- Prof. Dr. C.J. van der Woude, maag-darm-leverarts, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVMDL
Klankbordgroep
De klankbordgroepleden hebben gedurende de ontwikkeling van de richtlijn meegelezen met de conceptteksten en deze becommentarieerd.
- Dr. J. Curvers, klinisch chemicus, werkzaam in het Catharina ziekenhuis te Eindhoven, NVKC
- Dr. W. van Gemert, chirurg, werkzaam in het Universitair Medisch Centrum te Maastricht, NVvH
- Dr. L. Hanff, ziekenhuisapotheker, werkzaam in het Prinses Máxima Centrum te Utrecht, , NVZA
- T. Markus, directeur, werkzaam bij de Crohn en Colitis Ulcerosa Vereniging Nederland te Woerden
- H. Rippen, directeur, werkzaam bij Stichting Kind en Ziekenhuis te Utrecht
- H. van der Wielen, verpleegkundig specialist kinder-MDL, werkzaam in het Jeroen Bosch Ziekenhuis te Den Bosch, V&VN
Met ondersteuning van:
- Dr. I.M. Mostavaya, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.M.M. Vaes, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Escher |
kinderarts maagdarmleverziekten |
-adviserend arts voor cyberpoli IBD, (onbetaald) -editor voor diverse vaktijdschriften, (onbetaald) -Bestuurslid NVGE (onbetaald) -Voorzitter kinder-IBD-werkgroep (KICC; sectie kinder-MDL, NVK) (onbetaald)
|
-Deelname aan en advisory board member register studie DEVELOP (sponsor is Janssen) -Deelname aan en advisory board member register studie CAPE (sponsor is Abbvie) -Deelname aan TISKIDS studie (ZONMW, co-sponsor is Pfizer) -Biomarkers studie (co-sponsor is MSD) |
Geen actie |
|
Aardoom |
Arts-onderzoeker in Erasmus MC Sophia op gebied van IBD bij kinderen |
Bestuurslid (secretaris) van Young-ICC (onbetaald)
|
- |
Geen actie |
|
Van den Brink |
Arts-onderzoeker in Erasmus MC-Sophia op het onderzoek HAPPY-IBD (angst/depressieklachten bij jongeren met IBD) |
|
- |
Geen actie |
|
Diederen |
Onderzoeker |
Onderzoeker in het Academisch Medisch Centrum-Emma op gebied van IBD bij kinderen |
- |
Geen actie |
|
Van Gaalen |
Verpleegkundig specialist kinder-MDL |
- |
- |
Geen actie |
|
Haisma |
Arts-onderzoeker |
Arts-onderzoeker in UMC Groningen op gebied van IBD bij kinderen |
- |
Geen actie |
|
Kindermann |
kinderarts maagdarmleverziekten |
-Lid commissie voeding NVK (onbetaald) -Lid commissie ondervoeding NVK (onbetaald) -Penningmeester kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK)(onbetaald)
|
-Deelname DEVELOP register studie (sponsor is Janssen) -Deelname CAPE register studie (sponsor is Abbvie) |
Geen actie |
|
Oldenziel |
Klinisch Psycholoog Hoofd vakgroep psychologie kind & jeugd Opleider |
-Docent aan de opleiding tot Gezondheidszorgpsycholoog, betaald -Docent/trainer, agressietraining, betaald -Deelnemer werkgroep NOLK, onbetaald |
- |
Geen actie |
|
Van Rheenen |
kinderarts maagdarmleverziekten |
-Associate Professor International Child Health (onbetaald) -Coordinator Tropical Medicine Master Education (onbetaald) -Secretaris kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK) (onbetaald) -Voorzitter P-ECCO (Paediatricians of European Crohn's and Colitis Organisation) (onbetaald) |
-SELFIE-studie, gefinancierd door Buhlmann Laboratories AG -GRINCH-studie, gefinancierd door CisBo BioAssays -CACATU-studie, gefinancierd door CisBo BioAssays |
Geen actie |
|
De Ridder |
kinderarts maagdarmleverziekten |
Lid kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK) (onbetaald) Secretaris ESPGHAN IBD Porto werkgroep (onbetaald) Penningmeester PIBDnet (onbetaald) Bestuurslid P-ECCO (Paediatricians of European Crohn's and Colitis Organisation) (onbetaald)
|
-Deelname DEVELOP register studie (sponsor is Janssen) -Deelname CAPE register studie (sponsor is Abbvie) -PI van TISKIDS studie (ZONMW, co-sponsor is Pfizer) -PI van REDUCE RISK (Horizon 2020) studie voor Nederland |
Geen actie |
|
Van Der Woude |
Maag-darm-leverarts |
-Lid educatie commissie UEG (onbetaald) -Lid scientific commissie ECCO (onbetaald) -Secretaris NVGE (onbetaald) |
- ZonMw - Pfizer - Danone - Tramedico |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een enquête onder leden van de CCUVN, welke door de CCUVN is geïnitieerd, en waaraan een aantal werkgroepleden inhoudelijk heeft meegewerkt. Het verslag hiervan is besproken in de werkgroep en de belangrijkste overwegingen zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de CCUVN, Stichting Kind en Ziekenhuis en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Nederlandse Vereniging voor Kindergeneeskunde, 2008) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door belanghebbende partijen tijdens de Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: 1) klinische relevantie; 2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit; 3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

