Biologicals
Uitgangsvraag
Wanneer dienen biologicals te worden overwogen bij kinderen met CU?
Deze uitgangsvraag bevat de volgende deelvragen:
- Wat is de plaats van biologicals (anti-TNFα, anti-α4ß7 integrine) in de behandeling van kinderen met colitis ulcerosa?
- Wat is het beleid ten opzichte van monotherapie versus combinatietherapie bij kinderen met colitis ulcerosa?
Deelvraag over het gebruik van biologicals in alle typen IBD:
- Wat is de rol van het monitoren van biological plasma dalspiegels en antistoffen tegen biologicals bij kinderen met IBD?
Aanbeveling
Deelvraag 1 Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met colitis ulcerosa vergeleken met conventionele behandelstrategieën?
Geef anti-TNFα therapie alleen in een centrum waar kinderartsen MDL werkzaam zijn die ervaring hebben met IBD op kinderleeftijd.
Evalueer voor het starten met anti-TNFα of de patiënt doorgemaakte of latente infecties heeft (TBC, Hepatitis B en Hepatitis C).
Intensiveer de behandeling door anti-TNFα te starten bij kinderen met actieve colitis ulcerosa wanneer onvoldoende effect wordt bereikt met immunomodulatoren onderhoudstherapie.
Start met infliximab als eerste anti-TNF middel van keuze bij zowel chronisch actieve ziekte als bij ernstige actieve ziekte.
Doseer infliximab volgens het volgende schema; 5 mg/kg per infusie in week 0, 2 en 6. Continueer onderhoudstherapie middels een infusie elke 8 weken en intensiveer frequentie en/of dosering bij onvoldoende respons, bij voorkeur op geleide van dalspiegelbepaling en (en wanneer deze sterk verlaagd is, een antistofbepaling).
Doseer subcutane adalimumab injecties volgens het volgende schema:
- Kinderen <40 kg: 80 mg bij de eerste s.c. toediening, 40 mg na 2 weken en vervolgens 20 mg elke 2 weken.
- Kinderen >40 kg: 160 mg bij de eerste s.c. toediening, 80 mg na 2 weken en vervolgens 40 mg elke 2 weken.
Overweeg wekelijkse injecties bij onvoldoende respons, bij voorkeur op geleide van spiegelbepaling en antistofbepaling.
Overweeg bij aanvang van anti-TNF therapie vanuit kostenaspect het voorschrijven van een biosimilar.
Hanteer de volgende voorwaarden bij het (vanuit kostenaspect) overstappen naar een biosimilar:
- geinformeerde toestemming van patiënt en ouders
- klinische remissie
- therapeutische (dal)spiegel zonder antistofvorming tegen anti-TNFα.
Overweeg behandeling met off-label vedolizumab indien er sprake is van falen van anti-TNFα therapie.
Overleg met en verwijs naar een academisch centrum met expertise op gebied van kinderen met IBD, indien vedolizumab behandeling wordt overwogen.
Meld de patient die gaat starten met vedolizumab aan bij de kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK), zodat er een prospectief register kan worden bijgehouden van dit off-label medicament.
Deelvraag 2 Wat zijn de gunstige en ongunstige effecten van combinatietherapie ten opzichte van monotherapie met biologicals bij de behandeling van kinderen <18 jaar met colitis ulcerosa?
Start anti-TNFα bij voorkeur in combinatie met een immuunmodulator.
Continueer de bestaande behandeling met een immuunmodulator wanneer anti-TNFα therapie wordt gestart. Streef vanaf 6 maanden na het starten van combinatietherapie naar het staken van de immuunmodulator, wanneer er sprake is van klinische remissie.
Deelvraag 3 Wat is de rol van het monitoren van biological plasma dalspiegels en antistoffen tegen biologicals bij kinderen met IBD?
Meet anti-TNFα dalspiegels en antistoffen na remissie inductie (dat wil zeggen 14 weken na het starten van infliximab en 8 tot 10 weken na het starten van adalimumab) voor het optimaliseren van de behandeling.
Meet anti-TNFα dalspiegels en antistoffen ook bij onvoldoende respons of verlies van respons om dosisverhoging en/of intervalverkorting of de overstap naar een ander anti-TNFα middel te begeleiden.
Meet anti-TNFα dalspiegels en antistoffen ook voordat wordt besloten tot stoppen van combinatie therapie met immunomodulatoren, aangezien dalspiegels <5 µg/ml geassocieerd zijn met verlies van respons.
Overwegingen
Deelvraag 1 Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met colitis ulcerosa vergeleken met conventionele behandelstrategieën?
Indicatie, effectiviteit & dosering
In 2018 werd de consensus richtlijn gepubliceerd door ECCO en de pediatrische IBD Porto groep van ESPGHAN over de ambulante behandeling van CU bij kinderen (Turner 2018). Hierin worden de volgende aanbevelingen gedaan:
- Infliximab moet worden overwogen in chronisch actieve of steroïd-afhankelijke CU, die onvoldoende onder controle is met mesalazine en thiopurines, voor zowel inductie als behoud van remissie.
- Adalimumab of golimumab kan worden overwogen bij kinderen met CU die aanvankelijk reageerden op infliximab, maar waarbij vervolgens het effect afneemt of intolerantie optreedt, bv op basis van de TDM-resultaten.
- Adalimumab en golimumab hebben geen rol bij patiënten met primaire non-respons op infliximab.
- Vedolizumab moet worden overwogen in chronisch actieve of steroïd-afhankelijke patiënten als tweedelijns biological na falen van anti-TNF.
Met betrekking tot stopindicaties voor anti-TNF behandeling is er geen literatuur bij kinderen maar stelt de Nederlandse Handleiding voor volwassen met IBD 2015:
- Overwogen kan worden om anti-TNF therapie te stoppen indien er sprake is van klinische, biologische én endoscopische remissie gedurende tenminste één jaar waarbij voor iedere patiënt een weloverwogen individuele afweging genomen dient te worden.
De werkzaamheid van infliximab in kinderen en adolescenten (n=60) met matig-ernstige CU is onderzocht in een ongecontroleerde trial, waarbij 8 weken na een standaard remissie inductieprotocol (5mg/kg, op week 0, 2, 6) 73.3% klinisch respondeerde, 40% in klinische remissie was en 71.4% bij endoscopie mucosaal herstel (MH) liet zien (Mayo endoscopische subscore 0 of 1) (Hyams, 2012). De patiënten die klinisch respondeerden (n=44) ontvingen infliximab als onderhoudsmedicatie, elke 8 of 12 weken (5mg/kg, met mogelijkheid tot escalatie tot 10mg/kg). Na 54 weken behandeling waren er in de 8-week interval groep tweemaal zoveel patiënten in klinische remissie vergeleken met de 12-week interval groep (38% versus 18%; p=0.146). Een systematische review van cohort studies naar de effectiviteit van infliximab bij kinderen met CU toonde aan dat de gepoolde klinische effectiviteit (verschillende definities) op lange termijn 64% is (Turner and Griffiths, 2011). In een grote cohort studie van kinderen met CU (n=332) was corticosteroïd-vrije remissie onder infliximab na 12 en 24 maanden respectievelijk 38% en 21%. Daarnaast wordt er een verband gezien tussen het toegenomen gebruik van anti-TNF-middelen en een vermindering van het risico op chirurgische ingrepen (Larsen, 2016). Een Cochrane systematisch overzicht van 7 trials in volwassen met CU concludeerde dat infliximab effectief is in het induceren van klinische remissie, het bevorderen van mucosaal herstel (mucosal healing, MH), en het verminderen van de noodzaak tot colectomie vergeleken met placebo (Lawson, Thomas, en Akobeng, 2006).
De werkzaamheid van adalimumab in kinderen met CU is onderzocht in een kleine retrospectieve cohortstudie (n=11) (Volonaki, 2015). Alle patiënten waren eerder reeds behandeld met infliximab. Zes (55%) bereikten klinische remissie, met een mediane duur van de behandeling van 25 maanden. Er zijn geen gepubliceerde gegevens over adalimumab in kinderen met CU naïef voor anti-TNF. De effectiviteit van adalimumab subcutane behandeling als inductie en onderhoudstherapie is aangetoond in volwassenen met matige-ernstige CU. In de ULTRA-1 studie kregen volwassen patiënten adalimumab als remissie inductie therapie (160 mg in week 0, 80 mg in week 2, 40 mg in week 4 en 6) of (80 mg in week 0, 40 mg in week 2, 4 en 6), waarin na 8 weken respectievelijk 18.5% en 10.0% van de patiënten in klinische remissie waren versus 9.2% in de placebo groep (Reinisch, 2011; Sandborn, 2012). Dit correspondeert met ULTRA-2 trial waarin patiënten na 8 en 52 weken respectievelijk 17.3% en 17.5% in klinisch remissie waren (160 mg in week 0, 80 mg in week 2, 40 mg in week 4 en 6) (Sandborn, 2012). De conclusie uit een meta-analyse van RCT's bij volwassen met matige tot ernstige CU, is dat adalimumab effectiever is dan placebo in het induceren van musocal healing op korte (8 weken) en lange termijn (52 weken) (Cholapranee, 2017). Adalimumab is een off-label behandeling bij kinderen met CU, maar is wel als add-on geneesmiddel voor deze indicatie geregistreerd, en wordt dus vergoed. In de recente Europese richtlijn (Turner 2018) wordt adalimumab geadviseerd als tweede anti-TNF middel, bij verlies van effect van infliximab (bij lage infliximab spiegels met antistofvorming tegen infliximab). Aangezien adalimumab minder snel werkt dan infliximab, verdient infliximab ook bij ernstige ziekte activiteit (en onvoldoende response op prednison intraveneus) de voorkeur.
Naast adalimumab is golimumab een tweede subcutaan toegediende, volledig humaan anti-TNF. Golimumab werd bestudeerd in kinderen met matig-ernstige CU in open-label farmacokinetische studie (n=35) (Hyams 2017). De gegeven dosis was 90mg/m2 op week 0 en 2, vervolgens 45mg/m2 elke 4 weken voor kinderen <45kg en 200mg/m2 op week 0 en 2, vervolgens 100mg/m2 elke 4 weken voor kinderen >45kg. Klinische respons en remissie na 6 weken was respectievelijk 60% en 43%, waarbij 54% MH liet zien. De farmacokinetische data lieten zien dat kinderen <45kg lagere golimumab plasmaconcentraties hadden. De equivalente dosering van 200mg bij volwassenen en adolescenten werd berekend op 115mg/m2 op week 0 en 2, gevolgd door 60mg/m2 voor onderhoud. Placebogecontroleerde studies in anti-TNF naïeve volwassenen met matig-ernstige actieve CU laten zien dat de percentages van klinische respons (51.0% versus 30.3%), remissie (17.8% versus 6.4%) en mucosal healing (42.3% versus 28.7%) significant groter is in de golimumab groep versus placebo (Sandborn, 2014). Na 54 weken waren de percentages van klinische respons (49.7% versus 31.2%) en MH (42.4% versus 26.6%) in de golimumab groep ook significant groter vergeleken met placebo (Sandborn, 2014).
Over het algemeen kan de respons op anti-TNF-geneesmiddelen al na 1 tot 4 weken aanwezig zijn maar kan er nog steeds respons optreden na 12 tot 16 weken behandeling (Reinisch, 2011; Sandborn, 2012; Rutgeerts, 2005).
Vedolizumab is een gehumaniseerde anti-α4β7 integrine dat intestinale inflammatie verminderd door migratie van specifiek intestinale T-lymfocyten te remmen. De ervaring met intraveneuze vedolizumab behandeling bij kinderen met CU is momenteel beperkt tot kleine retrospectieve cohorten, met patiënten die eerder faalden op anti-TNF (Ledder, 2017; Conrad, 2016; Singh, 2016). Het percentage van patiënten in remissie na 14 weken in de drie studies was 37% (n=41; Ledder, 2017), 40% (n=5; Conrad, 2016), en 76% (n=22; Singh, 2016). Na 22 weken was respectievelijk 34%, 40% en 71% van de patiënten nog steeds in remissie. In de GEMINI-1 trial werden volwassenen behandeld met vedolizumab als remissie inductie therapie (300mg in week 0 en 2), waarbij 47% versus 25.5% in de placebo groep klinisch respondeerden (Feagan, 2013). Na 6 weken werden de diegenen die respondeerden opnieuw gerandomiseerd naar vedolizumab 300 mg intraveneus elke 4 of 8 weken of placebo. De remissie percentages op week 52 waren 42% (8 weken) en 45% (4 weken) (Feagan, 2013), ongeacht de eerdere status van anti-TNF-blootstelling (Feagan, 2017).
Vedolizumab wordt in momenteel in Nederland in uitzonderingsgevallen gegeven aan kinderen met colitis ulcerosa (en de ziekte van Crohn), wanneer er sprake is van chronisch actieve ziekte met steroïd-afhankelijkheid ondanks anti-TNFα therapie. Gezien de geringe ervaring met vedolizumab, wordt dit middel tot op heden alleen off-label toegediend in specifieke centra die meerdere patiënten (jonger dan 18 jaar) met vedolizumab behandelen.
In een netwerk meta-analyse waren infliximab, adalimumab, golimumab en vedolizumab alle superieur aan placebo voor inductie en behoud van klinische remissie en MH (Danese, 2014). Wanneer deze biologicals onderling werden vergeleken lijkt infliximab na 8 weken effectiever in de inductie van remissie en MH dan adalimumab, maar na 52 weken behandeling was er geen significant verschil in effectiviteit (Danese, 2014). Dit werd bevestigd in andere meta-analyses (Cholapranee, 2017; Thorlund, 2014). Geen enkele andere indirecte vergelijking in effectiviteit tussen biologicals was statistisch significant.
Veiligheid en bijwerkingen
De veiligheidskwesties van anti-TNF omvatten ernstige en opportunistische infecties, acute infusiereacties (binnen 4 uur na infusie), vertraagde overgevoeligheidsreacties (tussen 4 uur en 14 dagen na infusie) en een potentieel risico op maligniteiten en ontwikkeling van anti-TNF gerelateerde psoriasis.
Vereiste infectieuze screening voorafgaand aan de start van anti-TNF behandeling omvat hepatitis B & C-virus, HIV, varicella zoster virus en tuberculose (Andersen en Jess, 2014). Het testen op latente tuberculose kan middels een X-thorax, Mantoux-test en/of Quantiferon-test. Het risico op reactivering van andere virussen (bijvoorbeeld cytomegalovirus en Epstein-Barr virus) is niet duidelijk. Drie procent van de kinderen behandeld met anti-IFX ontwikkelt een ernstige infectie, gebaseerd op een gepoolde analyse (onder andere sepsis, meningitis, longontsteking, infecties met herpes zoster of varicella, EBV-geassocieerde hemofagocytaire lymfohistiocytose en opportunistische schimmelinfecties) (Ruemmele, 2014). Een systematische literatuursearch naar ernstige infecties (als zodanig gecategoriseerd door originele onderzoeker/ geleid tot stopzetting therapie, ziekenhuisopname of overlijden) rapporteerde dat kinderen die anti-TNF therapie gebruiken significant minder kans hebben op ernstige infecties vergeleken met corticosteroïd gebruikers (SIR 0.48; 95% CI: 0.40 tot 0.58) (Dulai, 2014). Een meta-analyse naar infectierisico bij biologicals (anti-TNF, natalizumab en vedolizumab) gebruik onder meer dan 14.000 volwassenen concludeerde dat biologicals een mild tot matig verhoogd risico geven op infecties (OR 1.19 (95%CI 1.1 tot 1.29)) en een aanzienlijk verhoogd risico op opportunistische infecties (OR 1.90 (1.21 tot 3.01)) (Bonovas. 2016).
Een pediatrische cohortstudie rapporteerde infusiereacties in 60 van de 1652 (3.6%) anti-TNF infusies (Jacobstein, 2005). De meest voorkomende symptomen van een acute infusiereactie zijn kortademigheid, plotseling roodheid van het gezicht en de hals, misselijkheid, buikpijn hoofdpijn, koorts/rillingen en tachycardie. In slechts 2 van de 1652 gevallen was er sprake van anafylactische symptomen. Gegevens bij volwassen IBD patiënten zijn vergelijkbaar, waarbij de kans op infusie reactie per infusie 3% is, waarvan slechts 0.047% ernstig (Lichtenstein, 2012). Er is geen evident bewijs dat premedicatie de ontwikkeling van acute infusiereactie in kinderen behandeld met anti-TNF kan voorkomen (Jacobstein, 2005).
Naast het risico op infecties is er ook literatuur over een potentieel risico op maligniteiten. De DEVELOP-studie is een veiligheidsregister waarin zowel kinderen die anti-TNF ontvingen als anti-TNF naïeve kinderen werden geïncludeerd (n=5691; 23.637 patiëntenjaren aan follow-up; mediaan 4,5 jaar follow-up per patiënt). Anti-TNF (of biological gebruik in het algemeen) was niet gerelateerd aan een verhoogde incidentie van hemofagocytische lymfohistiocytose of maligniteiten in het algemeen (maligniteiten/1000 patiënten jaren (95%CI): antiTNF: 0,46 (0,15 tot 1,08) versus biologicals 0,64 (0,31 tot 1,18) versus geen-biologicals 0,56 (0,18 tot 1,31)) (Hyams, 2017).
Gegevens over de veiligheid van vedolizumab in kinderen zijn beperkt. Infecties van de bovenste luchtwegen, misselijkheid, vermoeidheid, hoofdpijn, nasofaryngitis, huidinfecties en sinusitis zijn beschreven (Conrad, 2016). Daarnaast zijn eenmalige gevallen van pruritus, infusiereactie en nasofaryngitis gerapporteerd (Ledder, 2017).
In kinderen met CU die colectomie (n=55) ondergaan wordt geen verschil gezien in postoperatieve complicaties, zowel van infectieuze aard als niet niet-infectieuze aard, tussen anti-TNF en niet-anti-TNF behandelde patiënten (Schaufler, 2012).
Biosimilars
Biosimilars zijn generieke versies van een biological, gemaakt door een andere farmaceut nadat het patent van het oorspronkelijke merk-biological verlopen is. In 2015 gaf de European Medicine Agency (EMA) goedkeuring voor het gebruik van infliximab biosimilars en in 2017 voor het gebruik van adalimumab biosimilars bij kinderen met IBD op basis van het extrapolatieprincipe. Momenteel beschikbare infliximab biosimilars zijn Remsima®, Inflectra® en Flixabi®, en de beschikbare adalimumab biosimilars zijn Cyltezo® en Imraldi®.
Een beschrijving van wetenschappelijke data betreffende biosimilars in kinderen met IBD vindt u terug onder deelvraag 1. Samenvattend ontbreken studies in kinderen en adolescenten met IBD die biosimilars direct vergelijken met het oorspronkelijke merk-biological. Echter laten de studies die de effecten van biosimilars bij kinderen met IBD onderzochten zien dat de effecten van deze middelen vergelijkbaar zijn met het oorspronkelijke merk-biological. De EMA stelt omdat Remsima®, Inflectra® en Flixabi® (infliximab) en Cyltezo® en Imraldi® (adalimumab) biosimilar geneesmiddelen zijn, onderzoeken naar de werkzaamheid en veiligheid niet dienen te worden herhaald.
Deelvraag 2 Wat zijn de gunstige en ongunstige effecten van combinatietherapie ten opzichte van monotherapie met biologicals bij de behandeling van kinderen <18 jaar met colitis ulcerosa?
Indicatie, effectiviteit & dosering
Combinatietherapie van infliximab en azathioprine bleek superieur in de SUCCESS-trial in volwassen UC vergeleken met infliximab monotherapie (Panaccione, 2014). Corticosteroïd-vrije remissie in week 16 werd bereikt bij 39.7% in de combinatietherapie groep en bij 22.1% in de monotherapie groep (p=0.017). Mucosal healing (Mayo-score 0 of 1) verschilde niet tussen beide groepen (combi 62.8% versus 54.6%, p=0.295), maar meer patiënten in de combinatietherapie groep hadden een Mayo score van 0 (combi 29.5% versus 11.7%, p=0.006). The COMMIT-trial randomiseerde patiënten naar infliximab met methotrexaat of infliximab monotherapie, waarbij er geen verschil werd gezien corticosteroïd-vrije remissie na 14 weken (Feagan, 2014). Het gebrek aan verschil in effectiviteit werd mogelijk veroorzaakt door de lage ziekte activiteit van vele patiënten bij inclusie.
Er wordt gedacht dat het mogelijk verschil in effectiviteit van mono versus combinatie therapie ten grondslag ligt aan het voorkomen van antistofvorming tegen anti-TNFα. Studies in kinderen met IBD geven echter geen eenduidige resultaten met betrekking tot antistofvorming en combinatie therapie (Miele, 2004; Merras-Salmio en Kolho, 2017; Zitomersky, 2015). In de SUCCES-trial bleken patiënten op infliximab en azathioprine combinatie therapie minder vaak antistofvorming te hebben vergeleken met infliximab monotherapie (3% versus 19) (Panaccione, 2014). Gelijksoortige resultaten werden geobserveerd in de grote cohortstudie in volwassenen met IBD (Baert, 2003; Vermeire, 2007). Daarnaast liet de COMMIT-trial zien dat patiënten behandeld met infliximab combinatietherapie met methotrexaat minder vaak antistofvorming hebben vergeleken met monotherapie (4% versus 20%, p= 0.01) (Feagan, 2014).
Alhoewel er geen RCT’s zijn uitgevoerd naar adalimumab combinatie- versus monotherapie, rapporteren systematische reviews van cohortstudies dat combinatietherapie geassocieerd is met meer frequente klinische respons (Kopylov, 2014), maar niet met minder frequent voorkomen van antistoffen (Paul, 2014). Er is momenteel geen bewijs dat combinatietherapie van vedolizumab met immunomodulatoren superieur is ten opzichte van vedolizumab monotherapie (Ledder, 2017; Shelton, 2015).
Duur van combinatietherapie
Van Assche, 2008 includeerde 80 volwassenen met de ZvC op infliximab combinatie therapie met thiopurines voor tenminste 6 maanden waarna er randomisatie volgende naar combinatietherapie of IFX en placebo. Deze studie rapporteerde dat na 104 weken was er geen verschil was in de noodzaak tot infliximab intervalverkorting of infliximab discontinuatie tussen combinatie- en monotherapie, alhoewel de combinatietherapie groep significant hogere infliximab dal spiegels vertoonden.
Veiligheid en bijwerkingen
De hierboven besproken SUCCES rapporteerde geen verschil in bijwerkingen tussen infliximab combinatie- en monotherapie, noch bijwerkingen die resulteerden in therapiebeëindiging (Panaccione, 2014). Daarnaast wordt er in systematische reviews geen associatie gerapporteerd tussen anti-TNFα combinatietherapie en het voorkomen van ernstige infecties (Jones, 2015; Osterman, 2015).
Een belangrijk punt bij de overweging combinatie therapie te starten (of staken) is het risico op maligniteiten. De DEVELOP-studie toont dat een biological in combinatie met een thiopurine een hogere incidentie van zowel hemofagocytische lymfohistiocytose (HLH) als maligniteiten in het algemeen geeft vergeleken met biological monotherapie (aantal/1000 patiënten jaren (95%CI): HLH: combi 0.29 (0.09 tot 0.68) versus mono 0.00 (0.00 tot 0.41), maligniteiten: combi 0.75 (0.40 tot 1.29) versus mono 0.27 (0.03 tot 0.99)) (Hyams, 2017). Stratificatie op basis van methotrexaat blootstelling toonde geen verhoogde incidentie van HLH of maligniteiten in het methotrexaat-blootgestelde cohort versus het niet-methotrexaat-blootgestelde cohort.
Combinatie van mesalazine en biologicals
Mesalazine preparaten (oraal of topicaal) worden veelal gebruikt als onderdeel van de eerste stap in de behandelin van CU. Mesalazine preparaten kennen over het algemeen een gunstig bijwerkingenprofiel (Turner, 2018). Studies die het effect van Mesalazine preparaten in combinatie met biologicals evalueren ontbreken echter tot op heden. Hierdoor is het geven van eenaanbeveling over deze combinatie niet mogelijk.
Samenvattend
Het beperkte vergelijkende onderzoek tussen combinatietherapie van een biological met immunomodulator versus biological monotherapie bij kinderen met UC en de klinische trials bij volwassenen beperkt zich vooral tot infliximab gebruik in combinatie met thiopurines. Hierbij lijkt de combinatie van infliximab en thiopurines effectiever in het induceren van klinische respons, remissie en MH op korte termijn en behoud van klinische remissie en voorkomen van colectomie op lange termijn. Daarnaast verkleint combinatie therapie met een thiopurine of methotrexaat de kans op antistofvorming tegen zowel infliximab als adalimumab.
Deelvraag 3 Wat is de rol van het monitoren van biological plasma dalspiegels en antistoffen tegen biologicals bij kinderen met IBD?
Onlangs werden de eerste prospectieve trials die TDM van anti-TNF onderzochten afgerond. Deze studies vergeleken de effectiviteit van op dalspiegel concentratie doseren vergeleken met dosering op geleide van symptomen. De TAXIT-trial includeerde volwassenen met de ZvC of CU met een stabiele respons op infliximab, waarbij als eerste door middel van een algoritme de dosis werd aangepast om een dalspiegel tussen de 3 en 7 µg/ml te bereiken (vande Casteele, 2015). Dit resulteerde in een hoger percentage patiënten met de ZvC in remissie dan vóór dosisescalatie (88% versus 65%; p=0.020), terwijl er niet meer opvlamming was in de patiënten waarbij de dosis werd verlaagd. Vervolgens werden patiënten gerandomiseerd naar een groep die infliximab-dosering ontving op basis van dalspiegel en symptomen of alleen op basis van symptomen. Na een jaar was er echter geen verschil in het aantal patiënten in klinische remissie of biochemische remissie (CRP <5mg/L) tussen beide groepen. In tegenstelling tot de TAXIT-trial includeerde Paul (2013) juist patiënten die een verlies van respons op infliximab lieten zien (symptomen en biochemische of endoscopische activiteit) waarbij de dosis werd verhoogd naar 10 mg/kg in plaats van 5mg/kg (Paul, 2013). Het verhogen van de infliximab dosis leidde tot hogere dalspiegels, wat geassocieerd was met MH. De TAILORIX-studie randomiseerde anti-TNF naïeve volwassenen met de ZvC na inductie therapie met infliximab, naar dosis escalatie op basis van symptomen, ontstekingswaarden en dalspiegels of dosering op slechts symptomen (D’Haens, 2016). Er was geen verschil was in het percentage endoscopische remissie tussen de groepen.
Relatie tussen dalspiegels en antistoffen
Er bestaat een sterke relatie tussen lage anti-TNF dalspiegels en de aanwezigheid van antistoffen bij kinderen en volwassenen met de ZvC en CU (Sharma, 2015; Adedokun, 2013; Mazor, 2014)
Relatie tussen dalspiegels of antistoffen en effectiviteit
Klinische respons
Studies bij kinderen met IBD tonen aan dat er sterke relatie bestaat tussen lage dalspiegels en/of hoge antistoffen en matige klinische effectiviteit en hoge ontstekingswaarden (CRP en fecaal calprotectine) (Merras-Salmio en Kolho, 2017; Sharma, 2015; Adedokun, 2013; Hämäläinen; Sipponen; en Kolho, 2013). Studies naar TDM van anti-TNFα in volwassenen met de ZvC en CU beschrijven over het algemeen grotere cohorten en berekenden hiermee afkapwaarden voor dal spiegels voorspellend voor respons. Infliximab dalspiegels van >3.5-3.7 µg/ml na remissie inductie (tijdens onderhoudsbehandeling) zijn het beste voorspellend voor een aanhoudende klinische respons (gebaseerd op klinische activiteit indexen: CDAI (ZvC), Mayo-score (CU) (Adedokun, 2014; Cornillie, 2014). Voor TDM van adalimumab geldt dat in volwassenen met ZvC en CU een dalspiegel van >4.85-5.85 µg/ml ten tijde van onderhoudsbehandeling geassocieerd is met klinische remissie (Roblin, 2014; Mazor, 2014). De reden dat de afkapwaarden van adalimumab dalspiegels hoger zijn dan die van infliximab kan gerelateerd zijn aan het gebruikt van de striktere uitkomstmaat klinische remissie, in plaats van klinische respons (Adedokun, 2014; Cornillie, 2014; Roblin, 2014; Mazor, 2014).
Een retrospectieve studie onderzocht de associatie tussen anti-TNFα dalspiegels en het effect van medicatie aanpassingen in kinderen en volwassen met een verlies aan respons (klinisch in combinatie met een daadwerkelijk toename van inflammatie) (Yanai, 2015). Uit deze studie bleek dat intensiveren van de anti-TNF behandeling of switchen naar een ander anti-TNF middel niet zinvol is bij patientendie ondanks een therapeutische dalspiegel de respons op anti-TNFα verloren. Ook is dosisintensivering niet eefectief wanneer er een hoge (anti-anti-TNF) antistoftiter is gevonden.
Endoscopie
Een infliximab dalspiegel van >4 µg/ml was de best voorspellende afkapwaarde voor MH healing in 45 patiënten met de ZvC (Imaeda, 2014). Een infliximab dal spiegel van ≥2.1 μg/mL op week 14 was een onafhankelijke voorspeller voor MH (Papamichael, 2016). De afkapwaarden van adalimumab dalspiegels zijn naar verluid hoger. Studies in volwassenen met zowel de ZvC als CU tonen aan dat adalimumab dalspiegels ≥7.5 tot 8.14 μg/ml voorspellend zijn voor MH (Zittan, 2016; Papamichael, 2017).
Factoren geassocieerd met lagere anti-TNFα dalspiegels
Factoren die lagere anti-TNFα dalspiegels voorspellen (en dus mogelijk hogere doseringen dicteren) zijn onder meer een hogere lichaamsmassa-index (Sharma, 2015; Klaasen, 2011) of een laag lichaamsgewicht <30 kg (Dotan, 2014). Lagere infliximab dalspiegels zijn geassocieerd met het mannelijk geslacht in het kader van de aanmaak van antistoffen (Ternant, 2008; Fasanmade, 2009). Daarnaast is een hoge ontstekingsbelasting, uitgedrukt als hoge ontstekingswaarden of meer aangedane darm gerelateerd aan lagere anti-TNFα dal spiegels (Hämäläinen; Sipponen; Kolho, 2013; Sharma, 2015; Ordás, 2012). Lage infliximab dalspiegels zijn ook geassocieerd met hypoalbuminemie (Sharma, 2015; Fasanmade, 2010) en de afwezigheid van een gelijktijdige immunomodulator (Ungar, 2016; Gecse; Végh; Lakatos, 2016; Panaccione, 2014). Een infliximab dalspiegel <5 µg/ml is voorspellend voor het verlies van respons na stoppen van combinatietherapie met een immunomodulator, in volwassenen met de ZvC (Mazor, 2014).
Naast bovenstaande factoren is ook het type IBD, ZvC versus CU, van invloed op dalspiegels en antistofvorming. Het percentage CU patiënten met niet-meetbare infliximab dalspiegels blijkt hoger (Ternant, 2008) dan in een voorgaande studie uitgevoerd door dezelfde onderzoekers bij patiënten met de ZvC (Maser, 2006). Een mogelijke verklaring van deze bevindingen is dat patiënten met CU een snellere klaring van infliximab hebben dan patiënten met CD, door hoger verbruik vanwege een groter ontstoken darmoppervlak en/of verlies via het darmoppervlak. Brandse (2015) rapporteerde een hoog verlies van infliximab in de ontlasting van volwassenen met matig-ernstige UC tijdens remissie inductietherapie, wat geassocieerd was met primaire non-respons (Brandse, 2015).
Onderbouwing
Achtergrond
Biologicals worden in de dagelijkse praktijk gebruikt als inductie- en onderhoudstherapie bij kinderen met colitis ulcerosa (CU). Ze worden met name gestart wanneer CU therapieresistent is voor conventionele therapieën, bestaande uit corticosteroïden als inductietherapie en aminosalicylaten (mesalazine) of immunomodulatoren (azathioprine, mercaptopurine) als onderhoudstherapie. De eerste op de markt gebrachte biologicals voor IBD blokkeren het cytokine Tumor Necrosis Factor alpha (TNFa). In Nederland is infliximab (Remicade®) geregistreerd als anti-TNFα therapie voor kinderen en adolescenten met ZvC en colitis ulcerosa en is adalimumab (Humira®) alleen geregistreerd voor kinderen met ZvC (https://www.ema.europa.eu/en). Voor kinderen met colitis ulcerosa wordt adalimumab wel als off-label medicatie vergoed. Recentelijk zijn biosimilars van zowel infliximab als adalimumab goedgekeurd als therapie voor kinderen met IBD. Bij falende anti-TNF behandeling worden kinderen (< 18 jaar) momenteel off-label en in onderzoeksverband behandeld met vedolizumab (Entyvio®), een medicijn dat bindt aan het darm specifieke eiwit α4β7-integrine waardoor de passage van leukocyten van de bloedbaan naar de darm voorkomen wordt.
De huidige nationale richtlijnen voor de behandeling van kinderen met CU omvatten nog geen duidelijke handvatten over de plaats en effectiviteit van biologicals. Het is daarom van belang in kaart te brengen wanneer behandeling met biologicals geïndiceerd is en wat er in de literatuur bekend is over de effectiviteit maar ook wat de mogelijke bijwerkingen en complicaties kunnen zijn. Daarnaast is de manier van toedienen van een biological relevant; met name of dit in de vorm van monotherapie moet plaatsvinden of juist als combinatietherapie (een biological gecombineerd met een immunomodulator). Tevens is het van belang in kaart te brengen wat de plaats en effectiviteit is van Therapeutic Drug Monitoring (TDM). Een laatste vraag betreft de stopcriteria van de biologicals. Hier ontbreken studies bij kinderen, waardoor dit onderwerp niet verder in deze richtlijn wordt besproken.
Conclusies / Summary of Findings
Deelvraag 1 Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met colitis ulcerosa vergeleken met conventionele behandelstrategieën?
|
Zeer laag GRADE |
Er is een zeer laag niveau van bewijskracht dat top-down-behandeling met anti-TNF effectief is in het terugdringen van corticosteroïd gebruik vergeleken met step-up-behandeling.
Bronnen (Lee, 2016) |
Deelvraag 2 Wat zijn de gunstige en ongunstige effecten van combinatietherapie ten opzichte van monotherapie met biologicals bij de behandeling van kinderen <18 jaar met colitis ulcerosa?
|
Zeer laag GRADE |
Er is een zeer laag niveau van bewijskracht dat anti-TNFα combinatietherapie effectiever klinische respons of remissie induceert op korte of lange termijn dan anti-TNFα monotherapie.
Bronnen (McGinnis en Murray, 2008; Hyams, 2012) |
|
Zeer laag GRADE |
Er is een zeer laag niveau van bewijskracht dat anti-TNFα combinatietherapie effectiever mucosal healing (MH) induceert. dan anti-TNFα monotherapie.
Bronnen (Hyams, 2012) |
|
Zeer laag GRADE |
Er is een zeer laag niveau van bewijskracht dat anti-TNFα combinatietherapie effectiever is in het voorkomen van colectomie dan anti-TNFα monotherapie.
Bronnen (Hyams, 2010) |
Samenvatting literatuur
Deelvraag 1 Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met colitis ulcerosa vergeleken met conventionele behandelstrategieën?
Beschrijving studies
Er is in totaal één studie gevonden die een vergelijking maakt tussen behandeling met een biological (anti-TNF) en conservatieve therapie in kinderen met IBD (Lee, 2016). Deze studie vergelijkt top-down-therapie (start anti-TNF binnen 30 dagen na het eerste medicatie-recept voor IBD) versus step-up (start anti-TNF tenminste 30 dagen na het eerste medicatie-recept voor IBD). Het betreft een observationele retrospectieve cohortstudie waarin kinderen, adolescenten en jong-volwassenen tot 24 jaar werden geïncludeerd. Het observationele karakter van deze studie beperkt de validiteit van de resultaten, daar de verschillen in de uitgangswaarden tussen verschillende patiëntengroepen niet is te controleren.
Resultaten
Effect op medicatiegebruik
De studie van Lee (2016) includeerde 1298 patiënten in top-down-groep en 2002 patiënten in de step-up-groep. Patiënten die top-down-behandeling ontvingen gebruikten minder vaak corticosteroïden (32.5% versus 94.2%, p-waarde=0.0001), 5-aminosalicylaten (17.3% versus 75.1%, p-waarde=0.0001), methotrexaat (7.2% versus 14.6%, p-waarde=0.0001), of thiopurines (13.5% versus 54.7%, p-waarde=0.0001) vergeleken met step-up-patiënten. Er bestond geen verschil in het switchen tussen verschillende anti-TNF’s in patiënten behandeld volgens de top-down of step-up strategie (5.7% versus 7.4%, p-waarde=0.0581).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat effect op medicatiegebruik is met 2 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias) en extrapoleerbaarheid (bias ten gevolge van indirectheid).
Deelvraag 2 Wat zijn de gunstige en ongunstige effecten van combinatietherapie ten opzichte van monotherapie met biologicals bij de behandeling van kinderen <18 jaar met colitis ulcerosa?
Beschrijving studies
Er zijn in totaal 3 studies gevonden die een vergelijking maken tussen behandeling met een monotherapie met anti-TNFα (allen infliximab) en combinatie therapie van anti-TNFα met immunomodulatoren (thiopurines, methotrexaat) bij kinderen met CU. Het betreft een retrospectieve (McGinnis en Murray, 2008) en een prospectieve cohortstudie (Hyams, 2010) en een niet-gerandomiseerd prospectief cohort van een trial (Hyams, 2012). Het observationele karakter van deze studies beperkt de validiteit van de resultaten, daar de verschillen in de uitgangswaarden tussen verschillende patiëntengroepen niet is te controleren. De definitie van combinatietherapie verschilt tussen de studies. McGinnis (2008) definieert niet wanneer tijdens de follow-up combinatietherapie moet hebben plaats gevonden. Hyams (2010) evalueert of er op moment van het nemen van de uitkomstmaat er combinatietherapie is, terwijl Hyams (2012) combinatie therapie definieert als het gebruik van een immunomodulator direct bij de start van anti-TNF. Naast verschillende definities van combinatietherapie gebruiken de studies ook verschillende uitkomstmaten, zijnde colectomie (Hyams, 2010), klinische respons/remissie (op basis van Truelove and Witts index (McGinnis en Murray, 2008) of Mayo-index (Hyams, 2012) en mucosal healing (Hyams, 2012).
Resultaten
Klinische respons en remissie
Klinische respons werd door McGinnis (2008) vastgesteld na de eerste of de tweede infilximab infusie (bij sommige patiënten met een ernstiger ziekte activiteit). Klinische respons werd gedefinieerd als een her-classificatie van de Truelove and Witts index naar de ‘mild’ categorie of hoger. In totaal werden er 39 patiënten geïncludeerd, waarvan er 20 patiënten infliximab combinatietherapie ontvingen met azathioprine of 6-mercaptopurine en 19 patiënten infliximab monotherapie. Er werd geen verschil gezien in het percentage klinische respons tussen combinatietherapie (75%) en monotherapie (63%).
Klinische respons werd door Hyams (2012) werd vastgesteld 8 weken na de start met infliximab inductie therapie. Klinische respons werd definieert als een daling van de Mayo-score met 30% en 3 punten, met een daling van de rectale bloedverlies sub-score van 1 of een rectale bloedverlies sub-score van 0 of 1. In totaal werden er 60 patiënten geïncludeerd, waarvan er 28 patiënten infliximab combinatietherapie ontvingen met azathioprine, 6-mercaptopurine of methotrexaat en 32 patiënten infliximab monotherapie. Er werd geen verschil gezien in het percentage klinische respons tussen combinatietherapie (72%) en monotherapie (75%). Naast klinische respons als primaire uitkomstmaat rapporteerde deze studie ook klinische remissie (Mayo-score ≤2 met geen van de subscore >1) na 8 weken en na 54 maanden in patiënten die respondeerden op de inductietherapie en vervolgens infliximab onderhoudsbehandeling ontvingen. Er werd geen verschil gezien in het percentage klinische remissie tussen combinatie- en monotherapie na 8 (41% versus 39%) en 54 weken (46% versus 30%).
Mucosal healing (MH)
De bovenstaande studie van Hyams (2012) evalueerde ook endoscopische respons en rapporteerde betreffende MH op 8 weken na de start met infliximab inductie therapie (Mayo-endoscopie sub-score van 0 of 1). Er werd geen verschil gezien in het percentage MH tussen combinatietherapie (66%) en monotherapie (72%).
Colectomie
Hyams (2010) includeerde 52 patiënten vanaf de start van infliximab, waarvan initieel 32 op combinatietherapie met azathioprine of 6-mercaptopurine. Elke 3 maanden gedurende de follow-up werd combinatietherapie en colectomie status geëvalueerd. Op zowel 3, 6, 12 en 24 maanden was het percentage van patiënten met een colectomie kleiner in de combinatietherapie groep (combi versus mono: 3 maanden 38 % versus 13%, 6 maanden 25% versus 36%, 12 maanden 26% versus 50%, 24 maanden 47% versus 78%).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat klinische respons en remissie is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat musocal healing is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat colectomie is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten (imprecisie).
Deelvraag 3 Wat is de rol van het monitoren van biological plasma dalspiegels en antistoffen tegen biologicals bij kinderen met IBD?
Beschrijving studies
Therapeutic drug monitoring (TDM) van biologicals bestaat uit het meten van plasma dalspiegels en antistoffen om de behandeling met biologicals te begeleiden. Er zijn geen studies in kinderen met IBD die de uitkomsten van een groep kinderen behandeld met biologicals op basis van TDM vergelijkt met behandeling niet op basis van TDM. Studies bij kinderen met IBD beperken zich tot de relatie tussen biological dalspiegels en antistoffen en klinische en mucosale uitkomsten. Deze studies worden beschreven in de overwegingen.
Zoeken en selecteren
Om de uitgangsvragen te kunnen beantwoorden is er een systematische literatuuranalyse verricht. In verband met mogelijk grote overlap in studies betreffende kinderen met de ziekte van Crohn (ZvC) en colitis ulcerosa (CU) werden beiden ziektebeelden meegenomen in één search. De systematische literatuur analyse werd verricht naar de volgende zoekvraag (deelvragen):
1) Wat is de effectiviteit van behandeling met biologicals bij kinderen <18 jaar met colitis ulcerosa vergeleken met conventionele behandelstrategieën?
P: kinderen met de Ziekte van Crohn of colitis ulcerosa <18 jaar;
I: biological;
C: huidige behandelstrategieën;
O: klinische verbetering, endoscopische verbetering, behouden van remissie, duur van remissie, aantal opvlammingen, bijwerkingen.
2) Wat zijn de gunstige en ongunstige effecten van combinatietherapie ten opzichte van monotherapie met biologicals bij de behandeling van kinderen <18 jaar met colitis ulcerosa?
P: kinderen met de Ziekte van Crohn of colitis ulcerosa <18 jaar;
I: combinatietherapie; een biological in combinatie met een immuunmodulator;
C: monotherapie; gebruik van alleen een biological zonder immuunmodulator;
O: klinische verbetering, endoscopische verbetering, behouden van remissie, duur van remissie, aantal opvlammingen, bijwerkingen.
3) Hoe dient monitoring van biologicals plaats te vinden bij behandeling van kinderen <18 jaar met de ziekte van Crohn en colitis ulcerosa?
P: kinderen met de Ziekte van Crohn of colitis ulcerosa <18 jaar;
I: monitoring;
C: geen monitoring;
O: vorming van antilichamen, verlies van respons, behouden van remissie, duur van remissie, complicaties, veiligheid, bijwerkingen.
Relevante uitkomstmaten
Betreffende uitgangsvragen 1 en 2 achtte de werkgroep behoud van remissie van ziekte en het optreden van ernstige complicaties voor de besluitvorming kritieke uitkomstmaten; en mucosaal herstel (mucosal healing, MH), endoscopische en klinische verbetering, duur van remissie en het aantal opvlammingen voor de besluitvorming belangrijke uitkomstmaten.
Betreffende uitgangsvraag 3 achtte de werkgroep vorming van antilichamen en verlies van respons als kritieke uitkomstmaten; en duur van remissie, complicaties, veiligheid en bijwerkingen voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
Er werden twee verschillende zoekacties verricht; de eerste ter beantwoording van deelvraag 1 en 2 (PICO 1 en 2) en de tweede ter beantwoording van deelvraag 3. Alle zoekacties werden verricht in de volgende databases; Medline (via OVID), Embase (via Embase.com), Cochrane Central, Web of Science and Google Scholar. De 1e en 2e zoekactie werden verricht op respectievelijk op 29 mei 2017 en 7 juli 2017. De zoekverantwoording van beide zoekacties is weergegeven onder het tabblad Verantwoording. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Studies werden geselecteerd op grond van de volgende selectiecriteria: het volledige artikel was beschikbaar, Engelstalig en geïncludeerde patiënten in de studie waren kinderen en/of adolescenten. De literatuurzoekactie voor deelvraag 1 en 2 leverde 4138 treffers op, waarbij er 3064 overbleven na verwijderen van de duplicaten. Op basis van titel en abstract werden in eerste instantie 265 studies voor uitgangsvraag 1 voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 264 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 1 studie definitief geselecteerd.
Flowchart uitgangsvraag 1
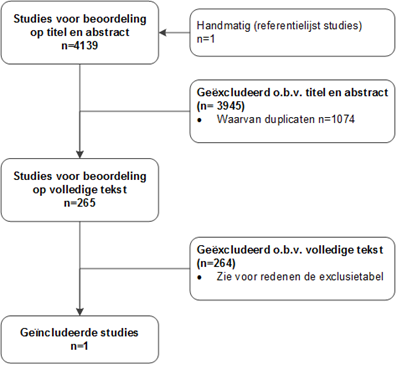
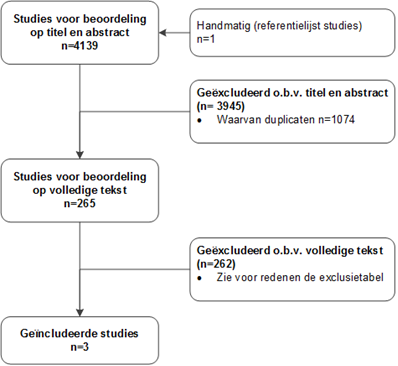
Betreffende uitgangsvraag 2 werden op basis van titel en abstract in eerste instantie 265 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 262 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 3 studies definitief geselecteerd.
Flowchart uitgangsvraag 2
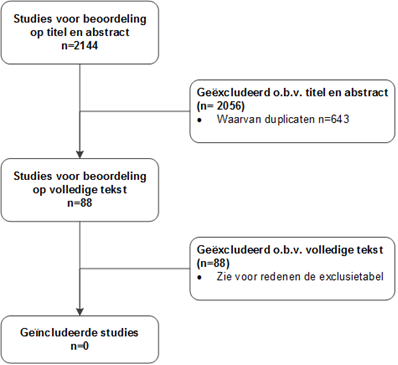
De literatuurzoekactie voor deelvraag 3 leverde 2144 treffers op, waarbij er 1501 overbleven na verwijderen van de duplicaten. Op basis van titel en abstract werden in eerste instantie 88 studies voor uitgangsvraag 3 voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens voor beantwoording van deelvraag 3 geen onderzoeken opgenomen in de literatuuranalyse.
Flowchart uitgangsvraag 3
Referenties
- Adedokun OJ, Omoniyi J, William J, et al. Association Between Serum Concentration of Infliximab and Efficacy in Adult Patients With Ulcerative Colitis. Gastroenterology. 2014;147(6):12961307.e5. doi:10.1053/j.gastro.2014.08.035.
- Adedokun OJ, Omoniyi J, Xu Z, et al. Pharmacokinetics of Infliximab in Children with Moderate-to-Severe Ulcerative Colitis. Inflammatory Bowel Diseases. 2013;19(13):275362. doi:10.1097/01.MIB.0000435438.84365.f7.
- Andersen V, Nyboe N, Jess T. Risk of Infections Associated with Biological Treatment in Inflammatory Bowel Disease. World Journal of Gastroenterology. 2014;20(43):16014. doi:10.3748/wjg.v20.i43.16014.
- Assche, van G., MagdelaineBeuzelin C., D'Haens, et al. Withdrawal of immunosuppression in Crohn's disease treated with scheduled infliximab maintenance: a randomized trial. Gastroenterology, 2008;134(7), 1861-1868.
- Baert F, Noman M, Vermeire S, et al. Influence of Immunogenicity on the Long-Term Efficacy of Infliximab in Crohns Disease. New England Journal of Medicine. 2003;348(7):6018. doi:10.1056/NEJMoa020888.
- Bonovas S, Fiorino G, Allocca M, et al. Biologic Therapies and Risk of Infection and Malignancy in Patients With Inflammatory Bowel Disease: A Systematic Review and Network Meta-Analysis. Clinical Gastroenterology and Hepatology. 2016;14(10):13851397.e10. doi:10.1016/j.cgh.2016.04.039.
- Brandse JF, van den Brink GR, Wildenberg ME, et al. 2015. Loss of Infliximab Into Feces Is Associated With Lack of Respons to Therapy in Patients With Severe Ulcerative Colitis. Gastroenterology. 2015;149(2):350355.e2. doi:10.1053/j.gastro.2015.04.016.
- vande Casteele, N, Ferrante M, van Assche G, et al. Trough Concentrations of Infliximab Guide Dosing for Patients With Inflammatory Bowel Disease. Gastroenterology. 2015;148(7):13201329.e3. doi:10.1053/j.gastro.2015.02.031.
- Cholapranee A, Hazlewood GS, Kaplan GG, et al. Systematic Review with Meta-Analysis: Comparative Efficacy of Biologics for Induction and Maintenance of Mucosal Healing in Crohns Disease and Ulcerative Colitis Controlled Trials. Alimentary Pharmacology & Therapeutics. 2017;45(10):12911302. doi:10.1111/apt.14030.
- Conrad MA, Stein RE, Maxwell EC, et al 2016. Vedolizumab Therapy in Severe Pediatric Inflammatory Bowel Disease. Inflammatory Bowel Diseases. 2016;22(10):242531. doi:10.1097/MIB.0000000000000918.
- Cornillie F, Hanauer SB, Diamond RH, et al. Postinduction Serum Infliximab Trough Level and Decrease of C-Reactive Protein Level Are Associated with Durable Sustained Respons to Infliximab: A Retrospective Analysis of the ACCENT I Trial. Gut. 2014;63(11):172127. doi:10.1136/gutjnl-2012-304094.
- DHaens GR, Vermeire S, Lambrecht G, et al. 692 Drug-Level Based Dosing Versus Symptom-Based Dose Adaptation in Patients With Crohns Disease: A Prospective, Randomized Multicenter Study (TAILORIX). Gastroenterology. 2016;150(4). Elsevier: S143. doi:10.1016/S0016-5085(16)30583-2.
- Danese S, Fiorino G, Peyrin-Biroulet L, et al. Biological Agents for Moderately to Severely Active Ulcerative Colitis. Annals of Internal Medicine. 2014;160(10):704. doi:10.7326/M13-2403.
- Dotan I, Ron Y, Yanai H, et al. 2014. Patient Factors That Increase Infliximab Clearance and Shorten Half-Life in Inflammatory Bowel Disease. Inflammatory Bowel Diseases. 2014;20(12):224759. doi:10.1097/MIB.0000000000000212.
- Dulai PS, Thompson KD, Blunt HB, et al. 2014. Risks of Serious Infection or Lymphoma with Anti-Tumor Necrosisfactor Therapy for Pediatric Inflammatory Bowel Disease: A Systematic Review. Clinical Gastroenterology and Hepatology. 2014;12(9):144351. doi:10.1016/j.cgh.2014.01.021.
- Fasanmade AA, Adedokun OJ, Olson A, et al. Serum Albumin Concentration: A Predictive Factor of Infliximab Pharmacokinetics and Clinical Respons in Patients with Ulcerative Colitis. International Journal of Clinical Pharmacology and Therapeutics. 2010;48 (5):297308.
- Fasanmade AA, Adedokun OJ, Ford J, et al. Population Pharmacokinetic Analysis of Infliximab in Patients with Ulcerative Colitis. European Journal of Clinical Pharmacology. 2009;65(12):121128. doi:10.1007/s00228-009-0718-4.
- Feagan BG, McDonald JWD, Panaccione R, et al. Methotrexate in Combination With Infliximab Is No More Effective Than Infliximab Alone in Patients With Crohns Disease. Gastroenterology. 2014;146(3):681688.e1. doi:10.1053/j.gastro.2013.11.024.
- Feagan BG., Rubin DT, Danese S, et al. Efficacy of Vedolizumab Induction and Maintenance Therapy in Patients With Ulcerative Colitis, Regardless of Prior Exposure to Tumor Necrosis Factor Antagonists. Clinical Gastroenterology and Hepatology. 2017;15(2):229239.e5. doi:10.1016/j.cgh.2016.08.044.
- Feagan BG, Rutgeerts P, Sands BE, et al. 2013. Vedolizumab as Induction and Maintenance Therapy for Ulcerative Colitis. New England Journal of Medicine. 2013;369(8):699710. doi:10.1056/NEJMoa1215734.
- Gecse KB, Végh Z, László Lakatos P. Optimizing Biological Therapy in Crohns Disease. Expert Review of Gastroenterology & Hepatology. 2016;10(1):3745. doi:10.1586/17474124.2016.1096198.
- Hämäläinen A, Sipponen T, Kolho KL. Serum Infliximab Concentrations in Pediatric Inflammatory Bowel Disease. Scandinavian Journal of Gastroenterology. 2013;48(1):3541. doi:10.3109/00365521.2012.741619.
- Hyams J, Damaraju L, Blank M, et al. Induction and Maintenance Therapy With Infliximab for Children With Moderate to Severe Ulcerative Colitis. Clinical Gastroenterology and Hepatology. 2012;10(4):391399.e1. doi:10.1016/j.cgh.2011.11.026.
- Hyams JS, Dubinsky MC, Baldassano RN, et al. Infliximab Is Not Associated With Increased Risk of Malignancy or Hemophagocytic Lymphohistiocytosis in Pediatric Patients With Inflammatory Bowel Disease. Gastroenterology. 2017;152(8). W.B. Saunders: 19011914.e3. doi:10.1053/j.gastro.2017.02.004.
- Hyams JS, Lerer T, Griffiths A, et al. 2010. Outcome Following Infliximab Therapy in Children With Ulcerative Colitis. The American Journal of Gastroenterology. 2010;105(6):143036. doi:10.1038/ajg.2009.759.
- Hyams JS, Chan D, Adedokun OJ, et al. Subcutaneous Golimumab in Pediatric Ulcerative Colitis: Pharmacokinetics and Clinical Benefit. Inflamm Bowel Dis. 2017 Dec;23(12):2227-2237.
- Imaeda H, Bamba S, Takahashi K, et al. Relationship between Serum Infliximab Trough Levels and Endoscopic Activities in Patients with Crohns Disease under Scheduled Maintenance Treatment. Journal of Gastroenterology. 2014;49(4):67482. doi:10.1007/s00535-013-0829-7.
- Jacobstein DA, Markowitz JE, Kirschner BS, et al. Premedication and Infusion Reactions with Infliximab: Results from a Pediatric Inflammatory Bowel Disease Consortium. Inflammatory Bowel Diseases. 2005;11(5):44246.
- Jones JL, Kaplan GG, Peyrin-Biroulet L, et al. Effects of Concomitant Immunomodulator Therapy on Efficacy and Safety of AntiTumor Necrosis Factor Therapy for Crohns Disease: A Meta-Analysis of Placebo-Controlled Trials. Clinical Gastroenterology and Hepatology. 2015;13(13):22332240.e2. doi:10.1016/j.cgh.2015.06.034.
- Klaasen R, Wijbrandts CA, Gerlag DM, et al. Body Mass Index and Clinical Respons to Infliximab in Rheumatoid Arthritis. Arthritis & Rheumatism. 2011;63(2):35964. doi:10.1002/art.30136.
- Kopylov U, Al-Taweel T, Yaghoobi M, et al. Adalimumab Monotherapy versus Combination Therapy with Immunomodulators in Patients with Crohns Disease: A Systematic Review and Meta-Analysis. Journal of Crohns and Colitis. 2014;8(12):163241. doi:10.1016/j.crohns.2014.07.003.
- Larsen MD, Qvist N, Nielsen N, et al. Use of Anti-TNFa Agents and Time to First-Time Surgery in Paediatric Patients with Ulcerative Colitis and Crohns Disease. Journal of Crohns & Colitis. 2016;10(6):65056. doi:10.1093/ecco-jcc/jjw017.
- Lawson MM, Thomas AG, Akobeng AK. Tumour Necrosis Factor Alpha Blocking Agents for Induction of Remission in Ulcerative Colitis. Cochrane Database of Systematic Reviews. 2006;no. 3(July): CD005112. doi:10.1002/14651858.CD005112.pub2.
- Ledder O, Assa A, Levine A, et al. Vedolizumab in Paediatric Inflammatory Bowel Disease: A Retrospective Multi-Centre Experience From the Paediatric IBD Porto Group of ESPGHAN. Journal of Crohns and Colitis. 2017;11(10):123037. doi:10.1093/ecco-jcc/jjx082.
- Lichtenstein GR, Feagan BG, Cohen RD, et al. Serious Infection and Mortality in Patients With Crohns Disease: More Than 5 Years of Follow-Up in the TREATTM Registry. The American Journal of Gastroenterology. 2012;107(9):140922. doi:10.1038/ajg.2012.218.
- Maser EA, Villela R, Silverberg MS, et al. Association of Trough Serum Infliximab to Clinical Outcome After Scheduled Maintenance Treatment for Crohns Disease. Clinical Gastroenterology and Hepatology. 2006;4(10):124854. doi:10.1016/j.cgh.2006.06.025.
- Mazor Y, Almog R, Kopylov U, et al. Adalimumab Drug and Antibody Levels as Predictors of Clinical and Laboratory Respons in Patients with Crohns Disease. Alimentary Pharmacology & Therapeutics. 2014;40(6):62028. doi:10.1111/apt.12869.
- McGinnis JK, Murray KF. Infliximab for Ulcerative Colitis in Children and Adolescents. Journal of Clinical Gastroenterology. 2008;42(8):87579. doi:10.1097/MCG.0b013e3181354417.
- Merras-Salmio L, Kolho KL. Clinical Use of Infliximab Trough Levels and Antibodies to Infliximab in Pediatric Patients With Inflammatory Bowel Disease. Journal of Pediatric Gastroenterology and Nutrition. 2017;64(2):27278. doi:10.1097/MPG.0000000000001258.
- Miele E, Markowitz JE, Mamula P, et al. Human Antichimeric Antibody in Children and Young Adults with Inflammatory Bowel Disease Receiving Infliximab. Journal of Pediatric Gastroenterology and Nutrition. 2004;38 (5):5028.
- Ordás I, Mould DR, Feagan BG, et al. Anti-TNF Monoclonal Antibodies in Inflammatory Bowel Disease: Pharmacokinetics-Based Dosing Paradigms. Clinical Pharmacology & Therapeutics. 2012;91(4):63546. doi:10.1038/clpt.2011.328.
- Osterman MT, Haynes K, Delzell E, et al. Effectiveness and Safety of Immunomodulators With AntiTumor Necrosis Factor Therapy in Crohns Disease. Clinical Gastroenterology and Hepatology. 2015;13(7):12931301.e5. doi:10.1016/j.cgh.2015.02.017.
- Panaccione R, Ghosh S, Middleton S, et al. Combination Therapy With Infliximab and Azathioprine Is Superior to Monotherapy With Either Agent in Ulcerative Colitis. Gastroenterology. 2014;146(2):392400.e3. doi:10.1053/j.gastro.2013.10.052.
- Papamichael K, Baert F, Tops S, et al. Post-Induction Adalimumab Concentration Is Associated with Short-Term Mucosal Healing in Patients with Ulcerative Colitis. Journal of Crohns and Colitis. 2017;11(1):5359. doi:10.1093/ecco-jcc/jjw122.
- Papamichael K, van Stappen T, vande Casteele T, et al. Infliximab Concentration Thresholds During Induction Therapy Are Associated With Short-Term Mucosal Healing in Patients With Ulcerative Colitis. Clinical Gastroenterology and Hepatology. 2016;14(4).W.B. Saunders: 54349. doi:10.1016/J.CGH.2015.11.014.
- Paul S, Moreau AC, Del Tedesco E, et al. Pharmacokinetics of Adalimumab in Inflammatory Bowel Diseases. Inflammatory Bowel Diseases. 2014;20(7):128895. doi:10.1097/MIB.0000000000000037.
- Paul S, Del Tedesco E, Marotte H, et al. Therapeutic Drug Monitoring of Infliximab and Mucosal Healing in Inflammatory Bowel Disease. Inflammatory Bowel Diseases. 2013;19(12):256876. doi:10.1097/MIB.0b013e3182a77b41.
- Reinisch W, Sandborn WJ, Hommes DW, et al. Adalimumab for Induction of Clinical Remission in Moderately to Severely Active Ulcerative Colitis: Results of a Randomised Controlled Trial. Gut. 2011;60(6):78087. doi:10.1136/gut.2010.221127.
- Roblin X, Marotte H, Rinaudo M, et al. Association Between Pharmacokinetics of Adalimumab and Mucosal Healing in Patients With Inflammatory Bowel Diseases. Clinical Gastroenterology and Hepatology. 2014;12 (1):8084.e2. doi:10.1016/j.cgh.2013.07.010.
- Ruemmele FM, Veres G, Kolho KL, et al. 2014. Consensus Guidelines of ECCO/ESPGHAN on the Medical Management of Pediatric Crohns Disease. Journal of Crohns and Colitis. 2014;8(10). The Oxford University Press: 11791207. doi:10.1016/j.crohns.2014.04.005.
- Rutgeerts P, Sandborn WJ, Feagan BG, et al. Infliximab for Induction and Maintenance Therapy for Ulcerative Colitis. New England Journal of Medicine. 2005;353(23): 246276. doi:10.1056/NEJMoa050516.
- Sandborn WJ, van Assche G, Reinisch W, et al. Adalimumab Induces and Maintains Clinical Remission in Patients With Moderate-to-Severe Ulcerative Colitis. Gastroenterology. 2012;142(2):257265.e3. doi:10.1053/j.gastro.2011.10.032.
- Sandborn WJ, Feagan BG, Marano C, et al. Subcutaneous Golimumab Induces Clinical Respons and Remission in Patients With Moderate-to-Severe Ulcerative Colitis. Gastroenterology. 2014;146(1):8595. doi:10.1053/j.gastro.2013.05.048.
- Sandborn WJ, Feagan BG, Marano C, et al. Subcutaneous Golimumab Maintains Clinical Respons in Patients with Moderate-to-Severe Ulcerative Colitis. Gastroenterology. 2014;146(1):96109.e1. doi:10.1053/j.gastro.2013.06.010.
- Schaufler C, Lerer T, Campbell B, et al. Preoperative Immunosuppression Is Not Associated With Increased Postoperative Complications Following Colectomy in Children With Colitis. Journal of Pediatric Gastroenterology and Nutrition. 2012;55(4):42124. doi:10.1097/MPG.0b013e318252c831.
- Sharma S, Eckert D, Hyams JS, et al. Pharmacokinetics and ExposureEfficacy Relationship of Adalimumab in Pediatric Patients with Moderate to Severe Crohn's Disease. Inflammatory Bowel Diseases. 2015;21(4):78392. doi:10.1097/MIB.0000000000000327.
- Shelton E, Allegretti JR, Stevens B, et al. Efficacy of Vedolizumab as Induction Therapy in Refractory IBD Patients. Inflammatory Bowel Diseases. 2015;21(12):287985. doi:10.1097/MIB.0000000000000561.
- Singh N, Rabizadeh S, Jossen J, et al. Multi-Center Experience of Vedolizumab Effectiveness in Pediatric Inflammatory Bowel Disease. Inflammatory Bowel Diseases. 2016;22(9):212126. doi:10.1097/MIB.0000000000000865.
- Ternant D, Aubourg A, Magdelaine-Beuzelin C, et al. Infliximab Pharmacokinetics in Inflammatory Bowel Disease Patients. Therapeutic Drug Monitoring 2008;(4):52329. doi:10.1097/FTD.0b013e318180e300.
- Thorlund K, Druyts E, Mills EJ, et al. Adalimumab versus Infliximab for the Treatment of Moderate to Severe Ulcerative Colitis in Adult Patients Naïve to Anti-TNF Therapy: An Indirect Treatment Comparison Meta-Analysis. Journal of Crohns and Colitis. 2014;8 (7):57181. doi:10.1016/j.crohns.2014.01.010.
- Turner D, Griffiths AM. Acute Severe Ulcerative Colitis in Children: A Systematic Review. Inflammatory Bowel Diseases. 2011;17 (1):44049. doi:10.1002/ibd.21383.
- Turner D, Veereman G, Hyams J, et al. P522 A Multicentre Open-Label Study Assessing Pharmacokinetics, Efficacy, and Safety of Subcutaneous Golimumab in Paediatric Patients with Moderately to Severely Active Ulcerative Colitis. J Crohns Colitis. 2016;10:(suppl 1):S364-S65.
- Turner D, Ruemmele FM, Orlanski-Meyer E, et al. Management of Paediatric Ulcerative Colitis, Part 1: Ambulatory Care-An Evidence-based Guideline From European Crohn's and Colitis Organization and European Society of Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018 Aug;67(2):257-291.
- Ungar B, Mazor Y, Weisshof R, et al. Induction Infliximab Levels among Patients with Acute Severe Ulcerative Colitis Compared with Patients with Moderately Severe Ulcerative Colitis. Alimentary Pharmacology & Therapeutics. 2016;43(12):129399. doi:10.1111/apt.13631.
- Vermeire S, Noman M, van Assche G, et al. Effectiveness of Concomitant Immunosuppressive Therapy in Suppressing the Formation of Antibodies to Infliximab in Crohns Disease. Gut. 2007;56(9):122631. doi:10.1136/gut.2006.099978.
- Volonaki E, Mutalib M, Kiparissi F, et al. Adalimumab as a Second-Line Biological Therapy in Children with Refractory Ulcerative Colitis. European Journal of Gastroenterology & Hepatology. 2015;27(12):142528. doi:10.1097/MEG.0000000000000470.
- Yanai H, Lichtenstein L, Assa A, et al. Levels of Drug and Antidrug Antibodies Are Associated With Outcome of Interventions After Loss of Respons to Infliximab or Adalimumab. Clinical Gastroenterology and Hepatology. 2015;13(3):522530.e2. doi:10.1016/j.cgh.2014.07.029.
- Zitomersky NL, Atkinson BJ, Fournier K, et al. Antibodies to Infliximab Are Associated with Lower Infliximab Levels and Increased Likelihood of Surgery in Pediatric IBD. Inflammatory Bowel Diseases. 2015;21(2):30714. doi:10.1097/MIB.0000000000000284.
- Zittan E, Kabakchiev B, Milgrom R, Higher Adalimumab Drug Levels Are Associated with Mucosal Healing in Patients with Crohns Disease. Journal of Crohns and Colitis. 2016;10(5):51015. doi:10.1093/ecco-jcc/jjw014.
Evidence tabellen
Evidence-tabel deelvraag 1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Lee, 2016 |
Type of study: Retrospective cohort study
Setting: Data obtained from Truven Health MarketScan Commercial Claims and Encounters (CCAE) databases containing health care claims for about 180 million people, 2009-2013
Country: US Source of funding: Unknown |
Inclusion criteria: Children and young adults < 24 years of age, newly diagnosed with IBD. At least 6 months of enrolment after the date of diagnosis in the registry and patients had have received at least one IBD medication during the follow-up period.
Exclusion criteria: Patients with a history of tuberculosis and/or medications for tuberculosis.
N total at baseline: Intervention: 1298 Control: 2002
Important prognostic factors2: Not assessed
Groups comparable at baseline? Not assessble |
Describe intervention (treatment/procedure/test):
“top-down”: was defined as TNFa inhibitor initiation within 30 days of the first medication prescription for IBD (i.e., 5-aminosalicylates, systemic corticosteroids, thiopurines, and/or immunosuppressants)
|
Describe control (treatment/procedure/test):
The conventional “step-up” approach was defined as TNFα inhibitor initiation more than 30 days after the first IBD medication prescription. |
Length of follow-up: Not clearly described
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Patients who received top-down treatment were less likely to use corticosteroids (32.5% versus 94.2%, P= 0.0001), 5-aminosalicylates (17.3% versus 75.1%, P = 0.0001), methotrexate (7.2% versus 14.6%, P = 0.0001), or thiopurines (13.5% versus 54.8%, P = 0.0001) compared with step-up patients. No difference in switching between different types of TNFα (5,7% versus 7.4%, P = 0.0581). |
Aims:
Comments: Not real clinically relevant outcomes for our research question |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Evidence-tabel deelvraag 2
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
McGinnis, 2008 |
Type of study: Retrospective cohort
Setting: outpatient clinic
Country: U.S.
Source of funding: none |
Inclusion criteria: children with steroid-resistant and dependent UC who received IFX in a 36-month interval
Exclusion criteria:
N total at baseline: Intervention: 20 Control:19
Important prognostic factors2: Not specified
Groups comparable at baseline? unknown |
Describe intervention (treatment/procedure/test):
IFX + Azathioprine or mercaptopurine
|
Describe control (treatment/procedure/test):
IFX |
Length of follow-up: Mean 18.5 months (range 1-36)
Loss-to-follow-up: Four patients (10%) were lost to follow-up. Not specific intervention versus control.
Incomplete outcome data: See loss to follow-up
|
Outcome measures and effect size (include 95%CI and p-value if available):
Respons (posttreatment recategorization into Truelove and Witts ‘‘mild’’ category or better):
No difference in respons combi (15/20) versus mono (12/19), p=0.50
|
|
|
Hyams, 2010 |
Type of study: prospective, multicenter, inception cohort study
Setting: hospitalized and outpatient
Country: U.S.
Source of funding: none |
Inclusion criteria: Children < 16 years with UC started on IFX
Exclusion criteria:
N total at baseline: Intervention: 32 Control: 20
Important prognostic factors2: Not specified
Groups comparable at baseline? unknown |
Describe intervention (treatment/procedure/test):
Azathioprine or mercaptopurine +IFX (at start IFX, at 3, 6, 12 ,24 months)
|
Describe control (treatment/procedure/test):
IFX |
Length of follow-up: Median 30 months
Loss-to-follow-up: Not specified
Incomplete outcome data: Not specified
|
Outcome measures and effect size (include 95%CI and p-value if available):
Lower colectomy rate in combi therapy at: - combi vs mono 3 months - combi vs mono 6 months 25% vs 36% - combi vs mono 12 months 26% vs 50% - combi vs mono 24 months , 47% vs 78%
|
Geen p-waarde gegeven voor mono vs combi op 3, 6, 12, 24 maanden |
|
Hyams, 2012 |
Type of study: prospective, multicenter, inception cohort study
Setting: hospitalized and outpatient
Country: U.S.
Source of funding: Janssen Research & Development
|
Inclusion criteria: Patients (6–17 years old) with active UC (Mayo scores of 6–12; endoscopic subscores 2) not responded to or tolerated conventional treatment start on IFX
Exclusion criteria:
N total at baseline: Intervention: 28 Control: 32
Important prognostic factors2: Not specified
Groups comparable at baseline? unknown |
Describe intervention (treatment/procedure/test):
IFX + AZA, 6-MP, MTX at baseline
|
Describe control (treatment/procedure/test):
IFX |
Length of follow-up: 8 weeks for nonreponders, 52 week for responders
Loss-to-follow-up: 7 (30.4%) discontinued treatment because of an adverse event, 3 (13.0%) for unsatisfactory therapeutic effect,and 1 (4.3%) for other reasons. Groups not specified.
Incomplete outcome data: Not specified
|
Outcome measures and effect size (include 95%CI and p-value if available):
clinical respons: decrease in the Mayo score by 30% and 3 points, with a decrease in the rectal bleeding subscore of 1 or a rectal bleeding subscore of 0 or 1.
clinical remission: as defined by a mayo score ≤2 with no individualsubscore >1
mucosal healing: Mayo endoscopy subscore of 0 or 1
Week 8 combi (n=32) vs mono (n=28): no differences 23 (71.9%) vs 21 (75.0%) - mucosal healing 21 (65.6%) vs 20 (71.4%) Week 52 combi (n=11) vs mono (n=10): no differences |
Geen p-waarde gegeven voor mono vs combi |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders)
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Evidence-tabel deelvraag 3
Niet van toepassing aangezien er geen geïncludeerde studies zijn.
Risk of bias deelvraag 1
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Lee, 2016 |
unlikely |
unclear |
unlikely |
likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Risk of bias deelvraag 2
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
McGinnis, 2008 |
likely |
unclear |
unlikely |
likely |
|
Hyams, 2010 |
likely |
unclear |
unlikely |
likely |
|
Hyams, 2012 |
likely |
unclear |
unlikely |
likely |
Risk of bias deelvraag 3
Niet van toepassing aangezien er geen geïncludeerde studies zijn.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 17-12-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (https://www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om een effectieve en efficiënte diagnostiek en behandeling te realiseren bij kinderen met een inflammatoire darmziekte (de ziekte van Crohn of colitis ulcerosa (IBD, Inflammatory Bowel Disease).
Doelgroep
Deze richtlijn is bedoeld voor kinderartsen, kinderartsen-MDL, MDL-artsen, IBD-verpleegkundig specialisten, IBD-physician assistants en IBD-verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen en adolescenten met inflammatoire darmziekten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. Dr. J.C. Escher, kinderarts maag-darm-leverziekten, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK, voorzitter
- Drs. M.A. Aardoom MSc, arts-onderzoeker, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK
- Drs. G. van den Brink MSc, arts-onderzoeker, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK
- Dr. K. Diederen, MSc, onderzoeker binnen de kindergeneeskunde, werkzaam in het Academisch Medisch Centrum-Emma Kinderziekenhuis te Amsterdam, NVK
- M.A.C. van Gaalen, verpleegkundig specialist kinder-MDL, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, V&VN
- Drs. S. Haisma MSc, arts-onderzoeker, werkzaam in het Universitair Medisch Centrum-Beatrix Kinderkliniek te Groningen, NVK
- Dr. A. Kindermann, kinderarts maag-darm-leverziekten, werkzaam in het Emma Kinderziekenhuis-Emma Kinderziekenhuis te Amsterdam en in het Academisch Medisch Centrum te Amsterdam, NVK
- Drs. M. Oldenziel, klinisch psycholoog, werkzaam in het Gelre ziekenhuis te Apeldoorn, NIP
- Dr. P.F. van Rheenen, kinderarts maag-darm-leverziekten, werkzaam in het Universitair Medisch Centrum-Beatrix Kinderkliniek te Groningen, NVK
- Dr. L. de Ridder, kinderarts maag-darm-leverziekten, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK
- Prof. Dr. C.J. van der Woude, maag-darm-leverarts, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVMDL
Klankbordgroep
De klankbordgroepleden hebben gedurende de ontwikkeling van de richtlijn meegelezen met de conceptteksten en deze becommentarieerd.
- Dr. J. Curvers, klinisch chemicus, werkzaam in het Catharina ziekenhuis te Eindhoven, NVKC
- Dr. W. van Gemert, chirurg, werkzaam in het Universitair Medisch Centrum te Maastricht, NVvH
- Dr. L. Hanff, ziekenhuisapotheker, werkzaam in het Prinses Máxima Centrum te Utrecht, , NVZA
- T. Markus, directeur, werkzaam bij de Crohn en Colitis Ulcerosa Vereniging Nederland te Woerden
- H. Rippen, directeur, werkzaam bij Stichting Kind en Ziekenhuis te Utrecht
- H. van der Wielen, verpleegkundig specialist kinder-MDL, werkzaam in het Jeroen Bosch Ziekenhuis te Den Bosch, V&VN
Met ondersteuning van:
- Dr. I.M. Mostavaya, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.M.M. Vaes, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Escher |
kinderarts maagdarmleverziekten |
-adviserend arts voor cyberpoli IBD, (onbetaald) -editor voor diverse vaktijdschriften, (onbetaald) -Bestuurslid NVGE (onbetaald) -Voorzitter kinder-IBD-werkgroep (KICC; sectie kinder-MDL, NVK) (onbetaald)
|
-Deelname aan en advisory board member register studie DEVELOP (sponsor is Janssen) -Deelname aan en advisory board member register studie CAPE (sponsor is Abbvie) -Deelname aan TISKIDS studie (ZONMW, co-sponsor is Pfizer) -Biomarkers studie (co-sponsor is MSD) |
Geen actie |
|
Aardoom |
Arts-onderzoeker in Erasmus MC Sophia op gebied van IBD bij kinderen |
Bestuurslid (secretaris) van Young-ICC (onbetaald)
|
- |
Geen actie |
|
Van den Brink |
Arts-onderzoeker in Erasmus MC-Sophia op het onderzoek HAPPY-IBD (angst/depressieklachten bij jongeren met IBD) |
|
- |
Geen actie |
|
Diederen |
Onderzoeker |
Onderzoeker in het Academisch Medisch Centrum-Emma op gebied van IBD bij kinderen |
- |
Geen actie |
|
Van Gaalen |
Verpleegkundig specialist kinder-MDL |
- |
- |
Geen actie |
|
Haisma |
Arts-onderzoeker |
Arts-onderzoeker in UMC Groningen op gebied van IBD bij kinderen |
- |
Geen actie |
|
Kindermann |
kinderarts maagdarmleverziekten |
-Lid commissie voeding NVK (onbetaald) -Lid commissie ondervoeding NVK (onbetaald) -Penningmeester kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK)(onbetaald)
|
-Deelname DEVELOP register studie (sponsor is Janssen) -Deelname CAPE register studie (sponsor is Abbvie) |
Geen actie |
|
Oldenziel |
Klinisch Psycholoog Hoofd vakgroep psychologie kind & jeugd Opleider |
-Docent aan de opleiding tot Gezondheidszorgpsycholoog, betaald -Docent/trainer, agressietraining, betaald -Deelnemer werkgroep NOLK, onbetaald |
- |
Geen actie |
|
Van Rheenen |
kinderarts maagdarmleverziekten |
-Associate Professor International Child Health (onbetaald) -Coordinator Tropical Medicine Master Education (onbetaald) -Secretaris kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK) (onbetaald) -Voorzitter P-ECCO (Paediatricians of European Crohn's and Colitis Organisation) (onbetaald) |
-SELFIE-studie, gefinancierd door Buhlmann Laboratories AG -GRINCH-studie, gefinancierd door CisBo BioAssays -CACATU-studie, gefinancierd door CisBo BioAssays |
Geen actie |
|
De Ridder |
kinderarts maagdarmleverziekten |
Lid kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK) (onbetaald) Secretaris ESPGHAN IBD Porto werkgroep (onbetaald) Penningmeester PIBDnet (onbetaald) Bestuurslid P-ECCO (Paediatricians of European Crohn's and Colitis Organisation) (onbetaald)
|
-Deelname DEVELOP register studie (sponsor is Janssen) -Deelname CAPE register studie (sponsor is Abbvie) -PI van TISKIDS studie (ZONMW, co-sponsor is Pfizer) -PI van REDUCE RISK (Horizon 2020) studie voor Nederland |
Geen actie |
|
Van Der Woude |
Maag-darm-leverarts |
-Lid educatie commissie UEG (onbetaald) -Lid scientific commissie ECCO (onbetaald) -Secretaris NVGE (onbetaald) |
- ZonMw - Pfizer - Danone - Tramedico |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een enquête onder leden van de CCUVN, welke door de CCUVN is geïnitieerd, en waaraan een aantal werkgroepleden inhoudelijk heeft meegewerkt. Het verslag hiervan is besproken in de werkgroep en de belangrijkste overwegingen zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de CCUVN, Stichting Kind en Ziekenhuis en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Nederlandse Vereniging voor Kindergeneeskunde, 2008) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door belanghebbende partijen tijdens de Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: 1) klinische relevantie; 2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit; 3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
