HMB: Beeldvormende diagnostiek
Uitgangsvraag
Disclaimer
Bij de update van de module is besloten om deze module niet te updaten met een nieuwe literatuursearch. De module was geprioriteerd om de MUSA-criteria toe te kunnen voegen aan de overwegingen. De aanbevelingen van de module zouden naar verwachting niet veranderen door de nieuw gepubliceerde literatuur toe te voegen. De module is dus op narratieve wijze geüpdatet, zonder wijzigingen aan te brengen in de literatuuranalyse van 2012. Omdat de literatuuranalyse in 2012 met de EBRO-methodiek is uitgewerkt, en deze sterk afwijkt van de huidige GRADE-systematiek volgens FMS Richtlijnen 3.0, zal deze worden toegelicht waar nodig.
Uitgangsvraag
[2024] Welke diagnostische testen zouden de voorkeur hebben om, bij de beeldvormende diagnostiek van hevig menstrueel bloedverlies, anatomische afwijkingen van de uterus en/of het cavum uteri vast te stellen?
Aanbeveling
[2024]
Start altijd met een transvaginale 2D-echoscopie van de uterus bij je work-up van hevig menstrueel bloedverlies. De IETA- en MUSA-criteria kunnen gebruikt worden als handvat om het endometrium en het myometrium systematisch te beschrijven.
De MUSA-criteria kunnen ondersteunen in adenomyose gemakkelijker herkennen bij transvaginale echoscopie en om te kunnen differentiëren tussen myomen en adenomyose.
Verricht bij voorkeur een SIS/GIS bij twijfel over het bestaan van intra-uteriene afwijkingen (hierbij kan gebruik gemaakt worden van de IETA-criteria).
Verricht niet routinematig een diagnostische hysteroscopie bij een normale SIS/GIS, maar alleen op indicatie bij afwijkende of inconclusieve resultaten.
Verricht alleen een MRI, bij het vermoeden van myomen en/of adenomyose op basis van transvaginale echoscopie of klinische symptomen, als dit therapeutische consequenties heeft.
Overwegingen
[2024]
De afgelopen decennia is niet alleen de kwaliteit van onze echoapparaten enorm verbeterd, maar ook onze vaardigheden in het verrichten en beoordelen van de gynaecologische echoscopie. Vanwege de vele minimaal invasieve behandelingen is differentiëren tussen verschillende uteriene afwijkingen van groot belang. In 2009 publiceerde de International Endometrial Tumor Analysis (IETA) Group een consensusverklaring over terminologie, definities en metingen die kunnen worden gebruikt om de echografische kenmerken van het endometrium en het cavum te beschrijven met 2D echoscopie, colour doppler en sonohysterography (SIS). Deze terminologie en definities vormen een basis voor de praktijk maar ook voor toekomstig wetenschappelijk onderzoek. Zoals er voor het endometrium de (IETA)-criteria zijn, zo zijn er voor het myometrium de Morphological Uterus Sonographic Assessment (MUSA)-criteria (Leone, 2009; Van den Bosch, 2015).
Sinds de laatste literatuur search (van 2000 tot 2012) zijn er geen veranderingen in de nauwkeurigheid van het diagnosticeren van intracavitaire afwijkingen gepubliceerd, enkel bevestigende resultaten (Nieuwenhuis, 2017). Als het gaat om adenomyose en de differentiatie tussen (vormen van) adenomyose en myomen vormen de resultaten van de MUSA-groep een belangrijke aanbeveling voor de dagelijkse praktijk bij patiënten met hevig menstrueel bloedverlies. We gaan hieronder daarom uitgebreid in op adenomyose en beeldvorming.
Adenomyose is een benigne aandoening gedefinieerd als de aanwezigheid van endometriumklierbuizen en stroma in het myometrium. Adenomyose kent diverse verschijningsvormen: de puur diffuse/focale adenomyose of adenomyose in combinatie met één of meer myomen (± 15-50%). De incidentie van adenomyose bij vrouwen tussen de 40 en 55 jaar wordt geschat op 20-30% (Upson, 2020; Yu, 2020). Het stellen van de diagnose adenomyose is een uitdaging, zowel klinisch als met beeldvormende diagnostiek. Dit wordt mede verklaard door de verscheidenheid aan uitingsvormen waardoor detectie met beeldvorming moeilijk kan zijn, en ook omdat er veel overlap is in klachten bij adenomyose en myomen. Daarbij is de accuratesse van beeldvorming veelal ook afhankelijk van het ervaringsniveau van de gebruiker en ontbrak het aan duidelijke criteria om de aanwezigheid en uitgebreidheid/ernst van adenomyose te kunnen vaststellen op basis van beeldvorming.
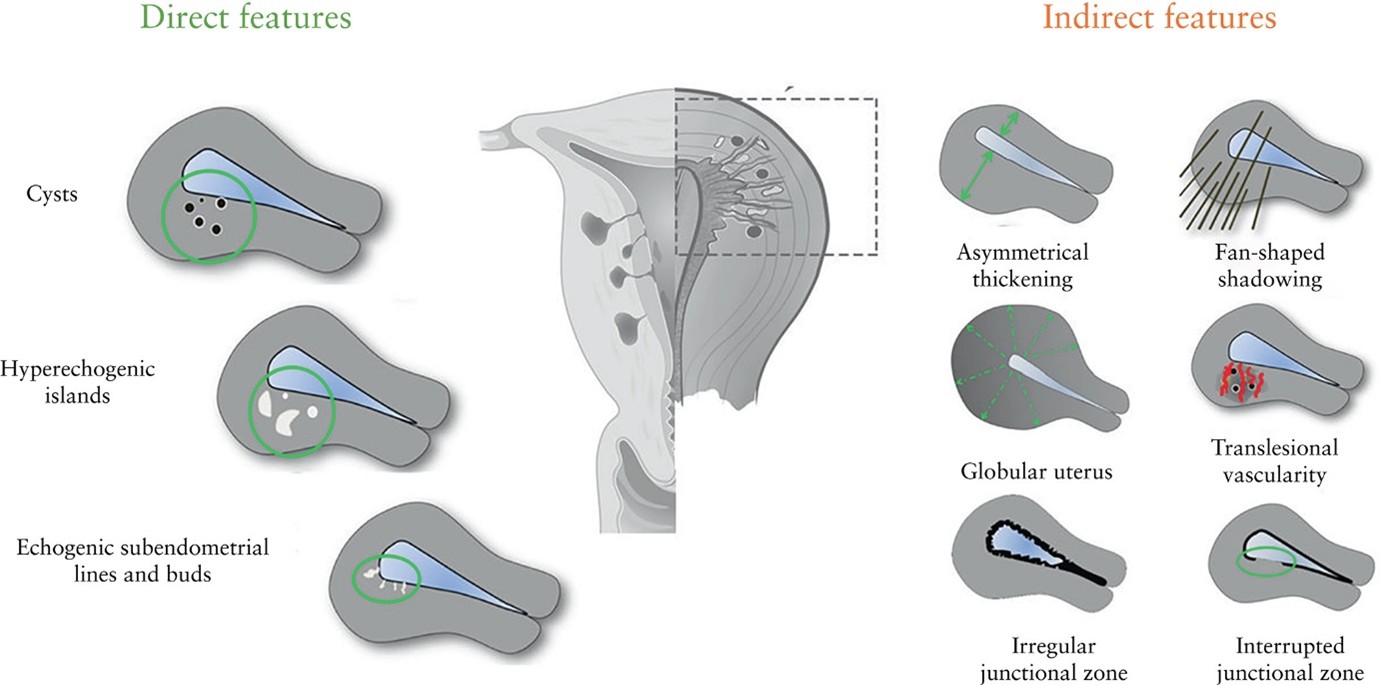
In 2015 publiceerde de internationale Morphological Uterus Sonographic Assessment (MUSA)-groep een consensuspaper waarin nieuwe terminologie en definities (MUSA-criteria, zie figuur 1 MUSA-criteria oorspronkelijk (2015)) werden voorgesteld die je kunnen helpen in het vaststellen van adenomyose en differentiëren tussen adenomyose en/of myomen in het myometrium bij transvaginale 2D echoscopie (Van den Bosch, 2015).
Dit heeft uiteindelijk geleid in 2019 tot het ontwikkelen van een uniform en praktisch classificatiesysteem voor het vaststellen van de verschillende uitingsvormen en uitgebreidheid van adenomyose bij transvaginale echoscopie (Van den Bosch, 2019).
In 2021 zijn de MUSA-criteria nog verder aangepast na een Delphiprocedure (Harmsen 2021, https://pubmed.ncbi.nlm.nih.gov/34587658/) in directe en indirecte MUSA-criteria om adenomyose met transvaginale 2D echoscopie nog makkelijker te kunnen herkennen. (Figuur 1 MUSA-criteria gereviseerd (2021)) De directe MUSA-criteria correleren met de aanwezigheid van ectopisch baarmoederslijmvlies in het myometrium.
Figuur 1. MUSA-criteria gereviseerd (2021)
De oude literatuursearch heeft laten zien dat transvaginale 2D echoscopie en beeldvorming met magnetische resonantie (MRI) een vergelijkbare diagnostische accuratesse hebben voor het vaststellen adenomyose (Champaneria et al., 2010). Dit wordt nogmaals ondersteund in een meer recente meta-analyse (Tellum, 2020). Deze laatste beschrijft tevens dat 3D echoscopie de diagnostische accuratesse kan verbeteren omdat het veranderingen in de JZ in meer detail kan visualiseren. Waar 2D echoscopie goed is in het detecteren van veranderingen in het myometrium kan 3D de JZ beter beoordelen. Echoscopische meting van de JZ-dikte speelt momenteel geen rol in de klinische praktijk. De beoordeling van de junctionele zone lijkt vooral belangrijk in het geval van onzekerheid over de diagnose van adenomyose (Harmsen, 2021), maar vergt expertise op het gebied van 3D-echoscopie, en is in veel ziekenhuizen niet standaard beschikbaar in echoapparatuur op de polikliniek. Of deze verscherpte MUSA-criteria zowel in ervaren als in onervaren handen ons daadwerkelijk in staat zullen stellen om nog beter adenomyose vast te stellen zal moeten blijken uit toekomstige diagnostische studies. Deze zijn tot op heden echter nog zeer weinig voorhanden. Ze zijn dan ook moeilijk om uit te voeren, aangezien de referentiestandaard pathologie is, en niet alle vrouwen met vermoedelijke adenomyose een definitieve ingreep (hysterectomie) ondergaan. Daarnaast bestaat er ook geen internationale overeenstemming tussen pathologen over de diagnose van adenomyose.
Ook als het gaat om het diagnosticeren van myomen hebben 2D echoscopie en MRI een vergelijkbare accuratesse (Dueholm 2002). Om het exacte aantal, de grootte, en de locatie van myomen vast te stellen, heeft de MRI de voorkeur, met name bij grotere uteri en meer dan vier myomen. In de dagelijkse praktijk dient dan ook altijd eerst een transvaginale echoscopie te worden verricht bij het vaststellen van adenomyose en myomen. Deze test lijkt namelijk voldoende accuraat met een sensitiviteit en specificiteit 78%. Mogelijk kunnen de MUSA-criteria ons verder helpen om adenomyose nog beter te kunnen opsporen met echoscopie. Een groot voordeel van de transvaginale echoscopie ten opzichte van de MRI is dat het altijd beschikbaar is op de polikliniek, relatief goedkoop is, geen voorbereiding vereist, en geen contra-indicaties kent. Tevens is transvaginale echoscopie een dynamisch onderzoek wat je ook in staat stelt om adhesies op te sporen met verminderde mobiliteit van bekkenorganen en pijnpunten bij onderzoek duidelijk kunt vaststellen. Dit in tegenstelling tot MRI. Dit dynamische aspect van de transvaginale echoscopie lijkt vooral belangrijk als adenomyose samengaat met de aanwezigheid van endometriose. De toegevoegde waarde van 3D echoscopie laat zich vooralsnog vooral zien bij de beoordeling van de junctionele zone en wordt nog niet standaard toegepast in de dagelijkse kliniek.
De combinatie van beide modaliteiten (2D echoscopie en MRI) leidt mogelijk in de dagelijkse praktijk tot de beste accuratesse, namelijk 90% (Levgur, 2007; Mijatovic et al., 2010). Beeldvorming met MRI heeft toevoegde waarde als de uitslag hiervan therapiekeuzes kan beïnvloeden. De rol van MRI lijkt vooral weggelegd voor het beoordelen van de uterus voorafgaand aan een myoomenucleatie/embolisatie, en als er een vermoeden bestaat op aanwezigheid van diepe endometriose bij adenomyose van de uterus, en er een indicatie is tot een operatieve sanering.
Voor het beoordelen van intracavitaire pathologie zijn SIS/GIS en hysteroscopie goede diagnostische modaliteiten. Saline of gel infusion sonohysterography (SIS en GIS) hebben een vergelijkbare sensitiviteit en specificiteit voor het detecteren van intracavitaire afwijkingen (Werbrouck et al., 2011, Bij de Vaate et al., 2010). Voor SIS geldt dat in 94% van de gevallen het cavum goed beoordeeld kan worden, vergeleken met 92% voor hysteroscopie (van Dongen et al., 2008). Hierbij worden lagere pijnscores gerapporteerd voor SIS. Echter wanneer naar patiëntpreferenties gekeken wordt, blijkt dat ongeveer 40% van de patiënten direct een hysteroscopie prefereert boven een strategie die start met SIS (van Dongen et al., 2011). Gezien de lagere pijnscores bij SIS, de logistiek en uit kostenoverwegingen is de commissie echter van mening dat een strategie die start met SIS de voorkeur geniet.
Onderbouwing
Achtergrond
[2012] In clinical practice, different diagnostic tests/imaging modalities are used in the clinical work-up of women with heavy menstrual bleeding. These include transvaginal ultrasonography, saline or gel infusion sonohysterography, MRI and hysteroscopy. The aim of this chapter is to determine which of these tests should be used to accurately diagnose anatomical abnormalities (i.e., myoma, adenomyosis, polyps) of the uterus and/or uterine cavity, in relation to costs and patient satisfaction.
Conclusies / Summary of Findings
[2012]
|
High (A1 or A2) |
Ultrasound and MRI have a comparable diagnostic accuracy for diagnosing fibroids and adenomyosis.
Champaneria et al., 2010; Meredith et al., 2009 |
|
High (A1 or A2) |
A SIS without abnormalities virtually rules out intracavitary pathology.
de Kroon et al., 2003 |
|
Low (D) |
Gel Instillation Sonohysterography (GIS) has no proven added value over Saline Infusion Sonohysterography (SIS).
Werbrouck et al., 2011; Bij de Vaate et al., 2010 |
|
Moderate (B) |
The use of 3D contrast ultrasound has no added value over 2D contrast ultrasound for the detection of intrauterine abnormalities.
de Kroon et al., 2004 |
|
High (A1 or A2) |
Hysteroscopy is the best diagnostic modality for diagnosing intrauterine abnormalities, however, SIS is less painful than hysteroscopy.
van Dongen et al., 2008; Grimbizis et al., 2010; Soguktas et al., 2012 |
Samenvatting literatuur
[2012]
Description of studies
See evidence table.
Results
1. Sensitivity and specificity
Fibroids
No comparative studies were found between transvaginal ultrasound and MRI for the detection of fibroids. In clinical practice however, one always starts with transvaginal ultrasound and MRI will only be performed on indication. We will discuss the indications later (below) in more detail.
Adenomyosis
A meta-analysis (Champaneria et al., 2010), including 6 diagnostic accuracy studies of high quality, compared ultrasound with MRI in patients with histologically conformed adenomyosis. Sensitivity of transvaginal ultrasound was 0.72 (95%CI 0.65-0.79) compared to 0.77 (95%CI 0.67-0.85) for MRI. Specificity of transvaginal ultrasound was 0.81 (95%CI 0.77-0.85) compared to 0.89 (95%CI 0.84-0.92) for MRI. Corresponding likelihood ratios were LR+ 3.7 (95%CI 2.1-6.4) and LR- 0.3 (95%CI 0.1-0.5) for ultrasound and LR+ 6.5 (95%CI 4.5-9.3) and LR- 0.2 (95%CI 0.1-0.4) for MRI. The correct diagnosis was obtained more often with MRI, however the difference was not statistically significant.
A second meta-analysis (Meredith et al., 2009), with an analysis of 1898 women, compared transvaginal ultrasound with histology in a symptomatic patient population. This study showed a pooled sensitivity of 0.83 (95% CI 0.76-0.93) with a specificity of 0.85 (95% CI 0.73-0.94) for diagnosing adenomyosis. The results of this meta-analysis are comparable to the Champaneria meta-analysis.
Intracavitary pathology
• Saline Infusion Sonohysterography (SIS)
A systematic review (De Kroon et al., 2003) compared SIS (saline infusion sonography) with diagnostic hysteroscopy in pre- and postmenopausal patients with abnormal uterine bleeding. The overall sensitivity and specificity of SIS for intracavitary abnormalities were 0.95 (95% CI 0.93-0.97) and 0.88 (95% CI 0.85-0.92) respectively. The LR+ was 8.23 (95% CI 6.22-10.9) and the LR- was 0.06 (95% CI 0.04-0.09). From this, it can be concluded that a normal SIS excludes intracavitary pathology. De Kroon et al. (2004) compared a regular 2D SIS with a 3D SIS. In 45 pre- and postmenopausal women the results were comparable with hysteroscopy. Sensitivity and specificity of these tests were comparable (0.95 and 0.95 vs 0.88 and 0.88, NS).
In a prospective cohort study (Soguktas et al., 2012), including 89 premenopausal women with abnormal uterine bleeding, transvaginal ultrasound, SIS and hysteroscopy were compared. Sensitivity of the different diagnostic modalities was 0.89 for TVE, 0.94 for SIS and 0.98 for hysteroscopy. This corresponded with a specificity of 0.71 for TVE, 0.91 for SIS and 0.93 for hysteroscopy.
A prospective, blinded, controlled study in 105 women with heavy menstrual bleeding, postmenopausal bleeding or infertility, showed comparable accuracy parameters for the SIS (Grimbizis et al., 2010). The sensitivity, reported in this study, was 0.89 for TVE, 0.93 for SIS, and 0.98 for HS. The associated specificity was somewhat lower than in the Soguktas study: 0.56 for TVE, 0.60 for SIS and 0.92 for HS.
• Gel Instillation Sonohysterography (GIS)
A prospective cohort study (Werbrouck et al., 2011), including 804 patients with abnormal uterine bleeding (57.2% premenopausal), performed SIS in the first 400 patients and GIS (gel infusion sonography/gel contrast ultrasound) in the 400 subsequent patients. Compared to histology, SIS had a sensitivity of 0.78 versus 0.85 with GIS, with a corresponding specificity of 0.81 and 0.78. These differences were not statistically significant.
A Dutch study (Bij de Vaate et al., 2010) performed a SIS and GIS in 65 patients suspected of intrauterine deviations. Both techniques detected the same degree of abnormalities.
VAS
One RCT (van Dongen et al., 2008) compared pain scores in 100 (mainly premenopausal) women who underwent SIS and outpatient hysteroscopy. The average VAS scores were 2.7 (95% CI 2.0-3.4) with SIS and 4.0 (95% CI 3.4-4.6) with vaginoscopic hysteroscopy (p=0.10). The present pain index (PPI) was significantly lower with SIS compared with hysteroscopy. For SIS compared to GIS, no significant differences in pain scores were found (Bij de Vaate et al., 2010).
Level of evidence of the literature
[2024] This was not reported per outcome measure in the original guideline module. For this module EBRO grading was used for diagnostic accuracy studies because GRADE could not be used yet for these types of modules.
Table 1. EBRO evidence levels from diagnostic accuracy studies and studies of harm, etiology or prognosis
|
Level of evidence |
Diagnostic accuracy studies |
Harm side effects, etiology, prognosis |
|
A1 |
Meta-analysis of at least 2 independently conducted studies of A2 level |
Meta-analysis of at least 2 independently conducted studies of A2 level |
|
A2 |
Research compared to a reference test ('gold standard') with predefined cut-off values and independent assessment of results, with a sufficiently large series of consecutive patients who have all had the index and reference test. |
Prospective cohort study of sufficient size and follow-up, adequately controlling for confounding and sufficiently excluding selective follow-up. |
|
B |
Research compared to a reference test, but not with all the characteristics mentioned under A2. |
Prospective cohort study, but not with all the characteristics mentioned under A2 or retrospective cohort study or case-control study. |
|
D |
Non-comparative research. |
Non-comparative research. |
Zoeken en selecteren
Search and select
[2012] A systematic review of the literature was performed to answer the following question: What is the sensitivity and specificity of a transvaginal ultrasound (including saline or gel infusion sonohysterography) compared to MRI and hysteroscopy in detecting a) fibroids and adenomyosis and b) intracavitary pathology?
| P: | Patients with heavy menstrual bleeding |
| I: | Transvaginal ultrasound (including saline or gel infusion sonohysterography) |
| C: | MRI |
| R: | Hysteroscopy |
| O: |
Diagnostic accuracy in detecting a) fibroids and adenomyosis and b) intracavitary pathology |
|
Timing and setting: Gynaecologist in hospital |
Relevant outcome measures
[2012] The guideline development group considered sensitivity and specificity of diagnostic accuracy modalities as critical outcome measures for clinical decision-making. If available, patient satisfaction was assessed by means of VAS pain scores.
[2024] In 2012, the guideline panel did not define thresholds for minimal clinically important differences between tests, but reported the statistical differences.
Search and select (Methods)
[2012] The database Medline (via OVID) was searched with relevant search terms from 2000 until March 2012. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 235 hits. Nine studies were included in the literature analysis.
Results
[2012] Nine studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bij de Vaate, A.J., Brölmann, H.A., van der Slikke, J.W., Emanuel, M.H., & Huirne, J.A. (2010). Gel instillation sonohysterography (GIS) and saline contrast sonohysterography (SCSH): comparison of two diagnostic techniques. Ultrasound Obstet Gynecol., 35, 486-489.
- Champaneria, R., Abedin, P., Daniels, J., Balogun, M., & Khan, K.S. (2010). Ultrasound scan and magnetic resonance imaging for the diagnosis of adenomyosis: systematic review comparing test accuracy. Acta Obstet Gynecol Scand., 89, 1374-1384.
- De Kroon, C.D., de Bock, G.H., Dieben, S.W., & Jansen, F.W. (2003). Saline contrast hysterosonography in abnormal uterine bleeding: a systematic review and meta-analysis. BJOG, 110, 938-947.
- De Kroon, C.D., Louwe, L.A., Babtist Trimbos, J., & Jansen, F.W. (2004). The clinical value of 3-dimensional saline infusion sonography in addition to 2-dimensional saline infusion sonography in women with abnormal uterine bleeding. J Ultrasound Med., 23, 1433-1440.
- Dueholm M, Lundorf E, Hansen ES, Ledertoug S, Olesen F. Accuracy of magnetic resonance imaging and transvaginal ultrasonography in the diagnosis, mapping, and measurement of uterine myomas. Am J Obstet Gynecol. 2002 Mar;186(3):409-15.
- Grimbizis, G.F., Tsolakidis, D., Mikos, T., Anagnostou, E., Asimakopoulos, E., Stamatopoulos, P., & Tarlatzis, B.C. (2010). A prospective comparison of transvaginal ultrasound, saline infusion sonohysterography, and diagnostic hysteroscopy in the evaluation of endometrial pathology. Fertil Steril, 94, 2720-2725.
- Leone FP, Timmerman D, Bourne T, Valentin L, Epstein E, Goldstein SR, Marret H, Parsons AK, Gull B, Istre O, Sepulveda W, Ferrazzi E, Van den Bosch T. Terms, definitions and measurements to describe the sonographic features of the endometrium and intrauterine lesions: a consensus opinion from the International Endometrial Tumor Analysis (IETA) group. Ultrasound Obstet Gynecol. 2010 Jan;35(1):103-12.
- Levgur, M. (2007). Therapeutic options for adenomyosis: a review. Arch Gynecol Obstet, 276, 1-15. M eredith, S.M., Sanchez-Ramos, L., & Kaunitz, A.M. (2009). Diagnostic accuracy of transvaginal sonography for the diagnosis of adenomyosis: systematic review and metaanalysis. Am J Obstet Gynecol, 201, e1-6.
- Mijatovic, V., van Waesberghe, J.H., Schats, R., & Hompes, P.G. (2010). Adenomyose in historisch perspectief met focus op moderne beeldvorming en behandeling. NTOG, 123, 335-343.
- Nieuwenhuis LL, Hermans FJ, Bij de Vaate AJM, Leeflang MM, Brölmann HA, Hehenkamp WJ, Mol BWJ, Clark TJ, Huirne JA. Three-dimensional saline infusion sonography compared to two-dimensional saline infusion sonography for the diagnosis of focal intracavitary lesions. Cochrane Database Syst Rev. 2017 May 5;5(5):CD011126.
- Soguktas, S., Cogendez, E., Kayatas, S.E., Asoglu, M.R., Selcuk, S., & Ertekin, A. (2012). Comparison of saline infusion sonohysterography and hysteroscopy in diagnosis of premenopausal women with abnormal uterine bleeding. Eur J Obstet Gynecol Reprod Biol., 161, 66-70.
- Upson K, Missmer SA. Epidemiology of Adenomyosis. Semin Reprod Med. 2020 May;38(2-03):89-107. doi: 10.1055/s-0040-1718920. Epub 2020 Oct 26.
- Van den Bosch, T., de Bruijn, A.M., de Leeuw, R.A., Dueholm, M., Exacoustos, C., Valentin, L., Bourne, T., Timmerman, D. and Huirne, J.A.F. (2019), Sonographic classification and reporting system for diagnosing adenomyosis. Ultrasound Obstet Gynecol, 53: 576-582.
- Van den Bosch T, Dueholm M, Leone FP, Valentin L, Rasmussen CK, Votino A, Van Schoubroeck D, Landolfo C, Installé AJ, Guerriero S, Exacoustos C, Gordts S, Benacerraf B, D'Hooghe T, De Moor B, Brölmann H, Goldstein S, Epstein E, Bourne T, Timmerman D. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: a consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet Gynecol. 2015 Sep;46(3):284-98.
- Van Dongen, H., de Kroon, C.D., van den Tillaart, S.A., Louwe, L.A., Trimbos-Kemper, G.C., & Jansen, F.W. (2008). A randomised comparison of vaginoscopic office hysteroscopy and saline infusion sonography: a patient compliance study. BJOG, 115, 1232-1237.
- Van Dongen, H., Timmermans, A., Jacobi, C.E., Elskamp, T., de Kroon, C.D., & Jansen, F.W. (2011). Diagnostic hysteroscopy and saline infusion sonography in the diagnosis of intrauterine abnormalities: an assessment of patient preference. Gynecol Surg., 8, 65-70.
- Werbrouck, E., Veldman, J., Luts, J., van Huffel, S., van Schoubroeck, D., Timmerman, D., & van den Bosch, T. (2011). Detection of endometrial pathology using saline infusion sonography versus gel instillation sonography: a prospective cohort study. Fertil Steril, 95, 285-288.
- Yu O, Schulze-Rath R, Grafton J, Hansen K, Scholes D, Reed SD. Adenomyosis incidence, prevalence and treatment: United States population-based study 2006-2015. Am J Obstet Gynecol. 2020 Jul;223(1):94.e1-94.e10.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
||||||||||||||||||||||||
|
Champaneri, 2010 |
Type of study: Systematic review with meta-analysis.
Searched in databases: Embase, Medline, PsycInfo, DARE, Cochrane Library and MEDION (a database of diagnostic test reviews) from database inception to June 2010.
Setting: The systematic review was conducted based on a prospective protocol designed using widely recommended methods
Country: UK
|
Inclusion criteria:
-premenopausal women (some studies also gave data on postmenopausal women) -ultrasound scan or MRI -Reference standard: histological diagnosis of adenomyosis or adenomyoma. -Study design: studies in which test and reference standard were compared in the same individuals.
Articles included in systematic review n = 23(n= 2,312 women) MRI n = 4 Ultrasound n = 14 MRI & Ultrasound n = 5
Articles included in meta-analysis; n = 6 (MRI n = 3; Ultrasound n = 6) |
ultrasound scan or MRI
Cut-off point(s): |
histological diagnosis of adenomyosis or adenomyoma.
Cut-off point(s): |
Endpoint of follow-up: unclear
For how many participants were no complete outcome data available? Unclear
|
Outcome Sensitivity and specificity LR+ and LR- (A test with a LR+ of >5 or a LR- <0.2 are regarded as moderately useful)
Results (pooled) Transvaginal ultrasound sensitivity: 72% (95% CI 65–79%), (Inconsistency (I-square) = 78.4 %) specificity of 81% (95% CI 77–85%), (Inconsistency (I-square) = 88.5 %) LR+: 3.7 (95% CI 2.1–6.4) LR-: 0.3 (95% CI 0.1–0.5). MRI sensitivity of 77% (95% CI 67–85%), Inconsistency (I-square) = 39.9 % specificity of 89% (95% CI 84–92%), Inconsistency (I-square) = 3.5 % positive likelihood ratio: 6.5 (95% CI 4.5–9.3), negative likelihood ratio: 0.2 (95% CI 0.1–0.4). |
Quality of evidence: high |
||||||||||||||||||||||||
|
Meredith, 2009 |
Type of study: Systematic review and metaanalysis Searched in databases: Medline, Embase, Current Contents, Silver Platter, Covhrane Library. 1966-2007. Setting: This systematic review was preceded by a detailed study protcol that followed published guidelines for metaanalyses and systematic reviews evaluating screening and diagnostic tests. Country: US |
Inclusion criteria:
Studies that included women who underwent TVS for the assessment of uterine pathology
14 trials included in analysis (N = 1898) |
TVS |
pathology after hysterectomy confirmed the diagnosis of adenomyosis
|
Endpoint of follow-up: unclear; N/A
For how many participants were no complete outcome data available? N (%) unclear
Reasons for incomplete outcome data described?
|
Outcome: sensitivity and specificity TVS Results: for symptomatic patients: Sensitivity: 84.3 (CI 76.3-93.2) Specificity: 82.3 (CI 72.5-93.5)
|
Vergelijkt niet TVE met MRI, maar met pathology. Hele brede inclusiecriteria; dus patientengroep niet duidelijk
Heterogeniteit
Quality of evidence: high
|
||||||||||||||||||||||||
|
De Kroon, 2003 |
Type of study: Systematic review and metaanalysis Searched in databases: Medline, Embase, Current Contents, Science Citation Index, NLM-gateway, Bandolier, DARA, Conchrane. 1965-March 2003.
Setting:
Country: The Netherlands |
Inclusion criteria: report on diagnostic accuracy of saline contrast hysterosonography in abnormal uterine bleeding compared with either hysteroscopy or hysterectomy as gold standard. Women: pre and postmenopausal Evaluation of uterine cavity Complaining of abnormal uterine bleeding
The yidentified 36 articles; finally 24 studies remained for metaanalysis (including 2278 procedures). 16 studies (877 procedures) with homogenous data. |
saline contrast hysterosonography |
either hysteroscopy with or without histological sampling or hysterectomy |
Endpoint of follow-up: N/A
For how many participants were no complete outcome data available? N (%) unclear
Reasons for incomplete outcome data described?
|
Outcome: The pooled sensitivity and specificity Results: The largest population of homogeneous data were the studies with complete verification. In these studies, the pooled sensitivity and pooled specificity of saline contrast hysterosonography in uterine cavity evaluation were respectively 0.95 (95% CI 0.93 to 0.97) and 0.88 (95% CI 0.85 to 0.92), LR+ 8.23 (CI 6.22-10.9) LR- 0.06 (CI 0.04-0.09) |
Pre en post-menopausal bloedverlies samen, maar ook aparte berekening gedaan naar sens en spec. Abnormaal uterien bloedverlies is een begrip met grote spreiding.
Quality of evidence: high
|
||||||||||||||||||||||||
|
Van Dongen, 2008 |
Type of study: RCT
Setting: University Hospital Jan 2006 – July 2007
Country: Leiden, The Neherlands
Source of funding: none
|
Inclusion criteria: Women with an indication for further investigation of the uterine cavity. (AUB, infertility, other)
Exclusion criteria: Previous office hysteroscopy or SIS, uterus >12 weeks, contracindication for SIS/hysteroscopy
N= 100; 97 analysed (50 SIS, 47 hysteroscopy)
Mean age ± SD: 44.8 (CI 42.1-47.5) 44.4 (CI 42.9-46.9) p=0.774
Sex: % M / % F: N/A
Other important characteristics: Mostly premenopausal SIS: 84%, Hyst: 83% AUB: 86% - 89% |
Indextest: SIS
|
Reference test: vaginoscopic office hysteroscopy
Cut-off point(s): |
Endpoint of follow-up: N/A
For how many participants were no complete outcome data available? N (%) 3 (%)
Reasons for incomplete outcome data described? Yes
|
Outcome measures: -visual analogue scale (VAS) for pain - present pain intensity (PPI) scale
Effect size (include 95%CI and p-value if available):
SIS vs office hysteroscopy VAS, mean: 2.7 (CI 2.0-3.4) vs 4.0 (CI 3.4-4.6) p 0.010 VAS > 7: 1 (2%) vs 2 (4%) p 0.521 PPI, median: 1 (range 0-5) vs 2 (0-4) p 0.004 PPI >2: 6 (12%) vs 10 (20%) p 0.219
|
Randomisatie: + Toewijzing verborgen: - Behandelaar geblindeerd: - Patiënt geblindeerd: - Effectbeoordelaar geblindeerd: - Interventie- en controlegroep vergelijkbaar: + Follow-up voldoende (≥80%): + Intention-to-treat analyse: - Financiering: nvt Overig: dit zijn niet alleen vrouwen met menorrhagie
Quality of evidence: moderate
|
||||||||||||||||||||||||
|
Soguktas, 2012 |
Prospective cohort study
Istanbul, Turkey |
Inclusion criteria: premenopausal women with abnormal uterine bleeding such as menorrhagia, metrorrhagia, menometrorrhagia and polymenorrhea related to intracavitary pathology
Exclusion criteria: infection, pregnancy, abnormal uterine bleeding without intracavitary pathology
N= 89 patients
Mean age ± SD: Mean age: 43.1 (± 2.9 yrs)
Other important characteristics: |
TVS, SIS, HS by different physicians blindly |
pathology |
Endpoint of follow-up:
For how many participants were no complete outcome data available? N (%)
Reasons for incomplete outcome data described?
|
Outcome measures: The positive and negative likelihood ratios (LR+ and LR, area under the curve (AUC)
Effect size (include 95%CI and p-value if available): Any abnormality:
When the three procedures were compared with each other separately, HS and SIS similar diagnostic accuracy (p=0.08), but diagnostic accuracy of HS and SIS was found to be superior of TVS (p1=0.000, p2=0.000)
|
Randomisatie: - Toewijzing verborgen: - Behandelaar geblindeerd: Patiënt geblindeerd: - Effectbeoordelaar geblindeerd: - Interventie- en controlegroep vergelijkbaar: +/- Follow-up voldoende (≥80%): + Intention-to-treat analyse: - Financiering: nvt Overig:
Quality of evidence: moderate |
||||||||||||||||||||||||
|
Werbrouck, 2011 |
Prospective cohort study
Leuven, Belgium
Oct 2004 – Dec 2008 |
Women presenting at the Bleeding Clinic
Mean age: 50. 7 (12.0) vs 50.2 (11.2)
N: 804 patients
53 ns 57.2 % premenopausal
First 402 women: SIS Next 402: GIS
|
SIS and GIS |
After contrast sonography, office hysteroscopy was performed in 685 patients (367 of the SIS group versus 318 of the GIS group). The endometrium was sampled in 487 patients, and 274 women underwent subsequent surgery. In the SIS group, 131 women underwent operative hysteroscopy and 14 women had a hysterectomy versus 99 and 30, respectively, in the GIS group. |
Endpoint of follow-up: N/A
For how many participants were no complete outcome data available? N (%)?
Reasons for incomplete outcome data described?
|
Outcome: and final diagnosis. Pathology was diagnosed in 180 patients (49%) of the SIS group versus 147 patients of the GIS group (40.2%). The sensitivity was 77.8% and 85.0%, respectively (NS). Specificity was 80.7% and 78.1% (NS)
|
Quality of evidence: low |
||||||||||||||||||||||||
|
Bij de Vaate, 2010 |
Prospective cohort study
The Netherlands
Sept 2007-April 2008 |
Inclusion:65 women suspected for having an intrauterine abnorality with an indication for SCSH/GIS. heavy and/or irregularmenstrual bleeding (49%) or infertility (20%) Exclusion: risk PID, cervical cancer, pregnancy or possibility of pregnancy N: 65 Mean age: ? No patients characteristics |
First SCSH (Saline contrast sonohysterography) |
Subsequently GIS |
Endpoint of follow-up: N/A
For how many participants were no complete outcome data available? N (%)?
Reasons for incomplete outcome data described?
|
Outcome measures: (primary: difference in distension). Secondary: VAS VAS scores for pain experienced on SCSH and GIS were 1.5 and 1.6, respectively (P = 0.62).
|
De auteurs onderkennen een aantal valkuilen van de studie, zoals de subjectiviteit van de beeldkwaliteitscore (observer bias) en review bias, door de beoordeling van beide technieken door dezelfde echoscopist met voorkennis van de resultaten van de SIS bij evaluatie van de GIS-echo. Ook werd mogelijk de VAS-score van de GIS beïnvloed doordat de catheter na de SIS-echo in de uterus aanwezig bleef. Aangezien beide technieken dezelfde mate van afwijkingen detecteerden, lijkt er voor tweedimensionale contrastechoscopie niet veel meerwaarde van GIS te zijn.
Quality of evidence: low |
||||||||||||||||||||||||
|
De Kroon, 2004 |
prospective diagnostic trial
|
Inclusion: All premenopausal and postmenopausal women with abnormal uterine bleeding who were suspected of having intrauterine abnormalities were eligible for this study Exclusion: women with AUB but without abnomral findings on TVS
49 women (45 left for evaluation); First SIS, then 3D. in cases of intrauterine abnormalities surgical hysteroscopy was performed
Mean age: 42.3 (range 27-70)
91.1% premenopausal 60.0% menorrhagia |
SIS, 3D-SIS |
(hyseroscopy, endometrial sampling and clinical follow-up)
Surgical hysteroscopy was performed in 22 women (48.9%), and endometrial biopsy was performed in an additional 7 women (15.5%). Therefore, pathologic specimens were available for evaluation in 29 women (64.4%) |
Endpoint of follow-up: at least 9 months; mean 10.7, range 9-13 months.
For how many participants were no complete outcome data available? N (%)? 4
Reasons for incomplete outcome data described? Yes
|
Outcome: sensitivity and specificity
Results:
|
Quality of evidence: moderate
|
||||||||||||||||||||||||
|
Grimbizis, 2010
|
Type of study: Prospective, blind, comparative study Setting: 2004-2006
Country: Greece
Source of funding: |
Inclusion criteria: Premenopausal women presenting with abnormal uterine bleeding, infertility patients, postmenopausal women with vaginal bleeding
Exclusion criteria: PID, pregnancy, recent uterine sugery,
N= 105; 7 excluded (they did not undergo all 3 procedures)
Mean age ± SD: 43.3 (range 26-71)
Sex: % M / % F
Other important characteristics: 55 premenopausal with AUB 28 infertility 22 postmenopausal |
TVS, SIS, next day:HS (different examiners; blinded) |
Based on combined hysteroscopic and histologic results |
Endpoint of follow-up: N/A
For how many participants were no complete outcome data available? N (%) 7/105
Reasons for incomplete outcome data described? Yes |
Outcome measures: sensitivity and specificity, LR+, LR-. Any abnormality.
Effect size (include 95%CI and p-value if available):
|
Quality of evidence: moderate |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-06-2025
Beoordeeld op geldigheid : 11-06-2025
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Samenstelling van het cluster
Voor het ontwikkelen van Benigne Gynaecologie cyclus 2 is in 2023 een multidisciplinaire cluster ingesteld. Dit cluster bestaat uit vertegenwoordigers van alle relevante organisaties die betrekking hebben op de zorg voor patiënten met hevig menstrueel bloedverlies, patiënten in de menopauze en patiënten met EUG of ZOL.
Het cluster Benigne Gynaecologie bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule.
Het cluster Benigne Gynaecologie cyclus 2 bestaat uit de onderstaande personen. Voor een overzicht per module, zie Samenstelling van de werkgroep. Sommige werkgroepleden zijn schrijver en meelezer bij meerdere modules.
Clusterstuurgroep
- (Voorzitter) Timmermans, Mevr. dr. A. (Anne), gynaecoloog, AmsterdamUMC, Amsterdam, NVOG
- Breijer, Mevr. dr. M.C. (Merel), gynaecoloog, ADRZ, Goes en Vlissingen, NVOG
- Lips, Dhr. dr. D.J. (Daan), gastrointestinaal/oncologisch chirurg met HPB specialisatie, MST, Enschede, NVvH
- Radder, Mevr. Dr. C.M. (Celine), gynaecoloog, OLVG, Amsterdam, NVOG
Schrijvers module Beeldvormende diagnostiek
- Kaijser, Dhr. drs. J. (Jeroen), gynaecoloog, Ikazia Ziekenhuis, Rotterdam, NVOG
- Nieuwenhuis, Mevr. dr. L.L. (Lotte), gynaecoloog, Hagaziekenhuis, Den Haag, NVOG
Meelezers module Beeldvormende diagnostiek
- Bosch, Mevr. M. (Marlies), patiëntenvertegenwoordiger, Stichting Bekkenbodem4All
- Bruijn, de Mevr. drs. A.M. (Annefleur) de, gynaecoloog i.o. (aios), Spaarne Gasthuis, Haarlem, NVOG
- De Bie, Mevr. B.L.F. (Bianca), patiëntenvertegenwoordiger, Endometriose Stichting
- Geomini, Mevr. dr. P.M.A.J. (Peggy), gynaecoloog, MaximaMC, Eindhoven en Veldhoven, NVOG
- Janssen, Mevr. dr. C.A.H. (Ineke), gynaecoloog, Groene Hart Ziekenhuis (GHZ), Gouda, NVOG
- Schrojenstein Lantman, Mevr. Ir. E.S. (Esther) van, klinisch fysicus, Albert Schweitzer ziekenhuis (ASz), Dordrecht, Zwijndrecht en Sliedrecht en Beatrix Ziekenhuis, Gorinchem, NVKF
- Venmans, Dhr. Dr A. (Alexander), interventieradioloog, Elisabeth-TweeSteden Ziekenhuis (ETZ), Tilburg, NVvR
Met ondersteuning van
- Dederen, MSc. dhr. T.A. (Thibaut), junior adviseur bij het Kennisinstituut van de Federatie Medisch Specialisten, Utrecht, FMS
- Labeur, MSc. Y.J. (Yvonne), adviseur bij het Kennisinstituut van de Federatie Medisch Specialisten, Utrecht, FMS
- Lee, PhD. Mevr. J.H. (Hanneke) van der, senior adviseur bij het Kennisinstituut van de Federatie Medisch Specialisten, Utrecht, FMS
- Tuijtelaars, dr. J. (Jana), adviseur bij het Kennisinstituut van de Federatie Medisch Specialisten, Utrecht, FMS
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterstuurgroepleden en actief betrokken expertisegroepsleden (fungerend als schrijver en/of meelezer bij tenminste één van de geprioriteerde richtlijnmodules) hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een richtlijnmodule worden wijzigingen in belangen aan de projectleider doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase. Een overzicht van de belangen van de clusterleden en betrokken expertisegroepsleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
Tabel 2. Gemelde (neven)functies en belangen stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Timmermans* |
Gynaecoloog; Amsterdam UMC; 0.8 fte |
Lid commissie kwaliteitsdocumenten NVOG (onbetaald); projectgroep Gynae Goes Green NVOG (onbetaald) |
Geen |
Geen restricties |
|
Breijer |
Gynaecoloog Admiraal De Ruyter Ziekenhuis |
Lid commissie kwaliteitsdocumenten NVOG namens pijler gynaecologie, onbetaald |
Geen |
Geen restricties |
|
Lips |
Chirurg, Chirurgencoöperatie Oost-Nederland Enschede, Medisch Spectrum Twente |
Medisch Manager, afdeling chirurgie. Medisch voorzitter, Chirurgencooperatie ChirCON |
Proctor, Intuitive Surgical |
Geen restricties |
|
Radder |
Gynaecoloog te OLVG in Amsterdam, 1.0 fte |
Registratiecommissie Obstetrie en Gynaecologie van NVOG, onbetaald Clusterstuurgroep koploperproject richtlijnen 2.0 FMS, betaald |
Geen |
Geen restricties |
*Voorzitter cluster Benigne Gynaecologie
Clusterexpertisegroep
Tabel 3. Gemelde (neven)functies en belangen expertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bosch |
Stichting Bekkenbodem4All: PR en Belangenbehartiging |
'Fotograaf en journalist voor diverse kerkelijke bladen. Soms betaald, meestal niet. |
We hebben een informatieve functie als belangenbehartiger voor het welzijn van patiënten met bekkenbodemklachten in het algemeen. |
Geen restricties |
|
Bruijn, de |
Aios gynaecologie |
Geen |
Geen |
Geen restricties |
|
De Bie |
Voorzitter en projectleider bij Endometriose Stichting |
Geen |
In loondienst als projectleider van de Endometriose Stichting Een nieuwe up to date richtlijn voor endometriose zou voor ons als patientenorganisatie van grote toegevoegde waarde zijn voor de verbetering van de behandeling van die patientengroep |
Geen restricties |
|
Geomini |
Peggy Geomini, gynaecoloog Maxima MC |
Geen |
Live demonstratie Novasure endometriumablatie onder lokaal anesthesie voor binnenlandse en buitenlandse collega's die door Hologic worden uitgenodigd. Voor deze werkzaamheden ontvang ik een financiele vergoeding van Hologic ACCEPT studie: kwaliteit van leven onderzoek naar vrouwen met ovariumcyste ZonMW Kwaliteit van leven onderzoek naar vrouwen met ovariumcyste |
Geen restricties |
|
Janssen |
Gynaecoloog GHZ Gouda |
Lid externe klachtencommissie HMC, vacatievergoeding |
Consortiumstudie Myomex-2, geen projectleider |
Geen restricties |
|
Kaijser |
Gynaecoloog Ikazia Ziekenhuis, Rotterdam |
Cursusinstructeur Echografie van het vergrote ovarium: Nederlandse IOTA cursus. Jaarlijkse eendaagse cursus. Accreditatie via NVOG Kleine financiële vergoeding. |
Geen |
Geen restricties |
|
Nieuwenhuis |
Gynaecoloog, Hagaziekenhuis |
Lid NVOG commissie Echo onderwijs Lid NVOG commissie Preventie |
Geen |
Geen restricties |
|
Schrojenstein Lantman |
Klinisch Fysicus, Albert Schweitzer Ziekenhuis |
Klinisch fysicus, Rivas Zorggroep |
Geen |
Geen restricties |
|
Venmans |
Interventieradioloog, 1 fte, vakgroep radiologie ETZ ziekenhuis te Tilburg |
Wetenschappelijke Commissie Interventie Radiologie (WCIR) Examencommissie NVvR Koploperproject benigne gynaecologie, module embolisatie versus chirurgie bij myomen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van relevante patiëntenorganisaties aan de need-for-update, de prioritering en de ontwikkeling van modules. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijnmodules zijn tevens ter commentaar voorgelegd aan de relevante patiëntenorganisaties in de expertisegroep (zie ‘Initiatief en autorisatie’ onder ‘Verantwoording’). De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Tabel 4. Kwalitatieve raming
|
Module |
Uitkomst raming |
Toelichting |
|
Module HMB Beeldvormende diagnostiek |
Geen financiële gevolgen |
p.57-59 (implementatieplan module Beeldvormende diagnostiek) |
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn is digitaal verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Daarnaast wordt een samenvatting van de richtlijn gepubliceerd in het Nederlands Tijdschrift voor Geneeskunde en in tijdschriften van de deelnemende wetenschappelijke verenigingen. Ook is de richtlijn te downloaden vanaf de website van de Nederlandse Vereniging voor Radiologie en Nederlandse Vereniging voor Obstetrie en Gynaecologie en via de website van de Kwaliteitskoepel.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase (september-oktober, 2023) inventariseerde het cluster de geldigheid van de richtlijnmodules binnen het cluster. Ook was er de mogelijkheid om nieuwe onderwerpen aan te dragen die aansloten bij één (of meerdere) richtlijn(en) behorend tot het cluster. Naast de partijen die deelnemen aan de stuur- en expertisegroep zijn hier ook andere stakeholders voor benaderd.
Deze betrokken partijen betroffen:
Beroepsvereniging Verzorgenden Verpleegkundigen (V&VN)
Endometriose Stichting
Inspectie Gezondheidszorg en Jeugd (IGJ)
KBO-PCOB (samenwerkingsverband inmiddels opgeheven)
Nederlandse Vereniging van Ziekenhuisapothekers (NVZA)
Nederlandse Vereniging van Ziekenhuizen (NVZ)
Nederlandse Vereniging voor Anesthesiologie (NVA)
Nederlandse Vereniging voor Bekkenfysiotherapie (NVFB)
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV)
Nederlandse Vereniging voor Heelkunde (NVvH)
Nederlandse Vereniging voor Hematologie (NVvH) via NIV
Nederlandse Vereniging voor Kindergeneeskunde (NVK)
Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC)
Nederlandse Vereniging voor Klinische Fysica (NVKF)
Nederlandse Vereniging voor Medische Microbiologie (NVMM)
Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
Nederlandse Vereniging voor Psychiatrie (NVvP)
Nederlandse Vereniging voor Radiologie (NVvR)
Nederlandse Vereniging voor Urologie (NVU)
Nederlandse Vereniging voor Vulva Pathologie (NVvVP)
Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVVS)
Stichting Bekkenbodem4All (BB4All)
Vereniging van Klinische Genetica Nederland (VKGN)
Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
Vuurvrouw
Werkgroep Psychosomatische Obstetrie en Gynaecologie (WPOG)
Zelfstandige Klinieken Nederland (ZKN)
Zorginstituut Nederland (ZiNL)
Zorgverzekeraars Nederland (ZN)
In de 1e cyclus is per richtlijnmodule aangegeven of deze geldig is, herzien moet worden, kan vervallen of moet worden samengevoegd. In de 2e cyclus is dit overzicht van cyclus 1 opnieuw beoordeeld door de stuurgroep. De richtlijnmodules die mogelijk herzien moesten worden, werden doorgezet naar de prioriteringsronde. Ook suggesties voor nieuwe richtlijnmodules (afkomstig van de uitvraag bij bovenstaande stakeholders en expertiseleden) werden doorgezet naar de prioriteringsronde.
De prioriteringsronde is uitgevoerd door de stuur- en expertisegroep, en gebundeld per vereniging. Daarna werd de RE-weighted Priority-Setting (REPS) – tool gebruikt, om tussen verenigingen te ranken. De uitkomst (ranklijst) van de schriftelijke prioritering werd gebruikt als uitgangspunt voor de discussie. De definitieve top-5 is afgestemd door de stuurgroep.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd indien mogelijk gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
Tabel 5. Gradaties voor de kwaliteit van wetenschappelijk bewijs
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in een richtlijnmodule volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel 6. Sterkte van de aanbevelingen
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de richtlijnmodule Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodules zijn voorgelegd aan alle partijen die beschreven zijn in Tabel 1. Initiatief en autorisatie (dit voorstel is vooraf met alle betrokken partijen afgestemd). De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werden de conceptrichtlijnmodules aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd ter autorisatie of goedkeuring voorgelegd aan de partijen die beschreven staan bij ‘Initiatief en autorisatie’ onder ‘Verantwoording’.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
|
Wat is de sensitiviteit en specificiteit van een transvaginale echoscopie (inclusief water- en gelecho) ten opzichte van MRI en hysteroscopie in het aantonen van A: myomen en adenomyose B: intracavitaire pathologie?
Database: Medline (OVID) 2000-maart 2012 Engels
|
17 ultrasonography.fs. (172901) 18 exp Ultrasonography/ (221751) 19 ("vaginal sonography" or "transvaginal ultrasonography" or "transvaginal sonography" or TVS or "saline infusion sonography" or SIS or ultrasound or "saline contrast hysterosonography" or "endovaginal ultrasound").ti,ab. (133813) 20 17 or 18 or 19 (349955) 21 11 and 20 (1605) 27 "Endometrial Neoplasms"/us [Ultrasonography] (528) 28 "Endometriosis"/us [Ultrasonography] (448) 29 27 or 28 (966) 30 21 or 29 (2393) 31 limit 30 to (english language and yr="2000 -Current") (1260) 32 Hysteroscopy/ (3183) 33 exp Magnetic Resonance Imaging/ (259842) 34 ("Magnetic Resonance Imaging" or MRI).ti,ab. (174626) 35 Hysteroscop*.ti,ab. (4179) 36 32 or 33 or 34 or 35 (314494) 74 31 and 36 (417) 75 exp "Sensitivity and Specificity"/ (349891) 76 (Sensitivity or Specificity).ti,ab. (621998) 77 (predict* or ROC-curve or receiver-operator* or differen* or risk or probability).ti,ab. (4660673) 78 exp risk/ (701435) 79 exp Probability/ (795137) 80 (likelihood or LR*).ti,ab. (89357) 81 exp Diagnostic Errors/ (84988) 82 (inter-observer or intra-observer or validity or kappa).ti,ab. (139457) 83 reproducibility.ti,ab. (42055) 84 "Reproducibility of Results"/ (226284) 85 accuracy.ti,ab. (184362) 86 Diagnosis, Differential/ (350216) 87 or/75-86 (5879496) 90 74 and 87 (268) 91 89 and zoekfilter SR (28) 120 exp epidemiological study/ (1386866) 157 90 and 120 (104) 158 90 and 151 (153) (filter RCT –Cochrane) 159 limit 90 to (clinical trial, all or clinical trial or comparative study or controlled clinical trial or evaluation studies or government publications or guideline or meta analysis or multicenter study or practice guideline or randomized controlled trial or "research support, american recovery and reinvestment act" or research support, nih, extramural or research support, nih, intramural or research support, non us gov't or research support, us gov't, non phs or research support, us gov't, phs or "review" or validation studies) (163) 160 157 or 158 or 159 (217) |
235 |