Opportunistische Salpingectomie
Uitgangsvraag
Dient een patiënte met een benigne gynaecologische aandoening die intra-abdominaal geopereerd wordt, een opportunistische salpingectomie (OS) beiderzijds te worden aangeboden indien er sprake is van voltooide kinderwens?
Deze klinische vraag bevat de volgende deelvragen:
- Verlaagt het verrichten van een OS het risico op ovariumcarcinoom?
- Wat is het risico op per- en postoperatieve complicaties van een OS?
- Leidt een OS tot verandering van ovariële functie (te weten: afname ovariële reserve Anti-Müllerian hormone (AMH), toename menopauzale symptomen, verandering van de hormoonproductie en/of vervroegde menopauze)? Voor zowel pre- als postmenopauzale vrouwen.
Clinical question
Should a patient with a benign gynaecological condition undergoing intra-abdominal surgery be offered an opportunistic salpingectomy (OS) on both sides if her desire to have children is fulfilled?
This clinical question includes the following underlaying questions:
- Does performing an OS reduce ovarian cancer (OC) risk?
- What is the risk of per- and postoperative complications of an OS?
- Does an OS lead to changes in ovarian function? (e.g., reduction of ovarian reserve, increase of menopausal symptoms, changes in hormone production or early menopause) for both pre- and postmenopausal women.
Aanbeveling
Overweeg patiënten te counselen over de opportunistische salpingectomie, waarbij het volgende besproken kan worden:
- Er zijn aanwijzingen dat er een risico-reducerend effect is op eierstokkanker, maar het bewijs is nog van lage kwaliteit.
- Er lijkt geen verhoogd risico op chirurgische complicaties te zijn.
Er lijkt op korte termijn geen effect op de ovariële reserve te zijn; effecten op lange termijn zijn nog niet bekend.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Door vrouwen met een voltooide kinderwens een opportunistische salpingectomie (OS) aan te bieden kunnen zij indien gewenst hun kans op het ontwikkelen van ovariumcarcinoom mogelijk verkleinen. Aan de hand van de huidige evidence wordt een risico reducerend effect variërend van 42-64% verwacht. Omdat de bewijskracht hiervoor is beoordeeld als zeer laag blijft het onzeker wat het precieze effect van een OS op het ontwikkelen van ovariumcarcinoom is. De reden voor deze lage bewijskracht is dat er in twee van de zes studies niet gecorrigeerd is voor belangrijke confounders en er weinig events waren. Ondanks de lage bewijskracht is de OS al in meerdere landen geïmplementeerd. Ofschoon er verder onderzoek nodig is om het risico reducerende effect van de opportunistische salpingectomie aan te tonen kan er overwogen worden om vrouwen die in aanmerking komen voor een OS hiervoor te counselen.
Belangrijk is om bij het aanbieden van de OS in acht te houden dat het absolute risico op het ontwikkelen van ovariumcarcinoom klein is. De risico’s van de OS moeten dus altijd worden afgewogen tegen de voordelen. Deze mogelijke voor- en nadelen van OS kunnen per individu verschillend zijn. De behandelaar kan de patiënt counselen over het feit dat het uitvoeren van OS niet altijd mogelijk blijkt tijdens de operatie, zoals bij uitgebreide adhesies. De operateur kan te allen tijde tijdens de operatie afzien van OS indien de risico’s te groot blijken.
Op basis van de gevonden evidence is het onzeker wat het effect op het aantal per- en postoperatieve complicaties bij het uitvoeren van een OS ten tijde van een intra-abdominale ingreep voor een andere indicatie. Er zijn echter ook geen aanwijzingen dat er een verhoogd aantal per- en postoperatieve complicaties is. Daarom wordt aanbevolen patiënten te counselen dat het onzeker is of een OS het risico op per- en postoperatieve complicaties vergroot, maar dat het vanwege het type ingreep onwaarschijnlijk wordt geacht dat dit zo is. Deze aanbeveling wordt gebaseerd op de Cochrane review van van Lieshout et al, waarin 7 RCT’s zijn geïncludeerd. Hierin wordt benoemd dat het aantal complicaties in de beoordeelde studies erg laag was, met de kanttekening dat complicaties bij dit type ingrepen in het algemeen zeldzaam zijn en er daarom grote studies met grote aantallen deelnemers nodig zijn om te bepalen of er een verschil is in het aantal per- en postoperatieve complicaties tussen vrouwen die wel en niet een OS ondergaat ten tijde van een hysterectomie. Zij concluderen dat zij met het gelimiteerde aantal studies en deelnemers niet in staat waren om mogelijke verschillen te detecteren. Op basis van het hoge risico op bias en het lage aantal events in de geïncludeerde studies is het bewijs voor deze uitkomstmaat beoordeeld als ‘zeer laag’.
Voor de derde uitgangsvraag zijn een systematic review en een RCT beoordeeld (van Lieshout, 2019, Vahedpour 2020). De bewijskracht is als ‘laag’ beoordeeld, vanwege risk of bias en imprecisie in de geïncludeerde studies. De gepoolde analyse van deze data laat een gemiddeld verschil van -0.21 (95% BI -0.60 – 0.18, p=0.29) in de postoperatieve AMH-waarde ten faveure van de groep die geen OS heeft gehad zien. Op basis hiervan wordt geconcludeerd dat de data suggereert dat een OS geen effect heeft op de ovariële reserve. Echter, het is onzeker wat deze trend voor klinische betekenis heeft. Daarom wordt op dit moment STOPOVCA-young-studie uitgevoerd om te onderzoeken wat het langetermijneffect van een OS is op de leeftijd van de menopauze (Gelderblom, 2022).
Waarden en voorkeuren van patiënten
Gelderblom et al (2021) hebben in een mixed-method-studie gekeken naar OS vanuit patiënten perspectief. De belangrijkste barrière voor patiënten bij het nemen van de beslissing om al dan niet OS te ondergaan, is dat ze niet op de hoogte zijn van de mogelijkheid. Patiënten missen kennis over de voordelen, nadelen en de omvang van de interventie, wat een weloverwogen beslissing in de weg staat. Adequate informatie over alle aspecten van de operatie is essentieel om patiënten participatie in besluitvorming mogelijk te maken. Of patiënten OS willen ondergaan, hangt af van hun persoonlijke overtuigingen en waarden. Hoewel gezondheidszorg professionals vaak het gevoel hebben dat ze weten wat belangrijk is voor patiënten, is dit niet altijd waar. De bevindingen van Gelderblom et al laat discrepanties zien tussen reacties van patiënten en professionals in het domein van de emoties en motivatie van de patiënt.
Uit de studie van Gelderblom et al (2021) blijkt dat voor patiënten de belangrijkste barrière voor een OS, gebrek aan kennis is over: het bestaan van de OS, grootte van de operatie en de mogelijke nadelen die eraan verbonden zijn. Bovendien geven sommige patiënten hun terughoudendheid aan omdat zij zorgen hebben over het verwijderen van gezonde organen.
Kosten (middelenbeslag)
Naumann et al (2021) heeft kosteneffectiviteit van een OS onderzocht. Het gebruikte Markov model in deze studie voorspelt dat OS in plaats van tubaligatie, de sterfte aan ovariumcarcinoom met 8,13% zal verminderen. OS toevoegen aan een hysterectomie zal de sterfte aan eierstokkanker met 6,34% verminderen. Beide strategieën zijn kosteneffectief wanneer alleen de kosten van de OS worden meegenomen. De extra kosten van OS in plaats van tubaligatie waren $ 433,91 met een ICER (incrementele kosteneffectieve verhouding) van $ 6401 per levensjaar en $ 5469 per QALY bij correctie voor OC met een utility van 0,64. De ICER voor OS tijdens hysterectomie tegen een kostprijs van $ 124,70 was $ 2006 per levensjaar en $ 1667 per QALY. In deze studie lijkt OS een aanzienlijke besparing in de gezondheidszorg op te leveren. Gebruikmakend van een disconteringsvoet van 3%, wordt geschat dat de totale besparingen voor universele salpingectomie in de Verenigde Staten kunnen oplopen tot $ 445 miljoen per jaar. Een sensitiviteitsanalyse rond het voordeel van OS suggereert dat deze procedure kosteneffectief zal zijn, zelfs als salpingectomie slechts een bescheiden vermindering van het risico op OC oplevert. In Nederland is een dergelijke studie tot op heden niet uitgevoerd.
De extra kosten van een OS zijn zeer gering (ervan uitgaande dat de verwijderde tubae niet ingestuurd worden voor PA-onderzoek) (Samini, 2018). Ook al is de vermindering van het risico op OC maar heel gering, het verrichten van een OS zal kosteneffectief zijn. Dit wordt ondersteunt door de Amerikaanse studie van Naumann et al. (2021)
Aanvaardbaarheid, haalbaarheid en implementatie
Gelderblom et al (2021) hebben in een mixed method studie behalve naar het patiënten perspectief op implementatie van de OS, ook het perspectief van de professional onderzocht. In deze studie geven professionals aan dat ze vaker zouden adviseren tot OS als ze toegang hadden tot begeleidingsmateriaal en als er meer bewijs was over de effectiviteit ervan met betrekking tot risicovermindering en lange termijneffecten van OS zoals het begin van de menopauze. Als barrières voor implementatie van OS worden genoemd: de behoefte aan meer operatietijd, toename van de consultduur, onduidelijkheid over facturatie van de OS en welke diagnose-behandelcombinatie een OS bevat. Tenslotte geven de professionals aan dat het opnemen van OS in de richtlijnen van de NVOG, implementatie zou vergemakkelijken.
Voor patiënten
Heb je binnenkort een buikoperatie of sterilisatie waarbij je voor de keuze staat om jouw eileiders te laten verwijderen? In de keuzehulp ‘eileiders weghalen’ krijg je informatie over de verschillende behandelingen. De keuzehulp is er om je te helpen bij het maken van een keuze. Neem de tijd om de informatie door te nemen, zo bereid je je voor op het gesprek met de arts. Samen kies je welke behandeling het beste bij je past.
Bekijk de keuzehulp Eileiders weghalen.
Onderbouwing
Achtergrond
Recente literatuur wijst erop dat de meest voorkomende vorm van ovariumcarcinoom, het hooggradig sereus carcinoom, ontstaat vanuit tubair epitheel. Het profylactisch verwijderen van tubae tijdens een intra-abdominale ingreep voor een andere indicatie, een opportunistische salpingectomie, kan op deze manier voorkomen dat afwijkende cellen ontstaan in het tubaire epitheel. Het aanbieden van een opportunistische salpingectomie kan het risico op ovariumcarcinoom verkleinen. Hiervoor is het van belang inzicht te hebben in de voordelen en risico’s.
Conclusies / Summary of Findings
|
Very low GRADE |
The effect of opportunistic salpingectomy on the occurrence of ovarian cancer is uncertain.
Sources: Darelius, 2021; Falconer, 2015; Hanley, 2022; Lessard-Anderson, 2014; Madsen, 2015 and van Lieshout, 2021 |
|
Very low GRADE |
The effect of opportunistic salpingectomy on complication rate is uncertain.
Sources: van Lieshout, 2019 |
|
Low GRADE |
The evidence suggests that opportunistic salpingectomy does not have a short term effect on ovarian reserve compared to no opportunistic salpingectomy. There is no evidence for long term effects.
Sources: Vahedpour 2020 & van Lieshout, 2019 |
Samenvatting literatuur
Abbreviations used in this literature analysis
|
AMH |
Anti-Müllerian hormone |
|
BRCA |
Breast cancer susceptibility protein (type 1 and type 2) |
|
BSO |
Bilateral salpingo-oophorectomy |
|
EOC |
Epithelial ovarian cancer |
|
FSH |
Follicle-stimulating hormone |
|
HR |
Hazard ratio |
|
ICER |
Incremental cost-effectiveness ratio |
|
IQR |
Interquartile range |
|
IR |
Incidence ratio |
|
LH |
Luteinizing hormone |
|
MD |
Mean difference |
|
OC |
Ovarian cancer |
|
OR |
Odds ratio |
|
OS |
Opportunistic salpingectomy |
|
PID |
Pelvic inflammatory disease |
|
QALY |
Quality-adjusted life year |
|
RCT |
Randomized controlled trial |
|
SR |
Systematic review |
Description of studies for outcome measure-1 (ovarian cancer (OC) incidence)
Darelius (2021) performed a Swedish nationwide register-based case-control study and analysed associations between hysterectomy, salpingectomy, tubal ligation (for a benign reason) and risk reduction of epithelial ovarian cancer (EOC) Type I and II. Type I cancers included low-grade serous carcinomas, mucinous carcinomas, Brenner tumours, low-grade endometroid-, clear cell- and seromucinous carcinomas and Type II carcinoma consisted of high- grade serous carcinoma, high-grade endometroid carcinoma, undifferentiated carcinoma, and malignant mixed mesodermal tumours (carcinosarcoma). Patients (n=4669) were diagnosed with epithelial ovarian-, fallopian tube-, or primary peritoneal-cancer between 2008 and 2014 (6 years) and were classified into Type I or II OC. Ten controls for each case were matched for age, parity, and level of education leading to a total number of 39 100 controls. Exclusion criteria for controls were bilateral oophorectomy or an OC diagnosis prior to entering the cohort. The analysis was controlled for endometriosis, pelvic inflammatory disease and other types of surgical procedures (accounting for more than one procedure of interest in the same patient). The majority of patients (n= 4040) had OCs.
Falconer (2015) conducted a population-based cohort study and assessed if removal of the fallopian tubes for benign indications is associated with a reduction in OC. For comparison, hysterectomy and sterilization were analysed in relation to OC. A cohort of women in Sweden treated between 1973 to 2009 was studied. Four groups, hysterectomy, hysterectomy and concomitant bilateral salpingo-oophorectomy (BSO), salpingectomy and sterilization, were identified as exposures (n= 251 465) and compared to an unexposed population (n= 5 449 119). Exclusion criteria were: 1) any gynaecological surgical procedure before entering the cohort, 2) primary OC before entering the cohort, 3) other inconsistencies in the patient data, and 4) emigrated out of Sweden before entering the cohort. Age at entry was lowest in the salpingectomy group with 37.5 ± 8.9 years and highest in the hysterectomy and BSO group with 63.1 ± 12.0 years. Controls were on average 63.1 ± 12.0 years at entry. In the analysis, adjustments for age, calendar year, parity and education level were performed.
In the Canadian cohort study by Hanley (2022) observed vs expected rates of OC among women who had undergone OS during hysterectomy were compared to those who had undergone hysterectomy or tubal ligation alone. The study period was between 2008 and 2017 and median follow-up (IQR) was 3.2 (1.6 to 5.1) to 7.3 (4.6 to 8.7) years in the intervention and control group respectively. Exclusion criteria were diagnosis of gynaecological cancer before or within 6 months of the procedure and borderline tumours. A total of 25 889 women underwent/had an OS ((mean age ± SD) 40.2 ± 7.1 years) compared to 32 080 (38.2 ± 7.9 years) who did not. At baseline, women in the OS group were older at time of surgery, had fewer live births and pregnancies and were more likely to have endometriosis than those in the control group. The number of EOC in the OS group was less than or equal to 5 (exact numbers not stated due to privacy reasons) and 21 in the control group. There were no cases of serous carcinomas (low and high grade combined) in the OS group compared to 15 in the control group. Due to low numbers of cancer cases, statistical models were not run. Instead, the distribution of the potential confounders across the OS and control groups and their standardized differences were presented.
Lessard-Anderson (2014) performed a population-based case-control study (Minnesota, USA) with the objective to determine the effect of excisional tubal sterilization on subsequent development of EOC or primary peritoneal cancer. All patients with a diagnosis of serous EOC or PPC from 1966 through 2009 were identified. Patients were excluded if they did not have EOC or PPC or did not reside in Olmsted County at the time of diagnosis, if they had fallopian tube carcinoma, or if the cancer was of non-serous histology. A total of 194 patients with a diagnosis of serous EOC or PPC were age matched to two controls without either diagnosis in the index year (i.e., year of diagnosis for the matched case) (n= 388). Age at baseline was 61.4 ± 15.2 years for both groups. Groups were comparable regarding BMI, age at menarche and menopausal status at baseline (see evidence table). Adjustment for confounders was carried out (i.e., age, prior hysterectomy, prior bilateral salpingo-oophorectomy, oral contraceptive use, endometriosis, infertility, gravidity, and parity). Fourteen cases (7.2%) and 46 controls (11.9%) had undergone tubal sterilization.
The Danish nationwide register-based case-control study by Madsen (2015) aimed to explain the role of tubal ligation and salpingectomy in the aetiology of EOC. Cases were women living in Denmark who were first diagnosed with EOC or borderline ovarian tumour in the period 1982 to 2011 and aged 30 to 80 years with no previous cancer. A total of 3241 cases were age matched to fifteen female population controls (n= 194689). Controls were excluded in case of previous bilateral oophorectomy or salpingo-oophorectomy. Adjustment for confounders was carried out (i.e., age, parity, infertility, endometriosis, pelvic inflammatory disease, and hysterectomy). Of the 13 241 cases of EOC n=89 received unilateral salpingectomy and n=17 received a bilateral salpingectomy.
The cohort study by Van Lieshout (2021) was a nationwide population-based database study in the Netherlands. The aim was to determine the protective effect of salpingectomy on OC risk in the Dutch population. OC incidence was compared between women who had undergone salpingectomy for ectopic pregnancy or hydrosalpinx and a control group of women who had not undergone salpingectomy but had a benign dermal nevus removed between January 1990 and December 2012 (22 years). In total n= 18961 cases were compared to n= 23 686 controls. Median age at baseline was 33 years (IQR 29 to 37) for the salpingectomy group and 32 years (IQR 28 to 37) for the control group. Median duration of follow-up was 13.0 years (IQR 8.5 to 18.0) in the salpingectomy group and 13.5 years (IQR 8.7 to 18.6) in the control group. Adjustment for confounders could not be carried out. There were 14 compared to 24 OC cases in the salpingectomy- and control group respectively.
Description of studies for outcome measure-2 (per- and postoperative complications) and 3 (ovarian function)
Van Lieshout (2019) performed a Cochrane review and meta-analysis with the objective to assess the effect and safety of hysterectomy with opportunistic salpingectomy (OS) versus hysterectomy without salpingectomy for OC prevention in women with benign gynaecological conditions undergoing hysterectomy for. Outcomes of interest include the incidence of EOC, surgery-related adverse events and postoperative ovarian reserve. Searches were performed in the Cochrane Gynaecology and Fertility Group trials register, CENTRAL, MEDLINE, Embase, PsycINFO, CINAHL and two clinical trial registers up to January 2019.
Inclusion criteria were: 1) individuals with a population-based risk of OC undergoing surgery for benign gynaecological conditions; 2) RCTs and non-RCTs for outcome incidence of OC, only RCTs for outcome complications and postoperative ovarian reserve. Exclusion criteria were: 1) women with a history of OC; 2) women with an elevated risk of OC based on a proven gene germline mutation such as BRCA1/2 mutation carriers; 3) women who had undergone previous bilateral oophorectomy; 4) women who had undergone previous bilateral salpingectomy. Seven RCT’s (n=350 women) were included in the review (Behnamfar 2017, Findley 2013, Popov 2015, Sezik 2007, Song 2016 Tehranian 2017, van Lieshout 2018).
The samples of the RCTs consisted of 30 to 104 premenopausal women. The intervention carried out was (laparoscopic) hysterectomy with bilateral salpingectomy compared to hysterectomy without salpingectomy. The follow-up was 3 to 6 months. The outcome OC risk was not reported in this review because studies reporting on this outcome measure were lacking. The outcome measure complications was defined as intraoperative and short-term postoperative complication rate, surgical time, estimated blood loss, conversion rate to open surgery (applicable only to laparoscopic and vaginal approaches) and duration of hospital admission. The outcome ovarian function reserve was defined as postoperative hormonal status, menopause-related symptoms, and quality of life.
Vahedpour (2020) conducted a RCT in an Iranian hospital to assess the effects of salpingectomy on the serum level of anti-Müllerian hormone (AMH). Patients were randomly allocated to receive either an abdominal hysterectomy with salpingectomy or an abdominal hysterectomy without salpingectomy. Inclusion criteria were women: 1) aged 30-50 years, 2) with regular menstrual cycles, 3) no history of tubal ligation, oophorectomy, gynaecological malignancies, or hormone replacement therapy and 4) consent for participation. Exclusion criteria were: 1) loss to follow-up; and 2) oophorectomy during hysterectomy. A total of 90 women were included in the study of which 45 in the intervention (mean age 44.4 ± 4.2 years) and 45 in the control group (mean age 45.7 ± 2.9 years). Follow-up time was three months. Loss to follow-up was a total of four patients (two from each group).
Results
1. Reduction in occurrence of OC
Three case control studies (Darelius, 2021; Lessard-Anderson, 2014 and Madsen, 2015) and three cohort studies (Falconer, 2015; Hanley, 2022 and van Lieshout 2021) reported on OC risk. The effect measures differed per study (Table 1). The study by Falconer (2015) did not report absolute numbers, therefore it was not possible to add the data of Falconer to the pooled analysis (Figure 1).
Table 1. Outcome measures of the included studies for assessment of OC risk
|
Study |
Study design |
Outcome measure |
Crude odds measure* |
Adjusted effect measure^ |
|
Darelius, 2021 |
Case control |
OR |
0.35 (0.13 to 0.94) |
Not clear |
|
Lessard-Anderson, 2014 |
Case control |
OR |
0.22 (0.03 to 1.73) |
Not clear |
|
Madsen, 2015 |
Case control |
OR |
0.61 (0.37 to 0.99) |
0.58 (0.36 to 0.95) |
|
Falconer, 2015 |
Cohort study |
HR/IR |
NR |
Adjusted HR: 0.35 (95% CI 0.17 to 0.73) |
|
Hanley, 2022 |
Cohort study |
Observed vs expected OC |
0.29 (0.11 to 0.78) * |
No adjustment for confounders |
|
Van Lieshout 20211 |
Cohort study |
HR/IR |
0.53 (0.07 to 3.93) |
No adjustment for confounders |
* OR derived from data given in the article and calculated using Revman
^ Darelius, 2021: Adjusted for: endometriosis, history of PID and adjustment for other types of surgical procedures to account for more than one procedure of the studied exposures in the same woman
^ Lessard-Anderson, 2014: Adjusted for age, prior hysterectomy, prior bilateral salpingo-oophorectomy, oral contraceptive use, endometriosis, infertility, gravidity and parity
^ Madsen, 2015: Adjusted for age, parity, infertility, endometriosis, pelvic inflammatory disease and hysterectomy
^ Falconer, 2015: Adjusted for age, calendar year, parity, and education
1 Median age at baseline was 33 years (IQR 29 to 37) for the salpingectomy group and 32 years (IQR 28 to 37) for the control group.
Figure 1. OC risk, comparison with and without opportunistic salpingectomy
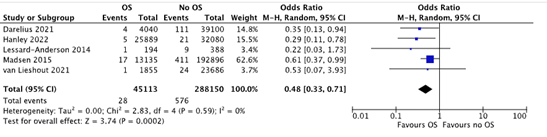 A sensitivity analysis was performed to assess the pooled effect of the case-control studies and cohort studies separately. The results were similar; therefore, all studies were pooled.
A sensitivity analysis was performed to assess the pooled effect of the case-control studies and cohort studies separately. The results were similar; therefore, all studies were pooled.
OC risk was assessed in 45 113 women who received an OS compared to 288 150 control patients who did not receive OS. OC occurred in 28 (0.06%) women in the OS group and in 576 (0.2%) women in the no OS group (OR 0.48 (95% CI 0.33 to 0.71, p= <0.001)) in favour of OS. The calculated NNT is 725.
The study by Falconer (2015) included 5 449 119 women during the unexposed period and 3051 women received a bilateral salpingectomy. Hazard ratios and incidence rates for OC were assessed in exposed versus unexposed women. In the group of patients with bilateral salpingectomy, an incident rate (IR) of 9.9 (95% CI 4.7 to 20.8) was reported (IR per 100 000 person-years, 95% CI calculated assuming that the number of OCs follows the Poisson distribution). The fully adjusted HR was 0.35 (95% CI 0.17 to 0.73) (adjusted for age, calendar year, parity and education) in favour of OS.
2. Per- and postoperative complications
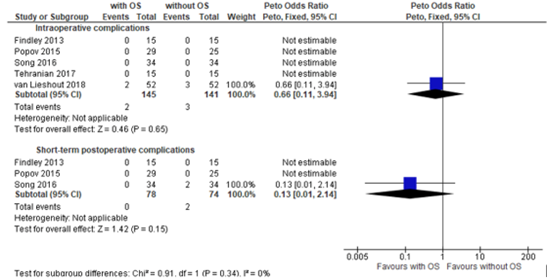
One systematic review and meta-analysis (van Lieshout, 2019) reported on the outcome measure complications. The review included 5 trials on OS during hysterectomy that reported on intraoperative and 3 trials on short-term postoperative complications. In total, 2/145 (1.4%) of OS patients and 3/141 (2.13%) of no OS patients had intraoperative complications, however the complication rate was very low ((OR 0.66 (95% CI 0.11 to 3.94, p= 0.65)). Only one of five studies found complications, in respectively two and three patients with and without OS (figure 2).
The review included 3 trials that reported on short-term postoperative complication rate. None of patients (0/78) experienced complications compared to 2/74 (2.7%) control patients who did not receive OS (OR 0.13 (95% CI 0.01 to 2.14, p=0.15)) (Figure 2).
Reported complications were blood loss over 1000 ml, unplanned unilateral oophorectomy, umbilical wound infection and ileus requiring prolonged hospital admission.
Figure 2. Per- and postoperative complications, comparison with and without opportunistic salpingectomy during hysterectomy
3. Ovarian function
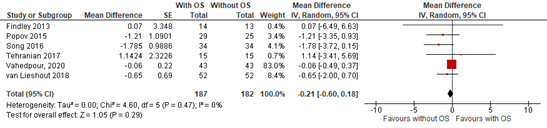
One systematic review and meta-analysis (van Lieshout, 2019) and one study published thereafter (Vahedpour, 2020) reported on the outcome measure ovarian reserve. Van Lieshout (2019) reported on postoperative AMH-, FSH-, LH- and Estradiol levels. Vahedpour (2020) reported on postoperative AMH levels. The pooled analysis of the outcome measure AMH levels is shown in Figure 3. Postoperative AMH levels were assessed in 187 patients who received an OS compared to 182 control patients who did not receive OS. A mean difference (MD) was found of -0.21 (95% CI -0.60 to 0.18, p= 0.29).
Figure 3. Postoperative AMH levels, comparison with and without opportunistic salpingectomy
Postoperative FSH levels were reported for 71 patients who received OS compared to 74 control patients who did not receive OS. A MD was found of -0.59 (95% CI -1.58 to 0.40, p=0.25) in favour of surgery without OS.
Postoperative LH levels were reported for 56 patients who received OS compared to 59 control patients. A MD was found of -0.73 (95% CI -2.14 to 0.68, p=0.31) in favour of surgery without OS.
Finally, postoperative estradiol levels were reported for 41 patients who received an OS compared to 37 control patients. A MD was reported of 4.51 (-28.96 to 37.98, p= 0.79).
At the time of publication of this literature analysis, long-term effects of OS are not known, but two large-scale RCTs and two large-scale observational studies are on their way: the HOPPSA trial conducted in Sweden (NCT03045965), ‘Preventing Ovarian Cancer Through Oportunistic Salpingectomy at the Time of Colorectal Surgery’ trial conducted in Canada (NCT05300711), the STOPOVCA observational study in The Netherlands (NCT04470921) and the STOPOVCAyoung observational study in The Netherlands (NCT04757922). More information about these trials can be found in the Appendix ‘Kennislacunes’ (in Dutch).
Level of evidence of the literature
Systematic reviews of randomized controlled trials and randomized controlled trials start at GRADE high. Observational studies for a therapeutic research question start at low GRADE.
The level of evidence regarding the outcome measure reduction in occurrence of OC was downgraded to very low GRADE because of study limitations (risk of bias: 2 studies did not correct for confounding); number of included patients (imprecision: the number of reported events).
The level of evidence regarding the outcome measure per- and postoperative complications was downgraded by three levels to very low GRADE because of study limitations (risk of bias; limitations of study design due to unclear definitions of adverse events); and number of observed events (2 levels for imprecision: only 5 reported events).
The level of evidence regarding the outcome measure ovarian reserve was downgraded by two levels to low GRADE because of study limitations (risk of bias; postoperative hormone levels were measured between 3 to 6 months postoperatively) and imprecision (confidence interval of pooled effect includes no significant effect (OR = 1) and no clinically relevant effect (OR < 0.8)).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
Does performing opportunistic salpingectomy (OS) reduce ovarian cancer (OC) risk? What are the risks of OS on complications? What are the effects of OS on ovarian function?
P patients: Woman with a benign gynaecological condition undergoing intra-abdominal surgery, when her desire to have children is fulfilled
I intervention: Opportunistic salpingectomy
C control: No opportunistic salpingectomy
O outcome measure: Reduction in occurrence of ovarian cancer (OC) (outcome measure-1), per- and postoperative complications (outcome measure-2), ovarian reserve Anti-Müllerian hormone (AMH), increase in menopausal symptoms, changes in hormone production and/or early menopause (outcome measure-3)
Relevant outcome measures
The guideline development group considered ovarian cancer (OC) risk as a crucial outcome measure for decision-making; and risk of complications and ovarian function as important outcome measures for decision making.
For the outcome measures OC risk, per- and postoperative complications and ovarian function, the working group argued that it is not suitable to define a minimal clinically (patient) important difference. Therefore, the GRADE default - a difference of 25% in the relative risk for dichotomous outcomes (Schünemann, 2013) and 0.5 standard deviation for continuous outcomes - was choosen as a minimal clinically important difference.
Search and select (Methods)
The databases Medline (via OVID), Cochrane library and Embase (via Embase.com) were searched with relevant search terms until February 24th, 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 3834 hits. Studies were selected based on the following inclusion criteria:
- Outcome measures include OC risk reduction, per- or postoperative complications, age of menopause, ovarian reserve or menopausal symptoms.
- Exclusion criteria were: questionnaire studies, opportunistic salpingectomy for sterilization, oophorectomy as intervention, cost effectiveness as (only) outcome measure and non-English manuscript.
Forty-five studies were initially selected based on title and abstract screening. After reading the full text, thirty-seven studies were excluded (see the table with reasons for exclusion under the tab Methods), and eight studies were included.
Results
For outcome measure-1 (ovarian cancer incidence), initially one review and meta-analysis (Yoon, 2018) was assessed but finally excluded after assessment of the study quality. Three observational studies included in Yoon (2018) were individually assessed (Falconer, 2015; Lessard-Anderson 2014 and Madsen, 2015) and included in the analysis of the literature. Additionally, three observational studies (Darelius, 2021; Hanley, 2022 and van Lieshout 2021) that were published since 2018 were included. Finally, a total of six observational studies were included for this outcome measure.
For outcome measure-2 and -3 (per- and postoperative complications and ovarian function), one Cochrane systematic review and meta-analysis (van Lieshout, 2019) including seven RCTs was identified and supplemented with an RCT (Vahedpour 2020). A total of eight RCTs were included for these outcome measures.
In total, eight RCTs (seven from systematic review and meta-analysis by van Lieshout, 2019) and six observational studies were included in this overview.
Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Darelius, A., Kristjansdottir, B., Dahm?Kähler, P., & Strandell, A. (2021). Risk of epithelial ovarian cancer Type I and II after hysterectomy, salpingectomy and tubal ligationA nationwide case?control study. International Journal of Cancer, 149(8), 1544-1552.
- Falconer, H., Yin, L., Grönberg, H., & Altman, D. (2015). Ovarian cancer risk after salpingectomy: a nationwide population-based study. JNCI: Journal of the National Cancer Institute, 107(2).
- Gelderblom, M. E., IntHout, J., Hermens, R. P., Coppus, S. F., Ebisch, I., van Ginkel, A. A., ... & Piek, J. M. (2022). STop OVarian CAncer (STOPOVCA) young: Protocol for a multicenter follow-up study to determine the long-term effects of opportunistic salpingectomy on age at menopause. Maturitas, 159, 62-68.
- Gelderblom, M. E., Van Lieshout, L. A., Piek, J. M., De Hullu, J. A., & Hermens, R. P. (2021). Patients and professionals perspectives on implementation of opportunistic salpingectomy: a mixed-method study. BMC health services research, 21(1), 1-14.
- Hanley, G. E., Pearce, C. L., Talhouk, A., Kwon, J. S., Finlayson, S. J., McAlpine, J. N., ... & Miller, D. (2022). Outcomes From opportunistic salpingectomy for ovarian cancer prevention. JAMA network open, 5(2), e2147343-e2147343.
- Lessard-Anderson, C. R., Handlogten, K. S., Molitor, R. J., Dowdy, S. C., Cliby, W. A., Weaver, A. L., ... & Bakkum-Gamez, J. N. (2014). Effect of tubal sterilization technique on risk of serous epithelial ovarian and primary peritoneal carcinoma. Gynecologic oncology, 135(3), 423-427.
- Madsen, C., Baandrup, L., Dehlendorff, C., & Kjær, S. K. (2015). Tubal ligation and salpingectomy and the risk of epithelial ovarian cancer and borderline ovarian tumors: a nationwide casecontrol study. Acta obstetricia et gynecologica Scandinavica, 94(1), 86-94.
- Naumann, R. W., Hughes, B. N., Brown, J., Drury, L. K., & Herzog, T. J. (2021). The impact of opportunistic salpingectomy on ovarian cancer mortality and healthcare costs: a call for universal insurance coverage. American Journal of Obstetrics and Gynecology, 225(4), 397-e1.
- Samimi, G., Trabert, B., Geczik, A. M., Duggan, M. A., & Sherman, M. E. (2018). Population frequency of serous tubal intraepithelial carcinoma (STIC) in clinical practice using SEE-Fim protocol. JNCI cancer spectrum, 2(4), pky061.
- Vahedpour, Z., Abedzadeh-Kalahroudi, M., Sehat, M., & Allamezadeh-Davani, S. (2020). The effects of salpingectomy on the serum level of anti-Müllerian hormone: A single-blind randomized controlled trial. Journal of Gynecology Obstetrics and Human Reproduction, 49(3), 101658.
- van Lieshout, L. A., Steenbeek, M. P., De Hullu, J. A., Vos, M. C., Houterman, S., Wilkinson, J., & Piek, J. M. (2019). Hysterectomy with opportunistic salpingectomy versus hysterectomy alone. Cochrane Database of Systematic Reviews, (8).
- van Lieshout, L. A. M., Piek, J. M. J., Verwijmeren, K., Houterman, S., Siebers, A. G., de Hullu, J. A., & Bekkers, R. L. M. (2021). Ovarian cancer risk after salpingectomy for ectopic pregnancy or hydrosalpinx: results of the OCASE nationwide population-based database study. Human Reproduction, 36(1), 211-218.
Evidence tabellen
Outcome 1- Ovarian cancer risk
Research question: Does performing a opportunistic salpingectomy (OS) reduce ovarian cancer risk?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Darelius 2021
|
Type of study: case control
Setting and country:
Funding and conflicts of interest: Authors report no conflicts of interest. |
Inclusion criteria: Exclusion criteria: N total at baseline:
Age (mean SD) C: Groups comparable at baseline?
Age: Yes |
Describe intervention (treatment/procedure/test):
|
Describe control (treatment/procedure/test):
None of the intervention procedures, cases matched on age, parity and educational level |
Length of follow-up:
Loss-to-follow-up N (%): Not described Incomplete outcome data:
|
Outcome measure-1 Ovarian cancer risk (Type I and II) Outcome measure-2 Complications Not reported
Outcome measure-3 Ovarian function reserve Not reported
Outcome measures: Salpingectomy (unilateral & bilateral combined): (In favour of intervention, except for salpingectomy)
EOC Type 2: (In favour of intervention)
|
Risk of type I and type EOC assessed separately. “The main finding in this retrospective register-based case-control study was that salpingectomy was associated with a reduced risk of EOC Type II but not Type I. Furthermore, hysterectomy and tubal ligation were likely to be associated with a reduced risk for both Type I and II EOC, albeit with statistically significant findings for hysterectomy but not for tubal ligation.”
|
|
Falconer, 2015
|
Type of study: cohort study Setting and country: Funding and conflicts of interest: Authors report no conflicts of interest. |
Characteristics of cases and controls: Important prognostic factors: |
Describe intervention (treatment/procedure/test):
Previous surgery on benign indication (i.e., Sterilization, salpingectomy, hysterectomy, and bilateral salpingo-oophorectomy, hysterectomy)
|
Describe control (treatment/procedure/test):
|
Length of follow-up: Loss-to-follow-up: Not reported Incomplete outcome data:
|
Outcome measure-1 Ovarian cancer risk Defined as OC risk: HR 95% CI Outcome measure-2 Complications Not reported
Outcome measure-3 Ovarian function reserve Not reported
|
Falconer, 2015: “In this population-based cohort study encompassing more than 30000 individual case patients with ovarian cancer, we found that a history of hysterectomy, sterilization, or salpingectomy on benign indications was associated with a reduced risk of ovarian cancer. Except for the group of women with hysterectomy and BSO, the most pronounced protective effect was observed for women with bilateral salpingectomy”.
|
|
Hanley, 2022
|
Type of study: cohort study
Setting and country:
Funding and conflicts of interest:
|
Characteristics of cases and controls: Inclusion criteria: - Borderline tumors Age at time of surgery (years ± SD) *Examined how groups differed with respect to potential confounders (age at time of surgery, income, parity, gravidity, oral contraceptive use, BRCA variants and presence of benign gynecological conditions at time of surgery). Due to low number of cancer cases statistical models were NOT run. Instead, the distribution of the potential confounders across the OS and control groups and their standardized differences were presented. Observed vs expected rates of ovarian cancer were examined. |
Describe intervention (treatment/procedure/test):
Opportunistic Salpingectomy during hysterectomy
|
Describe control (treatment/procedure/test): |
Length of follow-up: Loss-to-follow-up: Not reported Incomplete outcome data:
|
Outcome measure-1 Ovarian cancer risk OR 95% CI In favour of OS Outcome measure-2 Complications Not reported
Outcome measure-3 Ovarian function reserve Not reported
|
Hanley 2022: “In this cohort study, we now present data strongly suggesting that OS is effective as an ovarian cancer primary prevention strategy at the population level. We have further shown that the OS group had the same risk of breast and colorectal cancers compared with the control group, indicating that the lack of ovarian cancers in the OS groups is unlikely to be associated with selection bias. The rates of common risk and protective factors for the OS group place them at slightly higher risk of ovarian cancer (e.g., lower parity, lower gravidity, and higher age), indicating that our results are unlikely to be explained by confounding”. Remarks: No correction for confounders Relatively young population Short follow-up period
|
|
Lessard-Anderson, 2014
|
Type of study: case-control study Setting and country: Funding and conflicts of interest: Authors report no conflicts of interest. |
Characteristics of cases and controls: Exclusion criteria:
N total at baseline:
Important prognostic factors: Age (years ± SD) BMI (kg/m2 mean ± SD) C: 27.0 ± 5.8
Mean age menarche (± SD) C: 13.1 ± 1.4
Menopause at index date (%) I: 75.3% C: 77.1% Groups comparable at baseline? Yes on most variables. However, control patients had significantly more pregnancies and live births, a higher rate of oral contraceptive pill use, and higher likelihood of prior hysterectomy and unilateral or bilateral salpingo-oophorectomy than case patients. Adjustment for these confounders was undertaken in the analysis. |
Describe intervention (treatment/procedure/test): Excisional tubal sterilization
|
Describe control (treatment/procedure/test): No excisional tubal sterilization
|
Length of follow-up: Loss-to-follow-up: Not reported Incomplete outcome data:
|
Outcome measure-1 Ovarian cancer risk Defined as OC risk: OR, 95% CI, P
Outcome measure-2 Complications Not reported
Outcome measure-3 Ovarian function reserve Not reported
|
Adjusted for following confounders in analysis: N=14 cases (7.2%) and n= 46 controls (11.9%) had undergone tubal sterilization. Lessard-Anderson 2014: “In our present study, excisional tubal sterilization techniques conferred a greater decrease in the risk of serous EOC and PPC (64%) than did all tubal sterilization techniques combined (41%), even when controlling for other factors previously shown to be associated with decreased risk of EOC. The decrease in risk was even greater when only distal fibroidectomy and complete salpingectomy were considered (78%). This suggests that excision of the fimbriae may confer the greatest serous EOC and PPC risk reduction from tubal sterilization in the general female population”.
|
|
Madsen, 2015
|
Type of study: case-control study
Funding and conflicts of interest: Authors report no conflicts of interest. |
Characteristics of cases and controls:
- resident in Denmark at diagnosis - first diagnosis of histologically verified epithelial ovarian cancer of borderline ovarian tumour - no previous cancer (except for nonmelanoma skin cancer)
N total at baseline:
Age (years ± SD) Groups comparable at baseline? Adjusted for following confounders in analysis:
|
Describe intervention (treatment/procedure/test):
Tubal ligation or unilateral and bilateral salpingectomy
|
Describe control (treatment/procedure/test):
|
Length of follow-up: Incomplete outcome data:
|
Outcome measure-1 Ovarian cancer risk Defined as OC risk: OR, 95% CI
Unilateral salpingectomy: Outcome measure-2 Complications Not reported
Outcome measure-3 Ovarian function reserve Not reported
|
Both epithelial ovarian cancer and epithelial borderline ovarian tumors were assessed in this study. N=89 cases received a unilateral salpingectomy and n=17 received a bilateral salpingectomy. Madsen 2015:
|
|
Van Lieshout 2021
|
Type of study: cohort study
Setting and country:
Funding and conflicts of interest: Authors report no conflicts of interest. |
Records in database manually checked:
Exclusion criteria:
N total at baseline: Intervention: 18961 (of which n=17106 unilateral salpingectomy (uni) and n=18555 bilateral salpingectomy (bi)) Control: 23686
Important prognostic factors: For example Age (median, IQR): I uni: 32 (28-36) C: 32 (28-37) Groups comparable at baseline? Age wise, yes,. Study was unable to correct for potential confounders due to the anonymous nature of the pathology Registry. |
Describe intervention (treatment/procedure/test): Salpingectomy for ectopic pregnancy or hydrosalpinx
|
Describe control (treatment/procedure/test): Control group of women who had a benign dermal nevus removed
|
Length of follow-up:
Loss-to-follow-up: Intervention: 4 yrs N (%) 628 (3.3%) 8 yrs N (%) 6375 (33.6%) 12 yrs N (%) 11481 (60.6%) 16 yrs N (%) 14163 (74.5%)
Control: 4 yrs N (%) 6 (0.02%) 8 yrs N (%) 6375 (31.9%) 12 yrs N (%) 11481 (58.2%) 16 yrs N (%) 14163 (79.7%)
Incomplete outcome data:
|
Outcome measure-1 Ovarian cancer risk Incidence rate (IR) of ovarian cancer Outcome measure-2 Complications Not reported
Outcome measure-3 Ovarian function reserve Not reported
Outcome measures: C:7.1 (4.7 to 10.5) P= 0.34 C: 4.0 (2.0 to 7.1) P=0.26 >16 yrs I: 1.5 (0.3 to 5.0) C: 2.2 (0.7 to 5.4) P=1.00
|
Only pre-menopausal women No correction for confounding Young study population (median entry 32-33 years, and mean duration of follow-up 13 years) while median age at ovarian cancer diagnosis is 62
|
Outcome 2- per- and postoperative complications and outcome 3- ovarian function
Research questions:
- What is the risk of per- and postoperative complications of an OS?
- Does an OS lead to changes in ovarian function? (e.g., reduction of ovarian reserve, increase of menopausal symptoms, changes in hormone production or early menopause) For both pre- and postmenopausal women.
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Van Lieshout, 2019
[individual study characteristics deduced from [van Lieshout 2019]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of 7 RCTs Literature search up to January 2019
A: Behnamfar 2017 B: Findley 2013 C: Popov 2015 D: Sezik 2007 E: Song 2016 F: Tehranian 2017 G: van Lieshout 2018
Study design: RCT, all parallel
Setting and Country: B: Single-centre, USA C: Single-centre, Russia D: Single-centre, country not reported E: Multicentre, country not reported F: Single-centre, country not reported G: Multicentre, the Netherlands
Source of funding and conflicts of interest: [commercial / non-commercial / industrial co-authorship] A: not reported B: non commercial C: non commercial D: not reported E: not reported F: not reported G: non commercial
|
Inclusion criteria SR: 1) individuals with a population-based risk of ovarian cancer undergoing surgery for benign gynaecological conditions. Exclusion criteria SR: 7 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A: 40 patients B: 30 patients, 37.2 years C: 54 patients D: 24 patients E: 68 patients, 42.9 yrs F: 30 patients, 40.1 yrs G: 104 patients,
Sex: all female Groups comparable at baseline? Yes |
Describe intervention: A: hysterectomy with bilateral salpingectomy
|
Describe control: A: hysterectomy with preservation of the fallopian tubes
|
Endpoint of follow-up:
A: 6 months B: 3 months C: 4 months D: 6 months E: 6 months F: 3 months G: 6 months
For how many participants were no complete outcome data available? (intervention/control) A: 3 from intervention B: 5 from intervention, 5 from control C: no loss to follow-up D: no loss to follow-up E: no loss to follow-up F: no loss to follow-up G: 6 from intervention, 8 from control
|
Outcome measure-1 Ovarian cancer risk Not reported
Outcome measure-2 Complications
Effect measure: OR [95% CI]: A: not reported B I: 0/13 C: 0/15 OR not estimable D: not reported E: I: 0/34 C: 0/34 OR not estimable F: I: 0/15 C: 0/15 OR not estimable 0.66 (0.11-3.94) Short-term postoperative (2 cases reported, among patients w/o OS) B: I: 0/15 C: 0/15 OR not estimable D: not reported E: I 0/34 C: 2/34 F: not reported
I2=0% Pooled effect not determined due to low number of complications in 2 studies (1 interoperative and 1 post-operative)
Outcome measure-3 Ovarian function reserve
Effect measure AMH overall: mean difference, [95% CI]: A: not reported B: 0.07, (-6.49 to 6.63) D: not reported E: -1.785, (-3.72 to 0.15) F: -1.1424, (-3.41 to 5.69) G: -0.65, (-2.0 to 0.7)
Pooled effect (fixed effects model): MD (95% CI)
Effect measure FSH overall: mean difference, [95% CI]: A: -6.31, (-13.74 to 1.12) B: not reported C: -0.86, (-5.43 to 3.71) D: -1.1, (-2.47 to 0.27) E: not reported F: 0.34, (-1.20 to 1.88) G: not reported
Pooled effect (fixed effects model): MD (95% CI)
Effect measure LH overall: mean difference, [95% CI]: A: -8.23, (-17.52 to 1.06) B: not reported C: 1.37, (-7.69 to 10.43) D: -0.6, (-2.04 to 0.84) E: not reported F: not reported G: not reported
Pooled effect (fixed effects model): MD (95% CI) Effect measure Estradiol overall: mean difference, [95% CI]: B: not reported C: 62.22, (-296.14 to 420.58) D: 4, (029.62 to 37.62) E: not reported F: not reported G: not reported
Pooled effect (fixed effects model): MD (95% CI) |
Facultative: Authors conclude: No studies reported on the incidence of menopause-related symptoms. No evidence of a difference between hysterectomy with opportunistic salpingectomy compared to hysterectomy without opportunistic salpingectomy for total surgical time, estimated blood loss, conversion rate to open surgery, duration of hospital admission or quality of life Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question: None of the studies included postmenopausal women. Results of this review are not applicable for vaginal hysterectomy. The included studies limited surgical approach to abdominal or laparoscopic hysterectomies. Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading:
-Sensitivity analysis for skewed data in the analysis of AMH levels. MD -0.25, 95% CI -0.43 to -0.06) I2 = 68%. Results remained compatible with reduction in AMH that would not be clinically significant.
Heterogeneity: No clinical and statistical heterogeneity; |
|
Vahedpour, 2020 |
Type of study: RCT (single blind)
Setting and country:
Funding and conflicts of interest: Authors report no conflicts of interest. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 45 Control: 45
Important prognostic factors2: For example age ± SD: I: 44.39 ± 4.17 C: 45.69 ± 2.88 I: 2.62 ± 0.97 C:
Groups comparable at baseline? YES |
Describe intervention (treatment/procedure/test): Abdominal hysterectomy with salpingectomy without oophorectomy
|
Describe control (treatment/procedure/test): Abdominal hysterectomy without salpingectomy
|
Length of follow-up:
Loss-to-follow-up: Intervention: N (%) 2 (4.4) Reasons (describe) n=1 loss to follow-up and n=1 oophorectomy
Control: N (%) 2 (4.4) Reasons (describe) n=2 loss to follow-up
Incomplete outcome data: N/A
|
Outcome measure-1 Ovarian cancer risk Not reported
Outcome measure-2 Complications Not reported
Outcome measure-3 Ovarian function reserve Defined as AMH levels.
Significant difference in AMH levels detected at baseline between I and C. Corrected by running analysis of covariance. Furthermore, linear regression was used to evaluate/correct for potential confounders: age, parity, case of hysterectomy.
Outcome measures and effect size (include 95%CI and p-value if available):
mean difference, SE, P-value (effect size: not reported, 95% CI: not reported)
AMH levels 3 months follow-up corrected for other confounders (between group comparison using linear regression analysis).
|
Premenopausal women only
AMH only |
Risk of bias assessment
Observational studies
Outcome 1- Ovarian cancer risk
Research question: Does performing an opportunistic salpingectomy (OS) reduce ovarian cancer risk?
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population? |
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables?
|
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
Darelius, 2021 |
Definitely yes
Reason: |
Definitely yes
Reason:
|
Probably yes
Reason: selection criteria were used excluding participants with the outcome of interest at the start date |
Definitely yes
Reason: Registry data used for important confounding factors |
Definitely yes
Reason: Matched on age, parity, educational level. Statistically corrected for other variables. |
Definitely yes
Reason: OC yes/no from registry data |
Probably yes
Reason: No loss to follow-up reported |
No information
|
Low
(Ovarian cancer risk)
|
|
Falconer, 2015 |
Definitely yes
Reason: Participants were selected from Swedish national databases |
Definitely yes
Reason: |
Probably yes
Reason: |
Definitely yes
Reason: Registry data used for important confounding factors |
Probably no
Reason: Control cases were not matched, some relevant confounders were taken into account in analysis (age, calendar year, parity, education level) |
Definitely yes
Reason: |
Probably yes
Reason: No loss to follow-up reported |
No information
|
Low
(Outcome ovarian cancer risk)
|
|
Hanley, 2022 |
Definitely yes
Reason: Various data sources were used (e.g. insurance information, hospital database, cancer registry) from which both cases and controls were derived
|
Definitely yes
Reason: |
Probably yes
Reason: selection criteria were used excluding participants with the outcome of interest at the start date and six months before and after |
Definitely no
Reason: No adjustment for confounding factors |
Definitely no
Reason: Baseline differences present in relevant factors and analysis did not include confounding factors |
Definitely yes
Reason: OC yes/no from registry data |
Probably no
Reason: No loss to follow-up reported and duration of follow-up significantly shorter in intervention group |
No information
|
High concerns
Not corrected for confounding factors
|
|
Lessard-Anderson, 2014 |
Definitely yes
Reason: Participants were selected from a research infrastructure |
Definitely yes
Reason: |
Probably yes
Reason: |
Definitely yes
Reason: Registry data used for important confounding factors |
Probably yes
Reason: |
Definitely yes
Reason: |
Probably yes
Reason: No loss to follow-up reported |
No information
|
Low
(Outcome ovarian cancer risk)
|
|
Madsen, 2015 |
Definitely yes
Reason: Participants were selected from Danish national databases |
Definitely yes
Reason: |
Probably yes
Reason: |
Definitely yes
Reason: Registry data used for important confounding factors |
Probably yes
Reason: |
Definitely yes
Reason: |
Probably yes
Reason: No loss to follow-up reported |
No information
|
Low
(Outcome ovarian cancer risk)
|
|
Van Lieshout, 2021 |
Definitely yes
Reason: Participants were selected from a registry |
Definitely yes
Reason: |
Probably yes
Reason: |
Definitely no
Reason: |
Probably no
Reason: |
Definitely yes
Reason: |
Probably yes
Reason:
|
No information
|
High concerns (Outcome ovarian cancer risk)
Not corrected for confounding factors
|
Intervention studies
Outcome 2- per- and postoperative complications and outcome 3- ovarian function
Research questions:
What is the risk of per- and postoperative complications of an OS?
Does an OS lead to changes in ovarian function? (e.g., reduction of ovarian reserve, increase of menopausal symptoms, changes in hormone production or early menopause) For both pre- and postmenopausal women.
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
a)Were patients blinded?
b)Were healthcare providers blinded?
c)Were data collectors blinded?
d)Were outcome assessors blinded?
e)Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Vahedpour, 2020 |
Definitely yes
Reason: |
Probably yes
Reason: |
Probably yes a)Yes b)Definitely no
Reason: |
Probably yes Reason: |
Definitely yes
Reason: |
Probably yes
Reason: |
Low
|
Systematic review
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies? Yes/no/unclear |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable? Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Van Lieshout, 2019 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Antosh, 2017 |
Exclusion by van Lieshout, 2019, feasibility study |
|
Asgari, 2018 |
Same data as Tehranian, 2017 |
|
Berlit, 2013 |
Exclusion by van Lieshout, 2019, feasibility study |
|
Buffeteau, 2020 |
Narrative review, useful as background article |
|
Chichura, 2020 |
Feasibility study in women with relative contraindications for opportunistic bilateral salpingectomy |
|
Collins, 2019 |
Studies with stronger design (RCT) available for this outcome, which were included in van Lieshout, 2019 |
|
Garcia, 2016 |
Exclusion by van Lieshout, 2019 |
|
Ganer Herman, 2017 |
Wrong comparison: tubal ligation versus salpingectomy for sterilization in women with caesarean section |
|
Ghezzi, 2009 |
Exclusie by van Lieshout, 2019 |
|
Gupta, 2021 |
Feasibility study, fulltext not found |
|
Hanley, 2018 |
Exclusion by van Lieshout, 2019 |
|
Hanley, 2017 |
Exclusion by van Lieshout, 2019 |
|
Ida, 2021 |
Studies with stronger design (RCT) available for this outcome, which were included in van Lieshout, 2019 |
|
Kho, 2017 |
More recent/better review available by Cochrane of van Lieshout, 2019 |
|
McAlpine, 2014 |
Exclusion by van Lieshout, 2019 |
|
Minig, 2015 |
Exclusion by van Lieshout, 2019 |
|
Morelli, 2013 |
Exclusion by van Lieshout, 2019 |
|
Naaman, 2017 |
Exclusion by van Lieshout, 2019 |
|
Paul, 2018 |
Exclusion by van Lieshout, 2019 |
|
Poonam, 2020 |
Studies with stronger design (RCT) available for this outcome, which were included in van Lieshout, 2019 |
|
Robert, 2015 |
Exclusion by van Lieshout, 2019 |
|
Schrot-Sanyan, 2016 |
Published before van Lieshout, 2019, probably excluded by van Lieshout, 2019 |
|
Song, 2016 |
Published before van Lieshout, 2019, probably excluded by van Lieshout, 2019 |
|
Suneja, 2020 |
Studies with stronger design (RCT) available for this outcome, which were included in van Lieshout, 2019 |
|
Till, 2018 |
Published before van Lieshout, 2019, probably excluded by van Lieshout, 2019 = non comparative study (cross sectional) of differences in opp sal rate over time |
|
Vorwergk, 2014 |
Published before van Lieshout, 2019, probably excluded by van Lieshout, 2019 |
|
Wang, 2021 |
Studies with stronger design (RCT) available for this outcome, which were included in van Lieshout, 2019 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 05-12-2023
Beoordeeld op geldigheid : 30-10-2023
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Opportunistische salpingectomie |
NVOG |
2023 |
2028 |
Elke 5 jaar |
NVOG |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met vergroot ovarium en laparoscopische hysterectomie voor benigne indicaties.
Stuurgroep cluster Benigne Gynaecologie
(Voorzitter) Timmermans A. (Anne), gynaecoloog, AmsterdamUMC, Amsterdam, NVOG
Breijer M.C. (Merel), gynaecoloog, Adrz, Goes en Vlissingen, NVOG
Lips D.J. (Daan), gastrointestinaal/oncologisch chirurg met HPB specialisatie, MST, Enschede, NVvH
Radder C.M. (Celine), gynaecoloog, OLVG, Amsterdam, NVOG
Schrijvers module Opportunistische Salpingectomie
Gelderblom M.E. (Malou), arts-onderzoeker/promovendus gynaecologische oncologie, Radboudumc, Nijmegen, schrijver op persoonlijke titel
Geomini P.M.A.J. (Peggy), gynaecoloog, MMC, Veldhoven, NVOG
Lems E. (Esther), arts-onderzoeker/promovendus gynaecologie, MMC, Veldhoven, schrijver op persoonlijke titel
Meelezers module Opportunistische Salpingectomie
Bosch M. (Marlies), patiëntvertegenwoordiger, Bekkenbodem4All
Hermens R. (Rosella), hoogleraar Persoonsgerichte oncologische keten- en netwerkzorg, Radboudumc, Nijmegen, meelezer op persoonlijke titel
Kruse A.J. (Arnold-Jan), gynaecologisch-oncoloog, Isala, Zwolle, NVOG
Lok C.A.R. (Christianne), gynaecologisch oncoloog, AVL, Amsterdam, NVOG
Piek J.M.J. (Jurgen), gynaecologisch-oncoloog, Catharina Ziekenhuis, Eindhoven, NVOG
Stiekema A. (Anna), AIOS gynaecologie, AmsterdamUMC, Amsterdam, NVOG
Swillens J. (Julie), postdoc bij IQ Healthcare, Radboudumc, Nijmegen, meelezer op persoonlijke titel
van Schrojenstein Lantman E.S. (Esther), klinisch fysicus, Albert Schweitzer ziekenhuis, Dordrecht , NVKF
Met ondersteuning van
Labeur Y.J. (Yvonne), adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Schultink J.M. (Janneke), adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Stuurgroep Koploperproject Benigne Gynaecologie
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Timmermans* |
Gynaecoloog, Amsterdam UMC (0.5 fte) |
Commissie kwaliteitsdocumenten NVOG (onbetaald); projectgroep Gynae Goes Green NVOG (onbetaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
13-2-2021 |
Geen restricties |
|
Breijer |
Gynaecoloog Maasziekenhuis Pantein |
Lid commissie kwaliteitsdocumenten NVOG namens pijler gynaecologie, onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
28-6-2021 |
Geen restricties |
|
Lips |
Chirurg, Chirurgencoöperatie Oost-Nederland Enschede, Medisch Spectrum Twente |
NVGIC werkgroep robot-chirurgie, onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
21-5-2021 |
Geen restricties |
|
Radder |
Gynaecoloog te OLVG in Amsterdam, 1.0 fte |
Registratiecommissie Obstetrie en Gynaecologie van NVOG, onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
6-7-2021 |
Geen restricties |
Expertisegroep module Opportunistische Salpingectomie
Schrijvers
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Gelderblom |
Arts onderzoeker gynaecologische oncologie Radboudumc |
Geen |
Geen |
Geen |
Arts onderzoeker van STOPOVCA studie; research project met betrekking tot de opportunistische salpingectomie. Onderzoek is verricht naar de belemmerende en faciliterende factoren rondom de implementatie van de opportunistische salpingectomie. Er is een keuzehulp ontwikkeld over de opportunistische salpingectomie. Deze keuzehulp wordt op dit moment geëvalueerd in de klinische praktijk in 16 Nederlandse ziekenhuizen. |
Geen |
Geen |
2-4-2021, geüpdatet 06-04-2023 |
Geen restricties |
|
Geomini |
Gynaecoloog MMC |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Geen restricties |
|
Lems |
Arts-onderzoeker, Máxima Medisch Centrum per 01-09-2021, fulltime, uitvoeren ACCEPT studie. |
Geen |
Geen |
Geen |
De ACCEPT studie (ZonMW) onderzoekt welk diagnostisch model het meest kosteneffectief is om een onderscheid tussen benigne en maligne ovariumtumoren. De studie heeft geen raakvlak met de opportunistische salpingectomie en zodoende geen belangenverstrengeling met deze richtlijn. |
Geen |
Geen |
30-3-2021, geüpdatet 14-03-2023 |
Geen restricties |
Meelezers
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Bosch |
Stichting Bekkenbodem4All: PR en Belangenbehartiging |
Fotograaf en journalist voor diverse kerkelijke beladen. Soms betaald, meestal niet. |
Geen |
Geen |
Geen |
We hebben een informatieve functie als belangenbehartiger voor het welzijn van patiënten met bekkenbodemklachten in het algemeen. |
Geen |
10-3-2023 |
Geen restricties |
|
Hermens |
Hoogleraar persoonsgerichte oncologische keten- en netwerkzorg afdeling IQ healthcare, Radboud UMC Nijmegen |
Ik doe onderzoek met subsidies van vooral KWF, ZonMW en Maarten van der Weijden. |
Geen |
Geen |
Financier/Inhoud onderzoek/Rol als projectleider |
Geen |
Geen |
5-4-2023 |
Geen restricties |
|
Kruse |
Gynaecoloog-oncoloog, Isala, Zwolle |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
31-3-2023 |
Geen restricties |
|
Lok |
Gynaecologisch oncoloog Antoni van Leeuwenhoek |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
17-3-2021 |
Geen restricties |
|
Piek |
Gynaecologisch Oncoloog Catharina ziekenhuis |
- Gynaecologisch Oncoloog Amphia ziekenhuis Breda (betaald) |
Geen |
dr De Hullu (gynaecologisch oncoloog Radboud UMC) |
- 2019 KWF grant –OVI-DETECT- |
De hypothese dat ovariumcarcinoom ontstaat uit tubaepitheel is afkomstig van oa De ondergetekende |
Geen |
8-4-2021 |
Geen restricties Gelderblom |
|
Stiekema |
Gynaecoloog Spaarne Gastziekenhuis + Antoni van Leeuwenhoek ziekenhuis |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
20-4-2023 |
Geen restricties |
|
Swillens |
Postdoctoraal onderzoeker (1.0 FTE) |
Geen |
Geen |
Geen |
Financier/Inhoud onderzoek/Rol als projectleider |
Geen |
Geen |
6-4-2023 |
Geen restricties |
|
Van Schrojenstein Lantman |
Klinisch fysicus in Albert Schweitzer ziekenhuis voor 1fte en hiervan voor 0,1 fte gedetacheerd bij Rivas Zorggroep |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
2-10-2020 |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door patiëntvertegenwoordigers in het cluster te laten deelnemen. De verkregen input is meegenomen bij schrijven van de overwegingen en aanbevelingen van de module. De conceptmodule is tevens voor commentaar voorgelegd aan de deelnemende patiëntverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module
|
Uitkomst raming |
Toelichting |
|
Module Opportunistische Salpingectomie |
Geen financiële gevolgen |
Salpingectomie wordt opportunistisch gedaan, gelijktijdig met operatie aan een ovarium; dus geen extra device kosten voor verrichten salpingectomie. Salpingectomie valt binnen de verrichting adnexextirpatie/ cystectomie, hoeft niet separaat te worden gedeclareerd, geen sprake van meerkosten. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Onderstaande stakeholders zijn benaderd voor de need for update ronde-1 in februari-mei 2022.
Het betreffen:
- Beroepsvereniging Verzorgenden Verpleegkundigen (V&VN)
- Endometriose Stichting (ES)
- Inspectie Gezondheidszorg en Jeugd (IGJ)
- KBO-PCOB
- Nederlandse Vereniging van Ziekenhuisapothekers (NVZA)
- Nederlandse Vereniging van Ziekenhuizen (NVZ)
- Nederlandse Vereniging voor Anesthesiologie (NVA)
- Nederlandse Vereniging voor Bekkenfysiotherapie (NVFB) (subvereniging van KNGF)
- Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV)
- Nederlandse Vereniging voor Heelkunde (NVvH)
- Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC)
- Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Nederlandse Vereniging voor Psychiatrie (NVvP)
- Nederlandse Vereniging voor Radiologie (NVvR)
- Nederlandse Vereniging voor Urologie (NVU)
- Nederlandse Vereniging voor Vulva Pathologie (NVvVP)
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVVS)
- Patiënten Federatie Nederland (PFN)
- Patiëntenvereniging Poi-Pof (inmiddels opgeheven)
- Stichting Bekkenbodem4All
- Vereniging van Klinische Genetica Nederland (VKGN)
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
- Vuurvrouw
- Zelfstandige Klinieken Nederland (ZKN)
- Zorginstituut Nederland (ZiNL)
- Zorgverzekeraars Nederland (ZN)
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansloten bij één of meerdere richtlijnen behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze modules zijn geprioriteerd door de clusterexpertiseleden, die door de verenigingen waren afgevaardigd. Uiteindelijk zijn er drie modules uit gekomen die konden worden herzien/nieuw ontwikkeld. Hiervoor zijn bovenstaande werkgroepen (zie Samenstelling van de werkgroep) gevormd, die de definitieve uitgangsvragen hebben vastgesteld.
De partijen die hebben deelgenomen aan deze werkgroepen zijn (zie ook Titelpagina en Samenstelling van de werkgroep):
- Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) (stuur- en expertisegroep)
- Nederlandse Vereniging voor Heelkunde (NVvH) (stuurgroep)
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC) (expertisegroep)
- Nederlandse Vereniging voor Klinische Fysica (NVKF) (expertisegroep)
- Nederlandse Vereniging voor Radiologie (NVvR) (expertisegroep)
- Stichting Bekkenbodem4All (expertisegroep)
Schrijfgroep en meeleesgroep
Bij de ontwikkeling van de modules is de expertisegroep per module opgesplitst in schrijfgroepjes en meeleesgroepjes. De schrijfgroep is bij alle stappen die onderstaand beschreven worden aanwezig geweest. Zij hebben de overwegingen en aanbevelingen opgesteld. De meeleesgroep was aanwezig bij de startbijeenkomst, heeft geholpen bij het opstellen van het raamwerk, de uitkomstmaten, en het aanleveren van eventuele zoektermen en/of ‘key articles’ voor de zoekstrategie. Vervolgens heeft de meeleesgroep de module nog verschillende keren meegelezen tijdens de ontwikkelfase. De schrijf- en meeleesgroep vormen samen de werkgroep per module.
Uitkomstmaten
Na het opstellen van de definitieve klinische uitgangsvraag, hebben de clusterexpertiseleden de zoekvraag opsteld, en geïnventariseerd welke uitkomsten voor de patiënt relevant zijn, kijkend naar zowel gewenste als ongewenste effecten. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming) of belangrijk (maar niet cruciaal). Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.3 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering hoog) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers
|
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Search Richtlijn Juli 2021
Medline
Onderdeel 1
Salpingectomy/
OR salpingectom*.tw,kf.
OR ((tubal adj3 excision*) or tubectom*).tw,kf.
Onderdeel 2 (PICO 1)
Ovarian Neoplasms/
OR (ovar* adj3 (serou* or cancer* or carcinom* or neoplas* or malignanc* or malignant)).tw,kf.
Database(s): Ovid MEDLINE(R) ALL 1946 to July 06, 2021
Search Strategy:
|
# |
Searches |
Results |
|
1 |
Salpingectomy/ |
1317 |
|
2 |
salpingectom*.tw,kf. |
2164 |
|
3 |
((tubal adj3 excision*) or tubectom*).tw,kf. |
248 |
|
4 |
1 or 2 or 3 |
3126 |
|
5 |
Ovarian Neoplasms/ |
83445 |
|
6 |
(ovar* adj3 (serou* or cancer* or carcinom* or neoplas* or malignanc* or malignant)).tw,kf. |
85091 |
|
7 |
5 or 6 |
111092 |
|
8 |
4 and 7 |
623 |
Onderdeel 3 (PICO 2)
Postoperative Complications/
OR (Post?operative adj2 Complication*) .tw,kf.
OR Intraoperative Complications/
OR (Intra?operative adj2 Complication*).tw,kf.
OR (peri?operative adj2 complication*).tw,kf.
OR surgical injur*.tw,kf.
OR Blood loss, surgical/
OR blood loss.tw,kf
OR h?emorrhage*.tw,kf.
OR infection/
OR infectio*.tw,kf.
OR Complication rate*.tw,kf.
OR Surgical complication*.tw,kf.
OR Operative complication*.tw,kf.
MEDLINE(R) ALL 1946 to July 06, 2021
Search Strategy:
|
# |
Searches |
Results |
|
1 |
Salpingectomy/ |
1317 |
|
2 |
salpingectom*.tw,kf. |
2164 |
|
3 |
((tubal adj3 excision*) or tubectom*).tw,kf. |
248 |
|
4 |
1 or 2 or 3 |
3126 |
|
5 |
Ovarian Neoplasms/ |
83445 |
|
6 |
(ovar* adj3 (serou* or cancer* or carcinom* or neoplas* or malignanc* or malignant)).tw,kf. |
85091 |
|
7 |
5 or 6 |
111092 |
|
8 |
4 and 7 |
623 |
|
9 |
Postoperative Complications/ |
379146 |
|
10 |
(Post?operative adj2 Complication*).tw,kf. |
85807 |
|
11 |
Intraoperative Complications/ |
32744 |
|
12 |
(Intra?operative adj2 Complication*).tw,kf. |
10521 |
|
13 |
(peri?operative adj2 complication*).tw,kf. |
12496 |
|
14 |
surgical injur*.tw,kf. |
1009 |
|
15 |
Blood loss, surgical/ |
18843 |
|
16 |
blood loss.tw,kf. |
56143 |
|
17 |
h?emorrhage*.tw,kf. |
210804 |
|
18 |
infection/ |
39911 |
|
19 |
infectio*.tw,kf. |
1677959 |
|
20 |
Complication rate*.tw,kf. |
59075 |
|
21 |
Surgical complication*.kw,kf |
17172 |
|
22 |
Operative complication*.tw,kf. |
14022 |
|
23 |
9 or 10 or 11 or 12 or 13 or 14 or 15 or 16 or 17 or 18 or 19 or 20 or 21 or 22 |
2359068 |
|
21 |
8 and 23 |
89 |
|
22 |
4 and 23 |
616 |
Onderdeel 4 (PICO 3)
menopause/ or menopause, premature/
OR Menopau*.tw,kf.
OR Ovarian reserve/
OR (ovarian reserve* OR Oocyte reserve*).tw,kf.
OR Follicle Stimulating Hormone/
OR (Follicle Stimulating Hormone* OR fsh OR follitrop?in*).tw,kf.
OR primary ovarian insufficiency/
OR (ovar* insufficiency OR ovarian failure).tw,kf.
OR Anti-mullerian hormone/
OR (anti?mu?llerian or mu?llerian?inhibit* or mu?llerian regression or AMH).tw,kf.
OR Ovarian Follicle/
OR (antral follicle count OR AFC OR ovari* follicle*).tw,kf.
OR Ovarian age.tw,kf.
OR Ovarian function.tw,kf.
OR Climacteric/
OR Climacteric.tw,kf.
Database(s): Ovid MEDLINE(R) ALL 1946 to July 06, 2021
Search Strategy:
|
# |
Searches |
Results |
|
1 |
Salpingectomy/ |
1317 |
|
2 |
salpingectom*.tw,kf. |
2164 |
|
3 |
((tubal adj3 excision*) or tubectom*).tw,kf. |
248 |
|
4 |
1 or 2 or 3 |
3126 |
|
5 |
menopause/ or menopause, premature/ |
29120 |
|
6 |
Menopau*.tw,kf. |
52112 |
|
7 |
Ovarian reserve/ |
1200 |
|
8 |
(ovarian reserve* or Oocyte reserve*).tw,kf. |
3779 |
|
9 |
Follicle Stimulating Hormone/ |
36300 |
|
10 |
(Follicle Stimulating Hormone* or fsh or follitrop?in*).tw,kf. |
43623 |
|
11 |
primary ovarian insufficiency/ |
2868 |
|
12 |
(ovar* insufficiency or ovarian failure).tw,kf. |
5686 |
|
13 |
Anti-mullerian hormone/ |
3366 |
|
14 |
(anti?mu?llerian or mu?llerian?inhibit* or mu?llerian regression or AMH).tw,kf. |
4759 |
|
15 |
Ovarian Follicle/ |
19158 |
|
16 |
(antral follicle count or AFC or ovari* follicle*).tw,kf. |
10194 |
|
17 |
Ovarian age.tw,kf. |
65 |
|
18 |
Ovarian function.tw,kf. |
7101 |
|
19 |
Climacteric/ |
4895 |
|
20 |
Climacteric.tw,kf. |
5532 |
|
21 |
5 or 6 or 7 or 8 or 9 or 10 or 11 or 12 or 13 or 14 or 15 or 16 or 17 or 18 or 19 or 20 |
147527 |
|
22 |
4 and 21 |
231 |
Embase
Onderdeel 1
Salpingectomy/
OR salpingectom*.tw,kw.
OR ((tubal adj3 excision*) or tubectom*).tw,kw.
Onderdeel 2 (PICO 1)
Ovarian Neoplasms/
OR (ovar* adj3 (serou* or cancer* or carcinom* or neoplas* or malignanc* or malignant)).tw,kw.
Database(s): Embase 1974 to 2021 July 06
Search Strategy:
|
# |
Searches |
Results |
|
1 |
Salpingectomy/ |
5171 |
|
2 |
salpingectom*.tw,kw. |
3609 |
|
3 |
((tubal adj3 excision*) or tubectom*).tw,kw. |
247 |
|
4 |
1 or 2 or 3 |
5920 |
|
5 |
Ovarian Neoplasms/ |
12634 |
|
6 |
(ovar* adj3 (serou* or cancer* or carcinom* or neoplas* or malignanc* or malignant)).tw,kw. |
119624 |
|
7 |
5 or 6 |
126286 |
|
8 |
4 and 7 |
755 |
Onderdeel 3 (PICO 2)
Postoperative Complications/
OR (Post?operative adj2 Complication*) .tw,kw.
OR Intraoperative Complications/
OR (Intra?operative adj2 Complication*).tw,kw.
OR (peri?operative adj2 complication*).tw,kw.
OR surgical injur*.tw,kw.
OR Blood loss, surgical/
OR blood loss.tw,kw.
OR h?emorrhage*.tw,kw.
OR infection/
OR infectio*.tw,kw.
OR Complication rate*.tw,kw.
OR Surgical complication*.tw,kw.
OR Operative complication*.tw,kw.
Database(s): Embase 1974 to 2021 July 06
Search Strategy:
|
# |
Searches |
Results |
|
1 |
Salpingectomy/ |
5171 |
|
2 |
salpingectom*.tw,kw. |
3609 |
|
3 |
((tubal adj3 excision*) or tubectom*).tw,kw. |
247 |
|
4 |
1 or 2 or 3 |
5920 |
|
5 |
Ovarian Neoplasms/ |
12634 |
|
6 |
(ovar* adj3 (serou* or cancer* or carcinom* or neoplas* or malignanc* or malignant)).tw,kw. |
119624 |
|
7 |
5 or 6 |
126286 |
|
8 |
4 and 7 |
755 |
|
9 |
Postoperative Complications/ |
84233 |
|
10 |
(Post?operative adj2 Complication*).tw,kw. |
116618 |
|
11 |
Intraoperative Complications/ |
24636 |
|
12 |
(Intra?operative adj2 Complication*).tw,kw. |
17077 |
|
13 |
(peri?operative adj2 complication*).tw,kw. |
19096 |
|
14 |
surgical injur*.tw,kw. |
1313 |
|
15 |
Blood loss, surgical/ |
14005 |
|
16 |
blood loss.tw,kw. |
89557 |
|
17 |
h?emorrhage*.tw,kw. |
277931 |
|
18 |
infection/ |
313315 |
|
19 |
infectio*.tw,kw. |
2105303 |
|
20 |
Complication rate*.tw,kw. |
89667 |
|
21 |
Surgical complication*.tw,kw. |
26404 |
|
22 |
Operative complication*.tw,kw. |
24843 |
|
23 |
9 or 10 or 11 or 12 or 13 or 14 or 15 or 16 or 17 or 18 or 19 or 20 or 21 or 22 |
2744436 |
|
24 |
4 and 23 |
1009 |
|
25 |
4 and 7 and 23 |
132 |
Onderdeel 4 (PICO 3)
menopause/ or early menopause/
OR Menopau*.tw,kw.
OR Ovarian reserve/
OR (ovarian reserve* OR Oocyte reserve*).tw,kw.
OR Follitropin/
OR (Follicle Stimulating Hormone* OR fsh OR follitrop?in*).tw,kw.
OR premature ovarian failure/
OR (ovar* insufficiency OR ovarian failure).tw,kw.
OR Muellerian inhibiting factor/
OR (anti?mu?llerian or mu?llerian?inhibit* or mu?llerian regression or AMH).tw,kw.
OR Ovary Follicle/
OR Antral follicle count/
OR (antral follicle count OR AFC OR ovar* follicle*).tw,kw.
OR Ovarian age.tw,kw.
OR Ovary function/
OR Ovar* function.tw,kw.
OR Climacteric/
OR Climacteric.tw,kw.
Database(s): Embase 1974 to 2021 July 06
Search Strategy:
|
# |
Searches |
Results |
|
1 |
Salpingectomy/ |
5171 |
|
2 |
salpingectom*.tw,kw. |
3609 |
|
3 |
((tubal adj3 excision*) or tubectom*).tw,kw. |
247 |
|
4 |
1 or 2 or 3 |
5920 |
|
5 |
menopause/ or early menopause/ |
49678 |
|
6 |
Menopau*.tw,kw. |
80186 |
|
7 |
Ovarian reserve/ |
6457 |
|
8 |
(ovarian reserve* or Oocyte reserve*).tw,kw. |
7205 |
|
9 |
Follitropin/ |
60932 |
|
10 |
(Follicle Stimulating Hormone* or fsh or follitrop?in*).tw,kw. |
56467 |
|
11 |
premature ovarian failure/ |
5113 |
|
12 |
(ovar* insufficiency or ovarian failure).tw,kw. |
8273 |
|
13 |
Muellerian inhibiting factor/ |
7766 |
|
14 |
(anti?mu?llerian or mu?llerian?inhibit* or mu?llerian regression or AMH).tw,kw. |
8806 |
|
15 |
Ovary Follicle/ |
19596 |
|
16 |
Antral follicle count/ |
1365 |
|
17 |
(antral follicle count or AFC or ovar* follicle*).tw,kw. |
13441 |
|
18 |
Ovarian age.tw,kw. |
104 |
|
19 |
Ovary function/ |
8781 |
|
20 |
Ovar* function.tw,kw. |
9216 |
|
21 |
Climacteric/ |
8388 |
|
22 |
Climacteric.tw,kw. |
5339 |
|
23 |
5 or 6 or 7 or 8 or 9 or 10 or 11 or 12 or 13 or 14 or 15 or 16 or 17 or 18 or 19 or 20 or 21 or 22 |
209778 |
|
24 |
4 and 23 |
538 |
Cochrane
Onderdeel 1
(salpingectom* OR tubal excision* or tubectom*):ti,ab,kw
Onderdeel 2 (PICO 1)
Ovarian Neoplasms:ti,ab,kw
OR (ovar* adj3 (serou* or cancer* or carcinom* or neoplas* or malignanc* or malignant)):ti,ab,kw
Search Name:
Date Run: 07/07/2021 14:44:36
Comment:
ID Search Hits
#1 (salpingectom* OR tubal excision* or tubectom*):ti,ab,kw 363
#2 Ovarian Neoplasms:ti,ab,kw 2756
#3 (ovarian cancer* OR ovarian carcinom* OR ovarian neoplas* or ovarian malignanc* or ovarian malignant):ti,ab,kw 7745
#4 #2 OR #3 7826
#5 #1 AND #4 53
Onderdeel 3 (PICO 2)
Postoperative Complications:ti,ab,kw
OR (Post?operative Complication*):ti,ab,kw
OR Intraoperative Complications:ti,ab,kw
OR (peri?operative complication*):ti,ab,kw
OR surgical injur*:ti,ab,kw
OR Blood loss, surgical:ti,ab,kw
OR blood loss:ti,ab,kw
OR h?emorrhage*:ti,ab,kw
OR infection:ti,ab,kw
OR infectio*:ti,ab,kw
OR Complication rate*:ti,ab,kw
OR Surgical complication*:ti,ab,kw
OR Operative complication*:ti,ab,kw
Search Name:
Date Run: 07/07/2021 14:50:40
Comment:
ID Search Hits
#1 (salpingectom* OR tubal excision* or tubectom*):ti,ab,kw 363
#2 Ovarian Neoplasms:ti,ab,kw 2756
#3 (ovarian cancer* OR ovarian carcinom* OR ovarian neoplas* or ovarian malignanc* or ovarian malignant):ti,ab,kw 7745
#4 #2 OR #3 7826
#5 #1 AND #4 53
#6 Postoperative Complications:ti,ab,kw 44217
#7 Intraoperative Complications:ti,ab,kw 10205
#8 (peri?operative complication*):ti,ab,kw 9272
#9 surgical injur*:ti,ab,kw 9254
#10 Blood loss, surgical:ti,ab,kw 8910
#11 blood loss:ti,ab,kw 32275
#12 h?emorrhage*:ti,ab,kw 30744
#13 infection:ti,ab,kw 92208
#14 infectio*:ti,ab,kw 126443
#15 Complication rate*:ti,ab,kw 30522
#16 Surgical complication*:ti,ab,kw 39276
#17 Operative complication*:ti,ab,kw 18481
#18 #6 OR #7 OR #8 OR #9 OR #10 OR #11 OR #12 OR #13 OR #14 OR #15 OR #16 OR #17 243598
#19 #1 AND #18 108
#20 #1 AND #4 AND #18 28
Onderdeel 4 (PICO 3)
(menopau*):ti,ab,kw
OR (ovarian reserve* OR Oocyte reserve*):ti,ab,kw
OR (Follicle Stimulating Hormone* OR fsh OR follitropin* OR follitrophin*):ti,ab,kw
OR (ovar* insufficiency OR ovar* failure):ti,ab,kw
OR (Antimullerian OR antimuellerian OR anti-mullerian OR anti-muellerian OR mullerian inhibit* OR muellerian inhibit* OR mullerianinhibit* OR muellerianinhibit* OR mullerian regression OR muellerian regression OR AMH):ti,ab,kw
OR (antral follicle count OR AFC OR ovar* follicle*):ti,ab,kw
OR Ovarian age:ti,ab,kw
OR Ovarian function:ti,ab,kw,
Search Name:
Date Run: 07/07/2021 14:37:10
Comment:
ID Search Hits
#1 (salpingectom* OR tubal excision* or tubectom*):ti,ab,kw 363
#2 (menopau*):ti,ab,kw 12936
#3 (ovarian reserve* OR Oocyte reserve*):ti,ab,kw 1077
#4 (Follicle Stimulating Hormone* OR fsh OR follitropin* OR follitrophin*):ti,ab,kw 7168
#5 (ovar* insufficiency OR ovar* failure):ti,ab,kw 1311
#6 (Antimullerian OR antimuellerian OR anti-mullerian OR anti-muellerian OR mullerian inhibit* OR muellerian inhibit* OR mullerianinhibit* OR muellerianinhibit* OR mullerian regression OR muellerian regression OR AMH):ti,ab,kw 1042
#7 (antral follicle count OR AFC OR ovar* follicle*):ti,ab,kw 4019
#8 Ovarian age:ti,ab,kw 3591
#9 Ovarian function:ti,ab,kw, 1703
#10 Climacteric:ti,ab,kw 1217
#11 #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9 OR #10 24113
#12 #1 AND #11 139