Bronchoalveolaire lavage
Uitgangsvraag
Wat is de plaats van een bronchoalveolaire lavage bij immuun-gecompromitteerde patiënten op de intensive care met tekenen van respiratoir falen en nieuwe of progressieve pulmonale afwijkingen op beeldvorming?
Aanbeveling
Beslis of een bronchoscopie met BAL van meerwaarde is indien aan de volgende twee criteria wordt voldaan:
1. Er kan op basis van klinische, non-invasieve microbiologische, en radiologische informatie geen duidelijke diagnose gesteld worden; en
2. Er is op basis van immuunstoornis en radiologische bevindingen een reële verdenking op specifieke infectieuze verwekkers waarbij de BAL resultaten van duidelijke toegevoegde waarde kunnen zijn.
of
Er is een hoge verdenking op een ziekte dan wel behandeling gerelateerde complicatie waarbij de BAL resultaten van duidelijk toegevoegde waarde zijn.
Verricht niet standaard een bronchoscopie met BAL.
Overwegingen
Balans tussen gewenste en ongewenste effecten
Er is literatuuronderzoek uitgevoerd naar de plaats van een bronchoscopisch verrichte bronchoalveolaire lavage (BAL) bij immuun-gecompromitteerde patiënten op de intensive care met tekenen van respiratoir falen en nieuwe of progressieve pulmonale infiltraten. Het stellen van een nieuwe diagnose, de verandering van behandelstrategie en complicaties werden als cruciale uitkomstmaten gedefinieerd. De duur van mechanische ventilatie, duur van verblijf op de intensive care, en mortaliteit werden als belangrijke uitkomstmaten gedefinieerd.
Er werd één gerandomiseerde studie geïncludeerd (Azoulay, 2010). De studie rapporteerde de cruciale uitkomstmaten ‘nieuwe diagnose’ en ‘complicaties’. Azoulay (2010) vergeleek patiënten waarbij alleen non-invasieve diagnostische testen werden gebruikt met patiënten die naast de non-invasieve testen ook een BAL ondergingen. Het aantal patiënten waarbij geen diagnose gesteld kon worden, was gelijk tussen beide groepen (20,4 versus 21,7%). Er werd dus geen klinisch relevant verschil gevonden en daarmee geen voordeel van verrichten van een BAL in deze studie. Azoulay (2010) rapporteerde ook de noodzaak tot intubatie en mechanische ventilatie. Voor de noodzaak tot endotracheale mechanische ventilatie werd geen klinisch relevant verschil gevonden. Er werd eveneens geen klinisch relevant verschil gevonden voor de belangrijke uitkomstmaat ‘mortaliteit’, in deze studie gedefinieerd als mortaliteit binnen 28 dagen.
Kwaliteit van bewijs
De overall kwaliteit van bewijs is laag. Dit betekent dat we onzeker zijn over het gevonden geschatte effect van de cruciale uitkomstmaten. Er is afgewaardeerd vanwege risico op bias (gebrek aan blindering van patiënten en beoordelaars) en imprecisie (onnauwkeurigheid, omdat de betrouwbaarheidsintervallen één of meerdere grenzen overschrijdt).
Op grond van boven beschreven resultaten uit de RCT is er geen overtuigend bewijs voor of tegen het verrichten van een BAL bij immuun-gecompromitteerde patiënten op de IC. Op basis van recentere observationele literatuur kan echter een genuanceerder beeld geschetst worden.
Achtergrond
Een steeds toenemend aantal patiënten op de IC is immuun-gecompromitteerd en ongeveer de helft hiervan heeft een hematologische maligniteit (Zampieri-Romano, 2021; Vincent, 2018; Efraim study Azoulay, 2017). In het eerste behandeljaar is voor 7 tot 22% van de hemato-oncologische patiënten een IC opname noodzakelijk. De meest frequente opnamereden is respiratoire insufficiëntie (Azoulay-Soares, 2021). De IC mortaliteit varieert per hematologische aandoening en ligt tussen de 10 en 32%.
Etiologie acute respiratoire insufficiëntie
De oorzaken van de respiratoire insufficiëntie zijn divers. In ongeveer 60% van de gevallen is er sprake van een infectieuze oorzaak. In 33% van de gevallen is een bacteriële verwekker de oorzaak, in 13% van de gevallen een virale verwekker, 8% wordt veroorzaakt door Pneumocystis Jirovecii, en in 7% is er sprake van een invasieve aspergillose (Azoulay, 2019). De overige 40% zonder infectieuze oorzaak kan worden onderverdeeld in cardiaal oedeem (3%), direct ziekte gerelateerd (7%), overige oorzaken (12%), en oorzaak onbekend (15%).
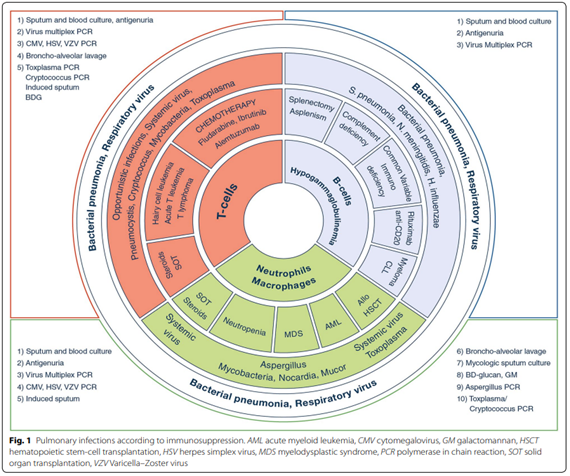
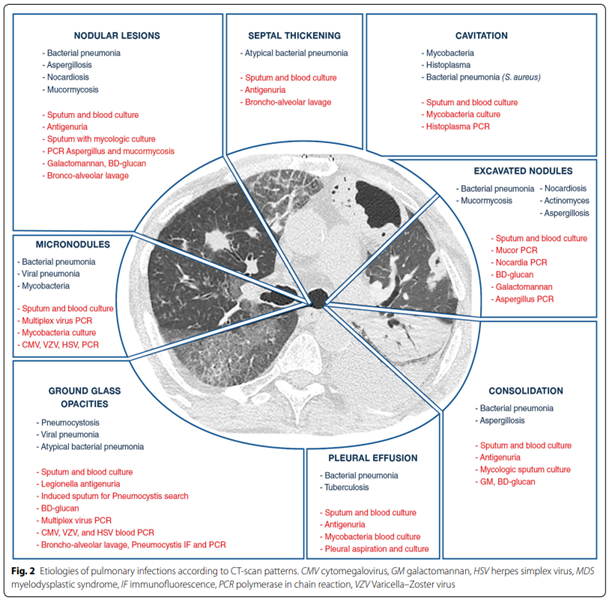
Om te bepalen welke van deze verscheidenheid aan oorzaken het meest waarschijnlijk is, dienen de duur en ernst van de klachten, mate en type van immuunstoornis, en het soort afwijkingen op de CT scan te worden meegewogen (Azoulay-Russel, 2020). Afbeelding 1 en 2 uit Azoulay (2020) bieden een handreiking voor de gedachtenvorming.
Afbeelding 1. Immunosuppressie en de te verwachten respiratoire infecties. Overgenomen uit Azoulay (2020)
Afbeelding 2. CT afwijkingen bij diverse respiratoire infecties. Overgenomen uit Azoulay (2020)
BAL versus andere diagnostiek
De gevarieerde etiologie betekent dat de toegevoegde waarde van een BAL per patiënt moet worden afgewogen. Het verrichten van een bronchoscopie met BAL zal met name van toegevoegde waarde zijn wanneer non-invasieve diagnostische testen ontoereikend (kunnen) zijn bij het stellen van de diagnose, zoals bij 1) specifieke infectieuze verwekkers (Pneumocystis Jirovecii, Aspergillus spp), 2) bij ziekte gerelateerde pulmonale complicaties (zoals pulmonale lokalisatie van lymfoom), of 3) toxiciteit van therapie (zoals een diffuus alveolaire bloeding) (Azoulay, 2019; Kamel, 2020).
Van de BAL wordt een diagnostische opbrengst tot 50% beschreven in de literatuur (Bauer, 2019; Choo, 2019). Een totaal van 22% van deze diagnoses waren ook aangetoond met non-invasieve tests, waarmee de extra opbrengst van de BAL uitkomst op ongeveer 28%. In 38% van de gevallen heeft de diagnose verkregen met BAL ook een aanpassing in beleid tot gevolg gehad (Bauer, 2019).
Risico’s BAL
De mogelijke voordelen van een BAL dienen te worden afgewogen tegen mogelijke complicaties. Deze staan hierna beschreven.
Respiratoire achteruitgang
In patiënten die ten tijden van de bronchoscopie op de IC niet invasief beademd worden, ligt de kans op significante respiratoire achteruitgang binnen 24 uur na de scopie rond de 30% (Kamel, 2020; Cracco, 2013). Mogelijk is de kans op complicaties kleiner bij een ervaren scopist dan bij een minder ervaren scopist (47% versus 28%) (Kamel, 2020).
De kans op respiratoire achteruitgang is beduidend kleiner op het moment dat de patiënt invasief beademd wordt. Dit ligt rond de 9%, al variëren de schattingen, ook naargelang de gebruikte definitie. Schnabel et al. lieten zien dat de gemiddelde P/F ratio daalt van 218 mm Hg naar 189 mmHg 1 uur na BAL bij geïntubeerde patiënten. Relevant gegeven is dat de P/F ratio na 24 uur weer steeg naar 233 mm Hg (Schnabel, BMC Pulm Med 2015). Dit suggereert dat, hoewel de respiratoire verslechtering significant kan zijn, deze ook meestal reversibel is.
Bloedingen
De kans op een endobronchiale bloeding is klein (<1%), maar kan oplopen tot 7% wanneer een BAL wordt verricht bij een patiënt met een trombocytopenie (NVALT richtlijn). Adequate suppletie van stollingsfactoren en trombocyten voorafgaand aan de procedure verkleint het risico (NVALT richtlijn).
Er zijn situaties waarbij er een indicatie bestaat voor bronchoscopie met BAL bij een respiratoir bedreigde patiënt die behandeld wordt met standaard O2-suppletie op de reguliere verpleegafdeling. In deze situatie dient te worden overwogen om de scopie te verrichten op de intensive care met respiratoire ondersteuning door NIV dan wel HFNC. Een kleine RCT uit 2011 liet zien dat desaturatie in deze patiëntengroep grotendeels voorkomen kan worden door NIV toe te passen (Antonelli, 2011). Er kan op basis van de literatuur geen voorkeur worden uitgesproken voor NIV danwel HFNC (Simon, 2014).
De eisen waaraan een BAL dient te voldoen worden beschreven in de leidraad bronchoscopie van de NVALT.
Eindconclusie
Respiratoire insufficiëntie is de meest frequente opname reden om op een IC te worden opgenomen voor een immuun-gecompromitteerde patiënt.
Alvorens over te gaan op een BAL, stel bij deze patiënten vast:
- Wat de duur, ernst en beloop van de respiratoire klachten zijn;
- welke specifieke immuniteit gestoord is;
- welke diagnoses op grond van het CT beeld waarschijnlijk zijn;
- welke micro-organisme je verwacht op grond van deze klinische, immunologische en radiologische argumenten; en
- of het mogelijk is de diagnose te stellen zonder BAL (bijvoorbeeld door gebruik van non-invasieve technieken).
Indien er op basis van bovenstaande ingeschat wordt dat een BAL van toegevoegde diagnostische waarde kan zijn, dient vervolgens een risicoafweging gemaakt te worden waarbij de kans op respiratoire verslechtering en endobronchiale bloeding wordt meegenomen.
Bij hoog-risico scopieën gaat de voorkeur ernaar uit de bronchoscopie te laten verrichten door een ervaren scopist, omdat er aanwijzingen zijn dat het risico op complicaties dan kleiner is, met name op het moment dat de patiënt niet geïntubeerd is.
De werkgroep ziet met name in de volgende situaties een rol weggelegd voor de bronchoscopie met BAL bij immuun-gecompromiteerde patiënten op de IC:
- Verdenking op infectieuze verwekkers waarbij BAL een essentieel onderdeel is van de diagnostiek (zoals P. Jirovecii, en Aspergillus infecties).
- Situaties waarbij er op basis van de beschikbare klinische, microbiologische, en radiologische informatie een reële verdenking bestaat op een ziekte of behandeling gerelateerde complicatie (zoals een diffuus alveolaire bloeding).
Waarden en voorkeuren van patiënten (en eventueel hun naasten/verzorgers)
De voordelen van een bronchoscopie kunnen groot zijn in de individuele patiënt op het moment dat hiermee een (nieuwe) diagnose wordt gesteld, waardoor de patiënt de juiste behandeling krijgt die de patiënt anders wellicht niet had gekregen. Op populatieniveau is er echter geen bewijs dat het routinematig verrichten van een bronchoscopie bij immuun-gecompromitteerde respiratoire insufficiënte patiënten leidt tot betere uitkomsten (Azoulay, 2019; Kamel, 2020).
De ongewenste effecten van een bronchoscopie zijn vaak van tijdelijke aard (transiënte hypoxemie), maar kunnen in een enkel geval bedreigend zijn voor de patiënt (zoals bij een ernstige endobronchiale bloeding). Daarnaast kan een bronchoscopie gepaard gaan met significant discomfort voor de patiënt. Patiënten en/of hun naasten dienen te worden geïnformeerd over zowel de te verwachten voordelen als ook de mogelijke complicaties en het ongemak dat de patiënt kan ervaren van een bronchoscopie. Handel bij interventies daarom conform de adviezen van de richtlijn Nazorg en Revalidatie van intensive care patiënten (2022). Betrek tevens zo veel mogelijk familie en, waar mogelijk, de patiënt zelf in de afwegingen rondom besluitvorming ten aanzien van het wel of niet verrichten van een bronchoscopie. Daarnaast is het van belang aandacht te houden voor de ontwikkeling van psychische klachten bij patiënt en/of naasten.
Kostenaspecten
Er zijn te weinig data voor een duidelijke uitspraak over kosteneffectiviteit. Echter zou de afweging inhouden dat naast de kosten voor invasieve diagnostiek ook andere aspecten mee moeten wegen (denk aan de kans op snellere diagnose met mogelijk minder andere diagnostische en therapeutische kosten).
Gelijkheid ((health) equity/equitable)
De interventie zal naar inschatting van de werkgroep niet leiden tot gezondheidsongelijkheid.
Aanvaardbaarheid:
Ethische aanvaardbaarheid
De werkgroep voorziet geen ethische bezwaren voor het verrichten of, op goede gronden, het juist niet verrichten van een bronchoscopie in deze patiëntenpopulatie.
Duurzaamheid
Naar mening van de werkgroep is er te weinig data ten aanzien van duurzaamheid om de keuze tussen de interventie (BAL) en controle behandeling (non-invasieve diagnostische testen) te sturen.
Haalbaarheid
Het verrichten van een bronchoscopie met BAL op de intensive care is onderdeel van standaardzorg in de dagelijkse praktijk en vereist geen nieuwe manier van zorgverlening.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De belangrijkste afwegingen die gemaakt zijn bij het formuleren van deze aanbeveling zijn:
1. De diagnostische opbrengst van een BAL:
(a) Bij de (klinisch-radiologische) verdenking op slechts een beperkt aantal verwekkers, en alleen in een host met daadwerkelijk een daarvoor relevante afweerstoornis, is er een duidelijke meerwaarde van het verrichten van een BAL (zie figuren bijlage 1-2).
(b) Bij de verdenking op een ziekte gerelateerde complicatie (bijvoorbeeld pulmonale lokalisatie van een lymfoom) kan een BAL van diagnostische meerwaarde zijn.
2. De kans op complicaties bij het verrichten van een BAL:
(a) Het grootste risico van het verrichten van een BAL is respiratoire achteruitgang en (transiënte) toename van hypoxemie en noodzaak tot intubatie en instellen van mechanische ventilatie.
(b) In de hemato-oncologische patiëntengroep met een trombocytopenie is het risico op bloedingen verhoogd, maar nog altijd minder dan 10% en nog verder te reduceren met adequate suppletie.
3. De klinische uitkomsten:
De literatuur toont aan dat een BAL vaak nieuwe diagnostische informatie oplevert en ook de behandeling van patiënten kan beïnvloeden. Echter er is te weinig data die aantoont dat de klinische uitkomsten in deze patiëntengroep verbeterd worden door het verrichten van een BAL bovenop reguliere diagnostiek.
Eindoordeel:
Conditioneel voor, sterk tegen.
Onderbouwing
Achtergrond
In the current guideline regarding hemato-oncology patients admitted to the ICU, the recommendation is to readily perform a bronchoscopy with bronchoalveolar lavage (BAL) in immunocompromised patients admitted to the ICU with (new/progressive) pulmonary abnormalities in whom there is uncertainty about the diagnosis. This recommendation is based on literature published more than 10 years ago In the last decade, significant changes have occurred in immunocompromised (hematologic-oncologic) patients: Many new therapies have been introduced, leading to a larger group of more selectively immunocompromised patients. There may be more diagnostic options available to achieve similar diagnoses less invasively. Benefits of BAL may be less obvious in the light of improving noninvasive diagnostics. Therefore, the current guideline needed revision regarding the role of BAL in immunocompromised ICU patients with new/progressive pulmonary abnormalities.
In the ICU, various procedures can be used to collect respiratory samples for analysis. These include:
- Bronchioalveolar lavage (BAL). A bronchoalveolar lavage is a bronchoscopy-guided lavage of the alveolar space, traditionally performed by placing the bronchoscope in wedged position such that the lumen of the bronchus is occluded by the bronchoscope. At this point sequential aliquots of normal saline are instilled (typically between 150-200 mL in total), and retrieved for analysis.
- Mini-BAL. Non-bronchoscopic technique used to obtain samples from the lower respiratory tract. A catheter is blindly inserted through endotracheal tube or tracheostomy and a small volume of normal saline (20-50 mL) is instilled and retrieved for analysis. It is explicitly not a BAL performed with smaller amounts of normal saline.
- Bronchial wash. In contrast to the BAL, the bronchoscope is not placed in the wedged position before instillation of normal saline, and smaller volumes are used. Samples collected in this way are not representative of the alveolar space.
This module provides guidance on the use of the BAL procedure as defined above. Importantly, it does not provide guidance on the usefulness of other procedures used to obtain respiratory samples. For a full description on how to perform the BAL we refer to the “Leidraad bronchoscopie” by the NVALT.
Conclusies / Summary of Findings
Summary of Findings
Population: FO-BAL plus non-invasive tests versus non-invasive tests only for immunologically compromised ICU/critically ill patients with signs of respiratory failure and new or progressive pulmonary infiltrates
Intervention: FO-BAL plus non-invasive tests
Comparator: non-invasive tests only
Click here to see this table in a document
|
Outcome Timeframe |
Study results and measurements |
Absolute effect estimates |
Certainty of the evidence (Quality of evidence) |
Summary |
|
|
Non-invasive tests only |
FO-BAL plus non-invasive tests |
||||
|
New diagnosis
|
Relative risk: 1.02 (CI 95% 0.89 - 1.17) Based on data from 219 participants in one study1
|
783 per 1000 |
799 per 1000 |
Low Due to serious risk of bias, Due to serious imprecision2 |
FO-BAL in combination with non-invasive tests may have little or no effect on new diagnosis rates in immunologically compromised ICU/critically Ill patients with signs of respiratory failure and new or progressive pulmonary infiltrates. |
|
Difference: 16 more per 1000 (CI 95% 86 fewer - 133 more) |
|||||
|
Need for endotracheal mechanical ventilation
|
Relative risk: 0.92 (CI 95% 0.65 - 1.29) Based on data from 219 participants in one study5
|
387 per 1000 |
356 per 1000 |
Low Due to serious risk of bias, Due to serious imprecision6 |
FO-BAL in combination with invasive tests may have little or no effect on need for endotracheal mechanical ventilation in immunologically compromised ICU/critically Ill patients with signs of respiratory failure and new or progressive pulmonary infiltrates. |
|
Difference: 31 fewer per 1000 (CI 95% 135 fewer - 112 more) |
|||||
|
28-day mortality
|
Relative risk: 0.88 (CI 95% 0.6 - 1.31) Based on data from 219 participants in one study7
Risk difference: -0.04 (95% CI -0.16 – 0.08) 219 participants in one study7 |
330 per 1000 |
290 per 1000 |
Low Due to serious imprecision, Due to very serious imprecision8 |
FO-BAL in combination with invasive tests may have little or no effect on 28-day mortality in immunologically compromised ICU/critically Ill patients with signs of respiratory failure and new or progressive pulmonary infiltrates. |
|
Difference: 40 fewer per 1000 (CI 95% 132 fewer - 102 more) |
|||||
1. Systematic review [1] with included studies: Azoulay (2010) Baseline/comparator Control arm of reference used for intervention.
2. Risk of Bias: serious. Inadequate/lack of blinding of participants and personnel, resulting in potential for performance bias, Inadequate/lack of blinding of outcome assessors, resulting in potential for detection bias; Imprecision: serious. Low number of patients, Only data from one study;
3. Systematic review [1] with included studies: Azoulay (2010) Baseline/comparator Control arm of reference used for intervention.
4. Risk of Bias: serious. Inadequate/lack of blinding of outcome assessors, resulting in potential for detection bias, Inadequate/lack of blinding of participants and personnel, resulting in potential for performance bias; Imprecision: very serious. Wide confidence intervals, Low number of patients;
5. Systematic review [1] with included studies: Azoulay (2010) Baseline/comparator Control arm of reference used for intervention.
6. Risk of Bias: serious. Inadequate/lack of blinding of participants and personnel, resulting in potential for performance bias, Inadequate/lack of blinding of outcome assessors, resulting in potential for detection bias; Imprecision: serious. Wide confidence intervals, Low number of patients;
7. Systematic review [1] with included studies: Azoulay (2010) Baseline/comparator Control arm of reference used for intervention.
8. Risk of Bias: no serious. Inadequate/lack of blinding of outcome assessors, resulting in potential for detection bias, Inadequate/lack of blinding of participants and personnel, resulting in potential for performance bias; Imprecision: very serious. Low number of patients, Wide confidence intervals.
Samenvatting literatuur
One randomized controlled trial was included in the analysis of the literature. Important study characteristics and results from the included randomized controlled trial are summarized in table 2.
Because of the inclusion of a randomized controlled trial, two observational studies which both matched the formulated PICO were excluded from this literature analysis. However, since both observational studies contained relevant information, both studies were presented descriptively in Table 3. The level of evidence was not graded for these two studies.
Table 2. Characteristics of included randomized controlled trial(s)
|
Study |
Participants |
Comparison |
Follow-up |
Outcome measures |
Comments |
Risk of bias |
|
Azoulay (2010) |
N at baseline Intervention: N = 113 Control: N = 106
Age (median, IQR) Intervention: 62 (49 to 69) years Control: 61 (50 to 71) years
Sex (male/female) Intervention: 79/34 Control: 74/32
Comorbidities Cardiovascular Intervention: 43/113 (38.1%) Control: 41/106 (38.7%)
Chronic respiratory insufficiency Intervention: 21/113 (18.8%) Control: 13/106 (12.3%)
Chronic renal insufficiency Intervention: 6/113 (5.3%) Control: 6/106 (5.7%)
Diabetes Intervention: 15/113 (13.3%) Control: 8/106 (7.6%) |
Intervention: Fiberoptic bronchoscopy with bronchoalveolar lavage (FO-BAL) plus non-invasive tests.
Control: Non-invasive tests only.
|
No information. |
New diagnosis I: 90/113 (79.6%) C: 83/106 (78.3%)
Change of treatment Not reported.
Need for endotracheal mechanical ventilation I: 40/113 (35.4%) C: 41/106 (38.7%)
Duration of mechanical ventilation Not reported.
Intensive care unit length of stay Not reported.
28-day mortality I: 33/113 (29.2%) C: 35/106 (33%)
In-hospital mortality Not reported. |
Supported by a grant from the Assistance-Publique Hôpitaux de Paris (AOM 04,139) and the French Society for Intensive Care Medicine. Funded primarily by the French Ministry of Health.
The authors are indebted to A. Wolfe for helping to prepare the manuscript. No potential conflict of interest relevant to this article was reported. |
LOW |
*For further details, see risk of bias table in the appendix
Table 3. Descriptive presentation of observational studies. The observational studies are excluded from the analysis of the literature and not graded.
|
Study |
Participants |
Comparison |
Outcome measures |
Comments |
|
Azoulay (2008) |
N at baseline N = 146 patients.
Age (mean, SD) Survivors: N = 66 Non-survivors: N = 82
Sex Survivors: N = 33 males Non-survivors: N = 49 males
Underlying malignancy Days since diagnosis of the malignancy Survivors: 243 (57-1112) days Non-survivors: 202 (44-897) days
Acute leukemia Survivors: 21/66 (31.8%) Non-survivors: 35/82 (42.7%)
Non-Hodgkin’s lymphoma Survivors: 19/66 (28.8%) Non-survivors: 17/82 (20.7%)
Myeloma Survivors: 5/66 (7.5%) Non-survivors: 6/82 (7.3%)
Solid tumor Survivors: 12/66 (18.2%) Non-survivors: 14/82 (17.0%)
Chronic myeloid or lymphocytic leukemia Survivors: 8/66 (12.1%) Non-survivors: 9/82 (11.0%)
Complete remission Survivors: 37/66 (56.0%) Non-survivors: 31/82 (38.0%) |
Intervention: Fiberoptic bronchoscopy and BAL procedure.
Control: Non-invasive diagnostic strategy consisting of variable combinations.
|
ICU stay During ICU stay, 75 (50.7%) patients required NIMV, 55 (37.2%) conventional MV, 91 (61.5%) vasopressors, and 47 (31.7%) renal placement therapy.
ICU mortality ICU mortality was 45.9%.
In-hospital mortality In-hospital mortality was 55.4%.
Independent determinants of hospital mortality by multivariable analysis
Related to the malignancy Remission of the malignancy OR 0.30 (95% CI 0.09 – 0.93)
Allogeneic bone marrow or stem cell transplantation OR 5.95 (95% CI 1.48 – 23.90)
Related to the cause of acute respiratory failure Admission during neutropenia recovery OR 0.13 (95% 0.03 – 0.57)
Undetermined diagnosis OR 8.65 (95% 1.39 – 53.56)
Related to the need for life-sustaining interventions Need for conventional mechanical ventilation OR 8.81 (95% CI 1.16 – 57.36)
Need for vasopressors OR 5.09 (95% 1.07 – 24.18) |
The authors have not disclosed any potential conflict of interest.
|
|
Bauer (2019) |
N at baseline Intervention: N = 618 Control: N = 969
Age (mean, SD) Intervention: 62.3 (53.3 – 69.9) years Control: 64.7 (55.2 – 72.4) years
Sex Intervention: 356/618 (58.3%) male Control: 583/969 (60.4%) male
Haematological malignancy any Intervention: 346/ 618 (56.0%) Control: 482/969 (49.7%)
Haematopoietic stem cell transplant Autologous Intervention: 44/618 (7.1%) Control: 56/969 (5.8%)
Allogeneic Intervention: 82/618 (13.3%) Control: 69/969 (7.1%)
Systemic disease Intervention: 124/618 (20.1%) Control: 153/969 (15.8%)
Solid organ tumour Intervention: 168/618 (27.2%) Control: 382/969 (39.4%)
Solid organ transplant Intervention: 78/618 (14.1%) Control: 63/969 (7.3%)
Neutropenia Intervention: 95/618 (16.4%) Control: 154/969 (16.4%) |
Intervention: Non-invasive testing coupled with fiberoptic bronchoscopy.
Control: Non-invasive testing only. |
ICU length of stay I: 11 (6 – 19) days (N = 598) C: 5 (2 – 9) days (N = 955)
ICU mortality I: 248/618 (40.1%) C: 267/969 (27.6%)
In-hospital mortality I: 294/618 (49.0%) C: 378/969 (41.0%)
90-day mortality I: 325/618 (60.5%) C: 436/969 (53.7%)
Complications Intubation I: 533/618 (86.3%) C: 446/969 (46.0%) |
Conflict of interest: K. Amrein reports grants and personal fees for lecturing from Fresenius Kabi, personal fees for lecturing and advisory board work from Vifor Pharma and Shire, outside the submitted work. A. Demoule reports grants, personal fees and nonfinancial support from Philips, personal fees for lecturing and advisory board work from Baxter, personal fees for lecturing from Hamilton, grants and nonfinancial support from Fisher & Paykel, grants from French Ministry of Health, outside the submitted work. E. Azoulay reports personal fees for lecturing and travel support for conference attendance from Gilead, personal fees for lecturing from Baxter, personal fees for lecturing and nonfinancial support from Alexion, grants from Ablynx and MSD, and devices for trials from Fisher & Paykel, outside the submitted work.
Other authors declare nothing to disclose.
Funding information for this article has been deposited with the Crossref Funder Registry. |
Results
1. New diagnosis (critical)
New diagnosis was reported in one trial (Azoulay, 2010). The number of patients who underwent FO-BAL plus non-invasive tests and in which a diagnosis was identified was 90/113 (79.6%), compared to 83/106 (78.3%) in patients who underwent non-invasive tests only. This resulted in a relative risk of 1.02 (95% CI 0.89 to 1.17), in favor of BAL plus non-invasive tests. This difference was not considered clinically relevant.
2. Change of treatment (critical)
The outcome ‘change of treatment’ was not reported in the included randomized controlled trial of Azoulay (2010).
3. Complications (critical)
Need for endotracheal mechanical ventilation was reported in one trial (Azoulay, 2010). The number of patients who underwent FO-BAL plus non-invasive tests and required endotracheal mechanical ventilation was 40/113 (35.4%), compared to 41/106 (38.7%) in patients who underwent non-invasive tests only. This resulted in a relative risk of 0.92 (95% CI 0.65 to 1.29), in favor of FO-BAL plus non-invasive tests. This difference was not considered clinically relevant.
4. Duration of mechanical ventilation (important)
The outcome ‘duration of mechanical ventilation’ was not reported in the included randomized controlled trial of Azoulay (2010).
5. Intensive care unit length of stay (important)
The outcome ‘intensive care unit length of stay’ was not reported in the included randomized controlled trial of Azoulay (2010).
6. 28-day mortality (important)
The 28-day mortality rates were reported in one trial (Azoulay, 2010). The 28-day mortality rate in patients who underwent FO-BAL plus non-invasive tests was 33/113 (29.2%), compared to 35/106 (33.0%) in patients who underwent non-invasive tests only.
This resulted in a relative risk of 0.88 (95% CI 0.60 to 1.31) and/or a risk difference of -0.04 (95% CI -0.16 to 0.08), in favor of FO-BAL plus non-invasive tests. This difference was not considered clinically relevant.
7. In-hospital mortality (important)
The outcome ‘in-hospital mortality’ was not reported in the included randomized controlled trial of Azoulay (2010).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question(s):
What is the effectiveness of performing bronchoalveolar lavage in immunologically compromised, ICU/critically ill patients with signs of respiratory failure with new or progressive pulmonary infiltrates compared with no bronchoalveolar lavage/non-invasive options for diagnostics?
Table 1. PICO
| Patients | Immunologically compromised ICU/critically ill patients with signs of respiratory failure and new or progressive pulmonary infiltrates |
|
Intervention |
Bronchoalveolar lavage |
| Control | No bronchoalveolar lavage / other diagnostics |
| Outcomes | New diagnosis, change of treatment, complications, duration of mechanical ventilation, intensive care unit length of stay, 30-day mortality, in-hospital mortality |
| Other selection criteria |
Study design: systematic reviews and randomized controlled trials >10 patients per group |
Relevant outcome measures
The guideline panel considered new diagnosis, change of treatment, and complications as critical outcome measures for decision making; and duration of mechanical ventilation, intensive care unit length of stay, 30-day mortality, and in-hospital mortality as important outcome measures for decision making.
The guideline panel defined the following thresholds as minimal clinically important differences:
- New diagnosis: difference in risk ratio (RR) of 15% (RR <0.869 and > 1.15)
- Change of treatment: difference in risk ratio (RR) of 15% (RR <0.869 and > 1.15)
- Complications: difference in risk ratio (RR) of 10% (RR <0.909 and > 1.10)
- Duration of mechanical ventilation: ≥1 day
- Intensive care unit length of stay: ≥1 day
- 28-day mortality: absolute risk difference of 5%
- In-hospital mortality: absolute risk difference of 5%
Search and select (Methods)
A systematic literature search was performed by a medical information specialist using the following bibliographic databases: Embase.com and Ovid/Medline. Both databases were searched up to the 23rd of August 2024 for systematic reviews, RCTs and observational studies. Systematic searches were completed using a combination of controlled vocabulary/subject headings (e.g., Emtree-terms, MeSH) wherever they were available and natural language keywords. The overall search strategy was derived from three primary search concepts: (1) Hematological / hematopoietic stem cell transplant ICU patients; (2) bronchoalveolar lavage; (3) adults.
Duplicates were removed using EndNote software. After removal of duplicates a total of 2537 records were imported for title/abstract screening. Initially, 25 studies were selected based on title and abstract screening. After reading the full text, 24 studies were excluded (see the exclusion table under the tab ‘Evidence tabellen’), and one study was included.
Referenties
- Antonelli M. The feasibility and safety of fiberoptic bronchoscopy during noninvasive ventilation in patients with established acute lung injury: another small brick in the wall. Crit Care. 2011;15(5):191. doi: 10.1186/cc10342. Epub 2011 Sep 30. PMID: 22027334; PMCID: PMC3334728.
- Azoulay E, Mokart D, Rabbat A, Pene F, Kouatchet A, Bruneel F, Vincent F, Hamidfar R, Moreau D, Mohammedi I, Epinette G, Beduneau G, Castelain V, de Lassence A, Gruson D, Lemiale V, Renard B, Chevret S, Schlemmer B. Diagnostic bronchoscopy in hematology and oncology patients with acute respiratory failure: prospective multicenter data. Crit Care Med. 2008 Jan;36(1):100-7. doi: 10.1097/01.CCM.0000295590.33145.C4. PMID: 18090351.
- Azoulay E, Mokart D, Lambert J, Lemiale V, Rabbat A, Kouatchet A, Vincent F, Gruson D, Bruneel F, Epinette-Branche G, Lafabrie A, Hamidfar-Roy R, Cracco C, Renard B, Tonnelier JM, Blot F, Chevret S, Schlemmer B. Diagnostic strategy for hematology and oncology patients with acute respiratory failure: randomized controlled trial. Am J Respir Crit Care Med. 2010 Oct 15;182(8):1038-46. doi: 10.1164/rccm.201001-0018OC. Epub 2010 Jun 25. PMID: 20581167.
- Azoulay E, Mokart D, Kouatchet A, Demoule A, Lemiale V. Acute respiratory failure in immunocompromised adults. Lancet Respir Med. 2019 Feb;7(2):173-186. doi: 10.1016/S2213-2600(18)30345-X. Epub 2018 Dec 7. PMID: 30529232; PMCID: PMC7185453.
- Azoulay E, Russell L, Van de Louw A, Metaxa V, Bauer P, Povoa P, Montero JG, Loeches IM, Mehta S, Puxty K, Schellongowski P, Rello J, Mokart D, Lemiale V, Mirouse A; Nine-i Investigators. Diagnosis of severe respiratory infections in immunocompromised patients. Intensive Care Med. 2020 Feb;46(2):298-314. doi: 10.1007/s00134-019-05906-5. Epub 2020 Feb 7. PMID: 32034433; PMCID: PMC7080052.
- Azoulay E, Pickkers P, Soares M, Perner A, Rello J, Bauer PR, van de Louw A, Hemelaar P, Lemiale V, Taccone FS, Martin Loeches I, Meyhoff TS, Salluh J, Schellongowski P, Rusinova K, Terzi N, Mehta S, Antonelli M, Kouatchet A, Barratt-Due A, Valkonen M, Landburg PP, Bruneel F, Bukan RB, Pène F, Metaxa V, Moreau AS, Souppart V, Burghi G, Girault C, Silva UVA, Montini L, Barbier F, Nielsen LB, Gaborit B, Mokart D, Chevret S; Efraim investigators and the Nine-I study group. Acute hypoxemic respiratory failure in immunocompromised patients: the Efraim multinational prospective cohort study. Intensive Care Med. 2017 Dec;43(12):1808-1819. doi: 10.1007/s00134-017-4947-1. Epub 2017 Sep 25. PMID: 28948369.
- Azoulay É, Soares M, Lengliné É. Preempting critical care services for patients with hematological malignancies. Intensive Care Med. 2021 Oct;47(10):1140-1143. doi: 10.1007/s00134-021-06521-z. Epub 2021 Sep 14. PMID: 34519846.
- Bauer PR, Chevret S, Yadav H, Mehta S, Pickkers P, Bukan RB, Rello J, van de Louw A, Klouche K, Meert AP, Martin-Loeches I, Marsh B, Socias Crespi L, Moreno-Gonzalez G, Buchtele N, Amrein K, Balik M, Antonelli M, Nyunga M, Barratt-Due A, Bergmans DCJJ, Spoelstra-de Man AME, Kuitunen A, Wallet F, Seguin A, Metaxa V, Lemiale V, Burghi G, Demoule A, Karvunidis T, Cotoia A, Klepstad P, Møller AM, Mokart D, Azoulay E; Efraim investigators and the Nine-I study group. Diagnosis and outcome of acute respiratory failure in immunocompromised patients after bronchoscopy. Eur Respir J. 2019 Jul 25;54(1):1802442. doi: 10.1183/13993003.02442-2018. PMID: 31109985.
- Choo R, Anantham D. Role of bronchoalveolar lavage in the management of immunocompromised patients with pulmonary infiltrates. Ann Transl Med. 2019 Feb;7(3):49. doi: 10.21037/atm.2019.01.21. PMID: 30906753; PMCID: PMC6389578.
- Cracco C, Fartoukh M, Prodanovic H. Safety of performing fiberoptic bronchoscopy in critically ill hypoxemic patients with acute respiratory failure. Intensive Care Medicine.
- Kamel T, Helms J, Janssen-Langenstein R, Kouatchet A, Guillon A, Bourenne J, Contou D, Guervilly C, Coudroy R, Hoppe MA, Lascarrou JB, Quenot JP, Colin G, Meng P, Roustan J, Cracco C, Nay MA, Boulain T; Clinical Research in Intensive Care Sepsis Group (CRICS-TRIGGERSEP). Benefit-to-risk balance of bronchoalveolar lavage in the critically ill. A prospective, multicenter cohort study. Intensive Care Med. 2020 Mar;46(3):463-474. doi: 10.1007/s00134-019-05896-4. Epub 2020 Jan 7. PMID: 31912201; PMCID: PMC7223716.
- Schnabel RM, van der Velden K, Osinski A, Rohde G, Roekaerts PM, Bergmans DC. Clinical course and complications following diagnostic bronchoalveolar lavage in critically ill mechanically ventilated patients. BMC Pulm Med. 2015 Sep 29;15:107. doi: 10.1186/s12890-015-0104-1. PMID: 26420333; PMCID: PMC4588466.
- Simon M, Braune S, Frings D, Wiontzek AK, Klose H, Kluge S. High-flow nasal cannula oxygen versus non-invasive ventilation in patients with acute hypoxaemic respiratory failure undergoing flexible bronchoscopy--a prospective randomised trial. Crit Care. 2014 Dec 22;18(6):712. doi: 10.1186/s13054-014-0712-9. PMID: 25529351; PMCID: PMC4300050.
- Vincent JL, Lefrant JY, Kotfis K, Nanchal R, Martin-Loeches I, Wittebole X, Sakka SG, Pickkers P, Moreno R, Sakr Y; ICON and SOAP investigators; SOAP investigators. Comparison of European ICU patients in 2012 (ICON) versus 2002 (SOAP). Intensive Care Med. 2018 Mar;44(3):337-344. doi: 10.1007/s00134-017-5043-2. Epub 2018 Feb 15. PMID: 29450593; PMCID: PMC5861160.
- Zampieri FG, Romano TG, Salluh JIF, Taniguchi LU, Mendes PV, Nassar AP Jr, Costa R, Viana WN, Maia MO, Lima MFA, Cappi SB, Carvalho AGR, De Marco FVC, Santino MS, Perecmanis E, Miranda FG, Ramos GV, Silva AR, Hoff PM, Bozza FA, Soares M. Trends in clinical profiles, organ support use and outcomes of patients with cancer requiring unplanned ICU admission: a multicenter cohort study. Intensive Care Med. 2021 Feb;47(2):170-179. doi: 10.1007/s00134-020-06184-2. Epub 2020 Aug 7. Erratum in: Intensive Care Med. 2021 Feb;47(2):259-260. doi: 10.1007/s00134-020-06252-7. PMID: 32770267.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-01-2026
Beoordeeld op geldigheid : 26-01-2026
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire cluster ingesteld. Het cluster Intensive Care bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden geven hun expertise in, indien nodig. De volgende personen uit het cluster zijn betrokken geweest bij de herziening van deze module:
Clusterstuurgroep
- Dr. E.J. Wils, voorzitter, internist-intensivist, Franciscus Gasthuis & Vlietland, Rotterdam
- Dhr. K.H. de Groot, internist-intensivist, Máxima MC, Eindhoven
- Dhr. E.J. van Lieshout, internist-intensivist, Amsterdam UMC, Amsterdam
- Dr. J. van Paassen, internist-intensivist, LUMC, Leiden
- Prof. dr. K. Kaasjager, internist, UMC Utrecht, Utrecht
- Dhr. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden Ziekenhuis, Tilburg
- Mevr. S.J. Bakker, longarts-intensivist, Elkerliek Ziekenhuis, Helmond
- Dhr. R. van Vugt, anesthesioloog-intensivist, Sint Maartenskliniek, Nijmegen
- Dr. S.W.M. de Jong, longarts-intensivist, Franciscus Gasthuis & Vlietland, Rotterdam
Clusterexpertisegroep
- Dr. J. van Paassen, internist-intensivist, LUMC, Leiden
- Dr. J.F. Frencken, longarts, Erasmus MC, Rotterdam
Meelezers clusterexpertisegroep:
- drs. M. Samuels, anesthesioloog-intensivist, Slingeland Ziekenhuis, Doetinchem
- dr. H. Aardema, arts-microbioloog, UMCG, Groningen
- prof. dr. B. Sinha, professor medische microbiologie, UMCG, Groningen
- drs. A. Brenters, patiëntenvertegenwoordiger, FCIC/IC-Connect
Met ondersteuning van
- Drs. F.M. Janssen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. Wesselman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten via secretariaat@kennisinstituut.nl.
Gemelde (neven)functies en belangen stuurgroep
|
Naam |
Hoofdfunctie |
Nevenwerkzaamheden |
Gemelde belangen |
Restrictie |
|
Wils |
Intensivist, Franciscus Gasthuis & Vlietland, Rotterdam (betaald) |
MICU-arts Zuidwest Nederland (betaald) Intensivist/arts-onderzoeker, ErasmusMC, Rotterdam (GVO; onbetaald) Lid Richtlijnencommissie NVIC (onbetaald) Taskforce 'Acute Infectiologische Bedreigingen' (onbetaald) Lid commissie kwaliteit NVIC (onbetaald) Lid commissie Wetenschap & Innovatie (onbetaald) Bestuurslid stichting Heilige Geest Huis (onbetaald) |
NORMO2 project (ZonMW projectnummer 10430102110007) Normo2: Niet-invasieve respiratoire ondersteuning bij COVID-19 longfalen: uitkomsten en risicofactoren (geen projectleider)
Beterketen: Harmoniseren, optimaliseren en verbeteren van nazorg na intensive Care behandeling (geen projectleider) |
Geen restricties |
|
Van Paassen |
Instituut: LUMC |
Lid Richtlijnencommissie NVIC (onbetaald) Lid Task force Acute infectiologische bedreigingen (onbetaald) Plaatsvervangend opleider IC (onbetaald) |
ZonMw Sparcs@ICU Antimicrobial steardship programs in the Dutch ICUs: a theory-to-practice Gap analysis, rol als projectleider |
Geen restricties |
|
De Groot |
Instituut: Franciscus Gasthuis & Vlietland Functie: Internist - intensivist Werkzaamheden: Klinisch |
Richtlijn commissie NVIC (onbetaald) Klankbordgroep Richtlijn bloeding tractus digestivus (onbetaald) |
REMAP-CAP, lokale hoofdonderzoeker |
Geen restricties |
|
Van Lieshout |
internist-intensivist, Amsterdam UMC, Intensive Care, locatie AMC |
onbetaald: |
nvt |
Geen restricties |
|
Kaasjager |
internist acute geneeskunde UMCU UU/Gelre 0.8 FTE |
bestuur NVIAG, onbetaald, |
nvt |
Geen restricties |
|
Wilting |
Chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis Tilburg |
Landelijk/extern: Instructeur diverse cursussen (ATLS, HMIMS, basiscursus echografie NVIC) (onkostenvergoeding) Visiteur kwaliteitsvisitatie NVIC (onkostenvergoeding) Regio intensivist IC regio ZWN (geen vergoeding)
Ziekenhuis/intern (allen zonder vergoeding): Medisch Manager IC Tactisch planningsoverleg Kernteam kwaliteit en veiligheid Commissie nieuwbouw acute as Trauma commissie |
Nvt |
Geen restricties |
|
Bakker |
Longarts-intensivist Elkerliek Ziekenhuis Helmond |
Stuurgroeplid & instructeur Bronchoscopie echo thorax en tracheostomie cursus MUMC
Partner is orthopedisch chirurg in JBZ (geen belangenverstrengeling) |
|
Geen restricties |
|
Van Vugt |
Anestesioloog, Sint Maartenskliniek (loondienst) |
Stuurgroep Epilepsie (vacatiegelden) |
|
Geen restricties |
|
De Jong |
Longarts Intensivist ZGT Almelo |
FMS - Netwerk Startend Medisch Specialist - Onebtaald NVIC - Werkgroep arbeidsmarktproblematiek - Onbetaald NVALT - Sectie IC - Onbetaald |
Geen |
Geen restricties |
Gemelde (neven)functies en belangen expertisegroep
|
Naam |
Hoofdfunctie |
Nevenwerkzaamheden |
Gemelde belangen |
Restrictie |
|
Van Paassen |
Instituut: LUMC |
Lid Richtlijnencommissie NVIC (onbetaald) Lid Task force Acute infectiologische bedreigingen (onbetaald) Plaatsvervangend opleider IC (onbetaald) |
ZonMw Sparcs@ICU Antimicrobial steardship programs in the Dutch ICUs: a theory-to-practice Gap analysis, rol als projectleider |
Geen restricties |
|
Frencken |
Longarts, Erasmus MC |
Geen |
Geen |
Geen restricties |
|
Aardema |
Arts-microbioloog, UMCG |
Geen |
Geen |
Geen restricties |
|
Sinha |
Arts-microbioloog (hoogleraar academisch medisch specialist) |
Delegate, Dutch Committee on Antimicrobial Policy (SWAB) Delegate, SWAB Working Party on Antimicrobial Stewardship Chair, UMCG Committee on Antimicrobial Therapy (CAM) [until 12/2021] Vice-Chair, UMCG Committee on TB Delegate, UMCG Infection Committee Delegate, UMCG PK/PD Working Party Delegate, ECCMID Programme Committee Member, ESGAP & ESGBIES Delegate, SWAB Guideline on Antimicrobial Stewardship prerequisites |
Geen |
Geen restricties |
|
Brenters |
Ervaringsdeskundige |
Geen |
Geen |
Geen restricties |
|
Samuels |
Anesthesioloog-Intensivist in Slingeland ziekenhuis |
Voorzitter sectie IC namens NVA |
nvt |
Geen restricties |
Gemelde (neven)functies en belangen ondersteuning Kennisinstituut
|
Naam |
Hoofdfunctie |
Nevenwerkzaamheden |
Gemelde belangen |
Restrictie |
|
Janssen |
Adviseur Kennisinstituut |
PhD-kandidaat UMCU |
Vader werkzaam als directeur bij EMCM |
Geen restricties |
|
Wesselman |
Senior adviseur Kennisinstituut |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule voerden de clusterleden conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uit om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema bij Werkwijze).
|
Module |
Uitkomst raming |
Toelichting |
|
Bronchoalveolaire lavage (BAL) |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
Voor meer details over de gebruikte richtlijnmethodologie verwijzen wij u naar de Werkwijze. Relevante informatie voor de ontwikkeling/herziening van deze richtlijnmodule is hieronder weergegeven.