Typering/gradering diffuse gliomen
Uitgangsvraag
Op welke wijze dient typering/gradering van diffuse gliomen plaats te vinden?
Aanbeveling
Typeren en graderen van gliomen dient te worden gedaan conform de meest recente WHO-classificatie.
Bepaal de mutatiestatus van IDH bij alle gliomen. Bij patiënten van 55 jaar of jonger met negatieve immuunhistochemie dient dit gevolgd te worden door sequencing voor IDH1 en 2 mutaties.
Onderzoek bij alle gliomen met IDH-mutatie de aan- of afwezigheid van 1p/19q-codeleties. Dit dient onderzoek van de hele arm 1p en 19q te betreffen. Indien verlies van ATRX-expressie of een ATRX-mutatie is aangetoond kan dit achterwege blijven.*
Verricht uitgebreide moleculaire karakterisering bij twijfel over de diagnose en verdenking op een glioom.
Onderzoek op de aanwezigheid van H3F3-K27-mutatie bij patiënten met een glioom in de midline, met name in de thalamus, hersenstam, cerebellum of ruggenmerg.
Bepaal tenminste de MGMT-methyleringsstatus bij oudere patiënten en/of patiënten met een slechte conditie met een glioblastoom (zie module Behandeling ouderen/kwetsbaren).
Overwegingen
In de in 2016 uitgebrachte, gereviseerde WHO-uitgave ‘WHO Classification of Tumors of The Central Nervous System’ is een belangrijke verandering aangebracht in de definitie van de verschillende tumoren (Louis, 2016). Waar in voorgaande edities de definities van de representanten van de diffuus infiltrerende gliomen steeds gebaseerd waren op morfologische aspecten, zijn deze sinds de editie van 2016 bepaald door discriminerende genetische mutaties die constant voorkomen en prognostische waarde vertegenwoordigen. Dit betreft mutaties van het isocitraat-dehydrogenase-gen (IDH-mutant) en het gecombineerde verlies van de chromosoomarmen 1p en 19q (1p/19q-codeletie). IDH-mutatie (IDHmut) is een prognostisch gunstig teken bij astrocytaire tumoren en is diagnostisch voor de zogeheten IDHmut-astrocytomen (Wick, 2009; Eckel-Passow, 2015; Louis, 2016). Codeletie van 1p/19q tezamen met een IDH-mutatie is diagnostisch voor een oligodendroglioom (Cairncross, 2013; van den Bent, 2015; Louis, 2016). Ook voor zeldzaam voorkomende tumoren is de genetische handtekening definiërend geworden. Subsets van tumoren zoals het bij kinderen voorkomend ‘diffuse midline glioma’ met een H3F3AK27M-mutatie gelden als een aparte diagnose.1 Het voorkomen van de H3K27M-mutatie zonder de klinische context van een tumor op een midlinelocatie is echter onvoldoende om de diagnose te stellen (Louis, 2016; Meyronet, 2017; Louis, 2018).
1Het gaat om mutaties positie K27 van de histon-coderende genen H3F3A, HIT1H3B of HIST1H3C. De mutatie H3F3A (kortweg H3.3 K27M) komt echter het meest voor en is als zodanig opgenomen in de WHO).
Ook voor de gliomen uit de ‘circumscripte’ groep (pilocytair astrocytoom, ganglioglioom) hebben moleculaire karakteristieken een belangrijke klinische betekenis verworven. Het pilocytair astrocytoom wordt genetisch gekenmerkt door mutaties in de genen geassocieerd met mitogen-activated proteïne kinase (MAPK), in het bijzonder het BRAF-gen. Afgezien van relevantie voor tumorclassificatie zijn bepaalde mutaties ook geassocieerd met de tumormaligniteitsgraad. Zo zijn mutaties in astrocytaire IDH-wildtype (wt) tumoren van TERT, PTEN of EGFR indicatief voor de diagnose glioblastoom.
In 2021 werd een herziene editie van de WHO-classificatie uitgebracht, waarin nieuwe inzichten in tumornomenclatuur en gradering worden geïntroduceerd, en er een nog grotere rol voor moleculaire diagnostiek is weggelegd. Het is belangrijk zich te realiseren dat de diagnostiek op basis van de thans in de classificatie opgenomen mutaties op DNA-niveau een ‘moving target’ is. Het is goed mogelijk dat toekomstige classificaties niet alleen andere mutaties zullen includeren, maar ook zullen worden uitgebreid met karakteristieke expressiepatronen op RNA- en eiwitniveau en vooral op basis van verschillen in methyleringsprofiel.
De transitie van de voorgaande WHO-edities naar de edities uit 2016 en 2021 waarin genetische definities worden gehanteerd, is gecompliceerd. De problemen die zich kunnen voordoen zijn:
De aansluiting van de oude op de nieuwe terminologie; in het verleden op morfologie / immunohistochemie gebaseerde diagnoses kunnen op basis van huidig moleculaire diagnostiek veranderen. Zo is de diagnose oligoastrocytoom in essentie verdwenen.
In de herziene editie van de WHO-classificatie van hersentumoren wordt de term ‘NOS’ (not otherwise specified) en ‘NEC’ (not elsewhere classified) toegepast. Indien moleculair onderzoek niet is verricht (om welke reden dan ook) of indien het technisch niet mogelijk was, zou ‘niet anders omschreven’ (NOS) moeten worden toegevoegd aan de diagnose, bijvoorbeeld: astrocytoom, WHO graad 2, NOS. Indien moleculair onderzoek wel is verricht en valide resultaten opleverde, maar er geen diagnose binnen de WHO classificatie aan kan worden gehangen, zou ‘niet elders te classificeren’ (NEC) moeten worden toegevoegd aan de diagnose, bijvoorbeeld histologisch een oligodendroglioom, maar zonder IDH-mutatie: oligodendroglioom, WHO graad 2 (of 3), NEC (Louis, 2018)
Diagnostische groepen
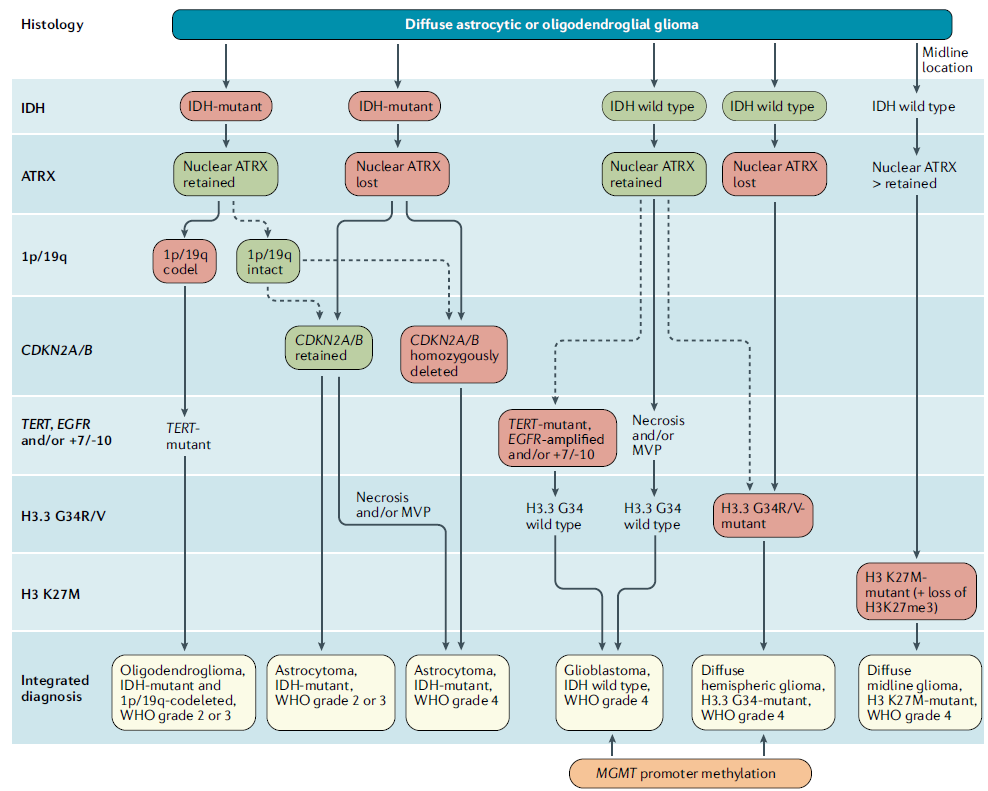
In onderstaande figuur worden de verschillende groepen diffuse gliomen weergegeven (Figuur 1). (kopie uit Weller, 2021)
Gradering van gliomen
In de WHO-classificatie wordt bij de gliomen allereerst onderscheid gemaakt tussen diffuse en circumscripte gliomen. Circumscripte gliomen betreffen bijvoorbeeld pilocytaire astrocytomen met een essentieel andere genetische opmaak (geen IDH-mutaties, wel vaak andere mutaties zoals BRAF-KIAA), pleomorf xanthoastrocytoma (PXA) en subependymale reuscel astrocytoma (SEGA). Deze richtlijn betreft alleen de diffuse astrocytaire en oligodendrogliale tumoren; de circumscripte blijven gezien de zeer lage prevalentie buiten beschouwing. De verschillende diagnostische categorieën zijn weergegeven in tabel 1.
De diffuse gliomen worden allereerst onderverdeeld in gliomen met en zonder IDH-mutatie; de IDH-gemuteerde tumoren worden vervolgens onderverdeeld in astrocytomen of oligodendrogliomen op basis van 1p/19q-status. Oligodendrogliale tumoren zijn per definitie IDH-gemuteerd, dit geldt in de nieuwe classificatie ook voor astrocytomen. IDH-mutant astrocytomen worden verder onderverdeeld in verschillende tumorgraderingen op basis van CDKN2A/B status en histologische kenmerken (microvasculaire proliferatie en necrose). IDH-wildtype gliomen worden glioblastoom genoemd. Patiënten met een graad 4, IDH-mutant astrocytoom hebben een significant betere overleving dan patiënten met een IDH-wildtype glioblastoom. (Shirahata 2018).
Tabel 1 Hoofdgroepen gliomen, conform WHO classificatie 2021
|
Diagnose |
Moleculaire karakteristieken |
|
Oligodendroglioom WHO graad 2 |
IDH mutant, 1p/19q codeletie |
|
Oligodendroglioom WHO graad 3 |
IDH mutant, 1p/19q codeletie |
|
Astrocytoom, IDHmut, WHO graad 2 |
IDH mutant, CDKN2A/B wildtype, frequent ATRX en/of TP53 mutatie |
|
Astrocytoom, IDHmut, WHO graad 3 |
IDH mutant, CDKN2A/B wildtype, frequent ATRX en/of TP53 mutatie |
|
Astrocytoom, IDHmut, WHO graad 4 |
IDH mutant, CDKN2A/B homozygote deletie, frequent ATRX en/of TP53 mutatie |
|
Glioblastoom, IDHwt |
IDH wildtype, vaak TERT mutatie, EGFR amplificatie, +7/-10 |
|
Diffuus ‘midline’ glioom |
IDH wildtype, H3K27 mutatie |
|
Diffuus hemisferisch glioom |
H3 G34-mutant |
Astrocytoom, IDHmut, WHO graad 2, 3 en 4
In de vorige classificatie (2016) werden er twee soorten diffuse astrocytomen gedefinieerd: astrocytomen IDHmut en astrocytomen IDHwt. In de huidige classificatie is er voor gekozen om alle IDH-mutante diffuse astrocytomen onder dezelfde noemer te scharen (astrocytoom, IDH mutant) en binnen deze groep te graderen als WHO graad 2, 3 of 4. De term glioblastoom is daarmee voor IDH-mutant astrocytomen in onbruik geraakt en alleen nog gereserveerd voor IDH wildtype WHO graad 4 astrocytomen.
IDHmut astrocytomen bestaan uit cellen die de voor astrocyten typische cytoplasmatische uitlopers of een meer afgeronde cytoplasmatische contour hebben (gemistocytair fenotype). De celkern is daarbij vaak vergroot en kan een abnormale vorm hebben. Zodra de polymorfie en pleomorfie van de cellen sterker zijn en de astrocytaire kenmerken van astrocyten minder duidelijk zijn, veelal in combinatie met een hogere celrijkdom en tevens het frequent voorkomen van mitosen, is de diagnose astrocytoom graad 3 morfologisch van toepassing. Met name de morfologische afgrenzing tussen astrocytoom WHO-graad 2 en astrocytoom WHO-graad 3 is subjectief.
Moleculaire veranderingen
De meeste diffuse astrocytomen hebben naast de kenmerkende IDH-mutaties ook mutaties in TP53 en ATRX. In de context van een astrocytaire tumor met zowel IDH-mutatie als verlies van ATRX-expressie en/of sterke p53-positiviteit kan de diagnose diffuus astrocytoom, IDH-mutant ook gesteld worden zonder testen van 1p/19q (Louis, 2018). Een homozygote deletie van CDKN2A/B is een belangrijke diagnostische en prognostische marker in IDH-mutant astrocytomen. Omdat gebleken is dat een homozygote CDKN2A/B deletie een zeer slechte prognose met zich meebrengt, rechtvaardigt de aanwezigheid van deze mutatie een WHO graad 4 toekenning (astrocytoom, IDH-mutant, WHO graad 4), onafhankelijk van de histologische gradering. (Brat, 2020) Indien dit type tumor geen mutatie in CDKN2A/B heeft, maar histologisch wel microvasculaire proliferaties en/of necrose laat zien, is het nog steeds een graad 4 tumor, maar is de prognose beter dan wanneer er wel een homozygote CDKN2A/B deletie aanwezig is. (Shirahata, 2018)
Oligodendroglioom
Het oligodendroglioom wordt gedefinieerd als een glioom met zowel een IDH-mutatie als het verlies van zowel de hele korte arm van chromosoom 1 en de gehele lange arm van chromosoom 19 (gecombineerd 1p/19q-verlies). De klassieke morfologie bestaat uit cellen met ronde kernen waar omheen cytoplasma, waarin geen intermediaire filamenten voorkomen, en dat door fixatie meestal verdwenen is. Hierdoor ontstaat een honingraatstructuur van het tumorweefsel.
Oligodendrogliomen worden onderverdeeld in WHO-graad 2 en WHO-graad 3. Voor de morfologische diagnose oligodendroglioom graad 3 is het voorkomen van microvasculaire proliferatie nodig, al of niet vergezeld door gebieden met necrose. Morfologisch kunnen oligodendrogliomen graad 3 overlappen met glioblastomen, die per definitie tot de astrocytaire tumoren behoren, echter de moleculaire eigenschappen zijn leidend voor de diagnose.
Moleculaire veranderingen
Naast de diagnostische combinatie van IDH-mutatie en 1p/19q-codeletie zijn mutaties in de TERT-promotor doorgaans aanwezig. De oligodendrogliale morfologie kan gezien worden bij andere tumoren zoals clearcell ependymomen, neurocytomen, dysembryoplastische neuro-epitheliale tumoren, sommige metastasen, maar deze tumoren missen de 1p/19q-codeletie. Anderzijds kan de oligodendrogliale genetische signatuur ook gevonden worden in tumoren met overwegend astrocytaire morfologie, bijvoorbeeld tumoren met veel gemistocytaire cellen, of in de randen van oligodendrogliomen, waar de morfologie van fibrillaire astrocyten kan overheersen. De moleculaire signatuur is echter leidend voor de diagnose en prognose.
Glioblastomen, IDHwt, WHO graad 4
Glioblastomen zijn diffuus infiltrerende astrocytomen van de hoogste maligniteitsgraad (WHO-graad 4), gekenmerkt door kernatypie, mitosen, microvasculaire proliferatie en necrose waarin in wisselende mate nog astrocytaire differentiatie wordt gezien.
Moleculaire veranderingen
Voor IDH-wildtype diffuse astrocytomen geldt dat de aanwezigheid van een TERT promotor (TERTp) mutatie, en/of een EGFR gen amplificatie, en/of +7/-10 een graad 4 toekenning rechtvaardigt. De diagnose glioblastoom, IDH-wildtype, WHO graad 4 kan worden gesteld in IDH-wildtype gliomen met aanwezigheid van necrose en/of microvasculaire proliferaties, en/of met aanwezigheid van één of meer van genoemde moleculaire afwijkingen (Brat, 2018). Hoewel enige voorzichtigheid betracht dient te worden bij histologisch graad 2 tumoren met enkel een TERTp mutatie (Berzero, 2021).
MGMT-promotormethylering
Patiënten met een WHO graad 4 glioom (IDHwt glioblastoom) met een gemethyleerde MGMT-promotor hebben na behandeling met temozolomide mediaan een langere overleving dan patiënten zonder deze methylering (Hegi, 2005; Wick, 2012). Echter ook bij patiënten zonder (aangetoonde) methylering van de MGMT-promotor wordt de mediane overlevingsduur verlengd door behandeling met temozolomide, zij het veel minder uitgesproken (Perry, 2017). Derhalve heeft de methyleringsstatus van MGMT zowel een prognostische als predictieve waarde.
Diagnostische procedure
Histologische beoordeling (laesionaal, tumor of geen tumor, primair of metastatisch, diffuus of circumscript, astro- of oligodifferentiatie, WHO-graad) dient altijd plaats te vinden op zo representatief mogelijk materiaal. Het vaststellen van moleculaire kenmerken kan vervolgens op twee manieren gedaan worden. Middels een next generation sequencing (NGS-)panel gericht op gliomen kunnen vrijwel alle voor gliomen relevante moleculaire veranderingen worden opgespoord1. In geval van een histologisch niet diagnostisch biopt kan moleculaire analyse soms toch een glioom op het spoor komen (Synhaeve, 2018). Een alternatieve en minder kostbare manier om moleculaire veranderingen vast te stellen, is middels immuunhistochemie van gemuteerde of overmatig tot expressie komende eiwitten. Mutatie van IDH1, EGFRvIII, TP53 en H3K27A leidt tot expressie van een gemuteerd eiwit dat middels immuunhistochemie kan worden aangetoond. Ook ATRX-mutatie kan immuunhistochemisch worden aangetoond door verlies van ATRX-expressie en sluit een oligodendroglioom uit (Cancer Genome Atlas research Network, 2015).
1 MGMT promotormethyleringsstatus wordt meestal in een aparte test bepaald.
De immunohistochemische test voor de expressie van het MGMT-eiwit correleert niet goed met gevoeligheid voor alkylerende chemotherapie (Quillien, 2012).
Conclusie
De uiteindelijke diagnose is een geïntegreerde diagnose op basis van de morfologische en moleculaire kenmerken. De gelaagde diagnose bestaat uit de histologische diagnose (tumorcategorie en WHO-graad), gevolgd door (alle) resultaten uit het moleculair onderzoek.
Onderbouwing
Achtergrond
In de richtlijn gliomen voor 2015 werd de diagnostiek van gliomen nog uitsluitend bepaald door microscopie, eventueel met immunohistochemie. In 2018 werd de richtlijn gereviseerd aan de hand van de criteria zoals neergelegd door de WHO in de gereviseerde vierde editie die in 2016 verscheen (Louis, 2016). In de laatste jaren is de moleculaire karakterisering verder toegenomen en verbeterd. In 2021 is er een nieuwe, vijfde, WHO-classificatie van centraal zenuwstelsel tumoren verschenen. Deze nieuwe classificatie is meegenomen in de herziening van de richtlijn in 2022/2023.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is geen systematische literatuuranalyse verricht maar is de WHO-classificatie (Louis, 2016) gebruikt. Naast deze editie verschenen publicaties van auteurs van de WHO-editie onder de titel cIMPACT-NOW (Consortium to Inform Molecular and Practical Approaches to CNS Tumor Taxonomy – Not Official WHO) waarin additionele, bijgewerkte aanbevelingen worden gedaan. Ook deze publicaties zijn meegenomen in deze modules. In ‘22/’23 is de module aangepast op basis van de vijfde WHO-classificatie (2021).
Referenties
- 1 - van den Bent, M.J., Brandes, A.A., Taphoorn, M.J., et al. (2013). Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol; 31(3): 344-50.
- 2 - Berzero G, Di Stefano AL, Ronchi S, Bielle F, Villa C, Guillerm E, Capelle L, Mathon B, Laurenge A, Giry M, Schmitt Y, Marie Y, Idbaih A, Hoang-Xuan K, Delattre JY, Mokhtari K, Sanson M. IDH-wildtype lower-grade diffuse gliomas: the importance of histological grade and molecular assessment for prognostic stratification. Neuro Oncol. 2021 Jun 1;23(6):955-966. doi: 10.1093/neuonc/noaa258. Erratum in: Neuro Oncol. 2023 Mar 21;: PMID: 33173941; PMCID: PMC8168809.
- 4 - Brat, D.J., Aldape, K., Colman, H., Holland, E.C., Louis, D.N., Jenkins, R.B., Kleinschmidt-DeMasters, B.K., Perry, A., Reifenberger, G., Stupp, R., von Deimling, A., Weller, M. (2018). cIMPACT-NOW update 3: recommended diagnostic criteria for "Diffuse astrocytic glioma, IDH-wild type, with molecular features of glioblastoma, WHO grade IV". Acta Neuropathol. 2018 Nov;136(5):805-810.
- 5 - Cairncross, G., Wang, M., Shaw, E., et al. (2013). Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 31(3): 337-43.
- 6 - Cancer Genome Atlas Research Network. (2015). Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas. New England Journal of Medicine, 372(26), 2481-2498.
- 7 - Eckel-Passow, J.E., Lachance, D.H., Molinaro, A.M., et al. (2015). Glioma Groups Based on 1p/19q, IDH, and TERT Promoter Mutations in Tumors. N Engl J Med 2015; 372(26): 2499-508.
- 8 - Hegi, M., Diserens, A., Gorlia, T., et al. (2005). MGMT Gene Silencing and Benefit from Temozolomide in Glioblastoma. N Engl J Med 2005; 352:997-1003.
- 9 - Louis, D.N., Giannini, C., Capper, D., Paulus, W., Figarella-Branger, D., Lopes, M.B., Batchelor, T.T., Cairncross, J.G., van den Bent, M., Wick, W., Wesseling P. (2018). cIMPACT-NOW update 2: diagnostic clarifications for diffuse midline glioma, H3 K27M-mutant and diffuse astrocytoma/anaplastic astrocytoma, IDH-mutant. Acta Neuropathol. 2018 Apr;135(4):639-642.
- 10 - Louis, D.N., Perry, A., Reifenberger, G., et al. (2016). The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 2016; 131(6): 803-20.
- 11 - Louis, D.N., Ohgaki, H., Wiestler, O.D., Cavenee, W.K., Ellison, D.W., Figarella-Branger, D., Perry A., Reifenberger G., Deimling von A. (2016). WHO classification of tumours of the Central Nervous System. 4 ed. Lyon: IARC.
- 12 - Louis, D.N., Wesseling, P., Paulus, W., Giannini, C., Batchelor, T.T., Cairncross, J.G., Capper, D., Figarella-Branger, D., Lopes, M.B., Wick, W., van den Bent, M. (2018). cIMPACT-NOW update 1: Not Otherwise Specified (NOS) and Not Elsewhere Classified (NEC). Acta neuropathologica;135(3):481-484.
- 13 - Meyronet, D., Esteban-Mader, M., Bonnet, C., et al. (2017). Characteristics of H3 K27M-mutant gliomas in adults. Neuro Oncol; 19(8): 1127-34.
- 14 - Perry, J.R., Laperriere, N., Mason, W.P. (2017). Radiation plus Temozolomide in Patients with Glioblastoma. N Engl J Med 2017;376:2197.
- 15 - Preusser, M., Charles Janzer, R., Felsberg, J., Reifenberger, G., Hamou, M.F., Diserens, A.C., Stupp, R., Gorlia, T., Marosi, C., Heinzl, H., Hainfellner, J.A., Hegi, M. (2008). Anti-O6-methylguanine-methyltransferase (MGMT) immunohistochemistry in glioblastoma multiforme: observer variability and lack of association with patient survival impede its use as clinical biomarker. Brain Pathol.;18(4):520-32.
- 16 - Quillien, V., Lavenu, A., Karayan?Tapon, L., Carpentier, C., Labussière, M., Lesimple, T., ... & Fina, F. (2012). Comparative assessment of 5 methods (methylation?specific polymerase chain reaction, methylight, pyrosequencing, methylation?sensitive high?resolution melting, and immunohistochemistry) to analyze O6?methylguanine?DNA?methyltranferase in a series of 100 glioblastoma patients. Cancer, 118(17), 4201-4211.
- 17 - Synhaeve, N.E., van den Bent, M.J., French, P.J., Dinjens, W.N.M., Atmodimedjo, P.N., Kros, J.M., Verdijk, R., Dirven, C.M., Dubbink, H.J. (2018). Clinical evaluation of a dedicated next generation sequencing panel for routine glioma diagnostics. Acta Neuropathol Commun. 23;6(1):126. doi: 10.1186/s40478-018-0633-y.
- 18 - Wick, W. et al. (2012). Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomised, phase 3 trial. Lancet Oncol. 2012; 13(7): 707-715.
- 19 - Wick, W., Hartmann, C., Engel, C., et al. (2009). NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with procarbazine, lomustine, and vincristine or temozolomide. J Clin Oncol; 27(35): 5874-80
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-07-2023
Algemene gegevens
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module 1 |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2 |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 3 Beeldvorming ter nadere differentiatie |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 4 Beeldvorming ten behoeve van behandeling |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met gliomen.
Werkgroep
- Mevr. dr. Monique Anten, neuroloog, Maastricht Universitair Medisch Centrum, Maastricht; NVN
- Mevr. dr. Jacoline Bromberg, neuroloog/ neuro-oncoloog, Erasmus MC, Rotterdam; NVN
- Mevr. drs. Sammy Olijslagers, neuroloog-in-opleiding, Canisius Wilhelmina Ziekenhuis, Nijmegen; NVN
- Mevr. drs. Sandra Huijs, neuroloog-in-opleiding, Zuyderland ziekenhuis, Heerlen; NVN
- Dhr. dr. Filip de Vos, internist-neuroloog, Universitair Medisch Centrum Utrecht, Utrecht; NIV
- Mevr. prof. dr. Marion Smits, radioloog, Erasmus MC, Rotterdam; NVvR
- Dhr. drs. Wouter Teunissen, radioloog-in-opleiding, Erasmus MC, Rotterdam; NVvR
- Dhr. Jelle de Vries, ervaringsdeskundige; Hersenletsel.nl
- Dhr. Hugo van Bers, ervaringsdeskundige; Hersenletsel.nl
- Dhr. dr. Joost Verhoeff, radiotherapeut-oncoloog, Universitair Medisch Centrum Utrecht, Utrecht; NVRO
- Dhr. prof. dr. Philip de Witt Hamer, neurochirurg, Amsterdam Universitair Medisch Centrum, Amsterdam; NVvN
- Mevr. Ilse Vosman, Verpleegkundig Specialist neuro-oncologie, Universitair Medisch Centrum Utrecht, Utrecht; V&VN (tot juni 2022)
Klankbordgroep
- Dhr. prof. dr. Johan Kros, ordinarius neuropathologie, Erasmus Medisch Centrum, Rotterdam; NVvP
Met ondersteuning van:
- Mevr. drs. Beatrix Vogelaar, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. dr. Josefien Buddeke, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. dr. Marja Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (dec 2021 tot april 2022)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Anten (voorzitter) |
Neuroloog, Maastricht UMC+ |
Geen |
Geen |
Geen |
|
Bromberg |
Neuroloog / neuro-oncoloog Erasmus MC, Rotterdam |
Bestuur stichting hersentumor.nl, onbetaald |
Geen |
Geen |
|
Olijslagers |
AIOS neurologie, |
Geen |
Geen |
Geen |
|
Huijs |
AIOS neurologie, Zuyderland Medisch Centrum |
Onderzoeker sarcopenie en invloed hiervan op prognose bij patiënten met glioblastoma multiforme (geen PI), onbetaald. |
Geen |
Geen |
|
Vos, de |
Internist-oncoloog, UMC Utrecht |
Lid palliatie consultatieteam UMC Utrecht, onbetaald |
Geen |
Geen |
|
Vosman |
Verpleegkundig Specialist AGZ (neuro-oncologie), UMC Utrecht |
Geen |
Geen |
Geen |
|
Smits |
Radioloog, Erasmus MC afdeling radiologie & nucleaire geneeskunde |
Voorzitter sectie neuroradiologie van de NVvR, onbetaald (tot 2021). Lid bestuur NVvR, portefeuille Wetenschap en internationale betrekkingen, onbetaald. Voorzitter van de Research Committee van de European Society of Radiology, onbetaald. |
Extern gefinancierde onderzoeksprojecten: - Deep Medical Imaging, gefinancierd door Convergence. - The Sound of Flow, gefinancierd door NWO Hestia. Consultancy Sprekershonorarium |
Geen |
|
Witt Hamer, de |
Neurochirurg, Amsterdam UMC, locatie VUmc |
Bestuurder stichting Hersentumor.nl, onbetaald |
Geen |
Geen |
|
Vries, de |
Projectmanager VanMeijel Automatisering |
Lid van het dagelijks bestuur van de Hersentumoren Contactgroep van hersenletsel.nl |
|
|
|
Bers, van |
ex-Patient |
Geen |
Geen |
Geen |
|
Verhoeff |
Associate professor radiotherapy UMC Utrecht |
Geen |
Geen |
Geen |
|
Teunissen |
Arts-onderzoeker afdeling radiologie en nucleaire geneeskunde, Erasmus MC Rotterdam
|
Geen |
Leading the change - Waarde van perfusie MRI bij hersentumoren - Geen projectleider |
Geen |
|
Kros (klankbordgroep) |
Hoogleraar / medisch specialist neuropathologie, Erasmus MC, Rotterdam |
Onbetaalde lidmaatschappen: |
Geen |
Geen |
|
Molag |
Adviseur, Kennisinstituut, Utrecht |
Geen |
Geen |
Geen |
|
Buddeke |
Senior adviseur, Kennisinstituut, Utrecht |
Geen |
Geen |
Geen |
|
Vogelaar |
Junior adviseur, Kennisinstituut, Utrecht |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenvereniging Hersenletsel.nl te betrekken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Hersenletsel.nl en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een glioom. Het verzoek om knelpunten aan te leveren is voorgelegd aanVerenso, Nederlands Huisartsen Genootschap, Nederlandse Vereniging van Ziekenhuizen, Patiëntenfederatie Nederland, Verpleegkundingen & Verzorgenden Nederland, Zelfstandige Klinieken Nederland, Zorgverzekeraars Nederland, Vereniging voor Neurologie, de Landelijke Werkgroep Neuro-Oncologie (via Vereniging voor Neurologie), Nederlandse vereniging voor Radiologie en de Nederlandse Vereniging van Klinische geriatrie via enquête. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.