Galweg- en Galblaascarcinoom - Chirurgische behandeling galblaascarcinoom
|
Disclaimer In aanvulling op de gebruikersvoorwaarden, die in deze onverkort van toepassing zijn, geldt hetgeen hierna staat. Deze richtlijn is eerder geplaatst geweest op Oncoline en is vooruitlopend op het actualiseren ervan, nu in deze database opgenomen. De richtlijn zoals die nu is opgenomen voldoet nog niet aan alle kwaliteitseisen die aan publicatie in de Richtlijnendatabase worden gesteld en is daarom als PDF geplaatst. De richtlijn zal modulair worden geactualiseerd in nog volgende onderhoudsronden. |
Zie het PDF-bestand 'Chirurgie galblaascarcinoom' in de bijlagen.
Onderbouwing
Conclusies
Preoperatief verdacht of bewezen galblaascarcinoom
Het is aannemelijk dat (een poging tot) een laparoscopische resectie van een galblaascarcinoom gepaard gaat met een slechtere overleving in vergelijking met een open resectie.
Hueman 2009 (3); Isambert 2011 (4); Lai 2008 (1); Jin 2011 (2)
Het is aannemelijk dat laparoscopie gebruikt kan worden ter stadiëring van het galblaascarcinoom en daarmee tot 38% van de laparotomieën voorkomen kan worden.
Gourgiotis 2008 (11); Agrawal 2005 (12); Weber 2002 (13)
De incidentie van galblaascarcinoom in porseleingalblazen ligt lager dan altijd aangenomen is en bedraagt 0-5%.
Khan 2011 (6); Towfigh 2001 (7); Stephen 2001 (8); Kim 2009 (9)
Peroperatief verdacht galblaascarcinoom
Men kan bij het peroperatief vaststellen of verdenking op een galblaascarcinoom direct een radicale oncologische resectie uitvoeren of de operatie afbreken en de patiënt verwijzen naar een hepatobiliair centrum.
Hueman 2009 (3); Ouchi 2002 (20); Shih 2007 (21); Fong 2000 (22)
Incidenteel gevonden galblaascarcinoom
Men zou na een postoperatief, incidenteel gevonden galblaascarcinoom de aanvullende chirurgie moeten laten afhangen van het T-stadium en het snijvlak van de ductus cysticus.
Hueman 2009 (3); Gourgiotis 2008 (11); Lai 2008 (1)
Tis en T1a galblaascarcinoom
Het is aannemelijk dat aanvullende chirurgische behandeling van het incidenteel gevonden Tis en T1a galblaascarcinoom geen overlevingswinst oplevert.
Hueman 2009 (3); Gourgiotis 2008 (11); Pilgrim 2009 (19); Lee 2011 (26)
T1b galblaascarcinoom
De werkgroep is van mening dat er geen consensus bestaat over overlevingsvoordeel van aanvullende chirurgische behandeling van het incidenteel gevonden T1b galblaascarcinoom.
Hueman 2009 (3); Lee 2011 (26); Jin 2011 (2)
T2 galblaascarcinoom
Het is aannemelijk dat aanvullende chirurgische behandeling van het T2 galblaascarcinoom overlevingsvoordeel oplevert.
Fuks 2011 (23); Goetze 2011 (39); Hueman 2009 (3)
T3 en T4 galblaascarcinoom
Het is aannemelijk dat chirurgische behandeling van het T3 en T4 galblaascarcinoom bij geselecteerde patiënten een overlevingsvoordeel biedt hoewel er verschil van mening hierover bestaat.
Hueman 2009 (3); Goetze 2010 (38); Goetze 2011 (39); Fuks 2011 (23); Gourgiotis 2008 (11)
Samenvatting literatuur
Bij de behandeling van het galblaascarcinoom moet onderscheid gemaakt worden tussen
- preoperatief verdacht of bewezen galblaascarcinoom (carcinomen die preoperatief gediagnosticeerd of verondersteld worden)
- peroperatief verdacht galblaascarcinoom (carcinomen die peroperatief tijdens een electieve cholecystectomie, voor galstenen of andere benige oorzaak, worden vastgesteld)
- incidenteel gevonden galblaascarcinoom (carcinomen die postoperatief bij toeval worden vastgesteld na pathologisch onderzoek van de galblaas)
Preoperatief verdacht of bewezen galblaascarcinoom
Van alle patiënten met een galblaascarcinoom, is dit in 30% van de gevallen preoperatief verdacht of bewezen. Tumoren die al preoperatief ontdekt zijn betreffen vaak T3 en T4 tumoren. Patiënten met T3 of T4 galblaastumoren mogen geen (poging tot) laparoscopische resectie krijgen (1) (2). Gallekkage tijdens laparoscopie treedt in 15-45% van de operaties op met peritoneale disseminatie tot gevolg, hetgeen gepaard gaat met een significant verminderde overleving (3) (4). Derhalve moeten patiënten met een preoperatief verdacht of bewezen galblaascarcinoom een open exploratie krijgen waarbij radicale resectie bij voorkeur meteen uitgevoerd kan worden (1) (2).
In het verleden werd de porseleingalblaas geassocieerd met een hoge incidentie van het galblaascarcinoom, oplopend tot 62% (5). Echter, in een recente review bleek deze associatie niet zo sterk (6). In 7 geanalyseerde studies met in totaal meer dan 60.000 cholecystectomieën, bleek de incidentie van porseleingalblaas 0,2% en bleek de incidentie van galblaascarcinoom in dergelijke galblazen 15%. Hierbij merken de auteurs op dat de incidentie van galblaascarcinoom in porseleingalblazen in de oudere literatuur hoger ligt dan in recentere literatuur. Uit de meest recente literatuur blijkt dat de incidentie 0-5% bedraagt (7) (8) (9), waarbij de incidentie hoger is in geval van focaal mucosale calciumdeposities in vergelijking tot diffuus intramurale calciumdeposities (8). Over de vraag of voor porseleingalblazen nog steeds de indicatie bestaat voor profylactische cholecystectomie bestaat geen consensus in de literatuur (6) (10).
Afhankelijk van het stadium van de tumor zijn peritoneale metastasen in 30%-75% aanwezig (3). Het verrichten van een diagnostische laparoscopie met eventueel laparoscopische echografie van de lever alvorens een laparotomie te verrichten kan zinvol zijn om peritoneale metastasen of additionele levertumoren op te sporen (11). De opbrengst van de diagnostische laparoscopie bedraagt 37-48% (12) (13). Op deze manier zou 38% onnodige laparotomieën voorkomen kunnen worden (12).
Tijdens een laparotomie of laparoscopie is het essentieel om tumorspil, door het openen van de galblaas of door tumor te snijden, tijdens de operatie te voorkomen (1).
Welke chirurgische behandeling moet volgen tijdens exploratie is afhankelijk van de uitgebreidheid in de lever, galwegen of andere omliggende structuren. De behandeling is afhankelijk van de uitgebreidheid van de tumor en kan variëren van alleen cholecystectomie tot partiële leverresectie (wigexcisie, resectie segmenten IVb en V, (extended) hemihepatectomie). Dit in combinatie met lymfadenectomie van het ligamentum hepatoduodenale en eventueel in combinatie met extrahepatische galwegresectie en (partiële) resectie van andere organen zoals pancreas, duodenum en colon (11) (1). Aangezien alleen R0-resectie kans geeft op lange-termijn overleving, moeten dergelijke resecties alleen verricht worden als R0 resectie mogelijk lijkt.
Het lange-termijn voordeel van agressieve chirurgie (uitgebreide resectie in combinatie met omliggende organen) is niet duidelijk en controversieel, mede gezien het feit dat dergelijke operaties gepaard gaan met hoge morbiditeit en mortaliteit (1). Met name in Japan is er een trend naar het uitvoeren van uitgebreide gecombineerde resecties (14) (15) (16) (11). Hierbij wordt 5-jaarsoverleving gerapporteerd van 7-87% met morbiditeits- mortaliteitspercentages van respectievelijk 40-57% en 0-6%. Maar bij deze studies kan sprake zijn van publicatiebias en zeer geselecteerde patiëntenpopulaties (1). Daarnaast betroffen deze studies kleine aantallen patiënten. Bij patiënten met een T3/T4 galblaascarcinoom is bij 19-25% sprake van positieve para-aortale lymfkliermetastasen (11)]. Bij dergelijke patiënten is geen overlevingswinst te behalen door chirurgische resectie (17). Over het algemeen wordt geadviseerd om niet routinematig agressieve chirurgische behandelingen, uitgebreide leverresectie in combinatie met resectie andere organen, uit te voeren. Het zou per individuele patiënt geëvalueerd moeten worden (11) (1) (18). Debulking van een galblaascarcinoom is niet zinnig en leidt niet tot overlevingswinst (11). Levermetastasen zijn een contra-indicatie voor uitgebreide resectie aangezien dit een manifestatie is van gedissemineerde ziekte (11).
Peroperatief verdacht galblaascarcinoom
Tijdens het uitvoeren van een open of laparoscopische cholecystectomie in verband met vermeend galsteenlijden of een andere reden kan er de suspectie op een galblaascarcinoom ontstaan. Dit kan voor of tijdens het verrichten van de cholecystectomie zijn of als de galblaas wordt geopend nadat de cholecystectomie verricht is. In beide gevallen moet er peroperatief stadiëring plaatsvinden door inspectie van het peritoneum, lever en de rest van het abdomen. Stadiëring kan ook plaatsvinden door het verrichten van biopsieën wanneer er afwijkingen zijn, die verdacht zijn voor metastasen (3). Biopsie van de galblaasafwijking of cholangiografie moet vermeden worden (3). Als de galblaas nog in-situ is, is het raadzaam echografie van de lever te verrichten om de uitgebreidheid van de tumor en de eventuele invasie hiervan in de lever vast te stellen (3). Wanneer de galblaas al verwijderd is, is het raadzaam om direct vriescoupe onderzoek te verrichten om de diagnose te bevestigen (3) (19). Vriescoupe onderzoek is geïndiceerd bij de volgende kenmerken (19) (2) (4):
- macroscopisch gecontraheerde of sclerotische mucosa
- macroscopische of palpabele verdikkingen of tumor van een deel van de galblaaswand
- bindweefsel in plaats van normaal weefsel in alle wandlagen
- macroscopische kleurverandering van de mucosa
- de aanwezigheid van polypoïde afwijkingen, ulceratie of een massa
Pogingen om een voor carcinoom verdachte galblaas laparoscopisch te verwijderen moeten vermeden worden in verband met de verhoogde kans op gallekkage tijdens laparoscopie (3) (4). Of na het vaststellen van het galblaascarcinoom of bij hoge suspectie hierop direct een radicale oncologische resectie uitgevoerd moet worden, hangt af van de expertise en ervaring van de chirurg (3). Wanneer deze zich niet bekwaam acht, dan dient de operatie afgebroken te worden en moet patiënt verwezen worden naar een hepatobiliair centrum (3). Onderzoek laat zien dat dit geen nadelige gevolgen heeft voor de prognose van de patiënt (20) (21) (22).
Incidenteel gevonden galblaascarcinoom
Men spreekt van een incidenteel gevonden galblaascarcinoom als de pathologie-uitslag na een cholecystectomie bij toeval carcinoom laat zien. In de meerderheid van deze gevallen is cholecystectomie verricht in verband met symptomatische galstenen en betreft het een carcinoom in een relatief vroeg stadium (Tis-T2).
Of aanvullende chirurgische behandeling na een incidenteel galblaascarcinoom noodzakelijk is, is met name afhankelijk van het T-stadium van het galblaascarcinoom en daarnaast van de pathologie-uitslag van het snijvlak van de ductus cysticus. Doel is, naast het stadiëren van de tumor, het verbeteren van de lange-termijn overleving. Als aanvullende chirurgische behandeling noodzakelijk is, dan kan deze bestaan uit de volgende behandelingen (3) (11) (1):
- Leverchirurgie
- Lymfadenectomie
- Excisie van de trocar-insteekopeningen
- Inkorten van de ductus cysticus of het verrichten van een extrahepatische galwegresectie
Leverchirurgie
Leverchirurgie wordt uitgevoerd om eventueel aanwezige residuele ziekte te verwijderen en kan bestaan uit excisie van het galblaasbed tot uitgebreide leverresecties. Ondanks series die geen correlatie laten zien tussen de incidentie van residuele ziekte en het T-stadium (23), lijkt er wel een correlatie te bestaan waarbij de incidentie van residuele tumor voor T1, T2, T3 en T4 carcinomen respectievelijk 0-10%, 10-61%, 36-85% en 100% is (24) (25) (26). Hoe uitgebreid de aanvullende leverchirurgie moet zijn is omstreden. De trend lijkt meer leversparende, non-anatomische resecties te verrichten dan uitgebreide resecties wanneer dat niet strikt noodzakelijk is (17) (27). Dit komt omdat majeure leverresecties tot meer morbiditeit leiden en niet noodzakelijkerwijs tot overlevingswinst (24) (3).
Lymfadenectomie
Lymfkliermetastasen komen in 12% tot 45% van de patiënten met een incidenteel galblaascarcinoom voor (24). De incidentie hiervan is gecorreleerd met het T-stadium (24). Aanvullende regionale lymfadenectomie, in de vorm van excisie van de klieren van het ligamentum hepatoduodenale (inclusief portale en hilaire klieren), geeft belangrijke informatie weer over het stadium van de ziekte en verlaagt mogelijk de kans op lokaal recidief van de tumor (3). Radicale lymfadenectomie door middel van excisie van de klieren rondom de truncus coeliacus, peripancreatisch, periduodenaal en rondom de arteria mesenterica superior wordt niet routinematig geadviseerd omdat dit niet leidt tot overlevingswinst (28) (29). Een dergelijke dissectie zou uitgevoerd kunnen worden ter stadiëring. Bij positieve klieren zou het tot terughoudendheid moeten leiden tot het verrichten van additionele leverchirurgie (11).
Excisie van de trocar-insteekopeningen
Laparoscopische excisie van een galblaascarcinoom zou mogelijk kunnen leiden tot een verhoogde kans op recidief tumor ter plaatse van de insteekopeningen van de trocars (3). Dit zou het gevolg zijn van de CO2-insufflatie, het zogenaamde ‘schoorsteeneffect' aan het einde van de laparoscopische operatie waarbij de CO2 uit de buikholte wordt gelaten én door het manoeuvreren van laparoscopische instrumenten door de trocar-insteekopeningen (3). De incidentie van recidief tumor ter hoogte van de trocar-insteekopeningen varieert van 2-14% (23) (24) (1). Na galblaasperforatie tijdens laparoscopische resectie is tot 40% recidief tumor gemeld (30). Recidief tumor ter plaatse van de trocar-openingen is een uiting van peritoneale disseminatie en gaat gepaard met een slechtere overleving (22) (31) (32) (33). Omdat het de overleving niet verbetert wordt standaard excisie van de trocar-insteekopeningen dan ook niet aanbevolen (33).
Inkorten van de ductus cysticus of het verrichten van een extrahepatische galwegresectie
Als het snijvlak van de ductus cysticus niet vrij van tumorcellen is dan dient aanvullend de ductus cysticus ingekort te worden tot sprake is van een tumor-negatief snijvlak. Indien het snijvlak uiteindelijk positief blijft, dan moet resectie van de extrahepatische galweg verricht worden. De incidentie van een positief snijvlak van de ductus cysticus kan 20% bedragen (24). Bij deze patiënten blijkt tot circa 40% sprake van carcinoom in de ductus choledochus (24). Het routinematig verrichten van een extrahepatische galwegresectie verbetert de overleving niet, levert niet meer lymfklieren op en leidt tot meer morbiditeit in vergelijking tot het niet-verrichten van een extrahepatische galwegresectie (27) (34).
Tis en T1a galblaascarcinoom (zie figuur 1)
Na cholecystectomie van het Tis en T1a galblaascarcinoom bestaat wereldwijd consensus dat dit geen additionele behandeling behoeft (3) (11) (19) (26). In een review bleek de incidentie op lymfkliermetastasen 1.8% en trad recidief galblaascarcinoom in 1.1% van de patiënten op (26). De 5-jaarsoverleving is meer dan 90% na alleen cholecystectomie (2) (1). Retrospectieve analyse van de SEER-database liet een mediane overleving van 156 maanden na Tis galblaascarcinoom en van 93 maanden na T1a carcinoom zien (35). De overleving van deze patiënten werd niet beïnvloed door uitgebreidere resecties dan alleen cholecystectomie, lymfadenectomie of door excisie van de trocar-insteekopeningen (35) (19).
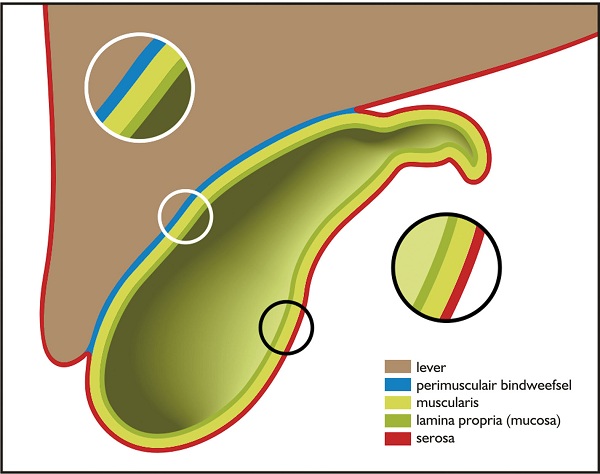
Figuur 1. Anatomische weergave van sagittale doorsnede van de galblaas en lever (L) waarin aangegeven de verschillende lagen van de galblaas
T1b galblaascarcinoom
Of patiënten met een T1b galblaascarcinoom aanvullende chirurgie moeten krijgen is controversieel in de literatuur (3) (26) (2). Een aantal retrospectieve studies laten 5-jaars overlevingspercentages van 95-100% zien na alleen cholecystectomie (36) (37).
Patiënten in de SEER-database, van wie de overleving niet werd beïnvloed door uitgebreidere resecties of lymfadenectomie, hadden een mediane overleving van 33 maanden (35). Anderen menen dat aanvullende chirurgie noodzakelijk is in verband met de kans op locoregionale recidieven en de aanwezigheid lymfkliermetastasen na alleen cholecystectomie. Lymfkliermetastasen tot 20%, residuele tumor tot 10% en recidief galblaascarcinoom tot 60% is gerapporteerd (26) (3) (19) (24). De 5-jaarsoverleving na T1b galblaascarcinoom varieert van 37.5%-100%, waarbij overleving minder dan 50% vaak patiënten betreft die enkel cholecystectomie ondergingen (26) (38) (23).
T2 galblaascarcinoom
De meerderheid (tot 67%) van de bij toeval gevonden galblaascarcinomen betreffen T2 tumoren (3). Studies hebben, bij deze patiënten met aanvullende chirurgie, residuele ziekte laten zien tot 61% en lymfkliermetastasen tot 62% (24) (25) (3) (11) (39). Na alleen cholecystectomie zijn tot 40% locoregionale recidieven beschreven (3). Meerdere retrospectieve studies laten zien dat er een overlevingsvoordeel te behalen valt met aanvullende chirurgie. De mediane overleving van patiënten in de SEER-database was 17 maanden (35). De overleving van patiënten die aanvullende resectie en lymfadenectomie kregen was significant beter dan patiënten die dat niet kregen. De 5-jaarsoverleving van patiënten die aanvullende chirurgie krijgt varieert van 52 tot 80% en is significant beter dan van patiënten na alleen cholecystectomie (0-41%) (23) (39) (3). Er is geen verschil in overleving tussen patiënten die een galblaasbedresectie kregen en een resectie van segmenten IVb en V (23).
T3 en T4 galblaascarcinoom
T3 en T4 tumoren zouden preoperatief vastgesteld moeten worden (19). Dergelijke tumoren groeien de lever en/of andere organen in en vereisen daardoor uitgebreidere resecties (39). De lange-termijn overleving na resectie van T3 tumoren door middel van cholecystectomie is laag (0-15%) (3) (38) (39) (23). Bij patiënten na een T3 carcinoom is het percentage residuele ziekte na cholecystectomie 36-85% en lymfkliermetastasen 38-46% (24) (25) (39). In geval van T4 carcinoom liggen deze percentages tot respectievelijk 100% en 80% (25).
Na aanvullende resectie, leverresectie al of niet in combinatie met andere organen, blijkt de 5-jaarsoverleving te variëren tussen 15% en 65% in geselecteerde patiëntengroepen na T3 carcinoom en 7-25% na T4 carcinoom (3) (38) (39) (23) (11). Agressieve chirurgie met uitgebreide resecties wordt niet standaard aanbevolen en zou voor iedere patiënt individueel bekeken moeten worden (19).
Referenties
- 1 - Lai EC, Lau WY. Gallbladder cancer – a comprehensive review. Surgeon. 2008;6:101-10.
- 2 - Jin K, Lan H, Zhu T, He K, Teng L. Gallbladder carcinoma incidentally encountered during laparoscopic cholecystectomy: how to deal with it. Clin Transl Oncol. 2011;13:25-33
- 3 - Hueman MT, Vollmer CM Jr, Pawlik TM. Evolving treatment strategies for gallbladder cancer. Ann Surg Oncol. 2009;16:2101-15.
- 4 - Isambert M, Leux C, Metairie S, Paineau J. Incidentally-discovered gallbladder cancer: When, why and which reoperation? J Visc Surg. 2011;148:e77-84.
- 5 - Etala E. Gallbladder cancer. Prensa Med Argent 1967; 54(28): 1479-84.
- 6 - Khan ZS, Livingston EH, Huerta S. Reassesing the need for prophylactic surgery in patients with porcelain gallbladder. Arch Surg 2011; 146(10): 1143-7.
- 7 - Towfigh S, McFadden DW, Cortina GR, et al. Porcelain gallbladder is not associated with gallbladder carcinoma. Am Surg 2001; 67(1):7-10.
- 8 - Stephen AE, Berger DL. Carcinoma in the porcelain gallbladder: a relationship revisited. Surgery 2001; 129(6): 699-703.
- 9 - Kim JH, Kim WH, Yoo BM, Kim JH, Kim MW. Should we perform surgical management in all patients with suspected porcelain gallbladder? Hepatogastroenterology 2009; 56(93): 943-5.
- 10 - Brown KM, Geller DA. Porcelain gallbladder and risk of gallbladder cancer. Arch Surg 2011; 146(10): 1148
- 11 - Gourgiotis A, Kocher HM, Solaini L, Yarollahi A, Tsiambas E, Salemis NS. Gallbladder cancer. Am J Surg. 2008;196:252-6.
- 12 - Agrawal S, Sonawane RN, Behari A, Kumar A, Sikora SS, Saxena R, et al. Laparoscopic staging in gallbladder caner. Dig Surg. 2005;22:440-5.
- 13 - Weber SM, DeMatteo RP, Fong y, Blumgart LH, Jarnagin WR. Staging laparoscopy in patients with extra-hepatic biliary carcinoma. Ann Surg. 2002;235:392-9.
- 14 - Sasaki R, Itabashi H, Fujita T, Takeda Y, Hoshikawa K, Takahashi Met al. Significance of extensive surgery including resection of the pancreas head for the treatment of gallbladder cancer – from the perspective of mode of lymph node involvement and surgical outcome. World J Surg. 2006;30(1):36-42.
- 15 - Shirai Y, Ohtani T, Tsukada K, Hatakeyama K. Combined pancreaticoduodenectomy and hepatectomy for patients with locally advanced gallbladder carcinoma: long term results. Cancer. 1997;80:1904-09.
- 16 - Araida T, Yoshikawa T, Azuma T, Ota T, Takasaki K, Hanyu F. Indications for pancreatoduodenectomy in patients undergoing lymphadenectomy for advanced gallbladder cancer. J Hepatobiliary Pancreat Surg. 2004;11:45-9.
- 17 - Kondo S, Nimura Y, Hayakawa N, Kamiya J, Nagino M, Uesaka K.Regional and para-aortic lymphadenectomy in radical surgery for advanced gallbladder carcinoma. Br J Surg. 2000;87:418-22.
- 18 - Miller G, Jarnagin WR. Gallbladder carcinoma. Eur J Surg Oncol. 2008;34:306-12
- 19 - Pilgrim C, Usatoff V, EvansPM. A review of the surgical strategies for the management of gallbladder carcinoma based on T stage and growth type of the tumour. Eur J Surg Oncol. 2009;35:903-7.
- 20 - Ouchi K, Mikuni J, Kakugawa Y, Organizing Committee, The 30th Annual Congress of the Japanese Society of Biliary Surgery.. Laparoscopic cholecystectomy for gallbladder carcinoma: results of a Japanese survey of 498 patients. J Hepatobiliary Pancreat Surg. 2002;9:256-60
- 21 - Shih SP, Schulick RD, Cameron JL, Lillemoe KD, Pitt HA, Choti MA, et al. Gallbladder cancer: the role of laparoscopy and radical resection. Ann Surg. 2007;245:893-901.
- 22 - Fong Y, Jarnagin WR, Blumgart LH. Gallbladder cancer: comparison of patients presenting initially for definitive operation with those presenting after noncurative intervention. Ann Surg. 2000;232:557-69
- 23 -
Fuks D, Regimbeau JM, Le Treut YP, et al. Incidental gallbladder cancer by the AFC-GBC-2009 Study Group. World J Surg 2011;35:1887-97
- 24 - Pawlik TM, Gleisner AL, Vigano L, Kooby DA, Bauer TW, Frilling A, et al. Incidence finding residual disease for incidental gallbladder carcinoma: implications for re-resection. J Gastrointest Surg. 2007;11:1478-87.
- 25 - Duffy A, Capanu M, Abou-Alfa GK, Huitzil D, Jarnagin W, Fong Y, et al. Gallbladder cancer (GBC): 10-year experience at Memorail Sloan-Kettering Cancer Centre (MSKCC). J Surg Oncol. 2008;98:485-9.
- 26 - Lee SE, Jang JY, Lim CS, Kang MJ, Kim SW. Systematic review on the surgical treatment for T1 gallbladder cancer. World J Gastroenterol. 2011;17:174-80.
- 27 - D’Angelica M, Dalal KM, DeMatteo RP, Fong Y, Blumgart LH, Jarnagin WR. Analysis of the extent of resection for adenocarcinoma of the gallbladder. Ann Surg Oncol. 2009;16:806-16.
- 28 - Bartlett DL, Fong Y, Fortner JG, Brennan MF, Blumgart LH. Long-term results after resection for gallbladder cancer. Implications for staging and management. Ann Surg 1996;224:639-46.
- 29 - Benoist S, Panis Y, Fagniez PL. Long-term results after curative resection for carcinoma of the gallbladder. French University Association for Surgical Research, Am J Surg. 1998;175:118-22.
- 30 -
Z'graggen K, Birrer S, Maurer CA et al. Incidence of port site recurrence after laparoscopic cholecystectomy for preoperatively unsuspected gallbladder carcinoma. Surgery. 1998;124:831-8
- 31 - Ricardo AE, Feig BW, Ellis LM et al. Gallbladder cancer and trocar site recurrences. Am J Surg. 1997;174:619-22.
- 32 - Pearlstone DB, Mansfield PF, Curley SA, Kumparatana M, Cook P, Feig BW.et al. Laparoscopy in 533 patients with abdominal malignancy. Surgery.1999;125:67-72.
- 33 - Maker AV, Butte JM, Oxenberg J, Kuk D, Gonen M, Fong Yet al. Is port site resection necessary in the surgical management of gallbladder cancer? Ann Surg Oncol. 2012;19:409-17.
- 34 - Pawlik TM, Choti MA. Biology dictates prognosis following resection of gallbladder carcinoma: sometimes less is more. Ann Surg Oncol 2009;16:787-8.
- 35 - Downing SR, Cadogan KA, Ortega G, Oyetunji TA, Siram SM, Chang DC, et al. Early-stage gallbladder cancer in the surveillance, epidemiology, and the end results database. Arch Surg. 2011;146:734-8.
- 36 - Sun CD, Zhang BY, Wu LQ, Lee WJ. Laparoscopic cholecystectomy for treatment of unexpected early-stage gallbladder cancer. J Surg Oncol. 2005;91:253-57.
- 37 - Shirai Y, Yoshida K, Tsukada K et al. Inapparent carcinoma of the gallbladder. An appraisal of a radical second operation after simple cholecystectomy. Ann Surg. 1992;215:326-31.
- 38 - Goetze TO, Paolucci V. Adequate extent in radical re-resection of incidental gallbladder carcinoma: analysis of the German Registry. Surg Endosc. 2010;24:2156-64.
- 39 - Goetze TO, Paolucci V. The prognostic impact of positive lymph nodes in stages T1 to T3 incidental gallbladder carcinoma: results of the German registry. Surg Endosc. 2012 May;26(5):1382-9. Nov 17. [Epub ahead of print].
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 20-05-2013
Laatst geautoriseerd : 20-05-2013
Geplande herbeoordeling :
De geldigheidsduur van deze richtlijn is vastgesteld op vijf jaar. De geldigheidstermijn voor de richtlijn wordt vanuit IKNL bewaakt. Om verscheidene redenen kan herziening eerder dan beoogd nodig zijn. De Landelijke Werkgroep Gastro-Intestinale Tumoren toetst daarom jaarlijks de actualiteit van de richtlijn. Het bestuur van deze landelijke werkgroep draagt de verantwoordelijkheid om de behoefte voor herziening van de huidige richtlijn bij de beroepsgroepen te peilen. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. Uiterlijk in 2017 zal een nieuwe multidisciplinaire werkgroep worden geïnstalleerd voor een herziene versie van de richtlijn.
Algemene gegevens
De Landelijke Werkgroep Gastro Intestinale Tumoren gaf in haar activiteitenplan 2011 aan behoefte te hebben aan revisie van de richtlijnen galgangcarcinoom en galblaascarcinoom. Het idee was om beide richtlijnen te bundelen in één nieuwe, evidence based richtlijn. De vorige consensus based versies van deze richtlijnen dateerden van respectievelijk oktober 2003 (galgang) en mei 2004 (galblaas).
Al bij het bespreken van de uitkomsten van de knelpunteninventarisaties onder professionals en patiënten (tweede bijeenkomst, mei 2011) waren er binnen de werkgroep, die met de revisie van de richtlijn aan de slag ging, twijfels over de haalbaarheid van een evidence based aanpak. De lage incidentie van beide tumorsoorten (zie onder Cijfers) brengt met zich mee dat er relatief weinig onderzoeksresultaten beschikbaar zijn. De werkgroep opteerde daarom uiteindelijk voor een opnieuw consensus based revisie van de richtlijn. Een consensus based gereviseerde richtlijn maakt óók gebruik van wetenschappelijke literatuur, echter zonder voorafgaande systematische zoektocht naar en beoordeling van literatuur door een (externe) methodoloog.
Naamgeving De vorige versie van de richtlijn hanteerde nog de term galgangcarcinoom. Diverse instanties (bijvoorbeeld de Maag Lever Darm Stichting) gebruiken in de regel de term galweg- of cholangiocarcinoom. Ook de TNM classificatie (zie hoofdstuk TNM) spreekt over galwegcarcinoom, en maakt daarbij onderscheid tussen kanker van de intra- of extrahepatische (binnen of buiten de lever gelegen) galwegen. De extrahepatische galwegcarcinomen worden vervolgens verder onderverdeeld in distale en proximale (of perihilaire) galwegcarcinomen. Laatstgenoemden worden ook wel Klatskin tumoren genoemd. Klatskin tumoren zijn de meest voorkomende vorm van galwegkanker.
De werkgroep heeft ervoor gekozen bovenstaande terminologie (galweg in plaats van galgang) in deze gereviseerde versie van de richtlijn over te nemen. Daarbij richt deze richtlijn zich met name op het proximaal gelokaliseerd galwegcarcinoom. Het distaal galwegcarcinoom komt aan bod in de richtlijn voor het pancreas(kop)carcinoom (zie richtlijn pancreascarcinoom) Galwegcarcinoom in de context van Primaire Scleroserende Cholangitis (PSC) is een aparte entiteit die buiten het kader van deze richtlijn valt. Graag verwijzen wij hieromtrent naar de EASL richtlijn voor PSC (www.easl.eu/_newsroom/press-release/easl-clinical-practice-guidelines-management-of-cholestatic-liver-diseases). Naast aandacht voor het proximaal galwegcarcinoom besteedt de gereviseerde richtlijn uiteraard opnieuw aandacht aan het galblaascarcinoom.
Cijfers Er zijn wat betreft proximaal galweg- en galblaascarcinoom relatief weinig (Nederlandse) cijfers over incidentie en prevalentie, sterfte en overleving. De Nederlandse Kankerregistratie (NKR) maakt pas sinds 2010 onderscheid tussen het distaal en het proximaal galwegcarcinoom. Dit resulteert in het volgende overzicht.
|
Incidentie, 2010 (bron: Nederlandse Kankerregistratie) |
|
|
Galblaas |
148 |
|
Extrahepatische galwegen (exclusief Papil van Vater), waarvan: |
297 |
|
+ Proximaal |
171 |
|
+ Distaal |
105 |
|
+ Onbekend |
21 |
Kanker van de galblaas of galwegen komt vooral voor bij mensen die ouder zijn dan zestig jaar. Het wordt meestal pas in een laat stadium ontdekt.
Doel en doelgroep
Doelstelling
Deze consensus based richtlijn bevat aanbevelingen gericht op het verbeteren van de kwaliteit van zorg voor patiënten met een proximaal galweg- of galblaascarcinoom. De onderwerpen waarop deze aanbevelingen betrekking hebben vloeien voort uit een voorafgaande inventarisatie onder professionals en patiënten van de belangrijkste knelpunten uit de dagelijkse praktijk.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met proximaal galweg- of galblaascarcinoom. Het betreft vooral maag-darm-leverartsen, chirurgen, internisten/medisch oncologen, pathologen, radiologen, radiotherapeuten en verpleegkundigen.
Samenstelling werkgroep
|
Naam |
Functie |
Werkplek |
Vereniging |
|
Prof. dr. T.M. van Gulik, voorzitter |
Chirurg |
AMC, Amsterdam |
NVvH |
|
prof.dr. M.J. Bruno |
MDL-arts |
EMC, Rotterdam |
NVMDL |
|
Mw. prof.dr. A.S.H. Gouw |
Patholoog |
UMCG, Groningen |
NVVP |
|
Dr. E. v.d. Linden |
Radioloog |
MCH, Den Haag |
NVvR |
|
Mw. prof. dr. I.D. Nagtegaal |
Patholoog |
UMC St Radboud, Nijmegen |
NVVP |
|
Mw. A. Ormeling |
Patiëntenvertegenwoordiger |
NFK |
NFK |
|
Mw. C. Pek |
Nurse-practioner |
EMC, Rotterdam |
V&VN |
|
Prof. dr. D.J. Richel |
Internist-oncoloog |
AMC, Amsterdam |
NIV |
|
H.J. Roelants |
Patiëntenvertegenwoordiger |
NFK |
NFK |
|
Mw. A. Schoorlemmer |
Verpleegkundig consulent |
AMC, Amsterdam |
V&VN |
|
Dr. E. Sieders |
Chirurg |
UMCG, Groningen |
NVVH |
|
Dr. G. van Tienhoven |
Radiotherapeut-oncoloog |
AMC, Amsterdam |
NVRO |
|
drs. J.J.F. de Groot, procesbegeleider |
Adviseur richtlijnen |
IKNL loc. Maastricht |
|
|
Mw. S. Janssen-van Dijk |
Secretaresse |
IKNL loc. Rotterdam |
Belangenverklaringen
Alle leden van de richtlijnwerkgroep hebben door middel van het invullen van een belangenverklaring verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn.
Inbreng patiëntenperspectief
De werkgroep bestond uit zowel vertegenwoordigers van een aantal professionele disciplines als ook uit een tweetal patiëntenvertegenwoordigers (namens Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK)). Een van beide patiëntenvertegenwoordigers was betrokken bij het aanpassen van de algemene tekst over nazorg en nacontrole voor patiënten met proximaal galweg- of galblaascarcinoom.
Als aanvulling op de enquête onder professionals vond een knelpunteninventarisatie plaats onder ervaringsdeskundigen; hiervoor werden vier patiënten geïnterviewd door een adviseur van de NFK. Dit gebeurde aan de hand van een gestructureerde vragenlijst, waarbij met name onderwerpen als diagnose (wanneer en waar gesteld, met behulp van welke technieken?) behandeling (waar en welke?), contact met lotgenoten en ervaren knelpunten aan bod kwamen.
Methode ontwikkeling
Consensus based
Implementatie
Het bevorderen van het gebruik van de richtlijn begint met een brede verspreiding, onder andere door middel van:
- het publiceren van de richtlijn op www.oncoline.nl
- het maken en verspreiden van een samenvattingskaartje deze kunt u bekijken en bestellen op www.iknl.nl
- het schrijven en aanbieden van een artikel ter publicatie in het Nederlands Tijdschrift voor Geneeskunde alsmede een samenvatting in het Nederlands Tijdschrift voor Oncologie.
Een goede verspreiding alléén is nog geen garantie voor daadwerkelijk gebruik van de richtlijn in de dagelijkse praktijk. Als aanvulling daarop ontwikkelt IKNL een implementatieplan. Dit plan bevat voor de belangrijkste aanbevelingen uit de richtlijn een overzicht van (mogelijk) belemmerende en bevorderende factoren voor toepassing van deze aanbevelingen. Op basis hiervan beschrijft het plan de belangrijkste doelgroepen en (adviezen voor) concrete acties om implementatie te bevorderen.
Evaluatie
De lage incidentie van galweg- en galblaascarcinoom (zie module Algemeen) bemoeilijkt statistisch verantwoord onderzoek naar naleving van deze richtlijn op basis van indicatoren. Om deze reden wordt afgezien van een evaluatie van de richtlijn op basis van gegevens uit de Nederlandse Kankerregistratie (NKR).
Werkwijze
De werkgroep startte met de revisie van de richtlijn in maart 2011 (eerste bijeenkomst werkgroep). Kort daarop (april/mei 2011) volgde een knelpunteninventarisatie in de vorm van een web-based enquête onder professionals. Deze is verspreid via diverse (mandaterende en andere) verenigingen, landelijke werkgroepen en regionale werkgroepen c.q. netwerken.
De vraag naar prioritering en eventuele aanvulling van de vooraf door de werkgroep opgestelde lijst met mogelijke knelpunten is door 203 professionals, met name chirurgen (32%) en MDL-artsen (27%), beantwoord.
Als aanvulling hierop vond een knelpunteninventarisatie plaats onder ervaringsdeskundigen; hiervoor werden vier patiënten geïnterviewd door een adviseur van de NFK (zie verder onder Patiëntenvertegenwoordiging).
Op basis van de uitkomsten van deze inventarisaties formuleerde de werkgroep een achttal uitgangsvragen (zie bijlage 4). Een van de kenmerken van een consensus based richtlijn is dat niet een (externe) methodoloog, maar de werkgroepleden zelf de voor beantwoording van deze vragen beschikbare literatuur aandragen. Om de volledigheid van deze zelf aangedragen literatuur te waarborgen, voerde een IKNL-adviseur een beperkte aanvullende literatuursearch uit. Zie voor een beschrijving van de daarbij gebruikte zoekstrategie (zie bijlage 5).
Naast het beantwoorden van de eerder genoemde uitgangsvragen heeft de werkgroep ook aandacht besteed aan het opnemen van het hoofdstuk over nazorg en nacontrole in de richtlijn galweg- en galblaascarcinoom. Dit hoofdstuk is een door het IKNL ontwikkelde algemene basistekst, gebaseerd op de richtlijnen ‘Detecteren behoefte psychosociale zorg' (juni 2010), ‘Herstel na kanker' (februari 2011) en ‘Oncologische revalidatie' (oktober 2011). Een aantal leden van de werkgroep (vertegenwoordigers van verpleegkundigen en patiënten) heeft de algemene tekst over nazorg en nacontrole op onderdelen verder toegespitst op patiënten met proximaal galweg- of galblaascarcinoom.
Een in april 2012 (vierde bijeenkomst werkgroep) besproken concept versie van de richtlijn is daarna door een gedeelte van de werkgroep ook redactioneel helemaal klaargemaakt voor de commentaarronde. De concept richtlijn is daartoe (juli 2012) aangeboden aan de mandaterende verenigingen en relevante regionale werkgroepen.
De vijfde en laatste bijeenkomst van de werkgroep (oktober 2012) stond vooral in het teken van het bespreken en verwerken van de - naar aanleiding van verspreiding van de concept versie - ontvangen commentaren.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
