Bestraalde erytrocytentransfusies bij kinderen en neonaten met kanker
Uitgangsvraag
1. What is the effect of irradiated RBC products on complications and other outcomes in children with cancer who need to undergo a RBC transfusion?
1. Wat is het effect van bestraalde RBC-producten op complicaties en andere uitkomsten bij kinderen met kanker die een RBC-transfusie moeten ondergaan?
2. What is the effect of irradiated RBC products on complications and other outcomes in neonates with cancer who need to undergo a RBC transfusion?
2. Wat is het effect van bestraalde RBC-producten op complicaties en andere uitkomsten bij pasgeborenen met kanker bij wie een RBC-transfusie moet worden toegediend?
Aanbeveling
De werkgroep is van mening dat bestraalde bloedproducten moeten worden gebruikt in het geval van een HLA-gelijkenis tussen donor (product) en ontvanger:
- Transfusie tussen 1e tot en met 3e graads verwanten van cel houdende bloedproducten;
- HLA compatibele trombocytenconcentraten.
- ZWAKKE aanbeveling. EXPERT evidence.
De werkgroep is van mening dat het granulocyten transfusieproduct bestraald moeten worden.
- ZWAKKE aanbeveling. EXPERT evidence.
De werkgroep is van mening dat bestraalde bloedproducten moeten worden gebruikt afhankelijk van de immuunstatus van de patiënt:
- Tijdens intra-uteriene transfusies, daarna tot en met 6 maanden na de à terme datum;
- Kinderen met aangeboren gecombineerde immuundeficiëntie (bijv. SCID);
- Verworven immuundeficiëntie zoals bij:
-
- Allogene stamceltransplantatie tot 1 jaar na transplantatie;
- Autologe stamceltransplantatie tot 6 maanden na transplantatie;
- Na toepassing van donor lymfocyten infusie (DLI) of infusie van cytotoxische T-lymfocyten (CTL) tot 1 jaar na transfusie.
- ZWAKKE aanbeveling. EXPERT evidence.
De werkgroep is van mening dat bestraalde bloedproducten moeten worden gebruikt in geval van patiënten met een langdurige T-cel depletie na medicatie:
- Fludarabine of andere T-cel depleterende therapie zoals het farmacotherapeutisch kompas dat aangeeft (tot 6 maanden na staken therapie);
- Medicatie die in combinatie met de ziekte een langdurige T-cel depletie geven, zoals anti-CD52 behandeling bij hematologische ziekten en ATG-behandeling bij aplastische anemie vanaf de instelling van de toediening tot 6 maanden na het voltooien van de behandeling.
- ZWAKKE aanbeveling. EXPERT evidence.
De werkgroep is van mening dat bestraalde bloedproducten moeten worden gebruikt in patiënten die CAR-T celtherapie krijgen vanaf 4 weken voor de leukaferese tot 1 jaar na de infusie. Tenzij anders beschreven in het onderzoeksprotocol.
- ZWAKKE aanbeveling. EXPERT evidence.
Overwegingen
Er waren geen pediatrische oncologische artikelen geïdentificeerd. De FMS (2019) heeft hierover een hoogwaardige richtlijn ontwikkeld met een AGREE II-score van 6 uit de 7. Zij baseren hun advies op een studie van Kopolovic (2015) en een enquete onder hemovigilantie-organisaties wereldwijd. Daarom heeft de werkgroep besloten de aanbevelingen met betrekking tot bestraalde bloedproducten uit de richtlijn van de FMS (2019) over te nemen. Enkel de indicatie voor het gebruik van CAR-T-cellen is toegevoegd, gebaseerd op de adviezen uit het huidige studieprotocol (het farmaceutische bedrijf dat de CAR-T cellen ontwikkelt, schrijft deze periode van bestraalde bloedproducten voor in studieverband).
Onderbouwing
Conclusies / Summary of Findings
E. Conclusions
As no studies were included, no conclusions were formulated.
Samenvatting literatuur
C. Discussion of the literature
C1: Discussion of the evidence
C1.1: Evidence in pediatric oncology
No pediatric oncology studies were included.
C1.2: Recommendations and evidence derived from guidelines
The only guideline that included recommendations for irradiated RBC products was the Dutch Association of Medical Specialists (FMS, 2019) based on one study (Kopolovic, 2015; a review cased on 348 case studies) and a survey under hemovigilance organisations worldwide:
- In case of HLA related products and donors:
- Transfusion between 1st to 3rd degree relatives of cell-containing blood products;
- HLA-compatible plated concentrates.
- In case of granulocyte transfusions
- Depending on the patient's immune status:
- During intrauterine transfusions until 6 months after the due date;
- Children with congenital combined immune deficiencies (e.g., SCID);
- Acquired immune deficiencies such as:
- Allogeneic stem cell transplantations up to 1 year after transplantation;
- Autologous stem cell transplantations up to 6 months after transplantation;
- After application of donor lymphocyte infusion (DLI) or infusion of cytotoxic T lymphocytes (CTL) up to 1 year after transfusion.
- In case of patients with prolonged T-cell depletion after medication:
- Fludarabine or other T-cell depleting therapy or indicated by the pharmacotherapeutic compass (up to 6 months after discontinuation of the therapy);
- Medications that, in combination with the disease, cause long-term T-cell depletions, such as anti-CD52 treatments in hematological diseases and ATG treatment in aplastic anemia from the initiation to 6 months after completion of the treatment.
C2: Description of the included studies
There were no primary pediatric oncology studies included from the systematic literature search and no additional studies from the additional literature review.
D. Results
As no studies were included, no results were presented.
Zoeken en selecteren
B. Background, search and selection, relevant outcomes, and methods
B1: Background
The background of red blood cell (RBC) transfusions in pediatric oncology is discussed in the “Background section” of Research question 1A.
B2: Search and selection
In order to be able to answer the clinical question, a systematic literature analysis was carried out into the following search questions:
What is the effect of irradiated RBC products on complications and other outcomes in children with cancer who need to undergo a RBC transfusion?
P = Children with cancer (aged 28 days-18 years) with curative intent who need to undergo a RBC transfusion for any indication
I = Irradiated RBC products
C = Non irradiated RBC products
O = Quality of life, transfusion-related complications, treatment-related complications, morbidity, mortality, admission to hospital, costs, late complications
What is the effect of irradiated RBC products on complications and other outcomes in neonates with cancer who need to undergo a RBC transfusion?
P = Neonates with cancer (aged 0-28 days) with curative intent who need to undergo a RBC transfusion for any indication
I = Irradiated RBC products
C = Non irradiated RBC products
O = Quality of life, transfusion-related complications, treatment-related complications, morbidity, mortality, admission to hospital, costs, late complications
B3: Relevant outcomes
The importance of outcomes and their hierarchy are discussed in the method section “Research questions and outcomes measures”.
B4: Methods
Evidence was searched in three electronic databases, in which (randomized) controlled trials including children and adolescents with cancer were eligible for inclusion. No pediatric oncology studies were included. Considering the scarcity of the primary evidence, the guideline panel decided that additional evidence ought to be sought in guidelines for general pediatric patients and for adults with cancer, reported in Supplemental Materials 1.
Referenties
- Federation of Medical Specialists. (2019). Startpagina - Bloedtransfusiebeleid - Richtlijn - Richtlijnendatabase. Federation of Medical Specialists. https://richtlijnendatabase.nl/richtlijn/bloedtransfusiebeleid/startpagina_-_bloedtransfusiebeleid.html
- Kopolovic, I., Ostro, J., Tsubota, H., Lin, Y., Cserti-Gazdewich, C. M., Messner, H. A., Keir, A. K., DenHollander, N., Dzik, W.
S., & Callum, J. (2015). A systematic review of transfusion-associated graft-versus-host disease. Blood, 126(3), 406–414.
https://doi.org/10.1182/blood-2015-01-620872
Evidence tabellen
Supplemental materials 1: Additional guidelines
The full description of the additional guidelines and the AGREE II-scores are presented in Addendum 5.
|
Research question 6A/B - The effect of irradiated RBC products in children and neonates with cancer |
|
|
Recommendations for children |
Federation of Medical Specialists (2019): Blood transfusion policy. AGREE II assessment: Domain 1 = 94%, Domain 2 = 100%, Domain 3 = 71%, Domain 4 = 89%, Domain 5 = 13%, Domain 6 = 100%, Overall Guideline Assessment: Score 6. Recommendations for irradiated RBC products according to Dutch Association of Medical Specialists (FMS, 2019):
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-08-2022
Beoordeeld op geldigheid : 29-06-2022
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2027 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde (NVK) of de modules van deze richtlijn nog actueel zijn. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVK is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Geldigheid van richtlijn
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2027 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde (NVK) of de modules van deze richtlijn nog actueel zijn. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVK is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Initiatief
NVK.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Voor wie is deze richtlijn bedoeld?
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor kinderen en neonaten met kanker die een curatieve behandeling ondergaan zoals, maar niet beperkt tot: medisch specialisten, verpleegkundigen of andere zorgverleners en patiënten die te maken hebben met kinderen met kanker.
Voor patiënten
Transfusies van rode bloedcellen zijn een belangrijk onderdeel van de ondersteunende zorg tijdens de behandeling van kinderkanker. Door bijvoorbeeld het geven van chemotherapie kan er beenmergonderdrukking ontstaan en kan er een tekort ontstaan aan rode bloedcellen. De behandelend arts kan een transfusie van rode bloedcellen voorschrijven wanneer deze noodzakelijk is en nadat er toestemming is gegeven door de wettelijk vertegenwoordiger (mits er geen sprake is van een acute en levensbedreigende situatie). Deze rode bloedcellen heten ook wel erytrocyten. Om het gebruik van bloedtransfusies zo optimaal mogelijk te houden, zijn in deze richtlijn adviezen voor erytrocytentransfusies bij kinderen met kanker vastgesteld, zodat ieder kind met kanker op het juiste moment een bloedproduct kan krijgen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2019 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen met kanker.
Samenstelling kernwerkgroep
- Drs. D.M. (Demi) Kruimer, ANIOS kindergeneeskunde, MSc Healthcare Management en arts-onderzoeker kinderoncologie Prinses Máxima Centrum, Utrecht, op persoonlijke titel
- Dr. E.A.H. (Erik) Loeffen, AIOS kindergeneeskunde, epidemioloog en postdoc onderzoeker kinderoncologie Prinses Máxima Centrum, Utrecht en Beatrix Kinderziekenhuis (Universitair Medisch Centrum Groningen), NVK
- Drs. D.C. (Debbie) Stavleu, arts-onderzoeker kinderoncologie Prinses Máxima Centrum, Utrecht en Beatrix Kinderziekenhuis (Universitair Medisch Centrum Groningen), op persoonlijke titel
- Dr. R.L. (Renée) Mulder, postdoc onderzoeker, richtlijn ontwikkelaar, methodoloog, Prinses Máxima Centrum, Utrecht, op persoonlijke titel
- Prof. Dr. L.C.M. (Leontien) Kremer, kinderarts, hoogleraar late effecten in kinderoncologie, Prinses Máxima Centrum, Utrecht en hoogleraar gepaste zorg, Amsterdam UMC, Amsterdam, NVK
- Prof. Dr. W.J.E. (Wim) Tissing, kinderoncoloog, hoogleraar Supportive Care, Prinses Máxima Centrum, Utrecht en Beatrix Kinderziekenhuis (Universitair Medisch Centrum Groningen), NVK
Samenstelling werkgroep
- Dr. D. (Dorine) Bresters, kinderoncoloog, Prinses Máxima Centrum, Utrecht, NVK
- Mw. J.H.P. (Janneke) Evers, MANP, verpleegkundig specialist, Prinses Máxima Centrum, Utrecht, V&VN
- Dr. J.P.J. (Sjef) van Gestel, kinderarts-intensivist, Wilhelmina Kinderziekenhuis (UMC Utrecht), Utrecht, NVK
- Dr. M.M. (Melanie) Hagleitner, kinderoncoloog, Prinses Máxima Centrum, Utrecht, NVK
- Dr. K.J.M. (Katja) Heitink-Pollé, kinderhematoloog-oncoloog, Prinses Máxima Centrum, Utrecht, NVK
- Drs. E.J. (Elise) Huisman, kinderarts-hematoloog, Sophia Kinderziekenhuis (Erasmus MC), Rotterdam, NVB
- Dhr. dr. G.O.R. (Geert) Janssens, kinderradiotherapeut, UMC Utrecht, Utrecht, NVRO
- Dr. P.H.M. (Philip) Kuijper, labaratorium specialist hematologie, Máxima Medisch Centrum, Veldhoven, NvKC
- Dhr. M.O. (Maarten) Mensink, kinderanesthesioloog, Prinses Máxima Centrum, Utrecht, NVA
- Dr. J.G. (Jeroen) Noordzij, kinderarts, Reinier de Graaf Gasthuis, Delft, NVK
- Mw. I. (Ida) Ophorst, MSc, kinderoncologie verpleegkundige, expert verpleegkundig onderzoek, Prinses Máxima Centrum, Utrecht, V&VN
- Mw. W. (Willemijn) Plieger, beleidsmedewerker VKN (Vereniging Kinderkanker Nederland)
- Dr. J. (Judith) Spijkerman, kinderarts, fellow kinderoncologie, Prinses Máxima Centrum, Utrecht, NVK
- Dr. A.F.W. (Lideke) van der Steeg, kinderchirurg, Prinses Máxima Centrum, Utrecht, NVvH
- Dr. M.D. (Marianne) van de Wetering, kinderoncoloog, Prinses Máxima Centrum, Utrecht, SKION
Bijzondere dank aan:
- Mw. E. (Erika) Heerema, onafhankelijk voorzitter
Kernwerkgroep
De kernwerkgroep bestond uit zes leden: een kinderoncoloog, een kinderarts, een kinderarts in opleiding/epidemioloog, een postdoc onderzoeker, een artsonderzoeker/promovendus, en een artsonderzoeker. De kernwerkgroep werd geleid door een van de artsonderzoekers (DK). De belangrijkste functies van de kernwerkgroep was het verwerven van de financiering, het definiëren van de uitgangsvragen, het samenstellen van de werkgroep, het coördineren van het literatuuronderzoek en de datacollectie, de kwaliteitsbeoordeling van de geïncludeerde studies, het organiseren en het begeleiden van de werkgroepbijeenkomsten, het maken van de aanbevelingen, het redigeren van de manuscripten voor indiening en als laatste het coördineren van de implementatie.
Opstelling werkgroep
Op basis van de uitgangsvragen werd een werkgroep ingesteld, bestaande uit de vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg van kinderen met kanker om de expertise in de werkgroep zo groot mogelijk te maken. De werkgroep bestond uit 21 leden. De volgende medische specialisten verenigingen waren vertegenwoordigd: Nederlandse Vereniging voor Kindergeneeskunde (NVK), Stichting Kinderoncologie Nederland (SKION), Vereniging Kinderkanker Nederland (VKN), Nederlandse Vereniging voor Anesthesiologie (NVA), Nederlandse Vereniging voor Heelkunde (NVH), Verpleegkundigen & Verzorgenden Nederland (V&VN), Nederlandse Vereniging Medische voor Radiotherapie en Oncologie (NVRO), Nederlandse Vereniging voor Bloedtransfusie (NVB) en Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerde de kernwerkgroep een aantal belangrijke en omvangrijke knelpunten. Deze werden vervolgens door de gehele werkgroep, inclusief alle afgevaardigden van de wetenschappelijke verenigingen, uitgebreid besproken en beoordeeld. Tevens zijn er nieuwe knelpunten aangedragen door de werkgroepleden. Hier is een volledige sessie aan gewijd met alle werkgroepleden in september 2019. In deze knelpunteninventarisatie is expliciet rekening gehouden met zowel het klinische belang van deze uitkomsten en de organisatie van zorg zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur.
Uitgangsvragen en uitkomstmaten
Op basis van de knelpuntenanalyse zijn door de kernwerkgroep een aantal concept-uitgangsvragen opgesteld. Deze uitgangsvragen zijn ontwikkeld volgens het PICO-format; Population (P), Intervention (I), Comparison (C) en Outcome (O). Deze uitgangsvragen zijn aan de volledige werkgroep voorgelegd waarna de definitieve uitgangsvragen zijn vastgelegd. Vervolgens is per uitgangsvraag geïnventariseerd door de werkgroep welke uitkomstmaten er relevant waren voor de patiënt. Hier ging het om zowel gewenste als ongewenste effecten. Deze uitkomsten zijn vervolgens groepsgewijs gerangschikt als cruciaal, belangrijk en onbelangrijk voor de besluitvorming rondom de aanbevelingen. Deze uitkomstmaten zijn door de werkgroep op basis van consensus geprioriteerd: mortaliteit, kwaliteit van leven, transfusie gerelateerde complicaties, behandelingsgerelateerde complicaties, morbiditeit en event free survival werden als cruciale uitkomsten beschouwd. Ziekenhuisopnames, late complicaties en kosten werden als belangrijke uitkomsten beschouwd, en er waren geen uitkomsten die als onbelangrijk werden beschouwd. Van deze uitkomsten werden mortaliteit, morbiditeit, transfusie gerelateerde complicaties, behandelingsgerelateerde complicaties en late complicaties beschouwd als ongewenste effecten. Kwaliteit van leven, event free survival, daling van kosten en minder ziekenhuisopnames werden beschouwd als gewenste effecten. In totaal zijn er zestien uitgangsvragen geformuleerd.
Individuele search
Strategie voor zoeken en selecteren van literatuur
Samen met een medisch bibliothecaris is een uitgebreid literatuuronderzoek opgesteld en uitgevoerd aan de hand van de opgestelde uitgangsvragen. PubMed, Embase, Cochrane CENTRAL werden doorzocht tot december 2019 met in totaal 6950 resultaten, waaruit 4 artikelen zijn geïncludeerd voor deze richtlijn. Dit literatuuronderzoek is geüpdatet in december 2020, waarna geen extra artikelen zijn geïncludeerd. Het volledige literatuuronderzoek is opgenomen in de bijlage (Addendum 2).
Er is een systematische review uitgevoerd van de literatuur over erytrocytentransfusies bij kinderen en neonaten met kanker. Studies kwamen in aanmerking voor inclusie als de onderzoekspopulatie bestond uit kinderen of neonaten zoals hierboven gedefinieerd met een evaluatie van erytrocytentransfusies. Gerandomiseerde gecontroleerde studies (RCT) kregen een sterke voorkeur. Wanneer er niet voldoende van deze studies geïncludeerd konden worden, konden er ook gecontroleerde onderzoeken anderszins worden opgenomen. Artikelen werden uitgesloten van inclusie als 1) de studies niet gerelateerd waren aan de indicaties voor erytrocytentransfusies bij kinderen en neonaten met kanker in curatieve opzet; 2) de interventie niet gerelateerd was aan een erytrocytentransfusie; 3) de studiepopulatie bestond uit volwassenen (gedefinieerd als leeftijd boven de 18 jaar); 4) de studiepopulatie bestond uit gemengde pediatrische en volwassen populatie met het onvermogen om de gegevens voor de kinderen te scheiden; 5) de studiepopulatie bestond uit dieren; 6) er geen originele onderzoeksgegevens beschikbaar waren (bijvoorbeeld systematische reviews); 7) Case-series en case-reports. Er was geen jaar of taalrestrictie.
Kwaliteitsbeoordeling individuele studies
Alle artikelen werden onafhankelijk gescreend en geselecteerd door twee auteurs (DK, DS) op basis van de vooraf gedefinieerde inclusie- en exclusiecriteria met behulp van Rayyan (Rayyan, 2021). Discrepanties werden opgelost door een derde onafhankelijke beoordelaar (EL). De data extractie werd gelijktijdig uitgevoerd door dezelfde onafhankelijke auteurs (DK, DS) om de nauwkeurigheid te vergroten. De geïncludeerde individuele studies werden systematisch beoordeeld om het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. De RCTs zijn kritisch beoordeeld op risk of bias (RoB) met behulp van de Cochrane Risk of Bias Assessment Tool for Randomized Trials (Cochrane Handbook for Systematic Reviews of Interventions, 2011). In geval van niet-RCTs werd de methodologie voor de RoB-beoordeling aangepast. De RoB-tool voor observationele studies, zoals beschreven is in het handboek van de International Guideline Harmonization Group (IGHG, 2021) is gecombineerd met een aantal aspecten van de RCT-tool, zoals hierboven beschreven. Door deze RoB-tools te combineren is er getracht om de best mogelijke tool te creëren om dit soort onderzoeken te beoordelen, te vinden in de bijlage (Addendum 3). De RoB is onafhankelijk uitgevoerd door dezelfde auteurs (DK, DS) en staat vermeld in Addendum 4. Bij discrepanties werd er overlegd met een derde reviewer (EL).
Aanvullende search
Strategie voor zoeken en selecteren van aanvullende literatuur
Gezien de schaarste van de geïdentificeerde primaire studies (n=4) besloot de werkgroep op zoek te gaan naar aanvullende evidence, namelijk in bestaande richtlijnen voor erytrocytentransfusies bij kinderen met kanker, kinderen in algemeen en volwassenen met kanker. Er is eerst oriënterend gezocht naar richtlijnen en vervolgens is de zoekstrategie gefocust op de specifieke uitgangsvragen. Er is gezocht naar alle termen met betrekking tot erytrocytentransfusies, zoals gedefinieerd in de uitgangsvragen. Aanvullende evidence en richtlijnen zijn gezocht op PubMed, Google, Joint Professional Advisory Committee (JPAC), National Institute for Health and Care Excellence (NICE), Guidelines International Network (GIN), American Society of Clinical Oncology (ASCO), International Pediatric Oncology Group (iPOG), Cancer Guideline Database, Federatie Medisch Specialisten (FMS) en Sanquin. In totaal zijn zeven richtlijnen geïncludeerd. De werkgroep heeft besloten om de individuele studies achter de aanbevelingen uit de richtlijnen te gaan gebruiken. De artikelen waarop de desbetreffende richtlijn zijn aanbevelingen heeft gebaseerd zijn samengevat in duidelijke evidence-tabellen en uitgezet per uitgangsvraag.
Kwaliteitsbeoordeling aanvullende literatuur
De geïncludeerde richtlijnen zijn op kwaliteit beoordeeld door twee onafhankelijke auteurs (DK, EL) op de AGREE II-methodologie, zie addendum 5 (AGREE II, 2009). Richtlijnen zijn opgenomen wanneer de AGREE II-eindscore 4 of hoger bedroeg.
Samenvatten van de literatuur
De verzamelde gegevens bestonden uit onderzoeks- en patiëntkenmerken, patiëntuitkomsten en de belangrijkste bevindingen, gepresenteerd in duidelijke evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven onder het kopje “Description of the literature”. Relatieve risico's en p-waarden werden geëxtraheerd uit de geïncludeerde studies en indien niet aanwezig werden ze berekend met behulp van Review Manager (RevMan) 5 (Review Manager, 2017). Bij voldoende overeenkomsten tussen de studies werden de gegevens middels RevMan 5 kwantitatief samengevat door middel van een meta-analyse. De mogelijkheid om de resultaten samen te voegen werd beoordeeld op basis van de homogeniteit in de baseline kenmerken van de participanten van de desbetreffende studie en de covariabelen van de individuele onderzoeken.
Beoordelen van de kracht van het wetenschappelijke bewijs
De beoordeling van de kracht van deze literatuur vond plaats volgens de GRADE-methode (Schünemann, 2013). GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’. De GRADE-methode onderscheidt vier niveaus voor de kwaliteit van het wetenschappelijke bewijs: hoog, redelijk, laag en zeer laag. Deze niveaus zeggen iets over de mate van zekerheid van de bevindingen en hieruit getrokken conclusies (Schünemann, 2013).
Tabel 1. Kwaliteit van evidence volgens GRADE (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
We hebben er alle vertrouwen in dat het werkelijke effect dicht bij dat van de schatting van het effect ligt. |
|
Redelijk |
We hebben matig vertrouwen in de effectschatting: het werkelijke effect zal waarschijnlijk dicht bij de schatting van het effect liggen, maar er is een mogelijkheid dat het substantieel anders is. |
|
Laag |
Ons vertrouwen in de effectschatting is beperkt: het werkelijk effect kan aanzienlijk verschillen van de schatting van het effect. |
|
Zeer laag |
We hebben heel weinig vertrouwen in de effectschatting: het werkelijke effect zal waarschijnlijk substantieel verschillen van de schatting van het effect. |
Formuleren van de conclusies
Voor elke relevante uitkomstmaat van de individuele search is het wetenschappelijk bewijs uit de evidence tabellen samengevat in een of meerdere literatuur conclusie tabellen met het bijbehorende niveau van bewijs, bepaald volgens de GRADE-methodiek. De werkgroepleden maakte de balans op in het zogeheten evidence to decision framework (Schünemann, 2013). Dit houdt in dat van elke interventie de gunstige en de ongunstige effecten van de erytrocytentransfusie bij een bepaalde Hb grens tegen elkaar af worden gewogen. Hierin werden de individuele studies uit zowel de initiële search naar kinderoncologie artikelen meegenomen als de individuele studies uit de richtlijnen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling, zijn naast de kwaliteit van het wetenschappelijke bewijs ook andere aspecten belangrijk en deze dienen meegewogen te worden, zoals de expertise van de werkgroepleden, de normen en waarden van de patiënt, voorkeuren van de ouders, beschikbaarheid van voorzieningen en organisatorische zaken. Indien deze aspecten niet meegenomen zijn in de literatuursamenvatting worden deze indien relevant vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
Op basis van het best beschikbare bewijs - gewogen in het evidence to decision framework - en de belangrijkste overwegen zijn aanbevelingen gemaakt die antwoord geven op de uitgangsvragen. De kracht van de aanbeveling wordt bepaald door zowel de kracht van het wetenschappelijke bewijs, maar ook door het gewicht dat door de werkgroep wordt gegeven aan de overwegingen. Dit betekent niet dat een lage bewijskracht automatisch tot een zwakke aanbeveling leidt en een hoge bewijskracht automatisch tot een sterke aanbeveling (Schünemann, 2013). Alle argumenten tezamen bepalen de uiteindelijke sterkte van de aanbeveling. Dit is conform de GRADE-methodiek.
Randvoorwaarden
Bij de ontwikkeling van de richtlijn is rekening gehouden met de organisatie van de zorg. Er is gepoogd een internationale richtlijn te maken, maar voor deze Nederlandse richtlijn is specifiek rekening gehouden met de Nederlandse situatie van de gezondheidszorg. Het gaat hier om alle aspecten die randvoorwaardelijk zijn voor het verlenen van goede zorg, zoals coördinatie, communicatie, menskracht, infrastructuur en (financiële) middelen. Wanneer er relevante randvoorwaarden een onderdeel maken voor het beantwoorden van een specifieke uitgangsvraag worden deze vermeld bij het kopje ‘overwegen’.
Kennislacunes
Per uitgangsvraag is door de gehele werkgroep nagegaan of er aanvullend onderzoek gedaan moet worden om de uitgangsvraag beter te kunnen beantwoorden. Een overzicht van de aanbevelingen voor aanvullend wetenschappelijk onderzoek is opgenomen in Addendum 1.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (kern)werkgroepleden voorgelegd. De commentaren werden verzameld en verwerkt en indien nodig besproken met de kernwerkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast naar de definitieve versie. De definitieve richtlijn werd aan de Nederlandse Vereniging voor Kindergeneeskunde voorgelegd en door hen geautoriseerd dan wel geaccordeerd.
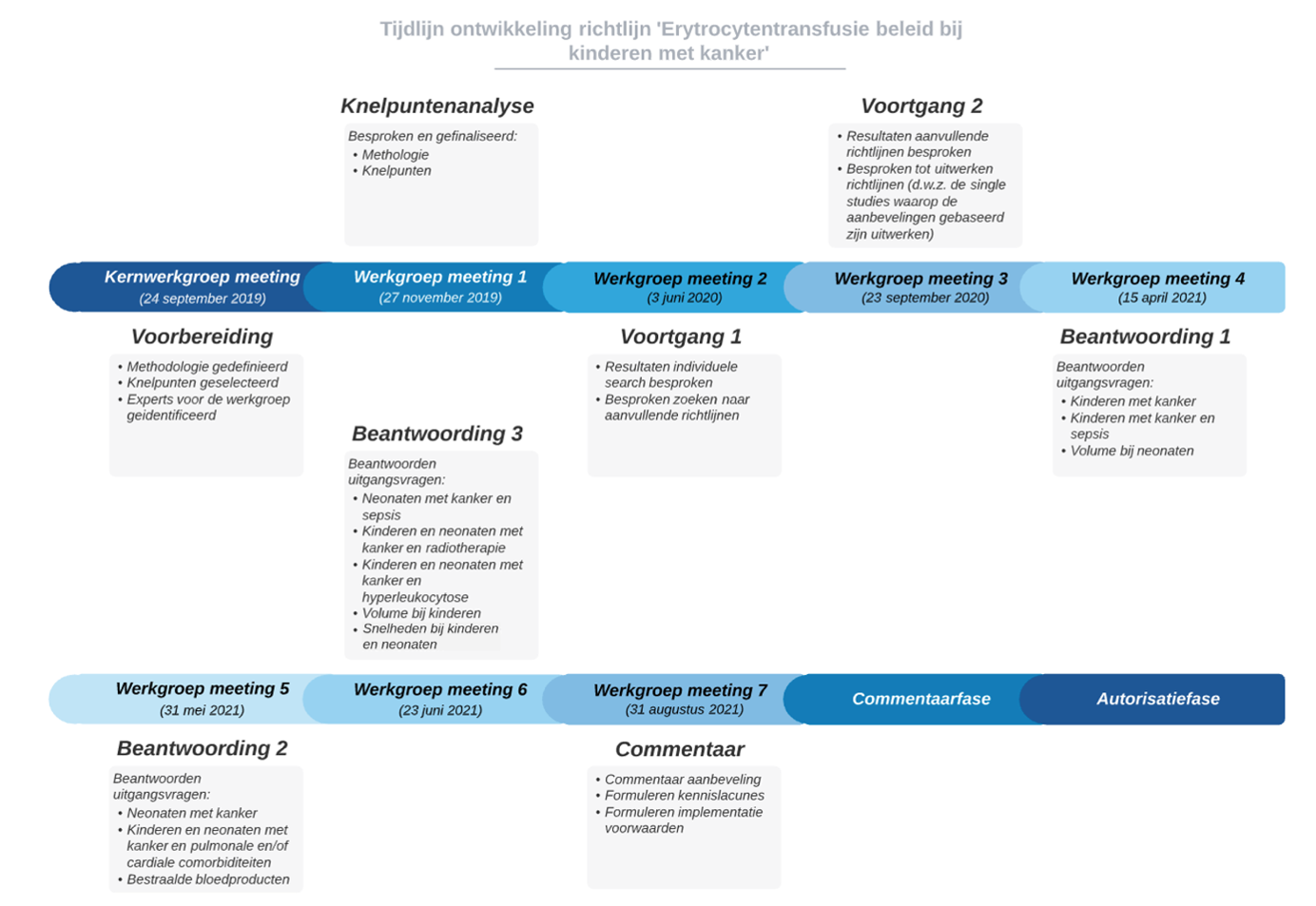
De werkgroep werkte gedurende twee jaar, vanaf september 2019 tot september 2021, in acht vergaderingen aan de totstandkoming van de conceptrichtlijn (Zie tijdlijn). De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep dd 26 april 2022. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd dd 29-06-2022.
Figuur 1. Tijdlijn ontwikkeling richtlijn ‘Erytrocytentransfusies bij kinderen en neonaten met kanker’.
Belangenverklaringen
Alle werkgroep leden hebben schriftelijk verklaard of zij directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroep leden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de NVK.
Kernwerkgroep
|
Kernwerkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Kruimer |
Arts-onderzoeker kinderoncologie Prinses Máxima Centrum, Utrecht |
ANIOS Kindergeneeskunde |
Geen |
Geen |
|
Loeffen |
Postdoc onderzoeker kinderoncologie Prinses Máxima Centrum, Utrecht en Beatrix Kinderziekenhuis (Universitair Medisch Centrum Groningen)
|
AIOS Kindergeneeskunde Epidemioloog B, Voorzitter Stichting Kinderboek & Wetenschap |
Geen |
Geen |
|
Stavleu |
Arts-onderzoeker kinderoncologie Prinses Máxima Centrum, Utrecht en Beatrix Kinderziekenhuis (Universitair Medisch Centrum Groningen) |
Geen |
Geen |
Geen |
|
Mulder |
Postdoc onderzoeker, richtlijn ontwikkelaar, methodoloog, Prinses Máxima Centrum, Utrecht |
Geen |
Geen |
Geen |
|
Tissing |
Kinderoncoloog, hoogleraar Supportive Care, Prinses Máxima Centrum, Utrecht en Beatrix Kinderziekenhuis (Universitair Medisch Centrum Groningen)
|
Geen |
Geen |
Geen |
|
Kremer |
Kinderarts, hoogleraar late effecten in kinderoncologie, Prinses Máxima Centrum, Utrecht en hoogleraar gepaste zorg, Amsterdam UMC, Amsterdam
|
Adviseur kenniscentrum palliatieve zorg, beurzen via KiKa, KWF, ZonMW in het kader van werkzaamheden onderzoeksgroep Late Effecten |
Geen |
Geen |
Werkgroep
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bresters |
Kinderoncoloog, Prinses Máxima Centrum, Utrecht |
Geen |
Geen |
Geen |
|
Evers |
Verpleegkundig specialist, Prinses Máxima Centrum, Utrecht |
Geen |
Geen |
Geen |
|
Gestel, van |
Kinderarts-intensivist, Wilhelmina Kinderziekenhuis, Utrecht |
Geen |
Geen |
Geen |
|
Hagleitner |
Kinderoncoloog, Prinses Máxima Centrum, Utrecht |
Geen |
Geen |
Geen |
|
Heitink-Pollé |
Kinderhematoloog-oncoloog, Prinses Máxima Centrum, Utrecht |
Voorzitter redactie werkboek kinderhematologie |
Geen |
Geen |
|
Huisman |
Kinderarts-hematoloog/Transfusiespecialist, Sophia Kinderziekenhuis (Erasmus MC), Rotterdam |
Transfusie specialist UTG, Sanquin Bloedvoorziening |
Geen |
Geen |
|
Janssens |
Kinderradiotherapeut, Wilhelmina Kinderziekenhuis, Utrecht |
Geen |
Geen |
Geen |
|
Kuijper |
Labaratorium specialist hematologie, Máxima Medisch Centrum, Veldhoven |
Docent Fontys Hogeschool |
Geen |
Geen |
|
Mensink |
Kinderanesthesioloog, Prinses Máxima Centrum, Utrecht
|
Bestuurslid sectie pijn- en palliatieve geneeskunde NVA |
Geen |
Geen |
|
Noordzij |
Kinderarts-infectioloog/ |
Geen |
Geen |
Geen |
|
Ophorst |
Kinderoncologie verpleegkundige, expert verpleegkundig onderzoek, Prinses Máxima Centrum, Utrecht |
Geen |
Geen |
Geen |
|
Plieger |
Beleidsmedewerker VKN (Vereniging Kinderkanker Nederland) |
Geen |
Geen |
Geen |
|
Spijkerman |
Kinderarts, fellow kinderoncologie, Prinses Máxima Centrum, Utrecht |
Geen |
Geen |
Geen |
|
Steeg, van der |
Kinderchirurg, Prinses Máxima Centrum, Utrecht |
Geen |
Geen |
Geen |
|
Wetering, van de |
SKION taakgroep Supportive Care, Kinderoncoloog, Prinses Máxima Centrum, Utrecht |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd ruim aandacht besteed aan het patiëntenperspectief door de Vereniging Kinderkanker Nederland (VKN) af te vaardigen in de werkgroep en in nauw contact te blijven gedurende het hele proces.
Methode ontwikkeling
Evidence based
Implementatie
Dit plan is opgesteld ter bevordering van de implementatie van de richtlijn “Erytrocytentransfusies bij kinderen en neonaten met kanker”. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijke bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die voor verschillende partijen ondernomen dienen te worden.
Werkwijze
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
- Per wanneer de aanbeveling geïmplementeerd moet kunnen zijn;
- De verwachte impact van implementatie van de aanbeveling op de zorgkosten;
- Randvoorwaarden om de aanbeveling te kunnen implementeren;
- Mogelijke barrières om de aanbeveling te kunnen implementeren;
- Mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- Verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbeveling is nagedacht over de hierboven genoemde punten. Er werd in deze richtlijn onderscheid gemaakt tussen ‘sterk geformuleerde aanbevelingen’ en ‘zwak geformuleerde aanbevelingen’. In het eerste geval doet de werkgroep een duidelijke uitspraak over iets dat zeker wel of zeker niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld (bijv. “overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor ‘sterk geformuleerde aanbevelingen’ geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden.
|
Aanbeveling |
Tijdspad voor implementatie |
Verwachte impact op zorgkosten |
Randvoorwaarden voor implementatie |
Mogelijke barrières voor implementatie |
Te ondernemen acties voor implementatie |
Verantwoordelijken voor acties |
|
Kinderen met kanker |
||||||
|
Overweeg een hemoglobine (Hb) grens van 4.3 mmol/L voor erytrocytentransfusie bij kinderen met kanker. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Wij adviseren tegen een hemoglobine (Hb) grens van 3.7 mmol/L voor erytrocytentransfusie bij kinderen met kanker. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Wij adviseren sterk tegen een hemoglobine (Hb) grens van 3.1 mmol/L of lager voor erytrocytentransfusie bij kinderen met kanker. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Neonaten met kanker |
||||||
|
Overweeg een hemoglobine (Hb) grens van 6.5 mmol/L voor erytrocytentransfusie bij neonaten met kanker indien ze minder dan 1 week oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Overweeg een hemoglobine (Hb) grens van 5.5 mmol/L voor erytrocytentransfusie bij neonaten met kanker indien ze tussen de 1 en 3 weken oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Overweeg een hemoglobine (Hb) grens van 4.5 mmol/L voor erytrocytentransfusie bij neonaten met kanker indien ze tussen de 3 en 4 weken oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Kinderen met kanker en sepsis |
||||||
|
Overweeg een hemoglobine (Hb) grens van 4.3 mmol/L voor erytrocytentransfusies bij stabiele kinderen met kanker en sepsis. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
De werkgroep is van mening dat het aanbevolen wordt om voor hemodynamisch onstabiele kinderen met kanker en sepsis en tekenen van zuurstoftekort (bijv. gebruik van inotropen, verhoogd lactaatgehaalte) een Hb grens te overwegen die varieert tussen 4.3 mmol/L en 6.2 mmol/L. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Neonaten met kanker en sepsis |
||||||
|
Overweeg een hemoglobine (Hb) grens van 6.5 mmol/L voor erytrocytentransfusie bij neonaten met kanker en sepsis indien ze minder dan 1 week oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Overweeg een hemoglobine (Hb) grens van 5.5 mmol/L voor erytrocytentransfusie bij neonaten met kanker en sepsis indien ze tussen de 1 en 3 weken oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Overweeg een hemoglobine (Hb) grens van 4.5 mmol/L voor erytrocytentransfusie bij neonaten met kanker en sepsis indien ze tussen de 3 en 4 weken oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Kinderen met kanker die radiotherapie ondergaan |
||||||
|
De werkgroep is van mening dat een hemoglobine (Hb) grens van 4.3 mmol/L voor erytrocytentransfusie moet worden gehandhaafd bij kinderen met kanker die radiotherapie ondergaan. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Neonaten met kanker die radiotherapie ondergaan |
||||||
|
De werkgroep is van mening dat een hemoglobine (Hb) grens van 6.5 mmol/L voor erytrocytentransfusie moet worden gehandhaafd bij neonaten met kanker die radiotherapie ondergaan indien ze minder dan 1 week oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
De werkgroep is van mening dat een hemoglobine (Hb) grens van 5.5 mmol/L voor erytrocytentransfusie moet worden gehandhaafd bij neonaten met kanker die radiotherapie ondergaan indien ze tussen de 1 en 3 weken oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
De werkgroep is van mening dat een hemoglobine (Hb) grens van 4.5 mmol/L voor erytrocytentransfusie moet worden gehandhaafd bij neonaten met kanker die radiotherapie ondergaan indien ze tussen de 3 en 4 weken oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Kinderen met kanker en cardiale/pulmonale comorbiditeiten |
||||||
|
Overweeg een hemoglobine (Hb) grens van 4.3 mmol/L voor erytrocytentransfusies bij kinderen met kanker en cardiale en pulmonale comorbiditeiten. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
De werkgroep is van mening dat bij een hemodynamisch instabiel kind met kanker en pulmonale en/of cardiale comorbiditeiten (bijv. gebruik van inotropica, verhoogd lactaatgehalte) een hogere Hb grens worden kan overwogen. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
De werkgroep is van mening dat voor kinderen aan de ECMO de aanbevelingen uit de richtlijn van Valentine (2018) overgenomen moeten worden1. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Neonaten met kanker en cardiale/pulmonale comorbiditeiten |
||||||
|
Overweeg een hemoglobine (Hb) grens van 7.5 mmol/L voor erytrocytentransfusie bij neonaten met kanker en cardiale en pulmonale comorbiditeiten indien ze minder dan 1 week oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Overweeg een hemoglobine (Hb) grens van 6.5 mmol/L voor erytrocytentransfusie bij neonaten met kanker en cardiale en pulmonale comorbiditeiten indien ze tussen de 1 en 3 weken oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Overweeg een hemoglobine (Hb) grens van 5.5 mmol/L voor erytrocytentransfusie bij neonaten met kanker en cardiale en pulmonale comorbiditeiten indien ze tussen de 3 en 4 weken oud zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Kinderen en neonaten met kanker en hyperleukocytose |
||||||
|
Bij kinderen en neonaten met kanker en hyperleukocytose, zijn wij van mening dat een erytrocytentransfusie terughoudend moet worden gegeven tot het aantal leukocyten gedaald is tot 100 x 109/L of lager, tenzij er klinische tekenen zijn van een ernstige anemie of in geval van een Hb lager dan 3.1 mmol/L. Indien nodig, alleen transfunderen met maximaal 5 ml/kg/3-4 uur. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Bestraalde erytrocytentransfusies bij kinderen en neonaten met kanker |
||||||
|
De werkgroep is van mening dat bestraalde bloedproducten moeten worden gebruikt in het geval van een HLA-gelijkenis tussen donor (product) en ontvanger1. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
De werkgroep is van mening dat het granulocyten transfusieproduct bestraald moeten worden. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
De werkgroep is van mening dat bestraalde bloedproducten moeten worden gebruikt afhankelijk van de immuunstatus van de patiënt1. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
De werkgroep is van mening dat bestraalde bloedproducten moeten worden gebruikt in geval van patiënten met een langdurige T-cel depletie na medicatie1. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
De werkgroep is van mening dat bestraalde bloedproducten moeten worden gebruikt in geval van patiënten die CAR-T celtherapie krijgen vanaf 4 weken voor de leukaferese tot 1 jaar na de infusie. Tenzij anders beschreven in het onderzoeksprotocol. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Hoog- of laag volume: kinderen met kanker |
||||||
|
Overweeg een transfusievolume van 10-15 ml/kg bij kinderen met kanker. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Overweeg een transfusievolume van maximaal 2 donoreenheden (volume tussen 500-600 ml). |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Wij adviseren tegen een transfusievolume van 20 ml/kg of hoger bij kinderen met kanker. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Hoog- of laag volume: neonaten met kanker |
||||||
|
Overweeg een transfusievolume van 10-15 ml/kg bij neonaten met kanker. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Wij adviseren tegen een transfusievolume van 20 ml/kg of hoger bij neonaten met kanker. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Transfusiesnelheden: kinderen met kanker |
||||||
|
De werkgroep is van mening dat de transfusiesnelheid van een erytrocytentransfusie bij kinderen met kanker 5 ml/kg/uur moet zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
|
Transfusiesnelheden: neonaten met kanker |
||||||
|
De werkgroep is van mening dat de transfusiesnelheid van een erytrocytentransfusie bij neonaten met kanker 5 ml/kg/uur moet zijn. |
Direct |
Geen |
Verspreiding van de richtlijn |
Geen kennis van de richtlijn |
Uitrollen van de richtlijn naar de betrokken beroepsgroepen/Verspreiding van de richtlijn |
Supportive Care groep, Prinses Máxima Centrum |
1 Voor de volledige aanbevelingen wordt er verwezen naar de desbetreffende hoofdstukken.
Te ondernemen acties per partij
De kinderoncologische zorg is Nederland is gecentraliseerd in het Prinses Máxima Centrum in Utrecht. De Supportive Care groep is betrokken bij het ontwikkelen en uitrollen van nieuwe (behandel)richtlijnen. Deze groep maakt de richtlijn bekend bij de direct betrokken wetenschappelijke verenigingen en beroepsorganisaties. Daarnaast is er uitgebreid contact met de Shared Care ziekenhuizen, minimaal twee keer per jaar, waardoor de uitrol van een richtlijn gemakkelijker wordt.
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen:
Initiatiefnemende ziekenhuis:
- Ziekenhuisbestuurders en waar van toepassing andere systeem stakeholders op de hoogte brengen van de aanbevelingen die (mogelijk) effect zullen gaan hebben op de organisatie van de zorg en op kosten en wat hierin van de betreffende partij verwacht zal worden;
- Bekend maken van de richtlijn onder andere betrokken wetenschappelijk- en beroepsverenigingen.
Alle direct betrokken wetenschappelijke verenigingen/beroepsorganisaties (NVK, SKION, VKN, NVA, NVIC, NVH, NVvH, NVI, V&VN, NVRO, NVB en NVKC):
- Bekend maken van de richtlijn onder de leden;
- Publiciteit voor de richtlijnen maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen;
- Ontwikkelen van gerichte bijscholing/trainingen;
- Ontwikkelen en aanpassen van patiënten informatie/keuzehulpen;
- Controleren van de toepassing van de aanbevelingen middels audits en de kwaliteitsvisitatie;
- Gezamenlijk afspraken maken over en opstarten van continue modulair onderhoud van de richtlijn.
De lokale vakgroepen/individuele medisch professionals:
- Het bespreken van de aanbevelingen in de vakgroepsvergadering en lokale werkgroepen;
- Het afstemmen van lokale protocollen op de aanbevelingen in de richtlijn;
- Het volgen van bijscholing die bij deze richtlijn ontwikkeld gaat worden;
- Aanpassen lokale patiënten informatie op grond van de materialen die door de verenigingen beschikbaar gesteld zullen worden;
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
De systeem stakeholders (onder andere zorgverzekeraars, (koepelorganisaties van) ziekenhuisbestuurders, IGJ):
Ten aanzien van het financieren van de zorg voor kinderen met kanker, wordt van het bestuur van de ziekenhuizen verwacht dat zij bereid zijn om de nodige investeringen te doen om de aanbevelingen in deze richtlijn te kunnen implementeren. Daarnaast wordt van de bestuurders verwacht dat zij bij de betrokken medisch professionals nagaan op welke wijze zij kennis hebben genomen van de nieuwe richtlijn en deze toepassen in de praktijk. Van zorgverzekeraars wordt verwacht dat zij de zorg die in deze richtlijn wordt voorgeschreven zullen vergoeden.
Wetenschappers en subsidieverstrekkers:
- Onderzoek initiëren naar de kennislacunes, bij voorkeur in internationaal verband.
Indicatorontwikkeling
Gezien de moeilijkheid van het ontwikkelen van toepasselijke indicatoren is er besloten om (vooralsnog) geen indicatoren te ontwikkelen.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence’ gebaseerde inzichten en aanbevelingen die zorgverleners helpen om kwalitatief goede zorg te verlenen. Aangezien deze aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt’, kunnen zorgverleners op basis van hun professionele autonomie zo nodig afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
