Verwijscriteria bij ovariumcarcinoom
Uitgangsvraag
Wanneer is er reden voor klinisch genetisch onderzoek bij patiënten met ovariumcarcinoom of bij een eerstegraads verwant?
Welke genen dienen minimaal getest te worden bij patiënten met ovariumcarcinoom?
Aanbeveling
- Verricht bij alle patiënten met ovariumcarcinoom, ongeacht het histologische type, diagnoseleeftijd en familieanamnese, onderzoek naar een mutatie in de genen die ovariumcarcinoom kunnen veroorzaken, waarbij de genen BRCA1 en BRCA2 minimaal dienen te worden onderzocht en de genen BRIP1, RAD51C, RAD51D en PALB2 zeer wenselijk dienen te worden onderzocht. Dit geldt uitdrukkelijk niet voor borderline ovariumtumoren. Indien de familieanamnese hier aanleiding toe geeft kan er reden zijn voor diagnostiek naar het Lynch syndroom.
- Verricht bij voorkeur DNA-onderzoek in de tumor (tumor DNA-test) bij alle vrouwen met ovariumcarcinoom, onder voorwaarde dat de kwaliteit van de tumortest vergelijkbaar is aan analyse in bloed. Indien geen materiaal beschikbaar is voor een tumortest dient een bloedonderzoek aangeboden te worden.
- De diagnostiek bij vrouwen met ovariumcarcinoom is weergegeven in onderstaand schema ’genetisch onderzoek bij ovariumcarcinoom’.
- Verwijs vrouwen met een ovariumcarcinoom ongeacht het histologische type, diagnoseleeftijd en familieanamnese, naar klinische genetica indien een pathogene mutatie in BRCA1, BRCA2, BRIP1, RAD51C, RAD51D of PALB2 bij tumor DNA-test is vastgesteld óf als een tumortest niet mogelijk was.
- Verwijs (eerstegraads) verwanten van vrouwen met een ovariumcarcinoom ongeacht het histologische type, diagnoseleeftijd en familieanamnese, naar klinische genetica indien bij het familielid met ovariumcarcinoom geen erfelijkheidsonderzoek kan plaats vinden of plaats heeft gevonden.
- Verwijs (eerstegraads) verwanten naar klinische genetica indien bij een familielid een erfelijke aanleg is vastgesteld (onder andere een pathogene mutatie in BRCA1, BRCA2, BRIP1, RAD51C, RAD51D, PALB2 of één van de Lynch syndroom genen).
Overwegingen
Bij de richtlijnontwikkeling in 2015 is een systematische internationale literatuursearch verricht door de richtlijnwerkgroep hetgeen geresulteerd heeft in een publicatie van een meta-analyse in the European Journal of Cancer. De meta-analyse beschrijft dat de algemene kans op een kiembaanmutatie in één van de BRCA-genen bij vrouwen met epitheliaal ovariumcarcinoom meer dan 10% is (Arts-de Jong, 2016). Recente studies met tumor DNA-onderzoek uit Leiden (De Jonge, 2018) en Nijmegen (Vos, 2020) tonen een percentage van kiembaan BRCA-mutaties aan in ~10% en > 15%.
Bij een populatiestudie beschreven door Alsop et al. (Alsop, 2012), werd DNA-onderzoek verricht bij 1.001 vrouwen met niet-mucineus epitheliaal ovariumcarcinoom, en werd in 14,1% een BRCA1- of 2-mutatie gevonden. Zhang (2011) liet een vergelijkbaar percentage zien (13,3%) bij 1.342 vrouwen met ovariumcarcinoom. De gemiddelde leeftijd van diagnose ovariumcarcinoom in de studie van Alsop was bij vrouwen met een BRCA1-mutatie 53,4 jaar, bij vrouwen met een BRCA2-mutatie 59,8 jaar, en bij vrouwen zonder mutatie 60,5 jaar (Alsop, 2012). Omdat de gemiddelde leeftijd van ontstaan van ovariumcarcinoom bij BRCA2-mutatiedraagsters nauwelijks verschilt van de leeftijd van optreden van sporadisch ovariumcarcinoom zal het instellen van een leeftijdscriterium als reden voor verwijzing ertoe leiden dat BRCA2-mutatie draagsters vaak gemist worden. De studies van Alsop (Alsop, 2012) en Zhang (Zhang, 2011) geven het leeftijdsspecifieke percentage van vrouwen met een BRCA-mutatie binnen de geteste groep van vrouwen met ovariumcarcinoom weer, samengevat in tabel 1. De kans op een BRCA-mutatie bij vrouwen met ovariumcarcinoom ouder dan 60 jaar is meer dan 8%.
|
|
% van vrouwen met een BRCA1- of BRCA2-mutatie |
|
|
Leeftijd |
Alsop, 2012 |
Zhang, 2011 |
|
<40 |
15,6% |
11,0% |
|
41-50 |
24,2% |
24,0% |
|
51-60 |
17,2% |
13,0% |
|
>60 |
8,3% |
8,4% |
Tabel 1. Overzicht van het vóórkomen van een kiembaanmutatie in BRCA1 of BRCA2 bij vrouwen met ovariumcarcinoom in verschillende leeftijdsgroepen.
In de studie van Alsop heeft 44% van de BRCA-mutatiedraagsters geen positieve familieanamnese. Een positieve familieanamnese heeft een lage sensitiviteit voor het herkennen van een erfelijke aanleg en is dus geen absoluut criterium om vrouwen met een BRCA-mutatie te herkennen. In de studies van Zhang en Alsop blijkt dat de kans op het vinden van een BRCA-kiembaanmutatie bij een vrouw met een negatieve familieanamnese nog 7,9% respectievelijk 8,3% bedraagt. De Nederlandse studie van Vos (Vos, 2020) beschrijft dat er bij 48% van de vrouwen met ovariumcarcinoom en een kiembaan BRCA-mutatie voorafgaand aan hun diagnose ovariumcarcinoom geen aanleiding was voor erfelijkheidsonderzoek op basis van de familiegeschiedenis.
Het is bekend dat het percentage BRCA-mutaties sterk samenhangt met het histologische type ovariumcarcinoom. In de module histologische triage bij ovariumcarcinoom wordt dit beschreven.
Niet alleen BRCA-mutaties zijn van belang bij het erfelijkheidsonderzoek bij patiënten met ovariumcarcinoom. Een recente meta-analyse toont aan dat bij ~2,5 % van de patiënten met ovariumcarcinoom mutaties in de genen RAD51C, RAD51D, BRIP1 of PALB2 betrokken zijn (Pavanello, 2020), terwijl een mutatie in één van de vier genen betrokken bij het Lynch syndroom aanwezig is bij ~0.6% van de patiënten met ovariumcarcinoom (Pavanello, 2020). Bij een mutatie in deze genen is het risico op ovariumcarcinoom matig verhoogd, zie module genen met licht en matig verhoogd risico op ovariumcarcinoom (link toevoegen na publicatie) en richtlijntekst over Lynch syndroom. link naar RLDB: erfelijk en familiair ovariumcarcinoom-Lynch syndroom. Een mutatie in ATM-gen gaat gepaard met een licht verhoogd risico op ovariumcarcinoom en komt voor bij ~0.6-0,9% van de patiënten met ovariumcarcinoom (vijf studies beschreven in Pavanello, 2020).
Bij het afwegen welke genen onderzocht dienen te worden bij patiënten met ovariumcarcinoom spelen onder andere kans op een mutatie, eventuele therapeutische consequenties en mogelijkheid voor preventieve maatregelen bij familieleden een rol. De werkgroep is van mening dat vanwege de mogelijkheid van familieonderzoek, het zeer wenselijk is dat bij vrouwen met epitheliaal ovariumcarcinoom naast de BRCA-genen ook de genen RAD51C, RAD51D, BRIP1 en PALB2 worden onderzocht. Gezien het weinig frequent vóórkomen van een mutatie in de Lynch syndroom genen is het niet waarschijnlijk dat standaard diagnostiek naar het Lynch syndroom doelmatig zal zijn. Op indicatie (bijvoorbeeld bij een positieve familieanamnese) kan onderzoek naar het Lynch syndroom (directe analyse van de 4 Lynch syndroom genen, immunohistochemie van MLH1, PMS2, MSH2 en MSH6 of microsatelliet instabiliteitsanalyse) worden verricht.
Wanneer naar Klinische Genetica verwijzen bij (familiair) voorkomen van ovariumcarcinoom?
Het antwoord op de vraag wanneer er reden is voor verwijzing naar het klinisch genetisch spreekuur hangt af van welk genetisch onderzoek (in de tumor of in bloed) er bij het familielid met ovariumcarcinoom reeds heeft plaatsgevonden.
Er is reden voor verwijzing naar klinische genetica indien er geen DNA-onderzoek bij de vrouw met ovariumcarcinoom heeft plaatsgevonden. Bij voorkeur wordt de vrouw met ovariumcarcinoom zelf verwezen omdat bij haar de diagnostiek zal plaatsvinden. Indien diagnostiek bij de vrouw met ovariumcarcinoom niet mogelijk is, kan DNA-onderzoek met het uitgebreide panel van genen bij eerstegraads verwanten plaatsvinden.
Indien met de tumor DNA-test een pathogene variant is aangetoond, is er reden voor verwijzing naar het klinisch genetisch spreekuur. Bij voorkeur bestaat het DNA-onderzoek bij patiënten met ovariumcarcinoom uit analyse van de genen BRCA1, BRCA2, RAD51C, RAD51D, BRIP1 en PALB2. In het verleden heeft de analyse bestaan uit onderzoek van BRCA1 en BRCA2. Indien BRCA-diagnostiek niet afwijkend is geweest in het verleden, dan wordt verwijzing voor uitbreiding van diagnostiek doorgaans niet nodig geacht. De kans op een pathogene mutatie in één van de andere acht genen (RAD51C/D, BRIP1, PALB2, MLH1, PMS2, MSH2 en MSH6) wordt voor hen namelijk laag ingeschat (<3%) (Pavanello, 2020). Er is wel reden om deze patiënten (opnieuw) te verwijzen naar klinische genetica bij de hieronder genoemde situaties.
Er zijn drie situaties waarbij er reden is een vrouw met ovariumcarcinoom of haar familielid te verwijzen naar de klinische genetica zelfs als kiembaan of tumor-DNA-onderzoek van de BRCA-genen niet afwijkend was;
- Bij de patiënte met ovariumcarcinoom wordt mammacarcinoom vastgesteld of is in het verleden mammacarcinoom voorgekomen. In dat geval kan er reden zijn van analyse van meer genen die bij een mutatie het risico op borst- en eierstokkanker verhogen.
- In het geval dat twee 1e of 2e graads verwanten ovariumcarcinoom hebben gehad. In dat geval is er reden om diagnostiek te verrichten van BRCA1, BRCA2, RAD51C, RAD51D, BRIP1 en PALB2 indien mogelijk bij alle familieleden met ovariumcarcinoom. Afhankelijk van de beschikbare familieleden voor bloedonderzoek en bewaard gebleven tumorweefsel, zal deze diagnostiek verder worden ingezet om een advies aan de familieleden te kunnen geven.
- Er is een positieve familieanamnese passend bij het Lynch syndroom (zie in onderstaand schema over genetisch onderzoek bij ovariumcarcinoom) en er heeft geen diagnostiek naar het Lynch syndroom plaatsgevonden. De klinisch geneticus beoordeelt in dat geval bij wie in de familie het beste diagnostiek naar het Lynch syndroom kan plaatsvinden.
Ter preventie van ovariumcarcinoom is het van groot belang dat een erfelijke aanleg in een familie wordt vastgesteld zodat presymptomatisch DNA-onderzoek bij familieleden kan plaatsvinden en mutatiedragers in aanmerking komen voor een Risico Reducerende Salpingo-Oöphorectomie (RRSO). Machanda beschrijft dat een RSSO al kosteneffectief is in postmenopauzale vrouwen met een cumulatief lifetime-risico van 5% of meer en bij premenopauzale vrouwen met lifetime-risico van meer dan 4% (Machanda 2018).
Het is voor de herkenning van families met een erfelijke aanleg belangrijk dat niet alleen degenen die nu ovariumcarcinoom hebben, maar ook de vrouwen die in het verleden ovariumcarcinoom hebben gehad of, indien degene met ovariumcarcinoom overleden is, de eerstegraads mannelijke en vrouwelijke verwanten van vrouwen met ovariumcarcinoom in aanmerking komen voor DNA-onderzoek. Nu bij veel vrouwen met ovariumcarcinoom eerst DNA-onderzoek in de tumor plaatsvindt en er alleen reden is voor verwijzing naar klinische genetica bij een afwijkende tumoruitslag en/of een positieve familieanamnese zal het aantal verwijzingen in belangrijke mate afnemen (tot 80%). Daarom wordt ingeschat dat er genoeg ruimte zal ontstaan om de eerstegraads verwanten van vrouwen met ovariumcarcinoom in het verleden op het klinisch genetisch spreekuur te zien.
Schema over genetisch onderzoek bij ovariumcarcinoom
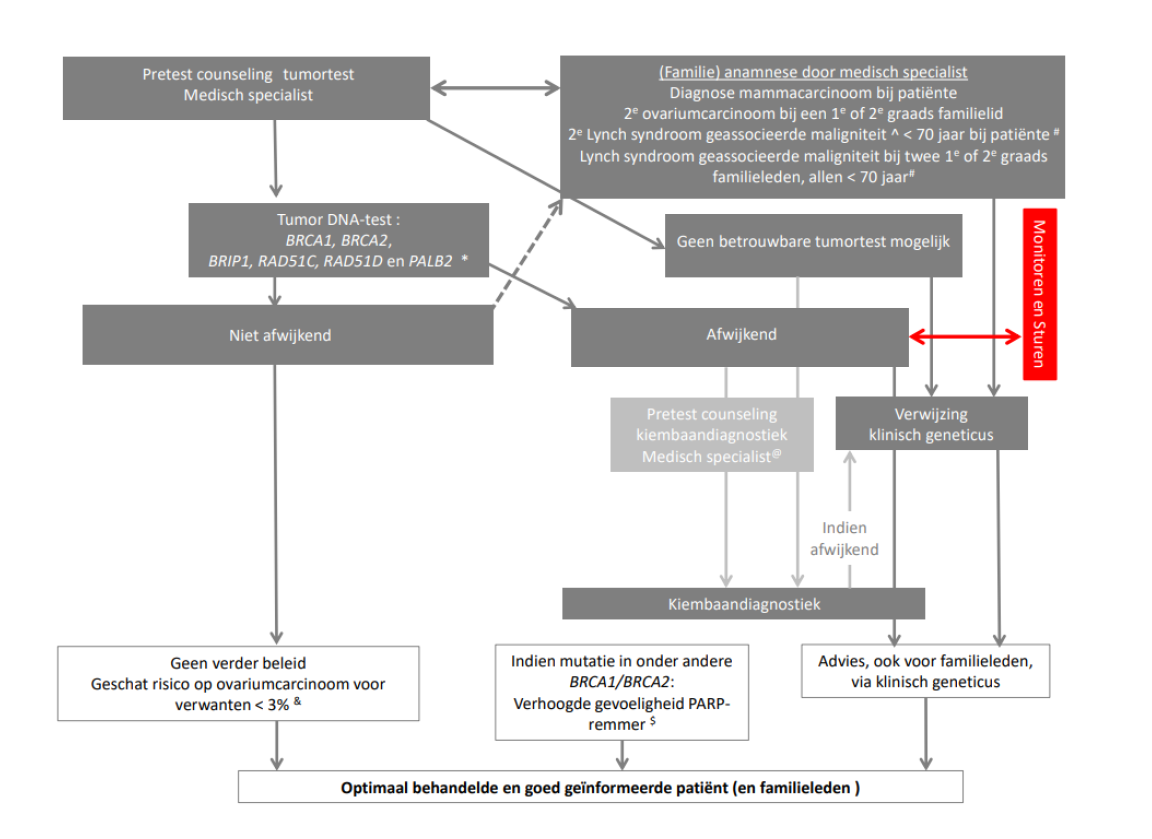
*Uitbreiding met de Lynch syndroom genen is mogelijk. Ook is het mogelijk dat de tumortest wordt uitgebreid met IHC MMR eiwitten of een MSI marker.
^Lynch syndroom geassocieerde maligniteit: Colorectaal carcinoom, endometriumcarcinoom, dunnedarmcarcinoom, galwegcarcinoom, maagcarcinoom, ovariumcarcinoom, nierbekkencarcinoom, uretercarcinoom, blaascarcinoom, talgkliercarcinoom (conform richtlijn erfelijke darmkanker)
# Indien tumortest geen IHC MMR eiwitten of een MSI marker bevat
$ Indicatie voor PARP-remmer is afhankelijk van adviezen van de commissie ter beoordeling van Oncologische Middelen (BOM) en aan verandering onderhevig.
@ Kiembaandiagnostiek door niet-klinisch geneticus vergt scholing. &zie algemene richtlijntekst hoofdstuk 2.2.4. Ovariumcarcinoom in de familie zonder dat een mutatie is vastgesteld.
& zie algemen richtlijntekst hoofdstuk 2.2.4. Ovariumcarcinoom in de familie zonder dat een mutatie is vastgesteld.
Onderstaand zijn de verwijscriteria weergegeven waarbij rekening is gehouden met of er wel of niet reeds tumor DNA-onderzoek heeft plaatsgevonden en wanneer er reden is voor verwijzing voor familieleden indien de vrouw met ovariumcarcinoom zelf niet verwezen kan of wil worden.
Essentieel is dat de patiënte en de huisarts geïnformeerd worden over de uitslag van genetische (tumor) diagnostiek en de eventuele adviezen voor familieleden.
Zie voor praktische informatie over tumor DNA-onderzoek www.tumorfirst.nl/toolbox.
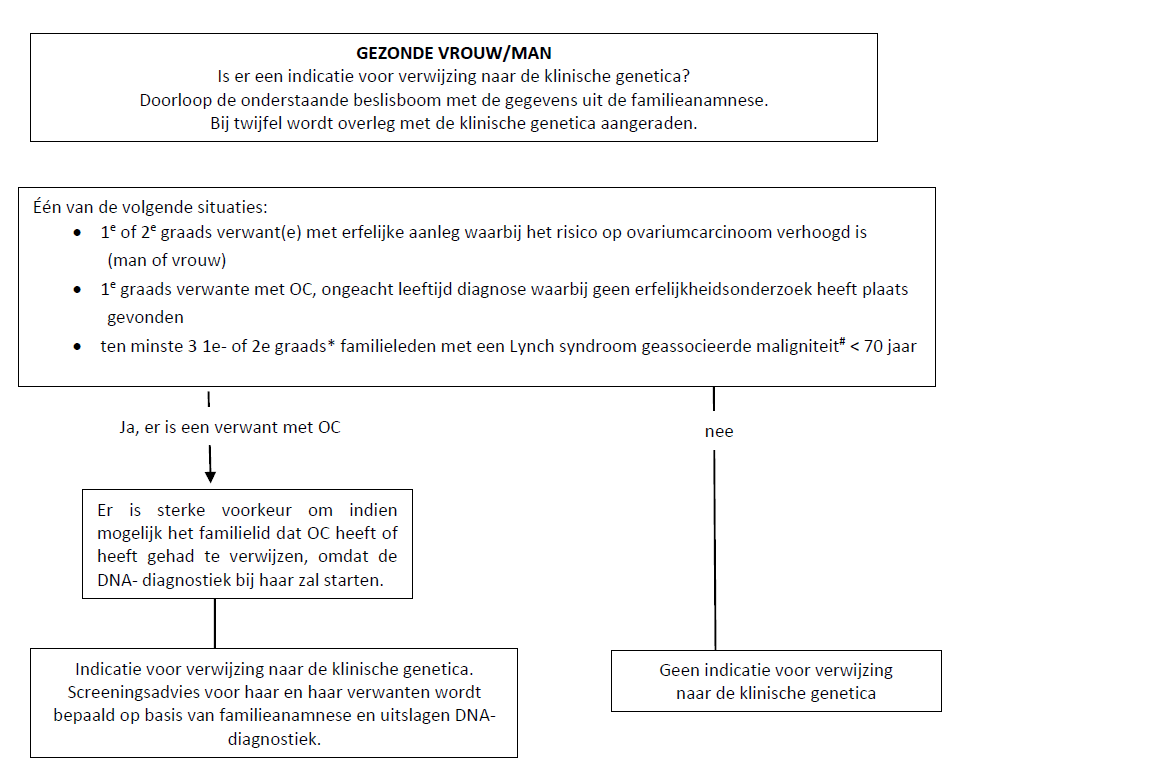
Flowchart 1 Indicaties voor verwijzing naar klinische genetica
Iemand zonder ovariumcarcinoom in de voorgeschiedenis, komt voor verwijzing naar klinische genetica in aanmerking als deze voldoet aan ten minste één van de kenmerken uit flowchart 1.
OC: ovariumcarcinoom
*1e graads verwanten; kinderen, broers/zussen, ouders
*2e graads verwanten: kleinkinderen grootouders, tantes en ooms, kinderen van broers/zussen.
# Lynch syndroom geassocieerde maligniteit(en): colorectaal carcinoom, endometriumcarcinoom dunnedarm carcinoom, galwegcarcinoom maagcarcinoom ovariumcarcinoom, nierbekkencarcinoom, uretercarcinoom, blaascarcinoom, talgkliercarcinoom
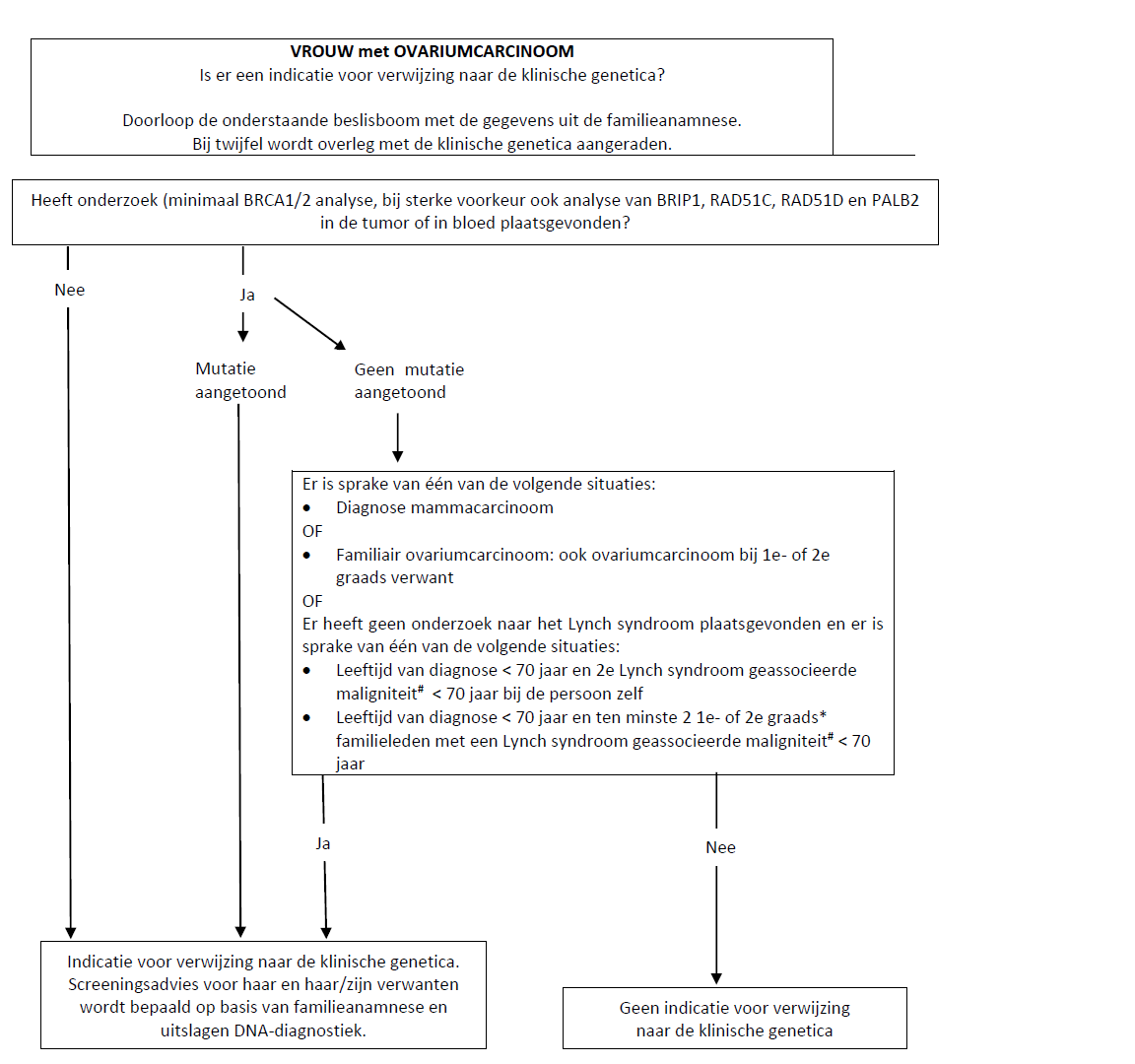
Flowchart 2 Indicaties voor verwijzing naar klinische genetica
Iemand met ovariumcarcinoom komt voor verwijzing naar de klinische genetica in aanmerking als deze voldoet aan ten minste één van de kenmerken uit flowchart 2.
OC: ovariumcarcinoom
*1e graads verwanten; kinderen, broers/zussen, ouders
*2e graads verwanten: kleinkinderen, grootouders, tantes en ooms, kinderen van broers/zussen
# Lynch syndroom geassocieerde maligniteiten: colorectaal carcinoom, endometriumcarcinoom dunnedarm carcinoom, galwegcarcinoom maagcarcinoom ovariumcarcinoom, nierbekkencarcinoom, uretercarcinoom, blaascarcinoom, talgkliercarcinoom
Onderbouwing
Achtergrond
In de richtlijntekst van 2015 was opgenomen dat er bij iedere vrouw met epitheliaal ovariumcarcinoom reden is voor genetisch onderzoek. Sindsdien zijn er nieuwe diagnostische mogelijkheden, namelijk DNA-onderzoek in de tumor. Daarnaast is er behoefte aan verwijscriteria voor gezonde familieleden als er ovariumcarcinoom in de familie is voorgekomen en DNA-onderzoek bij het aangedane familielid niet heeft plaatsgevonden. Dat vraagt om nieuwe afspraken wanneer er reden is voor verwijzing naar het klinisch genetisch spreekuur.
Samenvatting literatuur
Er zijn geen onderzoeken opgenomen in de literatuuranalyse.
Zoeken en selecteren
In de databases Medline en Embase is op 21 oktober 2021 gezocht naar studies over genetic testing bij patiënten met epitheliaal ovariumcarcinoom of een eerstegraads verwant. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 32 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: epitheliaal ovariumcarcinoom en genetic testing in de Nederlandse setting. Er zijn geen studies die voldoen aan de selectiecriteria.
Zodoende zijn de aanbevelingen gebaseerd op de overwegingen van de werkgroep.
Referenties
- Alsop K, Fereday S, Meldrum C, deFazio A, Emmanuel C, George J, Dobrovic A, Birrer MJ, Webb PM, Stewart C, Friedlander M, Fox S, Bowtell D, Mitchell G. BRCA mutation frequency and patterns of treatment response in BRCA mutation-positive women with ovarian cancer: a report from the Australian Ovarian Cancer Study Group. J Clin Oncol. 2012 Jul 20;30(21):2654-63. doi: 10.1200/JCO.2011.39.8545. Epub 2012 Jun 18. Erratum in: J Clin Oncol. 2012 Nov 20;30(33):4180.
- Arts-de Jong M, de Bock GH, van Asperen CJ, Mourits MJ, de Hullu JA, Kets CM. Germline BRCA1/2 mutation testing is indicated in every patient with epithelial ovarian cancer: A systematic review. Eur J Cancer. 2016 Jul;61:137-45. doi: 10.1016/j.ejca.2016.03.009.
- de Jonge MM, Ruano D, van Eijk R, van der Stoep N, Nielsen M, Wijnen JT, Ter Haar NT, Baalbergen A, Bos MEMM, Kagie MJ, Vreeswijk MPG, Gaarenstroom KN, Kroep JR, Smit VTHBM, Bosse T, van Wezel T, van Asperen CJ. Validation and Implementation of BRCA1/2 Variant Screening in Ovarian Tumor Tissue. J Mol Diagn. 2018 Sep;20(5):600-611. doi: 10.1016/j.jmoldx.2018.05.005.
- Lilyquist J, LaDuca H, Polley E, Davis BT, Shimelis H, Hu C, Hart SN, Dolinsky JS, Couch FJ, Goldgar DE. Frequency of mutations in a large series of clinically ascertained ovarian cancer cases tested on multi-gene panels compared to reference controls. Gynecol Oncol. 2017 Nov;147(2):375-380. doi: 10.1016/j.ygyno.2017.08.030.
- Manchanda R, Patel S, Gordeev VS, Antoniou AC, Smith S, Lee A, Hopper JL, MacInnis RJ, Turnbull C, Ramus SJ, Gayther SA, Pharoah PDP, Menon U, Jacobs I, Legood R. Cost-effectiveness of Population-Based BRCA1, BRCA2, RAD51C, RAD51D, BRIP1, PALB2 Mutation Testing in Unselected General Population Women. J Natl Cancer Inst. 2018 Jul 1;110(7):714-725. doi: 10.1093/jnci/djx265.
- Norquist BM, Harrell MI, Brady MF, Walsh T, Lee MK, Gulsuner S, Bernards SS, Casadei S, Yi Q, Burger RA, Chan JK, Davidson SA, Mannel RS, DiSilvestro PA, Lankes HA, Ramirez NC, King MC, Swisher EM, Birrer MJ. Inherited Mutations in Women With Ovarian Carcinoma. JAMA Oncol. 2016 Apr;2(4):482-90. doi: 10.1001/jamaoncol.2015.5495.
- Pavanello M, Chan IH, Ariff A, Pharoah PD, Gayther SA, Ramus SJ. Rare Germline Genetic Variants and the Risks of Epithelial Ovarian Cancer. Cancers (Basel). 2020 Oct 19;12(10):3046. doi: 10.3390/cancers12103046. PMID: 33086730; PMCID: PMC7589980.
- Suszynska M, Ratajska M, Kozlowski P. BRIP1, RAD51C, and RAD51D mutations are associated with high susceptibility to ovarian cancer: mutation prevalence and precise risk estimates based on a pooled analysis of ~30,000 cases. J Ovarian Res. 2020 May 2;13(1):50. doi: 10.1186/s13048-020-00654-3.
- Vos JR, Fakkert IE, de Hullu JA, van Altena AM, Sie AS, Ouchene H, Willems RW, Nagtegaal ID, Jongmans MCJ, Mensenkamp AR, Woldringh GH, Bulten J, Leter EM, Kets CM, Simons M, Ligtenberg MJL, Hoogerbrugge N; OPA Working Group. Universal Tumor DNA BRCA1/2 Testing of Ovarian Cancer: Prescreening PARPi Treatment and Genetic Predisposition. J Natl Cancer Inst. 2020 Feb 1;112(2):161-169. doi: 10.1093/jnci/djz080.
- Zhang S, Royer R, Li S, McLaughlin JR, Rosen B, Risch HA, Fan I, Bradley L, Shaw PA, Narod SA. Frequencies of BRCA1 and BRCA2 mutations among 1,342 unselected patients with invasive ovarian cancer. Gynecol Oncol. 2011 May 1;121(2):353-7. doi: 10.1016/j.ygyno.2011.01.020.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 30-09-2022
Herbeoordeling van deze tekst moet uiterlijk twee jaar na publicatie plaatsvinden door de Nederlandse Vereniging voor Obstetrie & Gynaecologie (NVOG).
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Verwijscriteria |
UMCG |
2022 |
2024 |
tweejaarlijks |
Commissie Richtlijnen Gynaecologische Oncologie (CRGO) |
Literatuur of nieuwe inzichten |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door IKNL (Integraal Kankercentrum Nederland) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doelstelling
Een richtlijn is een aanbeveling ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een erfelijke of familiaire ovariumtumor.
Samenstelling werkgroep
|
C.J. van Asperen |
Klinisch geneticus |
LUMC, Leiden |
|
M.J. Blok |
Laboratoriumspecialist klinische genetica |
Maastricht UMC+, Maastricht |
|
G.H. de Bock |
Epidemioloog |
UMCG, Groningen |
|
T. Bosse |
Patholoog |
LUMC, Leiden |
|
N. Hoogerbrugge |
Internist |
Radboudumc, Nijmegen |
|
J.A. de Hullu |
gynaecoloog oncoloog |
Radboudumc, Nijmegen |
|
C.M. Kets |
Klinisch geneticus |
Radboudumc, Nijmegen |
|
A. van der Kolk |
patiëntenvertegenwoordiging |
Stichting Olijf |
|
M.J.E. Mourits (voorzitter) |
gynaecoloog oncoloog |
UMCG, Groningen |
|
G.S. Sonke |
Internist oncoloog |
AvL, Amsterdam |
De richtlijnontwikkeling werd ondersteund Suzanne Verboort (senior-adviseur), Olga van der Hel (adviseur methodologie) en Hella Hamelers (secretaresse), namens IKNL.
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van IKNL. De belangenformulieren zijn besproken binnen de betreffende werkgroep en de NVOG cie Kwaliteitsdocumenten, indien van toepassing. Geen van de belangen heeft tot een eventuele actie geleid.
Inbreng patiëntenperspectief
Met Stichting Olijf heeft gedurende het ontwikkelproces contact plaatsgevonden over het patiëntperspectief. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Olijf en Patiëntenfederatie Nederland.
Implementatie
|
Aanbeveling |
Tijdspad voor implementatie: <1 jaar 1-3 jaar of > 3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implemen-tatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
|
alle |
<1 jaar |
niet onderzocht |
Geen |
|
|
Nederlandse Vereniging voor Obstetrie & Gynaecologie (NVOG) CRGO expertgroep |
1 Barrières kunnen zich bevinden op het niveau van de professional, op het niveau van de organisatie (het ziekenhuis) of op het niveau van het systeem (buiten het ziekenhuis). Denk bijvoorbeeld aan onenigheid in het land m.b.t. de aanbeveling, onvoldoende motivatie of kennis bij de specialist, onvoldoende faciliteiten of personeel, nodige concentratie van zorg, kosten, slechte samenwerking tussen disciplines, nodige taakherschikking, etc.
2 Denk aan acties die noodzakelijk zijn voor implementatie, maar ook acties die mogelijk zijn om de implementatie te bevorderen. Denk bijvoorbeeld aan controleren aanbeveling tijdens kwaliteitsvisitatie, publicatie van de richtlijn, ontwikkelen van implementatietools, informeren van ziekenhuisbestuurders, regelen van goede vergoeding voor een bepaald type behandeling, maken van samenwerkingsafspraken.
3 Wie de verantwoordelijkheden draagt voor implementatie van de aanbevelingen, zal tevens afhankelijk zijn van het niveau waarop zich barrières bevinden. Barrières op het niveau van de professional zullen vaak opgelost moeten worden door de beroepsvereniging. Barrières op het niveau van de organisatie zullen vaak onder verantwoordelijkheid van de ziekenhuisbestuurders vallen. Bij het oplossen van barrières op het niveau van het systeem zijn ook andere partijen, zoals de NZA en zorgverzekeraars, van belang.
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de modules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de modules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit.
Knelpuntenanalyse
Het UMCG inventariseerde de knelpunten bij de leden van de expertgroep. Deze knelpunten zijn allemaal uitgezocht door de leden van de expertgroep.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpunten zijn door de expertgroep de definitieve uitgangsvragen vastgesteld. Vervolgens inventariseerde de expertgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De leden van de expertgroep selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn opvraagbaar.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) -tabellen. De Cochrane RoB-tool werd gebruikt, dit is een gevalideerd instrument dat wordt aanbevolen door de Cochrane Collaboration.
Daarnaast heeft Olga van der Hel (adviseur methodologie, IKNL) advies gegeven bij de methodologie.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De leden van de expertgroep maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de
patiënt afgewogen.
De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de expertgroep, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)-organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
