Anti-aanvalsmedicatie en hormonale anticonceptie bij epilepsie
Uitgangsvraag
Welke anti-aanvalsmedicatie geven interactie met hormonale anticonceptie?
Aanbeveling
Bespreek de mogelijkheid van interacties tussen anti-aanvalsmedicatie en orale anticonceptie met vrouwen in de vruchtbare leeftijd en (de verzorgers van) jonge meisjes. Weeg daarbij de voor- en nadelen van behandeling met deze combinatie af en overweeg andere methodes van anticonceptie, bijvoorbeeld het progestageen (levenorgestrel) bevattend spiraaltje (IUD) (Mirena®).
Voor een goede anticonceptie bij gebruik van een P450-enzyminducerend anti-aanvalsmedicijn verdient het gebruik van een levonorgestrelbevatttend spiraaltje of een koperhoudend spiraaltje de voorkeur. Indien toch gekozen wordt voor een oraal anticonceptivum, adviseer dan een gecombineerd oraal anticonceptivum met een hogere dosering progestageen (bijvoorbeeld twee tabletten ethinylestradiol 30 µg/levenorgestrel 150 µg per dag). Voor optimale betrouwbaarheid bij deze combinatie kan het continu gebruik van 'de pil' overwogen worden, bij voorkeur in combinatie met een barrièremethode.
Ontraad het gebruik van de vaginale ring (Nuvaring®) en de pilpleister (Evra®) in combinatie met de P450-enzyminducerende anti-aanvalsmedicatie.
Ontraad het gebruik van uitsluitend progestageen bevattende orale anticonceptie bij vrouwen en meisjes die P450-enzyminducerende anti-aanvalsmedicatie gebruiken.
Ontraad het gebruik van de progestageen bevattende implantatiestift voor onderhuidse toediening (Implanon) bij vrouwen en meisjes die P450-enzyminducerende anti-aanvalsmedicatie gebruiken.
De methode met de morning-afterspiraal heeft bij vrouwen met epilepsie en P450-enzyminducerende anti-aanvalsmedicatie de voorkeur boven het gebruik van de morning-after pil.
Houd bij het starten of staken van orale anticonceptie rekening met een wijziging in de serumspiegel lamotrigine.
Ontraad de combinatie van een progestageen bevattend oraal anticonceptivum met een dosering van 12 mg perampanel.
Zie voor een overzicht van P450-enzyminducerende anti-aanvalsmedicatie de Overwegingen.
Overwegingen
De werkgroep neemt de NICE-aanbevelingen over met een aanvulling. In moderne gecombineerde anticonceptiepillen wordt ovulatie-inhibitie vooral bereikt door het progestageen en niet door het ethinylestradiol. Het oestrogeen is met name verantwoordelijk voor het maandelijks bloedverlies. Vrouwen die een oraal anticonceptivum gebruiken en een anti-aanvalsmedicijn wat het P450-enzym in de lever induceert, moeten voor een betere bescherming tegen zwangerschap een gecombineerd oraal anticonceptivum gebruiken met een hogere dosering progestageen (bijvoorbeeld twee tabletten ethinylestradiol 30 µg/ levonogestrel 150 µg per dag). Dit kan eventueel gecombineerd worden met het continu slikken van de anticonceptiepil. Ook dan geeft het uitblijven van doorbraakbloedingen geen zekerheid over de betrouwbaarheid van deze methode. Combinatie met gebruik van barrièremiddelen moet overwogen worden (expert opinion, (Schwenkhagen & Stodieck, 2008). Overigens kan de mate van inductie van het P450 3A4 isoenzym door anti-aanvalsmedicatie verschillen. Fenobarbital, fenytoïne, carbamazepine en primidon geven een sterke enzyminductie, oxcarbazepine, topiramaat en felbamaat een milde enzyminductie. Er zijn aanwijzingen dat topiramaatdoseringen onder de 200 mg per dag geen invloed hebben op hormonale anticonceptie.
Vanwege de onduidelijkheid over de betrouwbaarheid van de anticonceptiepil in combinatie met het gebruik van een P450-enzyminducerend anti-aanvalsmedicijn adviseert de werkgroep farmacotherapie en geneesmiddelinformatie van de KNMP om de pil te vervangen door een levenorgestrelbevattende spiraal of een koperhoudende spiraal (le Comte & Polderman, 2014).
Voor een praktisch overzicht van enzyminducerende anti-aanvalsmedicatie zie ook tabel 1.
Tabel 1. Crawford (Crawford, 2002): Enzyminducerende anti-aanvalsmedicatie
|
Enzyminducerende anti-aanvalsmedicatie |
Niet-enzyminducerende anti-aanvalsmedicatie |
|
Carbamazepine Felbamaat Fenytoïne Fenobarbital (ook als bestanddeel van primidon) Oxcarbazepine Topiramaat
|
Benzodiazepines Ethosuximide Gabapentine Levetiracetam Tiagabine Valproïnezuur Vigabatrine Zonisamide |
* Deze middelen induceren het enzym cytochroom P450 3A4 dat progestagenen en oestrogenen, aanwezig in de OAC, kan metaboliseren. Hierdoor neemt de anticonceptieve werking af.
Er bestaat in de literatuur discussie over de betrouwbaarheid van orale anticonceptie bij het gebruik van lamotrigine (Sabers & Harden, 2008). Aanvankelijk lieten resultaten van onderzoek geen effect zien van lamotrigine op de betrouwbaarheid van orale anticonceptie (Holdich, et al., 1991). Eén studie naar farmacokinetische effecten van lamotrigine bij gezonde vrouwen toonde echter een klinisch relevante invloed van een dagelijkse dosis van 300 mg lamotrigine op orale anticonceptie met 30 µg ethinylestradiol en 150 µg levonorgestrel. Hoewel er geen bewijs van ovulatie werd gevonden, kan de betrouwbaarheid van orale anticonceptie niet worden gegarandeerd, vooral niet als deze gecombineerd wordt met hogere doseringen van lamotrigine (Sidhu, et al., 2006).
De vaginale ring (Nuvaring®) en de pilpleister (Evra®)behoren tot de gecombineerde hormonale anticonceptiva. In combinatie met de P450-enzyminducerende anti-aanvalsmedicatie worden zij beschouwd als onveilig.
De zogenaamde minipillen met uitsluitend een lage dosering progestageen hebben met name een perifeer anticonceptief effect: ze verdikken de cervicale mucus waardoor penetratie van het sperma wordt bemoeilijkt. Tevens veranderen ze het endometrium en zorgen ze voor een verminderde motiliteit van de tuba. De minipillen moeten continu ingenomen worden zonder pilvrije periode en voorkomen de ovulatie niet altijd. Vanwege de zeer lage doseringen zijn ze waarschijnlijk niet effectief bij vrouwen die enzyminducerende anti-aanvalsmedicatie gebruiken.
Er is geen wetenschappelijk bewijs over de effectiviteit van medroxyprogesteron voor intramusculaire toediening (prikpil) in combinatie met anti-aanvalsmedicatie die het enzym P450 in de lever induceren. Overwogen kan worden om het interval tussen de injecties van de ‘prikpil’ te verkorten, bijvoorbeeld naar acht tot tien weken.
Er is evenmin bewijs over de effectiviteit van de morning-after pil bij vrouwen die een enzyminducerend anti-aanvalsmedicijn gebruiken. Hoewel dit buiten de licentie van dit product valt kan overwogen worden een hogere dosering voor te schrijven, bijvoorbeeld 1.5 mg levonorgestrel zo spoedig mogelijk, gevolgd door 0.75 mg levonorgestrel 12 uur later. Een praktisch bezwaar is dat er geen 0.75 mg tabletten levonorgestrel in Nederland in de handel zijn. De tabletten van 1.5 mg hebben geen breukstreep en zouden met een tabletsplitter gesplitst moeten worden, wat minder nauwkeurig is. Als alternatief kan het koperhoudend spiraal als morning-after methode worden gebruikt. Dit moet dan binnen vijf dagen na de geslachtsgemeenschap worden geplaatst. De methode met de morning-afterspiraal heeft bij vrouwen met epilepsie en P450-enzyminducerende anti-aanvalsmedicatie de voorkeur (Zorginstituut Nederland: Farmacotherapeutisch kompas > Noodanticonceptie).
Farmacokinetische studies beschrijven een mogelijk klinisch relevante interactie bij de combinatie van een progestageen bevattend oraal anticonceptivum met een dosering van 12 mg perampanel. Bij deze combinatie wordt een daling van de levonorgestrel (=progestageen) spiegel beschreven (Cmax verminderde met 42% en AUC 0-24h met 40 % bij 1 dd 12 mg perampanel gebruik). Daarom wordt aanvullende anticonceptie geadviseerd. Bij een lagere dosering perampanel werd deze interactie niet beschreven (Rohracher et al., 2016).
Davis et al. verrichtten een pilotstudie naar de veiligheid en verdraagzaamheid van het progestageen bevattend spiraal (IUD) bij 20 vrouwen met epilepsie en een stabiel gebruik van anti-aanvalsmedicatie. 14 vrouwen gebruikten monotherapie en 6 vrouwen polytherapie. Lamotrigine was het meest gebruikte anti-aanvalsmedicijn en werd door 12 vrouwen gebruikt. Deze vrouwen hadden gedurende 6 maanden na plaatsing van het IUD een stabiele lamotriginespiegel die ongewijzigd was ten opzichte van de maand voorafgaand aan de plaatsing. Van de 20 vrouwen nam de aanvalsfrequentie toe bij 3 vrouwen, bleef deze ongewijzigd bij 13 vrouwen en nam de frequentie af bij 4 vrouwen. Geen van de vrouwen dacht dat het IUD de aanvallen deed toenemen. Alle vrouwen waren enigszins of erg tevreden met het IUD tijdens de studie. Zij continueerden ook allen het gebruik na de studieduur van 6 maanden (Davis et al., 2016).
Economische evaluaties
Er zijn geen bruikbare economische evaluaties gevonden met betrekking tot deze uitgangsvraag.
Onderbouwing
Achtergrond
Het gelijktijdig gebruik van anti-aanvalsmedicatie en hormonale anticonceptie kan interacties geven. De vraag is welke combinaties kunnen leiden tot een verhoogd risico op zwangerschap, of een veranderde serumspiegel van het anti-aanvalsmedicijn.
Conclusies / Summary of Findings
|
Matig |
Het is aannemelijk dat het gebruik van anti-aanvalsmedicatie de werking van hormonale anticonceptie kan beïnvloeden door een effect op de hormoonspiegels in het bloed.
(Gaffield et al., 2011) |
|
Matig |
Het is aannemelijk dat door gebruik van gecombineerde hormonale anticonceptie de serumspiegel van lamotrigine wordt verlaagd.
(Gaffield et al., 2011) |
|
Laag |
Er zijn aanwijzingen dat het gebruik van uitsluitend progestageen bevattende anticonceptie of niet-hormonale anticonceptie geen effect heeft op de serumspiegel van lamotrigine.
(Gaffield et al., 2011) |
|
Laag |
Er zijn aanwijzingen dat door gebruik van gecombineerde hormonale anticonceptie de serumspiegel van valproaat wordt verlaagd.
(Gaffield et al., 2011) |
Samenvatting literatuur
NICE-aanbevelingen
- Bij vrouwen in de vruchtbare leeftijd moet de mogelijkheid van interacties tussen anti-aanvalsmedicatie en orale anticonceptie worden besproken. Er moet een afweging worden gemaakt tussen de risico’s en de voordelen van behandeling met deze (combinatie van) medicatie.
- Met meisjes in de vruchtbare leeftijd en met (de verzorgers van) jonge meisjes die waarschijnlijk ook in de vruchtbare leeftijd behandeling nodig hebben, moet de mogelijkheid van interacties tussen de anti-aanvalsmedicatie en orale anticonceptie besproken worden. De risico’s en de voordelen van behandeling met deze (combinatie van) medicatie moet tegen elkaar afgewogen te worden.
- Bij vrouwen en meisjes in de vruchtbare leeftijd moeten de risico’s en de voordelen van de verschillende anticonceptie methodes worden besproken, inclusief die van het progestageen (levonorgestrel) bevattend spiraaltje (IUD).
- Als een vrouw of een meisje enzyminducerende anti-aanvalsmedicatie gebruikt en er toch voor kiest om de gecombineerde anticonceptiepil te gebruiken moet er advies gegeven worden over de dosering.
- De uitsluitend progestageenbevattende anticonceptiepil wordt niet aanbevolen als betrouwbaar anticonceptivum voor vrouwen en meisjes die enzyminducerende anti-aanvalsmedicatie gebruiken.
- De progestageenbevattende implantatiestift voor onderhuidse toediening wordt niet aanbevolen voor vrouwen en meisjes die enzyminducerende anti-aanvalsmedicatie gebruiken.
- Het aanvullend gebruik van een barrièremethode moet worden besproken met vrouwen en meisjes op enzyminducerende anti-aanvalsmedicatie die ook orale anticonceptie of depot injecties progestageen gebruiken.
Aanvullend op de NICE-richtlijn is er gezocht naar relevante literatuur voor deze uitgangsvraag. Dit leverde een recente systematische review op (Gaffield,et al, 2011).
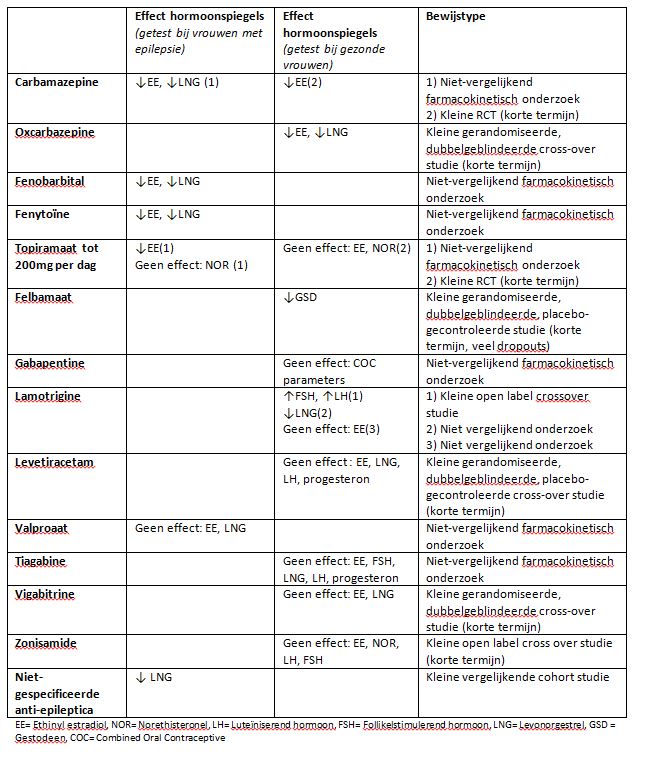
Gaffield et al. (Gaffield et al., 2011) verrichtten een systematische review, waarbij vanaf 1966 tot 3 mei 2010 werd gezocht in Pubmed en The Cochrane library naar artikelen over het gebruik van hormonale anticonceptiemethoden door vrouwen die anti-aanvalsmedicatie gebruiken. Er werden 43 artikelen geselecteerd en kwalitatief geanalyseerd. Een overzicht van het gevonden bewijs voor effecten van diverse anti-aanvalsmedicatie op de hormoonspiegels bij gebruik van anticonceptie is te zien in tabel 1. Voor effecten van gebruik van anticonceptie op de serumspiegel anti-aanvalsmedicatie werd minder bewijs gevonden. Wel werd in zes vergelijkende studies en twee case-series bij vrouwen met epilepsie aangetoond dat de serumspiegel lamotrigine toeneemt tijdens de stopweek bij gebruik van gecombineerde orale anticonceptie. Hetzelfde werd gevonden in een cross-over studie onder 16 vrouwen zonder epilepsie. In één van de vergelijkende studies (een cohortstudie onder 45 vrouwen) gingen sommige vrouwen over op uitsluitend progestageenbevattende orale anticonceptie, waarna de lamotrigine spiegel direct toenam. Dit ondersteunt de hypothese dat het progestageen de serumspiegel lamotrigine niet verlaagt. Volgens een farmacokinetische studie veranderde de concentratie lamotrigine niet als een vrouw een combinatietherapie van lamotrigine met valproaat gebruikte. Ook veranderde de concentratie lamotrigine volgens deze studie niet wanneer niet-hormonale anticonceptie werd gebruikt.
Voor het gebruik van valproaat werd in drie kleine farmacokinetische studies gevonden dat het gebruik van gecombineerde orale anticonceptie voor een versnelde klaring, en dus lagere concentraties valproaat zorgt.
Tabel 1. Gaffield et al. (Gaffield et al., 2011): bewijs ten aanzien van combinatie anti-aanvalsmedicatie en hormonale anticonceptie
Zoeken en selecteren
Voor deze uitgangsvraag is gekeken naar de aanbevelingen over dit onderwerp in de NICE-richtlijn (NICE-richtlijn, 2012). Daarnaast is gezocht naar literatuur waarin het effect van gelijktijdig gebruik van anti-aanvalsmedicatie en hormonale anticonceptie wordt bekeken. Er is gezocht via de databases Medline, Embase en the Cochrane Library naar systematische reviews en randomized controlled trials (RCTs) vanaf het jaar 1999. Na het lezen van de volledige tekst werd één artikel geselecteerd. Voor de selectie werden de volgende criteria gebruikt:
- De studie bekijkt het effect op de uitkomstmaten zwanger worden, serumspiegel anti-aanvalsmedicatie en/of aanvalsfrequentie.
- De studie is relevant voor de huidige Nederlandse situatie.
Referenties
- Christensen, J. et al. (2010). Oral contraceptives induce lamotrigin metabolism: evidence from a double-blind, placebo-controlled trial. Epilepsia, 48(3), 484-489.
- College ter Beoordeling Geneesmiddelen. (2016). Aangepast advies voor gebruiksters morning-afterpil die ook andere medicatie gebruiken. Nieuwsbericht 09082016, from https://www.cbg-meb.nl/actueel/nieuws/2016/08/09/aangepast-advies-voor-gebruiksters-morning-afterpil-die-ook-andere-medicatie-gebruiken
- le Comte, M., & Polderman, A. (2014). Dosisverhoging pil geschrapt. Nieuw advies bij interacties anticonceptiva en inductoren. Pharmaceutisch Weekblad, 149(32/33), 20-21.
- Crawford, P. (2002). "Interactions between antiepileptic drugs and hormonal contraception." CNS Drugs 16(4): 263-72.
- Davis, A. R., Saadatmand, H. J., & Pack, A. (2016). Women with epilepsy initiating a progestin IUD: A prospective pilot study of safety and acceptability. Epilepsia, 57(11), 1843-1848
- Gaffield, M.E. et al. (2011). The use of hormonal contraception among women taking anticonvulsant therapy. Contraception, 83(1),16-29.
- Holdich T, Whiteman P, Orme M et al. Effect of lamotrigine on the pharmacology of the combined oral contraceptive pill. Epilepsia 1991;32(suppl 1):96.
- National Institute for Health and Clinical Excellence (NICE). (2012). The Epilepsies: the diagnosis and management of the epilepsies in adults and children in primary and secondary care Nice Clinical Guideline 137. London: National Institute for Health and Clinical Excellence.
- Rohracher, A., Brigo, F., Hofler, J., Kalss, G., Neuray, C., Dobesberger, J., . . . Trinka, E. (2016). Perampanel for the treatment of primary generalized tonic-clonic seizures in idiopathic generalized epilepsy. Expert Opin Pharmacother, 17(10), 1403-1411. doi: 10.1080/14656566.2016.1195810
- Sabers A, Harden CL. Gender issues for drug treatment. In: Engel J, Pedley TA. Epilepsy. A comprehensive textbook, second edition. Lippincott Williams and Wilkins; 2008:1263-1268.
- Schwenkhagen, A.M. et al. (2008). Which contraception for women with epilepsy? Seizure, 17(2),145-150.
- Sidhu J, Job S, Singh S, Philipson R. The pharmacokinetic and pharmacodynamic consequences of the co-administration of lamotrigine and a combined oral contraceptive in healthy female subjects. Br J Clin Pharmacol 2006;61(2):191-199.
- Zorginstituut Nederland > Farmacotherapeutisch > Noodanticonceptie. link: https://www.farmacotherapeutischkompas.nl/bladeren/indicatieteksten/noodanticonceptie
Evidence tabellen
| Evidence table for systematic reviews | |||||||||||
| Study reference | Design | Inclusion Criteria | Quality | Results | Comments | ||||||
|
Gaffield, 2011 |
Systematic review of primary research studies and case reports |
Primary research studies or case reports investigating the safety and effectiveness or hormonal contraception among women of reproductive age with epilepsy who were prescribed anticonvulsant therapy.
Pharmacokinetic studies of hormonal contraception during concomitant administration of anticonvulsants in healthy women were also included.
Studies had to be published in peer-reviewed journals from database inception from 1966 through 3 May 2010 |
Search:
Selection:
Quality assessment of individual studies: |
combined oral contraceptives (COC): - Phenobarbital or carbamazepine use in combination with high dose COC caused decreased EE and LNG levels (2 cohorts) - Phenytoin use in combination with COC caused decreased EE levels (1 cohort) - Carbamazepine use in combination with COC caused decreased levonorgestrel levels (1 cohort) - Carbamazepine use in combination with low dose COC caused decreased levels and increased clearance of EE and norethisterone (1 rct) - Oxcarbazepine use in combination with high dose COC caused decreased plasma levels and increased clearance of EE and LNG (1 crossover trial) - Unintended pregnancies have been reported among women taking COC and: phenytoin (n=4), phenytoin in combination with other anticonvulsants (n=26), phenytoin with primidone or Phenobarbital (n=17), phenytoin and carbamazepine (n=2), Phenobarbital (n=7)
Progestogen-only contraceptives POC: - Phenytoin, carbamazepine, clonazapam or varying combinations of these together with levenorgestrel implant (Norplant) caused lower levels LNG en showed pregnancy (n=2) (1 cohort) - Unintended pregnancies have been reported in women using Norplant and: phenobarbital (n=1) or phenytoin (n=1) (1 cohort) - Unintended pregnancies have been reported in women using POPs and phenobarbital alone or combined (n=3) (1 cohort)
Lamotrigine (LTG): - COC use caused decreased LTG serum levels, increased LTG clearance and increased seizure-frequency (6 comparative studies and 2 case reports) - LTG use in combination with COC caused an 4.9-fold increase in FSH and LH levels, however no ovulation occurred and ethinol estradiol levels were unchanged (1 crossover trial) - POC caused no effects in LTG levels (1 cohort)
Valproate: - COC caused increased clearance of valproate (1 cohort) and decreased serum valproate concentrations (1 cohort) - Valproate in combination with high dose COC did not cause changes in EE, LNG or trough plasma concentrations (1 cohort)
Topiramate: - Topiramate use in combination with COC caused decreased EE levels and increased clearance rates and no changes in norethisterone pharmacokinetic parameters (1 cohort) - Topiramata use in combination with COC caused non-significant small increases in clearance rate for EE and norethisterone (1 rct)
Zonisamide: - Zonisamide use in combination with low dose COC caused no significant changes in pharmacokinetic parameters for EE or norethisterone and no significant changes in serum levels of LH, FSH and progesterone (1 crossover trial)
Levetiracetam: - Levetiracetam use in combination with COC caused no significant changes in pharmacokinetic parameters for EE or LNG and no significant changes in serum levels of LH and progesterone
Vigabitrin: - Vigabitrin use in combination with low dose COC caused no significant changes in pharmacokinetic parameters for EE or LNG and did not modify hepatic enzyme activity (1 crossover trial)
Felbamate: - Felbamate use in combination with low dose COC caused a minor decrease in EE serum level and a significant decrease in gestodene serum level. No evidence of ovulation was reported however one user reported intermenstrual bleeding (1 rct)
Gabapentin: - Gabapentin use in combination with high dose COC caused no changes in COC or gabapentin pharmacokinetic parameters (1 crossover trial)
Tiagabine: - Tiagabine use in combination with COC caused no changes in plasma EE, progesterone, LNG, desogestrel, PSH or LH levels. |
NR= not reported |
||||||
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 30-05-2023
Sinds 2014 wordt eenmaal per jaar een literatuursearch per module uitgevoerd. De clusterleden beoordelen of er in de resultaten van de search artikelen zijn die aanleiding geven om de (aanbevelingen van) de module aan te passen. Tot 2020 werden de geselecteerde artikelen opgenomen in een evidence tabel, en indien door de werkgroep voldoende relevant bevonden, werden de aanbevelingen inhoudelijk aangepast. Sinds 2020 is overgegaan tot modulair onderhoud van richtlijnen binnen clusters (zie: https://richtlijnendatabase.nl/werkwijze.html). Na de literatuurselectie wordt tijdens een vergadering met alle clusterleden de prioritering gemaakt voor de vijf te herziene modules van dat jaar. De herziene modules worden ter commentaar en autorisatie aangeboden aan de betrokken wetenschappelijke verenigingen. Dit is een zich jaarlijks herhalende cyclus.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS) en vanuit EpilepsieNL
De volgende verenigingen en organisaties hebben medewerking verleend aan de totstandkoming van de richtlijn (in alfabetische volgorde):
- EpilepsieNL
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Nederlands Instituut van Psychologen, sectie neuropsychologie (NIP)
- Nederlandse Liga tegen Epilepsie
Doel en doelgroep
Doel
De epilepsiepatiënt in Nederland op eenduidige en wetenschappelijk onderbouwde wijze diagnosticeren en behandelen. Ter ondersteuning van de richtlijngebruiker wordt - daar waar relevant - verwezen naar de module Informatie voor patiënten. De inhoud van de patiënteninformatie valt buiten verantwoordelijkheid van de werkgroep.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Samenstelling werkgroep
Voor het ontwikkelen van de webbased richtlijn is in 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met epilepsie. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de webbased richtlijn die in november 2013 vastgesteld en geautoriseerd werd. De richtlijn wordt vanaf 2013 jaarlijks geactualiseerd. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. Eventuele mutaties in de werkgroepsamenstelling vinden plaats in overleg met de Nederlandse Vereniging voor Neurologie, de werkgroep en de betreffende beroepsvereniging. Nieuwe leden dienen te allen tijden gemandateerd te worden door de betreffende beroepsvereniging. De werkgroep wordt ondersteund door adviseurs van het Kennisinstituut van Medisch Specialisten en door een voorlichter van het EpilepsieNL.
Werkgroep
- Prof. dr. H.J.M. Majoie (voorzitter), neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze en Maastricht
- Dr. C.M. (Carin) Delsman-van Gelder, Kinderarts/kinderneuroloog, Maxima Medisch Centrum, Veldhoven (vanaf 2022)
- Drs. M.H.G. (Marjolein) Dremmen, Radioloog (subspecialisatie kinderneuroradiologie), Erasmus MC, Rotterdam (vanaf 2020)
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Dr. J. Nicolai, kinderneuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Maastricht
- Dr. P. van Vliet, neuroloog/intensivist, Haaglanden Medisch Centrum, Den Haag
- Drs. R. (Roel) van Vugt, Anesthesioloog, Sint Maartenskliniek, Nijmegen (vanaf 2020)
- Dr. A. Altinbas, neuroloog-kinderneuroloog, SEIN /LUMC, Heemstede en Leiden (vanaf 2020)
- Drs. T. Balvers, neuroloog, SEIN/LUMC, Heemstede en Leiden (vanaf 2020)
- Dr. M.A.A.M. de Bruijn, AIOS neurologie, Elisabeth-Tweesteden Ziekenhuis, Tilburg (vanaf 2020)
- Prof. Dr. E.F.I. Comans, nucleair geneeskundige, Amsterdam UMC, Amsterdam (vanaf 2020)
- Dr. T.H.P. Draak, kinderneuroloog/neuroloog, Zuyderland Medisch Centrum, Heerlen en Sittard-Geleen (vanaf 2021)
- Drs. F.M.S. Eshuis, AIOS spoedeisende geneeskunde, Catharina ziekenhuis, Eindhoven (vanaf 2020)
- Dr. F.N.G. Van ’t Hof, neuroloog, SEIN, Heemstede en Amsterdam (vanaf 2020)
- Dr. P.A.M. Hofman, (neuro)radioloog, Maastricht UMC+ en Kempenhaeghe, Heeze en Maastricht
- Dr. D. Ijff, GZ psycholoog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze
- Ir. D. Jenniskens, Community Manager EpilepsieNL, Houten (vanaf 2020)
- Dr. J.A.F. Koekkoek, neuroloog, LUMC, Leiden, en Haaglanden Medisch Centrum, Den Haag
- Dr. R.H.C. Lazeron, neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Heeze
- Dr. M. Mantione, klinisch neuropsycholoog, UMC Utrecht (vanaf 2022)
- Drs. J.B. Masselink, Ziekenhuisapotheker, Medisch Spectrum Twente, Enschede (vanaf 2020)
- G.A.P.G. van Mastrigt, HTA onderzoeker/epidemioloog B, Universiteit Maastricht
- Dr. L. M’Rabet, MT-lid Kennis en Innovatie EpilepsieNL, Houten(vanaf 2022)
- Dr. J.C. Reijneveld, neuroloog en universitair hoofddocent neurologie, SEIN en Amsterdam UMC, Heemstede en Amsterdam (vanaf 2020)
- Drs. H.E. Ronner, neuroloog, AmsterdamUMC loctie VUmc, Amsterdam
- Dr. M.K.M. van Schie, AIOS neurologie, LUMC, Leiden (vanaf 2022)
- Dr. O. Schijns, neurochirurg, Maastricht UMC+, Maastricht (vanaf 2020)
- Dr. F.M. Snoeijen-Schouwenaars, AVG, Centrum voor Epilepsiewoonzorg Kempenhaeghe, Heeze
- Dr. R.D. Thijs, neuroloog, SEIN, Heemstede en LUMC, Leiden
- Dr. N. Tolboom, nucleair geneeskundige, UMC Utrecht, Utrecht (vanaf 2020)
- Dr. S.O. Tousseyn, neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Heeze
- Drs. J. H. van Tuijl, neuroloog, Elisabeth-TweeSteden ziekenhuis, Tilburg
- Dr. A. Uiterwijk, neuroloog, Academisch Centrum voor Epileptologie, Kempenhaeghe/Maastricht UMC+, Heeze
- Dr. N.E. Verbeek, klinisch geneticus, UMC Utrecht, Utrecht
- Dr. M. Vlooswijk, neuroloog, Maastricht UMC+, Maastricht (vanaf 2020)
- Dr. I. Wegner, neuroloog, SEIN, Zwolle en Leeuwarden
Werkgroepleden tot 2020/2021:
- P.B. Augustijn, kinderneuroloog, SEIN, Heemstede (tot 2020)
- Dr. C.A. van Donselaar, neuroloog, Maasstad Ziekenhuis, Rotterdam en Kempenhaeghe, Heeze (tot 2020)
- Dr. G.J. de Haan, neuroloog, SEIN, Heemstede (plaatsvervangend voorzitter, tot 2020)
- M.C. Hoeberigs, neuroradioloog, Maastricht UMC+ en Kempenhaeghe, Heeze (tot 2020)
- Dr. F. Leijten, neuroloog, UMC Utrecht, Utrecht (tot 2021)
- Em. prof. dr. D. Lindhout, klinisch geneticus, kinderarts niet praktiserend, UMC Utrecht en SEIN, Heemstede (tot 2020)
- Dr. W. van der Meij, neuroloog, Haaglanden Medisch Centrum, Den Haag (tot 2020)
- Dr. B. Panis, kinderneuroloog, Maastricht UMC+, Maastricht (tot 2021)
Met ondersteuning van
- I. Gijselhart, bibliothecaresse, Kempenhaeghe Heeze
- L. Linssen, secretaresse opleidingen medisch specialisten, Kempenhaeghe Heeze
- Dr. J. Buddeke, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf 2020)
- Dr. M.M.J. van Rooijen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf 2022)
Belangenverklaringen
Werkgroepleden verklaren schriftelijk of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn.
|
Werkgroeplid |
Belangen |
Zo ja, welke |
Jaar ingevuld |
|
Aldenkamp, dhr. |
Ja |
Deelname aan Wetenschappelijke |
2015 |
|
Augustijn, dhr. |
Ja |
Bestuurslid en regelmatig docent |
2015, herzien 2017 |
|
Beumer, mw. D. |
Nee |
|
2017 |
|
Bruijn, mw. M. de |
|
Coördinator van de ACES studie (antibodies causing epilepsy syndromes): nationale multicenterstudie waarvoor een beurs ontvangen van het Nationaal epilepsie Fonds (principal investigator: dr. M.J. Titulaer, euroloog, Erasmus MC). |
2017 |
|
Donselaar, dhr. dr. |
Ja |
Bestuurslid Stichting Epilepsie Onderwijs Nederland, onbetaald Lid Richtlijnen Commissie Diagnostiek en behandeling van Epilepsie (NVN, vergoeding) Lid Commissie Wetenschap Beter Keten (samenwerkingsverband Erasmus MC, Fransciscus Vlietland Groep, Maasstad Ziekenhuis, onbetaald) Aandelen UCB |
2015 |
|
Gijselhart, mw. I. |
|
|
|
|
Haan, dhr. dr. |
Ja |
Staflid neurologie Erasmus MC Rotterdam Begeleiden aios-en Cursorisch onderwijs (onbetaald) Eindredacteur vakblad Epilepsie Ex- voorzitter Liga tegen Epilepsie Adviseur EVN, EpilepsieNL |
2015, herzien 2017 |
|
Hofman, dhr. Dr. |
Nee |
|
2015, herzien 2017 |
|
Kolk, mw. N. van |
|
Gastdocent Radboud Health Academy (neurologie verpleegkunde), betaald |
2017 |
|
Kolsteren, mw. E. |
Nee |
|
2015, herzien 2017 |
|
Lazeron, dr. R.H.C. |
Ja |
Ontwikkeling nachtelijk aanvalsdetectie en - alarmeringssysteem, gefinancierd door ZonMW, Nuts-Ohra fonds, EpilepsieNL, met deelname van een hiertoe opgerichte onderneming LivAssured, met hulp van de firma ImplementationIQ en met participatie van investeringsfondsen in de gezondheidszorg. Geen direct of persoonlijk financieel belang in LivAssured, ImplementationIQ of de investeringsfondsen. |
2017 |
|
Leijten, dr. F.S.S. |
Ja |
Aandelen ProLira, een start-up bedrijf dat een deliriummonitor ontwikkelt. Ontwikkeling nachtelijk aanvalsdetectie en - alarmeringssysteem, gefinancierd door ZonMW, Nuts-Ohra fonds, EpilepsieNL, met deelname van hiertoe opgerichte onderneming LivAssured met hulp van de firma ImplementationIQ en met participatie van investeringsfondsen in de gezondheidszorg. Geen direct of persoonlijk financieel belang in LivAssured, ImplementationIQ of investeringsfondsen. |
2017 |
|
Lindhout, dhr. |
Ja |
Lid Gezondheidsraad (onbetaald) Lid vaste commissie Reproductie toxische stoffen van de Gezondheidsraad (vacatiegeld) Lid ad hoc commissies Gezondheidsraad (vacatiegeld) Lid Wetenschappelijke adviesraad Lareb (vacatiegeld) Lid Wetenschappelijk adviesraad Stichting Michelle (onbetaald) Lid Medische adviesraad STSN (onbetaald) |
2015 |
|
Majoie, mw. |
Ja |
Relevante commissies: |
2017 |
|
Mastrigt, mw. G. |
|
Onderzoeker/docent Universiteit Maastricht (0,1 fte) |
2017 |
|
Nicolai, dr. J. |
Ja |
Vanuit MUMC+ gedetacheerd in St. Jansgasthuis Weert, Elkerklierk Helmond en Kempenhaeghe Heeze (in dienst MUMC+) |
2017 |
|
Panis, mw. dr. P. |
Nee |
|
2017 |
|
Pols, mw. dr. M. |
|
|
|
|
Roelfsema, dr. V |
Nee |
|
2015, herzien 2017 |
|
Tuijl, mw. J.H. van |
Ja |
Lid werkgroep richtlijn Epilepsie (onbetaald) |
2015, herzien 2017 |
|
Uiterwijk, mw. A. |
Nee |
|
2017 |
|
Veendrick, mw. |
Nee |
|
2015 |
|
Venhorst, mw. K. |
|
|
|
|
Vliet, dhr. P. van |
Nee |
|
2015, herzien 2017 |
|
Wardt, dhr. J. van |
Nee |
|
2017 |
|
Wegner, mw. dr. I |
Ja |
Houden van wetenschappelijke voordrachten, voor een deel onbetaald, maar er zijn ook enkele voordrachten waarvoor de werkgever (SEIN) een financiële bijdrage heeft ontvangen van de firma UCB als vergoeding voor gemaakte uren. Dit alles volgens de officieel hiervoor geldende wet- en regelgeving. |
? |
|
Wijnen, dhr. B. |
|
|
|
|
Zijlmans, mw. |
Ja |
Commissielid communications committee international league against epilepsy (onbetaald) |
2015, herzien 2017 |
Inbreng patiëntenperspectief
Er wordt aandacht besteed aan het patiëntenperspectief door het betrekken van de Epilepsievereniging Nederland in commentaarfases. Bij de richtlijn is een module met patiëntinformatie ontwikkeld. Deze is geautoriseerd door de Epilepsie Vereniging Nederland en de Nederlandse Vereniging voor Neurologie.
Methode ontwikkeling
Evidence based
Werkwijze
Algemeen
AGREE
Deze richtlijn is opgesteld en wordt bijgehouden conform de eisen in het rapport ‘Richtlijnen 2.0’ van de adviescommissie Richtlijnen van de Raad WOK. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/). Dit is een internationaal breed geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Uitgangsvragen en uitkomstmaten
Op basis van de lijst met onderwerpen stellen de werkgroepleden en de adviseur concept-uitgangsvragen op. Deze worden met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen vaststelt. Vervolgens inventariseert de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn. Hierbij wordt zowel naar gewenste als ongewenste effecten gekeken. De werkgroep waardeert deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieert de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vindt, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er wordt eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews in PubMed en voor specifieke onderwerpen in the Cochrane Library, Embase en Psychinfo. Vervolgens wordt voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens wordt aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie wordt gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteren de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen worden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden onder ‘zoekstrategie’ van de desbetreffende uitgangsvraag.
Voor een aantal vragen is de recente Engelse evidence based richtlijn ‘The epilepsies’ van het NICE (National Institute of Clinical Excellence) als basis gebruikt.
Kwaliteitsbeoordeling individuele studies
Individuele studies worden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de evidence tabel.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen worden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur worden beschreven in de samenvatting van de literatuur. Bij een aantal interventievragen worden bij voldoende overeenkomsten tussen de studies de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen
De kracht van het wetenschappelijke bewijs wordt bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/) (Atkins et al, 2004) (zie tabel 1).
Tabel 1. GRADE-indeling van kwaliteit van studies per uitkomstmaat
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
1. Studiebeperkingen 2. Inconsistentie 3.Indirectheid 4. Imprecisie 5. Publicatiebias |
1. Groot effect 2. Dosis-respons relatie 3. Plausibele confounding |
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkende studie (bijvoorbeeld: patëntencontrole onderzoek, cohortonderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (bijvoorbeeld: case series of case reports) |
||
|
RCTs beginnen 'hoog'(4), observationele studies beginnen 'laag'(2) |
|||
Formuleren van conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose wordt het wetenschappelijke bewijs samengevat in één of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt de conclusie getrokken op basis van alle studies samen (body of evidence). Hierbij maken de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans worden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Voor een conclusie die gebaseerd is op (een) studie(s) die niet uit een systematisch literatuuronderzoek naar voren is/zijn gekomen, wordt geen niveau van bewijskracht bepaald. In een dergelijk geval staat bij de conclusie "geen beoordeling" vermeld.
Tabel 2. Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggend bewijs
|
Niveau |
Conclusie gebaseerd op |
|
Hoog |
Onderzoek van niveau A1 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken |
|
Matig |
één onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
Laag |
één onderzoek van niveau B of C |
|
Zeer laag |
Mening van deskundigen |
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn wordt expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn zijn er interne en externe kwaliteitsindicatoren ontwikkeld. Het doel van de indicatoren is om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroepleden is gevraagd om bestaande indicatoren en indicatoren gebaseerd op aanbevelingen uit de richtlijn te scoren op relevantie en registreerbaarheid. De indicatoren die het hoogst scoorden, zijn in de (concept)richtlijn opgenomen. Een overzicht treft u aan in de bijlage Indicatoren. De indicatoren zijn ook terug te vinden bij de betreffende uitgangsvraag.
Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Lacunes in kennis
De zorg voor patiënten met epilepsie kent nog veel aspecten waarover onzekerheid bestaat wat als optimaal kan worden aangewezen. In vrijwel alle modules van de richtlijn ‘Epilepsie’ zijn lacunes in kennis te onderkennen. Het is daarom zeer gewenst dat er verder wetenschappelijk onderzoek plaatsvindt naar de zorg voor patiënten met epilepsie. De werkgroep inventariseert de lacunes in kennis breed en heeft een aantal onderwerpen benoemd waarvan zij van mening is dat onderzoek hiernaar prioriteit verdient. Een overzicht treft u aan in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De richtlijn is in 2013 aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Vanaf 2013 wordt de richtlijn jaarlijks geactualiseerd (zie onder Herziening). De werkgroep doet aan het einde van het jaar een voorstel met welke modules zij denkt dat een commentaarronde nodig is aan de commissie Kwaliteit/subcommissie Richtlijnen van de Nederlandse Vereniging voor Neurologie (NVN). Hierbij is het uitgangspunt dat alleen die wijzigingen die eventueel tot discussie binnen de diverse beroepsgroepen kunnen leiden ter commentaar en tevens ter autorisatie voorgelegd worden. Alle andere wijzigingen worden doorgevoerd onder eigen verantwoordelijkheid van de werkgroep. De subcommissie Richtlijnen van de NVN beslist uiteindelijk welke modules aan de betrokken beroepsverenigingen worden voorgelegd. Voor die modules wordt eerst een commentaarfase gestart. Al het commentaar dat digitaal binnenkomt wordt gebundeld en in de werkgroep besproken en eventueel verwerkt in de richtlijnmodule. Vervolgens worden de aangepaste modules van de richtlijn voor autorisatie aangeboden. Bij akkoord van de beroepsverenigingen worden de geactualiseerde teksten definitief gepubliceerd op de website. De beroepsverenigingen worden hiervan op de hoogte gebracht.
Nieuwe uitgangsvragen
Als gebruikers van de richtlijn een belangrijk onderwerpen missen, kunnen zij een suggestie voor een nieuwe uitgangsvraag aanleveren bij de werkgroep (met motivering). De werkgroep zal jaarlijks de ontvangen suggesties bespreken en besluiten welke vragen opgenomen worden in de richtlijn.
Economische evaluaties
Doelmatigheid van behandeling
Sinds mei 2016 wordt aan de richtlijn ook kennis over de doelmatigheid (kosteneffectiviteit) van de epilepsiebehandeling meegenomen, ook wel economische evaluatie genoemd. Om deze kennis te verkrijgen is een systematische literatuur studie uitgevoerd (Wijnen et al., 2017, Wijnen et al., 2015). De gebruikte methodologie om de economische evaluaties in te bouwen in klinische richtlijnen is beschreven in een drietal papers (Wijnen et al., 2016, Mastrigt van et al., 2016, Thielen et al., 2016).
Databases
In MEDLINE (via PubMed), EMBASE en NHS economische evaluatie Database (NHS EED) is gezocht op kosteneffectiviteitsstudies. Voor bestaande systematische reviews, werden Cochrane Reviews, Cochrane DARE en Cochrane Health Technology Assessment Databases gebruikt.
Zoekstrategieën
Voor de identificatie van relevante studies zijn vooraf gedefinieerde klinische zoekstrategieën gecombineerd met een gevalideerd zoekfilter van McMaster University om economische evaluaties te identificeren (McMaster). Bij de zoekstrategieën hebben we ons beperkt tot therapeutische interventies.
Beoordeling van de studies
Om te beoordelen of de economische evaluaties kunnen worden opgenomen in de richtlijn is iedere gevonden studie beoordeeld aan de hand van zeven vragen. In deze pdf is de uitwerking van de verschillende vragen te vinden. Deze vragen zijn gebaseerd op de Consensus on Health Economics Criteria checklist (Evers et al., 2005) en de Welte transferability checklist (Welte et al., 2004).
Referenties
- Atkins, D., Best, D., Briss, P.A., Eccles, M., Falck-Ytter, Y., Flottorp, S., Guyatt, G.H., Harbour, R.T., Haugh, M.C., Henry, D., Hill, S., Jaeschke, R., Leng, G., Liberati, A., Magrini, N., Mason, J., Middleton, P., Mrukowicz, J., O’Connell, D., Oxman, A.D., Phillips, B., Schünemann, H.J., Edejer, T.T., Varonen, H., Vist, G.E., Williams, J.W. Jr, Zaza, S. GRADE Working Group. (2004). Grading quality of evidence and strength of recommendations. BMJ Jun; 19, 328(7454):1490.
- van Everdingen, J.J.E., Burgers, J.S., Assendelft, W.J.J., Swinkels, J.A., van Barneveld, T.A., van de Klundert, J.L.M. (2004). Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum.
- Evers, S., Goossens, M., De Vet, H., Van Tulder, M., Ament, A. (2005). Criteria list for assessment of methodological quality of economic evaluations: Consensus on Health Economic Criteria. International journal of technology assessment in health care. 21(02):240-245.
- van Mastrigt, G. A., Hiligsmann, M., Arts, J. J., Broos, P. H., Kleijnen, J., Evers, S. M., & Majoie, M. H. (2016). How to prepare a systematic review of economic evaluations for informing evidence-based healthcare decisions: a five-step approach (part 1/3). Expert Rev Pharmacoecon Outcomes Res (Nov 2), 1-16. doi: 10.1080/14737167.2016.1246960.
- McMaster University. (2016, Feb 09). Search Strategies for EMBASE in Ovid Syntax, from http://hiru.mcmaster.ca/hiru/HIRU_Hedges_EMBASE_Strategies.aspx.
- Thielen, F. W., Van Mastrigt, G., Burgers, L. T., Bramer, W. M., Majoie, H., Evers, S., & Kleijnen, J. (2016). How to prepare a systematic review of economic evaluations for clinical practice guidelines: database selection and search strategy development (part 2/3). Expert Rev Pharmacoecon Outcomes Res (Nov 2), 1-17. doi: 10.1080/14737167.2016.1246962.
- Welte, R., Feenstra, T., Jager, H., & Leidl, R. (2004). A decision chart for assessing and improving the transferability of economic evaluation results between countries. Pharmacoeconomics, 22(13), 857-876.
- Wijnen, B., van Mastrigt, G., Evers, G., Gershuni, O., Lambrechts, D., Majoie, H., & De Kinderen, R. (2015). Review of economic evaluations of treatments for patients with epilepsy. Prospero: International prospective register of systematic reviews. Retrieved from http://www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD42015019278.
- Wijnen, B., van Mastrigt, G., Redekop, W. K., Majoie, H., de Kinderen, R., & Evers, S. (2016). How to prepare a systematic review of economic evaluations for informing evidence-based healthcare decisions: data extraction, risk of bias, and transferability (Part 3/3). Expert Rev Pharmacoecon Outcomes Res (Oct 21). doi: 10.1080/14737167.2016.1246961.
- Wijnen, B. F., van Mastrigt, G. A., Evers, S. M., Gershuni, O., Lambrechts, D. A., Majoie, M. H., . . . de Kinderen, R. J. (2017). A systematic review of economic evaluations of treatments for patients with epilepsy. Epilepsia. doi: 10.1111/epi.13655.
