Anti-aanvalsmedicatie en borstvoeding bij epilepsie
Uitgangsvraag
Welke aanbevelingen zijn er ten aanzien van het geven van borstvoeding door vrouwen met epilepsie en anti-aanvalsmedicatiegebruik?
Aanbeveling
Bespreek met een (aanstaande) moeder en haar partner dat:
- er zeer weinig gedegen onderzoek is verricht naar directe effecten van anti-aanvalsmedicatie in de borstvoeding op de pasgeborene;
- tot op heden geen ernstige negatieve effecten zijn aangetoond;
- effecten op lange termijn onvoldoende zijn onderzocht;
- het geven van borstvoeding gezondheidsvoordelen heeft voor moeder en kind op zowel de korte als de langere termijn.
Let bij een baby die borstvoeding krijgt en waarvan de moeder anti-aanvalsmedicatie gebruikt goed op het eventueel optreden van bijwerkingen.
Overwegingen
De kwaliteit van de huidige literatuur met betrekking tot de mate waarin anti-aanvalsmedicatie doordringen in de borstvoeding is laag (met uitzondering voor lamotrigine) en laat per middel aanzienlijke verschillen zien (van der Meer et al., 2015). Soms kunnen er concentraties anti-aanvalsmedicatie gemeten worden in het serum van het kind. De klinische consequenties van de blootstelling van pasgeborenen aan anti-aanvalsmedicatie via de borstvoeding zijn onvoldoende onderzocht. Dit kan leiden tot tegenstrijdige adviezen aan de (aanstaande) moeder over het geven van borstvoeding. Overigens is het kind tijdens de zwangerschap al blootgesteld aan deze medicatie, aangezien de anti-aanvalsmedicatie in meer of mindere mate de placenta passeren (Harden et al., 2009). In de afweging om wel of geen borstvoeding te geven moeten ook de positieve effecten van het geven van borstvoeding voor de pasgeborene en de moeder worden meegenomen.
De mening van de werkgroep over het geven van borstvoeding door vrouwen met epilepsie is dat het gebruik van anti-aanvalsmedicatie door de moeder geen contra-indicatie vormt. Wel wordt gewaarschuwd voor het optreden van enige sedatie van de baby als moeders fenobarbital of benzodiazepines gebruiken. Ook wordt abrupt stoppen met borstvoeding geven en daarmee de toediening van anti-aanvalsmedicatie, ontraden omdat er een onthoudingssyndroom bij de baby kan ontstaan met overprikkelbaarheid, tremoren en slapeloosheid (Kuhnz et al., 1988). Een goede observatie van de baby op het mogelijk optreden van bijwerkingen wordt aangeraden.
Via de site is de database LactMed te raadplegen. Deze site wordt maandelijks bijwerkt en bevat informatie over mogelijke bijwerkingen van anti-aanvalsmedicatie blootstelling via de moedermelk bij het kind.
Economische evaluaties
Er zijn geen bruikbare economische evaluaties gevonden met betrekking tot deze uitgangsvraag.
Onderbouwing
Achtergrond
Anti-aanvalsmedicatie kunnen in meer of mindere mate in de borstvoeding terecht komen. De vraag is of borstvoeding bij vrouwen met epilepsie en anti-aanvalsmedicatiegebruik kan worden aanbevolen of moet worden afgeraden.
Conclusies / Summary of Findings
|
Laag |
Er zijn aanwijzingen dat primidon en levetiracetam in potentieel klinisch relevante hoeveelheden doordringen in de borstvoeding.
(Harden et al., 2009) |
|
Zeer laag |
Er zijn aanwijzingen dat gabapentine, lamotrigine, topiramaat en ethosuximide in potentieel klinisch relevante hoeveelheden doordringen in de borstvoeding.
(Harden et al., 2009) |
|
Laag |
Er zijn aanwijzingen dat valproaat, fenobarbital, carbamazepine en fenytoïne niet in potentieel klinisch belangrijke hoeveelheden doordringen in de borstvoeding.
(Harden et al., 2009) |
|
Zeer laag |
Er zijn aanwijzingen dat lamotrigine via borstvoeding in het bloed van de pasgeborene kan komen.
(Fotopoulou et al., 2009; Liporace et al., 2004) |
|
Zeer laag |
Er zijn aanwijzingen dat lamotrigine langzaam wordt geëlimineerd uit het bloed van de pasgeborene.
(Fotopoulou et al., 2009; Liporace et al., 2004) |
|
Zeer laag |
Er zijn aanwijzingen dat lamotrigine in het bloed van de pasgeborene geen nadelige effecten heeft voor het kind.
(Fotopoulou et al., 2009) |
|
Zeer laag |
Er zijn aanwijzingen dat het geven van borstvoeding door vrouwen op monotherapie carbamazepine, lamotrigine, fenytoïne of valproaat op een termijn van drie jaar geen nadelige cognitieve effecten veroorzaakt bij het eerder in utero al aan deze anti-aanvalsmedicatie blootgestelde kind.
(Fotopoulou et al., 2009) |
|
Laag |
Er zijn aanwijzingen dat het geven van borstvoeding door vrouwen die anti-aanvalsmedicatie gebruiken geen nadelige effecten heeft op het gebied van spraaktaal-capaciteiten, ontwikkeling, gedrag en motorische en sociale vaardigheden bij een kind van 6, 18 of 36 maanden oud.
(Veiby et al., 2013) |
|
Laag |
Er zijn aanwijzingen dat het geven van borstvoeding door vrouwen die anti-aanvalsmedicatie gebruiken positieve effecten heeft op het totale IQ en de verbale capaciteiten bij een kind van 6 jaar oud.
(Meador et al., 2014) |
Samenvatting literatuur
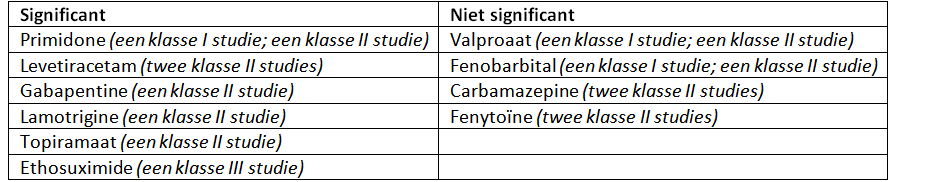
Voor onze uitgangsvraag werd een systematische review gevonden naar de mate waarin maternaal gebruikte anti-aanvalsmedicatie doordringen in de borstvoeding (Harden et al., 2009). In de review werd systematisch gezocht naar artikelen, gepubliceerd tussen 1985 en 2007, die bij minimaal vijf patiënten keken naar de correlatie van de maternale serumspiegel van anti-aanvalsmedicatie met de concentratie anti-aanvalsmedicatie in borstvoeding. De kwaliteit van de artikelen werd beoordeeld met behulp van het classificatie van bewijsschema van de American Academy of Neurology. Een verhouding borstmelk tot maternale serumspiegel van het anti-aanvalsmedicijn boven 0.6 werd als significant beoordeeld. De volgende resultaten werden gevonden:
Tabel 1. Harden, et al. (Harden, Pennell et al., 2009): bewijs voor anti-aanvalsmedicatie die doordringen in de borstvoeding
In het onderzoek van Harden et al. (Harden et al., 2009) werden geen studies gevonden die keken naar de stapeling van anti-aanvalsmedicatie in het kind (via de borstvoeding) of naar de gevolgen hiervan voor het kind.
Daarnaast werden twee prospectieve studies geïncludeerd die specifiek keken naar het doordringen van lamotrigine in de borstvoeding (Fotopoulou et al., 2009 en Liporace et al, 2004) en drie prospectieve studies die keken naar het cognitieve effect op het kind als de moeder anti-aanvalsmedicatie gebruikt en borstvoeding geeft (Meador et al., 2010, en Veiby et al., 2013, Meador et al., 2014).
Fotopoulou et al. (Fotopoulou et al., 2009) onderzochten bij negen vrouwen onder behandeling met monotherapie lamotrigine (verhoogd tot de optimale dosis) en hun pasgeborenen, onder andere wat het lamotriginegebruik voor effect had op de concentratie lamotrigine in borstvoeding en op concentratie in het bloed van het kind. De verhouding van lamotrigine in borstvoeding tot lamotrigine in het serum van de moeder was 0.59. De lamotrigineconcentratie in de borstvoeding nam af na de bevalling. De concentratie lamotrigine in het serum van het kind twaalf weken na de geboorte was 2.2 µg/ml (mediaan was dit 26% van de concentratie in het serum van de moeder). Bij kinderen werd lamotrigine langzaam uit het lichaam verwijderd. Er werden geen nadelige effecten als gevolg van de lamotrigine in het bloed bij het kind aangetoond. Liporace et al. (Liporace et al, 2004) deden een soortgelijke studie bij vier pasgeborenen die borstvoeding kregen van vrouwen die onder behandeling waren met lamotrigine. De concentratie lamotrigine in borstvoeding werd in deze studie niet gemeten, maar er werd wel gekeken naar de serumspiegels lamotrigine bij het kind op een langere termijn. Tien dagen na de geboorte werd er bij de kinderen respectievelijk 1.8 - 1.3 - 2.0 en <1 µg/ml lamotrigine in het bloed gevonden. Na twee maanden kregen slechts twee kinderen nog borstvoeding. Bij deze kinderen werd een concentratie lamotrigine in het bloed gevonden van respectievelijk 1.7 en 1 µg/ml. De hoge spiegels van lamotrigine in de pasgeborenen worden mogelijk verklaard door stapeling vanwege het nog onrijpe neonatale metabolisme van lamotrigine.
Meador et al. (Meador et al., 2010) onderzochten prospectief de cognitieve status van 199 kinderen tot een leeftijd van drie jaar. De moeders van de kinderen maakten gebruik van monotherapie carbamazepine, lamotrigine, fenytoïne of valproaat. De auteurs vergeleken daarbij de kinderen die wel borstvoeding kregen met de kinderen die geen borstvoeding kregen. De groepen werden niet gerandomiseerd, waardoor er verschillen waren in grootte van de groep, gemiddelde leeftijd van de moeder en gebruik van foliumzuur door de moeder. Er werden geen significante verschillen gevonden in IQ op driejarige leeftijd tussen de groep kinderen die borstvoeding kreeg en de groep kinderen die geen borstvoeding kreeg. Ook werden er geen significante verschillen gevonden in het IQ van de kinderen voor de verschillende soorten anti-aanvalsmedicatie die door de moeders gebruikt werden.
Veiby et al. (2013) onderzochten in een prospectieve cohort studie het effect van blootstelling aan anti-aanvalsmedicatie tijdens de zwangerschap en borstvoeding op de uitkomstmaten motorische en sociale vaardigheden, gedrag en spraak-taalontwikkeling van het kind. Zij deden dit na 6, 18 en 36 maanden. Het geven van borstvoeding door moeders die anti-aanvalsmedicatie gebruikten, had geen nadelig effect op de kinderen op het gebied van fijne en grove motorische en sociale vaardigheden, gedrag en spraaktaal ontwikkeling.
In een prospectieve observationele studie van Meador et al. uit 2014 (vervolg op Meador et al., 2010), uitgevoerd in de Verenigde Staten en het Verenigd Koninkrijk, werd het effect van blootstelling aan anti-aanvalsmedicatie door borstvoeding op de cognitieve status van 181 kinderen op de leeftijd van 6 jaar onderzocht. De moeders van de kinderen werden behandeld met monotherapie carbamazepine, lamotrigine, fenytoïne of valproaat. De groepen werden niet gerandomiseerd en de groepen waren verschillend voor maternale IQ, maternale leeftijd, maternaal foliumzuurgebruik en regio. Er werd door propensity score analysis gevonden dat deze baselineverschillen geen invloed hadden op de resultaten. Er werden significante verschillen gevonden tussen de kinderen die borstvoeding kregen en de kinderen die geen borstvoeding kregen op het totale IQ en de verbale capaciteiten. In de groep kinderen die borstvoeding kreeg was het IQ op de leeftijd van 6 jaar 108 versus 104 in de groep kinderen die geen borstvoeding kreeg. De verbale capaciteiten waren significant hoger op de leeftijd van 6 jaar in de groep kinderen die borstvoeding kregen. Bij de 6-jarige kinderen werden geen bijwerkingen gevonden van de mogelijke blootstelling aan anti-aanvalsmedicatie via de borstvoeding.
Zoeken en selecteren
Voor deze uitgangsvraag is gezocht naar literatuur waarin gekeken is naar het doordringen van anti-aanvalsmedicatie in de borstvoeding en naar de effecten hiervan voor pasgeborenen. Er is vanaf 1999 gezocht in de databases Pubmed, Embase en the Cochrane Library naar case-control studies, observationele studies, randomized controlled trials (RCTs) en systematische reviews. Na het lezen van de volledige tekst werden er zes studies geïncludeerd. De volgende selectiecriteria waren van toepassing:
- Relevant voor de huidige Nederlandse situatie.
- Geeft antwoord op de uitgangsvraag, waarbij als uitkomstmaten worden gehanteerd:
- concentratie anti-aanvalsmedicatie in de borstvoeding;
- concentratie anti-aanvalsmedicatie bij neonaat (serum);
- cognitieve effecten, irritatie, sufheid;
- ontwikkeling van het kind.
Referenties
- Fotopoulou, C., Kretz, R., Bauer, S., Schefold, J. C., Schmitz, B., Dudenhausen, J. W., & Henrich, W. (2009). Prospectively assessed changes in lamotrigine-concentration in women with epilepsy during pregnancy, lactation and the neonatal period. Epilepsy Res, 85(1), 60-64. doi: 10.1016/j.eplepsyres.2009.02.011
- Harden, C. L., Pennell, P. B., Koppel, B. S., Hovinga, C. A., Gidal, B., Meador, K. J., . . . American Epilepsy Society. (2009). Management issues for women with epilepsy--focus on pregnancy (an evidence-based review): III. Vitamin K, folic acid, blood levels, and breast-feeding: Report of the Quality Standards Subcommittee and Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Epilepsia, 50(5), 1247-1255.
- Kuhnz, W., Koch, S., Helge, H., Nau, H. (1998). Primidone and phenobarbital during lactation period in epileptic women: total and free drug serum levels in the nursed infants and their effects on neonatal behavior. Dev Pharmacol Ther. 11(3), 147-54.
- Liporace, J., Kao, A., & D'Abreu, A. (2004). Concerns regarding lamotrigine and breast-feeding. Epilepsy Behav, 5(1), 102-105.
- Meador, K. J., Baker, G. A., Browning, N., Clayton-Smith, J., Combs-Cantrell, D. T., Cohen, M., . . . Loring, D. W. (2010). Effects of breastfeeding in children of women taking antiepileptic drugs. Neurology, 75(22), 1954-1960. doi: 10.1212/WNL.0b013e3181ffe4a9
- Meador, K. J., Baker, G. A., Browning, N., Cohen, M. J., Bromley, R. L., Clayton-Smith, J., . . . Loring, D. W. (2014). Breastfeeding in children of women taking antiepileptic drugs: cognitive outcomes at age 6 years. JAMA Pediatr, 168(8), 729-736. doi: 10.1001/jamapediatrics.2014.118
- van der Meer, D. H., Wieringa, A., Wegner, I., Wilffert, B., & Ter Horst, P. G. (2015). Lactation studies of anticonvulsants: a quality review. Br J Clin Pharmacol, 79(4), 558-565. doi: 10.1111/bcp.12524
- Veiby G., Engelsen B.A., Gilhus N.E. (2013). Early child development and exposure to antiepileptic drugs prenatally and through breastfeeding: a prospective cohort study on children of women with epilepsy. JAMA Neurol. 70(11):1367-74.
Evidence tabellen
| Evidence table for systematic reviews | |||||||||||
| Study reference | Design | Inclusion Criteria | Quality | Results | Comments | ||||||
|
Harden, 2009 |
Systematic review of cohorts |
Articles in which the frequency of pregnancy-related or epilepsy-related complications was determined in a cohort study with pregnant women with epilepsy (WWE)
Articles needed to be published between 1985 and June 2007
Measuring a minimum of five maternal serum-breast milk pairs.
AED serum level was risk factor, AED level in breast milk was outcome |
Search: Selection: Quality assessment of individual studies: |
(AED transfer rate was considered clinically important if milk- to maternal concentration ratio was ≥0.6)
The following AEDs do significantly penetrate breast into milk: primidone (one class 1 study and one class 2 study), levetiracetam (two class 2 studies), gabapentin (one class 2 study), lamotrigine (one class 2 study) and topiramate (one class 2 study), ethosuximide( one class 3 study)
The following AEDs do not significantly penetrate into breast milk: valproate (one class 1 study and one class 2 study), phenobarbital (one class 1 study and one class 2 study), carbamazepine (two class 2 studies), phenytoin (two class 2 studies)
- There is no adequate data about accumulation of AEDs in newborn - There is no adequate data about symptomatic effects on newborns of WWE caused by indirect exposure to maternally ingested AEDs |
|||||||
| Interventieonderzoek (trials en cohort) | |||||||||||
| Study reference | Study characteristics | Patient characteristics | Intervention (I) | Comparison / control (C) | Follow-up | Outcome measures and effect size | Comments | ||||
|
Fotopoulou, 2009 |
Type of study: Prospective study
Setting: Charité-Virchow-Clinic in Berlin
Country: Germany
Source of funding: NR |
Inclusion criteria: Pregnant, epileptic women treated with lamotriginge (LTG) on a monotherapy regime, during pregnancy, at delivery and puerperium.
Exclusion criteria: NR
N: 9
Mean age ± SD: 31.5 (range 23-37) yr |
Lamotrigine (LTG) as monotherapy + oral folate (0.6-1g/day)
LTG dosage had to be increased (by an average of 250%) to obtain optimal therapeutic response. Blood samples for determination of serum concentration had to be drawn before morning dose evey 4 wks during pregnancy, at delivery and 3 wks after delivery
Fetal peripartal monitoring was preserved for cardiotocogramms and daily examination |
No control |
Endpoint of follow-up: LTG concentration in maternal blood, in blood of the umbilical cord, in blood of the newborn and in breast milk
Duration of follow-up: 9 months during pregnancy, till mean 3 wks postpartal (umbilical cord blood samples were taken 24 and/or 48h postpartum)
For how many participants were no complete outcome data available?
N (%):0/9 |
Mean LTG clearance above non-pregnant baseline: During delivery: 164% First wk postpartum: 218% After third wk postpartum: back to 100% p<0.05
Median ratio LTG-concentration breast milk: LTG-concentration maternal serum: 0.59
(LTG concentration in breast milk decreased after delivery)
Median LTG-concentration in breastfed new-born during first 12 wks postpartum: 2.2µg/ml (median 26% of maternal LTG-concentration)
(slow elimination in neonatal was recorded) |
- Very small study population |
||||
|
Liporace, 2004 |
Type of study: Observational prospective study
Setting: NR
Country: US
Source of funding: NR |
Inclusion criteria: Nursing mothers with epilepsy on lamotrigine (LTG) monotherapy
Exclusion criteria: NR
N: 4
Mean age ± SD: 29 (range 7-24) yr |
Lamotrigine (LTG) monotherapy
Mean doses 338 (range 150-525) mg/day before conception and mean 612 (range 200-1000) mg/day at delivery. Doses were adjusted during pregnancy when clinically indicated based on serum levels or change in seizures. Doses were reduced immediately postpartum and back to prepregnancy within 2 wks.
Concomitant medications included prenatal vitamins and folic acid. |
No control |
Endpoint of follow-up: Primary endpoint: serum LTG levels in nursing mothers and their neonates.
Secondary endpoint: LTG clearance preconception, during pregnancy and postpartum.
Duration of follow-up: Pregnancy till 2 months postpartum
For how many participants were no complete outcome data available?
N (%): 2
Reasons for incomplete outcome data described? Early termination of nursing (n=1), no reason given (n=1) |
Day 10 postpartum LTG serum concentration: Child 1: 1.8 µg/ml (20% of maternal level) Child 2: 1.3 µg/ml (20% of maternal level) Child 3: 2.0 µg/ml (43% of maternal level) Child 4: ˂1 (not measurable)
2 months postpartum LTG serum concentration: Child 1: 1.7 µg/ml (22% of maternal level) Child 2: 1.0 µg/ml (23% of maternal level) Child 3&4: not done
No adverse events reported |
- Measurement methods not defined - Very small study (n=4, with missing data for 2) - Serum concentrations in breast milk are not estimated - The results of the 2 children at 2 months postpartum were probably influenced by partly replacing breast-feeding by formula. |
||||
|
Meador, 2010 |
Type of study: Prospective multicenter observational study
Setting: 25 epilepsy centers
Country: USA & UK
Source of funding: supported by the NIH/NINDS and the UK Epilepsy Research Foundation |
Inclusion criteria: Pregnant women with epilepsy who were on 1 of the 4 AED monotherapies (carbamazepine, lamotrigine, phenytoin or valproate)
Exclusion criteria: Women on other AED (because of insufficient numbers) or on polytherapy, mothers with IQ below 70, mothers with certain diseases or risks.
N: 194 (with 199 children: 5 twins)
Intervention group N:82
Mean age ± SD (of mother): 31 (95%CI 30-32)
Other important characteristics: Use of folate: 56/82 (68%)
Control group N:112
Mean age ± SD (of mother): 30 (95%CI 28-31)
Other important characteristics: Use of folate: 59/112 (53%)
Groups comparable at baseline?: No, significant differences in number of patients, maternal age and use of folate. |
Breastfed children (42%, no differences between AED groups) (definition: currently breastfeeding at 3 month after delivery) |
Non breastfed children (58%) |
Endpoint of follow-up: Effects of breastfeeding during AED therapy on cognitive outcomes (IQ, Differential Ability Scales) of children at the age of 3 yr
Duration of follow-up: 3 yr (follow-up at 3, 26 and 45-month after delivery)
For how many participants were no complete outcome data available?
Intervention N (%): 2/84 children (2%)
Control N (%): 0
Reasons for incomplete outcome data described? 2 children because their mother switched or stopped AED while breastfeeding |
Mean adjusted IQ scores: I: 99 (95%CI 96-103) C: 98 (95%CI 95-101) P= not significant
Secondary analysis mean adjusted IQ scores (intention to treat, including 8 children with missing data on breastfeeding) I: 100 (95%CI 96-103) C: 97 (95%CI 94-100) Missing: 97 (95%CI 92-102) P= not significant
No significant differences in IQ between AED groups were found. |
- Data acquisition between 1999 and 2004 - No randomization to AED, neither to breastfeeding or not
Checklist * Outcome assessors were kept ‘blind’ to participants’ exposure to the intervention |
||||
|
Veiby et al., 2013 |
Type of study: Setting: Country: Source of funding: |
Inclusion criteria: Exclusion criteria: N: 78744 children Intervention group Control group Groups comparable at baseline?: |
All 974 children of mothers or fathers with epilepsy in theMoBa cohort at 6 months formed the epilepsy group. Exposure to antiepileptic drugs during pregnancy was reported in 223 children (44.3%), with the majority as monotherapy (n = 182). The most common monotherapies were lamotrigine (n = 71), carbamazepine (n = 48), and valproate (n = 27). Exposure to polytherapy with antiepileptic drugs was recorded in 41 children (18.4%). |
77 770 children of parents without epilepsy served as the reference group. |
Endpoint of follow-up: Duration of follow-up: For how many participants were no complete outcome data available? Due to both ongoing data collection and loss to followup, the numbers of children of parents with and without epilepsy differ at 6, 18, and 36 months. |
Continuous breastfeeding in children of women using antiepileptic drugs was associated with less impaired development (fine and gross motor skills and social skills) at ages 6 and 18 months compared with those with no breastfeeding or breastfeeding for less than 6 months. |
|||||
|
Meador et al., 2013 |
Type of study: Setting: Country: Source of funding: Because randomization was not performed for breastfeeding and specific AEDs, propensity scores were used to examine negative effects on baseline differences |
Inclusion criteria: Exclusion criteria: N: 177 mothers according to 181 children Intervention group Control group N: 101 Two children with complete data were excluded because their mothers switched AEDs or stopped using AED when breastfeeding. Intention to threat principle was conducted (311 live births, 1 child excluded because of missing data and 2 excluded because mother switched or stopped AEDs) Groups comparable at baseline?: No. Maternal IQ was higher in the breastfed group (105 versus the nonbreastfed group 95), The site (19,7% from United kingdom in the breastfed group versus 33,7% in the no breastfed group. Furthermore, maternal age at delivery was higher in the breastfed group and periconceptional folate use idem. |
Exposure to antiepileptic drugs by breastfeeding was reported in 76 children (42.9%). The mean duration of breastfeeding was 7,2 months. Breastfeeding rates and breastfeeding duration did not differ across AEDs. Dosages did not differ for breastfed versus nonbreastfed group. |
101 children who were nonbreastfed served as the control group. |
Endpoint of follow-up: Duration of follow-up: |
For all AEDs, IQ was higher by 4 points for children who were breastfed versus those who were not (108 versus 104). For the other cognitive domains, only verbal abilities differed across the both groups with a higher score for breastfed children versus nonbreastfed children (105 versus 102 cognitive domain index). |
|||||
Risk of bias tabellen
| Methodology checklist - intervention studies | |||||||||||
| Study reference | There was adequate concealment of allocation | Participants receiving care were kept 'blind' to treatment allocation | Care providers were kept 'blind' to treatment allocation | Outcome assessors were kept 'blind' to participants’ exposure to the intervention | Use of unvalidated or intermediate | Selective outcome reporting on basis of the results | Loss to follow-up/incomplete outcome data described and acceptable | Analysis by intention to treat | Other limitations | Comments | |
| Meador, 2010 | no | no | no | yes | no | no | yes | yes | no |
- Data acquisition between 1999 and 2004 - No randomization to AED, neither to breastfeeding or not
Checklist * Outcome assessors were kept ‘blind’ to participants’ exposure to the intervention |
|
| Veiby et al., 2013 | no | no | no | no | no | no | no | no | no | ||
| Meador et al., 2013 | no | no | no | no | no | no | no | no | no | ||
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-12-2020
Beoordeeld op geldigheid : 30-05-2023
Sinds 2014 wordt eenmaal per jaar een literatuursearch per module uitgevoerd. De clusterleden beoordelen of er in de resultaten van de search artikelen zijn die aanleiding geven om de (aanbevelingen van) de module aan te passen. Tot 2020 werden de geselecteerde artikelen opgenomen in een evidence tabel, en indien door de werkgroep voldoende relevant bevonden, werden de aanbevelingen inhoudelijk aangepast. Sinds 2020 is overgegaan tot modulair onderhoud van richtlijnen binnen clusters (zie: https://richtlijnendatabase.nl/werkwijze.html). Na de literatuurselectie wordt tijdens een vergadering met alle clusterleden de prioritering gemaakt voor de vijf te herziene modules van dat jaar. De herziene modules worden ter commentaar en autorisatie aangeboden aan de betrokken wetenschappelijke verenigingen. Dit is een zich jaarlijks herhalende cyclus.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS) en vanuit EpilepsieNL
De volgende verenigingen en organisaties hebben medewerking verleend aan de totstandkoming van de richtlijn (in alfabetische volgorde):
- EpilepsieNL
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Nederlands Instituut van Psychologen, sectie neuropsychologie (NIP)
- Nederlandse Liga tegen Epilepsie
Doel en doelgroep
Doel
De epilepsiepatiënt in Nederland op eenduidige en wetenschappelijk onderbouwde wijze diagnosticeren en behandelen. Ter ondersteuning van de richtlijngebruiker wordt - daar waar relevant - verwezen naar de module Informatie voor patiënten. De inhoud van de patiënteninformatie valt buiten verantwoordelijkheid van de werkgroep.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Samenstelling werkgroep
Voor het ontwikkelen van de webbased richtlijn is in 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met epilepsie. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de webbased richtlijn die in november 2013 vastgesteld en geautoriseerd werd. De richtlijn wordt vanaf 2013 jaarlijks geactualiseerd. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. Eventuele mutaties in de werkgroepsamenstelling vinden plaats in overleg met de Nederlandse Vereniging voor Neurologie, de werkgroep en de betreffende beroepsvereniging. Nieuwe leden dienen te allen tijden gemandateerd te worden door de betreffende beroepsvereniging. De werkgroep wordt ondersteund door adviseurs van het Kennisinstituut van Medisch Specialisten en door een voorlichter van het EpilepsieNL.
Werkgroep
- Prof. dr. H.J.M. Majoie (voorzitter), neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze en Maastricht
- Dr. C.M. (Carin) Delsman-van Gelder, Kinderarts/kinderneuroloog, Maxima Medisch Centrum, Veldhoven (vanaf 2022)
- Drs. M.H.G. (Marjolein) Dremmen, Radioloog (subspecialisatie kinderneuroradiologie), Erasmus MC, Rotterdam (vanaf 2020)
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Dr. J. Nicolai, kinderneuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Maastricht
- Dr. P. van Vliet, neuroloog/intensivist, Haaglanden Medisch Centrum, Den Haag
- Drs. R. (Roel) van Vugt, Anesthesioloog, Sint Maartenskliniek, Nijmegen (vanaf 2020)
- Dr. A. Altinbas, neuroloog-kinderneuroloog, SEIN /LUMC, Heemstede en Leiden (vanaf 2020)
- Drs. T. Balvers, neuroloog, SEIN/LUMC, Heemstede en Leiden (vanaf 2020)
- Dr. M.A.A.M. de Bruijn, AIOS neurologie, Elisabeth-Tweesteden Ziekenhuis, Tilburg (vanaf 2020)
- Prof. Dr. E.F.I. Comans, nucleair geneeskundige, Amsterdam UMC, Amsterdam (vanaf 2020)
- Dr. T.H.P. Draak, kinderneuroloog/neuroloog, Zuyderland Medisch Centrum, Heerlen en Sittard-Geleen (vanaf 2021)
- Drs. F.M.S. Eshuis, AIOS spoedeisende geneeskunde, Catharina ziekenhuis, Eindhoven (vanaf 2020)
- Dr. F.N.G. Van ’t Hof, neuroloog, SEIN, Heemstede en Amsterdam (vanaf 2020)
- Dr. P.A.M. Hofman, (neuro)radioloog, Maastricht UMC+ en Kempenhaeghe, Heeze en Maastricht
- Dr. D. Ijff, GZ psycholoog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze
- Ir. D. Jenniskens, Community Manager EpilepsieNL, Houten (vanaf 2020)
- Dr. J.A.F. Koekkoek, neuroloog, LUMC, Leiden, en Haaglanden Medisch Centrum, Den Haag
- Dr. R.H.C. Lazeron, neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Heeze
- Dr. M. Mantione, klinisch neuropsycholoog, UMC Utrecht (vanaf 2022)
- Drs. J.B. Masselink, Ziekenhuisapotheker, Medisch Spectrum Twente, Enschede (vanaf 2020)
- G.A.P.G. van Mastrigt, HTA onderzoeker/epidemioloog B, Universiteit Maastricht
- Dr. L. M’Rabet, MT-lid Kennis en Innovatie EpilepsieNL, Houten(vanaf 2022)
- Dr. J.C. Reijneveld, neuroloog en universitair hoofddocent neurologie, SEIN en Amsterdam UMC, Heemstede en Amsterdam (vanaf 2020)
- Drs. H.E. Ronner, neuroloog, AmsterdamUMC loctie VUmc, Amsterdam
- Dr. M.K.M. van Schie, AIOS neurologie, LUMC, Leiden (vanaf 2022)
- Dr. O. Schijns, neurochirurg, Maastricht UMC+, Maastricht (vanaf 2020)
- Dr. F.M. Snoeijen-Schouwenaars, AVG, Centrum voor Epilepsiewoonzorg Kempenhaeghe, Heeze
- Dr. R.D. Thijs, neuroloog, SEIN, Heemstede en LUMC, Leiden
- Dr. N. Tolboom, nucleair geneeskundige, UMC Utrecht, Utrecht (vanaf 2020)
- Dr. S.O. Tousseyn, neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Heeze
- Drs. J. H. van Tuijl, neuroloog, Elisabeth-TweeSteden ziekenhuis, Tilburg
- Dr. A. Uiterwijk, neuroloog, Academisch Centrum voor Epileptologie, Kempenhaeghe/Maastricht UMC+, Heeze
- Dr. N.E. Verbeek, klinisch geneticus, UMC Utrecht, Utrecht
- Dr. M. Vlooswijk, neuroloog, Maastricht UMC+, Maastricht (vanaf 2020)
- Dr. I. Wegner, neuroloog, SEIN, Zwolle en Leeuwarden
Werkgroepleden tot 2020/2021:
- P.B. Augustijn, kinderneuroloog, SEIN, Heemstede (tot 2020)
- Dr. C.A. van Donselaar, neuroloog, Maasstad Ziekenhuis, Rotterdam en Kempenhaeghe, Heeze (tot 2020)
- Dr. G.J. de Haan, neuroloog, SEIN, Heemstede (plaatsvervangend voorzitter, tot 2020)
- M.C. Hoeberigs, neuroradioloog, Maastricht UMC+ en Kempenhaeghe, Heeze (tot 2020)
- Dr. F. Leijten, neuroloog, UMC Utrecht, Utrecht (tot 2021)
- Em. prof. dr. D. Lindhout, klinisch geneticus, kinderarts niet praktiserend, UMC Utrecht en SEIN, Heemstede (tot 2020)
- Dr. W. van der Meij, neuroloog, Haaglanden Medisch Centrum, Den Haag (tot 2020)
- Dr. B. Panis, kinderneuroloog, Maastricht UMC+, Maastricht (tot 2021)
Met ondersteuning van
- I. Gijselhart, bibliothecaresse, Kempenhaeghe Heeze
- L. Linssen, secretaresse opleidingen medisch specialisten, Kempenhaeghe Heeze
- Dr. J. Buddeke, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf 2020)
- Dr. M.M.J. van Rooijen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf 2022)
Belangenverklaringen
Werkgroepleden verklaren schriftelijk of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn.
|
Werkgroeplid |
Belangen |
Zo ja, welke |
Jaar ingevuld |
|
Aldenkamp, dhr. |
Ja |
Deelname aan Wetenschappelijke |
2015 |
|
Augustijn, dhr. |
Ja |
Bestuurslid en regelmatig docent |
2015, herzien 2017 |
|
Beumer, mw. D. |
Nee |
|
2017 |
|
Bruijn, mw. M. de |
|
Coördinator van de ACES studie (antibodies causing epilepsy syndromes): nationale multicenterstudie waarvoor een beurs ontvangen van het Nationaal epilepsie Fonds (principal investigator: dr. M.J. Titulaer, euroloog, Erasmus MC). |
2017 |
|
Donselaar, dhr. dr. |
Ja |
Bestuurslid Stichting Epilepsie Onderwijs Nederland, onbetaald Lid Richtlijnen Commissie Diagnostiek en behandeling van Epilepsie (NVN, vergoeding) Lid Commissie Wetenschap Beter Keten (samenwerkingsverband Erasmus MC, Fransciscus Vlietland Groep, Maasstad Ziekenhuis, onbetaald) Aandelen UCB |
2015 |
|
Gijselhart, mw. I. |
|
|
|
|
Haan, dhr. dr. |
Ja |
Staflid neurologie Erasmus MC Rotterdam Begeleiden aios-en Cursorisch onderwijs (onbetaald) Eindredacteur vakblad Epilepsie Ex- voorzitter Liga tegen Epilepsie Adviseur EVN, EpilepsieNL |
2015, herzien 2017 |
|
Hofman, dhr. Dr. |
Nee |
|
2015, herzien 2017 |
|
Kolk, mw. N. van |
|
Gastdocent Radboud Health Academy (neurologie verpleegkunde), betaald |
2017 |
|
Kolsteren, mw. E. |
Nee |
|
2015, herzien 2017 |
|
Lazeron, dr. R.H.C. |
Ja |
Ontwikkeling nachtelijk aanvalsdetectie en - alarmeringssysteem, gefinancierd door ZonMW, Nuts-Ohra fonds, EpilepsieNL, met deelname van een hiertoe opgerichte onderneming LivAssured, met hulp van de firma ImplementationIQ en met participatie van investeringsfondsen in de gezondheidszorg. Geen direct of persoonlijk financieel belang in LivAssured, ImplementationIQ of de investeringsfondsen. |
2017 |
|
Leijten, dr. F.S.S. |
Ja |
Aandelen ProLira, een start-up bedrijf dat een deliriummonitor ontwikkelt. Ontwikkeling nachtelijk aanvalsdetectie en - alarmeringssysteem, gefinancierd door ZonMW, Nuts-Ohra fonds, EpilepsieNL, met deelname van hiertoe opgerichte onderneming LivAssured met hulp van de firma ImplementationIQ en met participatie van investeringsfondsen in de gezondheidszorg. Geen direct of persoonlijk financieel belang in LivAssured, ImplementationIQ of investeringsfondsen. |
2017 |
|
Lindhout, dhr. |
Ja |
Lid Gezondheidsraad (onbetaald) Lid vaste commissie Reproductie toxische stoffen van de Gezondheidsraad (vacatiegeld) Lid ad hoc commissies Gezondheidsraad (vacatiegeld) Lid Wetenschappelijke adviesraad Lareb (vacatiegeld) Lid Wetenschappelijk adviesraad Stichting Michelle (onbetaald) Lid Medische adviesraad STSN (onbetaald) |
2015 |
|
Majoie, mw. |
Ja |
Relevante commissies: |
2017 |
|
Mastrigt, mw. G. |
|
Onderzoeker/docent Universiteit Maastricht (0,1 fte) |
2017 |
|
Nicolai, dr. J. |
Ja |
Vanuit MUMC+ gedetacheerd in St. Jansgasthuis Weert, Elkerklierk Helmond en Kempenhaeghe Heeze (in dienst MUMC+) |
2017 |
|
Panis, mw. dr. P. |
Nee |
|
2017 |
|
Pols, mw. dr. M. |
|
|
|
|
Roelfsema, dr. V |
Nee |
|
2015, herzien 2017 |
|
Tuijl, mw. J.H. van |
Ja |
Lid werkgroep richtlijn Epilepsie (onbetaald) |
2015, herzien 2017 |
|
Uiterwijk, mw. A. |
Nee |
|
2017 |
|
Veendrick, mw. |
Nee |
|
2015 |
|
Venhorst, mw. K. |
|
|
|
|
Vliet, dhr. P. van |
Nee |
|
2015, herzien 2017 |
|
Wardt, dhr. J. van |
Nee |
|
2017 |
|
Wegner, mw. dr. I |
Ja |
Houden van wetenschappelijke voordrachten, voor een deel onbetaald, maar er zijn ook enkele voordrachten waarvoor de werkgever (SEIN) een financiële bijdrage heeft ontvangen van de firma UCB als vergoeding voor gemaakte uren. Dit alles volgens de officieel hiervoor geldende wet- en regelgeving. |
? |
|
Wijnen, dhr. B. |
|
|
|
|
Zijlmans, mw. |
Ja |
Commissielid communications committee international league against epilepsy (onbetaald) |
2015, herzien 2017 |
Inbreng patiëntenperspectief
Er wordt aandacht besteed aan het patiëntenperspectief door het betrekken van de Epilepsievereniging Nederland in commentaarfases. Bij de richtlijn is een module met patiëntinformatie ontwikkeld. Deze is geautoriseerd door de Epilepsie Vereniging Nederland en de Nederlandse Vereniging voor Neurologie.
Methode ontwikkeling
Evidence based
Werkwijze
Algemeen
AGREE
Deze richtlijn is opgesteld en wordt bijgehouden conform de eisen in het rapport ‘Richtlijnen 2.0’ van de adviescommissie Richtlijnen van de Raad WOK. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/). Dit is een internationaal breed geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Uitgangsvragen en uitkomstmaten
Op basis van de lijst met onderwerpen stellen de werkgroepleden en de adviseur concept-uitgangsvragen op. Deze worden met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen vaststelt. Vervolgens inventariseert de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn. Hierbij wordt zowel naar gewenste als ongewenste effecten gekeken. De werkgroep waardeert deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieert de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vindt, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er wordt eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews in PubMed en voor specifieke onderwerpen in the Cochrane Library, Embase en Psychinfo. Vervolgens wordt voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens wordt aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie wordt gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteren de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen worden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden onder ‘zoekstrategie’ van de desbetreffende uitgangsvraag.
Voor een aantal vragen is de recente Engelse evidence based richtlijn ‘The epilepsies’ van het NICE (National Institute of Clinical Excellence) als basis gebruikt.
Kwaliteitsbeoordeling individuele studies
Individuele studies worden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de evidence tabel.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen worden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur worden beschreven in de samenvatting van de literatuur. Bij een aantal interventievragen worden bij voldoende overeenkomsten tussen de studies de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen
De kracht van het wetenschappelijke bewijs wordt bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/) (Atkins et al, 2004) (zie tabel 1).
Tabel 1. GRADE-indeling van kwaliteit van studies per uitkomstmaat
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
1. Studiebeperkingen 2. Inconsistentie 3.Indirectheid 4. Imprecisie 5. Publicatiebias |
1. Groot effect 2. Dosis-respons relatie 3. Plausibele confounding |
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkende studie (bijvoorbeeld: patëntencontrole onderzoek, cohortonderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (bijvoorbeeld: case series of case reports) |
||
|
RCTs beginnen 'hoog'(4), observationele studies beginnen 'laag'(2) |
|||
Formuleren van conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose wordt het wetenschappelijke bewijs samengevat in één of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt de conclusie getrokken op basis van alle studies samen (body of evidence). Hierbij maken de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans worden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Voor een conclusie die gebaseerd is op (een) studie(s) die niet uit een systematisch literatuuronderzoek naar voren is/zijn gekomen, wordt geen niveau van bewijskracht bepaald. In een dergelijk geval staat bij de conclusie "geen beoordeling" vermeld.
Tabel 2. Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggend bewijs
|
Niveau |
Conclusie gebaseerd op |
|
Hoog |
Onderzoek van niveau A1 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken |
|
Matig |
één onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
Laag |
één onderzoek van niveau B of C |
|
Zeer laag |
Mening van deskundigen |
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn wordt expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn zijn er interne en externe kwaliteitsindicatoren ontwikkeld. Het doel van de indicatoren is om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroepleden is gevraagd om bestaande indicatoren en indicatoren gebaseerd op aanbevelingen uit de richtlijn te scoren op relevantie en registreerbaarheid. De indicatoren die het hoogst scoorden, zijn in de (concept)richtlijn opgenomen. Een overzicht treft u aan in de bijlage Indicatoren. De indicatoren zijn ook terug te vinden bij de betreffende uitgangsvraag.
Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Lacunes in kennis
De zorg voor patiënten met epilepsie kent nog veel aspecten waarover onzekerheid bestaat wat als optimaal kan worden aangewezen. In vrijwel alle modules van de richtlijn ‘Epilepsie’ zijn lacunes in kennis te onderkennen. Het is daarom zeer gewenst dat er verder wetenschappelijk onderzoek plaatsvindt naar de zorg voor patiënten met epilepsie. De werkgroep inventariseert de lacunes in kennis breed en heeft een aantal onderwerpen benoemd waarvan zij van mening is dat onderzoek hiernaar prioriteit verdient. Een overzicht treft u aan in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De richtlijn is in 2013 aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Vanaf 2013 wordt de richtlijn jaarlijks geactualiseerd (zie onder Herziening). De werkgroep doet aan het einde van het jaar een voorstel met welke modules zij denkt dat een commentaarronde nodig is aan de commissie Kwaliteit/subcommissie Richtlijnen van de Nederlandse Vereniging voor Neurologie (NVN). Hierbij is het uitgangspunt dat alleen die wijzigingen die eventueel tot discussie binnen de diverse beroepsgroepen kunnen leiden ter commentaar en tevens ter autorisatie voorgelegd worden. Alle andere wijzigingen worden doorgevoerd onder eigen verantwoordelijkheid van de werkgroep. De subcommissie Richtlijnen van de NVN beslist uiteindelijk welke modules aan de betrokken beroepsverenigingen worden voorgelegd. Voor die modules wordt eerst een commentaarfase gestart. Al het commentaar dat digitaal binnenkomt wordt gebundeld en in de werkgroep besproken en eventueel verwerkt in de richtlijnmodule. Vervolgens worden de aangepaste modules van de richtlijn voor autorisatie aangeboden. Bij akkoord van de beroepsverenigingen worden de geactualiseerde teksten definitief gepubliceerd op de website. De beroepsverenigingen worden hiervan op de hoogte gebracht.
Nieuwe uitgangsvragen
Als gebruikers van de richtlijn een belangrijk onderwerpen missen, kunnen zij een suggestie voor een nieuwe uitgangsvraag aanleveren bij de werkgroep (met motivering). De werkgroep zal jaarlijks de ontvangen suggesties bespreken en besluiten welke vragen opgenomen worden in de richtlijn.
Economische evaluaties
Doelmatigheid van behandeling
Sinds mei 2016 wordt aan de richtlijn ook kennis over de doelmatigheid (kosteneffectiviteit) van de epilepsiebehandeling meegenomen, ook wel economische evaluatie genoemd. Om deze kennis te verkrijgen is een systematische literatuur studie uitgevoerd (Wijnen et al., 2017, Wijnen et al., 2015). De gebruikte methodologie om de economische evaluaties in te bouwen in klinische richtlijnen is beschreven in een drietal papers (Wijnen et al., 2016, Mastrigt van et al., 2016, Thielen et al., 2016).
Databases
In MEDLINE (via PubMed), EMBASE en NHS economische evaluatie Database (NHS EED) is gezocht op kosteneffectiviteitsstudies. Voor bestaande systematische reviews, werden Cochrane Reviews, Cochrane DARE en Cochrane Health Technology Assessment Databases gebruikt.
Zoekstrategieën
Voor de identificatie van relevante studies zijn vooraf gedefinieerde klinische zoekstrategieën gecombineerd met een gevalideerd zoekfilter van McMaster University om economische evaluaties te identificeren (McMaster). Bij de zoekstrategieën hebben we ons beperkt tot therapeutische interventies.
Beoordeling van de studies
Om te beoordelen of de economische evaluaties kunnen worden opgenomen in de richtlijn is iedere gevonden studie beoordeeld aan de hand van zeven vragen. In deze pdf is de uitwerking van de verschillende vragen te vinden. Deze vragen zijn gebaseerd op de Consensus on Health Economics Criteria checklist (Evers et al., 2005) en de Welte transferability checklist (Welte et al., 2004).
Referenties
- Atkins, D., Best, D., Briss, P.A., Eccles, M., Falck-Ytter, Y., Flottorp, S., Guyatt, G.H., Harbour, R.T., Haugh, M.C., Henry, D., Hill, S., Jaeschke, R., Leng, G., Liberati, A., Magrini, N., Mason, J., Middleton, P., Mrukowicz, J., O’Connell, D., Oxman, A.D., Phillips, B., Schünemann, H.J., Edejer, T.T., Varonen, H., Vist, G.E., Williams, J.W. Jr, Zaza, S. GRADE Working Group. (2004). Grading quality of evidence and strength of recommendations. BMJ Jun; 19, 328(7454):1490.
- van Everdingen, J.J.E., Burgers, J.S., Assendelft, W.J.J., Swinkels, J.A., van Barneveld, T.A., van de Klundert, J.L.M. (2004). Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum.
- Evers, S., Goossens, M., De Vet, H., Van Tulder, M., Ament, A. (2005). Criteria list for assessment of methodological quality of economic evaluations: Consensus on Health Economic Criteria. International journal of technology assessment in health care. 21(02):240-245.
- van Mastrigt, G. A., Hiligsmann, M., Arts, J. J., Broos, P. H., Kleijnen, J., Evers, S. M., & Majoie, M. H. (2016). How to prepare a systematic review of economic evaluations for informing evidence-based healthcare decisions: a five-step approach (part 1/3). Expert Rev Pharmacoecon Outcomes Res (Nov 2), 1-16. doi: 10.1080/14737167.2016.1246960.
- McMaster University. (2016, Feb 09). Search Strategies for EMBASE in Ovid Syntax, from http://hiru.mcmaster.ca/hiru/HIRU_Hedges_EMBASE_Strategies.aspx.
- Thielen, F. W., Van Mastrigt, G., Burgers, L. T., Bramer, W. M., Majoie, H., Evers, S., & Kleijnen, J. (2016). How to prepare a systematic review of economic evaluations for clinical practice guidelines: database selection and search strategy development (part 2/3). Expert Rev Pharmacoecon Outcomes Res (Nov 2), 1-17. doi: 10.1080/14737167.2016.1246962.
- Welte, R., Feenstra, T., Jager, H., & Leidl, R. (2004). A decision chart for assessing and improving the transferability of economic evaluation results between countries. Pharmacoeconomics, 22(13), 857-876.
- Wijnen, B., van Mastrigt, G., Evers, G., Gershuni, O., Lambrechts, D., Majoie, H., & De Kinderen, R. (2015). Review of economic evaluations of treatments for patients with epilepsy. Prospero: International prospective register of systematic reviews. Retrieved from http://www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD42015019278.
- Wijnen, B., van Mastrigt, G., Redekop, W. K., Majoie, H., de Kinderen, R., & Evers, S. (2016). How to prepare a systematic review of economic evaluations for informing evidence-based healthcare decisions: data extraction, risk of bias, and transferability (Part 3/3). Expert Rev Pharmacoecon Outcomes Res (Oct 21). doi: 10.1080/14737167.2016.1246961.
- Wijnen, B. F., van Mastrigt, G. A., Evers, S. M., Gershuni, O., Lambrechts, D. A., Majoie, M. H., . . . de Kinderen, R. J. (2017). A systematic review of economic evaluations of treatments for patients with epilepsy. Epilepsia. doi: 10.1111/epi.13655.