Preventie van het ontwikkelen van epilepsie na een beroerte
Uitgangsvraag
Wat is het effect van een tijdelijke profylactische behandeling bij mensen met een beroerte op het voorkómen van het ontwikkelen van epilepsie?
Aanbeveling
Behandel patiënten met een herseninfarct of intracerebrale bloeding niet profylactisch met anti-aanvalsmedicatie gedurende een korte periode om het ontwikkelen van epilepsie na een beroerte te voorkomen.
Behandel ook niet profylactisch met een statine om epilepsie na een herseninfarct of intracerebrale bloeding te voorkomen.
Overwegingen
Balans tussen gewenste en ongewenste effecten
Het doel van deze uitgangsvraag was om te achterhalen wat het effect was van een kortdurende profylactische behandeling met anti-aanvalsmedicatie bij mensen met een beroerte in het voorkomen van het ontwikkelen van epilepsie. Daarbij werd ook gekeken naar het effect van deze profylactische behandeling op functionele uitkomst, mortaliteit en risico op het ontwikkelen van een pneumonie. Uit de systematische search zijn uiteindelijk 15 studies gevonden waarvan 3 RCTs en 12 observationele studies.
Epileptische aanvallen:
Tien studies, waarvan 3 RCTs, rapporteerden data m.b.t. de cruciale uitkomstmaat het optreden van epileptische aanvallen. Zij vergeleken de effectiviteit van profylactische medicatie met placebo bij patienten met een intracerebrale bloeding (ICH), dan wel een herseninfarct. Er is weinig tot geen bewijs voor de effectiviteit van profylaxe, de bewijskracht voor de kritieke uitkomstmaat epileptische aanvallen was laag. De gevonden studies toonden wel een lagere kans op epileptische aanvallen van profylaxe t.o.v. de placebo groep tijdens de follow-up periode, waarbij het effect het grootst was binnen de eerste week na de intracerebrale bloeding. De bewijskracht hiervoor was laag.
Functionele uitkomst, mortaliteit en pneumonie:
Daarnaast werden er andere belangrijke uitkomstmaten onderzocht. Zeven studies rapporteerden data over de vergelijking in functionele uitkomst na een intracerebrale bloeding tussen ASM profylaxe en placebo. Eén RCT vond een positief effect van ASM-profylaxe op functionele uitkomst (gemeten met de NIHSS schaal), en 6 observationele studies toonden overall een, klinisch relevante, slechtere functionele uitkomst bij gebruik van ASM-profylaxe vergeleken met placebo.
Daarnaast rapporteerden 6 studies (3 RCTs en 3 observationele studies) data over de vergelijking in mortaliteit tussen profylaxe en placebo na een intracerebrale bloeding of herseninfarct. Er werd geen klinisch relevant noch significant verschil gevonden tussen beide groepen in mortaliteit, met grote variatie in effect onderling. En twee RCTs rapporteerden daarnaast data over verschillen in het voorkomen van pneumonie tussen de profylaxe en placebo. Ook hier werd geen duidelijk klinisch relevant noch significant verschil gevonden. Noch kon met zekerheid gesteld worden dat deze effecten konden worden toegeschreven aan de toegediende behandelvorm (profylaxe of placebo). Voor al deze uitkomstmaten (slechte functionele uitkomt, mortaliteit of pneumonie) geldt dat er weinig tot geen bewijs is voor de effectiviteit van profylaxe dan wel placebo. De bewijskracht voor deze belangrijke uitkomstmaten was zeer laag.
In de klinische praktijk wordt er in Nederland bij patienten die een herseninfarct of hersenbloeding hebben doorgemaakt niet of zelden gestart met anti-aanvalsmedicatie om het ontwikkelen van epilepsie te voorkomen. Alleen voor levetiracetam en diazepam is er beperkt bewijs dat een kortdurende profylactische behandeling het opstaan van epilepsie kan voorkomen. Echter, de bijwerkingen die tijdens de behandeling met deze medicatie kunnen optreden vormen een belangrijk nadeel.
Statines worden zeer vaak gestart na het doormaken van een herseninfarct. Echter het doel van deze behandeling is dan het verlagen van het LDL-cholesterol om daarmee het risico op een recidief TIA of herseninfarct te verlagen.
Kwaliteit van bewijs
De overall kwaliteit van bewijs is laag tot zeer laag. Dit betekent dat we (zeer) onzeker zijn over het gevonden geschatte effect van de cruciale uitkomstmaat epileptische aanvallen als ook over de belangrijke uitkomstmaten functionele uitkomst, mortaliteit en bijwerkingen, bij de vergelijking tussen profylaxe en placebo. Er is afgewaardeerd vanwege:
- Risk of bias: methodologische beperkingen voornamelijk m.b.t. blindering van de toewijzing van de profylaxe of placebo (dan wel meting van exposure en outcome en mogelijke loss to follow up).
- Imprecisie: onnauwkeurigheid, omdat het betrouwbaarheidsinterval de grens (beide grenzen) van klinische relevantie overschrijdt.
- Inconsistentie: inconsistentie van de resultaten door heterogeniteit in effectschatting.
Waarden en voorkeuren van patiënten (en eventueel hun naasten/verzorgers)
Het bespreken van een verhoogd risico op epilepsie na het doormaken van een beroerte kan een extra belasting vormen voor patienten die zich reeds in een kwetsbare situatie bevinden na het doormaken van een beroerte.
Gewenste effecten
Bij het opstarten van profylactische medicatie ter voorkoming van het ontwikkelen van epilepsie na een beroerte dienen de gewenste effecten (het voorkomen van het ontwikkelen van epilepsie) te worden afgewogen tegen de ongewenste effecten, zoals bijwerkingen, polyfarmacie en interacties van medicatie.
Kostenaspecten
Profylactisch behandelen van patienten na een beroerte zal leiden tot kosten van de medicatie zelf, maar mogelijk ook van eventuele bijwerkingen en complicaties.
Gelijkheid ((health) equity/equitable)
Er is geen reden om aan te nemen dat het wel of niet toedienen van profylaxe gerelateerd is aan gezondheisongelijkheid.
Aanvaardbaarheid:
Het is ethisch bezwaarlijk om profylaxe toe te dienen ter voorkoming van epileptische aanvallen na een beroerte als er geen bewijs is dat dit effectief is. Het is vanuit duurzaamheidsoogpunt ook bezwaarlijk om medicatie te fabriceren, verpakken en transporteren die niet effectief is.De keuze om geen profylaxe te adviseren is derhalve aanvaardbaar.
Haalbaarheid
Niet profylactisch behandelen van patienten na een beroerte lijkt haalbaar want deze vereist geen nieuwe manier van zorgverlening, dit is namelijk wel conform standaardzorg in de praktijk. De werkgroep voorziet geen belemmeringen rondom praktische, technische, juridische en logistieke aspecten, als ook organisatorische of financiële aspecten, professionele interacties, dan wel personele capaciteit aangezien additionele (profylactische) behandeling juist wordt ontraden.
Rationale van de aanbeveling
Anti-aanvalsmedicatie
De beschikbare studies over het gebruik van anti-aanvalsmedicatie bij patiënten met een intracerebrale bloeding of herseninfarct geven geen eenduidige resultaten. Dit is mogelijk te verklaren door de verschillende typen anti-aanvalsmedicatie en variatie in duur van het gebruik van deze medicatie als profylaxe, als ook in duur van de follow-up.
Mogelijk zijn de verschillen in gevonden effect ook verklaarbaar door eventuele bias m.b.t. de keuzes voor het voorschrijven van de anti-aanvalsmedicatie aan verschillende patiënten(groepen) in observationele studies. Vooralsnog is de werkgroep van mening dat er onvoldoende bewijs is voor de effectiviteit van profylactische anti-aanvalsmedicatie bij een intracerebrale bloeding of herseninfarct. Gezien de potentiële schadelijke effecten van het profylactisch gebruik van anti-aanvalsmedicatie in de acute fase na een intracerebrale bloeding of herseninfarct moet hiervan worden afgezien.
Statines
De beschikbare studies over het gebruik van statines na een beroerte geven tegenstrijdige resultaten. Enkele grote retrospectieve observationele cohortstudies tonen een verlaagde incidentie van epilepsie bij het gebruik van statines (Lin FJ, 2018; Lin HW 2018). Er mist echter belangrijke informatie over de invloed van de ernst van de beroerte op de resultaten.
Bovendien lijken de populaties mogelijk niet goed op de Nederlandse. In de grootste Taiwanese studie met ruim 20.000 mensen, waarin een positief effect werd gevonden van statines, gebruikte slechts 25% na een beroerte een statine (Lin FJ, 2018). Exacte cijfers voor het gebruik van statines na een beroerte in Nederland ontbreken, maar naar schatting liggen de cijfers voor het gebruik van statines in Nederland veel hoger mede doordat de richtlijn herseninfarct en hersenbloeding aanbeveelt om patiënten na een TIA of herseninfarct te behandelen met cholesterolverlagende therapie (statines) ter reductie van ernstige cardiovasculaire gebeurtenissen, tenzij uitsluitend een andere oorzaak dan atherosclerose is aangetoond (Cholesterolverlagers na herseninfarct).
Andere grote studies (met samen ruim 20.000 mensen) tonen geen effect (Guo, 2015; Hsieh, 2020). Ook hier is het onduidelijk of de studies vergelijkbaar zijn met de Nederlandse populatie. Er zijn geen prospectieve, gerandomiseerde studies naar het effect van statines op voorkomen van epileptische aanvallen na een hersenbloeding of infarct. Deze studies zullen er voor herseninfarcten ook niet komen. Immers, na een herseninfarct bestaat er meestal al een indicatie voor cholesterolverlagende therapie.
Al met al is het onvoldoende systematisch uitgezocht, maar bestaat er op basis van de bewijskracht uit de huidige wetenschappelijke literatuur geen aanleiding om statines als profylaxe van epilepsie te gaan voorschrijven.
Eindoordeel:
Sterke aanbeveling tegen (Niet doen).
Onderbouwing
Achtergrond
One or more epileptic seizures may occur after stroke. Early epileptic seizures occur within one week after stroke. Late epileptic seizures occur more than one week after stroke, and because of the high risk of recurrent seizures may result in a diagnosis of epilepsy. It is still unclear whether stroke patients should be treated prophylactic with anti-seizure medication or statins to prevent the development of epilepsy. Furthermore, it is unclear if the risks and advice on prophylactic treatment should be different for patients with ischemic or hemorrhagic strokes. The aim was to update the existing guideline based on new evidence.
Conclusies / Summary of Findings
Table 2. Summary of findings table including GRADE
|
Outcome |
Study results and measurements |
Absolute effect estimates* |
Certainty of evidence (GRADE) |
Conclusions |
|
|
prophylaxis |
placebo |
||||
|
Seizure occurrence (crucial)
|
OR 0,50 (95% CI: 0.26 to 0.97)
Based on data from 898 participants in 3 RCTs
|
35 per 1000 |
68 per 1000 |
Low
Due to potential risk of bias, due to imprecision1 |
Prophylaxis may result in little to no difference in seizure occurrence when compared with placebo in patients with intracerebral hemorrhage or schemic stroke
Gilad, 2011; Peter Derex, 2022; Van Tuijl 2021 |
|
Difference 33 less per 1000 (95% CI: 49 less to 2 less |
|||||
|
(poor) Functional outcome (important)
|
OR 1.48 (95% CI: 1.11 to 1.99)
Based on data from 3591 participants in 6 studies
Poor functional outcome was measured by mRS with cut-off values as presented in individual studies |
602 per 1000 |
506 per 1000 |
Very low
Due to potential risk of bias and due to imprecision3 |
The evidence is very uncertain about the effect prophylactic ASM on functional outcome when compared with placebo in patients with intracerebral hemorrhage.
Christie, 2020; Mackey, 2017; Messe, 2009; Savalia, 2022; Sheth, 2015; Zandieh, 2016 |
|
Difference 96 more per 1000 (95% CI: 26 more - 165 more) |
|||||
|
Mortality (important)
|
OR 0.92 (95% CI: 0.67 to 1.28)
Based on data from 3551 participants in 7 studies
|
291 per 1000 |
309 per 1000 |
Very low
Due to potential risk of bias, due to inconsistency, due to serious imprecision2 |
The evidence is very uncertain about the effect of prophylaxis on mortality when compared with placebo in patients with intracerebral hemorrhage or ischemic stroke.
Battey, 2012; Gilad, 2011; Mackey, 2017; Peter Derex, 2022; Reddig, 2011; Van Tuijl, 2021; Zandieh, 2016 |
|
Difference 18 less per 1000 (95% CI: 79 less – 55 more) |
|||||
|
Adverse events: Pneumonia (important) |
Based on data from 2studies (RCTs) including 832 participants |
Peter Derex 2022 reported pneumonia in 2 out of 23 patients on LEV and in 2 out of 25 patients on placebo. Van Tuijl 2021 reported pneumonia in 53/389 patients on diazepam and 60/395 patients administered a placebo. |
Very low
Due to potential risk of bias and due to serious imprecision4
|
The evidence is very uncertain about the effect of prophylaxis on pneumonia when compared with placebo in patients with intracerebral hemorrhage or ischemic stroke.
Peter Derex 2022; Van Tuijl 2021 |
|
|
Difference 14 less per 1000 (95% CI: 54 less – 37 more) |
|||||
Reasons for downgrading certainty of evidence (RCTs start at high GRADE and observational studies start at moderate GRADE)
1. RCTs downgraded for potential RoB due to lack of complete blinding and allocation concealment (-1 level) and imprecision due to overlap of the 95% CI with the minimal clinically important difference, i.e. boundary of CI includes possibility of benefit or harm (-1 level)
2. Observational studies (with or without RCTs) downgraded for potential RoB due to lack of allocation concealment, potential bias in exposure and outcome assessment or loss to follow up (-1 level), inconsistency; large heterogeneity in presented results with no overlap in confidence intervals (-1 level), and serious imprecision due to overlap of the 95% CI with minimal clinically important difference i.e. boundary of CI includes possibility of benefit or harm and no effect (-2 levels)
3. Observational studies (downgraded for potential RoB due to potential bias in exposure and outcome assessment or loss to follow up (-1 level), and imprecision due to overlap of the 95% CI with minimal clinically important difference, i.e. boundary of CI includes possibility of benefit or harm (-1 level)
4. RCTs downgraded for potential RoB due to lack of complete blinding and allocation concealment (-1 level) and serious imprecision due to overlap of the 95% CI with the minimal clinically important difference, i.e. boundary of CI includes possibility of benefit or harm and no effect (-2 levels)
Samenvatting literatuur
Description of studies
A total of 2 systematic reviews were included in the analysis of the literature.
Mota Telles (2023) performed a systematic review and meta-analysis to assess whether prophylactic anti-seizure medication reduced seizure occurrence and improved functional outcomes (modified Rankin scales (mRS) or other neurological functional scales) in patients with spontaneous intracerebral hemorrhage (sICH). A systematic literature search was performed until 12 august 2022. Studies were included if they 1) included patients with spontaneous nontraumatic intracerebral hemorrhage, 2) patients were treated with prophylactic ASM, 3) compared prophylactic ASM to placebo or no comparison, 4) reported on seizure occurrence or functional outcomes and 5) had a RCT, nonrandomized trial or observational study design. Furthermore, studies including other types of strokes, detailing outcomes of interest for patients with sICH were also included.
Studies were excluded if they 1) analyzed other types of strokes or surgical patients, 2) treatment with ASM after documented seizure, 3) used benzodiazepines, 4) included only pediatric patients (<18 years) or studies in animals or 5) were reviews, letters or commentaries. In total 14 studies comprising 6742 patients were included in their analysis. A total of 2 RCTs (Gilad, 2011; Peter Derex, 2022), 5 prospective studies (Naidech, 2009; Naidech, 2018; Passero, 2002; Savalia, 2022; Sheth, 2015) and 7 retrospective studies (Battey, 2012; Christie, 2020; Mackey, 2017; Messe, 2009; Reddig, 2011; Woo, 2012; Zandieh, 2016). Mean patient age ranged from 60-73 years and women accounted for 32-52% of individual series. None of the studies reported on ischemic stroke, all were on patients with ICH (intracerebral hemorrhage). As it was not feasible to extract numbers and details for all outcome measures from Mota Telles (2023), we extracted the data from all (14) individual studies included in these two reviews.
Chang (2022) performed a Cochrane review to assess the effects of anti-seizure medication for the primary and secondary prevention (i.e. seizure occurrence in people without having had a seizure or after at least one post-stroke seizure respectively) of seizures after stroke. A systematic literature search was performed until 9 March 2021. They included a total of 2 RCTs comprising 856 patients for their analysis (Gilad, 2011; van Tuijl, 2021). As the study by Gilad (2011) was already included, only the study by van Tuijl (2021) was added to our results and analysis. This study was based on data from the EGASIS trial; a RCT on the neuroprotective property and safety of diazepam after acute ischemic or hemorrhagic stroke. Patients were included within 12h after stroke onset with their diagnosis confirmed within 7days by CT/MRI. Patients were excluded in case of a clear indication/ contra indication to benzodiazepines, unresponsive coma, total functional dependence before stroke or participation in another neuroprotection trial. They included 784 patients and assessed the occurrence of seizures and vital status and reported on complications as pneumonia.
Important study characteristics and results of included studies are summarized in table 1. The assessment of the risk of bias is summarized in the risk of bias tables (under the tab ‘Evidence tabellen’).
Table 1. Characteristics of included studies
*For further details, see risk of bias table in the appendix, including RoB per outcome measure
Results
Results are described per outcome measure. All results are summarized and presented in the Summary of Findings table, including the level of evidence, using GRADE (table 2 Summery of findings table including GRADE).
Seizure occurrence (crucial)
From ten studies data could be extracted to assess the effect of (ASM) prophylaxis on the occurrence of seizures (Gilad, 2011; Peter Derex, 2022; van Tuijl, 2021; Christie, 2020; Messe, 2009; Naidech, 2018; Passero, 2002; Reddig, 2011; Savalia, 2022 and Zandieh, 2016).
Studies varied in duration of follow up (from discharge up to 3 months).
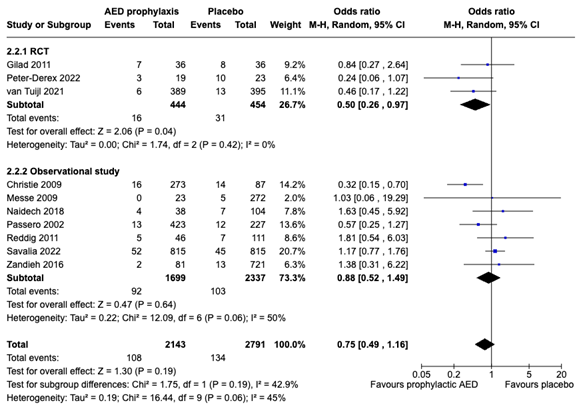
Pooled analysis included 2143 patients receiving prophylaxis (mainly LEV, PHT and VPA) and 2791 patients receiving placebo or no treatment. Seizures occurred in 108 of the 2143 patients on prophylaxis (5%) and in 134 of the 2791 patients in the placebo group (4,8%). The overall pooled OR was 0,75 (95% CI: 0,49 to 1,16) in favor of the prophylactic group, though individual study results varied largely.
A subgroup analysis was performed to compare differences in study designs. Both RCTs as well as observational studies presented an OR in favor of the prophylactic group.
For the RCTs the pooled OR was 0,50 (08% CI: 0,26 to 0,97), i.e. clinically relevant demonstrating a larger beneficial effect form prophylactic treatment on seizure occurrence compared to the observational studies. Results are summarized in a forest plot (Figure 1).
Figure 1. Forest plot seizure occurrence stratified per type of study design
Furthermore, as studies presented differences in follow up duration an additional subgroup analysis was performed between studies that reported the occurrence of seizures within the first 3 days of ICH (intracerebral hemorrhage) and studies that assessed seizure occurrence in a follow up period from 7 days to 3 months. The pooled OR resulting from the 5 studies (Christie, 2020; Messe, 2009; Naidech, 2018; Peter Derex, 2022 and Savalia, 2022) with a FU until 7 days was 0,68 (95% CI: 0.30 to 1.52) demonstrating a slightly more beneficial effect than the resulting OR from 5 studies (Gilad, 2011; Passero, 2002; Reddig, 2011; van Tuijl, 2021 and Zandieh, 2016) with a longer FU duration up till 3 months i.e. 0,76 (95% CI: 0,47-1,23), forest plot not shown.
Functional outcome (important)
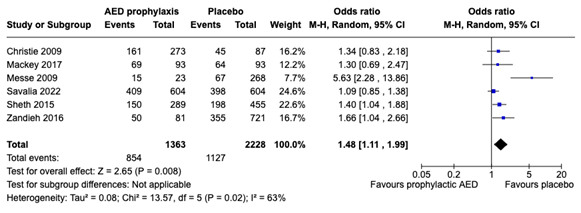
From seven studies data could be extracted to calculate the effect of ASM prophylaxis (mainly LEV and PHT) on functional outcome. Six studies (Christie, 2020; Mackey, 2017; Messe, 2009; Savalia, 2022; Sheth, 2015 and Zandieh, 2016) were included in the pooled analysis, all using the modified Rankin Scale (mRS) assessing good or poor functional outcome. Studies used different cut-off values defining good or poor functional outcome. Pooled analysis used the definitions on poor functional outcome as presented by the individual studies. Five of the included studies in pooled analysis presented mRS scores measured at 3 months, however Mackey (2017) presented mRS score at discharge.
Gilad (2011) was not included in the pooled analysis as this study presented the mean (and sd) resulting from the National Institute of Health Stroke Scale (NIHSS). This study found that patients treated with ASM prophylaxis (VPA) exhibited improved neurological outcome (mean NIHSS score 4.4 (± 4.1)) compared to placebo (mean NIHSS 8.6 (± 6.1)). In pooled analysis: a poor functional outcome was present in 854 of the 1363 patients on ASM prophylaxis (62,7%) and in 1127 of the 2228 patients in the placebo group (50,6%). The pooled OR was 1,48 (95% CI: 1,11 to 1,99) i.e. a clinically relevant effect, in favor of the placebo group.
Figure 2. Forest plot on poor functional outcome measured by the mRS
Mortality (important)
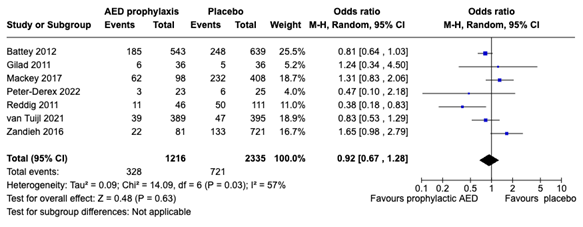
Mortality was reported in 7 studies (Battey, 2012; Gilad, 2011; Mackey, 2017; Peter Derex, 2022; Reddig, 2011; van Tuijl, 2021 and Zandieh, 2016). Studies varied in follow up duration and type of prophylaxis (mainly LEV, PHT and VPA). The study of Reddig (2011) combined mortality and hospice discharge. Pooled analysis included 1216 patients receiving prophylaxis and 2335 patients receiving placebo or no treatment. Mortality was reported in 328 of the 1216 patients on prophylaxis (27%) and in 721 of the 2335 patients in the placebo group (30,9 %). The pooled OR was 0,92 (95% CI: 0,67 to 1,28) slightly in favor of the prophylactic group, although not clinically relevant and individual study results varied largely. Subgroup analysis on type of study design didn’t provide different results (i.e. OR 0.83 (95% CI: 0.55 to 1.24) for RCTs vs OR 0.95 (95% CI: 0.95 to 1.54) for observational studies).
Figure 3. Forest plot on mortality
Adverse effects: pneumonia (important)
Most studies didn’t include a formal assessment of adverse effects. Some studies described the occurrence of adverse events, but it was frequently unclear if these were treatment related or not. Only 2 studies assessed pneumonia.
Peter Derex (2022) On levetiracetam there were serious adverse events in 5 out of 23 patients (22%) and in 9 out of 25 patients (36%) in the placebo group. These included 2 cases of severe pneumonia in each group, yet noted that none of these SAEs was considered to be related to the treatment by the investigator.
van Tuijl (2021) assessed the occurrence of pneumonia in the first 2 weeks following stroke and found no differences in developing pneumonia between patients treated with diazepam 14% (53/389 patients) or placebo group 15% (60/395 patients). No pooled analysis was performed.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question(s):
What is the efficacy of prophylactic (ASM; anti-seizure medication) treatment on the prevention of the occurrence of epilepsy in patients with acute cerebral (ischaemic or hemorrhagic) stroke.
| Patients |
Patients with (ischemic or hemorrhagic) stroke without epilepsy (without one or more epileptic seizures pre stroke) |
| Intervention | Prophylactic anti-seizure treatment (ASM) treatment (short period) |
| Control | No ASM treatment / wait and see |
| Outcomes |
Occurrence of epilepsy (one or more epileptic seizures post stroke apart from the direct stroke period) Functional outcome (modified Rankin Score (mRS) or NIHSS), Mortality and adverse events (pneumonia) |
| Other selection criteria |
Study design: systematic reviews, randomized controlled trials or observational studies Minimal follow-up: not specified |
Relevant outcome measures
The guideline panel considered the occurrence of seizures (post stroke) as critical outcome measure for decision making, a poor functional outcome, mortality or the occurrence of adverse events (pneumonia) were regarded as important outcome measures for decision making. A priori, the guideline panel did not define the outcome measures listed above but used the definitions used in the studies.
The guideline panel defined 10% difference for continuous outcome measures, 25% for dichotomous outcome measures informing on relative risk or odds ratio (0.8 ≤ OR ≥ 1.25), and 0.5 for Cohen’s d in standardized mean difference (-0.5 ≤ SMD ≥ 0.5) as minimal clinically (patient) important differences.
Search and select (Methods)
The previous version of this module was based on a Cochrane review (Sykes, 2014) which included only one RCT (Gilad, 2011), and also included four additional observational studies that were known to the guideline panel. For the current revision, a systematic literature search was performed.
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 05-01-2024. The detailed search strategy is listed under the tab ‘Literature search strategy’. The systematic literature search resulted in 568 hits. Studies were selected based on the following criteria
- Randomized controlled trials (RCTs), systematic review and/or meta-analysis or observational studies;
- studies on patients with stroke (without epilepsy);
- described prophylactic (ASM; anti-seizure medication) treatment as intervention;
- described no ASM treatment or wait and see as control;
- described at least one of the critical outcome measures (epilepsy or adverse events).
27 studies were initially selected based on title and abstract screening. After reading the full text, 25 studies were excluded (see the exclusion table under the tab ‘Evidence tabellen’), and 2 systematic reviews were included. These reviews also included the studies that were included in the previous version of the guideline on this topic.
Referenties
- Battey TW, Falcone GJ, Ayres AM, Schwab K, Viswanathan A, McNamara KA, DiPucchio ZY, Greenberg SM, Sheth KN, Goldstein JN, Rosand J. Confounding by indication in retrospective studies of intracerebral hemorrhage: antiepileptic treatment and mortality. Neurocrit Care. 2012 Dec;17(3):361-6. doi: 10.1007/s12028-012-9776-z. PMID: 22965324; PMCID: PMC3707622.
- Chang RS, Leung WC, Vassallo M, Sykes L, Battersby Wood E, Kwan J. Antiepileptic drugs for the primary and secondary prevention of seizures after stroke. Cochrane Database Syst Rev. 2022 Feb 7;2(2):CD005398. doi: 10.1002/14651858.CD005398.pub4. PMID: 35129214; PMCID: PMC8819727.
- Christie C, Daggubati L, Patel N, Matthews N, Lehman EB, Cockroft KM. Effect of Newer Generation Anticonvulsant Prophylaxis on Seizure Incidence After Spontaneous Intracerebral Hemorrhage. World Neurosurg. 2020 Sep;141:e461-e465. doi: 10.1016/j.wneu.2020.05.197. Epub 2020 May 28. PMID: 32474098.
- Gilad R, Boaz M, Dabby R, Sadeh M, Lampl Y. Are post intracerebral hemorrhage seizures prevented by anti-epileptic treatment? Epilepsy Res. 2011 Aug;95(3):227-31. doi: 10.1016/j.eplepsyres.2011.04.002. Epub 2011 May 31. PMID: 21632213.
- Guo J, Guo J, Li J, Zhou M, Qin F, Zhang S, Wu B, He L, Zhou D. Statin treatment reduces the risk of poststroke seizures. Neurology. 2015 Aug 25;85(8):701-7. doi: 10.1212/WNL.0000000000001814. Epub 2015 Jul 22. PMID: 26203092.
- Hsieh PF, Tung H, Lin CH. Statin effects on post-stroke epilepsy and mortality – Taiwan population-based study. Neurol Res. 2020 May;42(5):422-429. doi: 10.1080/01616412.2020.1735821. Epub 2020 Mar 2. PMID: 32122287.
- Lin FJ, Lin HW, Ho YF. Effect of Statin Intensity on the Risk of Epilepsy After Ischaemic Stroke:Real-World Evidence from Population-Based Health Claims. CNS Drugs. 2018 Apr;32(4):367-376. doi: 10.1007/s40263-018-0501-0. PMID: 29619760.
- Lin HW, Ho YF, Lin FJ. Statin use associated with lower risk of epilepsy after intracranial haemorrhage: A population-based cohort study. Br J Clin Pharmacol. 2018 Sep;84(9):1970-1979. doi: 10.1111/bcp.13626. Epub 2018 Jun 15. PMID: 29714813; PMCID: PMC6089806.
- Mackey J, Blatsioris AD, Moser EAS, Carter RJL, Saha C, Stevenson A, Hulin AL, O'Neill DP, Cohen-Gadol AA, Leipzig TJ, Williams LS. Prophylactic Anticonvulsants in Intracerebral Hemorrhage. Neurocrit Care. 2017 Oct;27(2):220-228. doi: 10.1007/s12028-017-0385-8. PMID: 28324261; PMCID: PMC6522136.
- Messé SR, Sansing LH, Cucchiara BL, Herman ST, Lyden PD, Kasner SE; CHANT investigators. Prophylactic antiepileptic drug use is associated with poor outcome following ICH. Neurocrit Care. 2009;11(1):38-44. doi: 10.1007/s12028-009-9207-y. Epub 2009 Mar 25. PMID: 19319701.
- Mota Telles JP, Rocha RB, Cenci GI, Nager GB, Silva GD, Figueiredo EG. Prophylactic antiseizure drugs for spontaneous intracerebral hemorrhage: An updated systematic review and meta-analysis. Int J Stroke. 2023 Aug;18(7):773-782. doi: 10.1177/17474930221140071. Epub 2022 Nov 27. PMID: 36337029.
- Naidech AM, Garg RK, Liebling S, Levasseur K, Macken MP, Schuele SU, Batjer HH. Anticonvulsant use and outcomes after intracerebral hemorrhage. Stroke. 2009 Dec;40(12):3810-5. doi: 10.1161/STROKEAHA.109.559948. Epub 2009 Sep 24. PMID: 19797183.
- Naidech AM, Beaumont J, Muldoon K, Liotta EM, Maas MB, Potts MB, Jahromi BS, Cella D, Prabhakaran S, Holl JL. Prophylactic Seizure Medication and Health-Related Quality of Life After Intracerebral Hemorrhage. Crit Care Med. 2018 Sep;46(9):1480-1485. doi: 10.1097/CCM.0000000000003272. PMID: 29923930; PMCID: PMC6095719.
- Passero S, Rocchi R, Rossi S, Ulivelli M, Vatti G. Seizures after spontaneous supratentorial intracerebral hemorrhage. Epilepsia. 2002 Oct;43(10):1175-80. doi: 10.1046/j.1528-1157.2002.00302.x. PMID: 12366733.
- Peter-Derex L, Philippeau F, Garnier P, André-Obadia N, Boulogne S, Catenoix H, Convers P, Mazzola L, Gouttard M, Esteban M, Fontaine J, Mechtouff L, Ong E, Cho TH, Nighoghossian N, Perreton N, Termoz A, Haesebaert J, Schott AM, Rabilloud M, Pivot C, Dhelens C, Filip A, Berthezène Y, Rheims S, Boutitie F, Derex L. Safety and efficacy of prophylactic levetiracetam for prevention of epileptic seizures in the acute phase of intracerebral haemorrhage (PEACH): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Neurol. 2022 Sep;21(9):781-791. doi: 10.1016/S1474-4422(22)00235-6. PMID: 35963261.
- Reddig RT, Nixdorf KE, Jensen MB. The prophylactic use of an antiepileptic drug in intracerebral hemorrhage. Clin Neurol Neurosurg. 2011 Dec;113(10):895-7. doi: 10.1016/j.clineuro.2011.07.008. Epub 2011 Aug 6. PMID: 21824722; PMCID: PMC3215779.
- Savalia K, Sekar P, Moomaw CJ, Koch S, Sheth KN, Woo D, Mayson D; ERICH Investigators. Effect of Primary Prophylactic Antiseizure Medication for Seizure Prevention Following Intracerebral Hemorrhage in the ERICH Study. J Stroke Cerebrovasc Dis. 2022 Jan;31(1):106143. doi: 10.1016/j.jstrokecerebrovasdis.2021.106143. Epub 2021 Oct 26. PMID: 34715523; PMCID: PMC10370357.
- Sheth KN, Martini SR, Moomaw CJ, Koch S, Elkind MS, Sung G, Kittner SJ, Frankel M, Rosand J, Langefeld CD, Comeau ME, Waddy SP, Osborne J, Woo D; ERICH Investigators. Prophylactic Antiepileptic Drug Use and Outcome in the Ethnic/Racial Variations of Intracerebral Hemorrhage Study. Stroke. 2015 Dec;46(12):3532-5. doi: 10.1161/STROKEAHA.115.010875. Epub 2015 Oct 15. PMID: 26470777; PMCID: PMC4659755.
- Sykes L, Wood E, Kwan J. Antiepileptic drugs for the primary and secondary prevention of seizures after stroke. Cochrane Database Syst Rev. 2014;24;1:CD005398.
- van Tuijl JH, van Raak EPM, van Oostenbrugge RJ, Aldenkamp AP, Rouhl RPW. Treatment with Diazepam in Acute Stroke Prevents Poststroke Seizures: A Substudy of the EGASIS Trial. Cerebrovasc Dis. 2021;50(2):216-221. doi: 10.1159/000512799. Epub 2021 Jan 19. PMID: 33465768.
- Woo KM, Yang SY, Cho KT. Seizures after spontaneous intracerebral hemorrhage. J Korean Neurosurg Soc. 2012 Oct;52(4):312-9. doi: 10.3340/jkns.2012.52.4.312. Epub 2012 Oct 22. PMID: 23133718; PMCID: PMC3488638.
- Zandieh A, Messé SR, Cucchiara B, Mullen MT, Kasner SE; VISTA-ICH Collaborators. Prophylactic Use of Antiepileptic Drugs in Patients with Spontaneous Intracerebral Hemorrhage. J Stroke Cerebrovasc Dis. 2016 Sep;25(9):2159-66. doi: 10.1016/j.jstrokecerebrovasdis.2016.05.026. Epub 2016 Jun 8. PMID: 27289186; PMCID: PMC5012954.
Evidence tabellen
Risk of Bias tables
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at Mc Master University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
|
Was the allocation adequately concealed?
|
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients/healthcare providers/ data collectors/ outcome assessors/ data analysts blinded? |
Was loss to follow-up (missing outcome data) infrequent?
|
Are reports of the study free of selective outcome reporting? |
Was the study apparently free of other problems that could put it at a risk of bias? |
Overall risk of bias If applicable/necessary, per outcome measure
|
|
Gilad 2011 RCT |
Definitely yes:
Reason: Randomization accomplished with a computer-generated randomization scheme |
Probably yes
Reason: Allocation according to randomization scheme, treatment within 2h from the event, but no details on allocation |
Probably yes
Reason: Double blinded RCT. Neurologist was blinded to treatment assignment. Not clear if data collectors’/assessors’/ analysts were blinded |
Definitely yes
Reason: No loss to follow up |
probably yes
Reason; All relevant outcomes were reported. Seizures were reported when observed by medical staff, family members or other eyewitnesses but may have been missed during first 2 weeks |
Probably yes
Reason: No other problems reported |
Some concerns (seizure occurrence, functional outcome)
Due to potential bias due to unclear blinding of data collectors/ assessors/analysts and no details on adequate allocation concealment |
|
Peter Derex 2022 RCT |
Definitely yes
Reason: Randomization using permuted blocks stratified by centre and NIHSS score at admission using centralised randomisation software |
Definitely yes
Reason: Treatment was distributed to participating centers in externally indistinguishable sealed treatment kits |
Definitely yes
Reason: Double blinded RCT. Patients and all those involved in patient management, data assessors were masked to treatment allocation |
Probably yes
reason: No loss to follow up reported, though in each group there were some patients without cEEG (4 LEV and 2 placebo) |
Definitely yes
Reason: All relevant outcomes were reported. |
Probably yes
Reason: No other problems reported |
Low (seizure occurrence, mortality, adverse events) |
|
Van Tuijl 2021 RCT |
Definitely yes
Reason: Central randomization by a 24h telephone service |
Probably yes
Reason: Allocation according to randomization treatment asap after stroke onset, within 12h, but no further details on allocation |
Definitely yes
Reason: All patients, investigators, attending physicians and nurses were blinded to allocated treatment |
Probably yes
Reason; Loss to follow up reported, 30 patients lost to FU, no large risk of bias |
Definitely yes
Reason; All relevant outcomes were reported, however no details on assessment |
Probably yes
Reason: No other problems reported |
Some concerns (seizure occurrence, mortality, adverse events)
Due to potential bias due to no details on adequate allocation concealment
|
Risk of bias table for intervention studies (cohort studies based on risk of bias tool by the CLARITY Group at Mc Master University)
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables? |
Assessment of outcome
Can we be confident in the assessment of outcome? |
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed? |
Co-interventions
Were co-interventions similar between groups?
|
Overall risk of bias |
|
Battey 2012
|
probably yes
Reason: Subjects obtained from a longitudinal cohort primary ICH |
probably yes:
Reason: prior ASM use or use during admission extracted from RPDR registry, |
Definitely yes:
Reason; mortality and mRS assessed at start |
Probably yes
Reason: Confounding factors addressed |
Probably yes
Reason: Confounding factors assessed, unliklely to have largely influenced the results |
Definitely yes:
Reason: Mortality defined as death during hospital stay or later through telephone interviews and SSDI |
Probably yes:
Reason: probably no loss to follow up, but not explicitly reported
|
Probably no
Reason: Not specifically reported |
Some concerns (mortality) |
|
Christie 2020
|
Probably yes
Reason: Subjects obtained from prospective CSC database diagnosed with nontraumatic ICH |
Probably no
Reason: ASM administration determined by admitting neurosurgery service, potential bias
|
Probably yes
Reason: Patients with previous seizures were excluded and preadmission mRS score estimated from information from patient/ family interview
|
Probably yes
Reason: Confounding factors addressed |
Probably yes
Reason: Confounding factors assessed, unliklely to have largely influenced the results |
Probably yes
Reason: Seizure occurrence measured during hospitalization and mRSs at discharge and 90d, no detailed information |
Probably no
Reason: No loss to follow up reported |
Probably no
Reason: Not specifically reported |
Some concerns (seizure occurrence and functional outcome) |
|
Mackey 2017
|
definitely yes:
Reason: Patients ICH extracted from INPC database and additional query and included a case characterization by review of medical records and imaging scans |
Probably no
Reason: no details presented on ASM administration |
Probably yes
Reason: NIHSS score at presentation was assessed
|
Probably yes
Reason: Confounding factors addressed |
Probably yes
Reason: Confounding factors assessed, unliklely to have largely influenced the results |
Probably yes
Reason: mRS assessed at discharge and mortality during hospitalization was recorded |
Probably no
Reason: No loss to follow up reported |
Probably no
Reason: Not specifically reported |
Some concerns (functional outcome and mortality) |
|
Messe 2009
|
Probably yes
Reason: Patients from a RCT on safety and tolerability of neuroprotectant in patients with ICH
|
Definitely yes
Reason; All ASM medication identified and randomly assigned in RCT |
Probably yes:
Reason Seizures were no explicit exclusion criteria and seizures prior to enrollment not documented, though a subgroup analysis was performed on those receiving ASM after the first day. mRS scored at inclusion only those with mRS 0 or 1 included |
Probably yes
Reason: Confounding factors addressed |
Probably yes
Reason: Confounding factors assessed, unlikely to have largely influenced the results |
Probably no
Reason: No detailed description of how outcomes were assessed |
Probably no
Reason: No loss to follow up reported |
Probably no
Reason: Not specifically reported |
Some concerns (seizure occurrence and functional outcome) |
|
Naidech 2009
|
Probably yes
Reason: consecutive patients with ICH, diagnosed clinically and with CT were enrolled, no further details presented |
Probably yes
Reason: ASM administration for prophylactic or therapeutic use prospectively recorded from the electronic medical records. |
Probably no
Reason: Not clearly defined if and how seizures were measured before ICH.
|
Probably yes
Reason: Confounding factors addressed |
Probably yes
Reason: Confounding factors assessed, unlikely to have largely influenced the results |
Probably yes
Reason: mRS was assessed at 28d and 3m by standardized questionnaire, by phone, |
Probably yes
Reason: probably no loss to follow up, but not explicitly reported |
Probably no
Reason: Not specifically reported |
Some concerns (functional outcome) |
|
Naidech 2018
|
Probably yes
Reason: Consecutive ICH patients identified on hospital admission |
Probably yes
Reason: ASM administration dose collected from EPD, no FU assessment |
Probably no
Reason: Not clearly defined if and how seizures were measured before ICH |
Probably yes
Reason: Confounding factors addressed |
Probably yes
Reason: Confounding factors assessed, unlikely to have largely influenced the results |
Probably yes
Reason: Continuous EEG monitoring in first 24h. (dis-)continuation based on agreement on likelihood of potential subclinical seizures |
Probably no
Reason: follow up of seizures after 24h probably unnoticed in some patients.
|
Probably yes:
Reason: administered dose of benzodiazepines assessed |
Some concerns (seizure occurrence, functional outcome) |
|
Passero 2002
|
Definitely yes
Reason: all eligible consecutive participants with non-traumatic non-aneurysmal ICH admitted to the hospital were selected. |
Probably yes
Reason: the prophylactic administration of ASM to patients who had not had a seizure based on the judgment of the responsible clinician, ASM prescription and potential changes were recorded. |
Probably yes
Reason: Patients with histories of epileptic seizures were excluded from the study. |
Probably yes
Reason: Stratification and assessment of confounding factors assessed |
Probably yes
Reason: Confounding factors assessed, unlikely to have largely influenced the results |
Probably yes
Reason: Diagnosis was based on direct observation of seizures during hospitalization by medical staff, clinician, ambulance personnel, family members or eye witnesses. All suspected cases of seizures were reviewed by two epileptologists. |
probably no
Reason: Follow up seems adequate and complete but not clearly described, seizures may have been missed |
Probably yes
Reason: No reports of co-intervention |
Some concerns (seizure occurrence) |
|
Reddig 2011
|
Probably yes
Reason: All patients with discharge diagnosis of ICH |
Probably no
Reason: No detailed information on administration of prophylactic ASM treatment |
Probably no
Reason: No description of seizures before ICH |
Probably yes
Reason: assessment of confounding factors
|
Probably yes
Reason: Confounding factors assessed, unlikely to have largely influenced the results |
Probably no
Reason: Seizure occurrence within 7 days but no detailed description how they were measured |
Probably no
Reason: No loss to follow up reported |
Probably no
Reason: Not specifically reported |
Some concerns (seizure occurrence and mortality) |
|
Savalia 2022
|
Definitely yes
Reason: Multicenter study using early identification of ICH cases through active screening of admission logs (ICU, general, neurology, neurosurgery) |
Definitely yes:
Reason: Anti-seizure medication reported from charts distinguishing prophylactic ASM from ASM for documented seizure |
probably yes:
Reason: Seizure occurrence was assessed by patient self (or proxy) records and patients with documented seizures were excluded. Functional outcome was assessed |
Probably yes
Reason: assessment of confounding factors
|
Probably yes
Reason: Confounding factors assessed, unlikely to have largely influenced the results |
Probably yes
Reason: Seizure occurrence assessed by standard practice (clinically or EEG) and questionnaire mRS by questionnaire
|
Probably yes
Reason: probably no loss to follow up, but not explicitly reported |
Probably no
Reason: Not specifically reported |
Some concerns (seizure occurrence and functional outcome) |
|
Sheth 2015
|
Probably yes:
Reason: patient selection seems adequate though no detailed description |
Probably no
Reason: ASM administration was at direction of treating physician, baseline difference between those who received ASM and those who didn’t |
Probably yes:
Reason: mRS measured at 3 months no detailed description |
Probably yes
Reason: assessment of confounding factors, exclusion of potential confounding factors |
Probably yes
Reason: Confounding factors assessed, unlikely to have largely influenced the results |
Probably yes
Reason: mRS assessed at 3 months no details presented |
Definitely yes
Reason: Loss to follow up were excluded |
Probably no
Reason: Not specifically reported |
Some concerns (functional outcome) |
|
Woo 2012
|
probably yes
Reason: All patients newly diagnosed ICH included and analyzed |
Probably no
Reason:
Administration ASM based on physicians’ attitude towards seizure prophylaxis. Practice differences. |
Probably yes
Reason:
Patients with histories of seizure, stroke, infection of the central nervous system, traumatic hemorrhage, metabolic disorders, brain tumor, hemorrhage due to arteriovenous malformation, subarachnoid hemorrhage, cerebellar hemorrhage or brain stem hemorrhage were excluded |
Probably yes
Reason: assessment of confounding factors. |
Probably yes
Reason: Confounding factors assessed, unlikely to have largely influenced the results |
Probably yes
Reason: direct observation of seizures during hospitalization or reliable descriptions from patient/ personnel/ family. EEG performed if possible after admission Functional outcome assessed with GOS at discharge and mRS discharge and 2 w after onset ICH with telephone interviews |
Probably yes
Reason: Relative short follow up period |
Probably no
Reason: Not specifically reported |
Some concerns (seizure occurrence and functional outcome) |
|
Zandieh 2016
|
Probably yes
Reason: Selection based on an international stroke trials archive (VISTA) |
Probably no:
Reason: No details on ASM administration potential risk of bias |
Probably no
Reason: Prior epileptic seizures or functional outcome assessment not reported |
Probably yes
Reason: assessment of confounding factors. |
Probably yes
Reason: Confounding factors assessed, unlikely to have largely influenced the results |
Probably no
Reason: Details on the assessment of seizure and functional outcome not reported and may have varied |
Probably no
Reason: No data on loss to follow up |
Probably no
Reason: Not specifically reported |
Some concerns (seizure occurrence, functional outcome and mortality) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Gigliotti MJ, Wilkinson DA, Simon SD, Cockroft KM, Church EW. A Systematic Review and Meta-Analysis of Antiepileptic Prophylaxis in Spontaneous Intracerebral Hemorrhage. World Neurosurg. 2021 Jul;151:218-224.e2. doi: 10.1016/j.wneu.2021.04.083. Epub 2021 Apr 30. PMID: 33940261. |
Systematic Review without additional individual studies |
|
Tran QK, Bzhilyanskaya V, Lurie T, Fairchild M, Rehan MA, Rashid A, Powell E, Pourmand A. Phenytoin prophylaxis and functional outcomes following spontaneous intracerebral hemorrhage: A systematic review and meta-analysis. J Neurol Sci. 2021 Oct 15;429:117624. doi: 10.1016/j.jns.2021.117624. Epub 2021 Aug 24. PMID: 34488044. |
Systematic Review without additional individual studies |
|
Tran QK, Bzhilyanskaya V, Afridi LZ, Ahmad M, Palmer J, Rehan MA, Raffman A, Rashid A, Menne A, Pourmand A. Preventing seizure occurrence following spontaneous intracerebral haemorrhage: A systematic review and meta-analysis of seizure prophylaxis. Seizure. 2021 Apr;87:46-55. doi: 10.1016/j.seizure.2021.02.029. Epub 2021 Mar 1. PMID: 33713891. |
Systematic Review without additional individual studies |
|
Angriman F, Tirupakuzhi Vijayaraghavan BK, Dragoi L, Lopez Soto C, Chapman M, Scales DC. Antiepileptic Drugs to Prevent Seizures After Spontaneous Intracerebral Hemorrhage. Stroke. 2019 May;50(5):1095-1099. doi: 10.1161/STROKEAHA.118.024380. PMID: 30935318. |
Systematic Review without additional individual studies |
|
Spoelhof B, Sanchez-Bautista J, Zorrilla-Vaca A, Kaplan PW, Farrokh S, Mirski M, Freund B, Rivera-Lara L. Impact of antiepileptic drugs for seizure prophylaxis on short and long-term functional outcomes in patients with acute intracerebral hemorrhage: A meta-analysis and systematic review. Seizure. 2019 Jul;69:140-146. doi: 10.1016/j.seizure.2019.04.017. Epub 2019 Apr 25. PMID: 31048270. |
Systematic Review without additional individual studies |
|
Chen Y, Xia F, Cai C, Li H, Ma L, Hu X, You C. Duration and choices of prophylactic anticonvulsants in subarachnoid hemorrhage: a systematic review and meta-analysis. Neurosurg Rev. 2021 Oct;44(5):2459-2467. doi: 10.1007/s10143-020-01466-1. Epub 2021 Jan 3. PMID: 33389342. |
Wrong comparison; Comparison between short and extended ASM treatment or different ASM treatments. |
|
Guo X, Zhong R, Han Y, Zhang H, Zhang X, Lin W. Incidence and relevant factors for seizures after spontaneous intracerebral hemorrhage: A systematic review and meta-analysis. Seizure. 2022 Oct;101:30-38. doi: 10.1016/j.seizure.2022.06.016. Epub 2022 Jun 26. PMID: 35850020. |
Wrong comparison/study type: Aimed to identify risk factors for seizures after ICH |
|
Moura LMVR, Donahue MA, Yan Z, Smith LH, Hsu J, Newhouse JP, Schwamm LH, Haneuse S, Hernandez-Diaz S, Blacker D. Comparative Effectiveness and Safety of Seizure Prophylaxis Among Adults After Acute Ischemic Stroke. Stroke. 2023 Feb;54(2):527-536. doi: 10.1161/STROKEAHA.122.039946. Epub 2022 Dec 21. PMID: 36544249; PMCID: PMC9870933. |
Not included in included systematic reviews
|
|
Pingue V, Mele C, Biscuola S, Nardone A, Bagnato S, Franciotta D. Impact of seizures and their prophylaxis with antiepileptic drugs on rehabilitation course of patients with traumatic or hemorrhagic brain injury. Front Neurol. 2022 Nov 11;13:1060008. doi: 10.3389/fneur.2022.1060008. PMID: 36438966; PMCID: PMC9691976. |
Not included in included systematic reviews |
|
Sanches PR, Tabaeizadeh M, Moura LMVR, Rosenthal ES, Caboclo LO, Hsu J, Patorno E, Westover MB, Zafar SF. Anti-seizure medication treatment and outcomes in acute ischemic stroke patients undergoing continuous EEG monitoring. Neurol Sci. 2022 Sep;43(9):5441-5449. doi: 10.1007/s10072-022-06183-9. Epub 2022 Jun 17. PMID: 35713732. |
Not included in included systematic reviews |
|
Smith AM, Clark PR, Winter KA, Smalley ZP, Duke SM, Dedwylder M, Washington CW. The effect of prophylactic antiepileptic medications in aneurysmal subarachnoid hemorrhage patients: A retrospective review. Clin Neurol Neurosurg. 2021 Apr 2;205:106633. doi: 10.1016/j.clineuro.2021.106633. Epub ahead of print. PMID: 33887506. |
Not included in included systematic reviews |
|
Suzuki H, Miura Y, Yasuda R, Yago T, Mizutani H, Ichikawa T, Miyazaki T, Kitano Y, Nishikawa H, Kawakita F, Fujimoto M, Toma N. Effects of New-Generation Antiepileptic Drug Prophylaxis on Delayed Neurovascular Events After Aneurysmal Subarachnoid Hemorrhage. Transl Stroke Res. 2023 Dec;14(6):899-909. doi: 10.1007/s12975-022-01101-9. Epub 2022 Nov 5. PMID: 36333650. |
Not included in included systematic reviews |
|
Wong YS, Wu CS, Ong CT. Discontinuation of preventive antiepileptic drugs in patients with intracerebral hemorrhage. BMC Neurol. 2021 Apr 7;21(1):150. doi: 10.1186/s12883-021-02177-w. PMID: 33827479; PMCID: PMC8025523. |
Wrong comparison/study design Aimed to assess factors related to early late seizure occurrence
|
|
Zafar SF, Rosenthal ES, Postma EN, Sanches P, Ayub MA, Rajan S, Kim JA, Rubin DB, Lee H, Patel AB, Hsu J, Patorno E, Westover MB. Antiseizure Medication Treatment and Outcomes in Patients with Subarachnoid Hemorrhage Undergoing Continuous EEG Monitoring. Neurocrit Care. 2022 Jun;36(3):857-867. doi: 10.1007/s12028-021-01387-x. Epub 2021 Nov 29. PMID: 34843082; PMCID: PMC9117405. |
Wrong comparison All patients received ASM treatment |
|
Huang YC, Wong YS, Wu CS, Tsai CF, Ong CT. Modified CAVE score for predicting late seizures after intracerebral hemorrhage. BMC Neurol. 2023 Dec 19;23(1):448. doi: 10.1186/s12883-023-03510-1. PMID: 38114955; PMCID: PMC10729474. |
Wrong study design Validation model
|
|
Rathore FA, Nazir SNB. Are antiepileptic drugs effective for the primary and secondary prevention of Seizures after stroke? A Cochrane Review summary with commentary. NeuroRehabilitation. 2023;53(2):249-251. doi: 10.3233/NRE-236004. PMID: 37638459. |
Wrong study design Commentary |
|
Cervenka MC. Be a PEACH and Hand Me That Levetiracetam: Seizure Prophylaxis for Spontaneous Intracerebral Hemorrhage. Epilepsy Curr. 2023 May 15;23(4):241-243. doi: 10.1177/15357597231174112. PMID: 37662466; PMCID: PMC10470104. |
Wrong study design commentary |
|
Gigliotti MJ, Srikanth S, Cockroft KM. Patterns of prophylactic anticonvulsant use in spontaneous intracerebral and subarachnoid hemorrhage: results of a practitioner survey. Neurol Sci. 2022 Mar;43(3):1873-1877. doi: 10.1007/s10072-021-05588-2. Epub 2021 Sep 8. PMID: 34495437. |
Wrong study design survey |
|
Jones FJS, Sanches PR, Smith JR, Zafar SF, Blacker D, Hsu J, Schwamm LH, Newhouse JP, Westover MB, Moura LMVR. Seizure Prophylaxis After Spontaneous Intracerebral Hemorrhage. JAMA Neurol. 2021 Sep 1;78(9):1128-1136. doi: 10.1001/jamaneurol.2021.2249. PMID: 34309642; PMCID: PMC8314179. |
Wrong study design Model for strategy assessment
|
|
Jones FJS, Sanches PR, Smith JR, Zafar SF, Hernandez-Diaz S, Blacker D, Hsu J, Schwamm LH, Westover MB, Moura LMVR. Anticonvulsant Primary and Secondary Prophylaxis for Acute Ischemic Stroke Patients: A Decision Analysis. Stroke. 2021 Aug;52(9):2782-2791. doi: 10.1161/STROKEAHA.120.033299. Epub 2021 Jun 15. PMID: 34126758; PMCID: PMC8384723. |
Wrong study design Model for strategy assessment |
|
Lee SH, Aw KL, Banik S, Myint PK. Post-stroke seizure risk prediction models: a systematic review and meta-analysis. Epileptic Disord. 2022 Apr 1;24(2):302-314. doi: 10.1684/epd.2021.1391. PMID: 34874273. |
Wrong study design Prediction model |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-08-2025
Beoordeeld op geldigheid : 04-08-2025
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Voor meer details over de gebruikte richtlijnmethodologie verwijzen wij u naar de werkwijze. Relevante informatie voor de ontwikkeling/herziening van deze richtlijnmodule is hieronder weergegeven.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2020 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Het cluster Epilepsie bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule. Het cluster bestaat uit de volgende personen:
Clusterstuurgroep
- Prof. dr. H.J.M. Majoie (voorzitter), neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze en Maastricht
- Dr. C.M. Delsman-van Gelder, kinderneuroloog, RadboudUMC, Nijmegen
- Drs. M.H.G. Dremmen, radioloog, Erasmus MC Rotterdam
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Dr. L. M’Rabet, patiëntvertegenwoordiger, EpilepsieNL, Houten
- Dr. P. van Vliet, neuroloog/intensivist, Haaglanden Medisch Centrum, Den Haag
Clusterexpertisegroep
- Drs. J. H. van Tuijl, neuroloog, Elisabeth-TweeSteden ziekenhuis, Tilburg
- Dr. M. Vlooswijk, neuroloog, Maastricht UMC+, Maastricht
Met ondersteuning van
- Dr. M.M.J. van Rooijen, adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
- Dr. I.J. Blokland, adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
- Dr. M. Wassenaar, adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterstuurgroepleden en actief betrokken expertisegroepsleden (fungerend als schrijver en/of meelezer bij tenminste één van de geprioriteerde richtlijnmodules) hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een richtlijnmodule worden wijzigingen in belangen aan de projectleider doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase. Een overzicht van de belangen van de clusterleden en betrokken expertisegroepsleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Majoie* |
Functie: Neurologie Werkgever: Academisch Centrum voor Epileptologie Kempenhaeghe, Maastricht UMC+ |
Relevante commissies
NB geen betaalde functies |
Lopende onderzoek- en zorginnovatieprojecten (anders dan contract research) worden gefinancierd uit ZonMW, Nationaal epilepsiefonds, stichting vrienden van Kempenhaeghe, en SKMS.
Incidenteel financiële ondersteuning aan stichting Kempenhaeghe voor organisatie refereeravonden en workshops/symposia (telkens volgens geldende wet en regelgeving). |
Geen actie |
|
Delsman |
Kinderneuroloog/kinderarts Werkgever: Maxima MC Veldhoven |
Geen |
Geen |
Geen actie |
|
Dremmen |
Functie: Kinderradioloog met subspecialisatie kinderneuroradiologie Werkgever: ErasmusMC Rotterdam |
Een van de voorzitters van de richtlijn Radiologische diagnostiek acute trauma-opvang bij kinderen Expertisegroep richtlijn Traumatologie Uitgenodigd spreker op meerdere nationale en internationale cursussen en congressen |
Geen |
Geen actie |
|
Klarenbeek |
Functie: Neuroloog (vrijgevestigd) Werkgever: Zuyderland te Heerlen/Sittard |
Geen |
Geen |
Geen actie |
|
Van Vliet |
Functie: Intensivist Werkgever: Haaglanden Medisch Centrum Den Haag |
|
Geen |
Geen actie |
|
M’Rabet |
Functie: MT-lid Kennis en Innovatie Werkgever: EpilepsieNL, Houten |
|
Familielid met epilepsie Lopend onderzoek epilepsie en een verstandelijke beperking Jazz Pharmaceuticals Benelux (werkpakketleider en projectmanager) |
Geen actie |
Betrokken clusterexpertisegroepleden
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van Tuijl |
Functie: Neuroloog Werkgever: ETZ Tilburg |
Voorzitter focusgroep CVA van de ROAZ regio Brabant (onbetaald) |
Geen. |
Geen actie |
|
Vlooswijk |
Functie: Neuroloog Werkgever: Maastricht UMC+ |
|
Geen. |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afvaardiging van EpilepsieNL in het cluster. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens ter commentaar voorgelegd aan Epilepsie NL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
|
Module |
Uitkomst raming |
Toelichting |
|
Preventie van het ontwikkelen van epilepsie na een beroerte |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase april 2024 inventariseerde het cluster de geldigheid van de richtlijnmodules binnen het cluster. Naast de partijen die deelnemen aan de stuur- en expertisegroep zijn hier ook andere stakeholders voor benaderd. Per richtlijnmodule is aangegeven of deze geldig is, herzien moet worden, kan vervallen of moet worden samengevoegd. Ook was er de mogelijkheid om nieuwe onderwerpen aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De richtlijnmodules waarbij door één of meerdere partijen werd aangegeven herzien te worden, werden doorgezet naar de prioriteringsronde. Ook suggesties voor nieuwe richtlijnmodules werden doorgezet naar de prioriteringsronde. Afgevaardigden vanuit de partijen in de stuur- en expertisegroep werden gevraagd om te prioriteren (zie ‘Samenstelling cluster’ onder ‘Verantwoording’). De uitkomsten (ranklijst) werd gebruikt als uitgangspunt voor de discussie. Voor de geprioriteerde richtlijnmodules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd indien mogelijk gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
Tabel Gradaties voor de kwaliteit van wetenschappelijk bewijs
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in een richtlijnmodule volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel Sterkte van de aanbevelingen
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de richtlijnmodule Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd voorgelegd aan alle partijen die benaderd zijn voor de need-for-update fase. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: Epilepsie |
|
|
Uitgangsvraag: CVA en Anti-aanvalsmedeicatie |
|
|
Database(s): Pubmed/Medline, Embase (Ovid) |
Datum: 05-01-2024 |
|
Periode: 2023 |
Talen: Engels |
|
Literatuurspecialist: Irene Gijselhart |
|
|
Toelichting en opmerkingen:
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (Ovid) en Pubmed/Medline is op 05-01-2024 met relevante zoektermen gezocht naar systematische reviews, RCTs over CVA en Anti-aanvalsmedicatie. De literatuurzoekactie leverde 95 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
Pubmed/MEDLINE |
Ontdubbeld |
|
SRs |
35 |
22 |
13 |
|
RCTs |
27 |
17 |
7 |
|
Observationele studies |
183 |
132 |
75 |
|
Overig |
|
|
|
|
Totaal |
245 |
171 |
95 |
Zoekstrategie
Embase (Ovid) <1974 to 2023 Week 52>
|
#1 |
((exp Epilepsy/ or exp Seizure/ or (epilep* or seizure* or convulsion*).ab,ti,kf.) not (pre eclampsia or preeclampsia or eclampsia).ab,ti,kf.) and (exp *cerebrovascular accident/ or exp *brain hemorrhage/ or exp *brain infarction/ or exp *brain ischemia/ or (cerebrovascular accident* or cerebral vascular accident* or cerebo vascular accident* or brain vascular accident* or stroke or cva or cvas).ab,ti,kf.) and (exp Acetazolamide/ or (acetazolamide or diamox).ab,ti,kf. or exp corticotropin/ or (acth or adrenocorticotrophin or corticotropin).ab,ti,kf. or anakinra/ or anakinra.ti,ab,kw. or exp brivaracetam/ or (brivaracetam or briviact).ab,ti,kf. or exp Carbamazepine/ or (carbamazepine or tegretol).ab,ti,kf. or cenobamate/ or cenobamate.ab,ti,kf. or exp clobazam/ or (clobazam or frisium).ab,ti,kf. or exp clonazepam/ or (clonazepam or ritrovil).ab,ti,kf. or cvl-865.ab,ti,kf. or exp Diazepam/ or (diazepam or stesolid or valium).ab,ti,kf. or exp eslicarbazepine acetate/ or (eslicarbazepine or zebinix).ab,ti,kf. or exp ethosuximide/ or (ethosuximide or ethymal or zarontin).ab,ti,kf. or exp ezogabine/ or exp felbamate/ or (felba* or taloxa or FBM).ab,ti,kf. or exp fenfluramine/ or (fenfluramine or fintepla).ab,ti,kf. or exp gabapentin/ or (gabapentin or neurontin).ab,ti,kf. or exp Ganaxolone/ or ganaxolone.ab,ti,kf. or exp lacosamide/ or (lacosamide or vimpat).ab,ti,kf. or exp etiracetam/ or (etiracetam or levetiracetam or keppra).ab,ti,kf. or exp lamotrigine/ or (lamotrigine or lamictal).ab,ti,kf. or exp lorazepam/ or (lorazepam or temesta).ab,ti,kf. or exp midazolam/ or (midazolam or dormicum).ab,ti,kf. or exp nitrazepam/ or (nitrazepam or mogadon).ab,ti,kf. or exp oxcarbazepine/ or (oxcarbazepine or trileptal).ab,ti,kf. or exp paraldehyde/ or paraldehyde.ab,ti,kf. or exp perampanel/ or (perampanel or fycompa).ab,ti,kf. or exp pregabalin/ or (pregabalin or lyrica).ab,ti,kf. or exp phenytoin/ or (phenytoin or diphantoine).ab,ti,kf. or exp phenobarbital/ or phenobarbital.ab,ti,kf. or exp rufinamide/ or (rufinamide or inovelon).ab,ti,kf. or exp sulthiame/ or (sulthiame or ospolot).ab,ti,kf. or exp stiripentol/ or (stiripentol or diacomit).ab,ti,kf. or exp topiramate/ or (topiramate or topamax).ab,ti,kf. or exp vigabatrin/ or (vigabatrin or sabril).ab,ti,kf. or exp valproic acid/ or ("valproic acid" or valproate or depakine or depakene or orfiril).ab,ti,kf. or exp zonisamide/ or (zonisamide or zonegran).ab,ti,kf. or exp anticonvulsants/ or exp barbituric acid derivative/ or exp anticonvulsive agent/ or (anticonvulsant* or antiseizure or anti-seizure or antiepileptic* or anti-epileptic).ab,ti,kf.) |
5916 |
|
#2 |
1 not ((exp animal/ or exp animal experiment/ or exp animal model/ or exp nonhuman/) not exp human/) not (conference abstract or conference review or editorial or letter or note).pt. |
3957 |
|
#3 |
limit 2 to yr="2022 -Current" |
522 |
|
#4 |
limit 3 to english language |
509 |
|
#5 |
exp meta analysis/ or exp "meta analysis (topic)"/ or (metaanaly* or meta analy* or metanaly*).ti,ab. or systematic review/ or "cochrane database of systematic reviews".jn. or prisma.ti,ab. or prospero.ti,ab. or ((systemati* or scoping or umbrella or structured literature) adj3 (review* or overview*)).ti,ab. or (systematic* adj1 review*).ti,ab. or ((systemati* or literature or database* or data base*) adj10 search*).ti,ab. or ((structured or comprehensive* or systematic*) adj3 search).ti,ab. or ((literature adj3 review).ti. and (search* or database* or data base*).ab.) or ((data extraction or "data source*") and study selection).ti,ab. or (search strategy and selection criteria).ti,ab. or (data source and data synthesis).ti,ab. or medline.ab. or pubmed.ab. or embase.ab. or cochrane.ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data base*)).ab. or metasynthes*.ti,ab. or meta synthes*.ti,ab. |
983616 |
|
#6 |
4 and 5 |
35 |
|
#7 |
exp randomized controlled trial/ or random*.ti,ab. or ((pragmatic or practical) adj clinical trial*).ti,ab. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab. |
2133136 |
|
#8 |
(4 and 7) not 5 |
27 |
|
#9 |
major clinical study/ or clinical study/ or case control study/ or family study/ or longitudinal study/ or retrospective study/ or prospective study/ or cohort analysis/ or cohort*.ab,ti. or (case control adj1 (study or studies)).ab,ti. or (follow up adj1 (study or studies)).ab,ti. or (observational adj1 (study or studies)).mp. or (epidemiologic adj1 (study or studies)).ab,ti. or (cross sectional adj1 (study or studies)).ab,ti. |
7457659 |
|
#10 |
case control study/ or exp comparative study/ or control group/ or controlled study/ or controlled clinical trial/ or crossover procedure/ or double blind procedure/ or phase 2 clinical trial/ or phase 3 clinical trial/ or phase 4 clinical trial/ or pretest posttest design/ or pretest posttest control group design/ or quasi experimental study/ or single blind procedure/ or triple blind procedure/ or (((control or controlled) adj6 trial) or ((control or controlled) adj6 (study or studies)) or ((control or controlled) adj1 active) or open label* or ((double or two or three or multi or trial) adj1 (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or sham-control* or ((single or double or triple or assessor) adj1 (blind* or masked))).ti,ab,kw. or nonrandom*.ti,ab,kw. or non-random*.ti,ab,kw. or quasi-experiment*.ti,ab,kw. or crossover.ti,ab,kw. or cross over.ti,ab,kw. or parallel group*.ti,ab,kw. or factorial trial.ti,ab,kw. or (phase adj5 (study or trial)).ti,ab,kw. or (case* adj6 (matched or control*)).ti,ab,kw. or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)).ti,ab,kw. or (propensity adj6 (scor* or match*)).ti,ab,kw. or versus.ti. or vs.ti. or compar*.ti. or (compar* adj1 study).ti,ab,kw. or ((major clinical study/ or clinical study/ or cohort analysis/ or observational study/ or cross-sectional study/ or multicenter study/ or correlational study/ or follow up/ or cohort*.ti,ab,kw. or follow up.ti,ab,kw. or followup.ti,ab,kw. or longitudinal*.ti,ab,kw. or prospective*.ti,ab,kw. or retrospective*.ti,ab,kw. or observational*.ti,ab,kw. or cross sectional*.ti,ab,kw. or cross?ectional*.ti,ab,kw. or multicent*.ti,ab,kw. or multi-cent*.ti,ab,kw. or consecutive*.ti,ab,kw.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kw. or odds ratio*.ab. or relative odds.ab. or risk ratio*.ab. or relative risk*.ab. or rate ratio.ab. or aor.ab. or arr.ab. or rrr.ab. or (rr adj6 ci).ab.)) |
14574624 |
|
#11 |
9 or 10 |
16510271 |
|
#12 |
(4 and 11) not (5 or 7) |
183 |
Pubmed/Medline
|
#10 |
#4 AND #9 NOT (#5 OR #7) |
132 |
|
#9 |
"Epidemiologic Studies"[Mesh] OR cohort[tiab] OR (case[tiab] AND (control[tiab] OR controll*[tiab] OR comparison[tiab] OR referent[tiab])) OR risk[tiab] OR causation[tiab] OR causal[tiab] OR "odds ratio"[tiab] OR etiol*[tiab] OR aetiol*[tiab] OR "natural history"[tiab] OR predict*[tiab] OR prognos*[tiab] OR outcome[tiab] OR course[tiab] OR retrospect*[tiab] |
8,644,050 |
|
#8 |
#4 AND #7 NOT #5 |
17 |
|
#7 |
("Randomized Controlled Trial" [Publication Type] OR random*[tiab] OR pragmatic clinical trial*[tiab] OR practical clinical trial*[tiab] OR non-inferiority trial*[tiab] OR noninferiority trial*[tiab] OR superiority trial*[tiab] OR equivalence clinical trial*[tiab]) |
1,614,255 |
|
#6 |
#4 AND #5 |
22 |
|
#5 |
("Meta-Analysis" [Publication Type] OR "Meta-Analysis as Topic"[Mesh] OR metaanaly*[tiab] OR meta-analy*[tiab] or metanaly*[tiab] OR "Systematic Review" [Publication Type] OR systematic[sb] OR "Cochrane Database Syst Rev"[Journal] or prisma[tiab] OR preferred reporting items[tiab] OR prospero[tiab] OR ((systemati*[ti] OR scoping[ti] OR umbrella[ti] OR structured literature[ti]) AND (review*[ti] OR overview*[ti])) OR systematic review*[tiab] OR scoping review*[tiab] OR umbrella review*[tiab] OR structured literature review*[tiab] OR systematic qualitative review*[tiab] OR systematic quantitative review*[tiab] OR systematic search and review[tiab] OR systematized review[tiab] OR systematised review[tiab] OR systemic review[tiab] OR systematic literature review*[tiab] OR systematic integrative literature review*[tiab] OR systematically review*[tiab] OR scoping literature review*[tiab] OR systematic critical review[tiab] OR systematic integrative review*[tiab] OR systematic evidence review[tiab] OR Systematic integrative literature review*[tiab] OR Systematic mixed studies review*[tiab] OR Systematized literature review*[tiab] OR Systematic overview*[tiab] OR Systematic narrative review*[tiab] OR ((systemati*[tiab] OR literature[tiab] OR database*[tiab] OR data-base*[tiab] OR structured [tiab] OR comprehensive*[tiab] OR systemic*[tiab]) AND search*[tiab]) OR (Literature[ti] AND review[ti] AND (database*[tiab] OR data-base*[tiab] OR search*[tiab])) OR ((data extraction[tiab] OR data source*[tiab]) AND study selection[tiab]) OR (search strategy[tiab] AND selection criteria[tiab]) OR (data source*[tiab] AND data synthesis[tiab]) OR medline[tiab] OR pubmed[tiab] OR embase[tiab] OR Cochrane[tiab] OR ((critical[ti] OR rapid[ti]) AND (review*[ti] OR overview*[ti] OR synthes*[ti])) OR (((critical*[tiab] OR rapid*[tiab]) AND (review*[tiab] OR overview*[tiab] OR synthes*[tiab]) AND (search*[tiab] OR database*[tiab] OR data-base*[tiab]))) OR metasynthes*[tiab] OR meta-synthes*[tiab]) |
758,700 |
|
#4 |
#3 AND (2022[pdat]:2023[pdat]) |
222 |
|
#3 |
#2 AND English[Language] |
1,803 |
|
#2 |
#1 NOT (("Animals"[Mesh] OR "Animal Experimentation"[Mesh] OR "Models, Animal"[Mesh]) NOT "Humans"[Mesh]) NOT (letter[pt] OR comment[pt] OR editorial[pt]) |
2,092 |
|
#1 |
("Epilepsy"[MeSH] OR epilep*[TW] OR "Seizures"[Mesh] OR seizure*[TW] OR convulsion[TW] OR convulsions[TW]) NOT ("pre eclampsia"[Mesh] OR "pre eclampsia"[TW] OR "preeclampsia"[TW] OR "Eclampsia"[Mesh] OR "eclampsia*"[TW]) AND ("Stroke"[Mesh] OR "Cerebral Hemorrhage"[Mesh] OR "Cerebral Hemorrhage, Traumatic"[Mesh] OR "Cerebral Infarction"[Mesh] OR "Subarachnoid Hemorrhage"[Mesh] OR "Subarachnoid Hemorrhage, Traumatic"[Mesh] OR "Basal Ganglia Hemorrhage"[Mesh] OR "Cerebrovascular disorders"[Mesh] OR "Ischemic Attack, Transient"[Mesh] OR "Brain ischemia"[Mesh] OR cva[TW] OR cvas[TW] OR stroke[TW] OR cerebrovascular accident*[TW] OR apoplex*[TW] OR "brain vascular accident"[TW] OR "brain vascular accidents"[TW]) AND (("Acetazolamide" [Mesh] OR acetazolamide[TW] OR diamox[TW]) OR ("Adrenocorticotropic Hormone"[Mesh] OR acth[TW] OR adrenocorticotrophin[TW] OR corticotropin [TW]) OR ("brivaracetam" [Supplementary Concept] OR brivaracetam [TW] OR Briviact[TW]) OR ("Carbamazepine"[Mesh] OR carbamazepine [TW] OR Tegretol[TW]) OR ("Cenobamate" [Supplementary Concept] OR cenobamate[TW]) OR ("Clobazam"[Mesh] OR clobazam[TW] OR frisium[TW]) OR ("Clonazepam"[Mesh] OR clonazepam[TW] OR ritrovil[TW]) OR "CVL-865"[TW] OR ("Diazepam"[Mesh] OR diazepam[TW] OR stesolid[TW] OR valium[TW]) OR ("eslicarbazepine acetate"[Supplementary Concept] OR eslicarbazepine[TW] OR zebinix[TW]) OR ("ethosuximide" [Mesh] OR ethosuximide[TW] OR ethymal[TW] OR zarontin[TW]) OR ("Felbamate"[Mesh] OR felba*[TW] OR taloxa[TW] OR FBM[TW]) OR ("Fenfluramine"[Mesh] OR fenfluramine[TW] OR fintepla[TW]) OR ("gabapentin" [Mesh] OR gabapentin [TW] OR neurontin[TW]) OR ("Interleukin 1 Receptor Antagonist Protein"[Mesh] OR "Interleukin 1 Receptor Antagonist Protein"[TW] OR anakinra[TW]) OR ("lacosamide" [Mesh] OR lacosamide[TW] OR vimpat[TW]) OR ("Levetiracetam"[Mesh] OR etiracetam [TW] OR levetiracetam[TW] OR keppra[TW]) OR ("lamotrigine" [Mesh] OR lamotrigine[TW] OR lamictal[TW]) OR ("lorazepam"[Mesh] OR lorazepam[TW] OR temesta[TW]) OR ("midazolam" [Mesh] OR midazolam [TW] OR dormicum[TW]) OR ("nitrazepam" [Mesh] OR nitrazepam[TW] OR mogadon[TW]) OR ("oxcarbazepine" [Mesh] OR oxcarbazepine[TW] OR trileptal[TW]) OR ("paraldehyde"[Mesh] OR paraldehyde[TW]) OR ("perampanel" [Supplementary Concept] OR perampanel[TW] OR fycompa[TW]) OR ("pregabalin" [Mesh] OR pregabalin[TW] OR lyrica[TW]) OR ("phenytoin" [Mesh] OR phenytoin[TW] OR diphantoine[TW]) OR ("phenobarbital"[Mesh] OR phenobarbital[TW]) OR ("rufinamide" [Supplementary Concept] OR rufinamide[TW] OR inovelon[TW]) OR ("sulthiame"[Supplementary Concept] OR sulthiame[TW] OR ospolot[TW]) OR ("stiripentol"[Supplementary Concept] OR stiripentol [TW] OR diacomit [TW]) OR ("Topiramate"[Mesh] OR topiramate[TW] OR topamax[TW]) OR ("vigabatrin"[Mesh] OR vigabatrin[TW] OR sabril[TW]) OR ("valproic acid" [Mesh] OR valproic acid[TW] OR valproate [TW] OR depakine[TW] OR depakene[TW] OR orfiril[TW]) OR ("Zonisamide" [Mesh] OR zonisamide[TW] OR zonegran[TW]) OR "anticonvulsants" [Pharmacological Action] OR "Anticonvulsants"[Mesh] OR anticonvulsant* [TW] OR antiseizure[TW] OR "anti-seizure"[TW] OR antiepileptic*[TW] OR anti-epileptic*[TW]) |
2,365 |