Generiek of specialité bij epilepsie
Uitgangsvraag
Is er verschil in effectiviteit en bijwerkingen tussen generieke middelen en specialités?
Aanbeveling
Overweeg het voorschrijven van een generiek middel bij de start van een nieuw anti-aanvalsmedicijn (initiële monotherapie, omschakelen naar alternatieve monotherapie, of start van add-on therapie).
Verander in principe niet van specialité naar generiek bij patiënten die aanvalsvrij zijn bij gebruik van een specialité. Indien de apotheek kan garanderen dat steeds hetzelfde generieke middel kan worden geleverd, neemt men met één keer wisselen naar een generiek middel een verantwoord risico.
Verander niet van fabrikant bij gebruik van een generiek middel.
Vermeld op het recept dat er een medische noodzaak is voor het niet substitueren van het specialité wanneer substitutie niet wenselijk is.
Overwegingen
Duh (Duh et al., 2009) heeft een literatuurreview verricht naar de medische kosten die gepaard gaan met generieke substitutie (gebaseerd op gegevens uit verzekeringsdatabases) en concludeert dat de lagere kosten van de middelen niet opwegen tegen de stijging van de overige medische kosten (meer opnames en doktersbezoek, meer gebruik van andere geneesmiddelen).
De NICE-richtlijn 2012 (NICE-richtlijn, 2012) geeft als algemene aanbeveling met betrekking tot generieke substitutie: “Een consistente levering van een preparaat van een bepaalde fabrikant wordt aanbevolen, tenzij de voorschrijvende arts, in overleg met de patiënt, van mening is dat dit niet belangrijk is. Verschillende preparaten van anti-aanvalsmedicatie kunnen variëren in biologische beschikbaarheid of farmacokinetisch profiel en daarom moet men alert zijn op een verminderde werking of een toename van bijwerkingen.”
De American Academy of Neurology (AAN) is van mening dat substitutie van een specialité door een generiek middel alleen kan met toestemming van de behandelend arts (en van de patiënt), omdat kleine verschillen in samenstelling al kunnen leiden tot terugkeer van aanvallen, met mogelijk ernstige gevolgen (Liow et al., 2007).
De Italian League Against Epilepsy (Perucca et al., 2006) beveelt aan om het voorschrijven van een generiek middel te overwegen en te bespreken met de patiënt bij de start van een nieuw middel (initiële monotherapie, omschakelen naar alternatieve monotherapie of start van add-on therapie), of wanneer een patiënt tijdens gebruik van een specialité niet aanvalsvrij is. Dit doet zij op grond van de weinige literatuur die er is, en op grond van het gegeven dat kleine verschillen in plasmaconcentraties kunnen leiden tot terugkeer van aanvallen bij patiënten die aanvalsvrij zijn. Bij patiënten die volledig aanvalsvrij zijn bij gebruik van een specialité, wordt aanbevolen niet van middel te veranderen.
In 2013 verscheen de 'Handleiding geneesmiddelensubstitutie' van de Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP, 2018). In deze handleiding wordt expliciet geadviseerd om bij anti-aanvalsmedicatie vanwege de indicatie epilepsie niet te substitueren.
Eén van de problemen bij substitutie is dat er geen garantie is dat steeds hetzelfde generieke middel (zelfde fabrikant) wordt afgeleverd. Als de apotheek deze garantie wel kan bieden, is het volgens de werkgroep verantwoord om één keer te wisselen naar een generiek middel. Als substitutie niet wenselijk is moet op het recept vermeld worden dat er een medische noodzaak is voor het voorschrijven van het specialité.
Tromboli et al (2018) vonden geen verandering in aanvalsfrequentie of bijwerkingen bij switchen van Keppra naar generieke levetiracetam.
Holtkamp et al (2018) evalueerden studies die de veiligheid van generieke anti-aanvalsmedicatie onderzochten. Er werd geen toename in aanvalsfrequentie of bijwerkingen bij wijziging van merk naar generiek preparaat of tussen generieke preparaten gevonden. De auteurs veronderstellen wel dat er weerstand kan zijn tegen variatie in vorm en kleur van gebruikte anti-aanvalsmedicatie waardoor minder therapie trouw.
Onderbouwing
Achtergrond
Wanneer een middel uit patent gaat, verschijnen er meestal generieke preparaten op de markt. In theorie zouden ze even goed moeten werken maar patiënten rapporteren vaak problemen: meer aanvallen of meer bijwerkingen. Randomized controlled trials (RCTs) zijn zeldzaam. Wel worden studies gerapporteerd uit verzekeringsdatabases waaruit blijkt dat switchen tot hogere uitgaven aan gezondheidszorg leidt omdat er meer aanvallen optreden.
Conclusies / Summary of Findings
|
Laag |
Er bleek geen relevant verschil te zijn in de odds voor het ontstaan van aanvalsgerelateerde events wanneer hetzelfde generieke anti-aanvalsmedicijn, werd herhaald in vergelijking met switchen naar een andere fabrikant.
(Kesselheim et al., 2016) |
|
Matig |
Er zijn geen aanwijzingen voor een klinisch relevant verschil in effectiviteit van anti-aanvalsmedicatie tussen specialité en corresponderend generiek middel. Voor de langere termijn en voor moderne anti-aanvalsmedicatie is dit onbekend.
(Kesselheim et al., 2010; Yamada & Welty, 2011) |
Samenvatting literatuur
De twee systematische reviews (Kesselheim et al., 2010; Yamada & Welty, 2011) analyseren zowel randomized controlled trials (RCTs) als observationele studies. Alleen bij de RCTs wordt een directe uitkomstmaat, de reductie in aanvalsfrequentie, gebruikt. In Yamada and Welty (2011) wordt een viertal RCTs geïncludeerd met aanvalsfrequentie als uitkomstmaat. In Kesselheim et al. (2010), worden naast deze vier RCTs, nog drie extra RCTs geïncludeerd, en tevens een meta-analyse uitgevoerd (zie tabel 1). In alle gevallen gaat het om patiënten van 10 jaar en ouder met overwegend therapiegevoelige stabiele epilepsie. Zes van de zeven RCTs zijn cross-over studies waarin patiënten in opeenvolgende periodes zowel de interventie- als controlebehandeling ondergaan. Specialités worden vergeleken met de corresponderende generieke middelen, tegretol versus carbamazepine (vier studies), dilantin versus fenytoïne (epsolin, eptoin en epileptin; één studie), Depakine versus valproaat (één studie), en een specialité versus een generieke formulering van sustained release carbamazepine (één studie). Het gaat om kleine studies (10-64 deelnemers) gepubliceerd tussen 1986 en 1997, met relatief korte studieduur variërend van 3 dagen per studiearm (één studie), tot 3 à 6 weken (vier studies), en 3 maanden (twee studies).
Aanvalsreductie
In geen van de RCTs was er sprake van een statistisch significant verschil in effectiviteit tussen specialité en corresponderend generiek middel. Een meta-analyse van de zeven RCTs (zie tabel 1) laat eveneens geen verschil in effectiviteit zien (OR: 1.0; 95% BI: 0.7-1.4). Dit beeld verandert niet na exclusie van de RCTs met lage studiekwaliteit (OR: 1.2; 95% BI: 0.6-2.2), of exclusie van studies met een follow-up duur van minder dan vier weken (OR: 0.8; 95% BI: 0.5-1.2). Geen van de studies maakt melding van veiligheidsissues of ernstige bijwerkingen bij het gebruik van generieke middelen.
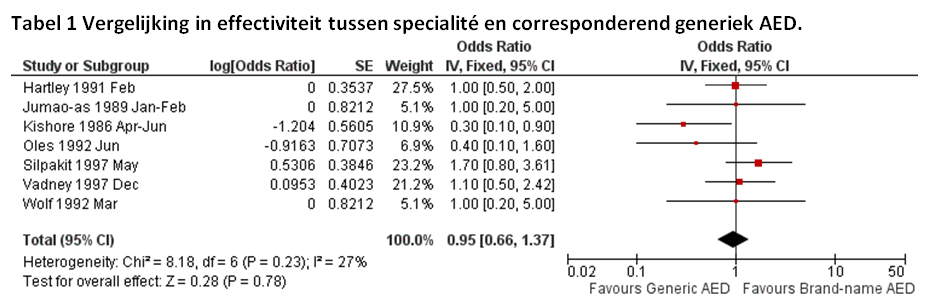
Opmerking: Effectiviteit is gebaseerd op een vergelijking van het percentage patiënten waarin sprake was van tenminste één epileptische aanval.
Bewijskracht
Bij beoordelen van de studies volgens GRADE is de bewijskracht matig voor de vergelijking tussen Tegretol en generiek carbamazepine, er zijn punten afgetrokken vanwege imprecisie (laag aantal events). Bij de vergelijking tussen Dilantin en generiek (fenytoïne, epsolin, eptoin, epileptin), en tussen Depakine en generiek valproaat, zijn extra punten afgetrokken vanwege indirectheid. De bewijskracht is in dit geval laag omdat in slechts één studie een directe vergelijking tussen deze middelen wordt gemaakt. Door de geringe omvang van de RCTs kan een klein verschil in effectiviteit tussen specialité en generieke middelen niet worden uitgesloten. Door de korte duur van de RCTs kan ook geen uitspraak worden gedaan over eventuele verschillen in effectiviteit op de langere termijn. Tenslotte ontbreken studies van recent op de markt gekomen anti-aanvalsmedicatie.
In beide systematische reviews worden naast RCTs ook observationele studies geanalyseerd (Kesselheim et al., 2010; Yamada & Welty, 2011). Hierin wordt gekeken naar niet-gevalideerde indirecte uitkomstmaten, zoals de frequentie waarmee de medicatie van patiënten wordt aangepast (‘switchback rates’), of de mate waarin epilepsiepatiënten aanspraak maken op de gezondheidszorg, voor en na introductie van een generiek alternatief. De relatie tussen deze indirecte uitkomstmaten en de effectiviteit van anti-aanvalsmedicatie in het reduceren van de aanvalsfrequentie is onduidelijk. Een hoge switchback frequentie na de introductie van een generiek anti-aanvalsmedicijn kan het gevolg zijn van een sterke voorkeur van patiënten mede ingegeven door berichtgeving in de media en anekdotisch bewijs. Een toename in het aantal doktersbezoeken na introductie van een generiek anti-aanvalsmedicijn kan het gevolg zijn van een meer intensieve begeleiding van de arts of angsten bij de patiënt zoals gebruikelijk bij de overgang op een nieuw middel. Geen van de observationele studies houdt voldoende rekening met bovenstaande en overige potentiële confounders, en de resultaten kunnen niet zonder meer gebruikt worden ter ondersteuning van de stelling dat er een verschil in effectiviteit zou bestaan tussen specialité en generieke middelen.
In een case-crossover studie is gekeken naar het risico van aanvalsgerelateerde gebeurtenissen, gerelateerd aan het doorgeven van hetzelfde generieke anti-aanvalsmedicijn versus het wisselen van fabrikant voor dat generieke anti-aanvalsmedicijn (Kesselheim et al., 2016). Hiertoe werd van 83.001 patiënten met epilepsie die een generiek anti-aanvalsmedicijn gebruikten en vanwege een epileptische aanval de eerste hulp bezochten of opgenomen werden, data uit twee grote Amerikaanse databases gebruikt. Patiënten fungeerden hierbij als hun eigen controlegroep.
Herhaling van hetzelfde generieke anti-aanvalsmedicijn was geassocieerd met een toename van 8% in de odds/kans op een aanvalsgerelateerde gebeurtenis (odds ratio (OR): 1,08; 95%-betrouwbaarheidsinterval (BI): 1,06–1,11). Er werd een toename van 9% in de odds op een aanvalsgerelateerde gebeurtenis gevonden bij het switchen naar een andere fabrikant voor het betreffende anti-aanvalsmedicijn (OR: 1,09; 95%-BI: 1,03–1,15). Het is de vraag of op grond van alleen de maat SEH-bezoek/-opname gezegd kan worden dat er geen toename of afname van de aanvalsfrequentie is geweest (Kesselheim, 2016).
Zoeken en selecteren
Er is gezocht naar literatuur waarin effectiviteit van generieke middelen en specialités wordt vergeleken bij volwassenen en kinderen, met aanvalsfrequentie en bijwerkingen als uitkomstmaat. Er is gezocht vanaf 1 januari 1999 in de databases Medline, Embase en the Cochrane Library. Uiteindelijk werden drie relevante artikelen geselecteerd. Het betreft systematische reviews van studies gepubliceerd tussen januari 1984 en augustus 2009 (Kesselheim et al., 2010) en tussen januari 1980 en oktober 2010 (Yamada & Welty, 2011). Daarnaast werd een crossover studie gevonden (Kesselheim et al., 2016).
Referenties
- Duh, M.S., Cahill, K.E., Paradis, P.E., Cremieux, P.Y., Greenberg, P.E. (2009). The economic implications of generic substitution of antiepileptic drugs: a review of recent evidence. Expert Opin. Pharmacother. 10, 2317-2328.
- Holtkamp, M., &W.H. Theodore. (2018). Generic antiepileptic drugs-Safe or harmful in patients with epilepsy? Epilepsia, 59(7), 1273-1281. DOI: 10.1111/epi.14439.
- Kesselheim, A.S., Stedman, M.R., Bubrick, E.J., Gagne, J.J., Misono, A.S., Lee, J.L., Brookhart, M.A., Avorn, J., Shrank, W.H. (2010). Seizure outcomes following the use of generic versus brand-name antiepileptic drugs: a systematic review and meta-analysis. Drugs 70, 605-21.
- Kesselheim, A. S., Bykov, K., Gagne, J. J., Wang, S. V., & Choudhry, N. K. (2016). Switching generic antiepileptic drug manufacturer not linked to seizures: A case-crossover study. Neurology, 87(17), 1796-1801. doi: 10.1212/wnl.0000000000003259
- KNMP (Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie) (2018). Handeleiding Geneesmiddelensubstitutie. Den Haag: KNMP Geneesmiddel Informatie Centrum. https://www.knmp.nl/patientenzorg/geneesmiddelen/handleiding-geneesmiddelsubstitutie
- Liow, K., Barkley, G.L., Pollard, J.R., Harden, C.L., Bazil, C.W. (2007). Position statement on the coverage of anticonvulsant drugs for the treatment of epilepsy. Neurology 68;1249-1250.
- National Institute for Health and Clinical Excellence (NICE). (2012). The Epilepsies: the diagnosis and management of the epilepsies in adults and children in primary and secondary care, Nice Clinical Guideline 137. London: National Institute for Health and Clinical Excellence.
- Perucca, E., Albani, F., Capovilla, G., Dalla Bernardina, B., Michelucci,R., Zaccara, G. (2006). Recommendations of the Italian League Against Epilepsy Working Group on Generic Products of Antiepileptic Drugs. Epilepsia, 47(Suppl. 5), 16–20.
- Trimboli, M., E. Russo, L. Mumoli, G. Tripepi, F. Fortunato, G. Mastroianni, . . . A. Labate.(2018). Brand-to-generic levetiracetam switching: a 4-year prospective observational real-life study. Eur J Neurol, 25(4), 666-671. DOI: 10.1111/ene.13568.
- Yamada, M., Welty, T.E. (2011). Generic substitution of antiepileptic drugs: a systematic review of prospective and retrospective studies. Ann. Pharmacother. 45, 1406-15.
Evidence tabellen
| Interventieonderzoek (trials en cohort) | |||||||||||
| Study reference | Study characteristics | Patient characteristics | Intervention (I) | Comparison / control (C) | Follow-up | Outcome measures and effect size | Comments | ||||
|
Kesselheim et al., 2016 |
Population-based case-crossover study Setting: Generic AED users who experienced a seizure-related hospital admission or emergency room visit between 2000 and 2013. Medicaid Analytic eXtract and a US commercial health insurance database were used to analyze data. Country: USA Source of funding: No targeted funding reported.
|
Inclusion criteria: Cases were identified as patients with an emergency room (ER) visit or hospitalization for seizures using ICD-9-CM codes 345.xx (epilepsy), 333.2x (myoclonus), or 780.3x (convulsions) as the primary discharge diagnosis.20 Exclusion criteria: - Another ER visit/hospitalization for seizure in the prior 6 months - No dispensing of an eligible AED during the prior 6 months - No dispensing of an eligible AED during at least 1 of the study periods - excluded subsequent episodes within the same patients N= 83,001 generic AED users Intervention group: N= 83,001 generic AED users Mean age ± SD: 34.12 ± 17.61 Sex: 46,3% M / 53,7% F Other important characteristics: Hospitalization primary diagnosis: - Epilepsy: 68,12% - Myoclonus: 0,25% - Convulsions: 18,21% |
Describe intervention (treatment/procedure/test): Exposure to a refill during days 2-36 preceding the seizure-related event was compared to exposure during days 51-85 (control period). |
Describe control (treatment/procedure/test): Patients served as their own controls. |
Endpoint of follow-up: 85 days after seizure-event For how many participants were no complete outcome data available: none Significant differences between groups?: No, patients served as their own controls |
Generic AED refilling was associated with an 8% increase in the odds of seizure-related events (odds ratio [OR] 1.08; 95%confidence interval [CI] 1.06–1.11). The OR following a switch to a different manufacturer of the same AED was 1.09 (95% CI 1.03–1.15); however, after adjusting for the process of refilling, there was no association between switching and seizure related hospital visits (OR 1.00; 95% CI 0.94–1.07). |
Case-crossover study |
||||
| Evidence table for systematic reviews | |||||||||||
| Study reference | Design | Inclusion Criteria | Quality | Results | Comments | ||||||
|
Kesselheim, 2010 |
Systematic review and meta-analysis |
Inclusion criteria: Randomized controlled trial, or randomized cross-over trial of a brand-name drug versus a generic equivalent looking at frequency of seizures or seizure-freedom.
Exclusion criteria: none
|
Search: adequate
Selection: adequate
Quality assessment of individual studies: adequate |
Seven RCT’s were included with a total of 204 patients. In addition seven observational studies were included.
Overall OR (95% CI) for seizure control brand-name medication versus generic mediaction
All studies 1.0 (0.7-1.4)
Studies w Jadad score >3 1.2 (0.6-2.2)
Studies w followup >3 weeks 0.8 (0.5-1.2) |
|||||||
|
Yamada, 2011 |
Systematic review |
Inclusion criteria: Randomized controlled trial of a brand-name drug versus a generic equivalent looking at seizure-freedom as direct outcome measure. |
Search: adequate
Selection: adequate
Quality assessment of individual studies: adequate |
Four RCT’s were included, which were also included in Kesselheim, 2010. For results, see Kesselheim, 2010 |
|||||||
Risk of bias tabellen
| Methodology checklist - intervention studies | |||||||||||
| Study reference | There was adequate concealment of allocation | Participants receiving care were kept 'blind' to treatment allocation | Care providers were kept 'blind' to treatment allocation | Outcome assessors were kept 'blind' to participants’ exposure to the intervention | Use of unvalidated or intermediate | Selective outcome reporting on basis of the results | Loss to follow-up/incomplete outcome data described and acceptable | Analysis by intention to treat | Other limitations | Comments | |
| Kesselheim et al., 2016 | yes | no | no | no | no | yes | yes | no |
Case-crossover study |
||
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-12-2020
Beoordeeld op geldigheid : 30-05-2023
Sinds 2014 wordt eenmaal per jaar een literatuursearch per module uitgevoerd. De clusterleden beoordelen of er in de resultaten van de search artikelen zijn die aanleiding geven om de (aanbevelingen van) de module aan te passen. Tot 2020 werden de geselecteerde artikelen opgenomen in een evidence tabel, en indien door de werkgroep voldoende relevant bevonden, werden de aanbevelingen inhoudelijk aangepast. Sinds 2020 is overgegaan tot modulair onderhoud van richtlijnen binnen clusters (zie: https://richtlijnendatabase.nl/werkwijze.html). Na de literatuurselectie wordt tijdens een vergadering met alle clusterleden de prioritering gemaakt voor de vijf te herziene modules van dat jaar. De herziene modules worden ter commentaar en autorisatie aangeboden aan de betrokken wetenschappelijke verenigingen. Dit is een zich jaarlijks herhalende cyclus.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS) en vanuit EpilepsieNL
De volgende verenigingen en organisaties hebben medewerking verleend aan de totstandkoming van de richtlijn (in alfabetische volgorde):
- EpilepsieNL
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Nederlands Instituut van Psychologen, sectie neuropsychologie (NIP)
- Nederlandse Liga tegen Epilepsie
Doel en doelgroep
Doel
De epilepsiepatiënt in Nederland op eenduidige en wetenschappelijk onderbouwde wijze diagnosticeren en behandelen. Ter ondersteuning van de richtlijngebruiker wordt - daar waar relevant - verwezen naar de module Informatie voor patiënten. De inhoud van de patiënteninformatie valt buiten verantwoordelijkheid van de werkgroep.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Samenstelling werkgroep
Voor het ontwikkelen van de webbased richtlijn is in 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met epilepsie. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de webbased richtlijn die in november 2013 vastgesteld en geautoriseerd werd. De richtlijn wordt vanaf 2013 jaarlijks geactualiseerd. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. Eventuele mutaties in de werkgroepsamenstelling vinden plaats in overleg met de Nederlandse Vereniging voor Neurologie, de werkgroep en de betreffende beroepsvereniging. Nieuwe leden dienen te allen tijden gemandateerd te worden door de betreffende beroepsvereniging. De werkgroep wordt ondersteund door adviseurs van het Kennisinstituut van Medisch Specialisten en door een voorlichter van het EpilepsieNL.
Werkgroep
- Prof. dr. H.J.M. Majoie (voorzitter), neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze en Maastricht
- Dr. C.M. (Carin) Delsman-van Gelder, Kinderarts/kinderneuroloog, Maxima Medisch Centrum, Veldhoven (vanaf 2022)
- Drs. M.H.G. (Marjolein) Dremmen, Radioloog (subspecialisatie kinderneuroradiologie), Erasmus MC, Rotterdam (vanaf 2020)
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Dr. J. Nicolai, kinderneuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Maastricht
- Dr. P. van Vliet, neuroloog/intensivist, Haaglanden Medisch Centrum, Den Haag
- Drs. R. (Roel) van Vugt, Anesthesioloog, Sint Maartenskliniek, Nijmegen (vanaf 2020)
- Dr. A. Altinbas, neuroloog-kinderneuroloog, SEIN /LUMC, Heemstede en Leiden (vanaf 2020)
- Drs. T. Balvers, neuroloog, SEIN/LUMC, Heemstede en Leiden (vanaf 2020)
- Dr. M.A.A.M. de Bruijn, AIOS neurologie, Elisabeth-Tweesteden Ziekenhuis, Tilburg (vanaf 2020)
- Prof. Dr. E.F.I. Comans, nucleair geneeskundige, Amsterdam UMC, Amsterdam (vanaf 2020)
- Dr. T.H.P. Draak, kinderneuroloog/neuroloog, Zuyderland Medisch Centrum, Heerlen en Sittard-Geleen (vanaf 2021)
- Drs. F.M.S. Eshuis, AIOS spoedeisende geneeskunde, Catharina ziekenhuis, Eindhoven (vanaf 2020)
- Dr. F.N.G. Van ’t Hof, neuroloog, SEIN, Heemstede en Amsterdam (vanaf 2020)
- Dr. P.A.M. Hofman, (neuro)radioloog, Maastricht UMC+ en Kempenhaeghe, Heeze en Maastricht
- Dr. D. Ijff, GZ psycholoog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze
- Ir. D. Jenniskens, Community Manager EpilepsieNL, Houten (vanaf 2020)
- Dr. J.A.F. Koekkoek, neuroloog, LUMC, Leiden, en Haaglanden Medisch Centrum, Den Haag
- Dr. R.H.C. Lazeron, neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Heeze
- Dr. M. Mantione, klinisch neuropsycholoog, UMC Utrecht (vanaf 2022)
- Drs. J.B. Masselink, Ziekenhuisapotheker, Medisch Spectrum Twente, Enschede (vanaf 2020)
- G.A.P.G. van Mastrigt, HTA onderzoeker/epidemioloog B, Universiteit Maastricht
- Dr. L. M’Rabet, MT-lid Kennis en Innovatie EpilepsieNL, Houten(vanaf 2022)
- Dr. J.C. Reijneveld, neuroloog en universitair hoofddocent neurologie, SEIN en Amsterdam UMC, Heemstede en Amsterdam (vanaf 2020)
- Drs. H.E. Ronner, neuroloog, AmsterdamUMC loctie VUmc, Amsterdam
- Dr. M.K.M. van Schie, AIOS neurologie, LUMC, Leiden (vanaf 2022)
- Dr. O. Schijns, neurochirurg, Maastricht UMC+, Maastricht (vanaf 2020)
- Dr. F.M. Snoeijen-Schouwenaars, AVG, Centrum voor Epilepsiewoonzorg Kempenhaeghe, Heeze
- Dr. R.D. Thijs, neuroloog, SEIN, Heemstede en LUMC, Leiden
- Dr. N. Tolboom, nucleair geneeskundige, UMC Utrecht, Utrecht (vanaf 2020)
- Dr. S.O. Tousseyn, neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Heeze
- Drs. J. H. van Tuijl, neuroloog, Elisabeth-TweeSteden ziekenhuis, Tilburg
- Dr. A. Uiterwijk, neuroloog, Academisch Centrum voor Epileptologie, Kempenhaeghe/Maastricht UMC+, Heeze
- Dr. N.E. Verbeek, klinisch geneticus, UMC Utrecht, Utrecht
- Dr. M. Vlooswijk, neuroloog, Maastricht UMC+, Maastricht (vanaf 2020)
- Dr. I. Wegner, neuroloog, SEIN, Zwolle en Leeuwarden
Werkgroepleden tot 2020/2021:
- P.B. Augustijn, kinderneuroloog, SEIN, Heemstede (tot 2020)
- Dr. C.A. van Donselaar, neuroloog, Maasstad Ziekenhuis, Rotterdam en Kempenhaeghe, Heeze (tot 2020)
- Dr. G.J. de Haan, neuroloog, SEIN, Heemstede (plaatsvervangend voorzitter, tot 2020)
- M.C. Hoeberigs, neuroradioloog, Maastricht UMC+ en Kempenhaeghe, Heeze (tot 2020)
- Dr. F. Leijten, neuroloog, UMC Utrecht, Utrecht (tot 2021)
- Em. prof. dr. D. Lindhout, klinisch geneticus, kinderarts niet praktiserend, UMC Utrecht en SEIN, Heemstede (tot 2020)
- Dr. W. van der Meij, neuroloog, Haaglanden Medisch Centrum, Den Haag (tot 2020)
- Dr. B. Panis, kinderneuroloog, Maastricht UMC+, Maastricht (tot 2021)
Met ondersteuning van
- I. Gijselhart, bibliothecaresse, Kempenhaeghe Heeze
- L. Linssen, secretaresse opleidingen medisch specialisten, Kempenhaeghe Heeze
- Dr. J. Buddeke, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf 2020)
- Dr. M.M.J. van Rooijen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf 2022)
Belangenverklaringen
Werkgroepleden verklaren schriftelijk of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn.
|
Werkgroeplid |
Belangen |
Zo ja, welke |
Jaar ingevuld |
|
Aldenkamp, dhr. |
Ja |
Deelname aan Wetenschappelijke |
2015 |
|
Augustijn, dhr. |
Ja |
Bestuurslid en regelmatig docent |
2015, herzien 2017 |
|
Beumer, mw. D. |
Nee |
|
2017 |
|
Bruijn, mw. M. de |
|
Coördinator van de ACES studie (antibodies causing epilepsy syndromes): nationale multicenterstudie waarvoor een beurs ontvangen van het Nationaal epilepsie Fonds (principal investigator: dr. M.J. Titulaer, euroloog, Erasmus MC). |
2017 |
|
Donselaar, dhr. dr. |
Ja |
Bestuurslid Stichting Epilepsie Onderwijs Nederland, onbetaald Lid Richtlijnen Commissie Diagnostiek en behandeling van Epilepsie (NVN, vergoeding) Lid Commissie Wetenschap Beter Keten (samenwerkingsverband Erasmus MC, Fransciscus Vlietland Groep, Maasstad Ziekenhuis, onbetaald) Aandelen UCB |
2015 |
|
Gijselhart, mw. I. |
|
|
|
|
Haan, dhr. dr. |
Ja |
Staflid neurologie Erasmus MC Rotterdam Begeleiden aios-en Cursorisch onderwijs (onbetaald) Eindredacteur vakblad Epilepsie Ex- voorzitter Liga tegen Epilepsie Adviseur EVN, EpilepsieNL |
2015, herzien 2017 |
|
Hofman, dhr. Dr. |
Nee |
|
2015, herzien 2017 |
|
Kolk, mw. N. van |
|
Gastdocent Radboud Health Academy (neurologie verpleegkunde), betaald |
2017 |
|
Kolsteren, mw. E. |
Nee |
|
2015, herzien 2017 |
|
Lazeron, dr. R.H.C. |
Ja |
Ontwikkeling nachtelijk aanvalsdetectie en - alarmeringssysteem, gefinancierd door ZonMW, Nuts-Ohra fonds, EpilepsieNL, met deelname van een hiertoe opgerichte onderneming LivAssured, met hulp van de firma ImplementationIQ en met participatie van investeringsfondsen in de gezondheidszorg. Geen direct of persoonlijk financieel belang in LivAssured, ImplementationIQ of de investeringsfondsen. |
2017 |
|
Leijten, dr. F.S.S. |
Ja |
Aandelen ProLira, een start-up bedrijf dat een deliriummonitor ontwikkelt. Ontwikkeling nachtelijk aanvalsdetectie en - alarmeringssysteem, gefinancierd door ZonMW, Nuts-Ohra fonds, EpilepsieNL, met deelname van hiertoe opgerichte onderneming LivAssured met hulp van de firma ImplementationIQ en met participatie van investeringsfondsen in de gezondheidszorg. Geen direct of persoonlijk financieel belang in LivAssured, ImplementationIQ of investeringsfondsen. |
2017 |
|
Lindhout, dhr. |
Ja |
Lid Gezondheidsraad (onbetaald) Lid vaste commissie Reproductie toxische stoffen van de Gezondheidsraad (vacatiegeld) Lid ad hoc commissies Gezondheidsraad (vacatiegeld) Lid Wetenschappelijke adviesraad Lareb (vacatiegeld) Lid Wetenschappelijk adviesraad Stichting Michelle (onbetaald) Lid Medische adviesraad STSN (onbetaald) |
2015 |
|
Majoie, mw. |
Ja |
Relevante commissies: |
2017 |
|
Mastrigt, mw. G. |
|
Onderzoeker/docent Universiteit Maastricht (0,1 fte) |
2017 |
|
Nicolai, dr. J. |
Ja |
Vanuit MUMC+ gedetacheerd in St. Jansgasthuis Weert, Elkerklierk Helmond en Kempenhaeghe Heeze (in dienst MUMC+) |
2017 |
|
Panis, mw. dr. P. |
Nee |
|
2017 |
|
Pols, mw. dr. M. |
|
|
|
|
Roelfsema, dr. V |
Nee |
|
2015, herzien 2017 |
|
Tuijl, mw. J.H. van |
Ja |
Lid werkgroep richtlijn Epilepsie (onbetaald) |
2015, herzien 2017 |
|
Uiterwijk, mw. A. |
Nee |
|
2017 |
|
Veendrick, mw. |
Nee |
|
2015 |
|
Venhorst, mw. K. |
|
|
|
|
Vliet, dhr. P. van |
Nee |
|
2015, herzien 2017 |
|
Wardt, dhr. J. van |
Nee |
|
2017 |
|
Wegner, mw. dr. I |
Ja |
Houden van wetenschappelijke voordrachten, voor een deel onbetaald, maar er zijn ook enkele voordrachten waarvoor de werkgever (SEIN) een financiële bijdrage heeft ontvangen van de firma UCB als vergoeding voor gemaakte uren. Dit alles volgens de officieel hiervoor geldende wet- en regelgeving. |
? |
|
Wijnen, dhr. B. |
|
|
|
|
Zijlmans, mw. |
Ja |
Commissielid communications committee international league against epilepsy (onbetaald) |
2015, herzien 2017 |
Inbreng patiëntenperspectief
Er wordt aandacht besteed aan het patiëntenperspectief door het betrekken van de Epilepsievereniging Nederland in commentaarfases. Bij de richtlijn is een module met patiëntinformatie ontwikkeld. Deze is geautoriseerd door de Epilepsie Vereniging Nederland en de Nederlandse Vereniging voor Neurologie.
Methode ontwikkeling
Evidence based
Werkwijze
Algemeen
AGREE
Deze richtlijn is opgesteld en wordt bijgehouden conform de eisen in het rapport ‘Richtlijnen 2.0’ van de adviescommissie Richtlijnen van de Raad WOK. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/). Dit is een internationaal breed geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Uitgangsvragen en uitkomstmaten
Op basis van de lijst met onderwerpen stellen de werkgroepleden en de adviseur concept-uitgangsvragen op. Deze worden met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen vaststelt. Vervolgens inventariseert de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn. Hierbij wordt zowel naar gewenste als ongewenste effecten gekeken. De werkgroep waardeert deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieert de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vindt, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er wordt eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews in PubMed en voor specifieke onderwerpen in the Cochrane Library, Embase en Psychinfo. Vervolgens wordt voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens wordt aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie wordt gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteren de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen worden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden onder ‘zoekstrategie’ van de desbetreffende uitgangsvraag.
Voor een aantal vragen is de recente Engelse evidence based richtlijn ‘The epilepsies’ van het NICE (National Institute of Clinical Excellence) als basis gebruikt.
Kwaliteitsbeoordeling individuele studies
Individuele studies worden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de evidence tabel.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen worden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur worden beschreven in de samenvatting van de literatuur. Bij een aantal interventievragen worden bij voldoende overeenkomsten tussen de studies de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen
De kracht van het wetenschappelijke bewijs wordt bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/) (Atkins et al, 2004) (zie tabel 1).
Tabel 1. GRADE-indeling van kwaliteit van studies per uitkomstmaat
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
1. Studiebeperkingen 2. Inconsistentie 3.Indirectheid 4. Imprecisie 5. Publicatiebias |
1. Groot effect 2. Dosis-respons relatie 3. Plausibele confounding |
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkende studie (bijvoorbeeld: patëntencontrole onderzoek, cohortonderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (bijvoorbeeld: case series of case reports) |
||
|
RCTs beginnen 'hoog'(4), observationele studies beginnen 'laag'(2) |
|||
Formuleren van conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose wordt het wetenschappelijke bewijs samengevat in één of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt de conclusie getrokken op basis van alle studies samen (body of evidence). Hierbij maken de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans worden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Voor een conclusie die gebaseerd is op (een) studie(s) die niet uit een systematisch literatuuronderzoek naar voren is/zijn gekomen, wordt geen niveau van bewijskracht bepaald. In een dergelijk geval staat bij de conclusie "geen beoordeling" vermeld.
Tabel 2. Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggend bewijs
|
Niveau |
Conclusie gebaseerd op |
|
Hoog |
Onderzoek van niveau A1 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken |
|
Matig |
één onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
Laag |
één onderzoek van niveau B of C |
|
Zeer laag |
Mening van deskundigen |
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn wordt expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn zijn er interne en externe kwaliteitsindicatoren ontwikkeld. Het doel van de indicatoren is om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroepleden is gevraagd om bestaande indicatoren en indicatoren gebaseerd op aanbevelingen uit de richtlijn te scoren op relevantie en registreerbaarheid. De indicatoren die het hoogst scoorden, zijn in de (concept)richtlijn opgenomen. Een overzicht treft u aan in de bijlage Indicatoren. De indicatoren zijn ook terug te vinden bij de betreffende uitgangsvraag.
Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Lacunes in kennis
De zorg voor patiënten met epilepsie kent nog veel aspecten waarover onzekerheid bestaat wat als optimaal kan worden aangewezen. In vrijwel alle modules van de richtlijn ‘Epilepsie’ zijn lacunes in kennis te onderkennen. Het is daarom zeer gewenst dat er verder wetenschappelijk onderzoek plaatsvindt naar de zorg voor patiënten met epilepsie. De werkgroep inventariseert de lacunes in kennis breed en heeft een aantal onderwerpen benoemd waarvan zij van mening is dat onderzoek hiernaar prioriteit verdient. Een overzicht treft u aan in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De richtlijn is in 2013 aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Vanaf 2013 wordt de richtlijn jaarlijks geactualiseerd (zie onder Herziening). De werkgroep doet aan het einde van het jaar een voorstel met welke modules zij denkt dat een commentaarronde nodig is aan de commissie Kwaliteit/subcommissie Richtlijnen van de Nederlandse Vereniging voor Neurologie (NVN). Hierbij is het uitgangspunt dat alleen die wijzigingen die eventueel tot discussie binnen de diverse beroepsgroepen kunnen leiden ter commentaar en tevens ter autorisatie voorgelegd worden. Alle andere wijzigingen worden doorgevoerd onder eigen verantwoordelijkheid van de werkgroep. De subcommissie Richtlijnen van de NVN beslist uiteindelijk welke modules aan de betrokken beroepsverenigingen worden voorgelegd. Voor die modules wordt eerst een commentaarfase gestart. Al het commentaar dat digitaal binnenkomt wordt gebundeld en in de werkgroep besproken en eventueel verwerkt in de richtlijnmodule. Vervolgens worden de aangepaste modules van de richtlijn voor autorisatie aangeboden. Bij akkoord van de beroepsverenigingen worden de geactualiseerde teksten definitief gepubliceerd op de website. De beroepsverenigingen worden hiervan op de hoogte gebracht.
Nieuwe uitgangsvragen
Als gebruikers van de richtlijn een belangrijk onderwerpen missen, kunnen zij een suggestie voor een nieuwe uitgangsvraag aanleveren bij de werkgroep (met motivering). De werkgroep zal jaarlijks de ontvangen suggesties bespreken en besluiten welke vragen opgenomen worden in de richtlijn.
Economische evaluaties
Doelmatigheid van behandeling
Sinds mei 2016 wordt aan de richtlijn ook kennis over de doelmatigheid (kosteneffectiviteit) van de epilepsiebehandeling meegenomen, ook wel economische evaluatie genoemd. Om deze kennis te verkrijgen is een systematische literatuur studie uitgevoerd (Wijnen et al., 2017, Wijnen et al., 2015). De gebruikte methodologie om de economische evaluaties in te bouwen in klinische richtlijnen is beschreven in een drietal papers (Wijnen et al., 2016, Mastrigt van et al., 2016, Thielen et al., 2016).
Databases
In MEDLINE (via PubMed), EMBASE en NHS economische evaluatie Database (NHS EED) is gezocht op kosteneffectiviteitsstudies. Voor bestaande systematische reviews, werden Cochrane Reviews, Cochrane DARE en Cochrane Health Technology Assessment Databases gebruikt.
Zoekstrategieën
Voor de identificatie van relevante studies zijn vooraf gedefinieerde klinische zoekstrategieën gecombineerd met een gevalideerd zoekfilter van McMaster University om economische evaluaties te identificeren (McMaster). Bij de zoekstrategieën hebben we ons beperkt tot therapeutische interventies.
Beoordeling van de studies
Om te beoordelen of de economische evaluaties kunnen worden opgenomen in de richtlijn is iedere gevonden studie beoordeeld aan de hand van zeven vragen. In deze pdf is de uitwerking van de verschillende vragen te vinden. Deze vragen zijn gebaseerd op de Consensus on Health Economics Criteria checklist (Evers et al., 2005) en de Welte transferability checklist (Welte et al., 2004).
Referenties
- Atkins, D., Best, D., Briss, P.A., Eccles, M., Falck-Ytter, Y., Flottorp, S., Guyatt, G.H., Harbour, R.T., Haugh, M.C., Henry, D., Hill, S., Jaeschke, R., Leng, G., Liberati, A., Magrini, N., Mason, J., Middleton, P., Mrukowicz, J., O’Connell, D., Oxman, A.D., Phillips, B., Schünemann, H.J., Edejer, T.T., Varonen, H., Vist, G.E., Williams, J.W. Jr, Zaza, S. GRADE Working Group. (2004). Grading quality of evidence and strength of recommendations. BMJ Jun; 19, 328(7454):1490.
- van Everdingen, J.J.E., Burgers, J.S., Assendelft, W.J.J., Swinkels, J.A., van Barneveld, T.A., van de Klundert, J.L.M. (2004). Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum.
- Evers, S., Goossens, M., De Vet, H., Van Tulder, M., Ament, A. (2005). Criteria list for assessment of methodological quality of economic evaluations: Consensus on Health Economic Criteria. International journal of technology assessment in health care. 21(02):240-245.
- van Mastrigt, G. A., Hiligsmann, M., Arts, J. J., Broos, P. H., Kleijnen, J., Evers, S. M., & Majoie, M. H. (2016). How to prepare a systematic review of economic evaluations for informing evidence-based healthcare decisions: a five-step approach (part 1/3). Expert Rev Pharmacoecon Outcomes Res (Nov 2), 1-16. doi: 10.1080/14737167.2016.1246960.
- McMaster University. (2016, Feb 09). Search Strategies for EMBASE in Ovid Syntax, from http://hiru.mcmaster.ca/hiru/HIRU_Hedges_EMBASE_Strategies.aspx.
- Thielen, F. W., Van Mastrigt, G., Burgers, L. T., Bramer, W. M., Majoie, H., Evers, S., & Kleijnen, J. (2016). How to prepare a systematic review of economic evaluations for clinical practice guidelines: database selection and search strategy development (part 2/3). Expert Rev Pharmacoecon Outcomes Res (Nov 2), 1-17. doi: 10.1080/14737167.2016.1246962.
- Welte, R., Feenstra, T., Jager, H., & Leidl, R. (2004). A decision chart for assessing and improving the transferability of economic evaluation results between countries. Pharmacoeconomics, 22(13), 857-876.
- Wijnen, B., van Mastrigt, G., Evers, G., Gershuni, O., Lambrechts, D., Majoie, H., & De Kinderen, R. (2015). Review of economic evaluations of treatments for patients with epilepsy. Prospero: International prospective register of systematic reviews. Retrieved from http://www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD42015019278.
- Wijnen, B., van Mastrigt, G., Redekop, W. K., Majoie, H., de Kinderen, R., & Evers, S. (2016). How to prepare a systematic review of economic evaluations for informing evidence-based healthcare decisions: data extraction, risk of bias, and transferability (Part 3/3). Expert Rev Pharmacoecon Outcomes Res (Oct 21). doi: 10.1080/14737167.2016.1246961.
- Wijnen, B. F., van Mastrigt, G. A., Evers, S. M., Gershuni, O., Lambrechts, D. A., Majoie, M. H., . . . de Kinderen, R. J. (2017). A systematic review of economic evaluations of treatments for patients with epilepsy. Epilepsia. doi: 10.1111/epi.13655.
