Nabehandeling gestabiliseerde enkelfractuur
Uitgangsvraag
Wat is de optimale nabehandeling van een operatief gestabiliseerde enkelfractuur?
Deelvragen
- Wat zijn de (on)gunstige effecten van immobilisatie versus geen immobilisatie als nabehandeling van een operatief behandelde enkelfractuur?
- Wat zijn de (on)gunstige effecten van belasten versus niet belasten als nabehandeling van een operatief behandelde enkelfractuur?
Aanbeveling
Kies bij relatief jonge, gezonde patiënten die instructies willen en kunnen opvolgen voor een oefenstabiele nabehandeling van operatief gestabiliseerde enkelfracturen, waarbij na goede wondgenezing eventueel belast kan worden met bescherming van een orthese.
Overweeg bij patiënten op hogere leeftijd en/of met co-morbiditeit een beschermende immobilisatie.
Overwegingen
Er bestaat geen eenduidigheid over de optimale nabehandeling van operatief gestabiliseerde enkelfracturen. Idealiter is er een zo snel mogelijk herstel van functioneren op het niveau van voor de fractuur, met zo min mogelijk complicaties.
De praktische invulling van een vroege enkelmobilisatie (VEM) wordt verschillend geïnterpreteerd, waardoor de resultaten soms lastig zijn te vergelijken. De werkgroep definieert een oefenstabiele nabehandeling als een behandeling gericht op vroeg oefenen zonder gips, eventueel voorafgegaan door een korte (één tot twee weken) immobilisatie in het kader van de wondgenezing. Essentieel voor een veilige oefenstabiele nabehandeling en eventueel vroegtijdig belasten is een goede selectie van geschikte patiënten. Daarbij zijn zowel patiëntkarakteristieken (leeftijd en comorbiditeit) als het type fractuur van belang (zie de module ‘Enkelfracturen met ernstige comorbiditeit’).
Hoewel het niet duidelijk uit de beschreven publicaties over de nabehandeling van geopereerde enkelfracturen naar voren komt hebben deze zich in het algemeen beperkt tot gezonde patiënten met een leeftijd van 18 tot 65 jaar en een stabiele situatie na osteosynthese; veelal fibulafracturen ter hoogte van de syndesmose en zonder relevant posterieur fragment. Deze uitgangsvraag zal zich derhalve hiertoe beperken. In de literatuuranalyse op basis van de review van Keene (2014) en de toegevoegde studies van Siddique (2005) en Van Laarhoven (1996) is gekeken naar de effecten van vroege enkelmobilisatie en eventueel vroegtijdig belasten (al dan niet zonder gips). In vrijwel alle studies met een vroege enkelmobilisatie was er wel sprake van bescherming in de vorm van een afneembare spalk.
De literatuuranalyse suggereert dat het risico op oppervlakkige en diepe infecties, en heroperaties ten gevolge van een complicatie verhoogd zijn bij vroege enkelmobilisatie vergeleken met immobilisatie, zowel in de belaste als de onbelaste subgroepen. Dit wordt echter niet bevestigd in een recente review van Smeeing (2015) waarin ook niet-gerandomiseerde studies zijn meegenomen. De literatuuranalyse suggereert tevens dat het functionele herstel op korte termijn (negen tot twaalf weken) beter is na VEM vergeleken met immobilisatie. Na één jaar zijn de functionele resultaten in alle groepen gelijk. Uit de studie van Smeeing blijkt dat zowel VEM leidt tot een snellere terugkeer naar professionele werkzaamheden en dagelijkse activiteiten vergeleken met immobilisatie, als vroeg belasten vergeleken met laat belasten. Een nadeel is dat niet goed beschreven is wat in de acht geïncludeerde studies wordt verstaan onder ‘vroeg’ en ‘laat’ belasten, waardoor het mogelijk een zeer heterogene groep betreft. Een bijkomend voordeel van een snelle oefenstabiele nabehandeling is dat er mogelijk een kleinere kans is op het ontwikkelen van een diep veneuze trombose. Bovendien is een oefenstabiele behandeling in de praktijk prettig omdat een normale (sport)schoen gedragen kan worden en zonder gips gedoucht kan worden. Ten slotte komt uit de review van Keene (2014) naar voren dat vroegtijdig bewegen leidt tot significant minder pijn op korte termijn. Chronische pijnklachten worden niet beschreven.
Gul (2007) heeft retrospectief een cohort patiënten onderzocht dat direct volledig mocht belasten zonder gips en dit vergeleken met een historisch cohort dat onbelast was nabehandeld in gips. Hieruit bleek geen verschil in functionele uitkomst en postoperatieve pijn, maar wel in terugkeer naar werkzaamheden in het voordeel van de patiënten die direct zonder gips mochten belasten. Er was geen verschil in complicaties. De auteurs geven aan dat direct postoperatief onbeschermd belasten op geleide van de klachten bij geselecteerde patiënten een veilige keuze is.
Er zijn geen studies gepubliceerd naar de effecten van de verschillende nabehandelingen van geopereerde enkelfracturen, waarbij er sprake was van een proximale (Weber C) fibulafractuur en/of posterieur fragment. Bij significante betrokkenheid van het gewichtdragende deel van het tibiaplafond kan direct belasten leiden tot een dislocatie van het posterieure fragment en daarmee mogelijk een slechtere uitkomst. Gangbaar is om hierbij 25% van het tibio-talaire oppervlak als grens aan te houden.
Concluderend lijkt vroegtijdig oefenen na fixatie van een enkelfractuur bij relatief jonge, gezonde patiënten vergeleken met immobilisatie te leiden tot een iets betere functie op de korte termijn en eerder hervatten van de werkzaamheden. Dit gaat mogelijk wel gepaard met een licht verhoogde kans op complicaties. Gezien de grote nadelige consequenties van een postoperatieve infectie raadt de werkgroep aan laagdrempelig te kiezen voor immobilisatie tot wondgenezing is opgetreden. Tevens wordt aanbevolen bij deze patiënten tijdens het belasten (na wondgenezing) bescherming aan te bieden in de vorm van een afneembare brace of walker. Direct onbeschermd belasten op geleide van klachten kan mogelijk ook zonder een verhoogde kans op complicaties, maar dit dient nog verder onderzocht te worden. Bij patiënten met een verhoogde kans op complicaties, zoals een hogere leeftijd of comorbiditeit (bijvoorbeeld osteoporose, perifeer vaatlijden, obesitas of diabetes mellitus) lijkt immobilisatie veiliger.
Onderbouwing
Achtergrond
Er bestaat controverse over de optimale nabehandeling van operatief gestabiliseerde enkelfracturen. Het belangrijkste doel is optimaal functioneel herstel met minimale complicaties. De, in de literatuur beschreven, nabehandeling varieert van (onbelast) oefenen zonder immobilisatie tot (volledig) belasten (met immobilisatie). Potentiële voordelen van immobilisatie zijn minder kans op wondcomplicaties en secundaire dislocatie. Potentiële voordelen van functionele nabehandeling zijn sneller herstel van de beweeglijkheid van het enkelgewricht, meer comfort voor de patiënt en minder atrofie.
Conclusies / Summary of Findings
Functionele uitkomsten
|
Laag GRADE |
Er zijn voorzichtige aanwijzingen dat vroegtijdig bewegen (belast of onbelast) het functioneren na negen tot 12 weken verbetert ten opzichte van immobilisatie (belast of onbelast). Na een jaar is het functioneren gelijk in beide groepen.
Bronnen (Keene, 2014; Siddique, 2005) |
Complicaties
|
Laag GRADE |
Er zijn voorzichtige aanwijzingen dat het risico op oppervlakkige en diepe infecties en op heroperatie in verband met een complicatie verhoogd is bij vroegtijdig bewegen ten opzichte van immobilisatie.
Bronnen (Keene, 2014) |
|
Laag GRADE |
Het is onduidelijk of er een verschil is in het risico op een veneuze trombo-embolie bij vroegtijdig bewegen ten opzichte van immobilisatie.
Bronnen (Keene, 2014) |
Overige uitkomsten
|
Zeer laag GRADE |
Het is onduidelijk of er na één jaar een verschil is tussen onbelaste nabehandeling zonder immobilisatie ten opzichte van immobilisatie met belasten voor de functionele uitkomsten, oppervlakkige infecties en tijd tot terugkeer naar werk.
Bronnen (Van Laarhoven, 1996) |
Samenvatting literatuur
Beschrijving studies
Keene (2014) heeft een zoekactie uitgevoerd tot juni 2013. In totaal werden veertien RCTs uit de periode van 1982 tot 2013 geïncludeerd. Drie studies bestonden alleen uit een conferentie-verslag waardoor uiteindelijk elf studies in de meta-analyse werden opgenomen. Functionele uitkomsten en complicaties werden kwantitatief geanalyseerd, kwaliteit van leven en tijd tot terugkeer naar werk/vrije tijd en patiënt-tevredenheid werden kwalitatief beschreven.
Alle geïncludeerde studies vergeleken een interventie waarbij vroege beweging van de enkel mogelijk was (vroege enkel mobilisatie, VEM) met immobilisatie voor zes weken. VEM varieerde in de verschillende studies van meteen bewegen na de operatie, bewegen na drie dagen immobilisatie, bewegen tot twee weken, bewegen na twee weken, waarbij het beweeg-protocol soms met onder supervisie van een fysiotherapeut werd uitgevoerd. Voor de specifieke protocollen per studie kunt u de evidence tabel raadplegen. Binnen de individuele studies was de mate van belasting in beide groepen identiek, echter tussen de studies onderling bestonden hierin grote verschillen. Het effect van deze verschillen werd onderzocht in de subgroep analyses. Alle studies hadden een hoog risico op bias, aangezien de geïncludeerde studies slecht rapporteerden over blindering, het randomisatie-proces en vooraf vastgestelde uitkomstmaten. Verder moeten de gepoolde resultaten voorzichtig geïnterpreteerd worden vanwege de gemixte soorten interventies in de VEM-groep.
Siddique (2005) vergeleek immobilisatie (zes weken gips) met mobilisatie (geen gips). Beide groepen mochten na vier weken gedeeltelijke belasting toepassen en indien mogelijk naar volledige belasting overgaan. Een niet-geblindeerde onderzoeker onderzocht de patiënten, zowel klinisch als radiologisch. De functionele uitkomsten werden met de Olerud & Molander Ankle Score vastgesteld na zes en twaalf weken, net als bij de studies die in Keene (2014) werden geïncludeerd. Daarom kon deze uitkomst toegevoegd worden aan de meta-analyse. Andere uitkomsten (pijn) konden niet gepoold worden met de systematic review van Keene (2014). Het is niet duidelijk waarom de studie van Siddique (2005) niet is geïncludeerd in de review van Keene (2014).
Van Laarhoven (1996) vergeleek 41 patiënten behandeld middels gips-immobilisatie met belasting (niet gespecificeerd) ten opzichte van 40 patiënten onbelast op krukken zonder gips, waarbij ook deze groep postoperatief eerst met twee tot vijf dagen gips werd behandeld. Aangezien deze interventies verschillen ten opzichte van de systematic review van Keene, 2014 werd deze studie niet toegevoegd aan de meta-analyse. De patiënten werden tien tot veertien dagen, zes weken, drie maanden en een jaar na de operatie gezien. Functionele uitkomsten werden met een aangepaste Olerud & Molander Ankle Score gemeten.
Resultaten
De resultaten van de subgroepen belasten versus onbelasten worden hieronder beschreven; voor de resultaten van VEM versus enkel-immobilisatie van beide subgroepen samen kunt u de evidence tabel raadplegen.
Functionele uitkomsten
De studie van Siddique (2005) is in de analyse van functionele uitkomsten van negen tot twaalf weken toegevoegd aan de subgroep Belasten van de meta-analyse van Keene (2014) (zie figuur 1). Alle functionele uitkomsten werden met de Olerud & Molander Ankle Score gemeten.
Figuur 1 Meta-analyse functionele uitkomsten na negen tot 12 weken: belasten versus niet belasten
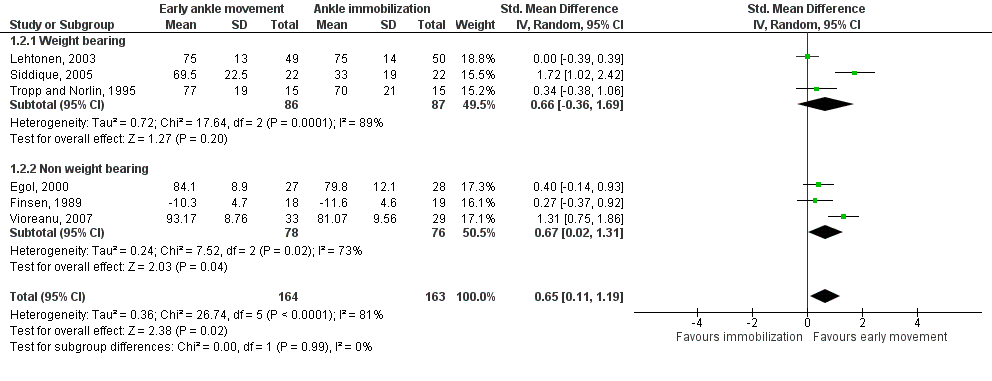
In de subgroep waarbij geen belasting was toegestaan, werd na negen tot twaalf weken een gestandaardiseerd gemiddeld verschil (SMD) van 0,67 gerapporteerd (n=154, 95%BI van 0,02 tot 1,31, significant) in het voordeel van de VEM-groep. Volgens Cohen (1988) kan een SMD van 0,2 gezien worden als klein, 0,6 als gemiddeld en 0,8 als groot. Hier gaat het dus om een gemiddelde verbetering.
De uitkomsten na één jaar verschilden niet tussen de subgroepen immobilisatie versus VEM en ook niet tussen de belaste en onbelaste groep. Voor details en overige resultaten kunt u de evidence-tabel raadplegen.
In de studie van Van Laarhoven (1995) werd in de onbelaste, niet-geïmmobiliseerde groep met krukken na drie maanden een score van 80 gevonden en in de belaste, geïmmobiliseerde groep een score van 85 (aangepaste Olerud & Molander Ankle Score). Beide groepen scoorden 95/100 één jaar na de operatie (p=0,90).
Complicaties
Diepe wondinfecties
In de subgroep waarbij belasting was toegestaan, werd een peto-odds-ratio van 7,25 gevonden (n=98, 95%BI van 0,98 tot 53,41, niet significant) in het voordeel van de immobilisatiegroep.
In de onbelaste subgroep, werd een peto-odds-ratio van 6,75 gevonden (n=118, 95% BI van 0,41 tot 111,14, niet significant) in het voordeel van de immobilisatiegroep.
Oppervlakkige wondinfecties
In de subgroep waarbij belasting was toegestaan, werd een relatief risico gevonden van 3,23 (n=135, 95%BI van 1,29 tot 8,09, significant) in het voordeel van de immobilisatiegroep. In de onbelaste subgroep werd een relatief risico gevonden van 1,48 (n=161, 95%BI van 0,33 tot 6,61, significant) in het voordeel van de immobilisatiegroep ten opzichte van de VEM-groep.
In de studie van Van Laarhoven werden oppervlakkige infecties gerapporteerd. In de onbelaste, niet-geïmmobiliseerde groep was dit 5% (2/40) en in de belaste, geïmmobiliseerde groep was dit 10% (4/41). Andere complicaties werden niet gespecificeerd tussen de groepen.
Veneuze trombo-embolie
In de subgroep waarbij belasting was toegestaan, werd een peto-odds-ratio gevonden van 0,12 (n=128, 95%BI van 0,01 tot 1,96, niet significant) in het voordeel van de VEM-groep. In de groep zonder belasting van de enkel werd een niet significant verschil gerapporteerd met een peto-odds ratio van 0,12 (n=117 met een 95%BI van 0,01 tot 1,19) in het voordeel van de VEM-groep.
Heroperatie in verband met diepe infectie of falen van fixatie
In de belaste subgroep werd een peto-odds-ratio gerapporteerd van 6,16 (n=127 met een 95%BI van 1,33 tot 28,50) in het voordeel van de immobilisatiegroep. In de onbelaste subgroep werd een peto-odds-ratio gevonden van 7,54 (n=193, 95%BI van 0,77 tot 73,99, niet significant), ook ten gunste van de immobilisatie-groep. Na samenvoegen van de subgroepen bleken acht patiënten uit de VEM-groep in verband met gefaalde fixatie en twee in verband met een diepe infectie geheropereerd te zijn. (5.1%; 10/198). In de geïmmobiliseerde groep was dit in totaal één patiënt (0.5%; 1/192) in verband met gefaalde fixatie. Dit gaf een Peto-odds ratio van 6.56 (95%BI: 1.84 tot 23.41, n=290). Verwijderen van het osteosynthesemateriaal vanwege andere redenen werd niet geanalyseerd in de studies.
Overige uitkomstmaten
De uitkomstmaten voor terugkeer naar werk, patiënttevredenheid en pijn na de operatie werden alleen kwalitatief beschreven en konden niet gepoold worden. Zes studies beschreven pijnbeleving binnen drie maanden na operatie, waarbij drie van de zes studies een significant verschil vonden in pijnbeleving ten gunste van de VEM-groep en de drie andere studies niet.
Drie studies vonden een significant verschil (niet gespecificeerd) in het voordeel van de VEM-groep wat betreft tijd tot terugkeer naar werk. Twee studies vonden geen significant verschil tussen de VEM- en immobilisatiegroep. Twee studies rapporteerden een kortere terugkeertijd (niet verder gespecificeerd) naar het werk voor de VEM-groep maar gaven geen informatie over significantie. In de studie van Van Laarhoven werd terugkeer naar werk gerapporteerd, hierin werd geen verschil tussen de groepen gevonden.
Kwaliteit van leven werd in drie studies beschreven, waarbij twee studies een verschil vonden in het voordeel van VEM-groep in de laatste en vond geen statistisch significant verschil (niet verder gespecificeerd). Twee studies beschreven patiënttevredenheid, waarbij één studie een verschil vond in het voordeel van de VEM-groep (er werden geen data gerapporteerd) en de andere studie beschreef dat patiënten in de VEM-groep meer tevreden waren na een week, maar dat er geen verschillen waren tussen de groepen na een dag of na zes weken. De specifieke details kunt u teruglezen in de evidence-tabel.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten van complicaties is gestart op hoog, vanwege de systematische review op basis van RCTs. Vervolgens is de bewijskracht met twee niveaus verlaagd naar lage bewijskracht gezien de inconsistentie in definitie van VEM tussen de studies en de beperkingen in de onderzoeksopzet van de geïncludeerde RCTs.
De bewijskracht voor de uitkomstmaat functionele uitkomsten is gestart op hoog, vanwege de systematische review op basis van RCTs. De bewijskracht werd met één niveau verlaagd gezien de inconsistentie in definitie van VEM tussen de studies en vervolgens met twee niveaus verlaagd tot zeer lage bewijskracht gezien de beperkingen in de onderzoeksopzet van de geïncludeerde RCTs.
De bewijskracht voor de overige uitkomstmaten (pijn, terugkeer naar werk en patiënttevredenheid) werden niet gegradeerd omdat er te weinig informatie beschikbaar was om hier een conclusie over te formuleren.
De bewijskracht voor de uitkomstmaten in de vergelijking van onbelaste, niet-geïmmobiliseerde nabehandeling ten opzichte van belaste, geïmmobiliseerde nabehandeling (Van Laarhoven, 1996), werd gestart op hoge bewijskracht vanwege de gerandomiseerde studie-opzet, waarna de bewijskracht werd verlaagd naar zeer lage bewijskracht gezien de imprecisie (laag aantal patiënten) en de beperkingen in de onderzoeksopzet (randomisatie op datum, niet volgen van intention-to-treat analyse).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstellingen:
1. Wat zijn de (on)gunstige effecten van immobilisatie versus geen immobilisatie als nabehandeling van een operatief behandelde enkelfractuur?
P patiënten die operatief behandeld zijn in verband met een enkelfractuur;
I immobilisatie;
C geen immobilisatie / functionele nabehandeling;
O pijn, functioneren, complicaties, terugkeer naar werk/sport.
2. Wat zijn de (on)gunstige effecten van belasten versus niet belasten als nabehandeling van een operatief behandelde enkelfractuur?
P patiënten die operatief behandeld zijn in verband met een enkelfractuur;
I belasten tijdens nabehandeling;
C niet belasten tijdens nabehandeling;
O pijn, functioneren, complicaties (infecties en secundaire dislocatie), terugkeer naar werk/sport.
Relevante uitkomstmaten
De werkgroep achtte functioneren, pijn, complicaties (infecties en secundaire dislocatie) voor de besluitvorming kritieke uitkomstmaten; en terugkeer naar werk/sport, artrose voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde tien punten als een klinisch relevant verschil op de functionele uitkomstscores.
Zoeken en selecteren (Methode)
In de databases Medline (OVID) en Embase is op 30 september 2015 met relevante zoektermen gezocht naar systematische reviews en (gerandomiseerd) gecontroleerd onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 407 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: volwassenen met een operatief behandelde enkelfractuur met tenminste twintig proefpersonen. Exclusiecriteria waren pilotstudies en conference abstracts waarvan geen volledige publicatie beschikbaar was. Er werden in totaal drie systematische reviews gevonden. De review van Smeeing (2015) beschreef in mindere mate uitkomsten over complicaties en de review van Lin (2012) is geëxcludeerd omdat deze minder recent was. Daarom is gekozen om de systematische review van Keene (2014) als uitgangspunt te nemen. De review van Keene (2014) onderzocht dezelfde PICO als vastgesteld voor deze module en had een zoekactie tot juni 2013. Zodoende werd deze review geïncludeerd voor het beantwoorden van de uitgangsvraag en geüpdatet met (gerandomiseerd) gecontroleerd onderzoek uit de literatuurzoekactie van deze module tot 30 september 2015. Op basis van titel en abstract werden in eerste instantie in totaal zestien studies geselecteerd. Na raadpleging van de volledige tekst, werden vervolgens dertien studies geëxcludeerd (zie exclusie-tabel) en drie studies definitief geselecteerd.
Resultaten
Drie onderzoeken zijn opgenomen in de literatuuranalyse (Keene, 2014; Siddique, 2005; van Laarhoven, 1996). De evidence-tabel hiervan en beoordeling van individuele studiekwaliteit kunt u in onder het tabblad Onderbouwing vinden.
Referenties
- Cohen J. Statistical Power Analysis for the Behavioral Sciences. Second ed. Hillsdale, NJ: Erlbaum; 1988.
- Gul A, Batra S, Mehmood S, et al. Immediate unprotected weight-bearing of operatively treated ankle fractures. Acta Orthop Belg. 2007;73(3):360-5. PubMed PMID: 17715727.
- Keene DJ, Williamson E, Bruce J, et al. Early ankle movement versus immobilization in the postoperative management of ankle fracture in adults: a systematic review and meta-analysis. J Orthop Sports Phys Ther. 2014;44(9):690-701, C1-7. doi: 10.2519/jospt.2014.5294. Epub 2014 Aug 6. Review. PubMed PMID: 25098197.
- Siddique A, Prasad CVR, O'Connor D. Early active mobilization versus cast immobilization in operatively treated ankle fractures: A prospective analysis of early functional recovery. European Journal of Trauma and Emergency Surgery. 2005;31(4):398-400.
- Smeeing DP, Houwert RM, Briet JP, et al. Weight-bearing and mobilization in the postoperative care of ankle fractures: a systematic review and meta-analysis of randomized controlled trials and cohort studies. PLoS One. 2015;10(2):e0118320. doi: 10.1371/journal.pone.0118320. eCollection 2015. Review. PubMed PMID: 25695796; PubMed Central PMCID: PMC4335061.
- Van Laarhoven CJ, Meeuwis JD, van der WerkenC. Postoperative treatment of internally fixed ankle fractures: a prospective randomised study. J Bone Joint Surg Br. 1996;78(3):395-9. PubMed PMID: 8636173.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Keene, 2014
Study characteristics and results are extracted from the SR (unless stated by asterics*: Siddique has been added to the review of Keene) |
SR and meta-analysis of [RCTs / cohort / case-control studies]
Literature search: up to June 2013
A: DiStasio, 1994 B: Dogra and Rangan, 1999 C: Egol, 2000 D: Finsen, 1989; Finsen and Benum, 1989 E: Franke, 2008 F: Hedstrom, 1994 G: Lehtonen, 2003 H: Sondenaa, 1986 I: Stockle, 2000 J: Tropp and Norlin, 1995 K: Vioreanu, 2007 L: Siddique, 2005*
Study design*: A: Quasi-randomised controlled trial B: RCT C: RCT D: RCT E: RCT F: RCT G: RCT H: RCT I: Quasi-randomized controlled trial J:RCT K: Quasi-randomised controlled trial L: Quasi-randomised controlled trial M: quasi-randomized controlled trial
Setting and Country: A: USA B: UK C: USA D: Norway E: Germany F: Sweden G: Finland H: Norway I: Germany J: Sweden K: Ireland L: Ireland
Source of funding: A: Funded by military B: Not reported C: Not reported D: Publicly funded E: Not reported F: Not reported G: Publicly funded H: Not reported I: Not reported J: Not reported K: Not reported L: Not reported |
Inclusion criteria SR: • Randomized and quasi-randomized controlled trials in skeletally mature adults with surgically treated ankle fractures • studies comparing a type of externally applied immobilization with a comparison intervention that allowed early ankle movement • studies between 1982 - 2013 Exclusion criteria SR: • studies looking at pilon fractures and talus were excluded. • Studies of pathological fractures (except osteoporotic fractures) and exercise-related stress fractures
11 studies included (14 studies were selected, but three were conference abstracts)
M: Inclusion: Weber B isolated lateral malleolar or bimalleolar ankle fracture without syndesmosis injury requiring osteosynthesis; age 16-60 years; isolated injury; no cognitive difficulties and availability for follow-up, surgically treated.
Important patient characteristics at baseline: N, mean age A: 61 patients, 25.6 year (range 19-41) B: I: 26patients; C: 26 patients. Overall mean age: 47.2 year (range 18-65) C: I: 27 patients, 39.5±17.2 (SD) year; C: 28 patients, 45.6±17.5 (SD) year D: I: 18 patients, 43 year (SE: 3.2); C: 19 patients, 40 year (SE: 3.3) E: I: 14 patients, 44.3 year (range20.3-59.4); C: 13 patients, 40.8 year (range 25-64.1) F: I: 28 patients, 44 year (range 15-70); C: 25 patients, 41 year (range 16-71) G: I: 50 patients, 41 year (SD 13); C: 50 patients, 41 year (SD 13) H: I: 20 patients, median 35 year (range 16-59); C: 23 patients, median: 37 (range 16-66) I: I: 20 patients, C: 20 patients; overall age: 45 year (range 20-65) J: I: 15 patients, C: 15 patients; overall median age: 26 year (range 19-60) K: I: 33 patients, 37.2 years (SD 12.9); C: 29 patients, 34.9 year (SD 16) L: I: 22 patients; C: 22 patients. No age reported Sex: (%male) A: 89% B: 48% C: I: 48%; C:55.6% D: I:44%; C: 42% E: I: 50%; C: 77% F: I: 46.4%; C: 44% G: I: 50%; C: 62% H: I: 40%; C: 40% I: 52.5% J: not reported K: I: 67.7%; C: 69% L: Not reported
Groups comparable at baseline? The groups were randomized and comparable at baseline. |
Early ankle movement:
A: Removable short-leg orthosis for 6 weeks; physical therapy immediately B: Plaster slab and exercise for 2 weeks, followed by below-knee walking cast for 4 weeks; rehabilitation from 24h postoperative to 2 wk, repeated dorsiflexion and plantar flexion, 4 sessions of 10 minutes per day C: Removable functional brace for 6 weeks; rehabilitation: instructed on active and passive ankle/subtalar exercises by physical therapist. Continued exercises at home out of brace 3 times daily D: Removable POP splint removed 3 days post-operative; below knee plaster cast with rubber walker for 6 weeks*; Rehabilitation: written instructions to dorsiflex/plantar flex/invert/evert ankle repeatedly each day E: Dynamic vacuum orthosis with ankle mobilization for 6 weeks; partial weight bearing second day, full weight bearing day 15 onward F: Removable orthosis; physical therapist instructed unloaded dorsiflexion/plantar flexion at least 5 times daily G: removable functional Air Stirrup ankle brace for 6 weeks; daily active and passive ankle exercises immediately postoperative until normal gait was achieved; After 2 weeks partial weight-bearing; full weight-bearing at 4 weeks. H: immobilization in backslab for approximatly3 days, then active exercises were allowed; 12 appointments with physical therapist; full weight-bearing after 6 weeks I: removable vacuum orthosis for 6 weeks; orthosis removed for wound check, hygiene, and intermittent physical therapy (not further specified) J: removable hinged brace, 10 weeks; weight bearing encouraged (dorsiflexion, plantar flexion, normal gait pattern), crutches first and second week; K: removable cast, non-weight bearing for 6 weks; active and passive exercises of the ankle and tubtalar joint without the brace (open- and closed-chain exercises), supervised by physical therapist L: No casting, partial weight bearing after 4 weeks, gradually progressed to full weight bearing as tolerated.
|
Ankle immobilization:
A: Below-knee, short-leg cast for 6 weeks; physical therapy at 6 weeks B: Plaster slab and no exercise for 2 weeks, followed by below-knee walking cast for 4 weeks. C: Short-leg cast for 6 weeks, physical therapy after 6 weeks; Both groups were initially treated for 2 or 3 days with a plaster A-O splint; both groups started weight-bearing after 6 weeks D: Lightweight POP cast for 6 weeks E: circular synthetic cast with a plastic supportive bandage for 6 weeks; window cut into postoperative cast on second day to allow dorsiflexion, non-weight bearing until change of cast, then partial weight bearing until day 14, full weight bearing from day 15; after cast removal, attended physical therapy 3 times per week for 4 weeks F: walking plaster cast G: plaster cast for 2 weeks, fiberglass cast for further 4 weeks; After 2 weeks partial weight-bearing; full weight-bearing at 4 weeks. H: plaster cast for 6 weeks; after 6 weeks active exercises and 12 appointments with physical therapist; After 2 weeks partial weight-bearing; full weight-bearing at 4 weeks. I: walking plaster cast for 6 weeks J: conventional plaster-cast boot with a sole for 6 weeks; weight bearing and walking with crutches. After removal, crutches for another 2-4 weeks, then full weight bearing allowed. Rehabilitation started at week 6 K: Below-knee cast, non-weight bearing for 6 weeks; exercises started at week 6. L: 6 weeks of below-knee plaster cast for 6 weeks following osteosynthesis, partial weight bearing after 4 weeks, gradually progressed to full weight bearing as tolerated. |
End-point of follow-up:
A: up to 6 months B: 12 week C: 6, 12, 24, 52 weeks D: 9, 18, 36 weeks; 1 and 2 years E: 6 and 10 week F: 3, 6, 18 months G: 6, 12, 51 weeks, 2 years H: 6, 12, 18 weeks, 1 year I: 6, 12 weeks J: 10 week, 1 year K: 6, 9, 12, 24 week L: day 2, week 1, week 6, 12 weeks
For how many participants were no complete outcome data available? (intervention/control) A: Not reported B: I: 0; C: 0 C: overall: n=5 (8%) D: I: 4 (7%) after 8 months C: 10 (18%) after 12 months E: I: 1 (7%) at week 2; C: 2 (15%) at week 2 F: I: 0 at 6 months; 2 at 18 months (7%); C: 0 at 6 monts; 4(16%) months G: I: 0 at 6 weeks, 1 at 12 weeks (2%), 4 at 2 years (8%); C: 0 at 12 weeks, 3 at 52 weeks (6%), 8 at 2 years (16%) H: Not reported I: I: 0; C: 0 J: Not reported K: Overall: 4 L: Not reported, availability for follow-up was part of the inclusion criteria.
|
Function : Standardized mean difference [95% CI]
Function at 9-12 weeks: pooled effect (studies C, D, G, J, K; n=183) (random effects model): 0.65 [95% CI 0.11-1.19] favoring early movement Heterogeneity (I2): 81%
Function at 1 year: pooled effect (studies C, D, G, J; n=218) (random effects model): 0.04 [95% CI -0.23 to 0.31] favoring early movement Heterogeneity (I2): 0%
Physical performance measures • 1 study(B) assessed walking symmetry 12 wk postoperation: 20 of 26 in the early ankle movement group and 6 of 26 in the immobilization group were assessed as walking with symmetry
Complications Deep surgical site infection OR (peto) [95%CI] Pooled effect (studies A, G, K; n=206) (fixed effects model) 7.08 [1.39 to 35.99] favoring immobilization Heterogeneity (I2): 0%
Superficial Surgical Site Infection RR (MH) [95%CI] Pooled effect (studies A, F, G, H, K; n=296) (fixed effects model) 2.62 [1.21 – 5.68] favoring immobilization Heterogeneity (I2): 0%
Venous Thromboembolism OR (peto) [95%CI] Pooled effect (studies C, G, I, K; n=245) (fixed effects model) 0.12 [0.02-0.71] favoring early movement Heterogeneity (I2): 0%
Fixation-related Complication (failure of fixation or reoperation to remove metalwork) OR (peto) [95%CI] Pooled effect (studies A, B, C, F, G, K; n=390) (fixed effects model) 6.56 [1.84-23.41] favouring immobilization Heterogeneity (I2): 0%
Other Time to return to work and leisure activities/sports • Not possible to pool data due to differences in data capture and reporting • 3 studies (A, C, K) reported a statistically significant difference in favor of the early ankle movement (or removable orthosis) group compared to immobilization for earlier return to work • 2 studies (D and G) reported no statistically significant differences between treatment groups • 2 studies (E, J) found an earlier return to work after early ankle movement but failed to report whether the differences were statistically significant • No studies reported time to return to leisure activities/sports
Quality of Life 3 studies (153 participants) used the SF-36 and SF-12 quality-of-life instruments • 1 study (K) reported no statistically significant differences between the groups in the SF-36 at 6 monts • 1 study (C) reported statistically significant differences in favor of the early ankle movement group in SF-36 domains of vitality and perceptions of general health at 1 year • 1 study (E) found a statistically significant difference in favor of the removable orthosis group compared to immobilization for the SF-12 mental component summary score
Patient satisfaction 2 studies (71 participants) (E, L) reported patient satisfaction measured on a visual analog scale. Study E found results in favour of the vacuum orthosis group compared to ankle immobilization at 10 weeks and discharge, but no data were reported. Study M reported that patients in the mobilized group were more satisfied at week 1 (p=0.04), but at day 2 and week 6, no differences were fount (p=0.06 and 0.55 respectivily). No scores higher than 5 were rated.
Pain: Six studies (B, D, E, F, H, L) reported post-operative pain outcomes (within three months after surgery). Three studies reported significant differences in favour of early ankle movement, three studies reported no significant differences. Specific details were not reported. |
Subgroup analysis and sensitivity analysis Function: Standardized mean difference [95% CI]:
Sub-group analysis, function 9-12 weeks: (added: study L) Weight bearing: Pooled effect (studies G, J, L; n=173) (random effects model): 0.66 [95% CI -0.36 to 1.69] favoring early movement Heterogeneity (I2): 89%
Non-weight bearing: Pooled effect (studies C, D, K; n=154) (random effects model): 0.67 [95% CI 0.02 to 1.31] favoring early movement Heterogeneity (I2): 73%
Sub-group analysis, function at 1 year: Weight bearing: Pooled effect (studies G, J; n=126) (random effects model): 0.08 [95% CI -0.27 to 0.42] favoring early movement Heterogeneity (I2): 0%
Non-weight bearing: Pooled effect (studies C, D; n=92) (random effects model): 0.67 [95% CI 0.02 to 1.31] favoring early movement Heterogeneity (I2): 73%
Complications Sub-group analysis, deep surgical site infection OR (peto) [95%CI] Weight bearing: Pooled effect (studie G; n=98) (fixed effect model): 7.25 [0.98 – 53.41] favouring immobilization Heterogeneity: NA
Non-weight bearing: Pooled effect (studies A, K; n=118) (fixed effect model): 6.75 [0.41 – 111.14] favouring immobilization. Heterogeneity: NA
Sub-group analysis, superficial surgical site infection RR (MH) [95%CI] Weight bearing: Pooled effect (studies F, G; n=135) (fixed effect model): 3.23 [1.29 – 8.09] favouring immobilization Heterogeneity (I2): 0%
Non-weight bearing: Pooled effect (studies A, H, K; n=161) (fixed effect model): 1.48 [0.33 – 6.61] favouring immobilization. Heterogeneity (I2): 0%
Sensitivity analysis: one study had a very high rate of postoperative wound infection (5% deep SSIs and 23% superficial SSIs).20 When this trial was removed from the meta-analysis, the effect estimates were not statistically significant for deep SSI (Peto OR = 6.75; 95% CI: 0.41, 111.14; P =.18) or superficial SSI (RR = 1.52; 95% CI: 0.43, 5.35; P =.52). An additional sensitivity analysis on the superficial SSI meta-analysis was conducted, removing a trial in which ankle splinting was used for only 3 days in the ankle movement group35; this did not impact the direction of results (RR = 2.57; 95% CI: 1.16, 5.71; P =.02).
Sub-group analysis, venous thromboembolism OR (Peto) [95%CI] Weight bearing: Pooled effect (studies G, I; n=128) (fixed effect model): 0.12 [0.01 – 1.96] favouring early movement Heterogeneity: NA
Non-weight bearing: Pooled effect (studies C, K; n=117) (fixed effect model): 0.12 [0.01 – 1.19] favouring early movement. Heterogeneity (I2): 0%
Sub-group analysis fixation-related complications OR (peto) [95%CI] Weight bearing: Pooled effect (studies B, F, G, J; n=217) (fixed effects model) 6.16 [1.33-28.50] favouring immobilization Heterogeneity (I2): 0%
Non-weight bearing: Pooled effect (studies A, C, K; n=193) (fixed effects model) 7.54 [0.77 – 73.99] favouring immobilization Heterogeneity (I2): 0%
Sensitivity analysis: One study reported a high level of fixation failure, with 6 out of 15 (40%) participants having failure of syndesmotic staples in the early ankle movement group. However, when this study was removed in a sensitivity analysis, the effect estimate remained statistically significant (Peto OR = 7.34; 95% CI: 1.02, 52.82; P =.05).
Author’s conclusions: Overall, the effects of early ankle movement on recovery of function within 12 weeks of surgery, when compared to ankle immobilization, are inconclusive, and there is no evidence of functional benefit at 1 years. However, these results should be interpreted with caution, due to low quality of evidence. High-quality, adequately powered clinical trial is needed.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question No trials used intention-to-treat analysis, reported sample size calculations, declared primary outcomes or reported factors that had the potential to influence healing / complications. All studies had high risk of bias.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading: |
SR: Systematic Review; NA: not applicable
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Van Laarhoven, 2009 |
Type of study: Quasi-randomized
Setting:
Country: The Netherlands
Source of funding: ‘No benefits in any form have been received from a commercial party related to the subject of this article’ |
Inclusion criteria: ankle fractures treated by internal fixation;
Exclusion criteria: exclusion: fractures assessed as unstable for early mobilisation after operation, grade-II and grade-III open fractures, pilon fractures of the tibia, open injuries of the physeal plate of the distal tibia, patients unable to cope with either of the two post-treatment schemes.
N total at baseline: I: n=40 C: n=41
Important prognostic factors2: I: n=40 median age: 35.5 years (range 17-77); C: n=41 median age: 37 (range 15-77) Sex: I: 58,5%; C: 52,5% Groups comparable at baseline?
|
Non-weight bearing ‘functional’mobilisation with active exercises and crutches |
Below-knee walking plaster with early weight bearing |
Length of follow-up: 10 days, 6 weeks, 3 months, 1 year
Loss-to-follow-up: 1 patient lost to follow up after 3 months, 1 extended follow-up at 20 months
Incomplete outcome data: Not reported |
Functional outcomes Modified subjective ankle score of Olerud & Molander at
12 weeks: I: 80/100 C: 85/100 P=0.84
12 months: I: 95/100 C: 95/100 P=0.90
Complications Superficial site infections I: 2/40 (5%) C: 4/41 (10%) Other complications not further specified between the groups
Return to work Return on a full-time basis: Median (range) I: 79 days (9 days-1year) C: 78 days (9-244 days) P=0.54
Return on a part-time basis: I: 44 (4-216 days) C: 24 days (7-183 days) P=0.19 |
Randomisation based on date of accident; high risk of bias |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Keene, 2015 |
Yes |
Yes |
Yes |
No, prognostic factors not reported in included studies, thus not in this SR either |
Not applicable |
Yes |
Yes. If not enough similarities, no pooling was applied. |
No |
No |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Van Laarhoven, 1996 |
Randomisation by date of accident (odd or even date) |
Unclear, not described |
Likely, not possible to blind for crutches or plaster |
Likely, not possible to blind for crutches or plaster |
Unclear whether the outcome assessors knew which treatment patients had undergone |
Unlikely, clear description of outcome measures in methods |
Unlikely, low loss to follow up, reasons described |
Likely, no ITT was used |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Smeeing, 2015 |
Keene als systematic review genomen, rapporteert meer uitkomsten over complicaties |
|
Schepers, 2013 |
Geen uitkomstmaten die overeenkomen met PICO |
|
Black, 2013 |
Keene als systematic review genomen, recenter dan Black |
|
Lin, 2012 |
Uitkomstmaten komen niet overeen met PICO van deze uitgangsvraag. Gekozen voor Keene et al. |
|
Thomas, 2009 |
Keene als systematic review genomen, recenter dan Thomas |
|
Agir, 2015 |
Geen overeenkomende uitkomstmaten |
|
Vioreanu, 2007 |
In Keene et al. geïncludeerd |
|
Honigmann, 2007 |
In Keene et al. geïncludeerd |
|
Simanski, 2006 |
In Keene et al. geïncludeerd |
|
Tropp, 1995 |
In Keene et al. geïncludeerd |
|
Lehtonen, 2003 |
In Keene et al. geïncludeerd |
|
Egol, 2000 |
In Keene et al. geïncludeerd |
|
Dogra, 1999 |
In Keene et al. geïncludeerd |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-09-2017
Beoordeeld op geldigheid : 25-07-2017
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde (NVvH) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is moet in 2019 gekeken worden of de module 'Behandeling instabiele enkelfractuur' (Willett, 2016 en Crossbat trial NCT01134094 in trialregister) en de module 'Nabehandeling gestabiliseerde enkelfractuur' (WOW-studie; Briet, 2015) herziening nodig in verband met het uitkomen van een nieuwe studies (zie kennislacunes). Bij de update van de module 'Enkelfracturen met ernstige comorbiditeit' zal de studie van White (2016) worden toegevoegd.
Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Eerstvolgende beoordeling actualiteit richtlijn |
|
Diagnostiek bij patienten met radiologisch bewezen enkelfractuur |
2021 |
|
Diagnostiek differentieatie SE2 en SE4 |
2021 |
|
Conservatieve behandeling |
2021 |
|
Operatieve vs. conservatieve behandeling |
2019 |
|
5Behandeling begeleidende letsels |
2021 |
|
Optimale behandeling syndesmoseletsels |
2021 |
|
Beste behandeling acuut geinfecteerd osteosynthesemateriaal |
2021 |
|
Operatietechniek bij patiënten met ernstige comorbiditeit |
2021 |
|
Optimale nabehandeling operatief gestabiliseerde enkelfractuur |
2019 |
|
Fysiotherapie indicatie |
2021 |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van diagnostiek en behandeling van enkelfracturen. Het doel van deze richtlijn is het vaststellen van de zorg betreffende de diagnostiek en behandeling van enkelfracturen. Standaardisatie van therapeutische opties door middel van een diagnose- en behandelalgoritme is noodzakelijk om praktijkvariatie te reduceren en de kwaliteit van de zorg te verhogen zonder de kosten te doen stijgen.
Doelgroep
De richtlijn beperkt zicht tot de diagnostiek en (na)behandeling van enkelfracturen bij volwassenen. De diagnostiek van enkelfracturen is gericht op het beoordelen van het soort fractuur, niet het vaststellen van de fractuur zelf. De Ottowa Ankle Rules zijn inmiddels de gouden standaard om de fractuur vast te stellen en behoeft geen verdere evaluatie. Ook wordt in deze richtlijn niet ingegaan op behandeling van osteoporose, open fracturen of pilon tibiale fracturen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met enkelfracturen (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. M. (Martijn) Poeze, traumachirurg, Maastricht University Medical Centre, Maastricht, NVvH (voorzitter).
- Dr. T. (Tim) Schepers, traumachirurg, Academisch Medisch Centrum, Amsterdam, NVvH
- Dr. J.M. (Jochem) Hoogendoorn, traumachirurg, Haaglanden MC, Den Haag, NVvH
- Drs. L. W. (Laurens) van der Plaat, orthopedisch chirurg-traumatoloog, AVE Orthopedische Klinieken, Huizen, NOV
- Dr. C.C.M.A. (Christian) Donken, orthopedisch chirurg in opleiding, Isala, Zwolle, NOV
- Dr. G (Göran) Zemack, revalidatiearts, Libra Revalidatie & Audiologie, Eindhoven, VRA
- Drs. A.C.L.F. (Arjan) Steenbakkers, musculoskeletaal-radioloog, Maartenskliniek, Nijmegen, NVvR
- Dr. A.F. (Ton) Lenssen, fysiotherapie, Maastricht University Medical Centre, Maastricht, KNGF
- B. A. (Annet) Warners, gipsverbandmeester, Medisch Centrum, Leeuwarden, VGN
Klankbordgroep:
- R. (Rinie) Lammers, MSc, beleidsadviseur, Patiëntenfederatie Nederland, Utrecht
- E. (Esther) Mik, MSc, commissie kwaliteit en richtlijnen, Orthobanda, Soest
Met ondersteuning van:
- Dr. W.A. (Annefloor) van Enst, senior adviseur, Kennisinstituut van Medisch Specialisten
- H.L. (Hilde) Vreeken, MSc., adviseur, Kennisinstituut van Medisch Specialisten (tot december 2015)
- E.A. (Ester) Rake, MSc., junioradviseur, Kennisinstituut van Medisch Specialisten (vanaf januari 2016)
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Getekend |
|
Donken |
AIOS orthopedie Medisch Spectrum Twente |
nvt |
nvt |
nvt |
nvt |
AO research Grant (project number: AO Start-up Grant S-10-60D) voor een biomiechanisch studie naar enkelfracturen. |
nvt |
nvt |
ja, 05-04-2015 |
|
Harsevoort |
Verpleegkundig Specialist (VS) orthopedie/traumatologie 50% Coordinator expertise centrum Osteogenesis Imperfecta (OI) Isala Zwolle 50% |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
ja, 28-9-2015 |
|
Hoogendoorn |
Traumachirurg |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
ja, 10-07-2015 |
|
Lenssen |
Onderzoeker afdeling fysiotherapie MUMC (0,8FTe) senior docent fysiotherapie Hogeschool Zuyd (0,3FTe) |
Tutor Stichting Opleidingen Muskuloskeletale Therapie (freelance, docent Manuele therapie, Kerpen, Duitsland) |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
Ja, 03-10-2016 |
|
Poeze |
Traumachirurg |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
ja, 25-06-2015 |
|
Schepers |
Traumachirurg |
nvt |
nvt |
nvt |
nvt |
Nvt |
Nvt |
nvt |
Ja, 14-04-2015 |
|
Steenbakkers |
Radioloog |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
ja, 09-04-2015 |
|
Van der Plaat |
Orthopedisch Chirurg |
Medisch directeur AVE Orthopedische Klinieken |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
ja, 31-03-2015 |
|
Van Warners |
Gipsverbandmeester |
Bestuurslid Verenigde Gipsverbandmeesters Nederland met protefeuille Registratie en Accreditatie, onbetaald |
nvt |
nvt |
als (bestuurs)lid VGN belang bij goede beschrijving van de richtlijn enkelfracturen en tevens boegbeeld voor de VGN |
nvt |
nvt |
nvt |
ja, 20-04-2015 |
|
Zemack |
Revalidatiearts |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
ja, 30-03-2015 |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het afnemen van een enquête onder het patiëntenpanel van Patiëntenfederatie Nederland. Verder las de Patiëntenfederatie Nederland mee met de conceptteksten. Een verslag van de patiëntenenquête (zie de ‘Enquête enkelfracturen Patiëntenfederatie Nederland’) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland. Gedurende de commentaarfase is samen met Patiëntenfederatie Nederland gewerkt aan uniforme patiënteninformatie via de patienteninformatietool.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens werden de volgende partijen uitgenodigd op de invitational conference om knelpunten aan te dragen: NOV, NVvR, VRA, KNGF, Verenigde Gipsverbandmeesters Nederland en de NVOS-Orthobanda, NPCF, Inspectie voor de Gezondheidszorg, Nefarma, Nederlandse Zorgautoriteit, Zorginstituut Nederland (ZiNL), Koepels van zorginstellingen (Nederlandse Vereniging van Ziekenhuizen (NVZ), Nederlandse Federatie van Universitair Medische Centra (NFU), Samenwerkende Topklinische Ziekenhuizen (STZ), Zelfstandige Particuliere Klinieken Nederland (ZKN), het Nederlands Huisartsen Genootschap (NHG), Vereniging voor Sportgeneeskunde (VSG), Nederlandse Vereniging voor Anesthesiologie (NVA), Verpleegkundigen & Verzorgenden Nederland (V&VN), DBC onderhoud, Federatie Medisch Coördinerende Centra (FMCC),VEKTIS en Zorgverzekeraars Nederland (ZN). Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor iedere uitgangsvraag werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008). In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (eindconclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De totale bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin, naast de conclusies uit de systematische literatuuranalyse, aanvullende argumenten (overwegingen) een rol spelen werd afgezien van een eindconclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en een weging van de (on)gunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in een aparte module.
Indicatorontwikkeling
Er werden geen indicatoren opgesteld, in de module Organisatie van Zorg is een suggestie opgenomen voor een toekomstige registratie van enkelfracturen.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Briet JP, Houwert RM, Smeeing DP, Pawiroredjo JS, Kelder JC, Lansink KW, Leenen LP, van der Zwaal P, van Zutphen SW, Hoogendoorn JM, van Heijl M, Verleisdonk EJ, van Lammeren GW, Segers MJ, Hietbrink F. Weight bearing or non-weight bearing after surgically fixed ankle fractures, the WOW! Study: study
protocol for a randomized controlled trial. Trials. 2015 Apr 18;16:175. doi: 10.1186/s13063-015-0714-1. PubMed PMID: 25927626.
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Dehghan N, McKee MD, Jenkinson RJ, Schemitsch EH, Stas V, Nauth A, Hall JA, Stephen DJ, Kreder HJ. Early Weightbearing and Range of Motion Versus Non-Weightbearing and Immobilization After Open Reduction and Internal Fixation of Unstable Ankle Fractures: A Randomized Controlled Trial. J Orthop Trauma. 2016 Jul;30(7):345-52. doi: 10.1097/BOT.0000000000000572. PubMed PMID: 27045369.
Keene DJ, Mistry D, Nam J, Tutton E, Handley R, Morgan L, Roberts E, Gray B, Briggs A, Lall R, Chesser TJ, Pallister I, Lamb SE, Willett K. The Ankle Injury Management (AIM) trial: a pragmatic, multicentre, equivalence randomised controlled trial and economic evaluation comparing close contact casting with open surgical reduction and internal fixation in the treatment of unstable ankle fractures in patients aged over 60 years. Health Technol Assess. 2016 Oct;20(75):1-158. Review. PubMed PMID: 27735787.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
White TO, Bugler KE, Appleton P, Will E, McQueen MM, Court-Brown CM. A prospective randomised controlled trial of the fibular nail versus standard open reduction and internal fixation for fixation of ankle fractures in elderly
patients. Bone Joint J. 2016 Sep;98-B(9):1248-52. doi: 10.1302/0301-620X.98B9.35837. PubMed PMID: 27587528.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1995-sept. 2015
Engels |
5 fibula/in or "Ankle Fractures"/ or "Ankle Injuries"/ or (((fibula* or malleol* or ankle*) adj3 fracture*).ti,ab. or ((fibula* or malleol* or ankle* or talocrural) adj3 fracture*) or ((distal or low*) and ((fibula* adj3 fracture*) or (tibia* adj3 fracture*)))).ti,ab. (12707) 6 (Ankle Injuries/ or Ankle/ or Ankle Joint/) and (exp Fractures, Bone/ or fracture*.ti,ab,kw.) (4824) 7 5 or 6 (13417) 8 4 and 7 (4) 9 surgery.fs. (1680987) 10 orthopedic procedures/ or exp orthopedic procedures/ or Postoperative Period/ or Postoperative Care/ (303379) 11 (operati* or surg* or postoperati* or post-operati*).ti,ab,kw. (1989337) 12 9 or 10 or 11 (2835978) 13 7 and 12 (8243) 14 exp External Fixators/ (19960) 15 Braces/ (4594) 16 (plaster* or cast* or brace* or immobi* or mobil*).ti,ab,kw. (406352) 17 Weight-Bearing/ (16172) 18 (weight-bearing or weightbearing or (weight adj3 bear*)).ti,ab,kw. (12876) 19 ((early or immediate*) adj3 ambulation).ti,ab,kw. (1134) 20 exp Rehabilitation/ or exp Physical Therapy Modalities/ or exp Exercise/ or Ambulatory Care/ or "Recovery of Function"/ or rehabilitation.fs. (549631) 21 14 or 15 or 16 or 17 or 18 or 19 or 20 (967557) 22 13 and 21 (2502) 23 limit 22 to (english language and yr="1995 -Current") (1458) 24 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (251591) 25 23 and 24 (68) – 67 uniek 26 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1520145) 27 23 and 26 (197) 29 28 not 25 (169) – 164 uniek |
407 |
|
Embase (Elsevier) |
'fibula fracture'/de OR 'ankle fracture'/exp OR 'malleolus fracture'/de OR ((fibula* OR malleol* OR ankle* OR talocrural) NEAR/3 fracture*):ab,ti OR 'ankle injury'/de OR (distal:ab,ti OR low*:ab,ti AND ((fibula* NEAR/3 fracture*):ab,ti OR (tibia* NEAR/3 fracture*):ab,ti)) OR 'distal tibia fracture'/exp NOT 'conference abstract':it AND (surgery:lnk OR operati*:ab,ti OR surg*:ab,ti OR postoperati*:ab,ti OR 'post operative':ab,ti OR 'orthopedic surgery'/exp OR 'postoperative period'/de OR 'postoperative care'/de) AND ('weight bearing'/exp/mj OR 'plaster cast'/exp OR 'brace'/mj OR plaster*:ab,ti OR cast*:ab,ti OR brace*:ab,ti OR immobi*:ab,ti OR mobil*:ab,ti OR 'weight bearing':ab,ti OR weightbearing:ab,ti OR (weight NEAR/3 bear*):ab,ti OR ((earl* OR immediate*) NEAR/3 ambulation):ab,ti OR 'manipulative medicine'/mj OR 'physical medicine'/exp/mj OR 'occupational therapy'/mj OR 'kinesiotherapy'/exp/mj OR 'exercise'/exp/mj OR 'training'/mj OR 'mobilization'/de OR 'rehabilitation'/exp/mj OR rehabilitat*:ab,ti OR training:ab,ti OR therap*:ab,ti OR physiotherap*:ab,ti OR (physical NEAR/3 therap*):ab,ti OR exercis*:ab,ti OR mobili*:ab,ti OR immobili*:ab,ti) AND [english]/lim AND [embase]/lim AND [1995-2015]/py
AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) (40) – 21 uniek
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it (239) – 155 uniek |
|
