GLP-1 receptor agonist versus bolus insuline
Uitgangsvraag
Wat is de optimale behandeling van volwassen personen met type 2 diabetes die onvoldoende reageren op een combinatie van metformine (in maximaal te tolereren dosering) en eenmaal daags (basaal) insuline: toevoeging van een GLP-1 receptor agonist of toevoeging van kortwerkend (bolus) insuline?
Aanbeveling
Geef intensivering van insulinebehandeling de voorkeur boven behandeling met GLP-1 receptor agonisten bij personen met type 2 diabetes en een zeer slechte glucoseregulatie (HbA1c >15 mmol/mol boven de individuele streefwaarde).
Start geen GLP-1 receptor agonist bij patiënten met pancreatitis of maligniteiten in pancreas of schildklier in de voorgeschiedenis of een sterk verhoogd risico op deze aandoeningen. Wees zeer terughoudend met GLP-1 receptor agonisten bij patiënten met bekende gastroparese, leverinsufficiëntie, nierfalen (eGFR <30 ml/min) of hartfalen.
Overweeg een proefbehandeling met een GLP-1 receptor agonist bij personen met type 2 diabetes en een BMI ≥30 kg/m2 die met metformine (en een SU-derivaat) en basaal insuline onvoldoende glykemische controle bereiken.
Overweeg proefbehandeling met een GLP-1 receptor agonist te stoppen indien na 6 maanden een HbA1c-daling van ten minste 5 mmol/mol zonder gewichtstoename niet is bereikt.
Overweeg behandeling met GLP-1 receptor agonisten te stoppen bij personen met type 2 diabetes bij wie de glucoseregulatie dusdanig verslechtert dat intensivering van insulinebehandeling (toevoeging van kortwerkend insuline of overgang naar mix insuline) nodig is.
NB: Deze aanbevelingen zijn gedaan op basis van data verkregen uit studies t/m april 2016 en zijn gelimiteerd doordat mogelijk nieuwe studies zijn verschenen. Bij toekomstige herziening wordt de vraagstelling van de uitgangsvraag geëvalueerd en worden nieuwe studies geraadpleegd.
Overwegingen
Het natuurlijk beloop van type 2 diabetes voorspelt dat patiënten die met orale glucoseverlagende medicatie en eenmaal daags (langwerkend) insuline worden behandeld hier op den duur niet (langer) voldoende glucoseregulatie mee bereiken. Allereerst is het dan aangewezen om dieet en leefstijl opnieuw kritisch te beschouwen. Aanpassingen in het dieet kunnen de glucoseregulatie verbeteren en leiden tot gewichtsreductie, waarmee toevoeging van medicatie soms kan worden uitgesteld (zie hiervoor de NDF-voedingsrichtlijn diabetes; NDF 2015a, module 4.2 Wat is de optimale workup bij patiënten die naar de tweede lijn (internist) zijn verwezen? en module 4.4 Wat is het optimale beleid voor patiënteducatie ter bevordering van diabetes zelfmanagement en leefstijl bij personen met type 2 diabetes in de tweede lijn?). Bij personen met een BMI>35 kg/m2 die jonger zijn dan 60 jaar dient daarnaast de mogelijkheid van bariatrische chirurgie te worden besproken. Een dergelijke ingreep leidt vaak tot fors en duurzaam gewichtsverlies, waarbij veel of soms alle glucoseverlagende medicatie kan of moet worden gestaakt (Schauer, 2014). Op medicamenteus gebied betreft de volgende stap vaak het toevoegen van kortwerkend (bolus) insuline bij de maaltijden. Alternatieven voor intensivering van de insulinebehandeling zijn toevoeging van een GLP-1 receptor agonist, een DPP-4-remmer of een SGLT-2-remmer. Het toevoegen van een DPP-4- of SGLT-2-remmer wordt elders besproken (zie module DPP-4-remmer versus bolus insuline en module SGLT-2-remmer versus bolus insuline). Hier richten wij ons op de vraag of het toevoegen van een GLP-1 receptor agonist aan intensieve insulinetherapie zinvol kan zijn.
Naast de mogelijkheid van het afzonderlijk voorschrijven van langwerkende insuline en een GLP-1 receptor agonist, is er ook een combinatiepreparaat van GLP-1 receptor agonist met insuline in een gefixeerde samenstelling op de markt. De waarde van deze 'fixed ratio' preparaten werd in de huidige richtlijnmodule niet onderzocht. Op theoretische gronden acht de werkgroep het direct combineren van beide middelen in een preparaat als onwenselijk, omdat doseringen van insuline en GLP-1 receptor agonist niet onafhankelijk van elkaar getitreerd kunnen worden, met kans op onderbehandeling van één van beide componenten. Daarnaast kan de therapeutische waarde van de GLP-1 receptor agonist en insuline niet afzonderlijk worden beoordeeld, waardoor behandeling met GLP-1 mogelijk ten onrechte wordt gecontinueerd, terwijl de lange termijn effectiviteit en veiligheid veel minder goed bekend zijn dan die van insuline.
Uit de vier uitgevoerde gerandomiseerde onderzoeken blijkt dat toevoeging van een GLP-1 receptor agonist aan eenmaal daags (basaal) insuline dezelfde verbetering van de glucoseregulatie (daling van het HbA1c) bewerkstelligt als toevoeging van kortwerkend insuline voor de hoofdmaaltijd(en). Het verschil tussen GLP-1 receptor agonisten en kortwerkend insuline zit vooral in de overige uitkomstmaten. Ten eerste is er een lager risico op hypoglykemieën bij gebruik van GLP-1 receptor agonisten dan bij kortwerkend insuline, zowel wat betreft het aantal patiënten dat tenminste één hypoglykemie rapporteert als het aantal hypoglykemieën per patiënt per jaar, al kan enige vertekening door verschillen in frequentie van zelfcontrole niet worden uitgesloten. Ernstige hypoglykemieën hebben in de geanalyseerde studies een dermate lage frequentie dat analyse niet mogelijk is. Alle deelnemende patiënten hadden op zijn minst overgewicht. Gebruik van GLP-1 receptor agonisten leidde tot daling van het overgewicht, terwijl patiënten die kortwerkend insuline kregen gemiddeld zwaarder werden. Na een half jaar behandeling bedroeg het gewichtsverschil 2,7 kg tussen de twee interventies. GLP-1 receptor agonisten verbeteren patiënttevredenheid en kwaliteit van leven ten opzichte van kortwerkend insuline, maar deze uitkomsten worden slechts in één onderzoek gemeten en de verschillen zijn dermate klein, dat men vraagtekens kan zetten bij de klinische relevantie. Het is niet uitgesloten dat de kwaliteit van leven bij aanvang te hoog was om een klinisch relevant effect aan te tonen. Nader onderzoek op dit terrein is noodzakelijk om hier een uitspraak over te doen.
Gebruik van GLP-1 receptor agonisten leidt tot meer bijwerkingen, met name gastro-intestinaal, en een ongeveer tweemaal zo groot percentage ‘uitvallers’ in vergelijking met kortwerkend insuline. Patiënten met bekende gastroparese zijn daarom over het algemeen niet in studies met GLP-1 receptor agonisten geïncludeerd. Ook huidreacties bij de injectieplaats kunnen een reden zijn dat patiënten de behandeling staken. Pancreatitis is als gevolg van behandeling met GLP-1 receptor agonisten beschreven, maar overtuigend bewijs dat deze bijwerking significant vaker optreedt bij gebruik van GLP-1 receptor agonisten ontbreekt. GLP-1 receptor agonisten zou als groeifactor een ongunstig effect kunnen hebben op bestaande premaligne laesies in de alvleesklier of in de schildklier (Butler 2013). De geanalyseerde RCT’s en twee andere grote onderzoeken naar GLP-1 receptor agonisten geven hier geen aanwijzingen voor (Marso 2016a, 2016b). Het is echter van belang dat patiënten met een voorgeschiedenis van bijvoorbeeld pancreatitis, c-cel hyperplasie of medullair schildkliercarcinoom, nierinsufficiëntie en leverproblematiek meestal van deelname aan klinische studies werden uitgesloten. Voor overige gerapporteerde potentiële bijwerkingen wordt verwezen naar het Lareb (Lareb, 2016).
Geen van de onderzoeken beantwoordt de vraag of toevoeging van GLP-1 receptor agonisten het risico op cardiovasculaire uitkomsten gunstiger beïnvloedt dan toevoeging van kortwerkend insuline. Drie grote placebogecontroleerde eindpuntstudies hebben op het gebied van cardiovasculaire veiligheid wel non-inferioriteit aangetoond van behandeling met een GLP-1 receptor agonist ten opzichte van placebo bij personen met type 2 diabetes en een verhoogd cardiovasculair risico (Marso, 2016a en 2016b; Pfeffer, 2015). De bestaande behandeling van patiënten in deze onderzoeken bestond uit alleen orale glucoseverlagende medicatie (Pfeffer, 2015) of een combinatie met insuline (Marso, 2016a en 2016b). In de onderzoeken waaraan ook patiënten behandeld met insuline meededen, bleek toevoeging van een (ultralange) GLP-1 receptor agonist gedurende 3-4 jaar geassocieerd te zijn met lagere incidentie van cardiovasculaire events en mortaliteit ten opzichte van placebo (Marso, 2016a en 2016b). In hoeverre dit resultaat het ‘positieve’ effect is van de GLP-1 receptor agonist of van de vermindering van het negatieve effect van de geïntensiveerde controlebehandeling (waaronder insuline) kan niet worden bepaald. Ook kan niet met zekerheid worden gezegd of de resultaten van deze trials, die werden uitgevoerd bij hoog-risicopatiënten ook van toepassing zijn op patiënten met een (relatief) laag risico op cardiovasculaire aandoeningen. Daarom gaat de werkgroep ervan uit dat het cardiovasculair voordeel van betere glucoseregulatie (daling van het HbA1c) voor GLP-1 receptor agonisten gelijk is aan die van insuline en mogelijk beter.
Hoe kunnen de onderzoeksresultaten worden vertaald naar de dagelijkse praktijk voor personen met type 2 diabetes die met basaal insuline alleen niet uitkomen? Daarbij zijn twee uitgangspunten van belang. Ten eerste dat betere glykemische controle (gemeten aan het HbA1c) van belang is om het risico op microvasculaire complicaties te verminderen en mogelijk ook dat van macrovasculaire complicaties en sterfte. Het tweede uitgangspunt is dat GLP-1 receptor agonisten op zijn minst veilig zijn op cardiovasculair gebied. Dat betekent dat een HbA1c-daling op behandeling met een GLP-1 receptor agonist tenminste zo effectief is als eenzelfde daling van het HbA1c met een andere behandeling. Wat betekent in dat geval de daling van het lichaamsgewicht en het geringere risico op (met name niet-ernstige) hypoglykemieën? Gemiddeld genomen is de gezondheidswinst hiervan in engere zin waarschijnlijk beperkt, omdat de gewichtsdaling lager is dan wat in het algemeen als klinisch relevant wordt beschouwd en er geen sprake is van minder ernstige hypoglykemieën. Helaas benoemt geen van de onderzoeken uitgangskarakteristieken die de kans op een positiever effect (op HbA1c, gewicht of hypoglykemieën, alleen of in combinatie) van behandeling met een GLP-1 receptor agonist voorspellen.
Gewichtstoename en hypoglykemieën zijn demotiverende bijwerkingen; veel patiënten zullen een behandeling verkiezen die deze bijwerkingen niet heeft, ook al is het effect beperkt. Daarnaast is behandeling met een GLP-1 receptor agonist in veel opzichten eenvoudiger dan behandeling met meermaal daags insuline, zeker als het om verschillende soorten en verschillende doseringen gaat. GLP-1 receptor agonisten hebben een vaste dosering en kunnen meestal onafhankelijk van de maaltijd worden genomen; behandeling hiermee vergt geen extra glucosecontrole en er hoeft niet te worden gerekend met koolhydraten of dosering van insuline. Dat betekent ook een geringere kans op doseringsfouten, terwijl evenmin hoeft te worden gevreesd voor verwisselingen van verschillende soorten insulinepreparaten. Ernstige hypoglykemieën zijn vooral bij de oudere diabetespopulatie vaak het gevolg van doseringsfouten en verwisselingen (Geller, 2014). Patiënten die alleen met basaal insuline worden behandeld hoeven ook niet altijd hun insulinepen en glucosemeter bij zich te hebben of bevreesd te zijn voor ontregeling als zij die spullen vergeten mee te nemen.
Er zijn onvoldoende gegevens over de veiligheid van GLP-1 receptor agonisten bij patiënten met nierfalen (KDOQI-stadium 4 of 5), ernstige leverproblematiek of hartfalen. In kleine, ongecontroleerde patiëntenseries is behandeling met GLP-1 receptor agonisten in verband gebracht met pancreatitis en (pre-) maligniteit van pancreas en schildklier (Butler, 2013; Elashoff, 2011). Dit verband kon niet worden bevestigd in grote eindpuntstudies, maar daar waren patiënten met deze aandoeningen van deelname uitgesloten.
Op basis van de beschikbare gegevens en bovengenoemde overwegingen komt de werkgroep tot de conclusie dat toevoeging van een GLP-1 receptor agonist aan eenmaal daags basaal insuline op een aantal punten voordelen biedt ten opzichte van intensivering van het insulineschema. Indien de HbA1c-streefwaarde echter ver af ligt van het huidige HbA1c (>15 mmol/mol boven de individuele HbA1c-streefwaarde; slechte tot zeer slechte glucoseregulatie), zal er een voorkeur zijn voor insuline, omdat het glucoseverlagende effect van een GLP-1 receptor agonist (te) beperkt is. Het is van belang hierop te merken dat de (individuele) streefwaarde afhangt van onder meer de leeftijd, levensverwachting en comorbiditeit van de patiënt. Bij patiënten bij wie slechts een beperkte verbetering van het HbA1c wordt nagestreefd, kan toevoeging van een GLP-1 receptor agonist worden overwogen, zeker als gewichtstoename en (hoger) risico op hypoglykemieën zeer ongewenst zijn. De mogelijke voordelen van GLP-1 receptor agonisten moeten worden afgezet tegen de nadelen. Naast de al genoemde gastro-intestinale bijwerkingen zijn dat vooral de hoge kosten. In hoeverre behandeling met een GLP-1 receptor agonist (op den duur) kosteneffectief is ten opzichte van behandeling met kortwerkend insuline is nog niet bekend. Een Noors onderzoek berekende op basis van een placebogecontroleerd onderzoek dat toevoeging van lixisenatide kosteneffectief was bij insulinebehandelde personen met type 2 diabetes (Huetson 2015). In afwachting van nader onderzoek op dit gebied kan worden gesteld dat kosteneffectiviteit het gunstigst wordt beïnvloed als behandeling met een GLP-1 receptor agonist wordt beperkt tot patiënten die goed reageren en wordt gestopt bij onvoldoende effect.
De werkgroep komt daarom tot de aanbeveling om een proefbehandeling van 6 maanden met een GLP-1 receptor agonist aan te bieden aan personen met type 2 diabetes die met eenmaal daags (langwerkend) insuline al of niet in combinatie met orale middelen onvoldoende glykemische controle bereiken, zeker als zij daarbij al (ernstige) hypoglykemieën ervaren. Een behandelduur van 6 maanden is niet onderzocht, maar lijkt te volstaan om het effect te beoordelen en komt overeen met adviezen uit andere richtlijnen (NICE). Vooraf dienen met de patiënt behandeldoelen voor HbA1c- en gewichtsdaling te worden afgesproken om te beoordelen of het zin heeft de behandeling nadien te continueren. Op basis van de behaalde resultaten in de besproken studies van in de praktijk makkelijk meetbare uitkomsten stelt de werkgroep dat van effectieve behandeling kan worden gesproken indien na een half jaar een HbA1c-daling van tenminste 5 mmol/mol (0,5%) zonder gewichtstoename is bereikt. Indien hier geen sprake van is dient sterk overwogen te worden de behandeling te staken.
Hoewel er geen goede bewijslast is voor een BMI-afkapwaarde waarboven GLP-1 receptor agonisten meerwaarde hebben boven intensivering van insulinetherapie, stelt de werkgroep een afkapwaarde van 30 kg/m2 voor, omdat de patiënten in de geanalyseerde studies voor het overgrote deel een BMI van tenminste 30 kg/m2 hadden. Wel is de werkgroep van mening dat patiënten die behalve type 2 diabetes andere, objectiveerbare, complicaties hebben van overgewicht (zoals slaapapnoe) ook bij een lager BMI in aanmerking komen voor het toevoegen van een GLP-1 receptor agonist. Voorts stelt de werkgroep dat (intensivering van de) insulinebehandeling de voorkeur geniet bij patiënten met een zeer slechte glucoseregulatie (HbA1c >15 mmol/mol boven de individuele streefwaarde). Van GLP-1 receptor agonisten kan in dat geval niet een dermate sterke verbetering van de glucoseregulatie worden verwacht dat daarmee de (individuele) HbA1c-streefwaarde zal worden gehaald. Indien het daarmee lukt de glucoseregulatie aanmerkelijk te verbeteren, kan eventueel alsnog behandeling met een GLP-1 receptor agonist worden overwogen; bij een deel van de patiënten lukt het dan om de insulinebehandeling te versimpelen of zelfs te stoppen (de Wit, 2014). Men dient zeer terughoudend te zijn met GLP-1 receptor agonisten bij patiënten met pancreatitis, (voorstadia van) pancreasmaligniteit, medullair schildkliercarcinoom of bekende (diabetische) gastroparese (in de voorgeschiedenis). Patiënten bij wie deze aandoeningen optreden tijdens gebruik van GLP-1 receptor agonisten dienen hiermee te stoppen. Terughoudendheid is ook geboden bij patiënten met een verminderde inname van voedsel met risico op ondervoeding (bijvoorbeeld door bijkomende ziekte of ouderdom).
Onderbouwing
Achtergrond
Type 2 diabetes wordt gekenmerkt door insulineresistentie en progressieve achteruitgang van de bètacelfunctie en dientengevolge toenemende insulinedeficiëntie. Een aanzienlijk deel van de personen met type 2 diabetes heeft daarom uiteindelijk insulinebehandeling nodig voor goede glucoseregulatie. Aangeraden wordt om te starten met eenmaal daags langwerkende insuline. Dit voorziet in de basale insulinebehoefte en wordt aangepast op geleide van de nuchtere glucosespiegel, maar heeft geen effect op de postprandiale glucosestijging. Daarvoor is kortwerkende insuline nodig, die direct voor de maaltijd wordt gespoten. Nadelen hiervan zijn (verdere) gewichtstoename en een verhoogd risico op hypoglykemieën. Bovendien is intensievere zelfcontrole en -regulatie vereist. Glucagon-like peptide 1 (GLP-1) receptor agonisten hebben eenzelfde effect als humaan endogeen GLP-1, maar met een veel langere werkingsduur. Het glucoseverlagende effect berust op glucose-afhankelijke stimulering van de insuline-afgifte, remming van de glucagonafgifte, vertraging van de maaglediging en potentiëring van het verzadigingsgevoel (na de maaltijd). Omdat de insuline-afgifte niet tijdens nuchtere periodes wordt gestimuleerd, is er geen hoger risico op hypoglykemieën en derhalve geen noodzaak voor extra zelfcontrole op de glucosespiegels. Toevoeging van een GLP-1 receptor agonist aan eenmaal daags langwerkend insuline is eenvoudiger dan een intensief (basaal-bolus) insulineschema. Toevoeging van een GLP-1 receptor agonist aan een basaal insulineschema zou wellicht tot vereenvoudiging van de behandeling kunnen leiden indien hiermee de noodzaak voor bolusinsuline zou komen te vervallen, en daarnaast de kans op hypoglykemie en gewichtstoename kunnen verminderen.
Conclusies / Summary of Findings
|
Matig1
GRADE |
GLP-1 receptor agonisten en bolus insuline hebben een vergelijkbare effectiviteit in het reduceren van HbA1c bij behandeling gedurende 26-30 weken van personen met type 2 diabetes die onvoldoende reageren op een combinatie van metformine en eenmaal daags (basaal) insuline.
Omdat head-to-head vergelijkingen tussen individuele GLP-1 receptor agonisten ontbreken en slechts een enkele RCT per individueel middel beschikbaar is voor de vergelijking met bolus insuline, kan geen uitspraak worden gedaan over eventuele verschillen tussen individuele GLP-1 receptor agonisten.
Bronnen (Diamant, 2014; Mathieu, 2014; Rosenstock, 2014; Rosenstock, 2016) |
|
Matig2
GRADE |
Behandeling met een GLP-1 receptor agonist in plaats van bolus insuline leidt tot een aanzienlijk lager risico op niet-ernstige symptomatische hypoglykemie bij behandeling gedurende 26-30 weken van personen met type 2 diabetes die onvoldoende reageren op een combinatie van metformine en eenmaal daags (basaal) insuline.
De verlaging, tenminste een halvering, van het risico op niet-ernstige symptomatische hypoglykemie is klinisch relevant.
Er zijn geringe aanwijzingen voor een eveneens verlaagd risico op ernstige hypoglykemie bij behandeling met GLP-1 receptor agonisten, maar door de te geringe studieomvang en studieduur van de beschikbare RCT’s is een conclusie niet verantwoord.
Bronnen (Diamant, 2014; Mathieu, 2014; Rosenstock, 2014; Rosenstock, 2016) |
|
- |
De effectiviteit van GLP-1 receptor agonisten in vergelijking met bolus insuline, in het verlagen van micro- en macrovasculaire morbiditeit en mortaliteit is onbekend.
Omvang en looptijd van de beschikbare RCT’s zijn onvoldoende.
Bronnen (Diamant, 2014; Mathieu, 2014; Rosenstock, 2014; Rosenstock, 2016) |
|
Hoog3
GRADE |
Behandeling met een GLP-1 receptor agonist in plaats van bolus insuline leidt tot een aanzienlijk hoger risico op gastro-intestinale bijwerkingen bij behandeling gedurende 26-30 weken van personen met type 2 diabetes die onvoldoende reageren op een combinatie van metformine en eenmaal daags (basaal) insuline.
Bronnen (Diamant, 2014; Mathieu, 2014; Rosenstock, 2014; Rosenstock, 2016) |
|
Zeer laag4
GRADE |
Er zijn geen aanwijzingen voor een verhoogd risico op ernstige bijwerkingen of complicaties bij inzet van GLP-1 receptor agonisten in plaats van bolus insuline bij behandeling van personen met type 2 diabetes die al worden behandeld met (eenmaal daags basaal) insuline.
De stringente inclusie- en exclusiecriteria, geringe omvang en korte looptijd van de RCT’s, laten geen betrouwbare uitspraak toe over het risico op zeldzame (ernstige) bijwerkingen en/ of bijwerkingen op lange termijn van behandeling met GLP-1 receptor agonisten.
Bronnen (Diamant, 2014; Mathieu, 2014; Rosenstock, 2014; Rosenstock, 2016) |
|
Laag5
GRADE |
Er zijn aanwijzingen dat behandeling met een GLP-1 receptor agonist in plaats van bolus insuline leidt tot reductie in lichaamsgewicht bij behandeling gedurende 26-30 weken van personen met type 2 diabetes die onvoldoende reageren op een combinatie van metformine en eenmaal daags (basaal) insuline.
Het gemiddelde gewichtsvoordeel na 26-30 weken behandeling is relatief gering maar ligt net boven de door de werkgroep gehanteerde grens voor klinische besluitvorming van 2,3 kg.
De beschikbare RCT’s geven geen uitsluitsel over de vraag of op de langere termijn een grotere gewichtsreductie wordt bereikt.
Er kan geen uitspraak worden gedaan over verschillen tussen individuele GLP-1 receptor agonisten.
Bronnen (Diamant, 2014; Mathieu, 2014; Rosenstock, 2014; Rosenstock, 2016) |
|
- |
Het effect van toevoeging van een GLP-1 receptor agonist aan intensieve (meermaal daagse) insulinetherapie op het aantal ziekenhuisopnames is onbekend.
Geen van de RCT’s rapporteert ziekenhuisopnames.
Bronnen (Diamant, 2014; Mathieu, 2014; Rosenstock, 2014; Rosenstock, 2016) |
|
Zeer laag6
GRADE |
Er zijn enige aanwijzingen dat 26-30 weken behandeling met een GLP-1 receptor agonist leidt tot een daling van de systolische bloeddruk bij personen met type 2 diabetes die onvoldoende reageren op een combinatie van metformine en eenmaal daags (basaal) insuline.
Effecten op de diastolische bloeddruk en het lipidenpatroon lijken gering of afwezig en niet klinisch relevant.
Onduidelijk is of het gunstige effect op de systolische bloeddruk een klasseneffect is of geneesmiddelspecifiek.
Bronnen (Diamant, 2014) |
|
Zeer laag7
GRADE |
Er zijn enige aanwijzingen dat behandeling met een GLP-1 receptor agonist in plaats van bolus insuline leidt tot een geringe verbetering van patiënttevredenheid en (obesitas-gerelateerde) kwaliteit van leven bij behandeling gedurende 26-30 weken van personen met type 2 diabetes die onvoldoende reageren op een combinatie van metformine en eenmaal daags (basaal) insuline.
De waargenomen verschillen in patiënttevredenheid en kwaliteit van leven tussen patiënten behandeld met een GLP-1 receptor agonist en patiënten behandeld met bolus insuline zijn statistisch significant in het voordeel van GLP-1 receptor agonisten, maar gering en waarschijnlijk niet klinisch relevant.
Bronnen (Diamant, 2014) |
|
- |
De relatieve kosten en kosteneffectiviteit van behandeling met een GLP-1 receptor agonist in vergelijking met bolus insuline zijn onbekend.
Geen van de RCT’s rapporteert kosten of kosteneffectiviteit.
Bronnen (Diamant, 2014; Mathieu, 2014; Rosenstock, 2014; Rosenstock, 2016) |
Samenvatting literatuur
De literatuur zoekactie levert vier relevante RCT’s op (Mathieu, 2014; Diamant, 2014; Rosenstock, 2014; Rosenstock, 2016). Het betreft open-label multinationale RCT’s (12 tot 18 landen, 108 tot 210 klinische locaties) met parallel design, gesponsord door de fabrikant van de GLP-1 receptor agonist en met een behandelduur van 26 tot 30 weken. De RCT van Mathieu (2014) valt op door het relatief grote aantal klinische locaties in verhouding tot het aantal deelnemers: 177 deelnemers uit 119 klinische locaties in 12 landen. Drie RCT’s zijn non-inferioriteits-RCT’s met afname in HbA1c als primaire uitkomstmaat (inferioriteits drempel van 0,4%), in Mathieu (2014) ontbreekt een power berekening. De studiegrootte varieert tussen 88 patiënten per arm in de RCT van Mathieu (Mathieu, 2014) en 281 tot 289 per arm in de overige drie RCT’s (Diamant, 2014; Rosenstock, 2014; Rosenstock, 2016).
De RCT’s zijn van redelijke kwaliteit (zie risk of bias tabel). Het ontbreken van blindering van de interventie heeft mogelijk een effect op titratieschema en dosering van basaal insuline en op rapportage van hypoglykemische episodes. Daarmee is er enige kans op vertekening van resultaten (risk of bias) voor verandering in HbA1c en lichaamsgewicht, hypoglykemische episodes, patiënttevredenheid en kwaliteit van leven.
De RCT’s hanteren stringente inclusie- en exclusiecriteria. De studies includeren volwassenen met type 2 diabetes, behandeld met metformine in combinatie met basaal insuline, en een HbA1c >7% (53 mmol/mol). Patiënten met een klinisch significante voorgeschiedenis van (recente) hart- en vaatziekten (myocardinfarct, hartfalen, beroerte), kanker, nier, lever en gastro-intestinale aandoeningen (inclusief pancreatitis) worden uitgesloten. Rosenstock (2016) sluit ook patiënten uit met een hoge bloeddruk (SBP>180 mmHg of DBP>95 mmHg). In drie RCT’s doorlopen de patiënten voorafgaand aan randomisatie een run-in fase (4 tot 12 weken) waarin de basale insuline behandeling wordt geoptimaliseerd. In Mathieu (2014) is geen sprake van een run-in fase, maar wel zijn deelnemers afkomstig uit een eerdere RCT waarin met basaal insuline werd behandeld. Deelnemers zijn overwegend blank (kaukasisch; 87 tot 94%; 62% in Rosenstock, 2014), van middelbare leeftijd (55 tot 61 jaar), met een diabetesduur van 11 tot 13 jaar, een BMI van 32 kg/m2 en een HbA1c tussen 7,7 tot 8,5% op baseline (gemiddelde waardes; zie evidence-tabel voor details). Deelnemers in de RCT’s komen daarmee redelijk overeen met de voor de uitgangsvraag relevante patiëntengroep. Een belangrijk aandachtspunt is het grotendeels ontbreken van patiënten met (een hoog risico op) ernstige comorbiditeit, met name cardiovasculaire aandoeningen, en van patiënten met een hoog risico op hypoglykemische episodes.
In alle gevallen wordt toevoeging van een GLP-1 receptor agonist vergeleken met intensivering van insulinetherapie door toevoeging van een kortwerkend insuline: insuline aspart 1x/dag (Mathieu, 2014), insuline lispro 3x/dag (Diamant, 2014; Rosenstock, 2014), insuline glulisine 1x/dag of 3x/dag (Rosenstock, 2016). In Mathieu (2014) en een van de armen in Rosenstock (2016) is dus slechts sprake van een beperkte intensivering van insulinetherapie met een enkele bolus insuline (basaal-plus). Er zijn geen studies gevonden waarin toevoeging van GLP-1 receptor agonist wordt vergeleken met intensivering van insulinetherapie door het overschakelen van basaal insuline op menginsuline of bifasisch insuline. De RCT’s testen verschillende GLP-1 receptor agonisten en toedieningsschema’s: subcutane injectie voor de twee grootste maaltijden van een kortwerkende GLP-1 receptor agonist (exenatide 2x/dag: Diamant, 2014) of een wekelijkse of eenmaal daagse subcutane injectie met een langwerkende GLP-1 receptor agonist (liraglutide 1x/dag, Mathieu (2014): albiglutide 1x/week, Rosenstock (2014): lixisenatide 1x/dag, Rosenstock 2016). Alle patiënten worden behandeld met basaal insuline. De dosering van basaal Insuline wordt tenminste wekelijks bijgesteld aan de hand van nuchtere glucose metingen waarbij gestreefd wordt naar een nuchtere glucosewaarde van 4.0 tot 4.9 mmol/l (Mathieu, 2014), ≤5,6 mmol/l zonder hypoglykemie (Diamant, 2014; Rosenstock, 2014), of 4,4 tot 5,6 mmol/l (Rosenstock, 2016). Bij de interpretatie van de resultaten moet rekening worden gehouden met een (mogelijk) verschil in dosering van basaal insuline tussen patiënten behandeld met GLP-1 receptor agonisten en patiënten behandeld met kortwerkend (bolus) insuline.
Glykemische controle (HbA1c; kritieke uitkomstmaat)
De vier RCT’s geven een gering verschil in HbA1c-daling te zien tussen de behandelgroepen, dat meestal in het voordeel is van behandeling met GLP-1 receptor agonist (zie figuur 1). In de RCT van Mathieu (2014) is er sprake van een statistisch significant voordeel voor de GLP-1 receptor agonist. Rosenstock (2016) vinden een statistisch significant voordeel voor de controlebehandeling als dit 3x/dag kortwerkend insuline betreft, maar geen statistisch significant verschil bij vergelijking van GLP-1 receptor agonist met eenmaal daags bolus insuline. Na meta-analyse bedraagt het gemiddelde groepsverschil (MD): MD= -0,06 (95% betrouwbaarheidsinterval, 95%BI= [-0,23; 0,11]; p= 0,48; n= 2140 patiënten), een klein en statistisch niet significant verschil in het voordeel van GLP-1 receptor agonisten. De effectschattingen (95% BI) in drie van de vier RCT’s en na pooling overlappen niet met het door de werkgroep benoemde minimaal klinisch relevant verschil (0,5%).
Eenzelfde beeld ontstaat bij vergelijking van het percentage responders (proportie patiënten met HbA1c ≤7% bij studie einde). Het percentage responders in respectievelijk interventiegroep (GLP-1 receptor agonist) en controlegroep (bolus insuline) bedraagt: 58% en 45% (Mathieu 2014), 50% en 49% (Diamant, 2014), 30% en 25% (Rosenstock, 2014), 42% en 49% (Rosenstock, 2016; basaal-bolus regime), 42% en 38% (Rosenstock, 2016; basaal-plus regime); de verschillen in respons zijn overwegend klein en in alle gevallen statistisch niet significant.
Deze resultaten suggereren een vergelijkbare effectiviteit in termen van reductie van HbA1c gedurende 26 tot 30 weken, van GLP-1 receptor agonisten en bolus insuline. Omdat in de literatuuranalyse head-to-head vergelijking tussen individuele GLP-1 receptor agonisten ontbreken en slechts een enkele RCT per individueel middel beschikbaar is voor de vergelijking met bolus insuline, kan geen uitspraak worden gedaan over eventuele verschillen tussen kortwerkende en langwerkende GLP-1 receptor agonisten, of verschillen tussen individuele GLP-1 receptor agonisten (exenatide 2x/dag, liraglutide 1x/dag, albiglutide 1x/week, lixisenatide 1x/dag). Er moet overigens worden opgemerkt dat het onderscheid tussen kortwerkende en langwerkende GLP-1 receptor agonisten klinisch met name relevant is voor de doseringsfrequentie en niet of veel minder voor het nagestreefde effect dat uitgaat van continue verhoogde GLP-1 spiegels.
Figuur 1 Meta-analyse en forest plot van het effect van GLP-1 receptor agonisten in vergelijking met bolus insuline op HbA1c afname ten opzichte van baseline
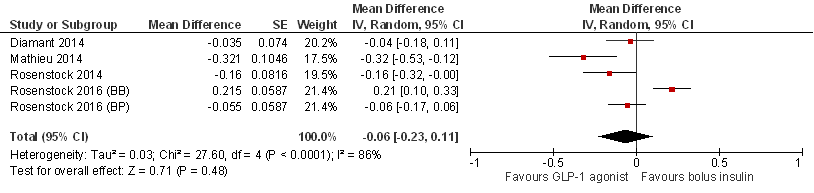
Gemiddeld groepsverschil (MD, mean difference) bij een studieduur van 26-30 weken. Vergelijking met een enkele bolus insuline voor de grootste maaltijd (Mathieu 2014; BP [basaal-plus] regime in Rosenstock 2014) of een bolus voor elke maaltijd (3x/dag; Diamant 2014, Rosenstock 2014, BB [basaal-bolus] regime in Rosenstock 2016). Patiënten aantallen ter illustratie. Random effects model (overall statistische heterogeniteit, I2 = 86%).
Hypoglykemie (bevestigde symptomatische hypoglykemie- kritieke uitkomstmaat)
De RCT’s hanteren verschillende definities voor hypoglykemische episodes (zie evidence-tabel) en niet altijd is duidelijk of symptomatische hypoglykemie wordt bedoeld (Mathieu 2014). Een bevestigde hypoglykemie is een hypoglykemie die is gedocumenteerd met een bloedglucosemeting (lage bloedsuikerwaarde, drempelwaarden tussen 3,0-3,9 mmol/l worden gehanteerd) of waarbij sprake is van een noodzaak voor hulp door anderen. Bij noodzaak voor hulp door anderen wordt gesproken van een ernstige hypoglykemische episode. Rosenstock (2014) hanteert een betrekkelijk hoge drempelwaarde van 3,9 mmol/l. Hierdoor ontstaat een overschatting van het aantal hypoglykemieën, zeker als het gaat om episodes die alleen door een glucosemeting zijn vastgelegd. In dit kader is het belangrijk op te merken dat in een aantal RCT’s patiënten in de bolus insuline groep vaker werden geacht hun bloedglucose te controleren dan patiënten in de GLP-1 receptor agonist groep. Hierdoor kan het beeld van het aantal gerapporteerde hypoglykemieën vertekend zijn ten nadele van behandeling met bolus insuline, met name voor de incidentie van ‘asymptomatische’ hypoglykemieën. De incidentie van hypoglykemische episodes in de RCT’s is daarentegen beduidend lager dan in de klinische praktijk, waarschijnlijk doordat patiënten met een hoog risico op hypoglykemische episodes werden uitgesloten van deelname.
Bevestigde symptomatische hypoglykemie (totaal, nachtelijk)
Mathieu (2014) rapporteert een gemiddelde van 1,0 (waarschijnlijk) symptomatische hypoglykemische episodes per patiëntjaar in de GLP-1 receptor agonist groep, en 8,1 episodes in de bolus insuline groep, statistisch significant in het voordeel van behandeling met de GLP-1 receptor agonist (relatief risico, RR; RR= 0,13; 95%BI= [0,08; 0,21]; p<0,0001). Een vergelijkbaar relatief risico wordt gevonden voor nachtelijke hypoglykemische episodes (RR= 0,14 [0.05; 0.40]; p=0.0002). Rosenstock (2014) vinden een met Mathieu (2014) vergelijkbaar aantal symptomatische hypoglykemische episodes per patiëntjaar in de GLP-1 receptor agonist groep (0,9 per patiëntjaar; 134 episodes), en dit aantal is opnieuw statistisch significant lager dan in de bolus insuline groep (2,3 per patiëntjaar; 325 episodes). Het aantal hypoglykemische episodes in de bolus insuline groep is lager dan in Mathieu (2014), waarschijnlijk als gevolg van een minder stringente insuline titratie in Rosenstock (2014): na 26 weken behandeling is HbA1c 7,7%, in vergelijking met 7,3% in Mathieu (2014). Nachtelijke hypoglykemie wordt niet gespecificeerd. Diamant (2014) vermelden het percentage patiënten met tenminste een hypoglykemische episode: 30% in de GLP-1 receptor agonist groep (332 episodes) en 41% (870 episodes) in de bolus insuline groep, een verschil van 11% in het voordeel van de GLP-1 receptor agonist (p= 0,004); er wordt geen verschil waargenomen voor nachtelijke hypoglykemische episodes (25% versus 27%; 232 versus 297 episodes). Rosenstock (2016) vindt een met Diamant (2014) vergelijkbaar percentage patiënten met tenminste een hypoglykemische episode in de GLP-1 receptor agonist groep (33%), en eveneens hogere percentages in de bolus insuline groepen (39% en 45% in respectievelijk de 1x/dag en 3x/dag bolus insuline groep). Het relatief risico op symptomatische hypoglykemie is lager in de GLP-1 receptor agonist groep (RR= 0,75 [0,53; 1,06] en 0,49 [0,34; 0,69]), en dit geldt ook voor nachtelijke hypoglykemische episodes (RR= 0,58 [0,37; 0,90] en 0,47 [0,30; 0,73]).
Ernstige hypoglykemie
Ernstige hypoglykemische episodes zijn zeldzaam, zowel in patiënten behandeld met een GLP-1 receptor agonist als patiënten behandeld met bolus insuline: afwezig in Mathieu (2104), bij 0,6% versus 2,2% van de patiënten (3 versus 11 episodes) in Diamant (2014), 0 versus 0,7% (0 versus 2 episodes) in Rosenstock (2014), en 0% versus 0,7% (basaal-plus) respectievelijk 0% (basaal-bolus) in Rosenstock (2016). Deze resultaten suggereren een mogelijk lager risico op ernstige hypoglykemie bij behandeling met GLP-1 receptor agonisten, maar door de te geringe studieomvang (te laag aantal events, onvoldoende statistische power) is een betrouwbare uitspraak niet mogelijk.
Deze resultaten laten een aanzienlijk lager risico zien op niet-ernstige symptomatische hypoglykemie, en bevatten enige aanwijzingen voor een niet-significant verlaagd risico op ernstige hypoglykemie, bij behandeling met een GLP-1 receptor agonist in vergelijking tot bolus insuline. De verlaging, tenminste een halvering, van het risico op niet-ernstige symptomatische hypoglykemie lijkt klinisch relevant, maar kan vertekend zijn door onevenredigheid in het aantal glucosemetingen.
Diabetes-gerelateerde complicaties (kritieke uitkomstmaat)
Naast het verhogen van de kwaliteit van leven, is hoofddoel van behandeling het reduceren van micro- en macrovasculaire morbiditeit en mortaliteit, met name hart- en vaatziekten maar ook retinopathie, nefropathie, en bijvoorbeeld voetcomplicaties. Doordat de RCT’s een korte looptijd hebben, stringente inclusie- en exclusiecriteria hanteren en hoog-risicopatiënten uitsluiten, zijn micro- en macrovasculaire morbiditeit en mortaliteit laag. In totaal overlijden in de geïncludeerde RCT’s vijf patiënten en is bij zes patiënten sprake van cardiovasculaire morbiditeit (op een totaal van 2140 patiënten), waarbij de aantallen vrijwel gelijk verdeeld zijn over de behandelgroepen. Omvang en looptijd van de RCT’s zijn onvoldoende om een uitspraak te kunnen doen over de effectiviteit van GLP-1 receptor agonisten in relatie tot micro- en macrovasculaire morbiditeit en mortaliteit.
De veiligheid van GLP-1 receptor agonisten is ook in een breder perspectief geanalyseerd in een aparte uitgangsvraag (zie analyse NHG: NHG, 2017).
Bijwerkingen (ernstige bijwerkingen – kritieke uitkomstmaat)
Het percentage patiënten met adverse events (AE’s), waaronder bijwerkingen van medicatie, is vergelijkbaar tussen de behandelgroepen: 70 tot 74% in de GLP-1 receptor agonist groepen versus 55 tot 80% in de bolus insuline groepen. In de GLP-1 receptor agonist groepen zijn de AE’s vaker gerelateerd aan de medicatie: in Diamant (2014) heeft 42% van de patiënten een mogelijk aan de medicatie gerelateerde AE versus 4% in de bolus insuline groep. Een groter aantal patiënten trekt zich terug uit de RCT vanwege een AE in de GLP-1 receptor agonist groepen: 5,0 tot 5,7% versus 0,4 tot 2,6% van de patiënten in de bolus insuline groepen. Gastro-intestinale bijwerkingen zoals misselijkheid en braken zijn de meest voorkomende reden voor terugtrekking en komen met name voor in de GLP-1 receptor agonist groepen (zie later in de tekst). Er lijkt geen verschil te bestaan in frequentie van ernstige AE’s (SAE’s; kritieke uitkomstmaat): 3,7 tot 7,4% in zowel GLP-1 receptor agonist als bolus insuline groepen. Afgezien van micro- en macrovasculaire morbiditeit en mortaliteit (zie onder Diabetes-gerelateerde complicaties) wordt nauwelijks andere morbiditeit gemeld: een patiënt met pancreatitis in een bolus insuline groep (beoordeeld als niet gerelateerd aan de medicatie; Mathieu 2014) en in een GLP-1 receptor agonist groep (Rosenstock, 2016), een patiënt met alvleesklierkanker in een GLP-1 receptor agonist groep (Diamant, 2014) en een patiënt met schildklierkanker in een GLP-1 receptor agonist groep (Rosenstock, 2014).
De meest voorkomende AE’s zijn milde gastro-intestinale bijwerkingen, en deze treden statistisch significant vaker op bij patiënten behandeld met GLP-1 receptor agonisten: misselijkheid (11 tot 32% in GLP-1 receptor agonist groep versus 1 tot 2% in bolus insuline groep), braken (6 tot 12% versus 1 tot 2%), en diarree (7 tot 13% versus 1 tot 5%). Diamant (2014), de enige RCT met een kortwerkende GLP-1 receptor agonist (exenatide), rapporteert daarnaast indigestie, met name in de GLP-1 receptor agonist groep (6% versus 1%). Verkoudheid lijkt vergelijkbaar vaak voor te komen in de behandelgroepen (6 tot 12% versus 6 tot 13%).
Deze resultaten laten een klinisch relevant hoger risico zien op gastro-intestinale bijwerkingen bij behandeling met GLP-1 receptor agonisten in vergelijking met bolus insuline. Met name deze gastro-intestinale bijwerkingen blijken een reden voor het stoppen van de behandeling met GLP-1 receptor agonisten. Door de stringente inclusie- en exclusiecriteria van de RCT’s, en hun geringe omvang en korte looptijd kan geen betrouwbare uitspraak worden gedaan over het risico op zeldzame (ernstige) en/of lange termijn AE’s bij behandeling met GLP-1 receptor agonisten in vergelijking met bolus insuline. Bijwerkingen zijn daarom ook in een breder perspectief geanalyseerd in een aparte uitgangsvraag met betrekking tot de veiligheid van GLP-1 receptor agonisten, DPP-4-remmers, en SGLT-2-remmers (zie analyse NHG: NHG, 2017).
Verandering in lichaamsgewicht (belangrijke uitkomstmaat)
De RCT’s laten een afname in lichaamsgewicht zien bij behandeling met een GLP-1 receptor agonist (gemiddelde afname met 0,6 tot 2,8 kg in 26 tot 30 weken) en een toename bij behandeling met bolus insuline (gemiddelde toename met 0,8 tot 2,1 kg). In alle RCT’s is er sprake van een statistisch significant verschil in gewichtsverandering ten opzichte van baseline tussen patiënten behandeld met een GLP-1 receptor agonist en patiënten behandeld met bolus insuline (zie figuur 2). Na meta-analyse bedraagt het gemiddelde groepsverschil (MD): MD= -2,7 kg (95%BI= [-3,9; -1,5]; p<0,00001; n= 2140 patiënten), statistisch significant in het voordeel van GLP-1 receptor agonisten. Bij het beoordelen van de effectgrootte en bewijskracht (GRADE) is de werkgroep uitgegaan van een grens voor klinische besluitvorming mede gebaseerd op basis van behoud van een constant lichaamsgewicht, en is een grens gehanteerd van 2,5% van het gemiddelde lichaamsgewicht op baseline (2,3 kg uitgaande van het gemiddelde gewicht van 90 kg; zie Relevante uitkomstmaten onder Zoeken en selecteren). Het gemiddelde gewichtsvoordeel (na pooling) van 2,7 kg na 26-30 weken behandeling met een GLP-1 receptor agonist ten opzichte van bolus insuline ligt boven deze door de werkgroep gehanteerde grens voor klinische besluitvorming van 2,3 kg, maar de effectschatting (95% BI) overlapt wel met de grens voor klinische besluitvorming. In de RCT van Diamant (2014), met een gemiddeld groepsverschil van 4,6 kg, wordt de grens voor klinische relevantie ruim overschreden maar dit hangt mede samen met de toename in gewicht in de bolus insuline groep (met gemiddeld 2,1 kg), die aanzienlijk groter is dan in de overige RCT’s (toename met 0,8 tot 1,4 kg: Mathieu, 2014; Rosenstock, 2014; Rosenstock, 2016).
Samenvattend suggereren de resultaten een mogelijk klinisch relevant voordeel voor behandeling met een GLP-1 receptor agonist in vergelijking met bolus insuline, bij de regulatie van het lichaamsgewicht en het vermijden van een gewichtstoename, bij een vergelijkbare verbetering in glucoseregulatie. Er kan geen uitspraak worden gedaan over eventuele verschillen tussen individuele GLP-1 receptor agonisten. De geïncludeerde RCT’s geven geen uitsluitsel over de vraag of op de langere termijn een grotere gewichtsreductie wordt bereikt. Omdat head-to-head vergelijking tussen individuele GLP-1 receptor agonisten ontbreken en slechts een enkele RCT per individueel middel beschikbaar is voor de vergelijking met bolus insuline, kan geen uitspraak worden gedaan over eventuele verschillen tussen individuele GLP-1 receptor agonisten (exenatide 2x/dag, liraglutide 1x/dag, albiglutide 1x/week, lixisenatide 1x/dag).
Figuur 2 Meta-analyse en forest plot van het effect van GLP-1 receptor agonisten in vergelijking met bolus insuline op verandering in lichaamsgewicht ten opzichte van baseline.
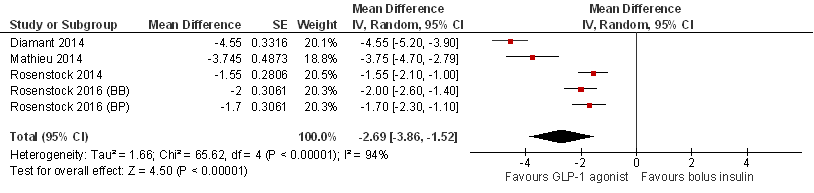
Gemiddeld groepsverschil (MD, mean difference) bij een studieduur van 26 tot 30 weken. Vergelijking met een enkele bolus insuline voor de grootste maaltijd (Mathieu 2014; BP [basaal-plus] regime in Rosenstock, 2014) of een bolus voor elke maaltijd (3x/dag; Diamant 2014, Rosenstock 2014, BB [basaal-bolus] regime in Rosenstock 2016). Patiënten aantallen ter illustratie. Random effects model (overall statistische heterogeniteit, I2 = 94%).
Ziekenhuisopname (belangrijke uitkomstmaat)
Geen van de RCT’s rapporteert het aantal ziekenhuisopnames als uitkomstmaat.
Effect op bloeddruk en lipiden (belangrijke uitkomstmaat)
Alleen Diamant (2014) rapporteren het effect van behandeling op cardiovasculaire risicofactoren, waaronder bloeddruk en lipiden. Er is sprake van een statistisch significante en mogelijk klinisch relevante verandering van de systolische bloeddruk in het voordeel van behandeling met de GLP-1 receptor agonist (exenatide) ten opzichte van bolus insuline: gemiddeld groepsverschil MD= -4,5 mmHg [–7,0; –2,0]; p<0,001; betrouwbaarheidsinterval bevat het minimale klinische relevante verschil van 5 mmHg). Er wordt geen verschil waargenomen in diastolische bloeddruk (gemiddeld groepsverschil, MD= -0,5 mmHg [–2,1; 1,1]; statistisch niet significant). Het HDL-cholesterol verandert statistisch significant, maar niet klinisch relevant, in het nadeel van behandeling met de GLP-1 receptor agonist (gemiddeld groepsverschil, MD= -0,07 mmol/l [–0,10; –0,04]; p<0,001), terwijl geen veranderingen worden waargenomen in LDL-cholesterol (MD= -0,1 mmol/l [–0,2; 0,0]; statistisch niet significant) en de concentratie triglyceriden in het nadeel van behandeling met GLP-1 receptor agonist (MD= 0.11 mmol/l [–0.03; 0.24]; statistisch niet significant). In hoeverre de als klinisch relevant geachte daling van de systolische bloeddruk en de geringe daling van het HDL-cholesterol zich vertalen in daadwerkelijke cardiovasculaire risicoreductie kan niet worden bepaald. Evenmin kan met zekerheid worden gezegd of het hier een klasse-effect of een geneesmiddel-specifiek effect van exenatide betreft.
Patiënttevredenheid en kwaliteit van leven (belangrijke uitkomstmaten)
Alleen Mathieu (2014) rapporteren patiënttevredenheid en kwaliteit van leven in hun RCT naar het effect van behandeling met exenatide. Patiënttevredenheid wordt gemeten met behulp van de DTSQ (Diabetes Treatment Satisfaction Questionnaire), een gevalideerde vragenlijst met acht items (Likert schaal, score tussen 0-6; totaalscore op basis van 6 items 0-36; hoger is beter). Op baseline is de patiënttevredenheid gemeten met de DTSQ al relatief hoog en in beide behandelgroepen neemt deze verder toe: DTSQ-totaalscore van 26,7 naar 28,9 in de GLP-1 receptor agonist groep en van 27,3 naar 28,7 in de bolus insuline groep. De verbetering in DTSQ-totaalscore en in subscores is statistisch significant groter in de GLP-1 receptor agonist groep dan in de bolus insuline groep (DTSQ-totaal score, gemiddeld groepsverschil, MD= 0.80 [SD 5,0]; p<0.01).
Kwaliteit van leven wordt gemeten met de IWQOL-Lite (verkorte vorm van de ‘Impact of Weight on Quality of Life’ vragenlijst), een gevalideerde vragenlijst (Likert schaal; totaal 0-100; hoger is beter) specifiek voor personen met obesitas en gericht op het meten van de invloed van ernstig overgewicht op kwaliteit van leven. In de GLP-1 receptor agonist groep is er een grotere verbetering in IWQOL-Lite-totaalscore en in alle subscores dan in de bolus insuline groep, statistisch significant voor totaalscore en drie van de vijf subscores (totaalscore, gemiddeld groepsverschil, MD= 3,88 (SD 22,0) p<0.01).
Deze resultaten laten een statistisch significante verbetering zien in patiënttevredenheid en invloed van overgewicht op kwaliteit van leven, in het voordeel van behandeling met de GLP-1 receptor agonist. In alle gevallen zijn de groepsverschillen echter klein, en ook aanzienlijk kleiner dan een halve standaarddeviatie, de GRADE default grens voor klinische relevantie bij continue uitkomstmaten (zie het onderdeel Relevante uitkomstmaten onder Zoeken en selecteren). De waargenomen verschillen in patiënttevredenheid en kwaliteit van leven tussen patiënten behandeld met de GLP-1 receptor agonist en patiënten behandeld met bolus insuline zijn daarom waarschijnlijk niet klinisch relevant.
Kosten (belangrijke uitkomstmaat)
Geen van de RCT’s rapporteert kosten of kosteneffectiviteit.
Bewijskracht van de literatuur
De bewijskracht (GRADE-methodiek) is bepaald per uitkomstmaat, de nummering verwijst naar de opeenvolgende literatuurconclusies:
- Glykemische controle (verandering in HbA1c): de bewijskracht is met 1 niveau verlaagd vanwege risk of bias, (RoB; geen blindering van interventie, mogelijke invloed op dosering insuline en daarmee op HbA1c). Omdat de effectschattingen (95% BI) in de individuele RCT’s en na pooling niet overlappen met het door de werkgroep benoemde minimaal klinisch relevant verschil is downgraden vanwege imprecisie of vanwege inconsistentie niet nodig (ondanks de grote statistische heterogeniteit: I2 van 86%; zie figuur 4). De bewijskracht is MATIG.
- Symptomatische hypoglykemie (niet-ernstige symptomatische hypoglykemie): de bewijskracht is met 1 niveau verlaagd vanwege RoB (geen blindering van interventie, mogelijke invloed op dosering insuline en op optreden en rapportage van hypoglykemische episodes). De bewijskracht is MATIG.
- Frequente bijwerkingen (gastro-intestinale bijwerkingen): de bewijskracht is niet verlaagd vanwege RoB, inconsistentie, indirectheid, imprecisie of publicatiebias. Het ontbreken van blindering van de interventie leidt mogelijk tot enige bias in rapportage van bijwerkingen, maar gezien het grote risicoverschil tussen de behandelgroepen, beïnvloedt dit naar inschatting van de werkgroep de zekerheid in de conclusie niet. De bewijskracht is HOOG.
- Zeldzame (ernstige) en/of lange termijn bijwerkingen en complicaties: de bewijskracht is met 1 niveau verlaagd vanwege indirectheid (ontbreken van hoog-risicopatiënten in studiepopulatie) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang, te korte studieduur). De bewijskracht is ZEER LAAG.
- Gewichtsverandering: de bewijskracht is met 1 niveau verlaagd vanwege RoB (geen blindering van interventie, mogelijke invloed op dosering insuline en daarmee op gewichtsverandering), en met 1 niveau vanwege imprecisie (overlap van de effectschatting [95%BI] met de grens voor klinische besluitvorming). Omdat het gemiddelde groepsverschil in geen van de individuele RCT’s ver onder de grens voor klinische besluitvorming ligt, heeft de werkgroep besloten niet te downgraden voor inconsistentie (ondanks de grote statistische heterogeniteit: I2 van 94%; zie figuur 5). De bewijskracht is LAAG.
- Cardiovasculaire risicofactoren (bloeddruk, lipiden): de bewijskracht is met 2 niveaus verlaagd vanwege ernstige indirectheid (ontbreken van patiënten met hoog cardiovasculair risico; onduidelijkheden met betrekking tot cardiovasculair risicomanagement), en met 1 niveau vanwege imprecisie (een enkele RCT). De bewijskracht is ZEER LAAG.
- Patiënttevredenheid en (obesitas-gerelateerde) kwaliteit van leven: de bewijskracht is met 1 niveau verlaagd vanwege RoB (geen blindering van interventie, mogelijke invloed op de PROMS voor patiënttevredenheid en kwaliteit van leven), 1 niveau voor imprecisie (een enkele RCT) en 1 niveau vanwege indirectheid (grotendeels ontbreken van complexe patiënten). De bewijskracht is ZEER LAAG.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: Wat zijn de gunstige en ongunstige effecten bij behandeling van volwassen personen met type 2 diabetes die onvoldoende reageren op een combinatie van metformine en eenmaal daags (basaal) insuline (met of zonder sulfonylureumderivaat), van de toevoeging van een GLP-1 receptor agonist, in vergelijking tot toevoeging van kortwerkend (bolus) insuline (of overschakelen van basaal insuline naar bifasisch of menginsuline)?
Relevante uitkomstmaten
De werkgroep achtte glykemische controle (afname HbA1c), bevestigde symptomatische hypoglykemieën, diabetes-gerelateerde complicaties (mortaliteit; micro- en macrovasculaire morbiditeit [HVZ, retinopathie, nefropathie, voetcomplicaties, erectiele disfunctie]), en ernstige bijwerkingen (SAE’s inclusief kanker en pancreatitis) voor de besluitvorming kritieke uitkomstmaten. Cardiovasculair risico (bloeddruk; lipiden), niet-ernstige bijwerkingen (milde AE’s; drop-outs als gevolg van AE’s), hypoglykemieën (totaal van symptomatisch en niet-symptomatisch, ernstig en niet-ernstig; niet-symptomatische hypoglykemieën), verandering in lichaamsgewicht, patiënttevredenheid, verandering in kwaliteit van leven (QoL), kosten (effectiviteit) en ziekenhuisopname werden benoemd als voor de besluitvorming belangrijke (maar niet kritieke) uitkomstmaten.
De veiligheid van GLP-1 receptor agonisten is ook in een breder perspectief geanalyseerd in een aparte uitgangsvraag (zie analyse NHG: NHG, 2017).
De analyse van hypoglykemische episodes richt zich primair op door glucosemeting bevestigde hypoglykemie, waarbij onderscheid wordt gemaakt tussen symptomatische hypoglykemie (onderscheid tussen totaal en nachtelijk, en tussen ernstig, waarbij hulp van anderen noodzakelijk is, en niet-ernstig) en niet-symptomatische hypoglykemie.
Een hypoglykemie waarbij sprake is van een noodzaak voor hulp door anderen, maar waarbij een bloedglucosemeting ontbreekt, wordt in principe ook tot de categorie bevestigde hypoglykemie gerekend.
Verandering in HbA1c is geanalyseerd ten opzichte van baseline (groepsverschil) als een continue uitkomstmaat, en als percentage responders (groepsverschil; proportie met HbA1c ≤7% [53,0 mmol/mol]). Responder analyses gebaseerd op combinaties van de uitkomstmaten HbA1c, hypoglykemie en gewichtsverandering zijn niet meegenomen.
Tenzij anders vermeld (zie hieronder) werden de door de internationale GRADE working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten. Conform de recente NICE-richtlijn Type 2 diabetes in adults: management (NICE, 2015) definieerde de werkgroep 5 mmol/mol (0,5%) als een minimaal klinisch relevante verandering in HbA1c. Voor verandering in lichaamsgewicht werd een grens voor klinische besluitvorming gedefinieerd mede op basis van behoud van een constant lichaamsgewicht. De werkgroep was van mening dat een toename in lichaamsgewicht als ongewenst moest worden beschouwd, niet louter uit gezondheidsoverwegingen, maar met name ook gelet op kwaliteit van leven en motivering om de bereikte verbetering van de glucoseregulatie op zijn minst te behouden. Daarom maakte de werkgroep bij het bepalen van de grens voor klinische besluitvorming onderscheid tussen een situatie waarin in beide behandelgroepen sprake was van gewichtstoename, en de situatie waarin er slechts in een van beide behandelgroepen sprake was van een gewichtstoename. Bij een gewichtstoename in beide behandelgroepen werd een verschil in gewichtstoename van 5% van het gemiddelde lichaamsgewicht op baseline (4 tot 5 kg bij een gemiddeld lichaamsgewicht tussen 80 en 100 kg) als grens voor klinische besluitvorming gehanteerd (zie Jensen 2014). Als er in de ene behandelgroep sprake was van een gewichtstoename terwijl in de andere behandelgroep het gewicht constant bleef of afnam, werd een minder strenge grens voor klinische besluitvorming gehanteerd bij 2,5% van het gemiddelde lichaamsgewicht op baseline (tussen 2 en 2,5 kg bij een gemiddeld lichaamsgewicht tussen 80 en 100 kg). Bij een gewichtsafname in beide behandelgroepen geldt in principe de strengere grens voor klinische besluitvorming bij 5% gewichtsverandering, deze situatie deed zich echter niet voor.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID, Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 4 mei 2016 vanaf het jaar 2000 met relevante zoektermen gezocht naar systematische reviews (SR’s) en RCT’s die de waarde van GLP-1 receptor agonisten vergelijken met insuline bij de behandeling van volwassen personen met type 2 diabetes die onvoldoende reageren op metformine. De zoekactie is een gecombineerde zoekactie voor de vergelijking tussen GLP-1 receptor agonisten en bolus insuline (deze module) en de vergelijking tussen GLP-1 receptor agonisten en basaal insuline (zie module GLP-1 receptor agonist versus basaal insuline). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 364 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: volwassenen met type 2 diabetes, onvoldoende resultaat bij behandeling met metformine en basaal insuline (glykemische streefwaarden worden niet gehaald), vergelijking van het toevoegen van een GLP-1 receptor agonist met het toevoegen van kortwerkend (bolus) insuline, een door de werkgroep als relevant benoemde uitkomstmaat.
Op basis van titel en abstract werden in eerste instantie 19 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 16 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 3 studies definitief geselecteerd. Aan deze selectie is een onderzoek verschenen net na de zoekperiode toegevoegd (Rosenstock, 2016).
Vier onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Butler AE, Campbell-Thompson M, et al. Marked expansion of exocrine and endocrine pancreas with incretin therapy in humans with increased exocrine pancreas dysplasia and the potential for glucagon-producing neuroendocrine tumors. Diabetes. 2013;62(7):2595-604. doi: 10.2337/db12-1686. PubMed PMID: 23524641.
- Butler PC, Elashoff M, Elashoff R, et al. A critical analysis of the clinical use of incretin-based therapies: Are the GLP-1 therapies safe? Diabetes Care. 2013;36(7):2118-25. doi: 10.2337/dc12-2713. PubMed PMID: 23645885.
- de Wit HM, Vervoort GM, Jansen HJ, et al. Liraglutide reverses pronounced insulin-associated weight gain, improves glycaemic control and decreases insulin dose in patients with type 2 diabetes: a 26 week, randomised clinical trial (ELEGANT). Diabetologia. 2014;57(9):1812-9. doi: 10.1007/s00125-014-3302-0. PubMed PMID: 24947583.
- Diamant M, Nauck MA, Shaginian R, et al. Glucagon-like peptide 1 receptor agonist or bolus insulin with optimized basal insulin in type 2 diabetes. Diabetes Care. 2014;37(10):2763-73. doi: 10.2337/dc14-0876. Epub 2014 Jul 10. PubMed PMID: 25011946.
- Elashoff M, Matveyenko AV, Gier B, et al. Pancreatitis, pancreatic, and thyroid cancer with glucagon-like peptide-1-based therapies. Gastroenterology. 2011;141(1):150-6. doi: 10.1053/j.gastro.2011.02.018. PubMed PMID: 21334333.
- Geller AI, Shehab N, Lovegrove MC, et al. National estimates of insulin-related hypoglycemia and errors leading to emergency department visits and hospitalizations. JAMA Intern Med. 2014;174(5):678-86. doi: 10.1001/jamainternmed.2014.136. PubMed PMID: 24615164
- Huetson P, Palmer JL, Levorsen A, et al. Cost-effectiveness of once daily GLP-1 receptor agonist lixisenatide compared to bolus insulin both in combination with basal insulin for the treatment of patients with type 2 diabetes in Norway. J Med Econ. 2015;18(8):573-85. doi: 10.3111/13696998.2015.1038271. PubMed PMID: 25853868.
- Jensen MD, Ryan DH, Apovian CM, et al.; American College of Cardiology/American Heart Association Task Force on Practice Guidelines.; Obesity Society.. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Circulation. 2014;129(25 Suppl 2):S102-38. doi: 10.1161/01.cir.0000437739.71477.ee. Erratum in: Circulation. 2014 Jun 24;129(25 Suppl 2):S139-40. PubMed PMID: 24222017.
- Lareb. Update overview of reports on new antidiabetic drugs. 2016. Link: http://databankws.lareb.nl/Downloads/Signals_2016_Update_overview_antidiabetic_website.pdf. [geraadpleegd januari 2017].
- Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016b;375(19):1834-1844. PubMed PMID: 27633186.
- Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016a;375(4):311-22. doi: 10.1056/NEJMoa1603827. PubMed PMID: 27295427.
- Mathieu C, Rodbard HW, Cariou B, et al. A comparison of adding liraglutide versus a single daily dose of insulin aspart to insulin degludec in subjects with type 2 diabetes (BEGIN: VICTOZA ADD-ON). Diabetes Obes Metab. 2014;16(7):636-44. doi: 10.1111/dom.12262. Epub 2014 Feb 11. PubMed PMID: 24443830.
- NDF. Voedingsrichtlijn Diabetes (versie 1.3). 2015a. Link: http://www.zorgstandaarddiabetes.nl/wp-content/uploads/2015/06/DEF-NDF-Voedingsrichtlijn-Diabetes-2015-versie-1.3.pdf [geraadpleegd op 20 januari 2017].
- NDF. Zorgstandaard Diabetes. 2015b. Link: http://www.zorgstandaarddiabetes.nl/ [geraadpleegd op 20 januari 2017].
- NHG. NHG-Standaard Diabetes mellitus type 2 (vierde herziening). 2017. [in uitvoering].
- NICE. National Institute for Health and Care Excellence. NICE guidelines [NG28]. Type 2 diabetes in adults: management. 2015. Link: https://www.nice.org.uk/guidance/ng28.
- Pfeffer MA, Claggett B, Diaz R, et al. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. N Engl J Med. 2015;373(23):2247-57. doi: 10.1056/NEJMoa1509225. PubMed PMID: 26630143.
- Rosenstock J, Fonseca VA, Gross JL, et al. Advancing basal insulin replacement in type 2 diabetes inadequately controlled with insulin glargine plus oral agents: a comparison of adding albiglutide, a weekly GLP-1 receptor agonist, versus thrice-daily prandial insulin lispro. Diabetes Care. 2014;37(8):2317-25. doi: 10.2337/dc14-0001. Epub 2014 Jun 4. PubMed PMID: 24898300.
- Rosenstock J, Guerci B, Hanefeld M, et al. Prandial Options to Advance Basal Insulin Glargine Therapy: Testing Lixisenatide Plus Basal Insulin Versus Insulin Glulisine Either as Basal-Plus or Basal-Bolus in Type 2 Diabetes: The GetGoal Duo-2 Trial. Diabetes Care. 2016;39(8):1318-28. doi: 10.2337/dc16-0014. Epub 2016 May 23. PubMed PMID: 27222510.
- Schauer PR, Bhatt DL, Kashyap SR. Bariatric surgery versus intensive medical therapy for diabetes. N Engl J Med. 2014;371(7):682. doi: 10.1056/NEJMc1407393. PubMed PMID: 25119615.
Evidence tabellen
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Zhang 2016 |
verkeerde PICO; SR beperkt zich tot een GLP-1 receptor agonist |
|
Maruthur 2016 |
verkeerde PICO |
|
Thompson 2015 |
geen SR of origineel onderzoek; review beperkt tot een GLP-1 receptor agonist |
|
Goldenberg 2014 |
overwegend verkeerde PICO; beperkte SR met alleen kwalitatieve synthese |
|
Berlie 2012 |
verkeerde PICO; SR met alleen kwalitatieve synthese |
|
Lingvay 2016 |
verkeerde PICO |
|
Yan 2015 |
in Chinees |
|
Investigators F-ST 2015 |
verkeerde PICO; protocol |
|
Blonde 2015 |
verkeerde PICO |
|
Ahmann 2015 |
verkeerde PICO |
|
Lane 2014 |
verkeerde PICO |
|
Distiller 2014 |
verkeerde PICO |
|
de Wit 2014 |
verkeerde PICO |
|
Buse 2014 |
verkeerde PICO (geen vergelijking met insuline escalatie) |
|
Riddle 2013 |
verkeerde PICO |
|
Buse 2011 |
verkeerde PICO |
Tabel Quality assessment (RoB) of RCT’s
Risk of bias table for intervention studies (randomized controlled trials)
Research question: How should patients with T2DM who are inadequately controlled with a combination of metformin and basal insulin (with or without sulfonylurea) be treated: by adding a GLP-1 receptor agonist or by adding a short-acting insulin (or switching from basal to mixed insulins)?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Mathieu 2014 |
not specified |
Unclear*1 |
Unclear*1 |
Unclear*1 |
Unlikely*1 |
Unlikely |
Unlikely |
Unlikely |
|
Diamant 2014b |
block randomization with computer-generated random sequence |
Unlikely |
Unclear*2 |
Unclear*2 |
Unlikely*2 |
Unlikely |
Unlikely |
Unlikely |
|
Rosenstock 2014b |
not specified |
Unclear*3 |
Unclear*3 |
Unclear*3 |
Unlikely*3 |
Unlikely |
Unlikely |
Unlikely |
|
Rosenstock 2016 |
randomized by interactive voice or Web response system |
Unlikely |
Unclear*4 |
Unclear*4 |
Unlikely*4 |
Unlikely |
Unlikely |
Unlikely |
*1 method randomization not specified (paper; trial registry); open-label i.e. intervention not blinded which may e.g. influence dosing and affect outcome: RoB unclear for HbA1c, weight and hypoglycaemic episodes, and likely for basal insulin use; note that SMBG was more frequent in the control group which may bias the relative risk of hypoglycemia (asymptomatic and symptomatic) in favour of GLP-1ra
*2 open-label i.e. intervention not blinded which may e.g. influence dosing and affect outcome: RoB unclear for HbA1c, weight, hypoglycaemic episodes, patient satisfaction and QoL, and likely for basal insulin use; main analysis based on PP but identical results with ITT analysis
*3 method randomization not specified (paper; trial registry); open-label i.e. intervention not blinded which may e.g. influence dosing and affect outcome: RoB unclear for HbA1c, weight and hypoglycaemic episodes, and likely for basal insulin use; note: for patients meeting hyperglycemia rescue criteria (22-24%), HbA1c and body weight at time of rescue were carried forward
*4 open-label i.e. intervention not blinded which may e.g. influence dosing and affect outcome: RoB unclear for HbA1c, weight, and hypoglycaemic episodes, and likely for basal insulin use
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis
Evidence-tabel
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: How should patients with T2DM who are inadequately controlled with a combination of metformin and basal insulin (with or without sulfonylurea) be treated: by adding a GLP-1 receptor agonist or by adding a short-acting insulin (or switching from basal to mixed insulins)?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Mathieu 2014
‘BEGIN: VICTOZA ADD-ON’
|
RCT, parallel, open-label
NCT01388361
sept 2011 – July 2012
Setting: multinational (12 countries, 119 sites); Austria, Belgium, Canada, Czech Republic, Denmark, Finland, France, Germany, Norway, Serbia, Spain, United States
Funding, COI: commercial, Novo Nordisk (manufacturer liraglutide); several potential COI |
Inclusion criteria: adults, DM2, using insulin degludec (IDeg) and metformin ≥104 weeks, HbA1c ≥7%
Exclusion criteria: taking IGlar or DPP4i; calcitonin >50 ng/l; history of pancreatitis or medullary thyroid carcinoma or multiple endocrine neoplasia syndr type 2; in earlier trial (see below) patients excluded with Impaired liver or kidney function, proliferative retinopathy, CVD (stroke, MI, bypass within 24 w of start)
patients completed earlier 52-w RCT and 52-w extension comparing IDeg and IGlar in background of metformin +/- DPP4i; patients on IGlar or DPP4i were excluded (see exclusion criteria)
N total at baseline: 177 Intervention: 88 Control: 89
Important prognostic factors2: For example age ±SD: I: 61.1 ±9.5 C:60.9 ±8.8 Sex: I: 72% M C: 60% M Ethnic origin White/Black/Asian I: 90/7/2% C: 93/3/2 Weight I: 95.4 ±19.2 kg C:91.3 ±16.8 BMI I: 32.5 ±5.4 C: 32.0 ±4.8 Duration Diab I: 12.9 ±6.4 yrs C:11.8 ±6.5 HbA1c % I: 7.7 ±0.6 C: 7.7 ±0.8 Basal insulin dose (U/kg.d) I: 0.70* C: 0.66 *0.57 at week-1 after 20% dose reduction
Groups comparable at baseline? Yes, but not higher weight in intervention and more female subjects in control
|
long-acting GLP1ra liraglutide (OD) n=88 +basal insulin (IDeg) +metformin
Lira 0.6 mg/d, increased to 1.2 mg/d after 1week; if, at week 5, mean pre-breakfast FPG ≥5.0 mmol/l, Lira increased to 1.8 mg/day; from week 6 onward, if pre-breakfast mean was ≥5.0 mmol/l, either Lira increased to 1.8 mg/day (recommended) or IDeg dose increased
IDeg (OD) with main evening meal, titrated (OW) based on mean 3 SMBG values according to algorithm aiming for pre-breakfast FPG of 4.0–4.9 mmol/l [note: in IDeg+Lira arm, IDeg dose reduced by 20% at randomization until week 6]
Metformin dose not reported
65.5% (57/87) ultimately titrated up to 1.8 mg/day of Lira; rest used 1.2 mg/day
|
short-acting insulin insuline aspart (OD) n=89 +basal insulin (IDeg) +metformin
IAsp (OD) 4U before largest daily meal, titrated (OW) based on mean pre-meal or bedtime SMBG
IDeg (OD) with main evening meal, titrated (OW) based on mean 3 SMBG values according to algorithm aiming for pre-breakfast FPG of 4.0–4.9 mmol/l
Metformin dose not reported
At w-25, IAsp injected pre-breakfast by 5%, pre-lunch by 47% and pre-main evening meal by 47% of subjects; end-of-trial mean IAsp dose was 0.21U/kg/day |
Length of follow-up: 26 weeks treatment
Loss-to-follow-up: Intervention: 12 (14%) due to AE (6%), ineffective ther (0%), non-compliance (0%), other (8%) Control: 14 (16%) due to AE (1%), ineffective ther (0%), non-compliance (2%), other (12%) ‘Other’= randomized in error, withdrawn consent, lost to followup, or withdrawn at investigators discretion
Incomplete outcome data: not reported;missing values imputed with LOCF
Data analysis: ANOVA (i.e. correction for covariates) |
HbA1c change (continuous; dichotomous at HbA1c <7%) ; weight change; change in basal insulin dose; hypoglycemia; adverse events (AEs); 95% CI
Hypoglycemia: confirmed hypoglycaemia (SMBG<3.1 mmol/l or severe episodes), nocturnal confirmed hypoglycaemia (confirmed hypo between 00:01 and 05:59), severe episodes (episodes requiring assistance from another person)
Change in HbA1c (%) primary outcome [but no power calculation provided] with respect to baseline I: -0.74 C: -0.39 Diff= -0.32 [-0.53; -0.12] p= 0.0024
Responders (<7.0% HbA1c; %) I: 51/88 (58.0%) C: 40/89 (44.9%) Diff= 13.1% p= NS
Change in weigth (kg) with respect to baseline I: -2.8 C: 0.9 Diff= -3.75 [-4.70; -2.79] p<0.0001
Change insulin dose (U/kg.d) basal insulin IDeg (U/kg.day) with respect to baseline I: 0.08 [using 0.57 for baseline] C: -0.02 Diff= 0.10 p= not reported
Hypoglcycemia (events) episodes/patient-year confirmed (overall) I: 1.00 C: 8.15 ERR= 0.13 [0.08; 0.21] p<0.0001 confirmed nocturnal I: 0.17 C: 1.11 ERR=0.14 [0.05; 0.40] p= 0.0002 severe I: 0 C: 0 Diff= 0 p= NS
Adverse events (other) % patients with event(s) [events per 100 patient years] Overall I: 70.1% [517] C: 54.7 [274] Withdrawn due to AE I: 5.7% (4/5 probably related) C: 1.1 (unlikely related) elevated lipase, vomitting, constipation and injection-site rash probably related to Lira Serious AE (SAE) I: 4.6% [10] C: 5.8% [12] none considered related to trial products mortality I: 0 C: 0 cardiovascular morbidity I: 1.1% (1 CAD; non-MACE) C: 2.3% (1 MACE, 1 non-MACE) other (serious) morbidity I: 0 C: 1.1% (1 pancreatitis) unlikely related to trial products (patient recovered) AEs with ≥5% frequency: Nausea I: 21% C: 0 Vommitting I: 6% C: 0 Diarrhea I: 10% C: 0 Nasopharingitis I: 10% C: 13 Lipase increased I: 6.9% C: 0 Pain in extremity I: 5.7% C: 0 |
Authors conclude that Lira (OD) improved long-term glycaemic control, with weight loss and less hypoglycaemia versus adding a single daily dose of IAsp in patients with T2DM inadequately controlled with IDeg+metformin
Note: insulin intensification by adding a single dose of bolus insulin with the largest daily meal (as a possible initial strategy going from OAD+basal to OAD+basal+bolus)
Note: HbA1c was 7.7 at baseline and inclusion and exclusion criteria (including those of the preceding trial) indicate that the patients require treatment intensification but do not (yet) have very severe or complex DM2
Note: in liraglutide group, IDeg dose was initially reduced by 20%, and Lira or IDeg dose could be increased at investigator’s discretion >>outcome measure Insulin dose has high RoB
Note: in the definition of confirmed hypoglycemia it is unclear whether only symptomatic hypoglycemia episodes are included; SMBG is more frequent in IAsp group increasing the chance of detecting hypoglycemia and increasing the difference in hypoglycemia rate between GLP-1ra and bolus insulin group (high RoB)
Note: nocturnal hypoglycaemia rates were higher in subjects who injected IAsp with main evening meal (1.78/PYE) than at lunch (0.38/PYE); Overall confirmed hypoglycaemia rates did not differ
Note: no sample size (power) calculation made; study is underpowered for a non-inferiority study (see power calculation in Diamant 2014b)
NS statistically not significant IDeg insulin degludec IAsp insulin aspart Lira liraglutide ERR estimated rate ratio COI conflicts of interest LOCF last observation carried forward |
|
Diamant 2014b
‘4B study’ |
RCT, parallel, open-label, non-inferiority
NCT00960661
Sept 2009 -August 2012
Setting: multinational (17 countries, 108 sites); Netherlands, Argentina, Belgium, France, Germany, Italy, Spain, UK, Korea, Mexico, Russian Federation and others
Funding, COI: commercial,Eli Lilly, Amylin, AstraZeneca (manufacturer exenatide); several potential COI |
Inclusion criteria: adults, DM2, using insulin glargine (IGlar) and metformin +/- SU; HbA1c 7-10%; BMI 25-45 kg/m2
Exclusion criteria: use of other glucose-lowering agents; clinically sign history of cardiac disease; clinically sign hematologic, oncologic, renal, cardiac, hepatic or gastrointestinal disease; history of pancreatitis; active or untreated malignancy
basal insulin optimization phase (12 weeks): SU discontinued; bedtime IGlar titrated to FPG ≤5.6 mmol/L without hypo (glucose <3.0 mmol/L); based on SMBG and dosing aid; patients not reaching HbA1c ≤7.0% were randomized
652/917 with high HbA1c, 637 randomized, 627 continued in study
N total at baseline: 627 Intervention: 315 Control: 312
Important prognostic factors2: For example age ±SD: I: 59.5 ±9.6 yrs C: 59.4 ±9.3 Sex: I: 52% M C: 51% M Ethnic origin White/Black/Asian I: 90/<1/5% C: 87/<1/5 Weight I: 89.3 ±16.6 kg C: 90.1 ±17.0 BMI I: 32.7 ±4.7 C: 32.3 ±4.7 Duration Diab I: 12 yrs (median) C: 11 HbA1c (%) I: 8.3 ±1.0 C: 8.2 ±0.9 Basal insulin dose (E/d) I: 61.5 C: 61.1
Groups comparable at baseline? Yes
|
short-acting GLP-1ra exenatide (BID) n=315 +basal insulin (IGlar) +metformin
Exenatide (BID) injected twice daily before 2 largest meals, 5 µg per injection first 4 weeks, 10 µg thereafter; dose reduction allowed based on tolerability
IGlar (OD) initially reduced 10% in patients with HbA1c ≤8.0%; thereafter, IGlar titrated as before (optimization phase)
Metformin 2g/day
at study end, 73% administered 10 µg exenatide per injection and 11% 5 µg per injection. On average 18.6 µg/day |
short-acting insulin lispro (TID) n=312 +basal insulin (IGlar) +metformin
Lispro (TID) before each meal; titrated based on self-monitored premeal glucose values
IGlar (OD) reduced by 1/2 or 1/3, at investigator’s discretion; reduced amount replaced with 3 doses lispro maintaining same total insulin dose; thereafter, IGlar titrated as before (optimization phase)
Metformin 2g/day
|
Length of follow-up: 30 weeks treatment
Loss-to-follow-up: Intervention: 52 (17%) due to subject decision (6%), AE (5%), protocol violation (1%), lack of efficacy (1%), lost to fup (0%), sponsor decision (<1%), death (<1%)
Control: 46 (14%) due to subject decision (9%), AE (2%), protocol violation (<1%), lack of efficacy (0%), lost to fup (<1%), sponsor decision (0%), death (0%)
Incomplete outcome data: not reported; LOCF mentioned
Data analysis: mixed models for repeated measures (MMRM) and ANCOVA with LOCF
Primary analysis (HbA1c) based on PP population (n=464; repeated for ITT population); sec analyses in PP population; AE analyis in as-treated population (randomized subjects taking at least one dose of study drug according to treatment received) |
HbA1c change (continuous; dichotomous at HbA1c ≤7% or 6.5%) ; weight change; cardiovascular parameters (lipds, blood pressure), change in basal insulin dose; patient satisfaction (DTSQ), QoL (IWQOL), hypoglycemia; adverse events (AEs); 95% CI
DTSQ: diabetes treatment satisfaction questionnaire, 8 items (0-6), 6 items in total score (0-36); higher = better
IWQOL-Lite: impact of weigth on qualtiy of life, 31 items in 5 domains and total (0-100); higher = better
Hypoglycemia: major (loss of consciousness or seizure with recovery after glucagon or glucose, or documented hypoglycemia BG <3.0 mmol/L requiring assistance), minor (symptom associated with hypo, self-treated or resolving on its own and BG <3.0 mmol/L), symptoms of hypo (reported episode not fitting major or minor hypo), nocturnal (between bedtime and waking), non-nocturnal (between waking and bedtime)
Change in HbA1c (%) primary outcome with respect to baseline I: -1.13 C: -1.10 Diff= -0.04 [-0.18; 0.11] (PP) p= NS Non-inferiority demonstrated (confirmed in ITT population) Responders (<7.0% HbA1c; %) I: 49.6 [42.6; 55.4] % C: 49.0 [42.9; 55.3] Diff= 0.6% p= NS Responders (<6.5% HbA1c; %) I: 26.2 [20.6; 31.8] % C: 25.5 [20.3; 31.2] Diff= 0.7% p= NS
Change in weigth (kg) with respect to baseline I: -2.5 kg C: 2.1 Diff= -4.6 [-5.2; -3.9] p<0.001
Cardiovascular parameters with respect to baseline SBP (mm Hg) I: -4.1 mm Hg C: 0.4 Diff= -4.5 [–7.0; –2.0] p<0.001 DBP I: -0.6 mm Hg C: -0.1 Diff= -0.5 [–2.1; 1.1] p= NS Cholesterol Total I: -0.1 mmol/L C: -0.0 Diff= -0.1 [–0.2; 0.0] p= NS LDL I: -0.1 mmol/L C: -0.0 Diff=-0.1 [–0.2; 0.0] p= NS HDL I: -0.04 mmol/L C: 0.03 Diff= -0.07 [–0.10; –0.04] p<0.001 Triglycerides I: 0.06 mmol/L C: -0.05 Diff= 0.11 [–0.03; 0.24] p= NS
Change insulin dose (U/d) basal insulin IGlar (U/day) with respect to baseline I: -4.6 C: -9.6 Diff= 5.3 [2.1; 8.5] p= 0.001
Patient satisfaction with respect to baseline DTSQ total score I: 2.19 C: 1.40 Diff= 0.80 (SE 0.23) [SD 5,0] p<0.01 total and all 8 items in favor of exenatide (stat significant)
Qualtity of life with respect to baseline IWQOL-Lite total score I: 4.40 C: 0.51 Diff= 3.88 (SE 1.02) [SD 22,0] p<0.01 total and all 5 items in favor of exenatide (stat significant for 3 items)
Hypoglcycemia (events) % patients with event(s) (total number events) minor (confirmed) I: 30% (332 events) C:41 (870) Diff= 11% p= 0.004 nocturnal (confirmed) I: 25% (232 events) C:27% (297 events) non-nocturnal (confirmed) I: 15% (103 events) C: 34% (584 events) Diff= 19% p<0.001 major I: 0.6% (3 events) C: 2.2% (11 events)
Adverse events treatment-emergent total includes hypoglcycemia % patients with event(s) Overall I: 72.4% (41.6% pos drug rel) C: 56.1 (4.2) p<0.001 (p<0.001) Withdrawn due to AE I: 5.4% C: 2.6 mainly nausea in exenatide group (n=9, 2.9%) Serious AE (SAE) I: 5.7% C: 7.4% mortality I: 0.6% (1 stroke; 1 pan cancer) C: 0 cardiovascular morbidity I: 0 C: 3 (2 MI, 1 bypass) other (serious) morbidity I: 0.3% (1 pancreatic cancer) C: 0 no pancreatitis observed AEs with ≥5% frequency: % patients Nausea I: 32.4% C: 1.6 Vommitting I:12.4% C: 1.0 Diarrhea I: 10.8% C: 5.1% Nasopharingitis I: 11.7% C: 6.4 Dyspepsia I: 6.0% C: 1.0 |
Authors conclude that adding exenatide to titrated glargine with metformin resulted in similar glycemic control as adding lispro and was well tolerated
‘Exenatide requires fewer daily injections, there is less need for glucose monitoring; HbA1c reduction is similar but with less nonnocturnal hypoglycemia, more weight loss, and improved treatment satisfaction’
Note: HbA1c was 8.2 at baseline i.e. higher than in Mathieu 2014, but inclusion and exclusion criteria are as stringent
Note: in both groups basal insulin is initially reduced, and dosing of insulin(s) is subsequently optimized >>outcome measure Insulin dose has high RoB
Note: in Lispro group basal insulin is reduced i.e. procedure differs from more recent ‘basal-plus’ method (cf Rosenstock 2016)
Note: lower dosage of glargine in the lispro group at study end could have affected the primary outcome HbA1c
Note: non-inferiority assessed at HbA1c margin of 0.4% and 0.3% (if upper limit of 95%CI is below margin, non-inferiority is demonstrated)
Note: power calculation (change HbA1c) indicates 580 patients required for 80% power to conclude non-inferiority with a margin of 0.3%, assuming 20% of randomized patients are excluded from PP analysis
Note: 22% exenatide patients tested positive for anti-exenatide antibodies at study end; antibody positivity was associated with similar HbA1c changes and incidences of treatment emergent AEs adverse events
Note: long-acting GLP-1 receptor agonists have less impact on gastric emptying delay and thus reduce mealtime glucose less than short-acting formulations
ITT intention to treat PP per protocol SE Standard Error SD Standard Deviation |
|
Rosenstock 2014b
“HARMONY-6” |
RCT, parallel, open-label, non-inferiority
NCT00976391
Sept 2009 – Oct 2011
Setting: multinational (14 countries, 210 sites); US, Brazil, France, Germany, Hong Kong, India, Korea, Mexico, Peru, Philippines, South Africa, Spain, Taiwan, UK
Funding, COI: commercial, GlaxoSmithKline (manufacturer albiglutide); several potential COI |
Inclusion criteria: adults (18-75 yrs), DM2, using insulin glargine, detemir, or NPH insulin, with or without OAD for ≥6 months and <5 yrs; HbA1c 7-10.5%; BMI 20-45 kg/m2
Exclusion criteria: ongoing sympt biliary disease; his pancreatitis; lipase >ULN; recent clin sign cardiovascular or cerebrovascular disease, his or fam his of medullary carcinoma or multiple endocrine neoplasia type 2; his of stroke
Run-in / stabilization period (4-8 weeks): all patients switched to IGlar, titrated /stabilized over 8 weeks to FPG ≤5.6 mmol/L ; continued current regimen of metformin, pioglitazone, and alpha-glucosidase inhibitors; use of SU, glinides, DPP-4i discontinued (per protocol)
586 randomized, 566 received treatment
N total at baseline: 566 Intervention: 285 Control: 281
Important prognostic factors2: For example age ±SD: I: 54.8 ±9.1 C: 56.3 ±8.9 Sex: I: 46% M C: 48% M Ethnic origin White/Black/Asian I: 62/14/17% C: 62/12/18 Weight I: 92.5 ±21.5 C: 91.6 ±21.0 BMI I: not reported C: not reported Duration Diab I: 11 ±7 C: 11 ±6 HbA1c (%) I: 8.5 ±0.9 C: 8.4 ±0.9 Basal insulin dose (U/d) I: 47.0 C: 43.4
Groups comparable at baseline? Yes
|
long-acting GLP-1ra albiglutide (OW) n=285 +basal insulin (IGlar) +/- metformin +/- TZD
75% used metformin 9% used TZD 23% used neither [5% used SU]
Albiglutide (OW), 30 mg weekly, could be uptitrated to 50 mg if HbA1c >8% in week 8-12 or HbA1c >7.5% in week 12-26
IGlar titrated to FPG <5.6 mmol/L according to insulin titration scheme provided, based on FPG from preceding 2 days (SBMG); dose decreased by 10–15% in case of severe hypoglycemia +/- Metformin dose not reported +/- TZD dose not reported
51% uptitrated to 50 mg albiglutide before week 26
|
short-acting insulin lispro (TID) n=281 +basal insulin (IGlar) +/- metformin +/- TZD
75% used metformin 8% used TZD 24% used neither [5% used SU]
Lispro (TID): preprandial, based on SMBG data; titrated at investigator’s discretion to preprandial glucose 4.4–7.2 mmol/L and peak (1–2 h) postprandial glucose of <10 mmol/L based on average of 2 previous days’ home glucose-monitoring results (before and 2 h after each meal and at bedtime)
IGlar titrated to FPG <5.6 mmol/L according to insulin titration scheme provided, based on FPG from preceding 2 days (SBMG); dose decreased by 10–15% in case of severe hypoglycemia +/- Metformin dose not reported +/- TZD dose not reported
|
Length of follow-up: 26 weeks treatment (end of trial at 52 weeks)
Loss-to-follow-up: Intervention:27/285 (9.5%) due to AEs (5.3%), protocol violation (0.4%), lost to fup (0.7%), withdrew consent (2.5%), other (0.7%)
Control: 17/281 (6.0%) due to AEs (0.4%), protocol violation (0.4%), lost to fup (1.4%), withdrew consent (3.9%), other (0%)
Incomplete outcome data: Intervention: 3/285 (1%) lacking HbA1c assessments Control: none >>ITT population, I/C = 282/281 patients
Note: For patients meeting rescue criteria before w26 or discontinued study participation, HbA1c at time of rescue was carried forward >>I: 61/282 (21.6%) C: 66/281 (23.5%)
Hyperglycemia rescue criteria: after w4, patients eligible to rescue medication if not meeting prespecified HbA1c goals (w4–12: 9.0% and 0.5% change from baseline; w12–16: 8.5%; weeks 16–26: 8.0%) and had not received a recent titration. Choice rescue medication determined by investigator (more intensive insulin titration or addition of other glucose-lowering medications; other GLP-1 analogs prohibited, DPP-4 inhibitor discouraged) |
HbA1c change (continuous; dichotomous at HbA1c ≤7% or 6.5%) ; change in basal insulin dose; hypoglycemia; adverse events (AEs); 95% CI
Hypoglycemia: ADA criteria (2005): severe (requiring assistance), documented symptomatic (BG <3.9 mmol/l), aymptomatic (BG <3.9 mmol/l w/o symptoms), probable symptomatic (symptoms but BG not measured), relative (symptoms but BG>3.9 mmol/l))
Change in HbA1c (%) primary outcome with respect to baseline I: -0.82 C: -0.66 Diff= -0.16 [-0.32; 0.00] p= NS (p value not reported) Non-inferiority demonstrated (p<0.0001 for non-inferiority margin of 0.4%) Note: including postrescue values in analysis results in Diff= -0.06% [-0.22; 0.11]
Responders (<7.0% HbA1c; %) I: 30% C: 25 Responders (<6.5% HbA1c; %) I: 11% C: 8 no statistics reported
Change in weigth (kg) with respect to baseline I: -0.73 C: 0.81 Diff= -1.5 [-2.1; -1.0] p<0.0001
Change insulin dose (U/d) basal insulin IGlar (U/day) with respect to baseline I: 6.2 C: 7.2 Diff= 1.0 p= NS
Hypoglcycemia (events) pre-rescue events/patient-year (total number of events) Severe I: 0 (no events) C: 0.01 (2 events; 2 patients) Documented symptomatic I: 0.94 (134 events) C: 2.33 (325) Diff= 1.39 no statistics provided Documented asymptomatic I: 0.22 (31 events) C: 0.31 (43) nocturnal not specified
Adverse events (other) % patients total includes hypoglcycemia % patients with event(s) Overall I: 73.3% C: 70.8 Withdrawn due to AE I: 5.3% C: 0.4 mainly GI events in albiglutide group (1.4%) Serious AE (SAE) I: 7.4% C: 6.8% mortality none cardiovascular morbidity none other (serious) morbidity I: 0.4% (1 medul thyroid canc) C: 0 no pancreatitis observed AEs with ≥5% frequency: % patients Nausea I: 11.2% C: 1.4 Vommitting I: 6.7% C: 1.4 Diarrhea I: 13.0% C: 4.3 Nasopharingitis I: 6.3% C: 7.8 Urinary tract infection I: 8.4% C: 6.0 |
Authors conclude that weekly albiglutide is a simpler therapeutic option than thrice-daily lispro for advancing basal insulin glargine therapy, resulting in comparable HbA1c reduction with weight loss and lower hypoglycemia risk
Note: almost 25% patients did not use metformin, and only 5% used SU; i.e. study population only partially corresponds to PICO of research question
Note: HbA1c 7.7-7.8 at 26 weeks i.e. considerably above target of 7.0%; probably due to suboptimal titration IGlar. Compare with other RCTs where HbA1c is close to target 7.0% at end of trial (e.g. Mathieu 2014, Diamant 2014b)
Note: HbA1c was 8.4 at baseline i.e. higher than in Mathieu 2014, but inclusion and exclusion criteria are as stringent
Note: ~30% patients is non-caucasian (Black, Asian)
Note: 22-24% patients met hyperglycemia rescue criteria, and their values for HbA1c, FPG, and body weight are carried forward to study end.
Note: power calculation (change HbA1c) indicates 500 patients required to conclude non-inferiority with a margin of 0.4%, assuming 10% loss to follow-up
Note: longer-acting GLP1ra are associated with less gastric emptying and apparently lower rates of gastrointestinal AEs; lower rates of nausea and vomiting may increase adherence
Note: 3.3% albiglutide patients tested positive for anti-exenatide antibodies; all were non-neutralizing
|
|
Rosenstock 2016
‘GetGoal Duo-2’ |
RCT, parallel, open-label, non-inferiority, 3 arms
NCT01768559
Jan 2013 - Dec 2014
Setting: multinational (18 countries, 199 sites); US, Canada, Chile, Czech Republic, Estonia, France, Germany, Hungary, Italy, Latvia, Lithuania, Mexico, Poland, Romania, Russia, Ukraine, UK
Funding, COI: commercial, Sanofi (manufacturer Lixisenatide); several potential COI |
Inclusion criteria: adults, DM2 for >1 yrs, using basal insulin for ≥6 months with or without OAD; HbA1c 7.0-9.0%; BMI 20-40 kg/m2
Exclusion criteria: clin rel his GI disease; his unexplained/chronic pancreatitis; his <6 months of MI, stroke, or heart failure requiring hospitalization; his or fam his of medullary thyroid carcinoma; SBP>180 mmHg or DBP>95 mmHg; amylase and/or lipase >3-times ULN
Run-in (12 weeks): all patients switched to IGlar, titrated to FPG btween 4.4-5.6 mmol/L while avoiding hypo; all OADs other than metformin were discontinued
if HbA1c remained between 7-9% and FPG was ≤140 mg/dL, patients were randomized: 849 randomized
N total at baseline: 849 Intervention: 298 Controls: 298/298
Important prognostic factors2: For example age ±SD: I: 59.8 ±8.6 C1: 60.2 ±8.6 C2: 59.4 ±9.5 Sex: 46/45/44% M Ethnic origin % White 93/94/91% Weight I: 90.1 ±17.4 kg C1: 88.4 ±15.9 C2: 90.0 ±17.2 BMI I: 32.3 ±4.6 C1: 31.9 ±4.4 C2: 32.5 ±4.6 Duration Diab 11.9/12.3/12.4 yrs HbA1c (%) I: 7.8 ±0.6 C1: 7.7 ±0.6 C2: 7.8 ±0.6 Basal insulin dose (U/d) I: 67 ±32 C1: 65 ±32 C2: 65 ±27
Groups comparable at baseline? Yes
|
long-acting GLP-1ra (1 arm) Lixisenatide (OD)
n=298 +basal insulin (IGlar) +/- metformin
88% used metformin
Lixisenatide (OD), 10 µg (OD) week 1-2, followed by 20 µg (OD) for remainder of study, injected 30–60 min before main meal
IGlar (OD) adjusted weekly to FPG 4.4-5.6 mmol/L except w1-4 when a stable insulin dose was maintained; If HbA1c was ≥7.0 and ≤8.0% at week minus–1, insulin glargine dose was reduced by 20%
+/- Metformin ≥1.5 g/day or max tolerated dose
Lixisenatide at breakfast (30% patients) or evening meal (70%)
IGlar injected by 26% in morning, 74% in evening
|
short-acting insulin (2 arms) Glulisine: C1: basal-plus: Glulisine OD C2: basal-bolus: GlulisineTID
n=298 / 298 for C1 and C2 +basal insulin (IGlar) +/- metformin
87% used metformin
Glulisine: starting dose 3–5 U OD (C1) or TID (before each meal; C2) titrated by investigator to SMPG 5.6-7.8 mmol/L while avoiding hypoglycemia
IGlar (OD) adjusted weekly to FPG 4.4-5.6 mmol/L except w1-4 when a stable insulin dose was maintained; If HbA1c was ≥7.0 and ≤8.0% at week minus–1, insulin glargine dose was reduced by 20%
+/- Metformin ≥1.5 g/day or max tolerated dose
C1: glulisine (OD) at breakfast (30% patients) or evening meal (70%)
IGlar injected by 26% in morning, 74% in evening |
Length of follow-up: 26 weeks treatment
Loss-to-follow-up: Intervention:30/298 (10.1%) due to AEs (5.0%), lack of efficacy (2.0%), other (3%)
C1: 17/298 (5.7%) due to AEs (0.7%), lack of efficacy (1.3%), poor protocol compliance (1.0%), other (2.7%) C2: 12/298 (4.0%) due to AEs (1.7%), lack of efficacy (1.3%), poor protocol compliance (0.7%), other (1.7%)
Incomplete outcome data: not reported; LOCF used
Data analysis: ANCOVA with LOCF; mITT (efficacy), safety population (AEs; safety)
|
HbA1c change (continuous; dichotomous at HbA1c ≤7% or 6.5%) ; change in basal insulin dose; hypoglycemia; adverse events (AEs); 95% CI
Hypoglycemia: symptomatic (typical hypo signs/symptoms reported by investigator [not confirmed]), symptomatic per protocol (idem but with glucose <3.3 mmol/L or associated with prompt recovery with oral carbohydrate); severe hypoglycemia (requiring assistance; plus glucose <2.0 mmol/L or prompt recovery after oral carbohydrate, iv glucose, or glucagon); nocturnal (23:00-6:00)
Change in HbA1c (%) with respect to baseline I: -0.6 C1: -0.6 C2: -0.8 Diff-C1= -0.1 [–0.17; 0.06]; pNS Diff-C2= 0.2 [0.10; 0.33] Non-inferiority demonstrated (non-inferiority margin of 0.4%)
Responders (<7.0% HbA1c; %) 42.1/38.4/49.2% Diff-C1= 3.7 [–4.0; 11.5]% Diff-C2= -7.3 [–15.1; 0.6] Responders (<6.5% HbA1c; %) 20.5/17.8/30.8% Diff-C1= 2.7 [–3.6; 9.0] % Diff-C2= -10.5 [–17.3; –3.6]
Change in weigth (kg) coprimary outcome with respect to baseline I: -0.6 C1: 1.0 C2: 1.4 Diff-C1= -1.7 [-2.3; -1.1] Diff-C2= -2.0 [-2.6; -1.4] superiority in comparison with C2 demonstrated (margin of 1 kg)
Change insulin dose (U/d) basal insulin IGlar (U/day) with respect to baseline I: 0.7 C1: -0.1 C2: -3.1 Diff-C1= 0.8 [-1.4; 2.9] Diff-C2= 3.8 [1.7; 6.0]
Hypoglcycemia (events) % patients with event(s) Symptomatic (not confirmed) I: 35.9% C1: 46.5 C2: 52.4 Diff-C1= 10.6% (p= 0.01) Diff-C2= 16.5% (p= 0.0001) Symptomatic per protocol (PP) I: 32.9% C1: 38.9 C2: 44.9 Estimated rate ratio (ERR) ERR-C1= 0.75 [0.53; 1.06] ERR-C2= 0.49 [0.34; 0.69] Nocturnal symptomatic PP ERR-C1= 0.58 [0.37; 0.90] ERR-C2= 0.47 [0.30; 0.73] Severe I: 0 C1: 0.7% (2 patients) C2: 0
Adverse events % patients with event(s) treatment emergent total includes hypoglcycemia Overall 74.2/73.8/80.3% Withdrawn due to AE 5.0/0.7/1.0% mainly due to GI AEs in lixisenatide arm (4%) Serious AE (SAE) 3.7/3.7/4.8% mortality 0.3/0.0/0.7% (1/0/2 patients) none adjudicated to be related to study medication; pancreatic cancer (I), ulcer bleeding / exarcebation chronic HF (C2) cardiovascular morbidity not reported (none?) other (serious) morbidity 0.3/0/0% (1/0/0 patients) patient with mild pancreatitis AEs with ≥5% frequency: % patients Nausea 25.2/1.7/1.0% Vommitting 8.7/1.7/2.0% Diarrhea 6.7/3.3/1.4% Total GI AEs 35.2/8.6/7.5% Nasopharingitis not reported |
Authors conclude that short-acting GLP1ra as add-on to basal insulin may become preferred treatment intensification option, attaining meaningful glycemic targets with fewer hypoglycemic events without weight gain versus basal-plus or basal-bolus in uncontrolled basal insulin-treated type 2 diabetes
‘basal plus prandial insulin being reserved for patients who cannot tolerate GLP-1 RAs due to gastrointestinal AEs’
Note: about 10% patients did not use metformin (and all other OADs were stopped)
Note: HbA1c 77.0-7.2 at 26 weeks i.e.close to target of 7.0%
Note: HbA1c was 7.8 at baseline after basal insulin optimization (HbA1c was 8.5 at screening); inclusion and exclusion criteria are stringent (note DBP and SBP exclusion criteria)
Note: the HbA1c group difference for the comparison with basal-bolus is statistically significant and in favour of basal-bolus; however this group difference is not clinically relevant and does also not meet the common criterium for superiority (margin at 0,3%)
Note: power calculation (change HbA1c) indicates 285 patients per arm required to conclude non-inferiority with a margin of 0.4% (HbA1c) and 1 kg (weight)
Note: no mention of anti-lixisenatide antibodies (in earlier GetGoal-Mono study 60% patients developed antibodies; safety and efficacy do not seem to be affected)
|
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 03-04-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Internisten Vereniging of deze richtlijn (module) nog actueel is. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Module |
Regie-houder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
GLP-1 receptor agonist versus basaal insuline |
NIV |
2017 |
2019 |
jaarlijks |
[NIV of de werkgroep] |
lopend onderzoek, toekomstige beschikbaarheid van nieuwe middelen |
|
DPP-4-remmer versus bolus insuline |
NIV |
2017 |
2019 |
jaarlijks |
[NIV of de werkgroep] |
lopend onderzoek, toekomstige beschikbaarheid van nieuwe middelen |
|
SGLT-2-remmer versus bolus insuline |
NIV |
2017 |
2019 |
jaarlijks |
[NIV of de werkgroep] |
lopend onderzoek, toekomstige beschikbaarheid van nieuwe middelen |
|
GLP-1 receptor agonist versus bolus insuline |
NIV |
2017 |
2019 |
jaarlijks |
[NIV of de werkgroep] |
lopend onderzoek, toekomstige beschikbaarheid van nieuwe middelen |
|
Toevoeging SGLT-2i aan basaal-bolus insuline |
NIV |
2017 |
2019 |
jaarlijks |
[NIV of de werkgroep] |
lopend onderzoek, toekomstige beschikbaarheid van nieuwe middelen |
|
Toevoeging GLP-1 receptor agonist aan basaal-bolus insuline |
NIV |
2017 |
2019 |
jaarlijks |
[NIV of de werkgroep] |
lopend onderzoek, toekomstige beschikbaarheid van nieuwe middelen |
|
Doorverwijs- en terugverwijsbeleid |
NIV |
2017 |
2020 |
eens in de twee jaar |
[NIV of de werkgroep] |
wijzigingen in onderliggende en/of overlappende richtlijnen |
|
Workup bij verwijzing naar tweedelijn |
NIV |
2017 |
2020 |
eens in de twee jaar |
[NIV of de werkgroep] |
lopend onderzoek, wijziging in transmurale afspraken of onderliggende richtlijnen |
|
Adviesfunctie tweedelijn |
NIV |
2017 |
2020 |
eens in de twee jaar |
[NIV of de werkgroep] |
wijzigingen in onderliggende en/of overlappende richtlijnen |
|
Patiënteneducatie, zelfmanagement en leefstijl |
NIV |
2017 |
2020 |
eens in de twee jaar |
[NIV of de werkgroep] |
wijzigingen in onderliggende en/of overlappende richtlijnen |
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In samenwerking met:
- Diabetesvereniging Nederland
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Doel is een multidisciplinaire richtlijn voor de behandeling van verhoogde glucosewaarden bij volwassen personen met DM type 2 die van de eerste naar de tweedelijnszorg verwezen worden. De richtlijn vormt onderdeel van de netwerkrichtlijn diabetes (NIV, 2017), die nauw aansluit bij de integrale Diabetes Mellitus richtlijn (NIV, 2014). De richtlijn beoogt een leidraad te geven voor de dagelijkse zorgpraktijk bij personen met type 2 diabetes en een complexe zorgvraag. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen zijn gericht op optimaal medisch handelen en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek en overwegingen van de werkgroep, waarbij voor zover mogelijk de inbreng door patiënten is meegenomen (patiënten perspectief). Het doel is een hogere kwaliteit en meer uniformiteit in behandelingsstrategie, en het verminderen van praktijkvariatie. Daarvoor zijn duidelijke verwijscriteria van eerste naar tweede lijn (en vice versa) noodzakelijk en adviezen voor een optimale organisatie van zorg. Doel van de richtlijn is met name ook om gestructureerde evidence-based adviezen en stappenplannen te ontwikkelen voor de nieuwe vormen van glucose verlagende medicatie. Behandeladviezen in de huidige richtlijn zullen zich weliswaar beperken tot adviezen die betrekking hebben op glucoseregulatie, maar hierbij zal wel worden aangegeven hoe deze adviezen passen in het totale beleid. Het identificeren van kennislacunes zal richting kunnen geven aan nieuw wetenschappelijk onderzoek en nieuwe ontwikkelingen. Tot slot is naar aanleiding van de noodzaak tot beheersing van de verdere groei van kosten in de gezondheidzorg aandacht besteed aan kosten en kosteneffectiviteit.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg en patiëntvoorlichting voor personen met type 2 diabetes en een complexe zorgvraag: onder andere internisten, huisartsen, specialisten ouderen geneeskunde, diabetesverpleegkundigen, diëtisten, (ziekenhuis-) apothekers, alsmede zij die hiervoor in opleiding zijn en de physician assistants op dit gebied. De richtlijn is met name bedoeld voor mensen met diabetes mellitus type 2 en hun behandelaars in de tweede lijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor mensen met diabetes mellitus type 2.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. B.E. (Bastiaan) de Galan, internist, Radboudumc, Nijmegen (voorzitter); Nederlandse Internisten Vereniging
- Dr. F. (Frits) Holleman, internist-endocrinoloog/vasculaire geneeskunde, Academisch Medisch Centrum, Amsterdam; Nederlandse Internisten Vereniging
- Dr. I.M. (Ingrid) Jazet, internist, Leids Universitair Medisch Centrum LUMC, Leiden; Nederlandse Internisten Vereniging
- Dr. J. (Joke) van der Linden, internist-endocrinoloog, Maasstad Ziekenhuis, Rotterdam; Nederlandse Internisten Vereniging
- Dr. T.M. (Titia) Vriesendorp, internist-endocrinoloog, Diabetescentrum Isala, Zwolle; Nederlandse Internisten Vereniging
- Dr. P.G.H. (Paul) Janssen, huisarts, Huisartsenpraktijk Baambrugge, Baambrugge; Nederlands Huisartsen Genootschap
- Dr. E.P. (Erwin) Klein Woolthuis, kaderhuisarts diabetes, Huisartsenpraktijk Meekes & Klein Woolthuis, Ede; Nederlands Huisartsen Genootschap
- Dr. K.A.C. (Kirsten) Berk, diëtist Erasmus MC, Universitair Medisch Centrum, Rotterdam; Nederlandse Vereniging van Diëtisten/Diabetes and Nutrition Organization
- N.M. (Nicole) La Croix, MANP, diabetesverpleegkundige, Zaans Medisch Centrum, Zaandam; V&VN
- E. (Eglantine) Barents, senior beleidsmedewerker Diabetesvereniging Nederland; Diabetesvereniging Nederland
- J.M. (Anne-Margreeth) Krijger-Dijkema, apotheker, Apotheek Stevenshof, Leiden; Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie en de Nederlandse Vereniging van Ziekenhuisapothekers
Met ondersteuning van:
- Dr. K.N.J. (Koert) Burger, epidemioloog, senior adviseur Kennisinstituut van Medisch Specialisten
- Ir. T.A. (Teus) van Barneveld, directeur Kennisinstituut van Medisch Specialisten
- S. (Samara) de Jong-Jaber, beleidsadviseur Nederlandse Internisten Vereniging
- M. (Monique) Wessels (MSc), medisch informatiespecialist, Kennisinstituut van Medisch Specialisten
- N.F. (Natalia) Bullock, secretaresse, Kennisinstituut van Medisch Specialisten
- S.K. (Sanne) Josso, secretaresse, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
de Galan |
internist |
Spreker/faculty DESG-aioscursus (mede mogelijk gemaakt door Novo Nordisk; betaling ten bate van onderzoeksprojecten Radboudumc) Lid wetenschappelijke adviesraad Diabetesfonds Nederland (onbetaald), Lid research comittee Diabetes UK (onbetaald) Gastdocent Hogeschool Arnhem/Nijmegen (HAN) (betaling aan Radboudumc); voorzitter Accreditatiecommissie NIV (onbetaald); Lid COIG-examencommissie NIV (onbetaald) |
Tot medio 2015 lid medische adviesraad van MSD, NovoNordisk en Sanofi (betaling ten bate van onderzoeksprojecten Radboudumc); Lid European Medical& Strategic lnsulin Working Group, Novo Nordisk Region Europe (betaling ten bate van onderzoeksprojecten Radboudumc); Sprekersvergoeding op nascholings-bijeenkomsten gesponsord door Novo Nordisk en Astra-Zeneca of georganiseerd door derden met sponsoring door verschillende farmaceutische bedrijven, waaronder MSD, Astra Zeneca, Novo Nordisk, Sanofi, Janssen en Menarini; Alle betalingen rechtstreeks ten bate van wetenschappelijke onderzoeksprojecten in het Radboudumc ln de afgelopen 5 jaar tot heden financiele ondersteuning van investigator-geÏnitieerd onderzoek door: Diabetesfonds Nederland (DFN), European Foundation for the Study of Diabetes (EFSD), European Pharma Group (EPG), Novo Nordisk en Astra-Zeneca |
nevenfuncties en belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen en besloten is dat er geen actie hoeft te worden ondernomen (adviezen zijn niet beperkt tot een bedrijf maar verstrekt aan een aantal elkaar beconcurrerende bedrijven op het gebied van de nieuwe middelen) |
|
Holleman |
internist AMC Amsterdam |
Editor diapedia, online textbook of diabetes (onbetaald) Lid NHG-Standaard commissie DM2 (2013; vacatiegelden) |
geen directe persoonlijke financiële belangen, wel ontvangt Stichting Asklepios die het wetenschappelijk onderzoek op het gebied van diabetes in het AMC ondersteunt gelden voor mijn werkzaamheden als lid van Nederlandse (en incidenteel internationale) adviesraden van diverse farmaceutische bedrijven en als spreker op (soms door de farmacie gesponsorde) nascholingen; In recente jaren Sanofi, Eli Lilly, Astra Zeneca, Boehringer Ingelheim, Janssen; als academisch internist is een belangrijk potentieel belangenconflict de druk (van werkgever/omgeving) om wetenschappelijke output te genereren; in het verleden (>3jaar geleden op 21-9-2015) investigator-initiated studies met firma MSD en meegewerkt aan company-initiated farmaceutische studies (onder andere van sanofi); op dit moment betrokken bij Revita-studie (thermische behandeling van twaalfvingerige darm) van de firma Fractyl (georganiseerd door MDL) |
nevenfuncties en belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen en besloten is dat er geen actie hoeft te worden ondernomen |
|
Berk |
dietist diabetesteam Erasmus MC (50%); onderzoeker inwendige Geneeskunde (50%) |
gastdocent post HBO voeding bij diabetes, HAN (betaald). Spreker op diverse symposia/nascholingen op het gebied van diabetes en voeding (betaald) |
Onderzoek naar gebruik van flavanolen bij DM2 en microalbuminurie, gefinancierd door Masquelier BV |
belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen en besloten is dat er geen actie hoeft te worden ondernomen (richtlijn bevat geen uitgangsvragen m.b.t. flavanolen) |
|
van der Linden |
internist -endocrinoloog |
spreker DESG 2015-2016, vergoeding op uurbasis |
Geen |
Geen |
|
Janssen |
huisarts (0,7 fte) universitair docent huisartsenopleiding VUMC (0,3 fte) |
deelname commissie NHG-standaard Diabetes; DiHAG (onbetaald); SCEN-arts (betaald per consultatie); voorzitter kwaliteitscommissie Diabetes Amstelland Zorggroep (vacatievergoeding) |
Geen |
Geen |
|
Barents |
senior beleidsadviseur Diabetesvereniging Nederland |
deelname in diverse werkgroepen namens DVN; deelname commissie NHG-standaard Diabetes; namens DVN afgevaardigde naar Ronde Tafel Diabeteszorg (onbetaald); namens DVN bestuurslid DPARD/Stichting Bidon (onbetaald) |
Geen |
Geen |
|
Jazet |
internist |
Geen |
tot half jaar geleden adviesraad (2015): novo nordisk, astra zeneca, lilly scandic, Aventis (honorering op projectnummer lumc); voordrachten op gebied van DM georganiseerd door derden met sponsoring door verschillende farmaceutische bedrijven, waaronder bovengenoemde bedrijven alsmede health investments, de baar, twohands events (honorering op projectnummer lumc); mede-PI bij 3 investigator-initiated studies die gesponsord worden door de industrie: Magna victoria 1 en 2 (GLP-1 agonist; Novo Nordisk), Effect sitagliptin on BAT (MSD), GLP-1 on BAT (Astra Zeneca) |
nevenfuncties en belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen: geen trekker op vragen m.b.t. GLP-1 agonist (richtlijn bevat geen uitgangsvragen m.b.t. BAT, brown adipose tissue) |
|
La Croix |
diabetesverpleegkundige Zaans Medisch Centrum (24 uur per week) |
Deelname EADV commissie Richtlijnen (onbetaald), EADV werkgroep herziening EADV richtlijn “Het toedienen van insuline met een insulinepen” (onbetaald), DESG (Diabetes Education Study Group) bestuur (onbetaald), Codecommissie Stichting Gedragscode Medische Hulpmiddelen (onbetaald) en spreker EADV/ DESG nascholingen op gebied diabetes (onbetaald/ betaald). |
Deelname adviesraad diabetesverpleegkundigen AstraZeneca 2014-2015 (betaald), NovoNordisk eenmalig 2015 (betaald) en Lilly 2014-2016 (betaald). |
nevenfuncties en belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen: geen trekker op medicamenteuze uitgangsvragen |
|
Vriesendorp |
internist-endocrinoloog |
lid bestuur nederlandse vereniging voor endocrinologie, onbetaald; lid diabetes education study group nederland, onbetaald; organisator bijeenkomst jonge onderzoekers van de ned.vereniging voor diabetesonderzoek en bijeenkomst van north european young diabetologists, onbetaald |
deelname aan GLUCON COPD studie (NCT02253121), gedeeltelijk gefinancierd door unrestricted grant van AstraZeneca |
nevenfuncties en belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen en besloten is dat er geen actie hoeft te worden ondernomen |
|
Krijger-Dijkema |
openbaar apotheker apotheek Stevenshof Leiden en senior onderzoeker SIR institute for pharmacy practice and Policy (betaald) |
lid special interest group (=SIG) diabetes KNMP en afgevaardigde (namens KNMP) in bestuur Nederlands diabetes federatie (NDF) (beide vacatiegeld) |
Geen |
Geen |
|
Klein Woolthuis |
Huisarts |
Kaderhuisarts diabetes (deels betaald, als ZZP-er); penningmeester DiHAG-bestuur (vacatiegelden) |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afvaardiging van de patiëntenvereniging in de werkgroep en een in een eerder stadium door de patiëntenvereniging uitgevoerde enquête onder haar leden (zie richtlijn Diabetes Mellitus; NIV 2014). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging (Diabetesvereniging Nederland).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference door: Diabetesvereniging Nederland, Zorginstituut Nederland, Bijwerkingencentrum Lareb, Koninklijke Nederlandse Maatschappij ter bevordering van de Pharmacie, Stichting Diabetes and Nutrition Organization, Nederlandse Vereniging van Diëtisten, Vereniging Innovatieve Geneesmiddelen, De beroepsorganisatie voor diabeteszorgverleners, Nederlandse Vereniging voor Obstetrie & Gynaecologie, Verpleegkundigen & Verzorgenden Nederland, Nederlandse Vereniging voor de Gezondheidszorgpsychologie, Nederlandse Internisten Vereniging (diabeteskamer) en Ronde Tafel Diabeteszorg. Een verslag van de invitational conference is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor deze richtlijn is geen overkoepelende oriënterende zoekactie uitgevoerd. Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (ROB) tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Indicatorontwikkeling
Er zijn geen nieuwe kwaliteitsindicatoren ontwikkeld omdat er voor diabetes al voldoende indicatoren bestaan, onder andere behorend bij de NDF Zorgstandaard Diabetes (NDF 2015). Daarnaast gaat binnenkort een landelijke kwaliteitsregistratie van start (DPARD: Dutch Pediatric and Adult Registry of Diabetes; pilot fase tot 1 augustus 2017). Indien hieruit nieuwe indicatoren voortkomen zullen deze in een volgende versie van deze richtlijn worden opgenomen.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisatie voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Bijwerkingencentrum Lareb, Zorginstituut Nederland, Vereniging Innovatieve Geneesmiddelen (voorheen Nefarma), Nederlandse Vereniging voor Obstetrie & Gynaecologie, Verpleegkundigen & Verzorgenden Nederland, Nederlandse Vereniging voor de Gezondheidszorgpsychologie, Nederlandse Diabetes Federatie, Inspectie voor de Gezondheidszorg, Zorgverzekeraars Nederland, Patiëntenfederatie Nederland, Nederlandse Federatie van Universitair Medische Centra, Nederlandse Zorgautoriteit, Nederlandse Vereniging van Ziekenhuizen, Stichting InEen, Nederlandse Vereniging voor Klinische Geriatrie, en Verenso. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. 2012. Link: https://richtlijnendatabase.nl/over_deze_site.html
NDF. Zorgstandaard Diabetes. 2015. Link: http://www.zorgstandaarddiabetes.nl/ [geraadpleegd op 20 januari 2017].
NIV. Diabetes mellitus. 2014. Link: https://richtlijnendatabase.nl/richtlijn/diabetes_mellitus/diabetes_mellitus_-_startpagina.html.
NIV. Netwerkrichtlijn Diabetes. 2017. [in ontwikkeling].
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
