SGLT-2-remmers bij patiënten met diabetes mellitus (DM) type 1
Uitgangsvraag
Wat is de waarde van SGLT-2-remmers bij volwassenen met diabetes mellitus type 1?
Aanbeveling
Start niet standaard met SGLT-2-remmers als (aanvullende) behandeling van diabetes mellitus type 1.
Start niet met SGLT-2-remmers bij diabetes mellitus type 1 indien er sprake is van recidiverende genitale infecties of indien er een verhoogd risico is op ketoacidose, zoals bij:
- Eén of meerdere ketoacidoses in het afgelopen jaar.
- Alcoholisme.
- Ondervoeding.
- Gebruik van sterk koolhydraatbeperkt dieet (< 70 gram koolhydraten per dag) of intermitterend vasten.
- Eetstoornissen als anorexia of boulimia nervosa.
- Bijkomende ziekte die gepaard gaat met wisselende of verminderde voedselinname.
Overweeg bij diabetes mellitus type 1 behandeling met SGLT-2-remmers in aanvulling op insulinetherapie alleen in bepaalde situaties, indien overige behandelopties redelijkerwijs zijn uitgeput, bij:
- (zeer) slecht ingestelde diabetes.
- Frequente ernstige hypoglykemieën.
- Hartfalen (op advies van of na afstemming met cardioloog).
Start een behandeling met SGLT-2-remmers alleen als de eGFR > 30 ml/min/1,73 m2. Indien de eGFR daalt tot < 30 ml/min per 1,73 m2 tijdens gebruik van de SGLT-2 remmer, wordt geadviseerd om deze te continueren en pas te staken bij de start van nierfunctievervangende behandeling.
Behandel mensen met diabetes mellitus type 1 alleen met SGLT-2-remmers in geval voldaan is aan de volgende voorwaarden:
- Educatie van de gebruiker met diabetes.
- Instructie te stoppen bij ziekte of anderszins onvoldoende voedselinname.
- Ketonenmeter en -strips met instructie over het gebruik.
- 24-uurs bereikbaarheid van medische achterwacht.
- Jaarlijkse toetsing van educatieniveau bij de gebruiker.
- Formulering van een klinisch relevant behandeldoel met staken van de behandeling indien dat doel niet binnen 6 maanden is gehaald.
Licht de patiënten in over het mogelijk optreden en herkennen van genitale bijwerkingen (met name mycotische infecties, en heel zeldzaam het syndroom van Fournier).
Bespreek met de patiënt de risicofactoren en symptomen van ketoacidose en informeer de patiënt over de noodzaak om inname van de SGLT-2-remmer (tijdelijk) te staken bij misselijkheid, braken of extreme dorst en bij een chirurgische ingreep, en om in deze gevallen contact op te nemen met de behandelend arts.
Overweeg behandeling met SGLT-2-remmers te stoppen indien:
- Er sprake is van recidiverende genitale infecties.
- Er een verhoogd risico is op dehydratie.
- Er een ischemisch voetulcus ontstaat.
- Er een nierfunctievervangende behandeling gestart moet worden.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de gunstige en ongunstige effecten van behandeling met een SGLT-2-remmer vergeleken met placebobehandeling als aanvulling op insulinetherapie bij volwassenen met diabetes mellitus type 1. In tien gerandomiseerde klinische trials werd behandeling met selectieve SGLT-2-remmers dapagliflozine, canagliflozine, empagliflozine en ipragliflozine, en de SGLT-1/2-remmer sotagliflozine vergeleken met placebo.
Als cruciale uitkomstmaten voor de besluitvorming zijn HbA1c, hypoglykemie, diabetische ketoacidose (DKA), tijd binnen de normaalwaarden, boven de normaalwaarden, en onder de normaalwaarden van bloedglucose en kwaliteit van leven onderzocht. Uit deze literatuuranalyse komt naar voren dat aanvullende behandeling van personen met diabetes mellitus type 1 met een SGLT-2-remmer resulteert in:
- een geringe (klinisch niet relevante) verbetering in HbA1c (GRADE beoordeling HOOG);
- waarschijnlijk een vergelijkbaar risico op (niet-ernstige) hypoglykemieën (GRADE beoordeling REDELIJK);
- mogelijk een verlaagd risico op ernstige hypoglykemieën (GRADE LAAG);
- waarschijnlijk een verhoogd risico op diabetische ketoacidose (GRADE REDELIJK);
- een toename in de tijd binnen de normaalwaarden van bloedglucose (GRADE beoordeling HOOG);
- mogelijk een vergelijkbare tijd onder de normaalwaarden van bloedglucose (GRADE LAAG).
Door een gebrek aan onderzoeksgegevens is er geen uitspraak mogelijk over het effect van een aanvullende behandeling met SGLT-2-remmers op de tijd boven de normaalwaarden van bloedglucose, en op de kwaliteit van leven, en is de overall bewijskracht, de laagste gevonden bewijskracht voor één van de cruciale uitkomstmaten, zeer laag.
Belangrijke uitkomstmaten voor de besluitvorming zijn overige bijwerkingen (adverse events) en patiënttevredenheid. Uit de literatuuranalyse komt naar voren dat aanvullende behandeling van personen met diabetes mellitus type 1 met een SGLT-2-remmer resulteert in:
- waarschijnlijk een vergelijkbaar overall risico op overige bijwerkingen (overall adverse events), waarschijnlijk een verhoogd risico op medicatie gerelateerde bijwerkingen, waarschijnlijk een verhoogd risico op (mycotische) genitale infecties, en waarschijnlijk een vergelijkbaar risico op urineweginfecties (GRADE REDELIJK).
Door een gebrek aan onderzoeksgegevens is er geen uitspraak mogelijk over het effect van een aanvullende behandeling met SGLT-2-remmers op patiënttevredenheid.
Enerzijds lijkt aanvullende behandeling met SGLT-2-remmers daarmee te resulteren in enige (klinisch niet relevante) verbetering in HbA1c en een toename in de tijd binnen de normaalwaarden van bloedglucose zonder een verhoogd risico op (niet-ernstige) hypoglykemie, terwijl het risico op ernstige hypoglykemie mogelijk is verlaagd. Uitgaande van een risico op een ernstige hypoglykemie van 10% per jaar bij insulinetherapie zou aanvullende behandeling van 1000 personen met een SGLT-2-remmer gemiddeld resulteren in 17 minder gevallen van ernstige hypo’s (van 32 minder tot 1 meer) maar de effectschatting is onzeker.
Anderzijds lijkt er sprake van een duidelijk verhoogd risico op diabetische ketoacidose en een duidelijk verhoogd risico op (mycotische) genitale infecties. Uitgaande van een risico op een DKA van 1% per jaar bij insulinetherapie zou aanvullende behandeling van 1000 personen met een SGLT-2-remmer gemiddeld resulteren in 25 extra gevallen van DKA (van 14 meer tot 41 meer).
Aanvullende argumenten
De behandeling van diabetes mellitus type 1 bestaat uit insuline, waarbij gestreefd wordt naar een zo goed mogelijke nabootsing van de fysiologie. Verfijning van de insulineproducten naar (ultra-) kortwerkende en (ultra-) langwerkende preparaten en toedieningswijze (injecties of continue pomp) hebben onmiskenbaar verbeteringen gebracht, maar verdere verbetering vanuit farmacologische hoek valt niet te verwachten. De behandeling is echter niet optimaal, zoals blijkt uit het feit dat slechts een minderheid van de mensen met diabetes mellitus type 1 in staat is optimale glucoseregulatie (HbA1c < 53 mmol/mol) te bereiken. De meeste glucoseverlagende medicijnen die de afgelopen jaren zijn ontwikkeld zijn gericht op type 2 diabetes, waarbij de werkzaamheid afhankelijk is van aanzienlijke beta-celreserve. Omdat de werkzaamheid van SGLT-2-remmers onafhankelijk is van de beta-celfunctie, kunnen deze middelen ook worden toegepast bij mensen met diabetes mellitus type 1, zij het altijd als aanvulling en nooit ter vervanging van behandeling met insuline, ook niet gedeeltelijk. Bijkomende voordelen van SGLT-2-remmers zijn de (geringe) daling van de bloeddruk en het gewicht (Dandona, 2018; Rosenstock, 2018; Buse, 2018 en Kaku, 2019). De klinisch niet-relevante verbetering van het HbA1c en de statistisch niet-significante daling van het aantal ernstige hypoglykemieën ondersteunen een dergelijke aanvullende behandeling met SGLT-2-remmers bij diabetes mellitus type 1 echter niet. Bovendien pleit het drievoudig verhoogde risico op ketoacidose niet voor behandeling met SGLT-2-remmers bij diabetes mellitus type 1. Daar is overigens wel een aantal kanttekeningen bij te plaatsen. Ten eerste wordt het ontbreken van statistische significantie op het eindpunt van ernstige hypoglykemieën waarschijnlijk verklaard door het lage aantal events in de studies. Het uitsluiten van patiënten met een verhoogd hypoglykemierisico is hier waarschijnlijk de oorzaak van. Dat ten aanzien van hypoglykemieën in het algemeen geen voordeel van SGLT-2-remmers wordt gezien ligt waarschijnlijk aan een te hoge glucose-afkapwaarde voor hypoglykemieën (meestal 3,9 mmol/l) in plaats van de klinisch meer relevante afkapwaarde van 3,0 mmol/l (Heller, 2020). Ten tweede dienen effecten op het HbA1c en ernstige hypoglykemieën in samenhang te worden gezien, waarbij de gelijktijdige daling van het HbA1c en de incidentie van ernstige hypoglykemieën opmerkelijk is. Anders gezegd, bij een gelijkblijvende incidentie van ernstige hypoglykemieën was de verbetering van het HbA1c wellicht wel klinisch relevant geweest of bij een gelijkblijvend HbA1c de reductie in ernstige hypoglykemieën statistisch significant. De studies zijn niet met dit specifieke doel ontworpen, hebben zich ook niet gericht op specifieke patiëntenpopulaties, zoals bijvoorbeeld mensen met verminderde hypo-awareness bij wie preventie van (ernstige) hypoglykemieën belangrijker kan zijn dan verbetering van het HbA1c. De derde kanttekening is dat geen van de geïncludeerde studies gericht was op nefrologische of cardiale eindpunten of op patiënten met een verhoogd risico op dergelijke problematiek. Er mag vanuit worden gegaan dat verbetering van de glucoseregulatie (daling HbA1c) door een SGLT-2-remmer zich op langere termijn vertaalt in vermindering van micro- en macrovasculaire complicaties, maar dat is (nog) niet aangetoond. Uitgebreid onderzoek bij mensen met type 2 diabetes laat bovendien zien dat het nefro- en cardioprotectieve effect van SGLT-2-remmers op eindpunten grotendeels onafhankelijk is van het HbA1c (Verma, 2018; zie ook richtlijn diabetes type 2, module SGLT-2-remmers bij hoog-risico patiënten; NIV/NHG, 2021). Een recente post-hoc analyse van de DEPICT-studies liet zien dat behandeling met dapagliflozine in vergelijking met placebo bij mensen met diabetes mellitus type 1 geassocieerd was met geringere albuminurie, een geaccepteerde maat voor (beginnende) nierschade (Groop, 2020). Behandeling met SGLT-2-remmers lijkt ook gunstig voor patiënten met alleen hartfalen, dat wil zeggen in afwezigheid van diabetes. Recent onderzoek toont dat behandeling met deze middelen bij deze patiëntengroep leidt tot lagere incidentie van hartfalen en overlijden aan cardiale oorzaken dan placebo (Zannad, 2020). Tot slot zijn er aanwijzingen dat aanvullende behandeling met SGLT-2-remmers bij mensen met diabetes mellitus type 1 leidt tot geringere glucosevariabiliteit (Mathieu, 2018), hetgeen de kwaliteit van leven kan verbeteren en mogelijk ook het risico op complicaties (Lachin, 2017; Beck, 2019). In afwachting van aanvullend onderzoek zou aanvullende behandeling met SGLT-2-remmers bij specifieke diabetes mellitus type 1 patiëntengroepen kunnen worden overwogen. Het gaat dan bijvoorbeeld om patiënten met (progressieve) nefropathie, die niet voldoende reageren op RAAS-blokkade, of bijkomend hartfalen (NYHA klasse II-IV), waarvoor de cardioloog een meerwaarde ziet van toevoeging van een SGLT-2-remmer. Ook kan worden gedacht aan patiënten met frequente (ernstige) hypoglykemieën of sterke glucosevariabiliteit. Afhankelijk van de indicatie dient overwogen te worden om de insuline met 10% te verlagen bij het starten van de SGLT-2-remmer. Momenteel wordt geadviseerd om een SGLT-remmer alleen te starten indien eGFR > 30 ml/min/1,73 m2. Er zijn ontwikkelingen die er toe zouden kunnen leiden dat dit criterium verlaagd wordt naar bijvoorbeeld 25 ml/min/1,73 m2.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Mensen met diabetes mellitus type 1 willen een - zoveel als mogelijk - onbezorgd leven leiden. Dit betekent zo min mogelijk beperkingen door de ziekte en behandeling, terwijl men zo gezond mogelijk blijft zonder korte- en langetermijn complicaties. Hoewel mensen met diabetes mellitus type 1 continu proberen hun glucosewaarden op peil te houden, wordt dit bemoeilijkt door onder andere de invloed van nagenoeg alle beslissingen die men dagelijks neemt (zoals bijvoorbeeld even stofzuigen). Dit verklaart waarom slechts een kleine minderheid de HbA1c streefwaarde lager dan 53 mmol/mol en/of time in range boven de 70% weet te behalen. Het actieve zelfmanagement is voor velen erg stressvol, vooral als men ondanks veel moeite geen positieve (gezondheids) uitkomsten weet te behalen. Uitkomsten zijn gerelateerd aan glucosewaarden, maar ook aan gewicht, slaap en kwaliteit van leven in het algemeen. Mensen met diabetes mellitus type 1 komen vaak in een negatieve spiraal terecht, waarbij de ene negatieve uitkomst bijdraagt aan de andere negatieve uitkomst. Een oraal in te nemen geneesmiddel dat zowel de bloedglucose als het gewicht verlaagt en beschermt tegen langetermijn complicaties zal daarom voor velen aantrekkelijk klinken. Directe positieve uitkomsten van een nieuwe behandeling zouden kunnen helpen bij het omdraaien van zo’n negatieve spiraal. Voorwaarde is wel dat het middel effectief is, over de lange termijn veilig is en er geen of weinig bijwerkingen zijn (zie Rationale). Uiteraard moet er aandacht zijn voor de individuele wensen van de persoon met diabetes, die goed besproken moeten worden en als uitgangspunt dienen voor elke nieuwe interventie. Het gaat dan om goede voorlichting (met betrekking tot gebruik, effect, risico’s en verplichtingen) en gezamenlijk beslissen, alsmede correcte begeleiding gedurende de behandeling.
Kosten (middelenbeslag)
In de studie van Bennett (2020) werd de kosteneffectiviteit van dapagliflozine aanvullend op standaardzorg (insulinetherapie) vergeleken met standaardzorg alleen. De analyse volgens het Cardiff Type 1 Diabetes Mellitus Model was uitgevoerd op basis van de UK National Health Service, gebruikmakend van de resultaten van de DEPICT-1 en DEPICT-2 trials en een netwerk meta-analyse van SGLT-2-remmers bij diabetes mellitus type 1. Als uitkomstmaten werden incremental cost-effectiveness ratio en quality-adjusted life-years gerapporteerd. Toekomstige kosten werden verminderd met 3,5% per jaar. Voor de dosering van 5 mg was dapagliflozine geassocieerd met een toename van 0,23 levensjaren en 0,42 quality-adjusted life years (QALY’s), met een 95% BI van 0,41 tot 0,43 waarbij de extra kosten £4240 per persoon (95% BI £4145 tot £4336) waren. Voor de dosering van 10 mg werd een toename van 0,24 levensjaren en 0,49 QALY’s (95% BI 0,47 tot 0,50) gevonden, met extra kosten ter hoogte van £2964 per persoon (95% BI £2870 tot £3059). De incremental cost-effectiveness ratio (ICER) komt daarbij uit op £6103 per QALY ten opzichte van standaardzorg. Bij interpretatie van deze waarden dient er rekening te worden gehouden met de lage bewijskracht ten gevolge van beperkte extrapoleerbaarheid (bias ten gevolge van indirectheid, omdat het een ander land en zorgsysteem betreft) en onzekerheid over de effectiviteit van de interventie (wat leidt tot imprecisie). Indien toekomstig onderzoek zich richt op patiëntengroepen met hoger uitgangsrisico op gezondheidsschade, zoals ernstige hypoglykemieën, hartfalen of nefropathie, dan kan een dergelijke analyse tot andere resultaten leiden. Dergelijke problematiek gaat immers met hogere kosten gepaard en voorkoming hiervan zou de kosteneffectiviteitsbalans in het voordeel van SGLT-2-remmers kunnen doen uitslaan.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is weinig tot geen goed onderbouwd kwantitatief of kwalitatief onderzoek gedaan naar aanvaardbaarheid of haalbaarheid van aanvullende behandeling met SGLT-2-remmers bij mensen met diabetes mellitus type 1. Zowel in het onderzoeksveld als in de klinische praktijk is veel discussie over de effectiviteit en veiligheid van deze middelen bij de diabetes mellitus type 1 populatie. Dit wordt geïllustreerd door het feit dat de Amerikaanse FDA SGLT-2-remmers niet heeft geregistreerd voor mensen met diabetes mellitus type 1 vanwege zorgen over de veiligheid (met name verhoogd risico op ketoacidose), terwijl de European Medicines Agency (EMA) dat wel heeft gedaan, maar alleen voor mensen met een BMI> 27 kg/m2 (EMA, 2019). Deze BMI-grens is gehanteerd, omdat analyse van de uitgevoerde studies suggereerde dat het risico op ketoacidose niet verhoogd leek te zijn bij zwaardere personen. Bij behandeling van mensen met diabetes mellitus type 1 met SGLT-2-remmers dient nadrukkelijk aandacht te zijn voor het (sterk) verhoogde risico op ketoacidose. Behandeling met SGLT-2-remmers bij deze populatie zal daarom moeten voldoen aan een aantal voorwaarden, zoals grondige educatie en instructies (zoals stoppen bij ziekte) van zowel het zorgpersoneel als mensen met diabetes mellitus type 1 bij wie dergelijke behandeling wordt overwogen. Daarnaast dienen patiënten de mogelijkheid te hebben ketoacidose in vroegtijdig stadium vast te stellen (bijvoorbeeld met een ketonenmeter) en moet het behandelteam laagdrempelig benaderbaar zijn voor overleg en opvang. Het is belangrijk te realiseren dat ketonenmeters en -strips meestal niet door de zorgverzekeraar wordt vergoed. Het verdient aanbeveling de kennis bij patiënten die met een SGLT-2-remmer worden behandeld regelmatig te toetsen en dat geldt wellicht ook voor de kennis bij het zorgpersoneel. Opgemerkt dient te worden dat de mate van surveillance en controle in de dagelijkse praktijk in het algemeen minder is dan in de onderzoeksetting en dat daarom extra voorzichtigheid is geboden bij het inzetten van deze middelen bij mensen met diabetes mellitus type 1. Frequente glucose monitoring is essentieel, zeker bij de start van de behandeling.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
SGLT-2-remmers worden niet standaard aanbevolen als aanvullende behandeling bij diabetes mellitus type 1. Aan dat advies liggen de volgende overwegingen ten grondslag. Ten eerste is de tot nu toe bekende gezondheidswinst bij deze patiëntengroep (te) beperkt. De literatuuranalyse laat zien dat met behandeling met SGLT-2-remmers in het algemeen minder dan 5 mmol/mol HbA1c-daling kan worden bereikt. Weliswaar neemt het risico op hypoglykemieën niet toe en neemt de incidentie van ernstige hypoglykemieën waarschijnlijk af, maar daar staat een min of meer zelfde of zelfs grotere toename aan diabetische ketoacidoses tegenover. Het feit dat deze ook kunnen optreden in afwezigheid van hyperglykemie (‘normoglykemische’ ketoacidose) bemoeilijkt tijdige opsporing hiervan. Bovendien is de verwachting dat het risico op ketoacidoses in de dagelijkse praktijk groter is dan tot nu toe gerapporteerd in goed gecontroleerde klinische trials.
In tegenstelling tot bovenstaande overwegingen zijn er wel uitzonderingen denkbaar waar aanvullende behandeling met een SGLT-2-remmer bij mensen met diabetes mellitus type 1 kan worden overwogen. Het gaat dan onder meer om zeer slecht gereguleerde diabetes of een overmatige incidentie van ernstige hypoglykemieën, waarbij redelijkerwijs geen overige behandelopties meer zijn (behoudens eilandjestransplantatie), dus ondanks behandeling met intensieve insulinetherapie en glucose monitoring met ten minste flash, maar bij voorkeur met real-time, glucose monitoring. Ook kan dergelijke aanvullende behandeling worden overwogen bij patiënten met hartfalen, waarvoor geen andere therapeutische opties zijn. Het behandeldoel is dan niet zozeer gericht op het verbeteren van de glucoseregulatie, maar op het verminderen van de ziektelast op cardiologisch gebied. Bij voorkeur dient in die gevallen behandeling met SGLT-2-remmers te worden afgestemd met of geadviseerd door een cardioloog. Uiteraard dient beslissing tot behandeling met SGLT-2-remmers samen met de betrokken persoon met diabetes mellitus type 1 te worden genomen (shared decision making). Het is volgens de werkgroep nog te vroeg SGLT-2-remmers in te zetten bij patiënten met diabetes mellitus type 1 en (ernstige) diabetische nefropathie. Het is weliswaar aannemelijk dat deze middelen ook in de diabetes mellitus type 1 populatie nefroprotectief zullen werken, maar hoe dit effect zich verhoudt tot de nadelen (met name ketoacidose) is bij afwezigheid van wetenschappelijk bewijs niet te bepalen (zie ook richtlijn Diabetische nefropathie, submodule SGLT-2-remmers; NIV, 2020).
Indien wordt besloten tot behandeling met SGLT-2-remmers bij diabetes mellitus type 1, dan kan dat alleen gebeuren indien is voldaan aan de volgende randvoorwaarden:
- Educatie: zowel de gebruiker met diabetes mellitus type 1 als het behandelteam moet op de hoogte zijn (gebracht) van de werking en de mogelijke bijwerkingen van SGLT-2-remmers, met name ketoacidose en genitale infecties, en de situaties waaronder de medicatie moet worden gestopt. De opgedane kennis dient jaarlijks te worden getoetst.
- Instructies: de gebruiker dient de instructie te krijgen met de medicatie te stoppen bij ziekte of bij anderszins onvoldoende voedselinname (bijvoorbeeld nuchter zijn voor een ingreep, intermitterend vasten of een sterk beperkte koolhydraatinname (<70 gram per dag)).
- Ketonenmeter: de gebruiker moet de beschikking hebben over een ketonenmeter en ketonenstrips met instructie over het gebruik en contactgegevens van het behandelteam.
- 24-uurs bereikbaarheid van medische achterwacht.
- Formulering van een klinisch relevant behandeldoel: voorafgaande aan de start van de behandeling dient tussen behandelaar en gebruiker een klinisch relevant behandeldoel te worden afgesproken; de behandeling dient te worden gestopt indien dat doel niet binnen 6 maanden is gehaald en dient bij voortzetting jaarlijks te worden geëvalueerd.
De werkgroep adviseert te allen tijde tegen het gebruik van SGLT-2-remmers in situaties waarbij er een bovengemiddeld verhoogd risico op ketoacidose bestaat. Het gaat dan onder meer om mensen met diabetes mellitus type 1 die in het voorafgaande jaar ten minste één ketoacidose hebben doorgemaakt, verdacht worden van alcoholmisbruik of een bijkomende ziekte hebben die gepaard gaat met sterk wisselende of verminderde voedselinname. SGLT-2-remmers dienen ook niet te worden toegepast in geval van eetstoornissen als anorexia of boulimia nervosa of in combinatie met intermitterend vasten of een sterk koolhydraatbeperkt dieet (< 70 gram koolhydraten per dag).
Onderbouwing
Achtergrond
Diabetes mellitus type 1 wordt gekenmerkt door (vrijwel) volledige afwezigheid van endogene insulineproductie door de bètacellen in de eilandjes van Langerhans in de pancreas. Mensen met miabetes mellitus type 1 zijn daarom afhankelijk van insulinebehandeling, middels subcutane injecties meerdere malen per dag of middels een continue subcutaan insuline infusie (CSII) door een insulinepomp. Ondanks intensieve insulinetherapie in combinatie met frequente glucosecontrole is optimale glucoseregulatie slechts voor een minderheid van de diabetes mellitus type 1 populatie beschikbaar en zijn zowel hyper- als hypoglykemieën een dagelijkse realiteit. Er is daarom sterke behoefte aan nieuwe behandelingen of behandelstrategieën die de glucoseregulatie kunnen verbeteren en de glucosevariabiliteit verminderen zonder dat het risico op hypoglykemieën toeneemt. SGLT-2-remmers zijn een nieuwe groep glucoseverlagende medicijnen. Deze medicatie blokkeert de natrium-glucose-cotransporter 2 (SGLT-2) in de proximale tubulus. Hierdoor wordt de glucose terugresorptie uit de urine geremd. Dit leidt tot uitscheiding van glucose in de urine. Naast betere glucoseregulatie, zorgen deze medicijnen ook voor gewichtsreductie en bloeddrukverlaging. Deze medicijnen worden vooral toegepast bij type 2 diabetes, maar een aantal is inmiddels ook geregistreerd voor behandeling van diabetes mellitus type 1 naast bestaande insulinetherapie.
Conclusies / Summary of Findings
Critical outcomes
|
High1 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy results in a limited (clinically not relevant) improvement in HbA1c compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (Lu, 2019; Baker, 2019; Kaku, 2019) |
|
Moderate2 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy probably does not reduce the risk of (non-severe) hypoglycaemia compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (Lu, 2019; Baker, 2019; Kaku, 2019) |
|
Low3 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy may reduce the risk of severe hypoglycaemia compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (Lu, 2019; Baker, 2019; Kaku, 2019) |
|
Moderate4 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy probably increases the risk of diabetic ketoacidosis compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (Lu, 2019; Baker, 2019; Kaku, 2019) |
|
High5 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy increases time within normal glucose levels compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (Buse, 2018; Danne, 2018, Mathieu, 2018; Rosenstock, 2018) |
|
Low6 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy may not affect time below normal glucose levels compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (Mathieu, 2018) |
|
- GRADE |
Due to the absence of data, it is unknown whether SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy affects time above normal glucose levels compared to additional placebo treatment in people with type 1 diabetes mellitus. |
Important outcomes
|
Moderate7 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy probably does not increase the risk of overall adverse events compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (Lu, 2019; Baker, 2019; Kaku, 2019) |
|
Moderate8 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy probably increases the risk of drug-related adverse events compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (Lu, 2019; Baker, 2019; Kaku, 2019) |
|
Moderate9 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy probably does not affect the risk of urinary tract infections compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (Lu, 2019; Baker, 2019; Kaku, 2019) |
|
Moderate10 GRADE |
SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy probably increases the risk of (mycotic) genital infections compared to additional placebo treatment in people with type 1 diabetes mellitus.
Sources: (xxx) |
|
- GRADE |
Due to the absence of data, it is unknown whether SGLT-2 inhibitor treatment in addition to (basal-bolus) insulin therapy affects patient satisfaction compared to additional placebo treatment in people with type 1 diabetes mellitus. |
Samenvatting literatuur
Description of studies
The main study characteristics of the included studies are outlined in table 1.
The meta-analysis by Lu (2019) reported efficacy and safety of SGLT-2 inhibitor treatment in addition to standard insulin treatment in adults with DM. The review included 10 studies published from 2015 up to and including 2018, with 5961 patiënten in total. The current analysis included seven of the studies: two abstracts were excluded, and of two studies that reported the same population, only the study with the longest follow-up was included. The included studies investigated selective SGLT-2 inhibitors dapagliflozin, canagliflozin, and empagliflozin as well as SGLT-1/2 inhibitor sotagliflozin. Follow-up of the studies was 12 to 52 weeks and the study populations were comparable. The meta-analysis reported the critical outcomes HbA1c, (severe) hypoglycaemia and DKA, as well as the important outcome other adverse events. The review distinguished low and high dose. All studies were registered and were of high quality (i.e. low risk of bias) based on evaluation with the Cochrane risk of bias tool. The meta-analysis found no indication for publication bias. It should be noted however, that studies were performed by the study sponsor or authors were employed by the sponsor. The review did not report the critical outcomes time above/below normal glucose levels. Therefore, the original publications of the InTandem1 (Buse, 2008), InTandem2 (Danne, 2018), DEPICT-2 (Mathieu, 2018), and EASE-2/EASE-3 trials (Rosenstock, 2018) were analysed.
Baker (2019) reported results of the InTandem4 trial, in which the authors compared the glycaemic and metabolic effects of SGLT-1/2 inhibitor sotagliflozin with placebo in 141 adults with DM1. This registered trial included men and non-pregnant women aged ≥ 18 years with DM1 whose HbA1c level was 7.0% to 10.0% at screening (53 to 86 mmol/mol). Patients with serum beta-hydroxy-butyrate levels > 0.6 mmol/L or estimated glomerular filtration rate < 60 mL/min/1.73 m2 at screening were excluded. Participants were randomly assigned 1:1:1:1 to placebo or sotagliflozin 75, 200 or 400 mg administered once daily before the first meal of the day, with randomization stratified by mode of insulin administration. The critical outcomes HbA1c, (severe) hypoglycaemia and DKA, as well as the important outcome other adverse events were reported, with a follow-up of 12 weeks (table 1). The study was conducted by the study sponsor. The risk of bias was considered low.
The RCT by Kaku (2019) compared SGLT-2 inhibitor ipragliflozin treatment combined with insulin therapy with placebo treatment combined with insulin therapy in 175 adults with DM1. In this Japanese multicentre phase 3 trial, men and women aged ≥ 20 years, diagnosed with DM1, and who had been receiving insulin therapy for ≥ 12 weeks prior to visit 1 (to 6 weeks), were eligible for inclusion. Patients with HbA1c levels between 58 and 96 mmol/mol (7.5% and 11%) at screening, fasting blood C-peptide levels < 0.1987 nmol/L and a body mass index (BMI) of 20.0 to 35.0 kg/m2 were included. Patients were excluded if they had experienced major hypoglycaemia or DKA within 12 weeks prior to visit 1; or had received hypoglycaemic agents other than insulin or α-glucosidase inhibitors (α-GIs) within 8 weeks prior to visit 1. Participants were randomized (2:1) to receive ipragliflozin or placebo. With a follow-up of 24 weeks, the study reported the critical outcomes HbA1c, hypoglycaemia and DKA, as well as the important outcome other adverse events. Most authors were employed by the study sponsor. The risk of bias was considered low.
Table 1 Overview of included trials that compared SGLT-2 (or SGLT-1/2) inhibitors with placebo
|
Publication |
Trial |
Medication |
Dose (mg) |
N |
Follow-up (weeks) |
|
Henry, 2015 |
|
Canagliflozin |
0; 100; 300 |
351 |
18 |
|
Dandona, 2018 |
DEPICT-1 |
Dapagliflozin |
0; 5; 10 |
833 |
52 |
|
Mathieu, 2018 |
DEPICT-2 |
Dapagliflozin |
0; 5; 10 |
813 |
24 |
|
Rosenstock, 2018 |
EASE-2/-3 |
Empagliflozin |
0; 2.5; 10; 25 |
1705 |
26; 52 |
|
Buse, 2018 |
InTandem1 |
Sotagliflozin |
0; 200; 400 |
793 |
52 |
|
Danne, 2018 |
InTandem2 |
Sotagliflozin |
0; 200; 400 |
782 |
24; 52 |
|
Garg, 2017 |
InTandem3 |
Sotagliflozin |
0; 400 |
1402 |
24 |
|
Baker, 2019 |
InTandem4 |
Sotagliflozin |
0; 75; 200; 400 |
141 |
12 |
|
Kaku, 2019 |
|
Ipragliflozin |
0; 50 |
175 |
24 |
Results
HbA1c (critical outcome)
Lu (2019) reported placebo-corrected reductions in HbA1c, distinguishing low and high medication dose. HbA1c was consistently improved after administration of SGLT-2 inhibitors (N=4264) as compared to placebo (N=2315). After addition of the results from Baker (2019) and Kaku (2019), the total pooled corrected reduction was -0.39% (-4.3 mmol/mol), with a 95% confidence interval (CI) from -0.42 to -0.36 (figure 1). For low medication dose alone, the difference was -0.38% (95% CI -0.43 to -0.33; N=3593) and -0.41% (95% CI -0.45 to -0.37; N=4803) for high dose. The HbA1c reduction during SGLT-2 treatment was statistically significant, but seemed too small to be clinically relevant.
Figure 1 HbA1c during treatment with a SGLT-2 inhibitor versus placebo
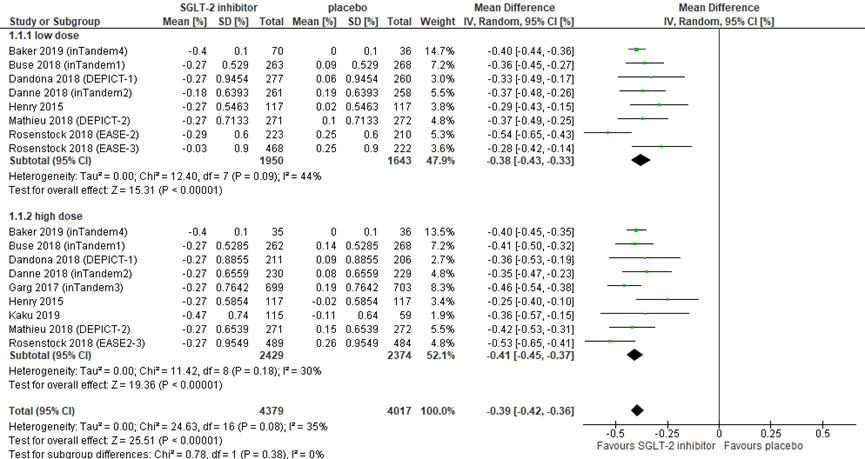
Placebo-corrected difference in HbA1c (%) compared to baseline. df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. Low dose includes sotagliflozin 75 mg and 200 mg, dapagliflozin 5 mg, canagliflozin 100 mg, and empagliflozin 2.5 and 10 mg; high dose includes sotagliflozin 400 mg, dapagliflozin 10 mg, canagliflozin 300 mg, and empagliflozin 25 mg. Following the distinction between low and high doses by Lu (2019), the placebo group is counted double when calculating the total pooled difference
Hypoglycaemia (critical outcome)
The meta-analysis by Lu (2019) and the RCTs by Baker (2019) and Kaku (2019) reported the risk ratio (RR) of hypoglycaemia (usually defined as blood glucose < 3.9 mmol/L) and severe hypoglycaemia (hypoglycaemic event which requires assistance of another person or caregiver), outlined in figure 2 and 3, respectively. For hypoglycaemia, no difference was observed between SGLT-2 inhibitors (N=2617) and placebo (N=1271), with a RR of 1.00 (95% CI 0.99 to 1.01). Therefore, there is no clinically relevant difference between treatment and placebo. High and low dose gave similar results. It should be noted however, that most of the included trials used a higher limit for hypoglycaemia (< 3.9 mmol/L) than the limit defined by the working group (< 3.0 mmol/L).
For severe hypoglycaemia, a RR of 0.83 was found in favour of SGLT-2 inhibitors (N=3176) compared to placebo (N=1755), with a 95% CI from 0.68 to 1.01. This is a clinically relevant but not statistically significant difference in favour of treatment with SGLT-2 inhibitors. Assuming a risk of severe hypoglycaemia of 10% per year with insulin therapy, additional treatment of 1000 people with a SGLT-2 inhibitor would on average result in 17 fewer cases of severe hypoglycaemia (from 32 fewer to 1 more). This (potential) advantage of SGLT-2 inhibitor treatment will likely to be more pronounced in patients with a (substantially) increased risk of severe hypoglycaemia (discussed in “Overwegingen”).
Figure 2 Hypoglycaemia during treatment with a SGLT-2 inhibitor versus placebo
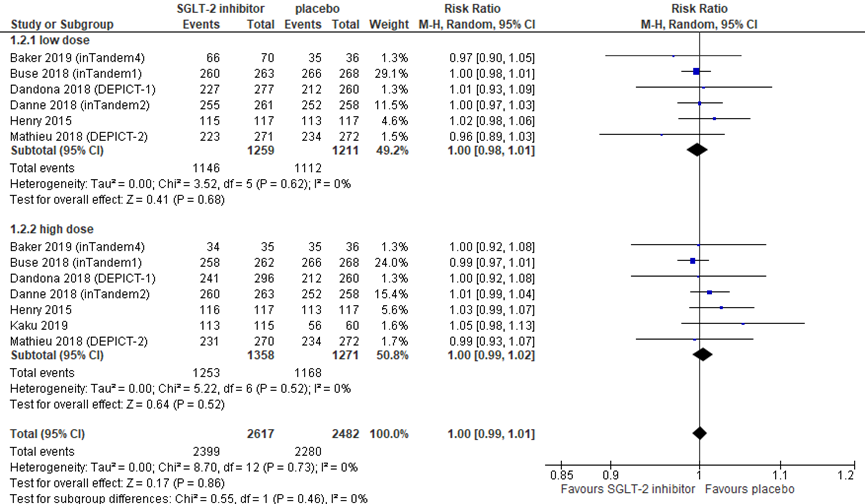
Risk ratio. df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. Low dose includes sotagliflozin 75 mg and 200 mg, dapagliflozin 5 mg, canagliflozin 100 mg, and empagliflozin 2.5 and 10 mg; high dose includes sotagliflozin 400 mg, dapagliflozin 10 mg, canagliflozin 300 mg, and empagliflozin 25 mg. Following the distinction between low and high doses by Lu (2019), the placebo group is counted double when calculating the total pooled difference
Figure 3 Severe hypoglycaemia during treatment with a SGLT-2 inhibitor versus placebo
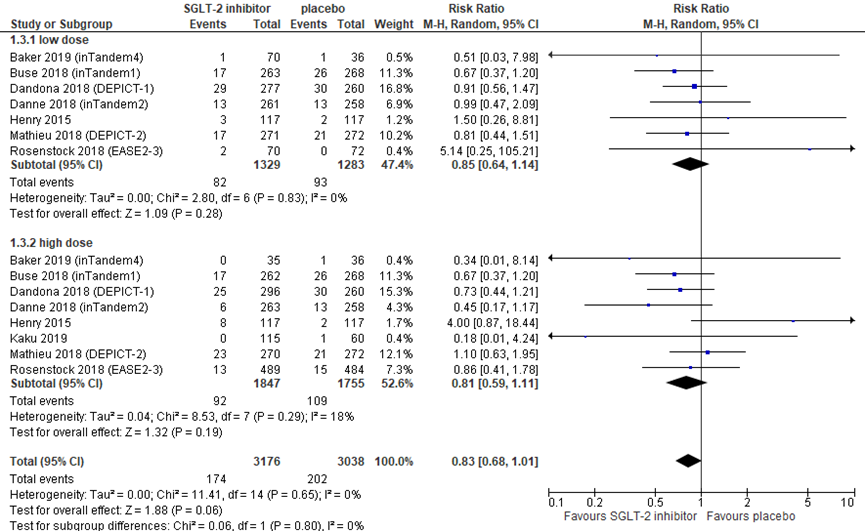
Risk ratio. df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. Low dose includes sotagliflozin 75 mg and 200 mg, dapagliflozin 5 mg, canagliflozin 100 mg, and empagliflozin 2.5 and 10 mg; high dose includes sotagliflozin 400 mg, dapagliflozin 10 mg, canagliflozin 300 mg, and empagliflozin 25 mg. Following the distinction between low and high doses by Lu (2019), the placebo group is counted double when calculating the total pooled difference
Diabetic ketoacidosis (critical outcome)
The meta-analysis by Lu (2019) and the RCTs by Baker (2019) and Kaku (2019) reported the RR of diabetic ketoacidosis (DKA). The pooled RR was 3.46 (95% CI 2.36 to 5.06) in favour of placebo treatment (N=2458) compared to SGLT-2 inhibitors (N=4537). Assuming a risk of DKA of 1% per year with insulin therapy, additional treatment of 1000 people with a SGLT-2 inhibitor would on average result in 25 extra cases of DKA (14 fewer to 41 more). This is a clinically relevant difference in favour of no treatment.
Figure 4 DKA during treatment with a SGLT-2 inhibitor versus placebo
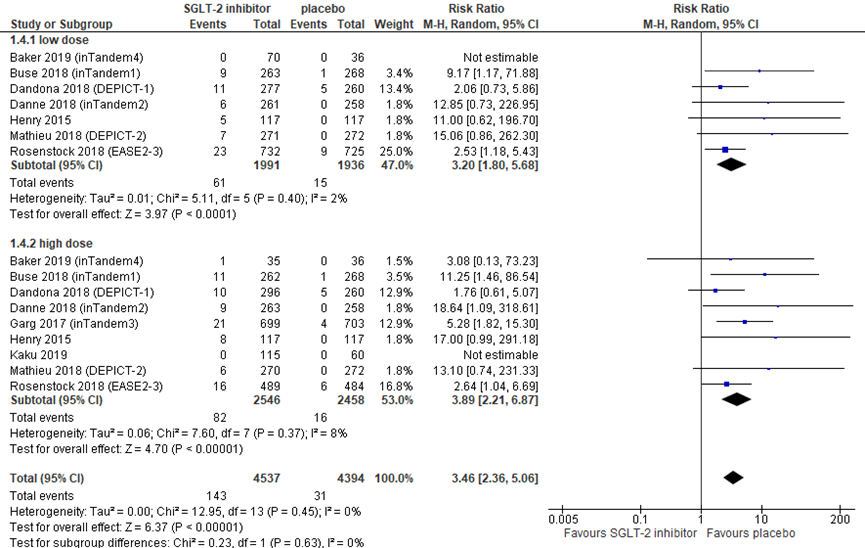
Risk ratio. df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. Low dose includes sotagliflozin 75 mg and 200 mg, dapagliflozin 5 mg, canagliflozin 100 mg, and empagliflozin 2.5 and 10 mg; high dose includes sotagliflozin 400 mg, dapagliflozin 10 mg, canagliflozin 300 mg, and empagliflozin 25 mg. Following the distinction between low and high doses by Lu (2019), the placebo group is counted double when calculating the total pooled difference
Time within normal glucose levels (critical outcome)
The review by Lu (2019) did not report time within normal glucose levels. Therefore, the original publications were used. The results are outlined in figure 5. Taken together, in 5 studies with a total of 1,098 adults with diabetes the change in time within normal glucose levels compared to baseline had a mean difference of 9.33% (95% CI 7.65 to 11.00) in favour of SGLT-2 inhibitors for the low dose. For the high dose, the mean difference compared to placebo was 12.97% (95% CI 11.71 to 14.24; N=1,110). The differences were clinically relevant and statistically significant in favour of SGLT-2 inhibitors.
Figure 5 Time within normal glucose levels during treatment with a SGLT-2 inhibitor versus
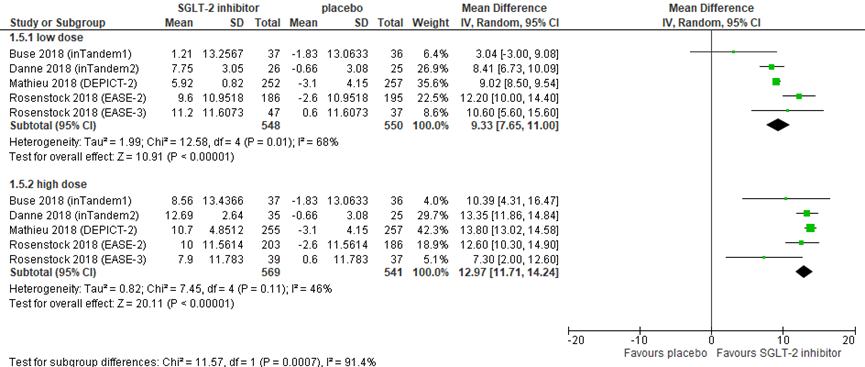
Reported values are difference with baseline in %. df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. Low dose includes sotagliflozin 75 mg and 200 mg, dapagliflozin 5 mg, canagliflozin 100 mg, and empagliflozin 2.5 and 10 mg; high dose includes sotagliflozin 400 mg, dapagliflozin 10 mg, canagliflozin 300 mg, and empagliflozin 25 mg. Following the distinction between low and high doses by Lu (2019), the placebo group is counted double when calculating the total pooled difference
Time below normal glucose levels (critical outcome)
The review by Lu (2019) did not report time within normal glucose levels. Only one of the included publications reported the outcome. Mathieu (2018) found a small and statistically not significant increase in time below target level (< 3.9 mmol/L) for 5 en 10 mg dapagliflozin compared to placebo (N=257) of 0.46% (N=252) and 0.70% (N=255), respectively. These differences are not clinically relevant.
Time below normal glucose levels (critical outcome)
The critical outcome time below normal glucose levels was not reported in the included literature.
Quality of life (critical outcome)
The critical outcome quality of life was not reported in the included literature.
Patient satisfaction
The outcome patient satisfaction was not reported in the included literature.
Other adverse events
The meta-analysis by Lu (2019) and the RCTs by Baker (2019) and Kaku (2019) reported adverse events. Based on 9 trials with a total of 6,977 patients, the pooled RR of overall adverse events was 1.04 (95% CI 1.00 to 1.07) in favour of no treatment, as presented in figure 6. This difference is not clinically relevant. The review also reported drug-related adverse events (ketoacidosis, urinary tract infections, genital infections, diarrhoea and bone fracture) and found a pooled RR of 1.67 (95% CI 1.32 to 2.11) in favour of no treatment (figure 6). This difference is clinically relevant. The most frequently reported drug-related adverse events were urinary tract infections and genital infections. In 8 RCTs with 5,278 participants in total, the pooled RR for urinary tract infections was 1.06 (95% CI 0.90 to 1.26) in favour of no treatment. This is neither statistically signific ant nor clinically relevant. Based on 10 RCTs with 5,434 participants in total, the RR for (mycotic) genital infections was 3.57 (95% CI 2.97 to 4.29) in favour of no treatment. This is a considerable effect, both statistically significant and clinically relevant. In conclusion, although overall adverse effects cannot contribute to clinical decision-making, drug-related adverse effects and (mycotic) genital infections in particular are in favour of no treatment.
Figure 6 Overall adverse events during treatment with a SGLT-2 inhibitor versus placebo
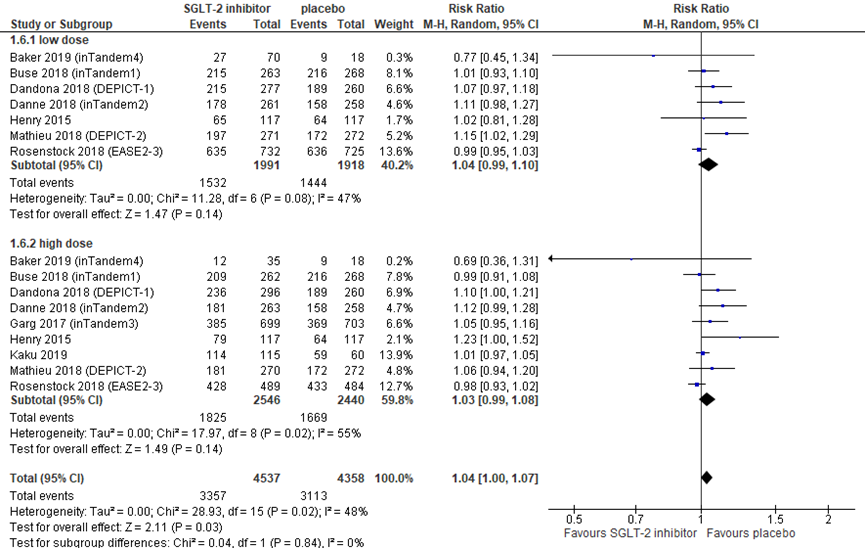
Risk ratio. df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. Low dose includes sotagliflozin 75 mg and 200 mg, dapagliflozin 5 mg, canagliflozin 100 mg, and empagliflozin 2.5 and 10 mg; high dose includes sotagliflozin 400 mg, dapagliflozin 10 mg, canagliflozin 300 mg, and empagliflozin 25 mg. Following the distinction between low and high doses by Lu (2019), the placebo group is counted double when calculating the total pooled difference
Figure 7 Drug-related adverse events during treatment with a SGLT-2 inhibitor versus placebo
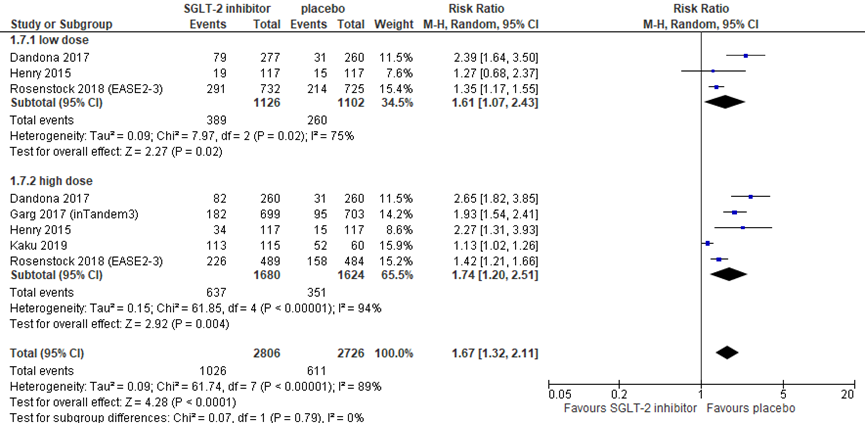
Risk ratio. df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. Low dose includes sotagliflozin 75 mg and 200 mg, dapagliflozin 5 mg, canagliflozin 100 mg, and empagliflozin 2.5 and 10 mg; high dose includes sotagliflozin 400 mg, dapagliflozin 10 mg, canagliflozin 300 mg, and empagliflozin 25 mg. Following the distinction between low and high doses by Lu (2019), the placebo group is counted double when calculating the total pooled difference
Level of evidence
The quality of evidence (according to the GRADE approach) was determined per outcome and started high in all cases, as the evidence was based on randomized controlled trials. Subsequently, the level of evidence was downgraded in case limitations in one or more of the following domains were established: limitations in study design or execution (risk of bias), inconsistency of results, indirectness of evidence, imprecision, and publication bias.
The level of evidence for the conclusions is as follows:
- Quality of evidence not downgraded: HIGH.
- Quality of evidence downgraded with one level due to indirectness of the evidence (different definition of hypoglycaemia): MODERATE.
- Quality of evidence downgraded with two levels due to serious imprecision (confidence interval includes line of no effect, limited number of events): LOW.
- Quality of evidence downgraded with one level due to imprecision (limited number of events): MODERATE.
- Quality of evidence not downgraded: HIGH.
- Quality of evidence downgraded with two levels due to serious imprecision (single study): LOW.
- Quality of evidence downgraded with one level due to imprecision (confidence interval includes limit of clinical decision-making): MODERATE.
- Quality of evidence downgraded with one level due to imprecision (limited number of events): MODERATE.
- Quality of evidence downgraded with one level due to imprecision (confidence interval includes limit of clinical decision-making): MODERATE.
- Quality of evidence downgraded with one level due to imprecision (limited number of events): MODERATE.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
What are the positive and negative effects of SGLT-2 treatment combined with usual care, compared with placebo treatment in combination with usual care in adults with type 1 diabetes mellitus (DM1)?
P: adults with DM1;
I: SGLT-2 inhibitor* (or SGLT-1/2 inhibitor sotagliflozin**) treatment and usual care (insulin treatment);
C: usual care (placebo and insulin treatment);
O: HbA1c levels, (severe) hypoglycaemia, diabetic ketoacidosis (DKA), time in normal glucose range, time above normal glucose range, time below normal glucose range, quality of life, patient satisfaction, other adverse events.
* After finalizing this literature analysis, SGLT-2 inhibitor dapagliflozin has been withdrawn for patients with DM1. Since this does not have an impact on the results, this literature analysis was not amended.
** SGLT-1/2 inhibitor sotagliflozin is included because the effects on glucose (HbA1c and hypoglycaemia) and adverse events (including genital infection and DKA) are comparable with SGLT-2 inhibitors.
Relevant outcomes
The guideline development group considered HbA1c levels, (severe) hypoglycaemia, DKA, time in normal glucose range, time above normal glucose range, and time below normal glucose range to be critical outcomes for decision-making; quality of life, patient satisfaction, and other adverse events were considered important outcomes for decision-making.
The working group defined the outcome hypoglycaemia (as an outcome in clinical trials) as a blood glucose level < 3.0 mmol/L (Heller, 2020). Severe hypoglycaemia was defined as a hypoglycaemic event in which the assistance of another person was required. The working group did not define the other outcomes but followed the definitions used in the studies.
The working group defined 5 mmol/mol (~0,5%) as a minimal clinically (patient) important difference for HbA1c. For time in normal glucose range, a difference of 5% was considered relevant. For severe hypoglycaemic events and DKA, the working group considered a 5-year number needed to treat (NNT) of 1000 clinically relevant. For all other outcomes, a 25% difference in risk ratio (RR) and 0.5 standard deviation were considered relevant for dichotomous and continuous outcomes, respectively.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms up to and including March 30, 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 797 hits. Studies were selected based on the following criteria: (meta-analysis of) randomised controlled trials (RCTs) comparing SGLT-2 or SGLT-1/2 treatment with placebo treatment with a minimal follow-up of 8 weeks. Analysis was based on the most recent and complete meta-analysis, supplemented with more recent RCTs. Based on title and abstract screening, 69 studies were initially selected. After reading the full text, 66 studies were excluded (see the table with reasons for exclusion under the tab Methods) and 3 were included. If the meta-analysis did not report critical outcomes, but the original article did, the original article was included. Therefore, 4 additional studies were included.
Results
One systematic review and two RCTs were included in the literature analysis. Four additional RCTs were used to report critical outcomes. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Baker C, Wason S, Banks P, Sawhney S, Chang A, Danne T, Gesty-Palmer D, Kushner JA, McGuire DK, Mikell F, O'Neill M, Peters AL, Strumph P. Dose-dependent glycometabolic effects of sotagliflozin on type 1 diabetes over 12 weeks: The inTandem4 trial. Diabetes Obes Metab. 2019 Nov;21(11):2440-2449. doi: 10.1111/dom.13825. Epub 2019 Aug 1. PMID: 31264767; PMCID: PMC6851757.
- Beck, R. W., Bergenstal, R. M., Riddlesworth, T. D., Kollman, C., Li, Z., Brown, A. S., & Close, K. L. (2019). Validation of time in range as an outcome measure for diabetes clinical trials. Diabetes Care, 42(3), 400-405.
- Bennett H, Tank A, Evans M, Bergenheim K, McEwan P. Cost-effectiveness of dapagliflozin as an adjunct to insulin for the treatment of type 1 diabetes mellitus in the United Kingdom. Diabetes Obes Metab. 2020 Jul;22(7):1047-1055. doi: 10.1111/dom.13992. Epub 2020 Feb 25. PMID: 32037675.
- Buse JB, Garg SK, Rosenstock J, Bailey TS, Banks P, Bode BW, Danne T, Kushner JA, Lane WS, Lapuerta P, McGuire DK, Peters AL, Reed J, Sawhney S, Strumph P. Sotagliflozin in Combination With Optimized Insulin Therapy in Adults With Type 1 Diabetes: The North American inTandem1 Study. Diabetes Care. 2018 Sep;41(9):1970-1980. doi: 10.2337/dc18-0343. Epub 2018 Jun 24. PMID: 29937430; PMCID: PMC6105319.
- Danne T, Cariou B, Banks P, Brandle M, Brath H, Franek E, Kushner JA, Lapuerta P, McGuire DK, Peters AL, Sawhney S, Strumph P. HbA1c and Hypoglycemia Reductions at 24 and 52 Weeks With Sotagliflozin in Combination With Insulin in Adults With Type 1 Diabetes: The European inTandem2 Study. Diabetes Care. 2018 Sep;41(9):1981-1990. doi: 10.2337/dc18-0342. Epub 2018 Jun 24. PMID: 29937431.
- EMA (2019). European Medicines Agency. New add-on treatment to insulin for treatment of certain patients with type 1 diabetes. Press release (1 March 2019). Link: https://www.ema.europa.eu/en/documents/press-release/press-release-new-add-treatment-insulin-treatment-certain-patients-type-1-diabetes_en.pdf (geraadpleegd 9 feb 2021).
- Groop, P. H., Dandona, P., Phillip, M., Gillard, P., Edelman, S., Jendle, J.,... & Mathieu, C. (2020). Effect of dapagliflozin as an adjunct to insulin over 52 weeks in individuals with type 1 diabetes: post-hoc renal analysis of the DEPICT randomised controlled trials. The Lancet Diabetes & Endocrinology, 8(10), 845-854.
- Heller, S. R., Buse, J. B., Ratner, R., Seaquist, E., Bardtrum, L., Hansen, C. T.,... & Moses, A. C. (2020). Redefining hypoglycemia in clinical trials: validation of definitions recently adopted by the American Diabetes Association/European Association for the Study of Diabetes. Diabetes care, 43(2), 398-404.
- IHSG (2017). International Hypoglycaemia Study Group. Glucose concentrations of less than 3.0 mmol/L (54 mg/dL) should be reported in clinical trials: a joint position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes care, 40(1), 155-157.
- Kaku K, Isaka H, Sakatani T, Toyoshima J. Efficacy and safety of ipragliflozin add-on therapy to insulin in Japanese patients with type 1 diabetes mellitus: A randomized, double-blind, phase 3 trial. Diabetes Obes Metab. 2019 Oct;21(10):2284-2293. doi: 10.1111/dom.13807. Epub 2019 Jul 11. PMID: 31173455; PMCID: PMC6772182.
- Lachin, J. M., Bebu, I., Bergenstal, R. M., Pop-Busui, R., Zinman, B., & Nathan, D. M. (2017). Response to Comment on Lachin et al. Association of Glycemic Variability in Type 1 Diabetes With Progression of Microvascular Outcomes in the Diabetes Control and Complications Trial. Diabetes Care 2017; 40: 777–783. Diabetes care, 40(11), e165-e166.
- Lu J, Tang L, Meng H, Zhao J, Liang Y. Effects of sodium-glucose cotransporter (SGLT) inhibitors in addition to insulin therapy on glucose control and safety outcomes in adults with type 1 diabetes: A meta-analysis of randomized controlled trials. Diabetes Metab Res Rev. 2019 Oct;35(7):e3169. doi: 10.1002/dmrr.3169. Epub 2019 May 9. PMID: 30974510.
- Mathieu, C., Dandona, P., Gillard, P., Senior, P., Hasslacher, C., Araki, E.,... & Thorén, F. (2018). This 24-week, double-blinded, phase 3 clinical trial (DEPICT-2; ClinicalTrials. gov, NCT02460978) evaluated efficacy and safety of dapagliflozin as adjunct therapy to adjustable insulin in patients with inadequately controlled type 1 diabetes (HbA1c. Diabetes Care, 41.
- Mathieu C, Dandona P, Gillard P, Senior P, Hasslacher C, Araki E, Lind M, Bain SC, Jabbour S, Arya N, Hansen L, Thorén F, Langkilde AM; DEPICT-2 Investigators. Efficacy and Safety of Dapagliflozin in Patients With Inadequately Controlled Type 1 Diabetes (the DEPICT-2 Study): 24-Week Results From a Randomized Controlled Trial. Diabetes Care. 2018 Sep;41(9):1938-1946. doi: 10.2337/dc18-0623. Epub 2018 Jul 19. PMID: 30026335.
- NIV (2020). Richtlijn Diabetische nefropathie. Richtlijnendatabase. Link: https://richtlijnendatabase.nl/richtlijn/diabetische_nefropathie/startpagina_-_diabetische_nefropathie.html (geraadpleegd 23 maart 2021).
- NIV/NHG (2021). Richtlijn Medicamenteuze therapie van hoog-risico patiënten met Diabetes mellitus type 2 (autorisatiefase 2021).
- Rosenstock J, Marquard J, Laffel LM, Neubacher D, Kaspers S, Cherney DZ, Zinman B, Skyler JS, George J, Soleymanlou N, Perkins BA. Empagliflozin as Adjunctive to Insulin Therapy in Type 1 Diabetes: The EASE Trials. Diabetes Care. 2018 Dec;41(12):2560-2569. doi: 10.2337/dc18-1749. Epub 2018 Oct 4. PMID: 30287422.
- Verma, S., & McMurray, J. J. (2018). SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review. Diabetologia, 61(10), 2108-2117.
- Zannad, F., Ferreira, J. P., Pocock, S. J., Anker, S. D., Butler, J., Filippatos, G.,... & Packer, M. (2020). SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta-analysis of the EMPEROR-Reduced and DAPA-HF trials. The Lancet, 396(10254), 819-829.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What are the (dis)advantages of SGLT-2 inhibitor treatment compared with placebo in adults with diabetes mellitus type 1?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Lu, 2019 |
SR and meta-analysis of RCTs Literature search up to November 2018 A: Baker, 2017* (inTandem4) B: Bode, 2017* C: Buse, 2018 (inTandem1) D: Dandona, 2017^ E: Dandona, 2018 (DEPICT1) F: Danne, 2018 (InTandem2) G: Garg, 2017 (inTandem3) H: Henry, 2015 I: Mathieu, 2018 (DEPICT2) J: Rosenstock, 2018 (EASE2 & 3)
* conference abstracts, excluded from present analysis. ^same cohort as Dandona (2018), excluded from present analysis if Dandona (2018) was reported.
Study design: RCT, parallel
Setting and Country: Zhengzhou University and Chengdu Women's and Children's Central Hospital, China.
Source of funding and conflicts of interest: National Natural Science Foundation of China, Grant/Award Number: 81603122; no conflict of interest. |
Inclusion criteria SR: RCTs that compared SGLT inhibitors to placebo as add‐on therapy to insulin in adults with T1D and included follow‐up for at least 12 weeks; Additional searches of ClinicalTrials.gov and reference lists of relevant articles were also performed to retrieve additional studies.
Exclusion criteria SR: none.
10 studies included (8 RCTs and 2 conference abstracts of RCTs)
Important patient characteristics at baseline:
N, mean age A: 141, NR B: 85, NR C: 793, 46 yrs D: 833, 42 yrs E: 833, 42 yrs F: 782, 41 yrs G: 1402, 43 yrs H: 351, 42 yrs I: 813, 43 yrs J: 1707, 44 yrs
Sex: A: NR B: NR C: 48% male D: 48% male E: 48% male F: 52% male G: 50% male H: 56% male I: 44% male J: 48% male
HbA1c %, mean: A: 8.0 B: 9.8 C: 7.6 D: 8.53 E: 8.53 F: 7.75 G: 8.24 H: 7.9 I: 8.44 J: 8.1
BMI, mean: A: NR B: NR C: 29.7 D: 28.4 E: 28.4 F: 27.8 G: 28.2 H: 28.0 I: 27.6 J: 29
diabetes duration, mean: A: NR B: NR C: 24 yrs D: 20 yrs E: 20 yrs F: 18 yrs G: 20 yrs H: 22 yrs I: 19 yrs J: 21 yrs
Total Daily Insulin Dose (IU/kg), mean: A: NR B: NR C: 0.72 D: 0.74 E: 0.74 F: 0.74 G: 0.70 H: NR I: 0.72 J: 0.71
Groups were comparable at baseline. |
A: Sotagliflozin 75, 200, 400 mg B: Sotagliflozin 400 mg C: Sotagliflozin 200, 400 mg D: Dapagliflozin 5, 10 mg E: Dapagliflozin 5, 10 mg F: Sotagliflozin 200, 400 mg G: Sotagliflozin 400 mg H: Canagliflozin 100, 300 mg I: Dapagliflozin 5, 10 mg J: 52-week FU: Empagliflozin 10, 25 mg; 26-week FU: 2.5, 10, 25 mg
Combined with insulin. |
All: placebo combined with insulin
|
End-point of follow-up:
A: 12 weeks B: 12 weeks C: 52 weeks D: 52 weeks E: 24 weeks F: 52 weeks G: 24 weeks H: 18 weeks I: 24 weeks J: 26 and 52 weeks
For how many participants were no complete outcome data available? Not specified.
|
HbA1c (critical outcome) Change of HbA1c (%), least squares mean difference (95% CI). Values per group were not reported.
Low dose# C: -0.36 (-0.45, -0.27) D: -0.42 (-0.56, -0.28) E: -0.33 (-0.49, -0.17) F: -0.37 (-0.48, -0.25) H: -0.29 (-0.43, -0.14) I: -0.37 (-0.49, -0.26) J: -0.28 (-0.42, -0.15) -0.54 (-0.65, -0.42) Pooled effect (random effects model) low dose: Mean difference -0.37 (95% CI -0.43 to -0.32) favoring SGLT-2 inhibitor. Heterogeneity (I2): 41.4%.
High dose# C: -0.41 (-0.50, -0.32) D: -0.45 (-0.58, -0.31) E: -0.36 (-0.53, -0.20) F: -0.35 (-0.47, -0.24) G: -0.46 (-0.54, -0.38) H: -0.25 (-0.40, -0.11) I: -0.42 (-0.53, -0.30) J: -0.53 (-0.66, -0.42) Pooled effect (random effects model) high dose: Mean difference -0.41 (95% CI -0.47 to -0.36) favoring SGLT-2 inhibitor. Heterogeneity (I2): 41.3%.
Pooled effect (random effects model) overall: -0.39 (95% CI -0.43 to -0.36) favoring SGLT-2 inhibitor. Heterogeneity (I2): 42.0%.
Hypoglycemia (critical outcome): Risk of hypoglycemia, n/N. Low dose# C: I: 260/263; C: 266/268 D: I: 220/277; C: 207/260 E: I: 227/277; C: 212/260 F: I: 255/261; C: 252/258 H: I: 115/117; C: 113/117 I: I: 223/271; C: 234/272 Pooled effect (random effects model) low dose: RR 1.00 (95% CI 0.99 to 1.01). Heterogeneity (I2): 0.0%.
High dose# C: I: 258/262; C: 266/268 D: I: 235/260; C: 207/260 E: I: 241/296; C: 212/260 F: I: 260/263; C: 252/258 G: I: 673/699; C: 670/703 H: I: 116/117; C: 113/117 I: I: 231/270; C: 234/272 Pooled effect (random effects model) high dose: RR 1.02 (95% CI 0.99 to 1.04) favoring placebo. Heterogeneity (I2): 37.3%.
Pooled effect (random effects model) overall: RR 1.01 (95% CI 0.99 to 1.02) favoring placebo. Heterogeneity (I2): 37.7%.
DKA (critical outcome) Risk of diabetic ketoacidosis (DKA), n/N Low dose# A: excluded: below the dose approved for T2D C: I: 9/263; C: 1/268 D: I: 4/277; C: 3/260 E: I: 11/277; C: 5/260 F: I: 6/261; C: 0/258 H: I: 5/117; C: 0/117 I: I: 7/271; C: 5/260 J: I: 23/732; C: 9/725 Pooled effect (random effects model) for low dose: RR 2.90 (95% CI 1.64 to 5.12) favoring placebo. Heterogeneity (I2): 7.4%
High dose# A: I: 1/35; C: 0/36 B: I: 0/43; C: 1/42 C: I: 11/262; C: 1/268 D: I: 5/260; C: 3/260 E: I: 10/296; C: 5/260 F: I: 9/263; C: 0/258 G: I: 21/699; C: 4/703 H: I: 8/117; C: 0/117 I: I: 6/270; C: 0/272 J: I: 16/489; C: 6/484 Pooled effect (random effects model) for high dose: RR 3.36 (95% CI 1.90 to 5.95) favoring placebo. Heterogeneity (I2): 16.8%
Pooled effect (random effects model) overall: RR 3.11 (95% CI 2.11 to 4.58) favoring placebo. Heterogeneity (I2): 8.4%
Time within target glucose range (critical outcome): Not reported.
Time below target glucose range (critical outcome): Not reported.
Time above target glucose range (critical outcome): Not reported.
Quality of life (critical outcome): Not reported.
Adverse events Risk of overall adverse events, n/N. Low dose# A: I: 27/70; C: 38/72 C: I: 215/263; C: 216/268 D: I: 187/277; C: 160/260 E: I: 215/263; C: 189/260 F: I: 178/261; C: 216/268 H: I: 65/117; C: 64/117 I: I: 197/271; C: 172/272 J: I: 635/732; C: 636/725 Pooled effect (random effects model) low dose: RR 1.05 (95% CI 0.99 to 1.10) favoring placebo. Heterogeneity (I2): 52.2%.
High dose# A: I: 12/35; C: 18/36 B: I: 25/43; C: 26/42 C: I: 209/262; C: 216/268 D: I: 207/260; C: 160/260 E: I: 236/296; C: 189/260 F: I: 181/263; C: 158/258 G: I: 385/699; C: 369/703 H: I: 79/117; C: 64/117 I: I: 181/270; C: 172/272 J: I: 428/489; C: 433/484 Pooled effect (random effects model) high dose: RR 1.07 (95% CI 1.00 to 1.15) favoring placebo. Heterogeneity (I2): 72.4%.
Pooled effect (random effects model) overall: RR 1.06 (95% CI 1.01 to 1.11) favoring placebo. Heterogeneity (I2): 64.5%.
Drug-related adverse events Risk of drug-related adverse events, n/N. Low dose# D: I: 79/277; C: 31/260 H: I: 19/117; C: 15/117 J: I: 291/732; C: 260/1102 Pooled effect (random effects model) low dose: RR 1.61 (95% CI 1.07 to 2.43) favoring placebo Heterogeneity (I2): 74.9%
High dose# D: I: 82/260; C: 31/260 G: I: 182/699; C: 95/703 H: I: 34/117; C: 15/117 J: I: 524/1565; C: 299/1564 Pooled effect (random effects model) high dose: RR 1.92 (95% CI 1.43 to 2.58) favoring placebo. Heterogeneity (I2): 76.8%.
Pooled effect (random effects model) overall: RR 1.78 (95% CI 1.44 to 2.19) favoring placebo. Heterogeneity (I2): 74.9%.
Patient satisfaction: Not reported.
Cost-effectiveness: Not reported.
#Low and high dose: the recommended starting dose for treatment of T2D and lower than recommended dose (very low dose) referred to ‘low dose’, and the recommended maximum referred to ‘high dose’. Low doses included sotagliflozin 75 mg and 200 mg, dapagliflozin 5 mg, canagliflozin 100 mg, and empagliflozin 2.5 mg and 10 mg; high doses included sotagliflozin 400 mg, dapagliflozin 10 mg, canagliflozin 300 mg, and empagliflozin 25 mg. |
If multiple reports were based on the same population, only the most complete, recently reported data were used.
Authors’ conclusion: Although adverse events exist, the available data provide evidence that the combination of SGLT inhibitors with basal insulin treatment is beneficial in patients with T1D.
Included studies generally had a low risk of bias for study design, unclear risk of bias for incomplete outcome data and selective reporting, and high risk of bias due to industry funding. |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies.
Research question: What are the (dis)advantages of SGLT-2 inhibitor treatment compared with placebo in adults with diabetes mellitus type 1?
Risk of bias table for systematic reviews
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: What are the (dis)advantages of SGLT-2 inhibitor treatment compared with placebo in adults with diabetes mellitus type 1?
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Lu, 2019 |
Yes |
Yes |
No. Excluded studies were not specified. |
Yes |
N/A |
Yes |
Yes |
Yes |
Yes |
Risk of bias table for intervention studies (randomized controlled trials)
Research question: What are the (dis)advantages of SGLT-2 inhibitor treatment compared with placebo in adults with diabetes mellitus type 1?
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome accessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Baker, 2019 |
Method not specified. Randomization stratified by insulin delivery method (MDI or CSII). To qualify for randomization, patients had to demonstrate ≥80% adherence to taking the expected amount of placebo tablets during a 2-week placebo run-in period. |
unclear |
unlikely |
unlikely |
unlikely |
unlikely
|
unlikely
|
unlikely
|
|
Buse, 2018 InTandem1 |
Not specified |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Danne, 2018 InTandem2 |
Not specified |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Kaku, 2019 |
Not specified |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Mathieu, 2018 DEPICT-2 |
Patients were randomized 1:1:1 using an interactive voice/web response system. |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Rosenstock, 2018 EASE2/3 |
Not specified |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Ahmed-Sarwar, 2017 |
Recentere SR beschikbaar |
|
Akturk, 2018 |
Narratieve review |
|
Araki, 2020 |
Geen vergelijking met C |
|
Baker, 2017 |
Abstract |
|
Bennett, 2020 |
Kosteneffectiviteitsstudie |
|
Biester, 2017 |
Te korte follow-up |
|
Bode, 2017 |
Abstract |
|
Boeder, 2019 |
Narratieve review |
|
Cai, 2017 |
Abstract |
|
Chen, 2016 |
Duplicaat |
|
Chen, 2017 |
Recentere SR beschikbaar |
|
Dandona, 2018 |
Beschreven in SR |
|
Dandona, 2019 |
Completere SR beschikbaar |
|
Danne, 2017 |
Duplicaat |
|
Danne, 2018 |
Geen originele studie |
|
Danne, 2018 (2) |
Narratieve review |
|
Danne, 2019 |
Geen originele studie |
|
Danne, 2109 (2) |
Geen originele studie |
|
Danne, 2019 (3) |
Posthoc analyse |
|
Deeks, 2019 |
Narratieve review |
|
Dellepiane, 2018 |
Narratieve review |
|
El Masri, 2018 |
Completere SR beschikbaar |
|
Garg, 2017 |
Beschreven in SR |
|
Garg, 2018 |
Abstract |
|
Gordon, 2019 |
Poster |
|
Gordon, 2020 |
Geen originele studie |
|
Frandsen, 2016 |
Narratieve review |
|
Hansen, 2017 |
DEPICT-1 al geïncludeerd |
|
Henry, 2018 |
Abstract |
|
Henry, 2017 |
Te korte follow-up |
|
Henry, 2015 |
Beschreven in SR |
|
Jendle, 2019 |
Abstract |
|
Ji Kim, 2019 |
Abstract |
|
Kaku, 2019 (2) |
Niet de PICO vergelijking |
|
Kuhadiya, 2016 |
Niet de PICO vergelijking |
|
Langford, 2018 |
Niet de PICO vergelijking |
|
Langford, 2020 |
Niet de PICO vergelijking |
|
Li, 2019 |
Recentere SR beschikbaar |
|
Ludeman, 2018 |
Abstract |
|
Ludeman, 2019 |
Geen originele studie |
|
Markham, 2019 |
Narratieve review |
|
Mathieu, 2019 |
Narratieve review |
|
Mathieu, 2019 (2) |
Geen originele studie |
|
McCrimmon, 2018 |
Narratieve review |
|
Musso, 2019 |
Completere SR beschikbaar |
|
Nuffer, 2019 |
Narratieve review |
|
Paik, 2019 |
Narratieve review |
|
Parkinson, 2019 |
Geen originele studie |
|
Parkinson, 2019 (2) |
Niet de PICO vergelijking |
|
Patoulias, 2018 |
Narratieve review |
|
Perkins, 2015 |
Niet de PICO vergelijking |
|
Peters, 2016 |
Ouder dan geïncludeerde SR |
|
Pettus, 2018 |
Abstract |
|
Rodbard, 2017 |
Subset van andere studie |
|
Saha, 2020 |
Completere SR beschikbaar |
|
Taylor, 2019 |
Completere SR beschikbaar |
|
Tosur, 2018 |
Narratieve review |
|
Van Raalte, 2019 |
Geen originele studie |
|
Yamada, 2018 |
Recentere SR beschikbaar |
|
Yang, 2017 |
Recentere SR beschikbaar |
|
Yang, 2017 (2) |
Recentere SR beschikbaar |
|
Zhang, 2020 |
SR met studies met korte follow-up |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 15-11-2021
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
SGLT-2-remmers bij DM1 |
NIV |
2021 |
2023 |
Jaarlijks |
NIV |
Lopend onderzoek, en beschikbaarheid nieuwe middelen |
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Doel
Doel is het opstellen van een modulaire evidence-based richtlijn conform de huidige criteria (OMS 2011) naar aanleiding van feedback uit het veld en op basis van actuele wetenschappelijke gegevens. Dit moet leiden tot een nog meer gerichte en uniforme behandelingsstrategie van patiënten met DM1. Daarnaast zal patiënten informatie worden ontwikkeld die zal aansluiten bij de informatie die al beschikbaar is op de website voor publieks- en patiënten informatie Thuisarts.nl.
In de voorbereidende fase zijn de volgende knelpunten geprioriteerd:
- Wat is de waarde van SGLT-2-remmers bij volwassenen met DM1?
- Wat is de optimale methode van glucose zelfmanagement voorvolwassenen met DM1 behandeld met insuline (MDI of CSII): (RT)CGM, FGM of SMBG (vingerprikken)?
- Wat is de meerwaarde van een semi-closed loop systeem (combinatie sensor (CGM) en pomp) voorvolwassen met DM1 behandeld met CSII?
- Wat is de waarde van 2e generatie langwerkende insuline analogen bij kinderen en volwassenen met DM1?
- Wat is de optimale insulinebehandeling voor volwassenen met DM1: CSII of basaal-bolus?
In de huidige conceptrichtlijn (aanvullende modules) zijn adviezen geformuleerd voor de eerste drie uitgangsvragen. Hierbij zijn de knelpunten met betrekking tot de inzet van sensoren en semi-closed loop systemen in een module gecombineerd. Een advies voor de resterende knelpunten wordt momenteel uitgewerkt en de concepttekst naar verwachting in het vierde kwartaal van 2021 ter commentaar aangeboden.
Doelgroep
Deze richtlijn is geschreven voor alle beroepsgroepen die betrokken zijn bij de zorg voor patiënten met DM1. Daarnaast wordt patiënten informatie ontwikkeld en gepubliceerd op de website voor publieks- en patiënten informatie Thuisarts.nl.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor personen met diabetes mellitus type 1.
Werkgroep DM1
- Prof. Dr B.E. (Bastiaan) de Galan, internist, hoogleraar interne geneeskunde-diabetologie, Maastricht UMC+; NIV (voorzitter)
- Dr. P.S. (Sytze) van Dam, internist niet-praktiserend, OLVG, locatie Oost, Amsterdam; NIV (voorzitter)
- Dr. A.C. (Arianne) van Bon, internist-endocrinoloog, Rijnstate, Arnhem; NIV
- Dr. T.C.J. (Theo) Sas, kinderarts-endocrinoloog, Erasmus MC, Sophia Kinderziekenhuis en Diabeter, Rotterdam; NVK
- P.L.M. (Petra) Bouhuijzen, diabetesverpleegkundige, St. Antonius Ziekenhuis, Utrecht, Nieuwegein; V&VN
- T.M. (Ties) Obers, beleidsmedewerker Diabetesvereniging Nederland, Leusden; Diabetesvereniging Nederland, vanaf november 2020.
Klankbordgroep DM1
- Dr. K.A.C. (Kirsten) Berk, diëtist Erasmus MC, Universitair Medisch Centrum, Rotterdam; NVD/ Diabetes and Nutrition Organization
Stuurgroep Modulair onderhoud diabetesrichtlijnen
- Dr. P.S. (Sytze) van Dam, internist niet-praktiserend, OLVG, locatie Oost, Amsterdam; NIV (overkoepelend voorzitter)
- Dr. E.H. (Erik) Serné, Internist-vasculaire geneeskunde/diabetologie, Amsterdam UMC, locatie VUmc, Amsterdam; NIV
- Prof. Dr B.E. (Bastiaan) de Galan, internist, hoogleraar interne geneeskunde-diabetologie, Maastricht UMC+; NIV
Met ondersteuning van
- Dr. K.N.J. (Koert) Burger, epidemioloog, senior-adviseur; Kennisinstituut van de Federatie van Medisch Specialisten (tot april 2021)
- H. (Hanneke) Olthuis-van Essen, adviseur; Kennisinstituut van de Federatie van Medisch Specialisten
- Dr. M.S. (Matthijs) Ruiter, adviseur; Kennisinstituut van de Federatie van Medisch Specialisten;
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
de Galan (vz) |
Internist, hoogleraar MUMC+ Maastricht en Radboudumc Nijmegen. |
Docent post-academisch onderwijs HAN (betaald; naar Radboudumc); Docent/cursusleider DESG cursus voor aios interne geneeskunde en kindergeneeskunde (betaald; naar Radboudumc); Lid wetenschappelijke adviesraad Diabetes UK (onbetaald); Bestuurslid Diabetes Education Study Group (DESG Nederland; onbetaald); Voorzitter accreditatiecommissie NIV (vacatiegelden); Lid COIG examencommissie NIV (vacatiegelden); Voorzitter J. Terpstraprijs commissie NVDO. Redactieraad Diabetologia (vanaf 2020) |
Adviesraad Novo Nordisk (2018, insulinebehandeling in de toekomst, betaling aan het Radboudumc; adviesraad inmiddels gestopt); Lilly (eenmalig, nasaal glucagon voor behandeling van ernstige hypo's, onbetaald); Onderzoek in het verleden ondersteund met subsidies van het Diabetesfonds, European Foundation for the Study of Diabetes (EFSD), NIH, Astra-Zeneca (unrestricted grant onderzoek naar behandeling hypo-unawareness met GLP-1 agonist; 2017-2018), Sanofì (unrestricted grant naar opname van lactaat in de hersenen, 2017-2018); Huidige onderzoeks-ondersteuning: European Union's Horizon 2020 lnnovative Medicine lnitiative (lMl); Juvenile Diabetes Research Fund; lnternational Diabetes Federation (lDF); The Leona M. and Harry B. Helmsley Charitable Trust, T1D Exchange; ZonMw en Diabetesfonds; Novo Nordisk (investigator-initiated trial naar aanpassing van degludec bij sport; unrestricted grant; geen vergelijking met andere insulines). |
Geen actie (in verleden adviesraden die nu zijn gestopt; toepassing van GLP-1-agonisten bij DM1 valt niet onder huidig modulair onderhoud). |
|
van Dam (vz) |
Internist endocrinoloog OLVG Amsterdam (momenteel onbetaald verlof). |
Ondersteuning Amsterdam Diabetes Centrum (vooralsnog onbetaald). |
Actief betrokken bij de ontwikkeling van een diabetescentrum (vooral type 1) in Amsterdam (samenwerking Amsterdam UMC met OLVG). |
Geen |
|
van Bon |
Internist-endocrinoloog Rijnstate ziekenhuis. |
Laag frequent geven van nascholing over diabetes, met name aan POH-ers en diabetes-verpleegkundigen (deels betaald door Sanofi, Novo Nordisk). |
Geen financieel belang. Nauw betrokken bij de ontwikkeling van kunstalvleesklier van het bedrijf lnreda Diabetic (testen prototypes; onbetaald). |
Geen actie (kunstalvleesklier valt niet onder huidig modulair onderhoud). |
|
Sas |
Kinderarts-endocrinoloog ErasmusMC - Sophia Rotterdam; kinderarts-endocrinoloog Diabeter, Rotterdam. |
Voorzitter Adviesgroep Groeihormoon, sectie Endocrinologie bij kinderen (NVK; onbetaald); commissielid sensor richtlijn NDF (vanuit NVK; onbetaald); secretaris ESPE Working Group on Turner syndrome (onbetaald). Voorzitter werkgroep Groei en Ontwikkeling van NVE - onbetaald |
Geen financieel voordeel; in loondienst bij ErasmusMC (UMS) en Diabeter (AMS). Diabeter is eigendom van Medtronic, die onder andere sensoren en pompen verkopen. Ik heb geen financiële relatie met Medtronic en wordt betaald volgens AMS door Diabeter. Medtronic heeft geen invloed op de zorg of zorgverleners of de producten en materialen die voorgeschreven worden. Ik heb bij mijn aanstelling een "onafhankelijkheidverklaring" getekend waarin ik mij niet laat leiden door enige prikkels van leveranciers, inclusief Medtronic. Medtronic sponsort op dit moment geen onderzoek met Diabeter naar sensoren, maar helpt Diabeter met uitvraag naar Carelink data naar zorg evaluatie van behandeling met pomp en sensor. Adviezen vanuit een richtlijn beïnvloeden niet deze evaluatie of de ondersteuning daarvan. |
Geen trekker bij uitgangsvragen met betrekking tot glucose management. |
|
Bouhuijzen |
Diabetes-verpleegkundige St. Antonius Ziekenhuis |
gastdocent Academie St. Antonius Ziekenhuis (betaald) |
Geen |
Geen |
|
Obers |
Beleidsmedewerker Belangenbehartiging, Diabetes Vereniging Nederland (24 uur/week); freelance adviseur voor Goede Doelen, Groei voor Goed (16 uur/week). |
Lid Cliëntenraad, UMC Utrecht (vrijwilligersvergoeding). |
Boegbeeldfunctie bij patiëntenorganisatie. |
Geen |
|
Klankbord |
||||
|
Berk |
Diëtist Diabetesteam- afdeling Inwendige Geneeskunde Erasmus MC; Postdoc onderzoek - afdeling Diëtetiek Erasmus MC. |
Docent post-HBO voeding bij diabetes - Hogeschool Arnhem en Nijmegen (betaald); spreker diverse nationale congressen over voeding blj diabetes (betaald). |
Geen financiële belangen; onderzoek naar effect flavanolen op mlcro-albumlnurie bij patiënten met type 2-diabetes (FLAVA onderzoek; 100k fundlng vanuit Masqueliers' OPC, bedrijf dat voedingsproduct met flavanolen produceert); onderzoek effectiviteit blended care versie van very-low calorie diet, met behulp van eHealth (E-DIET trial; levering benodigde maaltijd vervangers door Cambridge Weight Plan Benelux). |
Geen (diëten vallen niet onder huidig modulair onderhoud). |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van de patiëntenvereniging (Diabetesvereniging Nederland) in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Diabetesvereniging Nederland. De aangeleverde commentaren zijn bekeken en verwerkt.
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst.
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module SGLT2-remmers |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de stuurgroep van het project Modulair onderhoud diabetesrichtlijnen, en de werkgroep DM1, de knelpunten in de zorg van personen met diabetes mellitus type 1. Het project Modulair onderhoud diabetesrichtlijnen is gestart met een brede algemene analyse van de knelpunten in de zorg voor personen met diabetes: een schriftelijke knelpuntanalyse bij NIV, V&VN, DVN en het NHG, aangevuld met een enquête tijdens de Internistendagen (24 tot 26 april 2019, Maastricht) en een inventarisatie van de belangrijkste knelpunten (top-3) bij de genodigden voor de Invitational conference. In de Invitational conference zijn de uitkomsten van de schriftelijke knelpuntenanalyses besproken en waar nodig aangevuld, en is een eerste prioritering van de meest urgente revisies (bestaande modules) en aanvullingen (nieuwe modules) vastgesteld (zie het verslag van de invitational in de bijlage). De stuurgroep heeft de definitieve prioritering vastgesteld waarna onderwerpen zijn geclusterd en afzonderlijke werkgroepen zijn samengesteld op basis van de benodigde expertise, waaronder een werkgroep DM1. De werkgroep DM1 heeft de knelpunten rondom de zorg voor patiënten met DM1 verder geanalyseerd en concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Indien relevant worden algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas, T., Merglen, A., Heen, A. F., Kristiansen, A., Neumann, I., Brito, J. P.,... & Guyatt, G. H. (2017). UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ open, 7(11):e018593.
Alonso-Coello, P., Schünemann, H. J., Moberg, J., Brignardello-Petersen, R., Akl, E. A., Davoli, M.,... & GRADE Working Group. (2016). GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj, 353:i2016.
Alonso-Coello, P., Oxman, A. D., Moberg, J., Brignardello-Petersen, R., Akl, E. A., Davoli, M.,... & GRADE Working Group. (2016). GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj, 353:i2089.
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,... & Zitzelsberger, L. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Cmaj, 182(18), E839-E842.
Hultcrantz, M., Rind, D., Akl, E. A., Treweek, S., Mustafa, R. A., Iorio, A.,... & Guyatt, G. (2017). The GRADE Working Group clarifies the construct of certainty of evidence. Journal of clinical epidemiology, 87, 4-13.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann, I., Santesso, N., Akl, E. A., Rind, D. M., Vandvik, P. O., Alonso-Coello, P.,... & Guyatt, G. H. (2016). A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. Journal of clinical epidemiology, 72, 45-55.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Naam Richtlijn: Modulair onderhoud diabetes richtlijnen – werkgroep DM1 |
|
|
Uitgangsvraag: Wat is de waarde van SGLT-2-remmers bij volwassen met DM1? |
|
|
Database(s): Pubmed, Embase |
Datum: 30-3-2020 |
|
Periode: géén limitering |
Talen: géén limitering |
|
Literatuurspecialist: Eugenie Delvaux |
|
|
Toelichting en opmerkingen: geen |
|
|
Zoekopbrengst |
EMBASE |
PUBMED |
Ontdubbeld |
|
SRs |
351 |
40 |
269 |
|
RCTs |
298 |
388 |
528 |
|
Observationele studies |
|
|
|
|
Overig |
|
|
|
|
Totaal |
649 |
428 |
797 |
|
Database |
Zoektermen |
||||||||||||||||||||||||
|
Pubmed
|
|
||||||||||||||||||||||||
|
Embase
|
Database(s): Embase 1974 to 2020 Week 13
|
