Informatie voor pathologen bij CMN
Uitgangsvraag
Informatie voor pathologen bij congenitale melanocytaire naevi (CMN).
Aanbeveling
Pathogenese
Een enkele postzygotische somatische mutatie in NRAS of BRAF kan aanleiding geven tot CMN. De timing van deze mutatie speelt een rol bij de uitgebreidheid van CMN, zowel cutaan als extracutaan (centraal zenuwstelsel). Hoe vroeger de mutatie in de embryogenese, hoe uitgebreider het beeld.
Stellen van de diagnose CMN
De diagnose CMN wordt gesteld op basis van anamnese (aanwezigheid bij of in eerste 3 maanden na de geboorte) aangevuld met lichamelijk onderzoek (grootte, typische klinische kenmerken). Dermatoscopie en biopsie dragen niet bij aan het stellen van de diagnose CMN.
Bij een melanocytaire naevus van >1,5cm grootste diameter bij een kind of >3cm bij een volwassene kan men ervanuit gaan dat deze congenitaal is.
Biopsie/excisie focale verandering naevus
De werkgroep adviseert bij focale en suspecte veranderingen in een CMN een of meerdere biopten voor histologisch onderzoek af te nemen. Vanwege een risico op melanoom wordt bij kleine CMN een diagnostische excisie geadviseerd, bij CMN die te groot zijn om in één keer te excideren adviseert de werkgroep een incisiebiopt boven een stansbiopt, van de focale verandering. Hierbij dient het meest afwijkende deel in toto te worden verwijderd.
Bij de histopathologische aanvraag van een biopt uit CMN is het essentieel de patholoog volledig te informeren over de volgende items:
- Betreft een congenitale naevus
- De plaats van de biopsie
- Directe aanleiding voor het nemen van het biopt
- Beschrijving van het dermatoscopische beeld
Bovenstaande is van essentieel belang gezien de moeilijkheidsgraad van het beoordelen van deze laesies. Tevens is het gewenst een foto bij te voegen met daarop welk deel geëxcideerd is, én een foto van het dermatoscopisch beeld van het verdachte deel (morfologische informatie).
Excisie nieuwe nodus
De werkgroep adviseert bij een nieuw ontstane of veranderende nodus de patiënt binnen 2 weken te zien. In principe geldt altijd diagnostische excisie van de nodus, omdat het onderscheid tussen een benigne en maligne nodus klinisch niet is te maken. Alléén bij patiënten met reuze CMN (>40cm PAS) die bekend meerdere benigne proliferatieve noduli hebben kan soms na uitgebreide beoordeling en alleen onder strikte voorwaarden nog 4 weken worden afgewacht.
Routing biopt
De werkgroep is van mening dat biopten uit CMN door een reguliere patholoog kunnen worden beoordeeld. Bij resterende twijfel over atypie (clinicus en/of patholoog) dient het biopt te worden medebeoordeeld door een patholoog met speciale expertise op dit terrein, al dan niet na bespreking in een regionaal melanoompanel.
Echografie (+punctie/excisie) lymfeklieren
Bij lymfadenopathie is aanvullend onderzoek met behulp van echografie aangewezen. Bij afwijkende lymfeklier(en) dient histologisch materiaal te worden verkregen, hierbij volgt men de richtlijn melanoom.
Onderbouwing
Achtergrond
Volgens de richtlijnen van de Nederlandse Vereniging voor Pathologie (NVvP) is de informatie voor pathologen in één module samengebracht. De informatie in deze module betreft daarmee een doublure van passages elders in de richtlijn.
Samenvatting literatuur
Pathogenese
Naevi zijn benigne clonale proliferaties van melanocyten. Naevuscellen zijn afkomstig van melanocyten in de neurale lijst, van waaruit ze migreren naar het overliggende ectoderm. Proliferatie, differentiatie en migratie van melanocyten wordt gereguleerd door een complex netwerk van signaalmoleculen. Bij CMN kan alleen de huid zijn aangedaan (zowel epidermis, dermis als het subcutane weefsel kunnen geïnfiltreerd zijn met naevuscellen), of ook het centraal zenuwstelsel.
De pathogenese van CMN is nog niet geheel opgehelderd, maar recent zijn wel belangrijke nieuwe inzichten verschenen.
Kinsler et al. onderzochten en vergeleken in patiënten met multipele CMN meerdere weefsels van zowel huid als centraal zenuwstelsel met elkaar [Kinsler 2013]. Bij 80% werd een NRAS-mutatie gevonden, en bleek in dezelfde patiënten dezélfde mutatie aanwezig in meerdere aangedane gebieden van de huid ÉN het centraal zenuwstelsel (zowel melanocytair als niet-melanocytair), terwijl deze áfwezig was in de niet-aangedane gebieden en in het bloed. Bovenstaande bevindingen wijzen op:
- somatisch mosaïcisme; er is sprake van een lethale mutatie die overleefd door mosaïcisme (theorie van Happle 1987);
- indien er sprake is van zowel betrokkenheid van huid als hersenen, deze mutaties optreden in het zich ontwikkelend neuro-ectoderm vroeg in de embryogenese;
Charbel et al. vonden met ‘whole-exome sequencing’ in grote CMN dat somatische NRAS mutaties voldoende zijn om te zorgen voor melanocytaire proliferatie in utero, er werden geen andere mutaties gevonden naast NRAS [Charbel 2014].
De heersende gedachte is nu dat postzygotisch, vroeg in de embryogenese voorlopercellen van melanocyten een enkele somatische mutatie krijgen, resulterend in een mozaiek patroon van melanocyten die de huid en leptomeningen kunnen coloniseren [van Engen-van Grunsven 2014]. Deze ontstaanswijze is voor NRAS aangetoond in een muismodel [Pedersen 2013].
Waarschijnlijk bepaalt ‘timing’ van de mutatie voor een belangrijk deel hoe uitgebreid een CMN zich presenteert. Een mutatie vroeg in de embryonale ontwikkeling leidt tot wijde verspreiding van naevuscellen naar de huid (reuze CMN en satellieten of enkel multipele CMN) en ook het centraal zenuwstelsel, structuren die beide uit het ectoderm ontstaan. Een mutatie pas laat in de embryogenese geeft kleinere, alleen cutane CMN, in een omschreven gebied, zonder satellieten [Fernandez 2016, oral communication Kinsler]. Zie ook fig. 1.
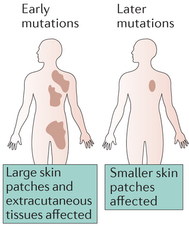
Fig. 1: ‘Timing’ van de postzygotische somatische mutatie bepaalt het fenotype van CMN [Bron: Fernandez 2016 Nature Reviews]
In de meeste studies zijn NRAS (codon 61) of BRAF (V600E) mutaties beschreven in CMN. NRAS en BRAF zijn beide onderdeel van de RAS/RAF/MEK/ERK ‘pathway’, betrokken bij o.a. celgroei, -differentiatie en -overleving. Beide mutaties zijn bekend van melanomen, mogelijk daarom zijn deze ook het meest onderzocht in naevi. Er lijkt een genotype-fenotype correlatie te zijn tussen grootte van CMN en het type mutatie [van Engen-van Grunsven 2014]. Grotere CMN hebben vaker NRAS-mutaties, kleinere naevi zijn minder vaak NRAS gemuteerd en hebben (net als verworden naevi) vaker een BRAF mutatie [Roh 2015]. Van NRAS-mutaties was reeds bekend dat dezelfde mutatie zich in zowel aangedane huid als zenuwweeefsel bevindt [Kinsler 2013], dit blijkt ook te gelden voor incidentele BRAF-mutaties in grotere CMN hoewel dit slechts zelden voorkomt [Salgado 2015].
Niet in alle patiënten kan een NRAS of BRAF mutatie worden gevonden. Eerdere studies beschrijven andere mutaties: in MC1R, TP53, GNAQ [Kinsler 2014]. Mogelijk dat deze de expressie van NRAS/BRAF moduleren, of nog een andere rol spelen in de pathogenese. Er zullen meerdere ‘pathways’ betrokken zijn in de pathogenese van CMN dan nu beschreven of bekend.
Hoe vanuit naevuscellen in de huid en het centraal zenuwstelsel melanoom ontstaat is nog niet opgehelderd. Theoretisch is in CMN een eerste ‘hit’ reeds aanwezig (BRAF/NRAS mutatie), er is nog een tweede ‘hit’ nodig voor het ontstaan van melanoom. Daarvoor zijn additionele ‘driver’ mutaties nodig. Deze theorie is aangetoond voor verworven naevi [Shain 2015]. Welke mutaties dit zijn bij CMN is nog onduidelijk, er wordt o.a. een mogelijke rol toebedacht aan ‘Wnt signaling’ [Pawlikowski 2015, Shakhova 2012].
In recente studies blijkt in in vitro en in muismodellen verder dat de naevuscellen in CMN zowel cutaan als in het centraal zenuwstelsel na de geboorte en tot op latere leeftijd nog verscheidene proliferatieve, klonogene en tumerogene eigenschappen bevatten [Charbel 2015, Basu 2015]. Guégan vergeleken dit tussen middelgrote CMN (1,5~10cm PAS) en grote CMN (20~40cm PAS). De hoeveelheid stamcelachtige cellen lijken per zelfde oppervlakte significant meer aanwezig in grote CMN dan in kleinere CMN [Guégan 2016]. De hypothese hierbij is dat om deze reden in grotere CMN eerder een tweede somatische activatie (‘second hit’) kan optreden die leidt tot melanoom (of mogelijk proliferatieve leptomeningeale melanocytose). Ook is denkbaar dat repigmentatie en de vorming van proliferatieve noduli hier mogelijk verband mee houden.
Verder onderzoek naar zowel de pathogenese van CMN, als van het ontstaan van melanoom uit CMN is nodig.
Histologie
Histologisch gezien is het onderscheid tussen congenitale en verworven naevi lastig, met name met betrekking tot kleine congenitale naevi. Naevi bestaan uit een neoplastische populatie melanocyten, aanwezig in de epidermis en/of dermis. In de epidermis worden veelal nesten en/of lentigineuze verdeelde proliferaties langs het dermo-epidermale grensvlak aangetroffen, terwijl de dermale component vaak bestaat uit nesten en meer verspreid verdeelde cellen, in oppervlakkige delen vaak wat groter en vaker pigment houdend dan in diepere delen [Viana 2013].
In het algemeen kunnen CMN van verworven naevi worden onderscheiden door een grotere omvang en de verspreiding van naevuscellen in diepere lagen van de huid en zelfs de subcutis. Het voorkomen van naevuscellen in talgklieren, zenuwen en bloedvaten diep in de reticulaire dermis is vrijwel bewijzend vor congenitale (i.p.v. verworven) naevus [Mark 1973, Rhodes 1985]. Hoewel deze kenmerken aanwezig kunnen zijn in CMN van alle groottes zijn ze aanzienlijk frequenter in reuze CMN. In grotere CMN reiken naevuscellen bij vrijwel 100% tot in de reticulaire dermis, en bij 75% tot in de subcutis [Barnhill 1995]. In kleine naevi zijn deze karakteristieke kenmerken vaak niet aanwezig, deze bevinden zich ook vaak oppervlakkiger [Magana 2015].
Er doet zich een moeilijkheid voor bij het beoordelen van noduli in CMN. Bij geboorte of in het spontane beloop kunnen in CMN proliferatieve noduli (PN’s) ontstaan. Het is lastig deze (klinisch en) histopathologisch te onderscheiden van melanomen, hetgeen grote consequenties kan hebben. Beide kunnen zich histologisch presenteren met verhoogde mitotische activiteit, nucleaire atypie en zelfs de aanwezigheid van atypische mitosefiguren en van necrose. Er zijn wel enkele kenmerken die bij benigne PN’s vaker lijken voor te komen dan bij melanomen (zoals multifoculiteit) en andersom, maar er zijn geen eenduidige criteria om deze entiteitten van elkaar te onderscheiden [Leech 2004, Yelamos 2015]. De laatste jaren worden moleculaire technieken vaker ingezet om benigne melanocytaire laesies van melanomen te onderscheiden, zoals CGH-array (‘comparative genomic hybridization’) en FISH (‘fluorescence in situ hybridization’). Hierbij geldt in het algemeen dat in PN’s vaker complete ‘copy number gains en ‘losses’ van chromosomen worden gezien, terwijl dit in melanomen (soms naast numerieke afwijkingen) vaak meer complexe structurele en partiële afwijkingen zijn [Yelamos 2015, Bastian 2002].
Stellen van de diagnose CMN
Expert opinion
Het stellen van de diagnose congenitale melanocytaire naevus (CMN) is meestal vrij eenvoudig.
Een melanocytaire naevus die aanwezig is bij de geboorte of zichtbaar wordt in de eerste drie maanden is een congenitale melanocytaire naevus [Barnhill 1995]. Ook wanneer uit de anamnese niet duidelijk naar voren komt of een moedervlek bij (of kort na) de geboorte reeds aanwezig was, gaat men ervanuit dat elke melanocytaire naevus van >1,5cm grootste diameter bij een kind of >3cm bij een volwassene congenitaal is [de Bliek 1990]. Naast grootte is de diagnose van grotere CMN meestal vrij duidelijk door de typische morfologische aspecten van een CMN. Bij kleinere naevi is het onderscheid met een verworven melanocytaire naevus soms lastig. Dit geldt op latere leeftijd, een pasgeborene heeft normaalgesproken geen huidafwijkingen en dus ook geen naevi, en een melanocytaire naevus zichtbaar in de eerste 3 maanden is dan altijd congenitaal.
Er zijn geen dermatoscopische items voldoende specifiek voor het stellen van de diagnose CMN of deze te differentiëren van een verworven melanocytaire naevus.
De meest voorkomende patronen bij CMN zijn een globulair, reticulair of diffuus patroon [Seidenari 2006], waarbij op de kinderleeftijd vaker een globulair patroon wordt gezien [Changchien 2007]. Dominante patronen per lokalisatie zijn gelijk aan die bij verworven naevi: een meestal reticulair patroon op de onderste extremiteiten [Changchien 2007], globulair patroon op het hoofd, nek en romp [Chanchien 2007, Seidenari 2006], en parallel patroon op de acra [Chuah 2015]. In de literatuur is niet goed te onderscheiden welk patroon bij welke grootte vaak voorkomt. Kutlu et al. vonden in hun studie dat wanneer een “cobblestone patroon” werd gezien dit bij 83% een kleine CMN betrof en een diffuus patroon bij 78% een middelgrote CMN [Kutlu 2007]. Andere dermatoscopische kenmerken die vaak voorkomen bij CMN zijn focale verdikking van de “network lines”, globuli, hypertrichose en perifolliculaire hypopigmentatie [Alikhan 2012]. Alle bovenstaande kenmerken en patronen kunnen ook voorkomen bij verworven naevi. Er zijn twee studies die daadwerkelijk de dermatoscopische kenmerken bij congenitale en verworven naevi hebben vergeleken [Stinco 2011, Seidenari 2006]. Stinco et al. vonden geen significante verschillen in dermatologische kenmerken. Seidenari et al. vonden wel verschillen, maar geen van deze structuren was specifiek.
Biopsie puur voor het stellen van de diagnose CMN is slechts zelden aangewezen. Een biopt kan eventueel worden overwogen indien men bij een grotere moedervlek sterk twijfelt aan de diagnose (bv mongolenvlek, naevus van Becker, naevus van Ota, café au lait macula, naevus spilus) én dit consequenties heeft voor het beleid. Met biopsie kan dan worden aangetoond of het een melanocytaire laesie betreft. Voor het maken van het onderscheid congenitale of verworven naevus wordt biopsie afgeraden, omdat histologische kenmerken onvoldoende specifiek zijn voor CMN [zie ook de module ‘Achtergrond van CMN’]. Bovendien betreft het dan vrijwel altijd kleine naevi waarbij het geen consequenties heeft te weten of een naevus al dan niet congenitaal is. Bij kleine CMN is vaak alleen de anamnese leidend in het onderscheid met verworven naevi.
Voor het stellen van de diagnose NCM zie de module ‘Neurocutane melanocytose (NCM)’ en ‘Follow-up van CMN’.
Biopsie/excisie focale verandering naevus
Expert opinion
De werkgroep is van mening dat er in geval van verdachte focale veranderingen in CMN een indicatie bestaat voor het afnemen van biopten ten behoeve van histologisch onderzoek, om een maligniteit uit te sluiten. Histologische bevestiging is gewenst omdat op basis van het klinisch en dermatoscopisch beeld bij CMN niet te zeggen is of een verandering een maligne transformatie betreft. Eerder gemaakte foto’s kunnen behulpzaam zijn bij de inschatting of er inderdaad sprake is van een verandering.
Hoewel de richtlijn Melanoom 2012 aangeeft dat er grote voorkeur is voor het in toto excideren van alle naevocellulaire laesies, wordt een uitzondering gemaakt voor CMN indien die bezwaarlijk in één keer te excideren zijn [Richtlijn melanoom 2012]. Bij kleine CMN wordt wél een diagnostische excisie geadviseerd. Bij grotere CMN kiest men indien mogelijk liever voor een incisiebioptie dan een stansbiopt. Het is dan noodzakelijk de patholoog volledig te informeren dat het een (incisie)biopt betreft en ook de plaats van het biopt binnen de laesie duidelijk te vermelden, liefst met behulp van een foto [zie richtlijn melanoom].
Het histologisch beoordelen van mogelijk maligne transformatie in CMN kan bijzonder lastig zijn. Bij ongeveer 25% van de biopten is geen zekere uitslag te geven, ook na consultatie van experts. Om dit probleem zo klein mogelijk te houden is het belangrijk dat de patholoog ook informatie heeft over morfologische kenmerken van de verdachte laesie, liefst in de vorm van dermatoscopische foto’s naast de macroscopische foto’s. Deze foto’s dienen dan beschikbaar te zijn voor de patholoog op het moment van beoordelen van het biopt. Tevens dient de rechtstreekse aanleiding voor het nemen van het biopt goed te worden beschreven op de aanvraag.
Excisie nieuwe nodus
Expert opinion
Voorgesteld beleid bij nieuwe noduli is de patiënt op zeer korte termijn te beoordelen, binnen twee weken. Bij deze beoordeling wordt de nodus gefotografeerd met een schaalverdeling en de patiënt uitgebreid onderzocht. Omdat klinisch vrijwel geen onderscheid te maken is tussen melanoom en een benigne proliferatieve nodus geldt bij een nieuwe of veranderende nodus in principe altijd diagnostische excisie.
Patiënten met reuze CMN kunnen meerdere goedaardige proliferatieve noduli (PN’s) ontwikkelen. Het merendeel van nieuwe noduli in reuze CMN zal stabiliseren en worden in principe niet maligne. Bij patiënten met meerdere PN’s kan bij een nieuwe nodus, na uitgebreide beoordeling (incl. lymfeklieren), ook even worden afgewacht. Als er geen verdere afwijkingen zijn wordt de patiënt dan vier weken later teruggezien. Indien de nodus dan gegroeid of veranderd is dient de nodus te worden geëxcideerd. Individuele benadering is hierbij wel van groot belang, bij een niet pluis gevoel tijdens het eerste bezoek of tussentijds is resectie in een eerder stadium aangewezen. Bovenstaand beleid voorkomt continue resecties in patiënten die veel noduli aanmaken [overgenomen van beleid dr. Kinsler, oral communication].
Routing biopt
Expert opinion
Gezien de moeilijkheid van het beoordelen van de histologie van CMN, en dan met name het opsporen van een melanoom, heeft de werkgroep aanbevelingen opgesteld over wie in welke situatie het PA-materiaal zou moeten beoordelen.
Vooral bij jonge patiënten is er kans op overdiagnostiek (m.n. door proliferatieve noduli, ‘ascensie’ van naevuscellen in de epidermis) [Nguyen 2013, Phadke 2011, Zayour 2011, Tannous 2005]. Sommige maligniteiten die in CMN bij jonge kinderen ontstaan hebben een afwijkend fenotype (ontstaan in diepe delen CMN, ontbreken van melanocytaire differentiatiekenmerken) en kunnen daardoor diagnostisch problemen geven.
De werkgroep is van mening dat in principe de beoordeling van CMN-preparaten door elke patholoog kan worden gedaan, mits deze zich voldoende bekwaam hiertoe acht. Indien er histologisch verdachte bevindingen zijn en er klinisch een verdenking is op een maligniteit, is het van belang de expertise van een patholoog met speciale expertise op dit terrein in te winnen, al dan niet na bespreking in een regionaal melanoompanel.
Echografie (+punctie/excisie) lymfeklieren
Expert opinion
Bij (m.n. reuze) CMN kunnen lymfeklieren fysiologisch vergroot zijn, o.a. door aanwezigheid van naevuscellen [Fontaine 2002] of reactief, maar er kan ook sprake zijn van metastase van melanoom. Indien er bij lichamelijk onderzoek sprake is van lymfadenopathie is het belangrijk hier aanvullend onderzoek naar te verrichten om de onderliggende oorzaak op te sporen.
Aanvullend onderzoek bestaat in eerste instantie uit echografisch onderzoek van de betreffende lymfeklierstation(s). Wanneer er bij echografisch onderzoek afwijkende lymfeklieren worden gezien is het van belang histologisch materiaal te verkrijgen voor een PA-diagnose. Hierbij dient de richtlijn melanoom te worden gevolgd [richtlijn melanoom 2012].
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-02-2018
Beoordeeld op geldigheid : 17-11-2017
Een richtlijn heeft alleen zeggingskracht als op continue basis onderhoud plaatsvindt, op grond van systematische monitoring van zowel de medisch wetenschappelijke literatuur als praktijkgegevens en door gebruikers van de richtlijn aangeleverde commentaren. Voor deze richtlijn is afgesproken één keer per jaar de literatuur te evalueren om nieuwe ontwikkelingen te volgen. Bij essentiële ontwikkelingen kan besloten worden om een gehele richtlijnwerkgroep bij elkaar te roepen en tussentijdse elektronische amendementen te maken en deze onder de verschillende beroepsgroepen te verspreiden. Om de richtlijn ‘levend’ te houden is modulaire herziening mogelijk, waarbij slechts een deel of delen van de richtlijn kunnen worden gereviseerd.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering in de begeleiding van patiënten met congenitale melanocytaire naevi (CMN) en hun directe omgeving. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming, door experts, gericht op het vaststellen van goed medisch handelen. De financiering van deze richtlijn is tot stand gekomen met gelden die de NVDV uit zijn SKMS-programma heeft vrijgemaakt.
Doelgroep
De richtlijn is bestemd voor leden van de medische en paramedische beroepsgroepen, waartoe tenminste behoren: dermatologen, plastisch chirurgen, pathologen, kinderartsen, neurologen, huisartsen, verpleegkundigen en huidtherapeuten. Tevens is in een samenwerking tussen patiëntenvereniging NNN en de VSOP een huisartsbrochure ontwikkeld.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordiging van de bij CMN betrokken disciplines. Bij het samenstellen van de werkgroep is getracht rekening te houden met de geografische spreiding van de werkgroepleden en met een evenredige vertegenwoordiging van academische en niet-academische werkgroepleden. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel werkgroeplid ontving gunsten met het doel de richtlijn te beïnvloeden.
|
Werkgroepleden |
Vereniging |
|
Prof.dr. Suzanne Pasmans (voorzitter) |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Drs. Céline Eggen (secretaris) |
Promovendus kinderdermatologie Erasmus MC (NVDV)
|
|
Prof.dr. Wilma Bergman |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Dr. Nicole Kukutsch |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Dr. Albert Wolkerstorfer |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Dr. Simone Stadhouders-Keet |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Dr. Marianne Crijns |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Drs. Annelies Lommerts
|
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Prof.dr. Chantal van der Horst |
Nederlandse Vereniging voor Plastische Chirurgie (NVPC) |
|
Dr. Corstiaan Breugem |
Nederlandse Vereniging voor Plastische Chirurgie (NVPC) |
|
Prof.dr. Wolter Mooi |
Nederlandse Vereniging voor Pathologie (NVVP) |
|
Dr. Hanneke Rijk-van Gent |
Nederlandse Vereniging voor Kindergeneeskunde (NVK) |
|
Prof.dr. Michèl Willemsen |
Nederlandse Vereniging voor Neurologie (NVN) en Nederlandse Vereniging voor Kinderneurologie (NVKN) |
|
Mw. Anja Ebus |
Verpleegkundigen en Verzorgenden Nederland Verpleegkundig Specialist (V&VN VS) en V&VN Dermatologie. |
|
Mw. Marjolein van Kessel |
Nevus Netwerk Nederland (NNN)
|
Verder hebben aan deze richlijn meegewerkt drs. Joep Wijnand en drs. Michéle Hennekam.
Inbreng patiëntenperspectief
Reeds sinds de start van het richtlijntraject is de patiëntenvereniging Nevus Netwerk Nederland (NNN) zeer betrokken geweest bij de totstandkoming van deze richtlijn, door afvaarding van een bestuurslid in de werkgroep. Zij zijn in deze hoedanigheid tijdens het gehele richtlijntraject betrokken geweest, door actieve participatie tijdens werkgroepvergaderingen, en het aandragen van knelpunten die vanuit patiëntenperspectief van groot belang zijn, evenals het deelgenoot maken van lopende initiatieven in het veld. Nevus Netwerk Nederland heeft ook zijn fiat verleend aan de inhoud van de richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van de conceptrichtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt gepubliceerd op de website van de NVDV, de website van de richtlijnen database en wordt tevens verspreid onder alle bij CMN betrokken beroepsgroepen. Ook wordt een samenvatting van de richtlijn gepubliceerd en er zal in verschillende specifieke vaktijdschriften aandacht aan worden besteed. Daarnaast wordt de richtlijn onder de aandacht gebracht via de betrokken patiëntenvereniging. De richtlijn is ondergebracht in huidhuis.nl (vanuit de NVDV) en gekoppeld aan het persoonlijk gezondheidsdossier van Patient1 in huidhuis.nl voor mensen met een huidafwijking en de betrokken professionals.
Werkwijze
De richtlijn congenitale melanocytaire naevi is een geheel nieuwe richtlijn. In de richtlijn melanoom (goedgekeurd op 13.08.2012) wordt reeds verwezen naar de in wording zijnde richtlijn CMN. De richtlijnwerkgroep is opgestart in het najaar van 2011, maar heeft tussendoor enkele malen stil gelegen onder andere vanwege een andere prioritering op de richtlijnagenda van de NVDV.
In de eerste vergadering(en) werden de knelpunten en wensen ten aanzien van het onderwerp CMN geïnventariseerd binnen de werkgroep. De werkgroep formuleerde aan de hand hiervan in de richtlijn vermelde uitgangsvragen. Ook werd aan de start van het traject een enquête uitgezet onder dermatologen en plastisch chirurgen in Nederland om het huidige beleid omtrent CMN te inventariseren. De doelen van deze enquête waren het vastleggen van de uitgangssituatie om tot een richtlijn te komen die aansluit op de werkvloer, en het identificeren van aanvullende knelpunten.
De uitgangsvragen werden op het bureau van de Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) uitgewerkt tot PICO-zoekvragen. Via systematische zoekopdrachten en reference checking is bruikbare literatuur verzameld. De secretaris van de richtlijn en studenten hebben samen met de werkgroepleden de literatuur beoordeeld op inhoud en kwaliteit. Vervolgens zijn er teksten geschreven waarin de beoordeelde literatuur werd verwerkt. Deze teksten, op basis van de evidencetabellen met de verwerkte literatuur, zijn tijdens een tweedaagse vergadering besproken en van nuances en aanbevelingen voorzien. Na verdere discussie binnen de gehele richtlijnwerkgroep is de tekst verder afgestemd.
De uiteindelijke tekst werd in september 2016 aan alle betrokken wetenschappelijke verenigingen aangeboden. Men is in staat gesteld om via websites van de betrokken verenigingen commentaar op de richtlijn te geven. De commentaren zijn in de definitieve versie van de richtlijn verwerkt.
Wetenschappelijke bewijsvoering
De aanbevelingen uit deze richtlijn zijn, voor zover mogelijk, gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek.
Relevante artikelen zijn gezocht via een systematische, oriënterende zoekopdracht in Pubmed, overkoepelend voor het onderwerp congenitale melanocytaire naevi (van 1987 tot november 2014, talen Nederlands, Engels, Frans, Duits). Voor specifieke uitgangsvragen werd nog een aanvullende systematische search verricht met meer specifieke zoektermen voor de desbetreffende vraag, en in aanvullende databases (zoals Embase, CENTRAL, Cochrane library etc). Tevens is voor enkele uitgangsvragen en passages de search meer recent herhaald (2014~2016). Zie ook de zoekstrategie.
De zoekacties zijn met behulp van de PICO-systematiek opgebouwd. Dit houdt in dat voor elke uitgangsvraag een zoekvraag is geformuleerd waarbij zoveel mogelijk de volgende structuur is gehanteerd: Patiënt-Interventie-Controle-Outcome. De zoekvragen hebben de P als gemeenschappelijk onderdeel, de overige onderdelen van de PICO zijn geformuleerd op basis van de uitgangsvraag. Het merendeel van de zoekcriteria is afhankelijk van de uitgangsvraag.
Algemeen werden de volgende zoek- en selectiecriteria opgesteld:
|
Taal |
Engels, Nederlands, Duits, Frans |
|
Populatie |
Congenitale melanocytaire naevi (in alle synoniemen), alle groottes, alle leeftijden (exclusie van verworven melanocytaire naevi, of als niet gespecifieerd was of de naevi congenitaal waren) |
|
level of evidence |
Literatuurselectie volgens piramide van bewijs (EBRO-methode). Vanwege het veelal ontbreken van studies van goede kwaliteit (gerandomiseerd of prospectief) is er niet beperkt op de fundamentele opzet van de studie |
|
grootte van de studies |
Hier is in het algemeen geen limiet aangesteld, omdat voor de meeste uitgangsvragen slechts caseseries met enkele patiënten beschikbaar zijn. Wel zijn bij meerdere uitgangsvragen casereports en caseseries met <5 patiënten geëxcludeerd, omdat deze een nog grotere selectiebias geven en daarmee een mogelijk te vertekend beeld van de werkelijkheid. |
Van de geselecteerde referenties op basis van titel en/of abstract werd de full-text aangevraagd. Op basis van full-text artikelen is vervolgens verder geselecteerd en zijn artikelen zonder informatie over de betreffende uitgangsvraag geëxcludeerd. De overgebleven artikelen zijn full-text beoordeeld op kwaliteit en inhoud.
Tijdens de search werden geen (buitenlandse) richtlijnen over dit onderwerp geïdentificeerd, maar wel enkele relevante en betrouwbare ‘learning articles’, waarin op gedegen wijze relevante literatuur over het onderwerp CMN in zijn totaliteit is samengebracht. Deze artikelen vormen deels de basis voor de enkele richtlijnteksten [Alikhan 2012, Ibrahimi 2012, Viana 2013], aangevuld met andere relevante literatuur.
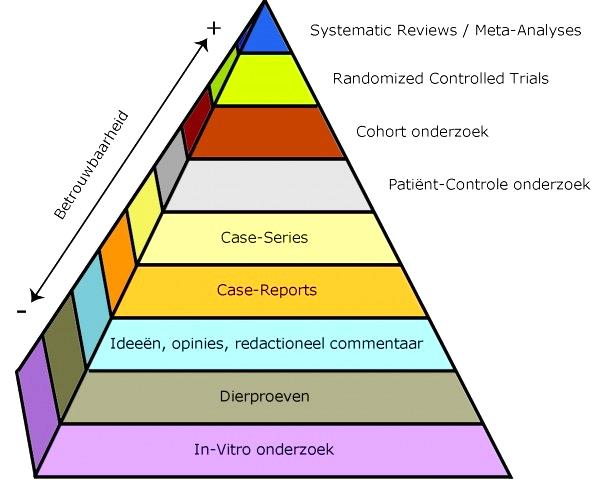
Fig. 1: Piramide van wetenschappelijk bewijs
Methode van literatuurbeoordeling
De richtlijn is ontwikkeld volgens de EBRO-methode (Evidence-based Richtlijn Ontwikkeling). Per deelonderwerp is van de relevante artikelen een ‘evidencetabel’ opgesteld, waarin de literatuur is samengevat en beoordeeld op kwaliteit. De beschrijving en beoordeling van de artikelen staan in de verschillende module onder het kopje ‘wetenschappelijke onderbouwing’, en de literatuur is vervolgens samengevat in ‘conclusies’. De kwaliteit van de artikelen en het niveau van het relevante bewijs is volgens de EBRO-methode gegradeerd, aan de hand van de indeling in tabel 1.
Daarnaast is voor de beoordeling van uitgangsvraag 12 gekozen voor de GRADE methodiek (Grading of Recommendations Assessment, Development and Evaluation), waarbij per uitkomstmaat het beschikbare bewijs is ‘gepooled’ en beoordeeld op de kwaliteit van het bewijs, zie tabel 2. De toepassing van GRADE voor deze richtlijn was lastig omdat er alleen observationele studies zijn, geen vergelijkende studies, en de studies erg heterogeen zijn qua patiënt- en naevuskenmerken. Deze methodiek is daarom alleen toegepast bij behandelmodaliteiten waarbij ‘pooling’ van resultaten volgens de werkgroep mogelijk was.
Tabel 1: EBRO methode; A. niveau van conclusies volgens EBRO; B. Indeling van methodologische kwaliteit van individuele studies
A.
|
niveau |
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
1 onderzoek van niveau A2 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
1 onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
B.
|
Kwaliteit |
Interventie |
Diagnostisch accuratesse onderzoek |
Schade / bijwerkingen*, etiologie, prognose |
|
A1 |
Systematische review van tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controle onderzoek, cohortonderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiënt-controle onderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Tabel 2: GRADE methode; A. niveau van bewijs volgens GRADE; C. wijze van beoordelen niveau van bewijs per uitkomstmaat
A.
|
GRADE Working Group grades of quality of evidence |
|
|
High |
We are very confident that the true effect lies close to that of the estimate of the effect |
|
Moderate |
We are moderately confident in the effect estimate: The true effect is likely to be close to the estimate of the effect, but there is a possibility that it is substantially different |
|
Low |
Our confidence in the effect estimate is limited: The true effect may be substantially different from the estimate of the effect |
|
Very low |
We have very little confidence in the effect estimate: The true effect is likely to be substantially different from the estimate of effect |
B.
|
Startpunt van beoordelen kwaliteit van bewijs |
|
|
RCT’s |
Beginnen als ‘high quality’ |
|
Observationele studies |
Beginnen als ‘low quality’ |
|
Per uitkomstmaat over de studies heen evt quality of evidence één of twee niveaus downgraden (1-5) of upgraden (6-8) |
|
|
1. |
risk of bias |
|
2. |
inconsistency |
|
3. |
indirectness |
|
4. |
imprecision |
|
5. |
publication bias |
|
6. |
large effect |
|
7. |
plausible confounding |
|
8. |
dose response gradient |
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijke bewijs vaak andere aspecten van belang, bijvoorbeeld: patiëntvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties of kosten. Deze aspecten worden besproken na de conclusie(s) onder ‘overige overwegingen’. Hierin wordt de conclusie op basis van de literatuur geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met deze overwegingen vanuit expert opinion. Het volgen van deze procedure en het opstellen van de richtlijn in dit format heeft als doel de transparantie van de richtlijn te verhogen.
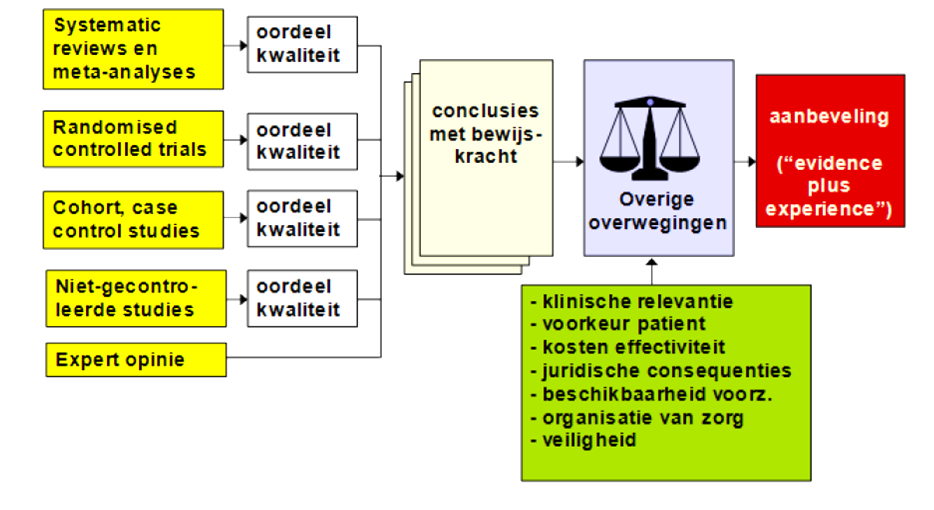
Fig. 2: Schematisch weergave methodiek van evidence-based richtlijnontwikkeling
Innovatie
Het veld van de congenitale melanocytaire naevi is in beweging. Enerzijds wordt langzamerhand de moleculaire signatuur van CMN ontrafeld, hetgeen belangrijke nieuwe aanknopingspunten geeft voor nieuwe (genetische) diagnostiek en (niet-chirurgische) therapieën. Daarnaast is er in de loop der jaren een verschuiving opgetreden van invasief en agressief behandelen om zoveel mogelijk naevusweefsel te verwijderen in het kader van een vermeend hoog melanoomrisico, naar minder agressief en meer oppervlakkig of partieel ingrijpen met meer oog voor het cosmetisch resultaat. Verder is er in het verleden veelal slechts retrospectief onderzoek verricht met een hoog risico op bias. Er zijn inmiddels enkele prospectieve studies verschenen over melanoomrisico, maar nog niet over therapie in CMN.
Advies voor onderzoek
Over de gehele linie ontbreekt het aan goed uitgevoerde studies op het gebied van CMN. Veelal zijn er alleen caseseries en casereports verschenen, met een hoog risico op bias. Dit is ergens inherent aan het onderwerp, waarbij met name grotere CMN zeldzaam zijn, en CMN daarnaast nog in grote mate interindividueel verschillen. Met name op het gebied van therapieën ontbreekt het aan betrouwbaar onderzoek. Bijna alle auteurs meten verschillende of niet-gevalideerde uitkomstmaten, en ‘patient-important outcomes’, zoals kwaliteit van leven, patiënttevredenheid maar ook veiligheid, worden vrijwel niet onderzocht. In de studies over melanoomrisico ontbreekt het aan studies in volwassen patiënten en kleinere CMN, en studies met langere follow-up duur (>10 jaar). Dit geldt ook voor studies naar het risico op NCM, hierbij zijn tevens veel verschillende definities voor NCM gehanteerd.
Onderzoek naar CMN zou moeten bestaan uit prospectief onderzoek, met nauwkeurige en gestandaardiseerde registratie van patiëntkenmerken, en gevalideerde en gestandaardiseerde registratie van uitkomsten, over een lange tijd. Hierbij moet er ten aanzien van behandeling ook meer aandacht komen voor voor de patiënt belangrijke uitkomsten en veiligheid. Op het gebied van melanoomrisico is dit internationaal reeds opgepakt, door het in diverse landen opzetten van (nationale) prospectieve registries. De werkgroep is van plan op korte termijn een dergelijke registry op te zetten in Nederland (via huidhuis.nl vanuit de NVDV), waarbij ook de uitkomsten van therapieën zullen worden meegenomen. Later zal deze gekoppeld worden aan internationale registries.
Daarnaast is meer en beter onderzoek nodig naar diagnostische modaliteiten bij CMN, zoals dermatoscopie en MRI, en diagnostische technieken om melanoom in CMN te ontdekken en te kunnen onderscheiden van benigne naevusweefsel of proliferaties.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer bewust van de richtlijn wordt afgeweken, moet dit echter beargumenteerd, gedocumenteerd en waar nodig in overleg met de patiënt worden gedaan.
Zoekverantwoording
Search richtlijn overkoepelend
Zoekstrategie voluit:
(nevi OR naevi OR nevus OR naevus OR mole OR moles OR birthmark* OR “Nevus”[MESH] OR “Nevus, pigmented”[MESH])
AND
((congenita* OR inborn OR hereditary OR newborn OR “congenital”[Subheading]) OR
(giant OR garment OR Tierfell OR gigantic OR ‘bathing trunk’))
NOT
connective tissue OR anaemicus OR elasticus OR inelasticus OR depigmentosus OR mucinosis OR lipomatosus OR sebaceus OR blue OR comedonicus OR spindle OR sponge OR woolly OR spilus OR spider OR flammeus OR Jadassohn OR Ota OR Becker OR Sutton OR Unna OR neurofibromatosis OR pancreas* OR placenta
Filters: taal: NL, EN, DU; jaar: vanaf 1987
Gezocht op 22.11.2014: 1934 hits (PubMed)
Tussentijds (2014~2016) op specifieke uitgangsvragen geupdate.
Search fotografie
Zoekstrategie voluit:
("congenital naevus".ti,ab OR "congenital naevi".ti,ab OR "congenital nevus".ti,ab OR "congenital nevi".ti,ab OR "congenital melanocytic naevus".ti,ab OR "congenital melanocytic naevi".ti,ab OR "congenital melanocytic nevus".ti,ab OR "congenital melanocytic nevi".ti,ab OR (("naevus".ti,ab OR "naevi".ti,ab OR "nevus".ti,ab OR "nevi".ti,ab OR "melanocytic naevus".ti,ab OR "melanocytic naevi".ti,ab OR "melanocytic nevus".ti,ab OR "melanocytic nevi".ti,ab) AND congenital*.ti,ab)) AND (Photography/ OR medical photography/ OR Photograph*.ti,ab) AND (english.la OR dutch.la)
Gezocht op 07.05.2014: 44 hits (34 Pubmed, 37 Embase waarvan 10 uniek)
Search dermatoscopie
Zoekstrategie voluit:
("congenital naevus".ti,ab OR "congenital naevi".ti,ab OR "congenital nevus".ti,ab OR "congenital nevi".ti,ab OR "congenital melanocytic naevus".ti,ab OR "congenital melanocytic naevi".ti,ab OR "congenital melanocytic nevus".ti,ab OR "congenital melanocytic nevi".ti,ab OR (("naevus".ti,ab OR "naevi".ti,ab OR "nevus".ti,ab OR "nevi".ti,ab OR "melanocytic naevus".ti,ab OR "melanocytic naevi".ti,ab OR "melanocytic nevus".ti,ab OR "melanocytic nevi".ti,ab) AND congenital*.ti,ab)) AND (Dermoscopy/ OR Dermascopy/ OR dermatosc*.ti,ab) AND (english.la OR dutch.la OR german.la)
Filters: taal: NL, EN, DU (zie searchtermen) en jaar vanaf 1990
Gezocht in mei/juni 2014: 243 hits (Pubmed, Embase) >> na ontdubbeling 171; met reference checking 2 extra artikelen
Search chirurgie
Chirurgische ingrepen (excision, tissue expansion, skin grafting)
((nevus/de AND ('congenital disorder'/de OR congenital:lnk OR (congent* OR unacquir* OR 'not acquired' OR 'non acquired'):ab,ti)) OR 'congenital nevus'/de OR 'pigmented nevus'/de OR 'melanocytic nevus'/de OR (((congenit* OR unacquir* OR 'not acquired' OR 'non acquired' OR pigment* OR melanocyt* OR nevocell* OR naevocell* OR 'nevo cellular' OR 'naevo cellular' OR giant OR gigantic OR medium OR large* OR multiple OR small* OR pilos* OR hair* OR divided) NEAR/3 (nevus OR naevus OR nevi OR naevi OR mole OR moles OR birthmark* OR nævi OR nævus)) OR nevocyt* OR nevomelanocyt* OR naevocyt* OR naevomelanocyt* OR ((nevocell* OR naevocell* OR 'nevo cellular' OR 'naevo cellular') NEAR/3 (lesion* OR laesion*)) OR tierfell* OR (bathing NEXT/1 trunk*) OR (((pigment* NEAR/3 (lesion* OR laesion*))) AND (nevus OR naevus OR nevi OR naevi OR mole OR moles OR birthmark*) AND (melanom* OR pseudomelanom*))):ab,ti) AND (surgery/de OR 'surgical technique'/de OR excision/de OR 'local excision'/de OR surgery:lnk OR 'minor surgery'/de OR 'major surgery'/de OR 'pediatric surgery'/exp OR 'plastic surgery'/exp OR dermatome/de OR 'skin surgery'/exp OR autograft/de OR allograft/de OR transplantation/de OR (surg* OR dermatosurg* OR excis* OR resect* OR remov* OR dermatome* OR shaving OR shave OR shaved OR ((skin OR tissue) NEAR/3 (flap* OR expan* OR stretch* OR transplant* OR replace*)) OR graft* OR autograft* OR allograft* OR reconstruct* OR resurfac*):ab,ti)
Gezocht in juli 2014: 4609 hits na ontdubbelen
|
Embase.com |
3134 |
|
Medline (OvidSP) |
393 |
|
Web-of-science |
304 |
|
Scopus |
618 |
|
PubMed publisher |
35 |
|
Cochrane |
0 |
|
Google scholar |
125 |
|
Total |
4609 |
Curettage, dermabrasie
Uit bovenstaande search kwamen ook artikelen over curettage en dermabrasie naar boven. Met reference checking en een korte search op synoniemen voor ‘congenital n(a)evi, dermbrasion, curettage) is gekeken of de gevonden artikelen voor dit onderwerp compleet waren.
Search lasertherapie
(((nevus[tiab] OR nevi[tiab] OR naevus[tiab] OR naevi[tiab] OR CMNs[tiab] OR SCMN[tiab] OR MCMN[tiab] OR LCMN[tiab] OR LCMNs[tiab] OR GCMN[tiab] OR GCMNs[tiab] OR CNNs[tiab] OR SCNN[tiab] OR MCNN[tiab] OR MCNNs[tiab] OR GCNN[tiab] OR Tierfell*[tiab] OR bathing-trunk*[tiab] OR garment-like[tiab] OR ((CNN[tiab] OR CMN[tiab] OR mole[tiab] OR moles[tiab] OR birthmark*[tiab]) AND (giant[tiab] OR gigantic[tiab] OR medium[tiab] OR large[tiab] OR multiple[tiab] OR pilos*[tiab] OR hairy[tiab] OR melanocytic[tiab] OR naevocytic[tiab] OR nevocytic[tiab] OR naevocell*[tiab] OR nevocell*[tiab] OR naevomelanocytic[tiab] OR nevomelanocytic[tiab] OR congenital*[tiab] OR unacquired[tiab] OR non-acquired[tiab]))) AND (laser[tiab] OR lasers[tiab] OR yttrium[tiab] OR erbium[tiab] OR neodymium[tiab] OR aluminum oxide[tiab] OR QSRL*[tiab] OR QSNYL*[tiab] OR QSND[tiab] OR FDQS*[tiab] OR NMRL*[tiab] OR NM-QS*[tiab] OR ND-QS*[tiab] OR Q-switch*[tiab] OR Qswitch*[tiab] OR YAG*[tiab] OR NDYAG*[tiab] OR ND-YAG*[tiab] OR ERYAG*[tiab] OR ER-YAG*[tiab] OR Neodymi*[tiab] OR Erbium*[tiab] OR Yttrium*[tiab] OR Alexandrit*[tiab] OR UCO2*[tiab] OR UltraPulse[tiab])) NOT ota[ti])
Gezocht in November 2015: 683 hits
|
Medline (OvidSP) |
330 |
|
Embase.com |
554 |
|
Central |
33 |
|
PubMed publisher |
7 |
|
Total (na ondubb.) |
683 |
