Biologicals
Uitgangsvraag
Wat is de plaats van biologicals (monoclonale antilichamen) in de behandeling van patiënten met chronische rhinosinusitis en neuspoliepen?
Aanbeveling
Overweeg om biologicals te starten bij patiënten met (matig-)ernstige chronische rhinosinusitis met neuspoliepen (type2 inflammatie) waarbij conventionele therapie onvoldoende effect heeft (gehad) op ziektegerelateerde kwaliteit van leven en ziekte-activiteit (zie stroomdiagram).
Bespreek met patiënten de indicatie en werking van biologicals inclusief het te verwachten effect en mogelijke bijwerkingen/risico’s/complicaties.
Volg de kwaliteitscriteria bij het voorschrijven van biologicals door de KNO-arts voor chronische rhinosinusitis met neuspoliepen (zie https://www.znformulieren.nl/formulieren/documenten?folderid=7291633664&title=Mepolizumab).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek gedaan naar de gunstige en ongunstige effecten van behandeling met biologicals (monoclonale antilichamen) bij patiënten met CRS met neuspoliepen. Elf gerandomiseerde studies rapporteerden de effecten van drie verschillende biologicals: dupilumab is een monoclonaal antilichaam tegen IL-4Rα en IL-13Rα; mepolizumab is een monoklonaal antilichaam tegen IL-5; omaluzimab is een antilichaam tegen IgE. Benraluzimab, een monoklonaal antilichaam tegen de IL-5 receptor, is op het moment van schrijven niet geregistreerd voor CRSwNP en is daarom niet meegenomen in de analyse. Patiëntgerapporteerde uitkomstmaten kwaliteit van leven, ernst van de ziekte en symptoomscore werden als cruciale uitkomstmaten gedefinieerd. Vrijwel alle studies includeerden patiënten met (matig-)ernstige CRS en neuspoliepen.
Behandeling met dupilumab als aanvulling op standaardbehandeling met lokale corticosteroïden verbeterde de kwaliteit van leven gemeten met SNOT-22, vergeleken met placebobehandeling in aanvulling op standaardbehandeling (GRADE hoog). Ook geeft dupilumab waarschijnlijk verbetering in de ervaren ernst van de ziekte gemeten met VAS. De totale bewijskracht van de cruciale uitkomstmaten is hoog. Daarnaast wezen ook de belangrijke uitkomstmaten in het voordeel van behandeling: dupilumab resulteert waarschijnlijk in minder revisiechirurgie, lijkt poliepscore te verbeteren en geeft mogelijk minder (ernstige) complicaties. Het effect op reuk werd niet beschreven in de in deze module geïncludeerde studies en in de “living” Cochrane review van Chong et al 2021 (data tot september 2020). Post-hoc analyses van SINUS-24 en SINUS-52 studies laten echter wél een klinisch relevante verbetering van reuk zien tijdens behandeling met dupilumab (gemeten d.m.v. patiënt gerapporteerde score (VAS) t.a.v. ernst van reukverlies, d.m.v. UPSIT reuktest en tenslotte d.m.v. SNOT-22 vragenlijst item “verminderde reuk/smaak”) (Mullol, 2022).
Voor de andere middelen is het bewijs iets minder sterk. Behandeling met mepolizumab als aanvulling op standaardbehandeling met lokale corticosteroïden verbetert waarschijnlijk de kwaliteit van leven gemeten met SNOT-22, vergeleken met placebobehandeling in aanvulling op standaardbehandeling (GRADE redelijk). Ook lijkt de behandeling de ervaren ernst van de ziekte gemeten met VAS te verbeteren. De totale bewijskracht van de cruciale uitkomstmaten is redelijk. Behandeling met mepolizumab lijkt verder klinisch relevante verbetering te geven in reuk, maar niet in revisiechirurgie. Een recente studie van Barosso (2022) in patiënten met ernstig astma i.c.m. neuspoliepen laat ook een verbetering van reuk zien in ca 35-39% van behandelde patiënten. Er is echter niet gebruik gemaakt van een objectieve test als de UPSIT reuktest; (verandering) van reuk werd gescoord door middel van patiënt gerapporteerde verandering t.o.v. de situatie vóór start van de behandeling met biologicals (geen verbetering c.q. verslechtering reuk / deels verbetering reuk / volledige verbetering reuk). De bewijskracht is hierdoor beperkt. Over het optreden van eventuele complicaties kunnen geen conclusies worden getrokken door de zeer lage bewijskracht.
Behandeling met omalizumab als aanvulling op standaardbehandeling met lokale corticosteroïden verbetert waarschijnlijk de kwaliteit van leven gemeten met SNOT-22, vergeleken met placebobehandeling in aanvulling op standaardbehandeling (GRADE redelijk). Ervaren ernst van de ziekte werd niet beschreven. De totale bewijskracht van de cruciale uitkomstmaten is redelijk. Verder lijkt behandeling met omalizumab revisiechirurgie te verminderen, maar lijkt er geen relevante verbetering in poliepscore. Het effect op reuk werd niet beschreven. Ook hier is in een later verschenen studie meer data beschikbaar gekomen. Gevaert (2020) beschrijft een klinisch relevante verbetering van de reuk op basis van zowel patiënt gerapporteerde scores als d.m.v. UPSIT reuktest. Over complicaties kunnen geen conclusies worden getrokken door de zeer lage bewijskracht.
Op basis van de literatuur verdient de behandeling met biologicals de voorkeur boven placebobehandeling bij patiënten met (vrij) ernstige CRS en neuspoliepen. Dupilumab komt het meest overtuigend naar voren, maar een directe vergelijking tussen de middelen is in de huidige analyse niet gemaakt.
Patiëntselectie / keuze van biological:
De huidige onderzoeken richten zich op (matig)ernstige CRS patiënten met type 2 inflammatie. De beoordeelde studies laten een response rate zien tussen de 50-70%; niet alle patiënten zullen dus even goed op deze medicatie reageren. Het is onbekend of (deze) biologicals (even) effectief zijn in patiënten met een lichte vorm van CRS met neuspoliepen en/of in patienten met CRS zonder duidelijke type 2 inflammatie. Ook is niet duidelijk welke biological de voorkeur geniet. De huidige Cochrane review beschrijft studies waarin een biological wordt vergeleken met placebo of geen behandeling; er zijn dus geen conclusies te trekken ten aanzien van relatieve effectiviteit van de verschillende biologicals. Wel zijn 2 verschillende network meta-analyses (NMA) verricht om de relatieve effectiviteit van de verschillende biologicals te onderzoeken (Cai, 2021 en Wu, 2021). Hoewel er in een NMA geen directe vergelijking van verschillende behandelingen mogelijk is, kan indirecte vergelijking van resultaten van interventies wel enige richting geven in t.a.v. de relatieve effectiviteit van de verschillende middelen. Volgens Cai (2021) lijkt dupilumab een groter effect te hebben op reductie van neuspoliepscore in vergelijking met omaluzimab en mepoluzimab. In patiënten met astma heeft dupilumab een groter effect op verbetering van neusverstoppingsklachten. Er zijn echter aanwijzingen dat deze beide effecten deels te wijten zijn aan de studie opzet; in de SINUS en POLYP studies werden respectievelijk dupilumab en omaluzimab c.q. placebo vergeleken met een standaard dagelijkse dosis intranasaal mometason fuoraat neusspray, terwijl in de SYNAPSE trial mepoluzimab werd vergeleken met een controle groep waarin intranasaal mometason fuoraat neusspray en/of systemische corticosteroïden zo nodig werd gegeven. Daardoor zou het therapeutische effect van mepoluzimab onderschat kunnen worden, aangezien in de controle groep een cumulatief hogere dosis corticosteroïden gebruikt werd in vergelijking met de patiënten die werden behandeld met mepoluzimab. Volgens Wu (2022) heeft dupilumab de beste effectiviteit en hoogste veiligheidskenmerken; omaluzimab heeft een betere score dan mepoluzimab wanneer effectiviteit en veiligheidskenmerken worden gecombineerd, echter als specifiek gekeken worden naar effectiviteit dan zou mepoluzimab hierop in vergelijking met omazulimab hoger scoren.
Tenslotte dient bij de keuze welke biological wordt voorgeschreven de co-morbiditeit van individuele patiënten worden meegenomen (in het bijzonder in het geval van eczeem, astma en/of urticaria). De scope van deze literatuursearch richt zich niet op de effectiviteit en veiligheid van de diverse biologicals bij astma, eczeem en urticaria. Indien sprake is van co-morbiditeit dient de effectiviteit van de diverse biologicals op deze comorbiditeiten te worden gewogen.
Risico’s/adverse effects:
In de grote meerderheid van de trials in de Cochrane review (Chong, 2021) zijn patiënten geselecteerd met (matig-)ernstige CRS (gedefinieerd op basis van hoge neuspoliepscore en op basis van de noodzaak tot frequent systemische corticosteroïden en/of chirurgische interventie). Zowel systemisch corticosteroïden gebruik als chirurgie geeft significante risico’s op bijwerkingen en/of complicaties. In deze patiëntgroep, waarbij effectief sprake is van falen van overige behandelopties, wordt tijdens behandeling met biologicals een significante verbetering van kwaliteit van leven en vermindering van ernst van ziekte aangetoond (op basis van afname van endoscopische neuspoliepscore en afname van radiologische Lund-Makay score). Daarbij lijkt geen sprake van verhoogd risico op bijwerkingen en/of complicaties ten opzichten van andere therapeutische opties (in ieder geval in de eerste 24-52 weken na start van de behandeling). In patiënten met (matig-)ernstige ziekteactiviteit kan door middel van biologicals mogelijk meer risicovolle interventies (revisiechirurgie) voorkomen worden.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het is belangrijk om de patiënt goed te informeren over de verschillende behandelopties. Biologicals lijken een veelbelovend middel in de behandeling van patiënten met (matig-) ernstig CRS met neuspoliepen (type 2 inflammatie) waarbij conventionele therapie (intranasale + systemische corticostereoiden en chirurgische behandeling in het verleden) onvoldoende effect heeft (gehad) op patiënt gerapporteerde ziekte gerelateerde kwaliteit van leven en ziekte-activiteit. Goede patiëntselectie is noodzakelijk. Het is belangrijk om de indicaties voor biologicals met patiënten te bespreken, aangezien op dit moment nog niet elke patiënt in aanmerking komt voor behandeling met een biological. De werking van biologicals inclusief het te verwachten effect en mogelijke bijwerkingen/risico’s/complicaties dienen te worden besproken. Er dient een afweging gemaakt te worden of een biological een aanvullend effect kan hebben boven conventionele therapie en of de hogere kosten van biologicals afwegen tegen (de vaak hogere) risico’s en mogelijke complicaties van (vaak uitgebreidere) revisie chirurgie. Er dient een afweging per individuele patiënt te worden gemaakt met welk middel (biological) het best te kan worden gestart. Indicatiestelling en keuze welke biological wordt gestart, dient te worden gemaakt samen met de longarts in een multidisciplinaire setting. Zie ook de richtlijn Biologicals (NVR, 2011) en kwaliteitscriteria, hieronder bij kopje “Aanvaardbaarheid, haalbaarheid en implementatie” nader toegelicht.
Kosten (middelenbeslag)
Tot op heden zijn biologicals duur in vergelijking met conventionele behandeling met (lokale en systemische) corticosteroïden en chirurgie. Daarbij is het noodzakelijk om behandeling met biologicals te continueren teneinde het beoogde effect op ziekteactiviteit te behouden. Verder onderzoek is nodig om de optimale dosis en behandelschema bij langduriger gebruik vast te stellen. Er zijn aanwijzingen dat dosisreductie en afname van dosisfrequentie mogelijk is bij goed effect (Van der Lans, 2021). Mogelijk dat hiermee de kosten per patiënt per jaar kunnen dalen. Ook is aannemelijk dat de prijs van deze middelen per patiëntjaar zal dalen indien deze middelen meer geïmplementeerd zullen gaan worden in de dagelijkse praktijk. Een goede patiëntselectie is noodzakelijk. Er is behoefte aan zowel kosten-effectiviteitsstudies en data over langetermijneffectiviteit van de verschillende biologicals om (bij huidige prijsstelling van de middelen) richting te geven aan de nut en noodzaak van gebruik van biologicals in de individuele patiënt aan de ene kant en de kosten voor de maatschappij aan de andere kant. Vanwege de hoge kosten vallen deze middelen op dit moment in het budget dure en weesgeneesmiddelen. Het is geadviseerd om jaarlijks de te verwachten aanspraak met het ziekenhuis te bespreken.
Aanvaardbaarheid, haalbaarheid en implementatie
Biologicals zijn medicijnen die pas sinds kort tot het therapeutisch arsenaal van de KNO-arts behoren. Het voorschrijven van biologicals kwam in het verleden niet aan bod in de opleiding tot KNO-arts. Er is dus relatief weinig ervaring met deze middelen, in tegenstelling tot bijvoorbeeld de longarts, dermatoloog en met name reumatoloog. Er zijn door Zorgkoepel NL in samenspraak met de Nederlandse Vereniging voor KNO-Heelkunde en hoofd-halschirurgie een aantal kwaliteitscriteria opgesteld, waaraan dient te worden voldaan bij het voorschrijven van biologicals door de KNO-arts voor CRS met neuspoliepen (ZN Formulier). Biologicals zijn alleen weggelegd voor patiënten met ernstige, ongecontroleerde CRS met neuspoliepen (primaire diffuse type 2 CRS) ondanks adequate standaardtherapie. De indicatiestelling gaat volgens criteria van de EPOS 2020 position paper (Fokkens, 2020). Het is van belang om vooraf de therapietrouw en comorbiditeiten van een patiënt goed beoordelen. Een patiënt dient niet te roken. Er dient al eens eerder adequate neusbijholtechirurgie te zijn verricht (FESS; in ieder geval infundibulotomie met volledige ethmoidectomie). Ten aanzien van institutionele voorwaarden dient sprake te zijn van de mogelijkheid tot het vaststellen van de EPOS criteria (zoals afname SNOT-22 vragenlijst, reuktest, laboratoriumonderzoek). Tevens is in de indicatiestelling en keuze van biological een multidisciplinaire patiëntbespreking met een longarts vereist. Er dient binnen de instelling bij longarts, dermatoloog en/of reumatoloog ervaring te zijn met het voorschrijven van biologicals en het behandelen van eventuele bijwerkingen als hypereosinofilie.
Behandelend KNO-artsen (en andere bij de zorg betrokkenen hulpverleners zoals doktersassistenten/verpleegkundigen) dienen vooraf adequaat te zijn geschoold. Ook de patiënt dient goed te worden geïnstrueerd over toediening van de medicatie (o.a. leren prikken). Dit zal in eerste instantie leiden tot hogere kosten door meer tijdsinspanning en cursussen/nascholing. Zie ook Competenties voor behandelaar biologicals (ZN formulier). Zoals al is besproken onder kopje “Kosten” dienen deze middelen vooralsnog te worden bekostigd binnen het budget “Dure en weesgeneesmiddelen” van elk ziekenhuis. Het ziekenhuis kan de implementatie van deze middelen hierdoor beperken tot een maximum of implementatie vertragen.
Tijdens het schrijven van de huidige module (begin 2023) vielen dupilumab, mepolizumab en omaluzimab onder verzekerde zorg bij CRS met neuspoliepen, maar benralizumab niet.
Lokale beschikbaarheid mag niet van invloed zijn op de beslissing wel of niet te starten met biologicals; indien een patiënt in aanmerking komt maar dit (nog) niet mogelijk is in het eigen ziekenhuis, dan dient met de patiënt een eventuele verwijzing naar een ander ziekenhuis of expertisecentrum te worden besproken.
Ten slotte is het van belang om na start met biologicals het effect en eventuele bijwerkingen goed te evalueren. De EPOS position paper raad aan om dit na 16 weken en na 1 jaar te doen (Fokkens, 2020).
Aanbeveling-1
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Overweeg om biologicals te starten bij patiënten met (matig-)ernstig CRS met neuspoliepen (type 2 inflammatie) waarbij conventionele therapie onvoldoende effect heeft (gehad) op ziekte gerelateerde kwaliteit van leven en ziekte-activiteit. Biologicals zijn geen vervanging van adequate standaard therapie maar een aanvulling hierop. Een goede patiëntselectie is noodzakelijk. De indicatiestelling gaat volgens het EPOS 2020 position paper (Fokkens, 2020). In deze patiëntgroep, waarbij effectief sprake is van falen van overige behandelopties, wordt tijdens behandeling met biologicals een significante verbetering van kwaliteit van leven en vermindering van ernst van ziekte aangetoond. Daarbij lijkt geen sprake van verhoogd risico op bijwerkingen en/of complicaties ten opzichte van andere therapeutische opties in het eerste behandeljaar. In patiënten met (matig-)ernstige ziekteactiviteit kunnen door middel van biologicals mogelijk meer risicovolle interventies (revisiechirurgie) voorkomen worden. Het is van belang om vooraf de therapietrouw en comorbiditeiten van een patiënt goed te beoordelen. Een patiënt dient niet te roken. Er dient al eens eerder adequate neusbijholtechirurgie (minimaal infundibulotomie met voorste- en achterste infundibulotomie) te zijn verricht. Er wordt geadviseerd biologicals voor CRS met neuspoliepen alleen voor te schrijven mits aan de institutionele voorwaarden is voldaan (zie stroomdiagram).
Onderbouwing
Achtergrond
Chronische rhinosinusitis (CRS) is een heterogeen ziektebeeld waarbij CRS met neuspoliepen (CRSwNP) in Westerse landen met name is geassocieerd met type 2 inflammatie. Symptomen van CRS met neuspoliepen zijn vaak onvoldoende onder controle door huidige medicamenteuze behandeling (zoals intranasale en systemische corticosteroïden) en ook na chirurgie van de neusbijholten wordt in een groot aantal patiënten nog onvoldoende ziektecontrole bereikt (regelmatig uitmondend in revisiechirurgie). Dit leidt tot significante ziekte-gerelateerde beperking van kwaliteit van leven en hoge consumptie van medische zorg, met bijbehorende hoge kosten.
Biologicals (of “biologics”) is een wat algemene term voor medicijnen die zijn geproduceerd door een biologisch proces. Een specifiek type biological betreft de monoklonale antilichamen. Deze antilichamen richten zich op specifieke ontstekingsmediatoren of immuuncellen die betrokken zijn bij chronische inflammatoire ziekten.
Tot circa 2010 was het meeste onderzoek naar de rol van deze biologicals gericht op de behandeling van ziekten als allergie, astma en reumatologische/immunologische aandoeningen. In recente trials zijn biologicals onderzocht in patiënten met (matig-)ernstige CRS met neuspoliepen. Deze biologicals zijn gericht op ontstekingsfactoren en -receptoren die betrokken zijn bij type 2 inflammatie. Er is hierbij sprake van een verhoogd IL-4, IL-5, IL-13 of totaal IgE. Voor CRS met neuspoliepen (primaire diffuse type 2 CRS) zijn momenteel de volgende drie biologicals beschikbaar. Dupilumab is een monoclonaal antilichaam tegen IL-4Rα en IL-13Rα; mepolizumab is een monoklonaal antilichaam tegen IL-5;. omaluzimab is een antilichaam tegen IgE. Benraluzimab, een monoklonaal antilichaam tegen de IL-5 receptor, is (vooralsnog) alleen geregistreerd voor ernstig ongecontroleerd eosinofiel astma en (nog) niet voor CRSwNP.
In deze module wordt de werking, effectiviteit en veiligheidsaspecten/bijwerkingen van de verschillende biologicals voor de behandeling van CRS met neuspoliepen besproken. Aanbevelingen ten aanzien van patiëntenselectie en de waarde van deze biologicals in het totale therapeutisch arsenaal voor patiënten met CRS met neuspoliepen worden gegeven.
Conclusies / Summary of Findings
Anti-IL-4Rα mAb (dupilumab)
Critical outcomes
|
High GRADE |
Dupilumab in addition to standard of care treatment including topical steroids improves health-related quality of life up to 24 weeks as determined by SNOT-22 in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Source: Chong, 2021. |
|
Moderate GRADE |
Dupilumab in addition to standard of care treatment including topical steroids likely improves disease severity (VAS) in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Source: Chong, 2021. |
Important outcomes
|
Low GRADE |
Dupilumab in addition to standard of care treatment including topical steroids may improve nasal polyp score in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Source: Chong, 2021. |
|
No GRADE |
No evidence was found regarding the effect of dupilumab on sense of smell/olfactory dysfunction when compared with placebo in patients with chronic rhinosinusitis with nasal polyps. |
|
Moderate GRADE |
Dupilumab in addition to standard of care treatment including topical steroids likely reduces need for revision surgery in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Source: Chong, 2021. |
|
Low GRADE |
Dupilumab in addition to standard of care treatment including topical steroids may reduce serious adverse events in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Source: Chong, 2021. |
|
Low GRADE |
Dupilumab in addition to standard of care treatment including topical steroids may have little to no effect on adverse events in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Source: Chong, 2021. |
Anti-IL-5 mAb (mepolizumab)
Critical outcomes
|
Moderate GRADE |
Mepolizumab in addition to standard of care treatment including topical steroids likely improves health-related quality of life as determined by SNOT-22 in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Sources: Bachert, 2022; Chong, 2021; Han, 2021. |
|
Low GRADE |
Mepolizumab in addition to standard of care treatment including topical steroids may improve disease severity (VAS) in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Sources: Chong, 2021; Han, 2021. |
Important outcomes
|
Low GRADE |
Mepolizumab in addition to standard of care treatment including topical steroids may not improve nasal polyp score in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Sources: Bachert, 2022; Chong, 2021. |
|
Low GRADE |
Mepolizumab in addition to standard of care treatment including topical steroids may not improve sense of smell in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Sources: Bachert, 2022; Han, 2021. |
|
Low GRADE |
Mepolizumab in addition to standard of care treatment including topical steroids may reduce the need for revision surgery in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Sources: Bachert, 2022; Chong, 2021; Han, 2021. |
|
Very low GRADE |
The evidence is very uncertain about the effect of mepolizumab on (serious) adverse events when compared with placebo in patients with moderate to severe chronic rhinosinusitis with nasal polyps.
Sources: Bachert, 2022; Chong, 2021; Han, 2021. |
Anti-IgE mAb (omalizumab)
Critical outcomes
|
Moderate GRADE |
Omalizumab in addition to standard of care treatment including topical steroids likely improves health-related quality of life up to 25 weeks as determined by SNOT-22 in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Sources: Chong, 2021. |
|
No GRADE |
No evidence was found regarding the effect of omalizumab on disease severity (VAS) when compared with placebo in patients with chronic rhinosinusitis with nasal polyps. |
Important outcomes
|
Low GRADE |
Omalizumab in addition to standard of care treatment including topical steroids may not improve nasal polyp score in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Source: Chong, 2021. |
|
No GRADE |
No evidence was found regarding the effect of omalizumab on sense of smell/olfactory dysfunction when compared with placebo in patients with chronic rhinosinusitis with nasal polyps. |
|
Low GRADE |
Omalizumab in addition to standard of care treatment including topical steroids may increase avoidance of surgery in patients with moderate to severe chronic rhinosinusitis with nasal polyps, when compared with placebo in addition to standard of care treatment including topical steroids.
Source: Chong, 2021. |
|
Very low GRADE |
The evidence is very uncertain about the effect of omalizumab on (serious) adverse events when compared with placebo in patients with moderate to severe chronic rhinosinusitis with nasal polyps.
Source: Chong, 2021. |
Samenvatting literatuur
Description of studies
Chong (2021) performed a Cochrane living review. The aim of the review is to see if any of the biologicals (monoclonal antibodies, mAb) are effective in treating people with chronic rhinosinusitis. In the 2021 edition of the review, the search was performed up to September 2020. The review included trials where patients with chronic rhinosinusitis were treated for at least three months with either one of the new biologic drugs or a placebo (dummy) treatment and that reported the effect of the drug on people's symptoms, their general health and any adverse effects. The review found 10 studies, looking at three different drugs: dupilumab (anti-IL-4Rα mAb, 3 RCTs with 784 participants in total), mepolizumab (anti-IL-5 mAb, 2 RCTs with 137 participants in total) and omalizumab (anti-IgE mAb, 5 RCTs with 329 participants in total). All the studies were sponsored or supported by industry. A total of 1262 participants were included. With the exception of two participants in one study (Pinto 2010), all the participants were adults with moderate to severe chronic rhinosinusitis with nasal polyps and a significant number of participants (43% to 100%) also had asthma as a co-morbidity. Overall, the risk of bias was low or unclear for most domains. Two studies were published after publication of the Cochrane review.
Han (2021) reported the results of the SYNAPSE trial, a randomised, double-blind, placebo-controlled, phase 3 trial studying treatment with mepolizumab. The multicentre trial (93 centres in 11 countries) included patients with recurrent, refractory, severe, bilateral nasal polyp symptoms (nasal obstruction symptom visual analogue scale [VAS] score of >5), were eligible for repeat nasal surgery (overall symptoms VAS score >7 and endoscopic nasal polyps score of ≥5, with a minimum score of 2 in each nasal cavity) despite standard of care treatment, and had to have at least one nasal surgery in the past 10 years. The coprimary endpoints were change from baseline in total endoscopic nasal polyp score at week 52 and in mean nasal obstruction VAS score during weeks 49–52, assessed in the intention-to-treat population (407 patients). The study was funded by GlaxoSmithKline, who also funded editorial support of the manuscript.
Results
Results are presented per outcome measure. The included studies compared dupilumab, mepolizumab or omalizumab with placebo, all in addition to standard of care, including topical steroid application.
Health-related quality of life
Six studies reported health-related quality of life assessed by SNOT-22 (0-110, lower is better) up to 25 weeks (figure 1), one study at 40 weeks and six studies at 52 to 56 weeks.
Anti-IL-4Rα mAb (dupilumab)
For dupilumab, three trials with in total 784 patients found a pooled mean difference (MD) of -19.50 in favor of treatment up to 25 weeks, with a 95% confidence interval (CI) from -22.43 to -16.58. At 52 weeks, the LIBERTY SINUS 52 trial reported a MD of -22.38 (95% CI -27.10 to -17.66; N=303) in favor of treatment. These differences are considered clinically relevant.
Anti-IL-5 mAb (mepolizumab)
For mepoluzimab, Bachert 2017 reported a MD of -13.26 (95% CI -22.08 to -4.44) in favor of treatment compared to placebo in 105 patients up to 25 weeks. Han (2021) found a of -16.49 (95% CI -23.57 to 9.43) in favor of mepoluzimab in 407 patients at 52 weeks. Taken together (figure 1), the MD of -13.60 (95% CI -17.76 to -9.44) is considered clinically relevant.
Anti-IgE mAb (omalizumab)
The POLYP1 and POLYP2 trial reported SNOT-22 in 265 patients and found a MD of -15.62 (95% CI -19.79 to -11.45) in favor of treatment. The difference is considered clinically relevant.
Figure 1. Health-related quality of life (SNOT-22) up to 25 weeks.
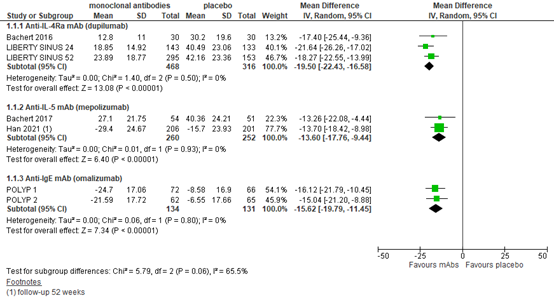
SNOT-22 score 0-110, lower is better. Follow-up up to 25 weeks unless stated otherwise.
Random effects model. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Disease severity
Anti-IL-4Rα mAb (dupilumab)
Based on 3 publications on dupilumab with 784 patients in total, the MD in disease severity (VAS 0-10, lower is better) was -3.00 (95% CI-3.47 to -2.53) in favor of treatment (figure 2). This was considered clinically relevant.
Anti-IL-5 mAb (mepolizumab)
Two mepolizumab trials reported disease severity and found MDs of -2.03 and -1.65 in 479 patients in favor of treatment (figure 2). The differences are considered clinically relevant.
Anti-IgE mAb (omalizumab)
Disease severity was not reported in an omalizumab trial.
Figure 2. Disease severity (VAS).
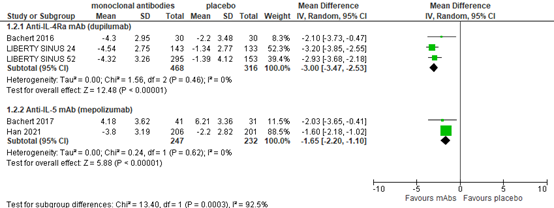
Visual analogue score 0-10, lower is better. Random effects model. Lower score is better. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Nasal polyp score
Anti-IL-4Rα mAb (dupilumab)
Three studies reported nasal polyp score (0-8, lower score is better) after dupilumab treatment. Up to 24 weeks, MD was -1.80 (95% CI -2.25 to -1.35) based on 3 studies with 784 patients (figure 3). At 52 weeks, the LIBERTY SINUS 52 trial reported a MD of -2.34 (95% CI -2.77 to -1.91) in 303 patients. The differences are considered clinically relevant.
Anti-IL-5 mAb (mepolizumab)
In two studies evaluating mepoluzimab in 137 patients (figure 3), improvement in nasal polyp score was more substantial in the experimental groups, with a MD of -1.23 (95% CI -1.79 to -0.68). In addition, Han (2021) reported change from baseline in total endoscopic nasal polyp score at week 52, and found a mean change of -0.9±1.90 in the mepoluzimab group versus -0.1±1.46 in the placebo group. The differences are not considered clinically relevant.
Anti-IgE mAb (omalizumab)
Four omalizumab trials reported nasal polyp score. The pooled MD for 312 patients was -1.26 (95% CI -2.21 to -0.31) in favor of omalizumab treatment (figure 3). The difference is not considered clinically relevant.
Figure 3. Nasal polyp score.
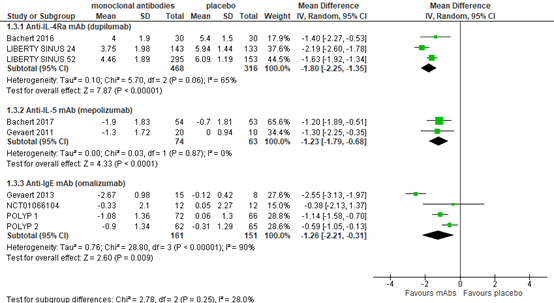
Polyp score 0-8, lower is better. Random effects model. Lower score is better. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Sense of smell/olfactory dysfunction
Anti-IL-4Rα mAb (dupilumab)
Chong (2021) did not report sense of smell or olfactory dysfunction for dupilumab.
Anti-IL-5 mAb (mepolizumab)
Han (2021) reported loss of smell change from baseline (VAS 0-10, lower is better) at week 49 to 52 in 407 patients and found a MD of -0.37 (95% CI -0.65 to -0.08) in favor of mepolizumab, which is not considered clinically relevant. Bachert (2022) reported difficulty in sense of smell as DSS score, which was derived from daily Nasal Polyposis Symptom Diary entries in which patients rated their worst difficulty in sense of smell over the past 24 hours on a scale of 0 (none) to 3 (severe). The MD in 272 patients at week 40 was -0.218 (95% CI -0.361, -0.074) and -0.237 (95% CI -0.389, -0.084) at week 52, in favor of benralizumab, which was not considered clinically relevant.
Anti-IgE mAb (omalizumab)
Chong (2021) did not report sense of smell or olfactory dysfunction for omalizumab.
Revision surgery
Anti-IL-4Rα mAb (dupilumab)
Chong (2021) reported the number of patients who had revision surgery as a rescue treatment. Based on 2 dupilumab trials with 725 patients, the relative risk (RR) was 0.17 (95% CI 0.05 to 0.52) in favor of treatment (figure 4), a clinically relevant difference.
Anti-IL-5 mAb (mepolizumab)
Chong (2021) reported one study (Bachert, 2017) with patients still meeting criteria for surgery at 24 weeks, and one study with patients requiring 'rescue' surgery during trial (Gevaert, 2011), as presented in figure 4. In addition, Han (2021) reported the proportion of patients having nasal surgery up to week 52. Taken together, the RR was 0.58 (95% CI 0.28 to 1.20), which is considered a clinically relevant difference.
Anti-IgE mAb (omalizumab)
For omalizumab, Chong (2021) reported avoidance of surgery. Based on 2 studies with 265 patients the RR was 5.60 (95% CI 1.99 to 15.76) in favor of omalizumab. This is considered clinically relevant.
Figure 4. Revision surgery
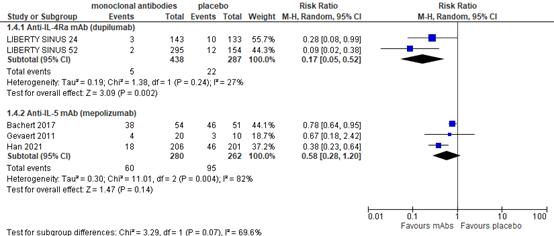
Random effects model. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Serious adverse events
Anti-IL-4Rα mAb (dupilumab)
Three studies reported serious adverse events for dupilumab and found a pooled RR of 0.47 (95% CI 0.29 to 0.76) in favor of treatment (782 patients), as presented in figure 5. This RR is considered clinically relevant.
Anti-IL-5 mAb (mepolizumab)
Based on three studies with 524 patients, the RR for serious adverse events was 0.93 (95% CI 0.44 to 1.94) in favor of treatment (figure 5). This is not considered clinically relevant.
Anti-IgE mAb (omalizumab)
For serious adverse events, Chong (2021) reported a RR of 0.32 (95% CI 0.05 to 2.00) in favor of omalizumab in five studies with 329 patients (figure 5), which is considered clinically relevant.
Figure 5. Serious adverse events
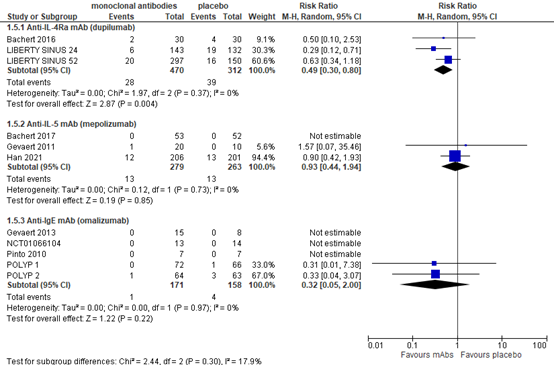
Random effects model. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Adverse events
Anti-IL-4Rα mAb (dupilumab)
As adverse events, Chong (2020) reported nasopharyngitis, including sore throat (figure 6). Based on three trials with 783 patients, the RR was 0.95 (95% CI 0.72 to 1.25) in favor of treatment, which is not considered a clinically relevant finding.
Anti-IL-5 mAb (mepolizumab)
Two studies with 135 patients reported nasopharyngitis, including sore throat as adverse events. One study with 105 patients found a RR of 0.70 (95% CI 0.34 to 1.43) in favor of mepolizumab, whereas another study with 30 patients reported a RR of 1.57 (95% CI 0.36 to 1.47) in favor of placebo (figure 6). Han (2021) reported a RR of 0.98 (95% CI 0.90 to 1.07) on any on-treatment adverse event. Taken together, the difference in adverse events is not clinically relevant.
Anti-IgE mAb (omalizumab)
As adverse events, nasopharyngitis including sore throat was reported (figure 6). Based on five studies with 329 patients, the RR was 0.71 (95% CI 0.29 to 1.73), which is considered clinically relevant.
Figure 6. Adverse events - nasopharyngitis, including sore throat
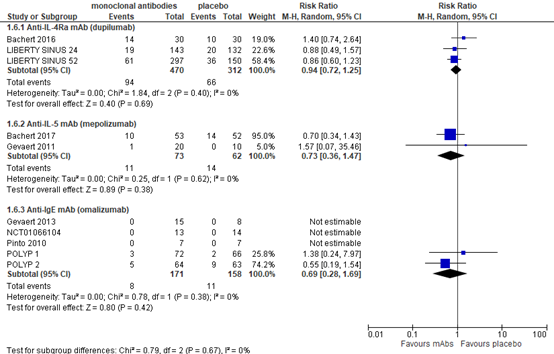
Random effects model. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Level of evidence of the literature
Evidence was graded separately for the different types of medication.
Anti-IL-4Rα mAb (dupilumab)
For anti-IL-4Rα mAb (dupilumab), the level of evidence for all outcome measures was based on randomized studies and therefore started at high.
For the outcome health-related quality of life up to week 25, the level of evidence was HIGH.
For the outcome disease severity, the level of evidence was downgraded with one level to MODERATE due to study limitations (methods or criteria used in the measurement of the outcome were not validated).
For the outcome nasal polyp score, the level of evidence was downgraded with two levels to LOW due to study limitations (methods or criteria used in the measurement of the outcome were not validated, -1) and because the confidence interval around the point estimate crossed one limit of clinical relevance (imprecision, -1).
For the outcome sense of smell/olfactory dysfunction, the evidence could not be graded due to a lack of data.
For the outcome revision surgery, the level of evidence was downgraded with one level to MODERATE due to study limitations (it is unclear which criteria were used to determine the need for 'rescue surgery').
For the outcomes serious adverse events and adverse events, the level of evidence was downgraded with two levels to LOW because of limited generalizability (more heterogeneous population and/or longer periods of treatment and follow-up needed, indirectness, -1) and small sample size for the outcome (imprecision, -1).
Anti-IL-5 mAb (mepolizumab)
For anti-IL-5 mAb (mepolizumab), the level of evidence for all outcome measures was based on randomized studies and therefore started at high.
For the outcome health-related quality of life, the level of evidence was downgraded with one level to MODERATE because the confidence interval around the point estimate crossed one limit of clinical relevance (imprecision, -1).
For the outcome disease severity, the level of evidence was downgraded with two levels to LOW due to study limitations (methods or criteria used in the measurement of the outcome were not validated) and because the confidence interval around the point estimate crossed one limit of clinical relevance (imprecision, -1).
For the outcome nasal polyp score, the level of evidence was downgraded with two levels to LOW due to study limitations (methods or criteria used in the measurement of the outcome were not validated, -1) and because the confidence interval around the point estimate crossed one limit of clinical relevance (imprecision, -1).
For the outcome sense of smell/olfactory dysfunction, the level of evidence was downgraded with two levels to LOW due to study limitations (methods or criteria used in the measurement of the outcome were not validated, -1) and because the confidence interval around the point estimate crossed one limit of clinical relevance (imprecision, -1).
For the outcome revision surgery, the level of evidence was downgraded to LOW due to study limitations (it is unclear which criteria were used to determine the need for 'rescue surgery', -1) and because the confidence interval around the point estimate crossed one limit of clinical relevance (imprecision, -1).
For the outcomes serious adverse events and adverse events, the level of evidence was downgraded to VERY LOW because of limited generalizability (more heterogeneous population and/or longer periods of treatment and follow-up needed, indirectness, -1) and because the confidence interval around the point estimate crossed both limits of clinical relevance (imprecision, -2).
Anti-IgE mAb (omalizumab)
For anti-IgE mAb (omalizumab), the level of evidence for all outcome measures was based on randomized studies and therefore started at high.
For the outcome health-related quality of life, the level of evidence was downgraded with one level to MODERATE because the confidence interval around the point estimate crossed one limit of clinical relevance (imprecision, -1).
For the outcome disease severity, the evidence could not be graded due to a lack of data.
For the outcome nasal polyp score, the level of evidence was downgraded with two levels to LOW due to study limitations (methods or criteria used in the measurement of the outcome were not validated, -1) and because the confidence interval around the point estimate crossed one limit of clinical relevance (imprecision, -1).
For the outcome sense of smell/olfactory dysfunction, the evidence could not be graded due to a lack of data.
For the outcome revision surgery (avoidance), the level of evidence was downgraded with two levels to LOW due to study limitations (criteria used for avoidance were not validated, -1) and limited sample size (imprecision, -1).
For the outcomes serious adverse events and adverse events, the level of evidence was downgraded to VERY LOW because of limited generalizability (more heterogeneous population and/or longer periods of treatment and follow-up needed, indirectness, -1) and because the confidence interval around the point estimate crossed both limits of clinical relevance (imprecision, -2).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the benefits and harms of biologicals (monoclonal antibodies) in the treatment of patients with chronic rhinosinusitis?
P: Patients with chronic rhinosinusitis with nasal polyps.
I: Monoclonal antibody treatment (dupilumab, mepolizumab, omaluzimab) plus intranasal steroids.
C: Placebo/no treatment plus intranasal steroids.
O: PROMs (disease-related quality of life (SNOT-score), total nasal symptom score or disease severity (VAS)), nasal polyp score, sense of smell/olfactory dysfunction, revision surgery, (serious) adverse events (short and long term).
In the current analysis, only biologicals approved for treatment of CRSwNP by the European Medicines Agency (i.e. dupilumab, mepolizumab, omaluzimab) were considered.
Relevant outcome measures
The guideline development group considered patient reported outcome measures (PROMs) as critical outcomes for decision making; and the outcomes nasal polyp score, sense of smell/olfactory dysfunction, revision surgery and (serious) adverse events as important outcomes for decision making.
A priori, the working group considered disease-related quality of life, as assessed by the Sino-Nasal Outcome Test (SNOT-22) score, the preferred outcome. This is a quality of life score specifically for CRS patients, in which patients score the burden of disease for 22 symptoms and social/emotional consequences from 0 (“no problem”) to 5 (“problem as bad as it can be”), resulting in a total score from 0 to 110. In case SNOT-22 was not reported, symptom severity as described by total nasal symptom score was preferred over the use of a visual analogue score (VAS). The important outcomes nasal polyp score and sense of smell/olfactory dysfunction could be assessed by any validated score. Adverse events were not defined a priori.
For the SNOT-22 score the working group defined 12.0 as a minimal clinically (patient) important difference (MCID) for medically managed patients with CRS, as described in literature (Phillips, 2018). For total symptom score, polyp score and VAS scores, the working group defined 15% of the maximum score as MCID, and 0.5 for standardized mean differences. For adverse events and revision surgery (risk ratio, RR), the working group defined 25% as a MCID.
Search and select (Methods)
The databases Embase.com and Ovid/Medline were searched with relevant search terms until October 10, 2022, for systematic reviews and RCTs about the place of biologicals as treatment for patients with CRS. The search resulted in 260 unique hits. Studies were eligible for inclusion if they were (1) randomized controlled trials (RCTs) or meta-analyses of RCTs, (2) comparing treatment with biologicals (monoclonal antibodies, any type, dose or duration) with placebo, (3) in patients with chronic rhinosinusitis, with or without nasal polyps. Based on title and abstract screening, 22 studies were initially selected. After reading the full text, twenty studies were excluded (see the table with reasons for exclusion under the ‘Methods’ tab) and two were included.
Results
One systematic review and one RCT were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bachert C, Han JK, Desrosiers MY, Gevaert P, Heffler E, Hopkins C, Tversky JR, Barker P, Cohen D, Emson C, Martin UJ, Shih VH, Necander S, Kreindler JL, Jison M, Werkström V. Efficacy and safety of benralizumab in chronic rhinosinusitis with nasal polyps: A randomized, placebo-controlled trial. J Allergy Clin Immunol. 2022 Apr;149(4):1309-1317.e12. doi: 10.1016/j.jaci.2021.08.030. Epub 2021 Sep 29. PMID: 34599979.
- Barroso B, Valverde-Monge M, Alobid I, Olaguibel JM, Rial MJ, Quirce S, Arismendi E, Barranco P, Betancor D, Bobolea I, Cárdaba B, Cruz Carmona MJ, Curto E, Domínguez-Ortega J, González-Barcala FJ, Martínez-Rivera C, Mahíllo-Fernández I, Muñoz X, Picado C, Plaza V, Rodrigo Muñoz JM, Soto-Retes L, Valero A, Del Pozo V, Mullol J, Sastre J. Smell improvement by anti-IgE and anti-IL 5 biologics in patients with CRSwNP and severe asthma. A real life study. J Investig Allergol Clin Immunol. 2022 Apr 12:0. doi: 10.18176/jiaci.0812. Epub ahead of print. PMID: 35416154.
- Cai S, Xu S, Lou H, Zhang L. Comparison of Different Biologics for Treating Chronic Rhinosinusitis With Nasal Polyps: A Network Analysis. J Allergy Clin Immunol Pract. 2022 Jul;10(7):1876-1886.e7. doi: 10.1016/j.jaip.2022.02.034. Epub 2022 Mar 8. PMID: 35272073.Chong LY, Piromchai P, Sharp S, Snidvongs K, Webster KE, Philpott C, Hopkins C, Burton MJ. Biologics for chronic rhinosinusitis. Cochrane Database Syst Rev. 2021 Mar 12;3(3):CD013513. doi: 10.1002/14651858.CD013513.pub3. PMID: 33710614; PMCID: PMC8094915.
- Fokkens WJ et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2020. Rhinology. 2020 Feb 20;58(Suppl S29):1-464. doi: 10.4193/Rhin20.600. PMID: 32077450.
- Fokkens WJ, Lund V, Bachert C, Mullol J, Bjermer L, Bousquet J, Canonica GW, Deneyer L, Desrosiers M, Diamant Z, Han J, Heffler E, Hopkins C, Jankowski R, Joos G, Knill A, Lee J, Lee SE, Mariën G, Pugin B, Senior B, Seys SF, Hellings PW. EUFOREA consensus on biologics for CRSwNP with or without asthma. Allergy. 2019 Dec;74(12):2312-2319. doi: 10.1111/all.13875. Epub 2019 Jul 15. PMID: 31090937; PMCID: PMC6972984.
- Gevaert P, Omachi TA, Corren J, Mullol J, Han J, Lee SE, Kaufman D, Ligueros-Saylan M, Howard M, Zhu R, Owen R, Wong K, Islam L, Bachert C. Efficacy and safety of omalizumab in nasal polyposis: 2 randomized phase 3 trials. J Allergy Clin Immunol. 2020 Sep;146(3):595-605. doi: 10.1016/j.jaci.2020.05.032. Epub 2020 Jun 7. Erratum in: J Allergy Clin Immunol. 2021 Jan;147(1):416. PMID: 32524991.
- Han JK, Bachert C, Fokkens W, Desrosiers M, Wagenmann M, Lee SE, Smith SG, Martin N, Mayer B, Yancey SW, Sousa AR, Chan R, Hopkins C; SYNAPSE study investigators. Mepolizumab for chronic rhinosinusitis with nasal polyps (SYNAPSE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2021 Oct;9(10):1141-1153. doi: 10.1016/S2213-2600(21)00097-7. Epub 2021 Apr 16. PMID: 33872587.
- Mullol J, Bachert C, Amin N, Desrosiers M, Hellings PW, Han JK, Jankowski R, Vodicka J, Gevaert P, Daizadeh N, Khan AH, Kamat S, Patel N, Graham NMH, Ruddy M, Staudinger H, Mannent LP. Olfactory Outcomes With Dupilumab in Chronic Rhinosinusitis With Nasal Polyps. J Allergy Clin Immunol Pract. 2022 Apr;10(4):1086-1095.e5. doi: 10.1016/j.jaip.2021.09.037. Epub 2021 Oct 7. PMID: 34628065
- Phillips KM, Hoehle LP, Caradonna DS, Gray ST, Sedaghat AR. Minimal clinically important difference for the 22-item Sinonasal Outcome Test in medically managed patients with chronic rhinosinusitis. Clin Otolaryngol. 2018 Oct;43(5):1328-1334. doi: 10.1111/coa.13177. Epub 2018 Jul 26. PMID: 29953729.
- Startpagina - Biologicals - Richtlijn - Richtlijnendatabase. (z.d.). https://richtlijnendatabase.nl/richtlijn/biologicals/biologicals_-_startpagina.html
- van der Lans RJL, Fokkens WJ, Adriaensen GFJPM, Hoven DR, Drubbel JJ, Reitsma S. Real-life observational cohort verifies high efficacy of dupilumab for chronic rhinosinusitis with nasal polyps. Allergy. 2022 Feb;77(2):670-674. doi: 10.1111/all.15134. Epub 2021 Oct 18. PMID: 34626497; PMCID: PMC9298295
- Wu Q, Zhang Y, Kong W, Wang X, Yuan L, Zheng R, Qiu H, Huang X, Yang Q. Which Is the Best Biologic for Nasal Polyps: Dupilumab, Omalizumab, or Mepolizumab? A Network Meta-Analysis. Int Arch Allergy Immunol. 2022;183(3):279-288. doi: 10.1159/000519228. Epub 2021 Oct 4. PMID: 34607329.
Evidence tabellen
Evidence tables
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What are the benefits and harms of biologicals (monoclonal antibodies) in the treatment of patients with chronic rhinosinusitis?
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: What are the benefits and harms of biologicals (monoclonal antibodies) in the treatment of patients with chronic rhinosinusitis?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Han, 2021
SYNAPSE |
Type of study: randomised, double-blind, placebo-controlled, phase 3 trial
Setting and country: Multicenter trial in 93 centres in 11 countries (Argentina, Australia, Canada, Germany, the Netherlands, South Korea, Romania, Russia, Sweden, the UK, and the USA).
Funding and conflicts of interest: This study was funded by GlaxoSmithKline (GSK ID: 205687; NCT03085797).
JKH has received consultancy fees from Sanofi Genzyme, Regeneron, Genentech, AstraZeneca, GlaxoSmithKline, and Gossamer Bio. CB has participated in advisory boards and received speaker fees from Sanofi, Novartis, AstraZeneca, GlaxoSmithKline, ALK-Abelló, and Meda Pharmaceuticals. WF has received clinical trial funding from Sanofi, Mylan, ALK-Abelló, Allergy Therapeutics, Novartis, and Chordate; and personal fees from Sanofi. MD has received clinical trial funding from AstraZeneca, GlaxoSmithKline, Probionase Therapies, and Sanofi; is an advisory board member for Regeneron Pharmaceuticals and Sanofi; and has equity in Probionase Therapies. MW has received advisory board fees or speaker fees from ALK-Abelló, Allergopharma, AstraZeneca, Bencard Allergie, Genzyme, HAL Allergie, InfectoPharm, LETIPharma, Meda Pharmaceuticals, Novartis, Sanofi,Stallergenes Greer, and Teva. SEL has participated in advisory boards and received clinical trial funding from Sanofi Genzyme, Regeneron, Genentech, AstraZeneca, and GlaxoSmithKline. SGS, NM, BM, SWY, ARS, and RC are employees of GlaxoSmithKline and own company stocks and shares. CH has received advisory board fees from Sanofi, AstraZeneca, Olympus, and Smith and Nephew. |
Inclusion criteria: Eligible patients were aged 18 years or older with recurrent, refractory, severe, bilateral nasal polyp symptoms (nasal obstruction symptom visual analogue scale [VAS] score of >5 [maximum 10]) and were eligible for repeat nasal surgery (overall symptoms VAS score >7 and endoscopic nasal polyps score of ≥5 [maximum 8], with a minimum score of 2 in each nasal cavity), despite standard of care treatment. Patients had to have at least one nasal surgery (defined as any incision [cutting open] of the paranasal sinuses and removal of polyp tissue from the nasal cavity [polypectomy] and the sinuses) in the past 10 years. In addition, patients required stable maintenance therapy with intranasal spray medication (mometasone furoate) for at least 8 weeks before screening, and displayed two or more different symptoms for at least 12 weeks before screening (nasal blockage, obstruction, and congestion, or nasal discharge [anterior or posterior nasal drip]), with one or more of the following symptoms: nasal discharge, facial pain or pressure, and reduction or loss of smell.
Exclusion criteria: Full inclusion and exclusion criteria are provided in the appendix.
N total at baseline: Intervention: 206 Control: 201
Important prognostic factors2: For example Age, mean ± SD: I: 48.6±13.6 C: 48.9±12.5
Sex, % female: I: 67 C: 76
Total endoscopic score (scale 0–8) I: 5.4±1.2 C: 5.6±1.4
Overall VAS symptom scale I: 9.0±0.8 C: 9.1±0.7
Loss of smell VAS score (scale 0–10) I: 9.6±0.8 C: 9.7±0.6
SNOT-22 total score I: 63.7±17.6 C: 64.4±19.0
Patients with asthma I: 68% C: 74%
Groups were comparable at baseline. |
Mepolizumab, 100 mg subcutaneously once every 4 weeks (using a safety syringe), in addition to standard of care for 52 weeks.
N=206 |
Placebo once every 4 weeks (using a safety syringe), in addition to standard of care for 52 weeks.
In line with the European Position Paper on Rhinosinusitis and Nasal Polyps (EPOS) 2020,2 standard of care consisted of daily mometasone furoate intranasal spray throughout the study period, in addition to saline nasal irrigations, and courses of systemic corticosteroids or antibiotics, or both, as required.
N=201 |
Length of follow-up: 52 weeks
Loss-to-follow-up: Intervention: 23 withdrew early from study treatment (8 withdrew from study and 15 continued being assessed)
Control: 34 withdrew early from study treatment (7 withdrew from study and 27 continued being assessed), 1 was lost to follow-up
Incomplete outcome data: Not specified.
|
Health-related quality of life Change from baseline in SNOT-22 total score at week 52 I: -29.4±24.67 C: -15.7±23.93 MD -16.49 [-23.57, 9.43] P=0.0032
Disease severity Change from baseline in composite VAS score during weeks 49–52 I: -3.8±3.19 C: -2.2±2.82 MD -2.68 [-3.44, -1.91] P=0.020
Nasal polyps score Change from baseline in total endoscopic nasal polyp score at week 52 (primary endpoint) mean difference [95% CI] I: -0.9±1.90 C: -0.1±1.46 MD -0.73 [-1.11, 0.34] P<0.0001
Sense of smell/olfactory dysfunction Change from baseline in loss of smell VAS symptom score during weeks 49–52 I: -2.8±3.61 C: -1.4±2.65 MD -0.37 [-0.65, -0.08] P=0.020
Proportion of patients having nasal surgery up to week 52 I: 18/206 (9%) C: 46/201 (23%) RR 0.43 (0.25 to 0.76) p=0·0032
Adverse events Any on-treatment event I: 169/206 (82%) C: 168/201 (84%)
Treatment-related event I: 30/206 (15%) C: 19/201 (9%)
Any on-treatment serious adverse event I: 12/206 (6%) C: 13/201 (6%)
Treatment-related serious adverse event I: 0/206 (0%) C: 1/201 (1%)
Change from baseline in nasal obstruction VAS score During weeks 49–52 (primary endpoint) I: -4.2±3.42 C: -2.5±3.15 MD -3.14 [-4.09, 2.18] P<0.0001
|
Authors’ conclusions: This phase 3 study showed the efficacy of mepolizumab with an acceptable safety profile in adults with severe chronic rhinosinusitis with nasal poly-3.8ps. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Chong, 2021 |
Yes |
Yes |
Yes |
Yes |
N/A |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What are the benefits and harms of biologicals (monoclonal antibodies) in the treatment of patients with chronic rhinosinusitis?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Han, 2021 |
Definitely yes;
Reason: Randomisation was done using an interactive response system. The randomisation sequence was computer generated by sponsor validated software (RandALL NG; version 1.3.3), done separately for each country, using permuted block design of block size 6. |
Definitely yes;
Reason: The allocation sequence was computer generated and investigators were informed of patients’ treatment assignment via an interactive response technology system. |
Definitely yes;
Reason: Mepolizumab and placebo were identical in appearance. Site staff, the central study team, and patients were masked to study treatment and absolute blood eosinophil counts (including white blood cell differentials); masking was maintained for the duration of the trial. |
Definitely yes;
Reason: Loss to follow-up was limited. |
Probably yes;
Reason: All relevant outcomes were reported |
Probably yes;
Reason: No other problems noted |
LOW |
Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location). Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules..
Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments, but this should not affect the risk of bias judgement. Blinding of those assessing and collecting outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment or data collection (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is usually not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary. Finally, data analysts should be blinded to patient assignment to prevents that knowledge of patient assignment influences data analysis.
Lost to follow-up: If the percentage of patients lost to follow-up or the percentage of missing outcome data is large, or differs between treatment groups, or the reasons for loss to follow-up or missing outcome data differ between treatment groups, bias is likely unless the proportion of missing outcomes compared with observed event risk is not enough to have an important impact on the intervention effect estimate or appropriate imputation methods have been used.
Selective outcome reporting: Results of all predefined outcome measures should be reported; if the protocol is available (in publication or trial registry), then outcomes in the protocol and published report can be compared; if not, outcomes listed in the ‘Methods’ section of an article can be compared with those whose results are reported.
Other biases: Problems may include: a potential source of bias related to the specific study design used (e.g. lead-time bias or survivor bias); trial stopped early due to some data-dependent process (including formal stopping rules); relevant baseline imbalance between intervention groups; claims of fraudulent behavior; deviations from intention-to-treat (ITT) analysis; (the role of the) funding body (see also downgrading due to industry funding https://kennisinstituut.viadesk.com/do/document?id=1607796-646f63756d656e74). Note: The principles of an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Overall judgement of risk of bias per study and per outcome measure, including predicted direction of bias (e.g. favors experimental, or favors comparator). Note: the decision to downgrade the certainty of the evidence for a particular outcome measure is taken based on the body of evidence, i.e. considering potential bias and its impact on the certainty of the evidence in all included studies reporting on the outcome.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Agache I, Song Y, Alonso-Coello P, Vogel Y, Rocha C, Solà I, Santero M, Akdis CA, Akdis M, Canonica GW, Chivato T, Del Giacco S, Eiwegger T, Fokkens W, Georgalas C, Gevaert P, Hopkins C, Klimek L, Lund V, Naclerio R, O'Mahony L, Palkonen S, Pfaar O, Schwarze J, Soyka MB, Wang Y, Zhang L, Canelo-Aybar C, Palomares O, Jutel M. Efficacy and safety of treatment with biologicals for severe chronic rhinosinusitis with nasal polyps: A systematic review for the EAACI guidelines. Allergy. 2021 Aug;76(8):2337-2353. doi: 10.1111/all.14809. Epub 2021 Mar 24. PMID: 33683704. |
More recent review used |
|
Aldajani A, Alroqi A, Alromaih S, Aloulah MO, Alsaleh S. Adverse events of biological therapy in chronic rhinosinusitis with nasal polyps: A systematic review. Am J Otolaryngol. 2022 Nov-Dec;43(6):103615. doi: 10.1016/j.amjoto.2022.103615. Epub 2022 Aug 28. PMID: 36057193. |
More complete review used |
|
Bachert C, Hellings PW, Mullol J, Hamilos DL, Gevaert P, Naclerio RM, Joish VN, Chao J, Mannent LP, Amin N, Abbe A, Taniou C, Fan C, Pirozzi G, Graham NMH, Mahajan P, Staudinger H, Khan A. Dupilumab improves health-related quality of life in patients with chronic rhinosinusitis with nasal polyposis. Allergy. 2020 Jan;75(1):148-157. doi: 10.1111/all.13984. Epub 2019 Oct 23. PMID: 31306495. |
Article included in Cochrane review |
|
Bachert C, Sousa AR, Han JK, Schlosser RJ, Sowerby LJ, Hopkins C, Maspero JF, Smith SG, Kante O, Karidi-Andrioti DE, Mayer B, Chan RH, Yancey SW, Chaker AM. Mepolizumab for chronic rhinosinusitis with nasal polyps: Treatment efficacy by comorbidity and blood eosinophil count. J Allergy Clin Immunol. 2022 May;149(5):1711-1721.e6. doi: 10.1016/j.jaci.2021.10.040. Epub 2022 Jan 7. PMID: 35007624. |
Post-hoc analysis of SYNAPSE trial |
|
Bachert C, Zinreich SJ, Hellings PW, Mullol J, Hamilos DL, Gevaert P, Naclerio RM, Amin N, Joish VN, Fan C, Zhang D, Staudinger H, Pirozzi G, Graham NMH, Khan A, Mannent LP. Dupilumab reduces opacification across all sinuses and related symptoms in patients with CRSwNP. Rhinology. 2020 Feb 1;58(1):10-17. doi: 10.4193/Rhin18.282. PMID: 31671432. |
Pre-defined outcomes not reported |
|
Bachert C, Han JK, Desrosiers MY, Gevaert P, Heffler E, Hopkins C, Tversky JR, Barker P, Cohen D, Emson C, Martin UJ, Shih VH, Necander S, Kreindler JL, Jison M, Werkström V. Efficacy and safety of benralizumab in chronic rhinosinusitis with nasal polyps: A randomized, placebo-controlled trial. J Allergy Clin Immunol. 2022 Apr;149(4):1309-1317.e12. doi: 10.1016/j.jaci.2021.08.030. Epub 2021 Sep 29. PMID: 34599979. |
Wrong comparison: Benraluzimab not registered for CRSwNP |
|
Borish L, Cohen NA, Chupp G, Hopkins C, Wagenmann M, Sousa AR, Smith SG, Silver J, Yang S, Mayer B, Yancey SW, Chan RH, Fokkens W. Evaluating enrollment and outcome criteria in trials of biologics for chronic rhinosinusitis with nasal polyps. Ann Allergy Asthma Immunol. 2022 Aug;129(2):160-168. doi: 10.1016/j.anai.2022.04.004. Epub 2022 Apr 8. PMID: 35398492. |
Wrong study design |
|
Chong LY, Piromchai P, Sharp S, Snidvongs K, Philpott C, Hopkins C, Burton MJ. Biologics for chronic rhinosinusitis. Cochrane Database Syst Rev. 2020 Feb 27;2(2):CD013513. doi: 10.1002/14651858.CD013513.pub2. Update in: Cochrane Database Syst Rev. 2021 Mar 12;3:CD013513. PMID: 32102112; PMCID: PMC7043934. |
More recent review used |
|
Damask C, Chen M, Holweg CTJ, Yoo B, Millette LA, Franzese C. Defining the Efficacy of Omalizumab in Nasal Polyposis: A POLYP 1 and POLYP 2 Subgroup Analysis. Am J Rhinol Allergy. 2022 Jan;36(1):135-141. doi: 10.1177/19458924211030486. Epub 2021 Aug 12. PMID: 34382434. |
Wrong study design |
|
Fujieda S, Matsune S, Takeno S, Asako M, Takeuchi M, Fujita H, Takahashi Y, Amin N, Deniz Y, Rowe P, Mannent L. The Effect of Dupilumab on Intractable Chronic Rhinosinusitis with Nasal Polyps in Japan. Laryngoscope. 2021 Jun;131(6):E1770-E1777. doi: 10.1002/lary.29230. Epub 2020 Nov 23. PMID: 33226139; PMCID: PMC8247406. |
post-hoc analysis of SINUS-52 |
|
Fujieda S, Matsune S, Takeno S, Ohta N, Asako M, Bachert C, Inoue T, Takahashi Y, Fujita H, Deniz Y, Rowe P, Ortiz B, Li Y, Mannent LP. Dupilumab efficacy in chronic rhinosinusitis with nasal polyps from SINUS-52 is unaffected by eosinophilic status. Allergy. 2022 Jan;77(1):186-196. doi: 10.1111/all.14906. Epub 2021 Jun 4. PMID: 33993501; PMCID: PMC9290136. |
Post-hoc analysis of SINUS-52 trial |
|
Gevaert P, Omachi TA, Corren J, Mullol J, Han J, Lee SE, Kaufman D, Ligueros-Saylan M, Howard M, Zhu R, Owen R, Wong K, Islam L, Bachert C. Efficacy and safety of omalizumab in nasal polyposis: 2 randomized phase 3 trials. J Allergy Clin Immunol. 2020 Sep;146(3):595-605. doi: 10.1016/j.jaci.2020.05.032. Epub 2020 Jun 7. Erratum in: J Allergy Clin Immunol. 2021 Jan;147(1):416. PMID: 32524991. |
More complete review used |
|
Hopkins C, Wagenmann M, Bachert C, Desrosiers M, Han JK, Hellings PW, Lee SE, Msihid J, Radwan A, Rowe P, Amin N, Deniz Y, Ortiz B, Mannent LP, Rout R. Efficacy of dupilumab in patients with a history of prior sinus surgery for chronic rhinosinusitis with nasal polyps. Int Forum Allergy Rhinol. 2021 Jul;11(7):1087-1101. doi: 10.1002/alr.22780. Epub 2021 Feb 21. PMID: 33611847; PMCID: PMC8359289. |
post-hoc analysis of SINUS-24/SINUS-52 |
|
Iqbal IZ, Kao SS, Ooi EH. The role of biologics in chronic rhinosinusitis: a systematic review. Int Forum Allergy Rhinol. 2020 Feb;10(2):165-174. doi: 10.1002/alr.22473. Epub 2019 Dec 23. PMID: 31869863. |
More recent review used |
|
Shen Y, Ke X, Hong S, Yang Y. Adverse events for biologics in patients with CRSwNP: A meta-analysis. Clin Transl Allergy. 2022 Jun 15;12(6):e12169. doi: 10.1002/clt2.12169. PMID: 35734272; PMCID: PMC9198683. |
More complete review used |
|
Takabayashi T, Asaka D, Okamoto Y, Himi T, Haruna S, Yoshida N, Kondo K, Yoshikawa M, Sakuma Y, Shibata K, Suzuki M, Kobayashi M, Kawata R, Tsuzuki K, Okano M, Higaki T, Takeno S, Kodama S, Yonekura S, Saito H, Nozaki A, Otori N, Fujieda S. A Phase II, Multicenter, Randomized, Placebo-Controlled Study of Benralizumab, a Humanized Anti-IL-5R Alpha Monoclonal Antibody, in Patients With Eosinophilic Chronic Rhinosinusitis. Am J Rhinol Allergy. 2021 Nov;35(6):861-870. doi: 10.1177/19458924211009429. Epub 2021 Apr 11. PMID: 33840229. |
Article included in Cochrane review |
|
Tsetsos N, Markou K, Konstantinidis I. Effect of monoclonal antibodies on olfactory dysfunction caused by chronic rhinosinusitis with nasal polyps: a systematic review and meta-analysis. Int Forum Allergy Rhinol. 2020 Jul;10(7):893-900. doi: 10.1002/alr.22576. Epub 2020 May 29. PMID: 32250544. |
More complete review used |
|
Tversky J, Lane AP, Azar A. Benralizumab effect on severe chronic rhinosinusitis with nasal polyps (CRSwNP): A randomized double-blind placebo-controlled trial. Clin Exp Allergy. 2021 Jun;51(6):836-844. doi: 10.1111/cea.13852. Epub 2021 Feb 27. PMID: 33595845. |
Article included in Cochrane review |
|
Wang Q, Sun Q, Chen Q, Li H, Liu D, Wu Q. Efficacy and Safety of Anti-Interleukin-5 Therapies in Chronic Rhinosinusitis with Nasal Polyps: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Int Arch Allergy Immunol. 2022;183(7):732-743. doi: 10.1159/000521859. Epub 2022 Feb 2. PMID: 35108711. |
More complete review used |
|
Wu Q, Yuan L, Qiu H, Wang X, Huang X, Zheng R, Yang Q. Efficacy and safety of omalizumab in chronic rhinosinusitis with nasal polyps: a systematic review and meta-analysis of randomised controlled trials. BMJ Open. 2021 Sep 3;11(9):e047344. doi: 10.1136/bmjopen-2020-047344. PMID: 34479933; PMCID: PMC8420736. |
More recent review used |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-09-2023
Beoordeeld op geldigheid : 07-09-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met chronische rhinosinusitis met/zonder neuspoliepen.
Werkgroep
- Dr. R. van Weissenbruch, KNO-arts, Wilhelmina Ziekenhuis Assen, Assen, NVKNO
- Dr. S. Reitsma, KNO-arts, Amsterdam Universitair Medisch Centrum, Amsterdam, NVKNO
- Drs. D.F. Eijkenboom, KNO-arts, Antonius Ziekenhuis, Sneek, NVKNO
- Drs. G.E. Joustra, AIOS, Universitair Medisch Centrum Groningen, Groningen, NVKNO
- Dr. G.J. Braunstahl, longarts, Franciscus Gasthuis, Rotterdam, NVALT
- Dr. M.B. Ekkelenkamp, arts-microbioloog, Universitair Medisch Centrum Utrecht, Utrecht, NVMM
- Drs. J. Vister, radioloog, Universitair Medisch Centrum Groningen, Groningen, NVvR
- Dhr. T. Jonkergouw, adviseur patiëntenbelang, Patiëntenfederatie Nederland (tot maart 2023)
- Mevr. M. Broere, adviseur patiëntenbelang, Patiëntenfederatie Nederland (vanaf maart 2023)
- Mevr. K.M. Jaarsma-Osseweijer, voorzitter Reuksmaakstoornis.nl
Met ondersteuning van
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. B.L. Gal-de Geest, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van Weissenbruch |
KNO-arts Wilhelmina Ziekenhuis Assen |
Geen voor CRS 2018-2019 bij en nascholing voor huisartsen en KNO-artsen voor ALK en Sanofi College en algemene KNO |
Geen |
Geen restricties. |
|
Braunstahl |
Longarts, Franciscus Gasthuis & Vlietland Rotterdam |
Nul-aanstelling ErasmusMC voor onderzoek: onbetaald |
Vergoeding: Presentaties en incidenteel advieswerk voor Boehringer Ingelheim, Sanofi, Novartis, GSK, AstraZeneca, ALK, MEDA en Chiesi. Onderwerp relevant voor de richtlijn is behandeling met biologicals.
Deelname richtlijn ernstige astma. Deelname klankbordgroep van het project ‘Obesitas volwassenen’
Geen vergoeding: Redactie NTvAAKI Bestuur RoLeX astma/COPD nascholingen Bestuur Rapsodi, ernstig astma database NL Voorzitter astmasectie NVALT Wetenschappelijke adviescommissie Longfonds |
Geen advieswerk voor industrie op gebied van CRS gedurende de looptijd van de richtlijn, restricties ten aanzien van besluitvorming voor module(s) over behandeling met biologicals. |
|
Ekkelenkamp |
Arts-microbioloog, UMC Utrecht |
Schrijver / columinst als ZZP’er, betaald |
Geen |
Geen restricties. |
|
Reitsma |
KNO-arts/rhinoloog, Amsterdam UMC |
Lid medische adviesraad patiëntenvereniging CRSwNP (crs-np.nl) onbetaald Lid bestuur stichting AERO (stichtinggaero.org) onbetaald |
Op incidentele basis de afgelopen 36 maanden: betaald adviseurschap voor Sanofi betaald adviseurschap voor Novartis. Onderwerp relevant voor de richtlijn is behandeling met biologicals. Op de afdeling KNO van het Amsterdam UMC, locatie AMC, wordt onderzoek verricht dat mede gefinancierd is met gelden van ZonMw, Mylan, Chordate Medical Systems, ALK, Allergy diagnostics, Sanofi, Novartis, GSK. Op ten minste 1 daarvan ben ik PI. Onderwerp relevant voor de richtlijn is behandeling met biologicals. Boegbeeldfunctie binnen de Nederlandse KNO-vereniging gezien voorzitterschap van de kerngroep Rhinologie
Lid van rhinologie-team Amsterdam UMC, locatie AMC, waar bijzondere/unieke expertise in behandeling van CRS patiënten is, in het bijzonder met het oog op biologicals; dit centrum heeft een landelijke tertiaire functie
Lid stuurgroep herziening Europese richtlijn voor CRS (EPOS; zie epos2020.com) waarin nieuwe theoretische concepten worden neergelegd |
Geen advieswerk voor industrie op gebied van CRS gedurende de looptijd van de richtlijn, restricties ten aanzien van besluitvorming voor module(s) over behandeling met biologicals. |
|
Eijkenboom |
KNO-arts Antonius ziekenhuis Sneek + Emmeloord |
Geen |
Deelname aan IPAS studie (ALICE) de afdeling KNO in het Antonius Ziekenhuis Sneek participeert sinds kort in de IPAS studie van ALK. IPAS staat voor "Itulazax Post-Authorisation Study". Het is een fase IV studie waarbij nog uitvoeriger gekeken wordt naar de bijwerkingen van een al in de normale praktijk voor te schrijven medicijn. Het betreft waarschijnlijk kleine patiënten aantallen (<10 in 2 jaar) met daarbij een beperkte vergoeding per patiënt. Safety studie. Geen PI. |
Geen restricties. |
|
Joustra |
Arts-assistent / promovendus KNO UMCG |
Geen |
Geen |
Geen restricties. |
|
Vister |
Neuro- en Hoofhalsradioloog UMCG |
Geen |
Geen |
Geen restricties. |
|
Jonkergouw |
Junior adviseur patiëntbelang bij Patiëntenfederatie Nederland |
Geen |
Geen |
Geen restricties. |
|
Jaarsma |
Voorzitter van de vereniging Reuksmaakstoornis |
project fondsenwerver stichting Fier (Betaald) Wethouder gemeente Krimpen aan den IJssel (betaald) |
Geen |
Geen restricties. |
|
Gal-de Geest |
Adviseur bij Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties. |
|
Ruiter |
Adviseur bij Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland en patiëntenorganisatie CRS voor de schriftelijke knelpuntenanalyse en deelname van de Patiëntenfederatie Nederland en Reuksmaakstoornis.nl aan de werkgroep.
De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en Reuksmaakstoornis.nl en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Implementatie
Wet kwaliteit, klachten en geschillen zorg (Wkkgz) & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wkkgz een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Kwantificeren van nasendoscopische beelden |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, en het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Beeldvorming bij CRS |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Diagnostiek onderste luchtwegen bij CRS |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Behandeling onderste luchtwegen bij CRS |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Langdurige antibiotica bij CRS |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Systemische corticosteroïden bij CRS |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Biologicals |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Chirurgie bij CRS |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Postoperatief corticosteroïdenimplantaat |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Ballondilatatie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Organisatie van zorg |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft]. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met chronische rhinosinusitis met/zonder neuspoliepen. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVKNO, 2009) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door ZKN, het Longfonds, de NVvR en de NVKNO via enquête. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten, welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor het zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder ‘Onderbouwing’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek, spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen, moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs, ook andere aspecten belangrijk en worden meegewogen. Dit kunnen aanvullende argumenten zijn uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg. Hieronder vallen alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg, zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur. Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/uploaded/docs/Medisch_specialistische_richtlijnen_2-0_-_tot_2023_-_verouderd.pdf?u=1aYjPr
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Zoekverantwoording
Algemene informatie
|
Cluster/richtlijn: Chronische rhinosinusitis en neuspoliepen |
|
|
Uitgangsvraag/modules: Wat is de plaats van biologicals in de behandeling van patiënten met CRS? |
|
|
Database(s): Ovid/Medline, Embase.com |
Datum: 10-10-2022 |
|
Periode: 2020 - heden |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Miriam van der Maten |
|
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen:
|
|
|
|
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
137 |
56 |
149 |
|
RCT |
95 |
61 |
111 |
|
Totaal |
232 |
117 |
260 |
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#10 |
#8 OR #9 |
232 |
|
#9 |
#5 AND #7 NOT #8 = RCT |
95 |
|
#8 |
#5 AND #6 = SR |
137 |
|
#7 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1968123 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
865124 |
|
#5 |
#3 AND #4 AND ([english]/lim OR [dutch]/lim) AND [2020-2022]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1492 |
|
#4 |
'biological factor'/exp OR 'biological product'/exp OR 'monoclonal antibody'/exp OR 'antiidiotypic antibody'/exp OR 'immunoglobulin e'/exp OR 'interleukin derivative'/exp OR 'interleukin receptor'/exp OR 'chemokine receptor ccr4 antagonist'/exp OR 'cytokine'/exp OR 'cytokine receptor antagonist'/exp OR biologicals:ti,ab,kw OR biologics:ti,ab,kw OR ((biologic* NEAR/3 (process* OR product* OR factor* OR treatment* OR therap*)):ti,ab,kw) OR 'monoclonal antibod*':ti,ab,kw OR 'dupilumab'/exp OR 'dupilumab':ti,ab,kw OR 'dupixent':ti,ab,kw OR 'regn 668':ti,ab,kw OR 'regn668':ti,ab,kw OR 'sar 231893':ti,ab,kw OR 'sar231893':ti,ab,kw OR 'mepolizumab'/exp OR 'bosatria':ti,ab,kw OR 'mepolizumab':ti,ab,kw OR 'nucala':ti,ab,kw OR 'sb 240563':ti,ab,kw OR 'sb-240563':ti,ab,kw OR 'sb240563':ti,ab,kw OR 'omalizumab'/exp OR 'fb 317':ti,ab,kw OR 'fb317':ti,ab,kw OR 'gbr 310':ti,ab,kw OR 'gbr310':ti,ab,kw OR 'hu 901':ti,ab,kw OR 'hu901':ti,ab,kw OR 'monoclonal antibody e 25':ti,ab,kw OR 'monoclonal antibody e25':ti,ab,kw OR 'olizumab':ti,ab,kw OR 'omalizumab':ti,ab,kw OR 'rg 3648':ti,ab,kw OR 'rg3648':ti,ab,kw OR 'rhumab 25':ti,ab,kw OR 'rhumab e25':ti,ab,kw OR 'sti 004':ti,ab,kw OR 'sti004':ti,ab,kw OR 'syn 008':ti,ab,kw OR 'syn008':ti,ab,kw OR 'xolair':ti,ab,kw |
4791211 |
|
#3 |
#1 OR #2 |
35900 |
|
#2 |
'chronic rhinosinusitis'/exp OR 'chronic rhinitis'/exp OR 'chronic sinusitis'/exp OR (('rhinosinusitis'/mj OR 'sinusitis'/mj OR 'rhinitis'/mj) AND 'chronic disease'/exp) OR ((chronic* NEAR/2 (sinusit* OR rhinit* OR rhinosinusit*)):ti,ab,kw) |
22444 |
|
#1 |
('nose polyp'/exp OR (((nose OR nasal OR nasi OR rhino* OR sinus* OR sinonasal) NEAR/3 (papilloma* OR polyp*)):ti,ab,kw) OR rhinopolyp*:ti,ab,kw OR crswnp*:ti,ab,kw OR crssnp*:ti,ab,kw OR ecrs:ti,ab,kw OR (crs:ti,ab,kw AND (sinonas* OR nasal OR naso* OR rhin* OR ent)) OR ((kartagener* NEAR/2 syndrom*):ti,ab,kw) OR 'primary ciliary dyskinesi*':ti,ab,kw) NOT ((copd:ti OR thoracic:ti OR pulmonary:ti) AND disease:ti OR bronchiectas*:ti) |
23660 |
Ovid/Medline
|
# |
Searches |
Results |
|
11 |
9 or 10 |
117 |
|
10 |
(6 and 8) not 9 = RCT |
61 |
|
9 |
6 and 7 = SR |
56 |
|
8 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1551473 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
622036 |
|
6 |
limit 5 to yr="2020 -Current" |
749 |
|
5 |
3 and 4 |
3109 |
|
4 |
exp Antibodies, Monoclonal/ or exp Immunoglobulin E/ or exp INTERLEUKINS/ or exp Receptors, Interleukin/ or exp Biological Therapy/ or exp Cytokines/ or biologicals.ti,ab,kf. or biologics.ti,ab,kf. or (biologic* adj3 (process* or product* or factor* or treatment* or therap*)).ti,ab,kf. or 'monoclonal antibod*'.ti,ab,kf. or 'dupilumab'.ti,ab,kf. or 'dupixent'.ti,ab,kf. or 'regn 668'.ti,ab,kf. or 'regn668'.ti,ab,kf. or 'sar 231893'.ti,ab,kf. or 'sar231893'.ti,ab,kf. or 'bosatria'.ti,ab,kf. or 'mepolizumab'.ti,ab,kf. or 'nucala'.ti,ab,kf. or 'sb 240563'.ti,ab,kf. or 'sb-240563'.ti,ab,kf. or 'sb240563'.ti,ab,kf. or exp Omalizumab/ or 'fb 317'.ti,ab,kf. or 'fb317'.ti,ab,kf. or 'gbr 310'.ti,ab,kf. or 'gbr310'.ti,ab,kf. or 'hu 901'.ti,ab,kf. or 'hu901'.ti,ab,kf. or 'monoclonal antibody e 25'.ti,ab,kf. or 'monoclonal antibody e25'.ti,ab,kf. or 'olizumab'.ti,ab,kf. or 'omalizumab'.ti,ab,kf. or 'rg 3648'.ti,ab,kf. or 'rg3648'.ti,ab,kf. or 'rhumab 25'.ti,ab,kf. or 'rhumab e25'.ti,ab,kf. or 'sti 004'.ti,ab,kf. or 'sti004'.ti,ab,kf. or 'syn 008'.ti,ab,kf. or 'syn008'.ti,ab,kf. or 'xolair'.ti,ab,kf. |
1917700 |
|
3 |
1 or 2 |
25784 |
|
2 |
((nasal polyps/ or ((nose or nasal or nasi or rhino* or sinus* or sinonasal) adj3 (papilloma* or polyp*)).tw,kf. or (rhinopolyp* or CRSwNP*).tw,kf. or CRSSNP*.tw,kf. or ECRS.tw,kf. or (CRS.tw,kf. and (sinonas* or nasal or naso* or rhin* or ENT).mp.) or (kartagener* syndrom* or primary ciliary dyskinesi*).mp.) not (COPD or thoracic or pulmonary disease or bronchiectas*).ti,ot.) or adenoids/ab or (adenoids/ and hypertrophy/) or ((adenoid* adj2 (hypertroph* or obstruct*)) or adenoidit*).tw,kf. |
18480 |
|
1 |
((Sinusitis/ or Rhinitis/) and Chronic Disease/) or (chronic* adj3 (sinusit* or rhinosinusit*)).ti,ab,kf. |
14530 |
