Medicamenteuze behandeling bij chronische bekkenpijn
Uitgangsvraag
Wat is de plaats van medicamenteuze behandeling bij patiënten met chronische bekkenpijn?
Aanbeveling
Bespreek vooraf de mogelijke bijwerkingen van een medicamenteuze behandeling van chronische bekkenpijn met de patiënt, kom gezamenlijk tot een besluit en documenteer dit.
Overweeg om bij patiënten met blaaspijnsyndroom te starten met amitriptyline in een dosis van 25 mg voor de nacht indien er geen contra-indicatie is. Verhoog de dosis met 25 mg per 2 weken tot een maximale dosis van 100 mg per dag.
Overweeg bij mannen met chronische bekkenpijn en mictieklachten behandeling van de pijn met een alfablokker. Evalueer het effect van deze behandeling na 3 maanden.
Overweeg een behandeling met progesteron bij vrouwen met chronische bekkenpijn alleen in overleg met een ervaren gynaecoloog werkzaam in een expertisecentrum.
Overweeg binnen een multimodale behandeling door een bekkenpijnteam een behandeling met gabapentine bij mannen en vrouwen met chronische bekkenpijn.
Behandel mannen en vrouwen met chronische bekkenpijn niet met antibiotica.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor alle hieronder genoemde medicamenteuze behandelingen geldt dat, wanneer een dergelijke behandeling wordt overwogen, de mogelijke bijwerkingen vooraf met de patiënt moeten worden besproken. Kom vervolgens gezamenlijk tot een besluit en documenteer dit.
Alfablokkers
Op basis van de beschikbare literatuur lijkt een behandeling met alfablokkers bij mannen met chronisch bekkenpijn de pijnintensiteit enigszins te kunnen verminderen vergeleken met placebo. De pathofysiologische rationale achter het effect van alfablokkers is dat het de gladde spieren van de urethraprostatica ontspant en daarmee een reductie van klachten geeft bij aanwezigheid van LUTS (lower urinary tract symptoms). Er werden geen studies geïncludeerd waarin het effect van alfablokkers bij vrouwen werd onderzocht.
De bewijskracht voor deze uitkomstmaat pijn is gegradeerd als ‘laag’, vanwege mogelijk risk of bias in de studies en imprecisie (overlap grens klinische besluitvorming). Voor de belangrijke uitkomstmaat kwaliteit van leven is het op basis van de literatuur onduidelijk wat het effect is van alfablokkers. Voor deze uitkomstmaat moest bij de GRADE-beoordeling een extra niveau worden afgetrokken vanwege inconsistentie in uitkomst tussen studies. Het is onbekend wat het effect van alfablokkers is bij mannen met chronische bekkenpijn voor de belangrijke uitkomstmaten patiënttevredenheid en complicaties, omdat deze uitkomstmaten niet gerapporteerd worden in de geïncludeerde studies.
De overall bewijskracht is gelijk aan de laagste gevonden bewijskracht voor de cruciale uitkomstmaat pijnintensiteit, dus is voor alfablokkers ‘laag’.
Bij mannen met chronische bekkenpijn kan een alfablokker de pijn verlichten. Advies is het effect van de behandeling na 3 maanden te evalueren. Bij vrouwen is hier geen enkel bewijs voor.
Antibiotica
Op basis van de beschikbare literatuur is het onduidelijk wat het effect van een behandeling met antibiotica op de cruciale uitkomstmaat pijnintensiteit en de belangrijke uitkomstmaten complicaties, patiënttevredenheid en kwaliteit van leven is. De geïncludeerde studies lieten geen significant effect zien op pijnintensiteit en kwaliteit van leven. Het vertrouwen in de conclusie is echter gegradeerd met een GRADE ‘zeer laag’, vanwege mogelijke risk of bias in de studies, tegenstrijdige resultaten en imprecisie.
De overall bewijskracht is gelijk aan de laagste gevonden bewijskracht voor de cruciale uitkomstmaat pijnintensiteit, dus is voor antibiotica ‘zeer laag’.
Concluderend lijkt antibiotica geen plaats te hebben in de behandeling van mannen met chronisch bekkenpijn. Voor vrouwen is dit niet onderzocht.
Progesteron
Op basis van de beschikbare literatuur lijkt een behandeling met progesteron de pijnintensiteit waarschijnlijk te kunnen verminderen vergeleken met placebo bij vrouwen met chronische bekkenpijn. Wel heeft een behandeling met progesteron waarschijnlijk nadelige effecten zoals gewichtstoename en een opgeblazen gevoel bij patiënten met chronische bekkenpijn. Andere bekende bijwerkingen van progesteron, zoals stemmingsklachten, werden niet beschreven in de geïncludeerde studies, maar staan wel vermeld in het Farmacotherapeutisch Kompas. De bewijskracht voor de uitkomstmaten pijnintensiteit en complicaties is gegradeerd als ‘redelijk, vanwege mogelijk risk of bias in de studies. Het is onbekend wat het effect van progesteron is bij patiënten met chronische bekkenpijn voor de belangrijke uitkomstmaten patiënttevredenheid en kwaliteit van leven, omdat deze uitkomstmaten niet gerapporteerd worden in de geïncludeerde studies.
De overall bewijskracht is gelijk aan de laagste gevonden bewijskracht voor de cruciale uitkomstmaat pijnintensiteit, dus is voor progesteron ‘redelijk’.
In de Nederlandse praktijk is weinig ervaring met behandeling met progesteron bij chronische bekkenpijn (wanneer endometriose is uitgesloten). Vanwege de nadelige effecten (zie ook het Farmacotherapeutisch Kompas) is het raadzaam, indien behandeling wordt overwogen, dit is samenspraak te doen met een gynaecoloog met expertise.
Amitriptyline
Op basis van de beschikbare literatuur lijkt een behandeling met amitriptyline de pijnintensiteit sterk te kunnen verminderen en de patiënttevredenheid te kunnen verbeteren bij patiënten met interstitiële cystitis, hierna: blaaspijnsyndroom. Daarnaast lijkt deze behandeling niet geassocieerd te zijn met ernstige complicaties, de meest gerapporteerde complicatie was een droge mond. De bewijskracht voor de uitkomstmaten pijnintensiteit, patiënttevredenheid en complicaties is gegradeerd als ‘redelijk’, vanwege mogelijk risk of bias in de studies. Het is onbekend wat het effect van amitriptyline is bij patiënten met chronische bekkenpijn voor de belangrijke uitkomstmaat kwaliteit van leven, omdat deze uitkomstmaat niet gerapporteerd werd in de geïncludeerde studies.
De overall bewijskracht is gelijk aan de laagste gevonden bewijskracht voor de cruciale uitkomstmaat pijnintensiteit, dus is voor amitriptyline ‘redelijk’.
Bekend is dat amitriptyline een gunstig effect kan hebben op neuropatische pijn, maar ook op de mictiefrequentie en slaappatroon (Fall, 2008). Het is van belang bij patiënten met blaaspijnsyndroom om met een lage dosis te starten (25 mg) en die langzaam op te hogen tot een maximale dosis van 100 mg voor de nacht. Vaak zullen de bijwerkingen de maximaal getolereerde dosis bepalen.
Gabapentine
Op basis van de beschikbare literatuur is het onduidelijk wat het effect van een behandeling met gabapentine op de cruciale uitkomstmaat pijnintensiteit is. Eén studie liet een statistisch significante verbetering in pijnscore zien na behandeling met gabapentine vergeleken met amitriptyline, en 1 studie liet een effect zien op 1 van de meegenomen vragenlijsten voor pijn (BPI), maar niet op de VAS-score. Het vertrouwen in de conclusie is gegradeerd met een GRADE ‘zeer laag’, vanwege mogelijke risk of bias in de studie en imprecisie.
De overall bewijskracht is gelijk aan de laagste gevonden bewijskracht voor de cruciale uitkomstmaat pijnintensiteit, dus is voor gabapentine ‘zeer laag’.
Op basis van expert opinion en ervaring kan worden overwogen om, binnen een multimodale behandeling door een bekkenpijnteam en in samenspraak met de patiënt, waarbij de mogelijke bijwerkingen worden besproken, gabapentine te geven aan patiënten met chronische bekkenpijn.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De medicamenteuze behandeling van pijn en pijn gerelateerde symptomen zoals LUTS heeft een belangrijke basis in de multimodale en multidisciplinaire behandeling van chronische bekkenpijn. De compliantie zal afhangen van effect en bijwerkingen. Een en ander is ook afhankelijk van de kwaliteit van counseling. Het is belangrijk de mogelijke bijwerkingen en complicaties van een medicamenteuze behandeling te bespreken met de patiënt.
Kosten (middelenbeslag)
Het is onbekend wat de kosteneffectiviteit van een medicamenteuze behandeling van patiënten met chronische bekkenpijn is.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn geen zaken ten aanzien van de aanvaardbaarheid, haalbaarheid en implementatie van de medicamenteuze behandeling van patiënten met chronische bekkenpijn bekend.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de resultaten van de literatuuranalyse en expert opinion kunnen de volgende aanbevelingen worden gedaan met betrekking tot de specifieke medicamenteuze therapie te verlichting van de pijn bij chronische bekkenpijn.
Onderbouwing
Achtergrond
De diagnose 'chronische bekkenpijn' is een diagnose die gesteld wordt bij vrouwen en mannen die langdurig (langer dan 6 maanden) klachten hebben in de bekkenregio. Omdat het mechanisme achter de chronische bekkenpijn nociceptief of neuropathisch kan zijn, dan wel door centrale sensitisatie kan optreden, is het waarschijnlijk dat er verschillende aangrijpingspunten zijn voor een medicamenteuze behandeling. Naast het achterliggende mechanisme van pijn zijn er vaak bijkomende symptomen die ook medicamenteus behandeld zouden kunnen worden en die een relatie hebben met de pijn. In deze module gaat het juist om de behandeling van deze bijkomende symptomen. Voor specifieke pijnbehandelingen verwijzen we naar betreffende richtlijnen. Medicamenteuze behandeling van chronische bekkenpijn kan binnen een multimodale behandeling van chronische bekkenpijn passen met vaak een vorm van combinatietherapie.
Conclusies / Summary of Findings
Alfablokkers
|
Laag GRADE |
Een behandeling met alfablokkers bij mannen met chronische bekkenpijn lijkt de pijnintensiteit enigszins te kunnen verminderen vergeleken met placebo.
Bronnen: (Anothaisintawee, 2011) |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van alfablokkers op kwaliteit van leven bij patiënten met mannen met chronische bekkenpijn is.
Bronnen: (Anothaisintawee, 2011) |
|
- GRADE |
Het is onbekend wat het effect van alfablokkers bij patiënten met chronische bekkenpijn is op de uitkomstmaten patiënttevredenheid en complicaties. Er werden geen studies gevonden waarin deze uitkomstmaten werden vergeleken tussen patiënten die behandeling met alfablokkers ondergingen en een placebo/TCA/eenvoudige pijnstillers behandeling. |
Antibiotica
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van antibiotica op pijnintensiteit bij patiënten met chronische bekkenpijn is.
Bronnen: (Anothaisintawee, 2011) |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van antibiotica op kwaliteit van leven bij patiënten met chronische bekkenpijn is.
Bronnen: (Anothaisintawee, 2011) |
|
- GRADE |
Het is onbekend wat het effect van antibiotica bij patiënten met chronische bekkenpijn is op de uitkomstmaten patiënttevredenheid en complicaties. Er werden geen studies gevonden waarin deze uitkomstmaten werden vergeleken tussen patiënten die behandeling met antibiotica ondergingen en een placebo/TCA/eenvoudige pijnstillers behandeling. |
Progesteron
|
Redelijk GRADE |
Een behandeling met progesteron vermindert waarschijnlijk de pijnintensiteit bij vrouwen met chronische bekkenpijn.
Bronnen: (Cheong, 2014) |
|
Redelijk GRADE |
Een behandeling met progesteron heeft waarschijnlijk nadelige effecten zoals gewichtstoename en een opgeblazen gevoel bij vrouwen met chronische bekkenpijn.
Bronnen: (Cheong, 2014) |
|
- GRADE |
Het is onbekend wat het effect van progesteron bij patiënten met chronische bekkenpijn is op de uitkomstmaten patiënttevredenheid en kwaliteit van leven. Er werden geen studies gevonden waarin deze uitkomstmaten werden vergeleken tussen patiënten die behandeling met progesteron ondergingen en een placebo/TCA/eenvoudige pijnstillers behandeling. |
Amitriptyline
|
Redelijk GRADE |
Een behandeling met amitriptyline leidt waarschijnlijk tot een sterke vermindering van de pijnintensiteit bij patiënten met interstitiële cystitis.
Bronnen: (van Ophoven, 2004) |
|
Redelijk GRADE |
Een behandeling met amitriptyline leidt waarschijnlijk tot en sterke verbetering van de patiënttevredenheid bij patiënten met interstitiële cystitis.
Bronnen: (van Ophoven, 2004) |
|
Redelijk GRADE |
Een behandeling met amitriptyline leidt waarschijnlijk niet tot ernstige complicaties bij patiënten met interstitiële cystitis. Er werden geen complicaties gerapporteerd met een GRADE 3 of hoger op basis van de Common Toxicity Criteria. De meest gerapporteerde complicatie van een behandeling met amitriptyline was een droge mond. |
|
- GRADE |
Het is onbekend wat het effect van amitriptyline bij patiënten met interstitiële cystitis is op de uitkomstmaat kwaliteit van leven. Er werden geen studies gevonden waarin deze uitkomstmaat werd vergeleken tussen patiënten die behandeling met amitriptyline ondergingen. |
Gabapentine
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van gabapentine op pijnintensiteit bij patiënten met chronische bekkenpijn is.
Bronnen: (Cheong, 2014; Lewis, 2015) |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van gabapentine op complicaties bij patiënten met chronische bekkenpijn is.
Bronnen: (Lewis, 2015) |
|
- GRADE |
Het is onbekend wat het effect van gabapentine bij patiënten met chronische bekkenpijn is op de uitkomstmaten patiënttevredenheid en kwaliteit van leven. Er werden geen studies gevonden waarin deze uitkomstmaten werden vergeleken tussen patiënten die behandeling met gabapentine ondergingen en een placebo/TCA/eenvoudige pijnstillers behandeling. |
Overige medicatie
|
- GRADE |
Het is onbekend wat het effect van SSRI, pregabaline, opiaten, opioïd receptor antagonisten (low dose naltrexone), s-ketamine of tapentadol bij patiënten met chronische bekkenpijn is op de uitkomstmaten pijnintensiteit, patiënttevredenheid, complicaties en kwaliteit van leven. Er werden geen studies gevonden waarin deze uitkomstmaten werden bestudeerd bij patiënten met chronische bekkenpijn. |
Samenvatting literatuur
Beschrijving studies
Anothaisintawee (2011) verrichtte een systematische review met netwerk meta-analyse naar de effectiviteit van verschillende therapieën bij mannen met chronische bekkenpijn en vergeleek de uitkomsten van alfablokkers, antibiotica, anti-inflammatoire medicatie, andere actieve medicatie en placebo met elkaar. Op 16 november 2010 werd gezocht in Medline (vanaf 1949) en Embase (vanaf 1974) naar RCT’s bij patiënten met chronische bekkenpijn waarbij een set van de volgende interventies met elkaar werden vergeleken: alfa-blokkers, antibiotica, steroïde en niet-steroïde anti-inflammatoire medicatie, finasteride, glycosminoglycans, phytotherapie en placebo. Als uitkomsten werden onder andere pijn scores en kwaliteit van leven scores meegenomen. Twintig RCT’s vergeleken 1 actieve behandeling met placebo, waarbij alpha-blockers werden onderzocht in 7 studies, waarvan 5 studies 1 of meerdere uitkomsten van interesse meenamen (Nickel, 2008; Tugcu, 2007; Cheah, 2003; Evliyaoglu, 2002; Gül, 2001) en antibiotica in 2 studies (Nickel, 2003; Zhou, 2008). Ook kon 1 studie worden meegenomen die alfablokkers plus antibiotica vergeleek met alfablokkers alleen, antibiotica alleen en placebo (Alexander, 2004). De overige studies onderzochten phytotherapie, en werden niet meegenomen in voorliggende literatuuranalyse. In de geïncludeerde studies varieerde de behandelingsduur tussen 6 en 24 weken en de leeftijd tussen 29,1 en 56,1 jaar.
Cheong (2014) verrichte een systematische review en meta-analyse naar de effectiviteit en veiligheid van niet-chirurgische interventies voor vrouwen met chronische bekkenpijn. Studies met betrekking tot endometriose of primaire dysmenorroe werden uitgesloten. Op 5 februari 2014 werd gezocht in Medline, Embase, The Menstrual Disorders and Subfertility Group Specialised Register of Controlled Trials, CENTRAL, PsycINFO en CINAHL naar gepubliceerde en niet-gepubliceerde RCT’s bij vrouwen met chronische bekkenpijn waarbij een medische interventie werd vergeleken met placebo, geen behandeling of een andere type interventie. Primaire uitkomstmaat was pijn. Secundaire uitkomsten waren psychologische uitkomsten, kwaliteit van leven, behoefte aan analgesie en adverse effects. In totaal werden 13 RCT’s geïncludeerd in de meta-analyse. Alleen de vergelijkingen die medicatieve behandelingen vergeleken met een placebo of eenvoudige pijnstillers waren relevant voor onze PICO en werden in de literatuuranalyse meegenomen. In totaal konden 3 studies worden geïncludeerd: 1 studie (Sator-Katzenschlager, 2005) met 56 vrouwen die gabapentine met amitriptyline en beide vergeleek, en 2 studies (Farquhar, 1989; Walton, 1992) met in totaal 204 vrouwen met chronische bekkenpijn die medroxyprogesteron met placebo vergeleken.
Lewis (2015) verrichtte een pilot RCT naar de behandeling met gabapentine van vrouwen met chronische bekkenpijn. Deelnemers waren vrouwen tussen 18 en 50 jaar oud met chronische bekkenpijn gedurende ten minste 6 maanden met geassocieerde functionele beperkingen, zonder duidelijke bekkenpathologie bij laparoscopie en die effectieve anticonceptie gebruikten. In totaal werden 47 vrouwen gerandomiseerd, 22 naar de groep die 6 maanden dagelijks gabapentine ontving (300 mg dagelijks bij de start en verhoogd per 300 mg elke week totdat 50% reductie in pijn of een maximale dosis van 2700 mg werd bereikt) en 27 naar de groep die een placebo ontving. De gemiddelde leeftijd op baseline was 26,8 jaar (SD 7,7) in de interventiegroep en 27,1 jaar (SD 5,8) in de controlegroep. De follow-up tijd was 6 maanden. Pijnintensiteit werd gemeten door middel van de VAS-score (range 0 tot 10) en de Brief Pain Inventory (BPI) score (range 0 tot 10).
Giammusso (2016) verrichtte een enkel-geblindeerde RCT naar de effectiviteit van een behandeling met Palmitoylethanolamide (PEA) vergeleken met Serenoa Repens in combinatie met alfaliponzuur. Deelnemers waren mannen tussen de 22 en 61 jaar met chronische bekkenklachten van ten minste 6 maanden. Er werden 22 mannen gerandomiseerd naar de groep die 2 keer per dag 300 mg PEA met alfaliponzuur ontving en 22 mannen naar de groep die 1 keer per dag een capsule met 320 mg Serenoa Repens ontving. Pijn werd op baseline en na 12 weken gemeten als onderdeel van de NIH-CPSI-vragenlijst. Helaas werden geen kwantitatieve data gerapporteerd, waardoor de resultaten niet gebruikt konden worden in de literatuuranalyse.
Van Ophoven (2004) verrichte een prospectieve, dubbelblind, placebogecontroleerde studie naar de effectiviteit van behandeling met amitriptyline vergeleken met een placebo bij patiënten met interstitiële cystitis. Alle patiënten waren eerder conservatief behandeld, wat in het meest gunstige geval alleen kortdurende symptomatische verlichting gaf. In totaal werden 50 patiënten gerandomiseerd, 25 patiënten (n=3 (12%) mannen; n=22 (88%) vrouwen) kregen de interventie en 25 patiënten (n=3 (12%) mannen; n=22 (88%) vrouwen) kregen een placebo. Patiënten werden 4 maanden behandeld met amitriptyline/placebo volgens een zelf-titratie protocol. Patiënten waren geïnstrueerd om 25 mg in te nemen rond bedtijd, wanneer ze na 1 week niet klachtenvrij waren mocht de dosis worden opgehoogd naar 50 mg. In week 3 en 4 mocht de dosis, indien nodig, worden opgehoogd naar 75 mg of 100 mg (maximale dosis). Wanneer patiënten tevreden waren met de mate van klachtverlichting werd geadviseerd de laagste effectieve dosis te handhaven en niet verder te verhogen. Gemiddelde duur van de klachten was 3,1 (SD 5,0) jaar in de interventie groep en 4,4 (SD 4,9) jaar in de controlegroep. In beide groepen viel 1 patiënt uit wegens adverse events, dit werd niet nader toegelicht. Amitriptyline werd door een farmaceutisch bedrijf verstrekt (Bayer Pharmaceuticals), het artikel vermeld niet of er conflicts of interest zijn.
Resultaten
De effecten van de medicamenteuze behandeling bij chronische bekkenpijn worden voor de vier uitkomstmaten per medicijn beschreven. Er werden 5 typen medicijnen beschreven in de geïncludeerde studies: alfablokkers, antibiotica, progesteron, gabapentine en amitriptyline. Er werden geen studies geïncludeerd waarin andere type medicijnen uit de PICO waren bestudeerd: SSRI, pregabaline, opiaten, opioïd receptor antagonists (low dose naltrexone), s-ketamine of tapentadol
1. Pijnintensiteit
1.1. Alfablokkers
De uitkomstmaat pijn bij een interventie met alfablokkers werd beschreven in 6 geïncludeerde studies van de systematische review van Anothaisintawee (2011). Het gaat in al deze studies om mannen met chronische bekkenpijn. Pijn werd in 4 studies (Alexander, 2004; Cheah, 2003; Nickel, 2008; Tugcu, 2007) gemeten met de National Institutes of Health Chronic Prostatitis Symptom Index (NIH-CPSI, range 0 tot 43), in 1 studie (Gul, 2001) met de Prostatitis Symptom Score Index (PSSI, range 0 tot 12) en in 1 studie (Evliyaoglu, 2002) met een pijnvragenlijst. Figuur 1 presenteert het gepoolde, gewogen gemiddelde verschil in de pijnscores. De overall verbetering in pijnscore na behandeling met alfablokkers was -1,06 (95% BI -1,77 tot -0,34); P=0.004). Er was sprake van grote heterogeniteit tussen de studies (I2=94%). Wanneer de studies met onduidelijke toewijzing van behandeling (randomisering) worden verwijderd uit de meta-analyse (Tugcu, 2007; Gul, 2001) wordt de overall verbetering in pijnscore na behandeling met alfablokker kleiner (SMD -0,43; 95% BI -0,82 tot -0,03; P=0,04) en blijft de heterogeniteit groot (I2=76%).
Figuur 1 Forest plot uitkomstmaat ‘pijnintensiteit’ op basis van het gewogen gemiddelde verschil tussen alfablokkers en placebo
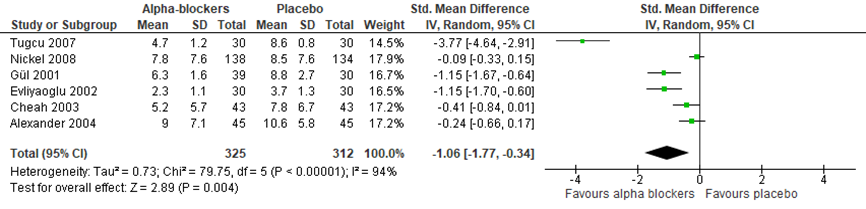
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
1.2. Antibiotica
De uitkomstmaat pijn bij een interventie met antibiotica werd beschreven in 3 geïncludeerde studies (Alexander, 2004; Nickel, 2003; Zhou, 2008) van de systematische review van Anothaisintawee (2011). Dit betrof in alle studies mannen met chronisch bekkenpijn, waarbij pijn werd gemeten met de National Institutes of Health Chronic Prostatitis Symptom Index (NIH-CPSI, range 0 tot 43). Figuur 2 presenteert het gepoolde, gewogen gemiddelde verschil in de pijnscores. De overall verbetering in pijnscore na behandeling met antibiotica was −1,43 (95% BI -3,26 tot 0.40); P=0,12). Er was sprake van grote heterogeniteit tussen de studies (I2=97%).
Figuur 2 Forest plot uitkomstmaat ‘pijnintensiteit’ op basis van het gewogen gemiddelde verschil tussen antibiotica en placebo
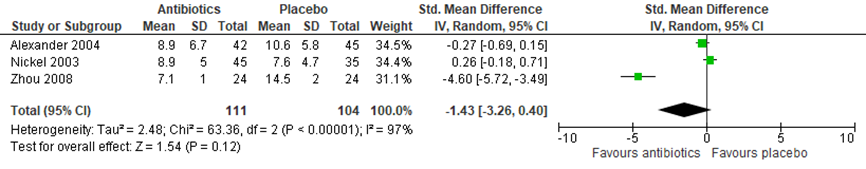
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
1.3. Progesteron
De uitkomstmaat pijn bij een interventie met progesteron bij vrouwen met chronische bekkenpijn werd beschreven in 2 geïncludeerde studies van de systematische review van Cheong (2014). Pijn werd gemeten op basis van een VAS-schaal 0 tot 10 (geen tot maximale pijn). Pijnintensiteit was gedefinieerd als een > 50% afname in VAS-pijn score aan het einde van de 4 maanden behandeling. Figuur 3 presenteert het gepoolde relatief risico in de pijnscores. Het relatief risico op een > 50% afname in pijn na behandeling met progesteron was 1,99 (95% BI 1,37 tot 2,89); P<0,001).
Figuur 3 Forest plot uitkomstmaat ‘pijnintensiteit’ op basis van de risk ratio tussen progesteron en placebo (bron: Cheong, 2014)
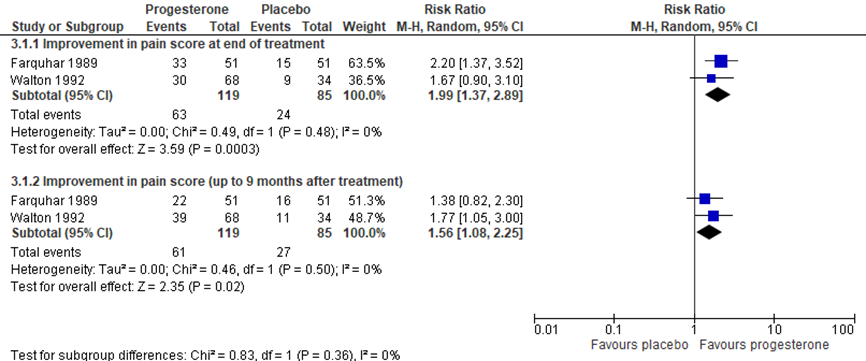
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
1.4. Amitriptyline
De uitkomstmaat pijn bij een interventie met amitriptyline versus placebo werd beschreven in 1 geïncludeerde studie met 48 patiënten met interstitiële cystitis (Van Ophoven, 2004). Pijn werd gemeten op basis van een VAS-schaal 0 tot 100 (geen tot maximale pijn). Pijnintensiteit was gedefinieerd als gemiddeld verschil in pijnscore tussen baseline en na 4 maanden behandeling. Het gemiddelde verschil in VAS-pijnscore na behandeling met amitriptyline vergeleken met placebo was -23,8 (95%BI -35,8 tot -11,80) in het voordeel van amitriptyline. Na vier maanden behandeling was de effectieve dosis als volg verdeeld in de groep: 25 mg (n=7 (29%)), 50 mg (n=9; (37.5%)), 75 mg (n=5 (21%)) en 100 mg (n=3 (12.5%)) in de interventiegroep.
1.5. Gabapentine
De uitkomstmaat pijn bij een interventie met gabapentine versus amitriptyline werd beschreven in 1 geïncludeerde studie met 40 vrouwen met chronische bekkenpijn (Sator-Katzenschlager, 2005) van de systematische review van Cheong (2014). Pijn werd gemeten op basis van een VAS-schaal 0 tot 10 (geen tot maximale pijn). Pijnintensiteit was gedefinieerd als VAS-pijnscore 24 maanden na behandeling. Het gewogen gemiddelde verschil in VAS-pijnscore na behandeling met gabapentine vergeleken met amitriptyline was -1,63 (95% BI -2,36 tot -0,91) in het voordeel van gabapentine (P<0,05).
Lewis (2015) rapporteerde 2 verschillende pijnmaten na 3 en 36 maanden bij vrouwen met chronische bekkenpijn, namelijk VAS-score en Brief Pain Inventory (BPI) score. Na 6 maanden was er geen verschil in de gemiddelde VAS-score tussen de gabapentine groep (gemiddeld 3,6; SD 2,4) en de placebogroep (gemiddeld 4,5; SD 2,3), met een gemiddeld verschil van 0,98 (9%% BI -0,87 tot 2,83) tussen de groepen. Wel was een verschil in de gemiddelde BPI-score na 6 maanden tussen de gabapentine groep (gemiddeld 2,9; SD 2,0) en de placebogroep (gemiddeld 4,1; SD 2,4), met een gemiddeld verschil van 1,72 (9%% BI 0,07 tot 3,36; P=0,04) tussen de groepen.
2. Patiënttevredenheid
2.1. Alfablokkers
Er werden geen studies geïncludeerd waarin de uitkomstmaat patiënttevredenheid bij behandeling met alfablokkers bij chronische bekkenpijn werd geanalyseerd.
2.2. Antibiotica
Er werden geen studies geïncludeerd waarin de uitkomstmaat patiënttevredenheid bij behandeling met antibiotica bij chronische bekkenpijn werd geanalyseerd.
2.3. Progesteron
Er werden geen studies geïncludeerd waarin de uitkomstmaat patiënttevredenheid bij behandeling met progesteron bij chronische bekkenpijn werd geanalyseerd.
2.4. Amitriptyline
De uitkomstmaat patiënttevredenheid bij een interventie met amitriptyline versus placebo werd beschreven in 1 geïncludeerde studie met 48 patiënten met interstitiële cystitis (Van Ophoven, 2004).
Patiënten warden gevraagd om hun tevredenheid met de therapeutische uitkomst te beoordelen op een schaal van excellent-goed-matig-slecht (het Patient Global Assessment Form). Tabel 1 laat de resultaten zien van deze beoordeling. Een goede of excellente beoordeling werd door Van Ophoven (2004) als tevredenheid gezien.
In totaal werd de patiënttevredenheid door 15/24 patiënten in de interventiegroep (65%) beoordeeld als goed of excellent, vergeleken met 1/24 patiënten in de controlegroep (4%) (RR 15,00 (95%CI 2,15 tot 104,75)).
Tabel 1 Beoordeling patiënttevredenheid behandeling amitriptyline versus. placebo bij interstitiële cystitis (Van Ophoven (2004))
|
Patient satisfaction |
Amitriptyline (n %) |
Placebo (n %) |
|
Poor |
3 (13%) |
21 (88%) |
|
Fair |
6 (25%) |
2 (8%) |
|
Good |
10 (42%) |
1 (4%) |
|
Excellent |
5 (21%) |
0 |
2.5. Gabapentine
Er werden geen studies geïncludeerd waarin de uitkomstmaat patiënttevredenheid bij behandeling met gabapentine bij chronische bekkenpijn werd geanalyseerd.
3. Complicaties
3.1. Alfablokkers
Er werden geen studies geïncludeerd waarin de uitkomstmaat complicaties bij behandeling met alfablokkers bij chronische bekkenpijn werd geanalyseerd.
3.2. Antibiotica
Er werden geen studies geïncludeerd waarin de uitkomstmaat complicaties bij behandeling met antibiotica bij chronische bekkenpijn werd geanalyseerd.
3.3. Progesteron
De uitkomstmaat complicaties bij een interventie met progesteron versus placebo werd beschreven in 2 geïncludeerde studies van de systematische review van Cheong (2014). In beide studies betroffen dit vrouwen met chronische bekkenpijn. Farquhar (1989) rapporteerde een hoger risico op gewichtstoename en opgeblazen gevoel in de progesteron groep. Het relatief risico op gewichtstoename na behandeling met progesteron was 2,41 (95% BI 1,55 tot 3,75; P<0,0001) vergeleken met placebo. Het relatief risico op een opgeblazen gevoel na behandeling met progesteron was 1,84 (95% BI 1,15 tot 2,96); P=0,01) vergeleken met placebo.
Walton (1992) rapporteerde de uitkomstmaat andere medische events zoals verandering in kleur van het been en borstknobbels. Het relatief risico op andere medische events na behandeling met progesteron was 1,60 (95% BI 0,56 tot 4,56; P=0,38) vergeleken met placebo.
3.4. Amitriptyline
De uitkomstmaat complicaties bij een interventie met amitriptyline versus placebo werd beschreven in 1 geïncludeerde studie met 48 patiënten met interstitiële cystitis (Van Ophoven, 2004). In beide groepen was eerder al 1 patiënt uitgevallen wegens complicaties, dit werd niet nader toegelicht, onderstaande resultaten beschrijven deze patiënten niet.
Alle complicaties werden gerapporteerd en gegradeerd volgens de Common Toxicity Criteria op een schaal van 0 tot 5 (geen tot mortaliteit). Tabel 2 presenteert een overzicht van alle gerapporteerde complicaties. De resultaten werden niet geanalyseerd maar alleen beschrijvend gepresenteerd.
Van Ophoven (2004) rapporteerde geen adverse events van GRADE 3 of hoger. Een droge mond was de meest frequent gerapporteerde complicatie in de amitriptyline groep.
Tabel 2 Beoordeling adverse events behandeling amitriptyline versus placebo bij interstitiële cystitis (Van Ophoven (2004))
|
Adverse side effect |
No. Grade 0, None (%) |
No. Grade 1, Mild (%) |
No. Grade 2, Moderate (%) |
|||
|
|
Amitriptyline |
Placebo |
Amitriptyline |
Placebo |
Amitriptyline |
Placebo |
|
Mouth dryness |
5 (21%) |
22 (92%) |
19 (79%) |
2 (8%) |
- |
- |
|
Weight gain |
9 (37%) |
22 (92%) |
10 (42%) |
2 (8%) |
5 (21%) |
- |
|
Sedation |
15 (62.5%) |
21 (87.5%) |
9 (37.5%) |
3 (12.5) |
- |
- |
|
Constipation |
13 (54%) |
22 (92%) |
8 (33.3%) |
2 (8%) |
3 (12.5%) |
- |
|
Nausea/vertigo |
21 (87.5%) |
21 (87.5%) |
3 (12.5%) |
3 (12.5%) |
- |
- |
|
Blurred vision/diplopia |
20 (83%) |
24 (100%) |
4 (17%) |
- |
- |
- |
|
Erectile dysfunction |
23 (96%) |
24 (100%) |
1 (4%) |
- |
- |
- |
3.5. Gabapentine
Lewis (2015) rapporteerde adverse events in de 2 groepen vrouwen met chronische bekkenpijn. Er waren geen verschillen tussen de groepen met 17/22 (77%) adverse events in de gabapentine groep en 16/25 (64%) in de controlegroep. Dit komt neer op een relatief risico van 1,21 (95% BI 0,83 tot 1,75) ten gunste van de placebogroep. De meeste events waren mild (15 in elke groep). Er waren 2 serieuze adverse events, beiden in de interventiegroep, maar dit waren beiden exacerbaties van COPD vanwege hospitalisatie en werden niet in verband gebracht met de gabapentine.
Voor de andere medicamenteuze behandelingen (alfablokkers, antibiotica) werd de uitkomstmaat complicaties niet gerapporteerd in de geïncludeerde studies.
4. Kwaliteit van leven
4.1. Alfablokkers
De uitkomstmaat kwaliteit van leven bij een interventie met alfablokkers werd beschreven in 5 geïncludeerde studies van de systematische review van Anothaisintawee (2011). Kwaliteit van leven werd in 4 studies (Nickel, 2008; Tugcu, 2007; Alexander, 2004; Cheah, 2003) gemeten met de National Institutes of Health Chronic Prostatitis Symptom Index (NIH-CPSI, range 0 tot 43), en in 1 studie (Evliyaoglu, 2002) met Prostatitis Symptom Score Index (PSSI, range 0 tot 12). Figuur 4 presenteert het gepoolde, gewogen gemiddelde verschil in de kwaliteit van leven scores. De overall verbetering in kwaliteit van leven na behandeling met alfablokkers was -0,98 (95% BI -1,79 tot -0,18); P=0.02). Er was sprake van grote heterogeniteit tussen de studies (I2=94%).
Figuur 4 Forest plot uitkomstmaat ‘Kwaliteit van leven’ op basis van het gewogen gemiddelde verschil tussen alfablokkers en placebo
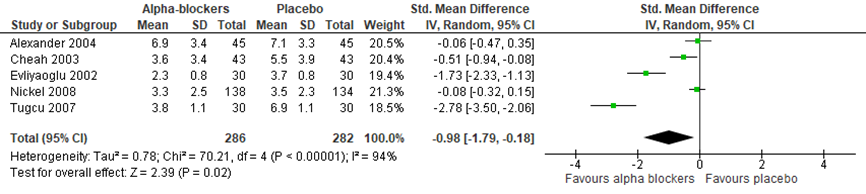
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
4.2. Antibiotica
De uitkomstmaat kwaliteit van leven bij een interventie met antibiotica werd beschreven in 3 geïncludeerde studies (Nickel, 2003; Alexander, 2004; Zhou, 2008) van de systematische review van Anothaisintawee (2011). Kwaliteit van leven werd in alle 3 de studies gemeten met de National Institutes of Health Chronic Prostatitis Symptom Index (NIH-CPSI, range 0 tot 43). Figuur 5 presenteert het gepoolde, gewogen gemiddelde verschil in de kwaliteit van leven scores. De overall verbetering in kwaliteit van leven na behandeling met antibiotica was -1,26 (95% BI -2,76 tot 0,24); P=0.10). Er was sprake van grote heterogeniteit tussen de studies (I2=96%).
Figuur 5 Forest plot uitkomstmaat ‘Kwaliteit van leven’ op basis van het gewogen gemiddelde verschil tussen antibiotica en placebo
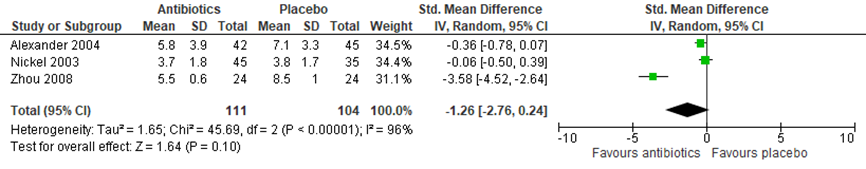
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
4.3. Progesteron
Er werden geen studies geïncludeerd waarin de uitkomstmaat kwaliteit van leven bij behandeling met progesteron bij chronische bekkenpijn werd geanalyseerd.
4.4. Amitriptyline
Er werden geen studies geïncludeerd waarin de uitkomstmaat kwaliteit van leven bij behandeling met amitriptyline bij chronische bekkenpijn werd geanalyseerd.
4.5. Gabapentine
Er werden geen studies geïncludeerd waarin de uitkomstmaat kwaliteit van leven bij behandeling met gabapentine bij chronische bekkenpijn werd geanalyseerd.
Bewijskracht van de literatuur
Alfablokkers
De bewijskracht voor de uitkomstmaat pijnintensiteit na behandeling met alfablokkers is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijke toewijzing van interventie in 4 van de 6 studies) en het betrouwbaarheidsinterval van het gepoolde effect overlapt de grens van klinische relevantie (imprecisie).
De bewijskracht voor de uitkomstmaten patiënttevredenheid en complicaties na behandeling met alfablokkers kon niet worden gegradeerd door middel van GRADE doordat er geen studies over alfablokkers werden geïncludeerd waarin deze uitkomstmaten werden bestudeerd.
De bewijskracht voor de uitkomstmaat kwaliteit van leven na behandeling met alfablokkers is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijke toewijzing van interventie in 3 van de 5 studies); tegenstrijdige resultaten (inconsistentie) en het betrouwbaarheidsinterval van het gepoolde effect overlapt de grens van klinische relevantie (imprecisie).
Antibiotica
De bewijskracht voor de uitkomstmaat pijnintensiteit na behandeling met antibiotica is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijke toewijzing van interventie in 2 van de 3 studies); tegenstrijdige resultaten (inconsistentie) en het betrouwbaarheidsinterval van het gepoolde effect overlapt de grens van klinische relevantie (imprecisie).
De bewijskracht voor de uitkomstmaten patiënttevredenheid en complicaties na behandeling met antibiotica kon niet worden gegradeerd door middel van GRADE doordat er geen studies over antibiotica werden geïncludeerd waarin deze uitkomstmaten werden bestudeerd.
De bewijskracht voor de uitkomstmaat kwaliteit van leven na behandeling met antibiotica is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijke toewijzing van interventie in 2 van de 3 studies); tegenstrijdige resultaten (inconsistentie) en het betrouwbaarheidsinterval van het gepoolde effect overlapt de grens van klinische relevantie (imprecisie).
Progesteron
De bewijskracht voor de uitkomstmaat pijnintensiteit en complicaties na behandeling met progesteron is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege selectieve uitval van patiënten in beide studies).
De bewijskracht voor de uitkomstmaten patiënttevredenheid en kwaliteit van leven na behandeling met progesteron kon niet worden gegradeerd door middel van GRADE doordat er geen studies over progesteron werden geïncludeerd waarin deze uitkomstmaten werden bestudeerd.
Amitriptyline
De bewijskracht voor de uitkomstmaten pijnintensiteit, patiënttevredenheid en complicaties na behandeling met amitriptyline is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijkheid rondom uitval wegens adverse events/conflict of interest).
De bewijskracht voor de uitkomstmaat kwaliteit van leven na behandeling met amitriptyline kon niet worden gegradeerd door middel van GRADE doordat er geen studies over amitriptyline werden geïncludeerd waarin deze uitkomstmaten werden bestudeerd.
Gabapentine
De bewijskracht voor de uitkomstmaat pijnintensiteit na behandeling met gabapentine is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege ontbreken blindering en incomplete uitkomsten vanwege uitval) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat complicaties na behandeling met gabapentine is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege ontbreken blindering en incomplete uitkomsten vanwege uitval) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaten patiënttevredenheid en kwaliteit van leven na behandeling met gabapentine kon niet worden gegradeerd door middel van GRADE doordat er geen studies over progesteron werden geïncludeerd waarin deze uitkomstmaten werden bestudeerd.
Overige medicatie
De bewijskracht voor de uitkomstmaten pijnintensiteit, patiënttevredenheid, complicaties en kwaliteit van leven kon niet worden gegradeerd door middel van GRADE doordat er geen studies over SSRI, pregabaline, opiaten, opioïd receptor antagonisten (low dose naltrexone), s-ketamine of tapentadol werden geïncludeerd waarin deze uitkomstmaten werden bestudeerd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit en veiligheid van medicamenteuze (farmacologische) behandeling van pijn ten opzichte van placebo, een ander farmacon, of een niet medicamenteuze behandeling.
P: patiënten met chronische bekkenpijn (duur van de pijn ≥ 6 maanden?);
I: behandeling met SSRI, TCA, cannabinoids (onder andere PEA), gabapentine/pregabaline, of opiaten, opiod receptor antagonists (Low dose naltrexone), s-ketamine, tapentadol;
C: placebo of een andere farmacologische compound zoals SSRI, TCA of opiaten, eenvoudige pijnstillers of een niet medicamenteuze behandeling;
O: pijnintensiteit, patiënttevredenheid, complicaties, kwaliteit van leven.
Relevante uitkomstmaten
De werkgroep achtte pijnintensiteit een voor de besluitvorming cruciale uitkomstmaat; en patiënttevredenheid, complicaties, kwaliteit van leven voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep hield de GRADE-default grenzen (25% voor dichotome uitkomstmaten en 0,5 SD voor continue uitkomstmaten) aan als een klinisch (patiënt) relevant verschil (Schüneman, 2013).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (Elsevier) is op 5 juli 2019 met relevante zoektermen gezocht naar systematische reviews, randomized controlled trials (RCT’s) en observationele cohortstudies waarin werd gekeken naar de effectiviteit en veiligheid van medicamenteuze behandeling van chronische bekkenpijn. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 616 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: 1) studie betrof patiënten met chronische bekkenpijn (duur pijn ≥ 6 maanden); 2) studie betrof een vergelijkend onderzoek waarin medicamenteuze behandeling werd vergeleken met een andere medicamenteuze, placebo of niet-medicamenteuze behandeling; 3) minimaal één van de volgende uitkomstmaten werd gerapporteerd: pijnintensiteit, patiënttevredenheid, complicaties, kwaliteit van leven. Op basis van titel en abstract werden in eerste instantie 65 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 60 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 5 studies (2 systematische reviews; 3 RCT’s) definitief geselecteerd.
Resultaten
Twee systematische reviews werden geïncludeerd in de literatuuranalyse, één over alfablokkers en antibiotica (Anothaisintawee, 2011) en één over progesteron (Cheong, 2014). Ook werden 3 RCT’s geïncludeerd over gabapentine, Palmitoylethanolamide (PEA) en amitriptyline (Lewis, 2015; Giamusso, 2016; Van Ophoven, 2004). Er werden geen studies geïncludeerd waarin andere type medicijnen uit de PICO waren bestudeerd: SSRI, pregabaline, opiaten, opioïd receptor antagonists (low dose naltrexone), s-ketamine of tapentadol. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Anothaisintawee T, Attia J, Nickel JC, Thammakraisorn S, Numthavaj P, McEvoy M, Thakkinstian A. Management of chronic prostatitis/chronic pelvic pain syndrome: a systematic review and network meta-analysis. JAMA. 2011 Jan 5;305(1):78-86.
- Cheong YC, Smotra G, Williams AC. Non-surgical interventions for the management of chronic pelvic pain. Cochrane Database Syst Rev. 2014 Mar 5;(3):CD008797.
- Fall M, Oberpenning F, Peeker R. Treatment of bladder pain syndrome/interstitial cystitis 2008: can we make evidence-based decisions? Eur Urol. 2008 Jul;54(1):65-75.
- Giammusso B, Di Mauro R, Bernardini R. The efficacy of an association of palmitoylethanolamide and alpha-lipoic acid in patients with chronic prostatitis/chronic pelvic pain syndrome: A randomized clinical trial. Arch Ital Urol Androl. 2017 Mar 31;89(1):17-21.
- Lewis SC, Bhattacharya S, Wu O, Vincent K, Jack SA, Critchley HO, Porter MA, Cranley D, Wilson JA, Horne AW. Gabapentin for the Management of Chronic Pelvic Pain in Women (GaPP1): A Pilot Randomised Controlled Trial. PLoS One. 2016 Apr 12;11(4):e0153037. doi: 10.1371/journal.pone.0153037.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is de effectiviteit en veiligheid van medicamenteuze (farmacologische) behandeling van pijn ten opzichte van placebo, elkaar of een niet medicamenteuze behandeling bij patiënten met chronische bekkenpijn?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Anothaisintawee, 2011 |
SR and network meta-analysis of RCTs
Literature search up to November 2010
A: Nickel, 2008 B: Tugcu, 2007 C: Cheah, 2003 D: Evliyaoglu, 2002 E: Gül, 2001 F: Nickel, 2003 G: Zhou, 2008 H: Alexander, 2004
Study design: RCT
Setting and Country: Thailand; NR for included studies
Source of funding: Not reported |
Inclusion criteria SR: RCT’s published in English and: (1) Participants met criteria for CP/CPPS categories IIIA or IIIB according to the NIH classification; (2) The study compared any pair of the following interventions: alpha-blockers, antibiotics, steroidal and nonsteroidal anti-inflammatory drugs, finasteride, glycosminoglycans, phytotherapy, gabapentinoids, and placebo; (3) study measured any of the following outcomes: pain scores, voiding scores, quality- of-life scores, and total symptom scores; (4) The full article could be retrieved and had sufficient data for extraction.
Exclusion criteria SR: none
23 studies included, from which 8 studies one or more outcomes of interest
Important patient characteristics at baseline: N, mean age ± SD A: 272 patients, 40.1± yrs B: 60 patients, 29.1± 5.2 yrs C: 86 patients, 35.5 yrs (range 20-50) D: 60 patients, 33.0 ± 28.5 yrs E: 69 patients, 39.6 yrs F: 80 patients, 56. Yrs (range 36-78) G: 48 patients, age NR H: 80 patients, 56.1 (range 36-78) yrs
Sex: NR
Groups comparable at baseline? NR |
A: Alfuzosin B: Doxazosin C: Terazosin D: Doxazosin E: Terazosin F: Levofloxacin G: Tetracyline hydrochloride
NB dose not reported |
A: Placebo B: Placebo C: Placebo D: Placebo E: Placebo F: Placebo G: Placebo
|
A: 12 weeks B: 24 weeks C: 14 weeks D: 12 weeks E: 12 weeks F: 6 weeks G: 12 weeks
For how many participants were no complete outcome data available? Not reported
|
1. Pain intensity Defined as pain score.
Effect measure: standardized mean difference (95% CI): Alpha-blockers A: -0.09 (-0.33 to 0.15) B: -3.77 (-4.64 to -2.91) C: -2.60 (-5.23 to 0.03) D: -0.41 (-0.84 to 0.01) E: -1.15 (-1.67 to -0.64) H: -0.24 (-0.66 to 0.17)
Pooled effect (random effects model): -1.06 (95% CI -1.77 to -0.34) favoring alpha blockers Heterogeneity (I2): 94%
Antibiotics F: 0.26 (-0.18 to 0.71) G: -4.60 (-3.26 to 0.40) H: -0.27 (-0.69 to 0.15)
Pooled effect (random effects model): -1.43 (95% CI -3.26 to 0.40) favoring antibiotics Heterogeneity (I2): 97%
2. Patient satisfaction Not reported
3. Complications Not reported
4. Quality of life Defined as quality of life score measured with NIH-CPSI (except Evliyaoglu, 2002 with IPSS).
Effect measure: standardized mean difference (95% CI): Alpha-blockers A: -0.08 (-0.32 to 0.15) B: -2.78 (-3.50 to -2.06) C: -0.51 (-0.94 to -0.08) D: -1.73 (-2.33 to -1.13) H: -0.06 (-0.47 to 0.35)
Pooled effect (random effects model): -0.98 (95% CI -1.79 to -0.18) favoring alpha blockers Heterogeneity (I2): 94%
Antibiotics F: -0.06 (-0.50 to 0.39) G: -3.58 (-4.52 to 0.40) H: -0.36 (-0.78 to -2.64)
Pooled effect (random effects model): -1.26 (95% CI -2.76 to 0.24) favoring antibiotics Heterogeneity (I2): 96% |
NIH-CPSI = National Institutes of Health Chronic Prostatitis Symptom Index (ranges from 0 to 43) PSSI = Prostatitis Symptom Score Index (ranges from 0 to 12)
Brief description of author’s conclusion: alpha-Blockers, antibiotics, and combinations of these therapies appear to achieve the greatest improvement in clinical symptom scores compared with placebo.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Level of evidence: 1. Pain intensity: Alpha-blockers: VERY LOW Due to risk of bias (unclear allocation concealment in 4 out of 6 studies), inconsistency in results and imprecision.
Antibiotics: VERY LOW Due to risk of bias (unclear allocation concealment in 2 out of 3 studies), inconsistency in results and imprecision.
4. Quality of life Alpha-blockers: VERY LOW Due to risk of bias (unclear allocation concealment in 3 out of 5 studies), inconsistency in results and imprecision.
Antibiotics: VERY LOW Due to risk of bias (unclear allocation concealment in 2 out of 3 studies), inconsistency in results and imprecision.
|
|
Cheong, 2014 |
SR and meta-analysis of RCTs (published and unpublished)
Literature search up to February 2014
A: Farquhar, 1989 B: Walton, 1992 C: Sator-Katzenschlager, 2005
Study design: RCT
Setting and Country: A: setting NR, England B: setting NR, UK C: setting and country NR
Source of funding: Non-commercial
|
Inclusion criteria SR: published and unpublished RCTs about women with CPP; medical interventions versus placebo/no treatment or other types of interventions, psychological/behavioural/cognitive treatments versus no treatment/ placebo/ other non-surgical treatments or other types of interventions, physical and complementary treatments versus no treatment/ sham or placebo or other types of interventions.
Exclusion criteria SR: not properly randomised trials, studies examining specific cohorts of women known to have solely endometriosis, primary dysmenorrhoea and/or pain due to active chronic pelvic inflammatory disease
23 studies included, from which 8 studies one or more outcomes of interest
Important patient characteristics at baseline:
N, mean age ± SD A: 102 women, 29.8 yrs B: 165 patients, age NR C: 56 patients, age NR
Groups comparable at baseline? NR |
A1: medroxyprogesterone acetate (MPA) 50 mg daily for 4 months (N = 25) A1: (MPA) and psychotherapy for 4 months (N = 26) B: medroxyprogesterone acetate 50 mg daily for 4 months C1: Gabapentin (N=20), increased from 300 mg per day up to a maximum dose of 3600 mg per day in 300-mg increments each week C2: Combination gabapentin and amitriptyline (N=16) |
A1: Placebo (N=25) A1: Placebo and psychotherapy (N=26) B: Placebo tablets C: Amitriptyline (N=20), initial dose of 25 mg per day up to a maximum dose of 150 mg per day
|
A: 9 months B: 4 months C: 24 months
For how many participants were no complete outcome data available? (intervention/control) A: 7 (group NR) B: 36%/ 43% C: 7 (group NR)
|
Progesterone 1. Pain intensity Defined as improvement in pain score (≥50% reduction in VAS-pain score (0-10)) at end of treatment
Effect measure: RR (95% CI): A: 2.20 (1.37 to 3.52) B: -1.67 (0.90 to 3.10)
Pooled effect (random effects model): 1.99 (95% CI 1.37 to 2.89) favoring progesterone Heterogeneity (I2): 0%
2. Patient satisfaction Not reported
3. Complications Not reported
4. Quality of life Not reported
1. Pain intensity Defined as VAS-pain score (0-10) at 24 months
Effect measure: standardized mean difference (95% CI) C: -1.63 (-2.36 to -0.91)
2. Patient satisfaction Not reported
3. Complications Not reported
4. Quality of life Not reported |
Brief description of author’s conclusion: evidence shows improvement of pain in women given a high dose of progestogen (50 mg medroxyprogesterone acetate) immediately post-treatment and for up to nine months after treatment. However, progestogen was associated with adverse effects such as weight gain and bloating.
Level of evidence: Progesterone 1. Pain intensity: ≥50% reduction in VAS-pain score: MODERATE Due to risk of bias (incomplete outcome data (attrition bias), 40% dropout rate in 1 of the 2 studies (other >10%).
Gabapentin 1. Pain intensity: VAS-pain score SMD at 24 months: LOW Due to risk of bias (no blinding, and incomplete outcome data (>10% attrition)). |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
IC: interstitial cystitis; SD: standard deviation
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders)
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/no tapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Anathaisintawee, 2011 |
Yes |
Yes |
Yes |
No, sex is not reported, and characteristics only described for total groups |
NA |
Yes |
Yes, but very high statistical heterogeneity |
Yes |
No, not indicated for SR and included studies |
|
Cheong, 2014 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
No, only indicated for SR |
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: what is the effectiveness of pharmaceutical treatment in patients with chronic pelvic pain, compared to other pharmaceutical treatments or placebo?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Giammusso,, 2016 |
Not described (only reported that a randomized single-blinded trial was performed) |
Unclear |
Unclear, blinding not described |
Unclear, blinding not described |
Unclear, blinding not described |
Unlikely |
Unclear, not reported who many patients were lost to follow-up |
Unclear |
|
Lewis, 2015 |
Randomisation by web-based system that ensured allocation concealment, using randomized blocks of size four, and stratified by centre. |
Unlikely |
Unclear, blinding not described |
Unclear, blinding not described |
Unclear, blinding not described |
Unlikely |
Likely, 47% were lost to follow-up |
Unlikely |
|
Van Ophoven, 2004 |
The patients were equally assigned to amitriptyline or placebo using a block randomization design.
Notes: Selection bias suspected based on unclear number of patients eligible for selection. Intervention was sponsored by commercial party (Bayer pharmaceuticals). |
Unlikely, double-blind design. |
Unlikely, double-blind design. |
Unlikely, double-blind design. |
Unclear, not reported. |
Unlikely |
Unclear, in both groups 1 patient dropped out due to adverse effects |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Aboumarzouk, 2012 |
Overlapt met netwerk meta-analyse van Anothaisintawee 2011 |
|
Agarwal, 2017 |
geen RCT |
|
Blagden, 2014 |
voldoet niet aan PICO (geen patiënten met CPP; bredere groep) |
|
Brown, 2008 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Brown, 2013 |
protocol paper |
|
Caruso, 2015 |
Voldoet niet aan PICO (vergelijkt niet met placebo of andere controlegroep). |
|
Cheong, 2006 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Cobellis, 2011 |
fulltekst niet beschikbaar |
|
Cohen, 2012 |
Overlapt met netwerk meta-analyse van Anothaisintawee 2011 |
|
De Andres, 2016 |
narrative review |
|
De Marqui, 2015 |
narrative review |
|
Di Francesco, 2014 |
voldoet niet aan PICO (hormonale behandeling (estroprogestinics en/of GnRH analogues)). |
|
Dimitrakov, 2007 |
literature review zonder RoB |
|
Dionisi, 2015 |
Voldoet niet aan PICO (vergelijkt niet met placebo of andere controlegroep). |
|
Fall, 2004 |
guideline CPP |
|
Farrar, 2010 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Gewandter, 2018 |
review over methodologische kwaliteit van studies over onder andere CPP. |
|
Giammusso, 2017 |
rapporteert geen kwantitatieve uitkomsten |
|
Giannantoni, 2012 |
review zonder RoB beoordeling geïncludeerde studies |
|
Giannantoni, 2014 |
voldoet niet aan PICO (vergelijkt verschillende gecombineerde behandelingen met elkaar) |
|
Giugliano, 2013 |
Voldoet niet aan PICO (vergelijkt niet met placebo of andere controlegroep). |
|
Hanno, 2011 |
guideline CPP |
|
Homma, 2009 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Horn, 2017 |
narrative review |
|
Horne, 2012 |
protocol paper |
|
Işik Şengün, 2013 |
Voldoet niet aan PICO (vergelijkt niet met placebo of andere controlegroep). |
|
Indraccolo, 2017 |
voldoet niet aan PICO (behandeling valt buiten PICO) |
|
Jackson, 2006 |
narrative review |
|
Jamison, 2007 |
protocol paper |
|
Jarrell, 2005 |
guideline CPP |
|
Katske, 2001 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Learman, 2005 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Lee, 2005 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Levine, 2010 |
narrative review |
|
Luzzi, 2002 |
narrative review |
|
Magistro, 2016 |
review met te beperkte presentatie van data |
|
Malde, 2018 |
guideline CPP |
|
Malec-Milewska, 2015 |
Voldoet niet aan PICO (vergelijkt niet met placebo of andere controlegroep). |
|
Miranda Varella Pereira, 2018 |
Voldoet niet aan PICO (behandeling valt buiten PICO) |
|
Nickel, 2014 |
voldoet niet aan PICO (geen vergelijkend onderzoek; behandeling op basis van fenotype) |
|
Nyirjesy, 2001 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Pazin, 2016 |
review met te beperkte presentatie van data. |
|
Pontari, 2010 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Rovner, 2000 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Sasaki, 2001 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Sator-Katzenschlager, 2005 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Seretny, 2019 |
voldoet niet aan PICO (fMRI studie met 12 mensen) |
|
Shoskes, 2010 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Stanford, 2008 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Stones, 2001 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Theoharides, 2008 |
narrative review |
|
Thomson, 2005 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
van Ophoven, 2004 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
van Ophoven, 2005 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
van Ophoven, 2007 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Vincent, 2018 |
protocol paper |
|
Wammack, 2002 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Warren, 2000 |
valt binnen search netwerk meta-analyse Anothaisintawee 2011 |
|
Wiffen, 2014 |
geen origineel artikel (overzicht gepubliceerde cochrane reviews) |
|
Won, 2010 |
narrative review |
|
Xia, 2011 |
Voldoet niet aan PICO (vergelijkt niet met placebo of andere controlegroep). |
|
Yang, 2014 |
geen origineel onderzoek |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-08-2021
Beoordeeld op geldigheid : 31-08-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Urologie (NVU) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVU is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Medicamenteuze behandeling |
NVU |
2020 |
2025 |
Elke 5 jaar |
NVU |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
De richtlijn is ontwikkeld in samenwerking met:
- Nederlandse Vereniging van Maag-Darm-Leverartsen
- Nederlandse Vereniging voor Anesthesiologie
- Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Nederlandse Vereniging voor Bekkenfysiotherapie
- Nederlandse Vereniging voor Heelkunde
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie
- Nederlands Instituut van Psychologen
- Landelijke Vereniging Medische Psychologie
- Koninklijke Nederlandse Organisatie van Verloskundigen
- Nederlands Huisartsen Genootschap
- Verpleegkundigen & Verzorgenden Nederland
- Stichting Bekkenbodem4All
- Interstitiële Cystitis Patiëntenvereniging
Doel en doelgroep
Doel
Het ontwikkelen van een evidence based richtlijn over chronische bekkenpijn volgens richtlijnen 2.0.
Doelgroep
Patiënten met chronische bekkenpijn. Alle zorgverleners die betrokken zijn bij de zorg voor patiënten met chronische bekkenpijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in december 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met chronische bekkenpijn.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. E.J. (Bert) Messelink, uroloog-seksuoloog NVVS, NVU (voorzitter).
- Dr. A. (Afina) Glas, uroloog, NVU
- Dr. J. (Jacqueline) Groeneweg, gynaecoloog, NVOG
- Dr. D. (Dick) Janssen, arts-onderzoeker urologie, NVU
- Drs. K. (Karlijn) Schweitzer, gynaecoloog, NVOG
- Drs. V. (Wafa) Rezvani, anesthesioloog-pijnbestrijder, NVA
- Dr. R.J.F. (Richelle) Felt-Bersma, maag-darm-leverarts, NVMDL
- Dr. R.J. (Remmie) Hammers, huisarts, kaderarts urogynaecologie, NHG
- Drs. G. (Gidia) Jacobs, gezondheidszorgpsycholoog, pedagoog, seksuoloog NVVS, NVVS, NIP, LVMP.
- Drs. C. (Corine) Adamse, geregistreerd bekkenfysiotherapeut, NVFB
- (Ana) dos Santos, MSc, geregistreerd bekkenfysiotherapeut, NVFB
- H.J. (Henk-Jan) Mulder, verpleegkundig specialist urologie, V&VN
- C.W.L. (Tine) van den Bos, MSPT, belangenbehartiger patiënten namens Stichting Bekkenbodem4All, voorzitter Stichting Bekkenbodem4All, geregistreerd bekkenfysiotherapeut, Stichting Bekkenbodem4All
Klankbordgroep
- Prof. dr. E.J.C. (Esther) Consten, chirurg, NVvH
- B.B.M. (Brigitte) Tebbe, verloskundige, KNOV
- H.M.T. Andriesse-Walhain, patiëntvertegenwoordiger, ICP
Met ondersteuning van
- Dr. I. (Irina) Mostovaya, senior-adviseur en teamleider, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A (Anne) Bijlsma-Rutte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (José) Maas, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Y.J. (Yvonne) Labeur, MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Monique) Wessels, MSc, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
* Messelink |
Uroloog - Seksuoloog NVVS Medisch Centrum Leeuwarden |
Verzorgen onderwijs: SOMT Amersfoort. Opleiding Bekkenfysiotherapeuten, 1,5 dag/jaar. Betaald RINO Utrecht. Opleiding seksuologie, 0,5 dag/jaar. Betaald Opleiding Stomaverpleegkundige Groningen. 2 uur/jaar. Betaald
Europese cursus: Chronic Pelvic Pain, European Association of Urology. Halve dag 1x/jaar. Betaald |
* Voorzitter Pelvic Floor Network, een non-profit organisatie die zich inzet voor het structureren van landelijk onderwijs en het opzetten van een zorg-netwerk betreffende chronische bekkenpijn. * Lid medische adviesraad van de patiëntenverenigingen: BB4All, PVVN. * Vice-chairman EAU Guideline panel Chronic Pelvic Pain. |
Geen |
|
Groeneweg |
gynaecoloog IJsselland ziekenhuis 0,625 fte expert gynaecologie Zorginstituut Nederland 0,2 fte |
bestuurslid werkgroep Bekkenbodem NVOG onbetaald
|
vanuit werkgroep Bekkenbodem ben ik de contactpersoon voor de patiëntenorganisatie BB4all |
Geen |
|
Schaapveld |
Voorzitter Bekkenbodem4all |
Lid cliëntenraad Residentie Molenwijck |
Niet van toepassing |
Geen |
|
Glas |
Uroloog, vrij gevestigd. ZaansMC |
Geen |
Ben betrokken bij opzet onderzoek naar blaasspoelingen bij preventie van urineweginfecties. Dit onderzoek wordt mogelijk gefinancierd (aanvraag unrestricted grant) door bedrijf dat ook blaasspoelingen verkoopt voor indicatie chronische bekkenpijn
Ik hoop dat eerder ontwikkelde standpunt BPS/ic waar ik actief betrokken bij ben geweest een plaats krijgt, qua inhoud, inde de nieuw te ontwikkelen richtlijn bekkenpijn.
Het meehelpen bij ontwikkelen van een dergelijke richtlijn, zal voor mij persoonlijke een intellectueel gewin opleveren. In die zin dat ik er ook iets hoop van te leren.
Het mee ontwikkelen van de richtlijn zal denk ik een gunstige invloed hebben op mijn rol als specialist met affiniteit voor de patiëntengroep en het ziektebeeld. |
Geen actie; NB-blaasspoelingen worden niet besproken in de richtlijn |
|
Adamse |
Bekkenfysiotherapeut en klinisch Epidemiologie Docent EBP en begeleider onderzoekstagiaires Antonius ziekenhuis Sneek |
Bekkenfysiotherapeut: Alle klinische en poliklinische zorg rondom bekken patiënten deelname aan multidisciplinair overleg met gynaecologie, urologie en chirurgie. Deelname aan seksuologisch spreekuur en MDO. samenwerking met MDL-artsen en gespecialiseerde verpleegkundigen. klinisch epidemioloog/ docent EBP/ begeleider onderzoekstherapie lesgeven en ondersteunen van onderzoeksvragen op het gebied van EBP voor zowel fysiotherapeuten als verpleegkundigen. Evidence based practise docent (gastdocent) NHL/stenden hogeschool Leeuwarden |
nee, behalve dat richtlijn mogelijk meer werk/aandacht oplevert voor bekkenfysiotherapie in het ziekenhuis
mogelijk meer aandacht voor bekkenfysiotherapie en de NVFB. Review gedaan naar chronische pijn en effectiviteit van e-health toepassingen en gepubliceerd (2017) |
Geen |
|
Santos |
Geregistreerd bekkenfysiotherapeut MSc bij PelviCentrum- Centrum voor Bekkenfysiotherapie Leiden Eigenaresse van PelviCentrum - Centrum l voor Bekkenfysiotherapie Leiden |
Lid van NVFB Wetenschappelijke Commissie. Vergoeding van de reiskosten en bijwonen van vergaderingen.
In samenwerking met verloskundigenpraktijk en Mamacafe Leiden geef ik workshops aan zwangeren en vrouwen postpartum. Deze werkzaamheden zijn onbetaald. |
Deelname aan het ontwikkelen van de richtlijn kan ervoor zorgen dat collega vaker gaan verwijzen naar mijn praktijk vanwege meer bekendheid. |
Geen |
|
Hammers |
Waarnemend huisarts Kaderhuisarts Urogyneacologie |
Lid medische adviesraad stichting Bekkenbodem4All. Onkostenvergoeding |
Ik ben de afgevaardigde vanuit de UgynHag (kaderhuisartsenartsen urogynaecologie) |
Geen |
|
Jacobs |
Gezondheidszorgpsycholoog, seksuoloog NVVS in vrijgevestigde praktijk: centrum voor psychische, relationele en seksuele gezondheid te Voorschoten. Gezondheidspsycholoog seksuoloog NVVS in deeltijd bij proctosklinkiek te Bilthoven Hoofdopleider post-big-opleiding seksuologie rino te Utrecht |
Lid van Tuchtrechtcommissietucht van de NVVS onbezoldigd. Adviseur van het bestuur van PFN onbezoldigd. Lesgeven bij diverse organisaties bv. SOMT, ZEL. (bezoldigd) |
Adviseur van het bestuur van PFN ik neem deel uit interesse voor het complexe vakgebied met als doelgroep patiëntenzorg te verbeteren. |
Geen |
|
Mulder |
Verpleegkundig specialist urologie Martini Ziekenhuis Groningen |
Lid van Adviesraad Hollister BV. |
|
Geen actie; NB (thuiszorg) hulpmiddelen worden niet besproken in de richtlijn |
|
Rezvani |
Anesthesioloog/pijnbestrijder, werkzaam in het St. Antonius ziekenhuis Nieuwegein/Utrecht in een maatschap |
Lid ledenraad NVA-sectie pijnbestrijding, onbetaald. |
|
Geen |
|
Janssen |
Arts bij Gynos vrouwenkliniek Den Haag, blaaspijn/bps-spreekuur (onderdeel van Andros klinieken)
Arts-onderzoeker, afdeling urologie, Radboudumc
|
Coördinator en docent Technische Geneeskunde Faculteit, Universiteit Twente.
- Medische adviesraad (MAR) patiëntenvereniging ICP |
Te vermelden voor openheid van zaken:
- Werkzaam in 2 medische centra (Radboudumc & Gynos vrouwenkliniek) die patiëntenzorg op dit deelgebied verlenen.
Meegeschreven aan NVU-standpunt BPS 2017 (onbetaald).
- In verleden tegen betaling eenmalig advies gegeven voor Bene Arzneimittel GMBH farmaceuticals, producent van Elmiron, medicijn voor blaaspijn syndroom.
- In 2017 tegen eenmalige vergoeding gesproken op European Association of Urology congres op gesponsorde sessie door IBSA farmaceuticals (producent GAG-therapie voor blaaspijnsyndroom)
- Eigenaar eenmanszaak dr. Dr. D.A.W. Janssen, Urology Science & Healthcare (KvK nr. 77488881). Geen bezit van patenten, geen (incl. toekomstige beloften voor) financieel gewin door participatie aan deze richtlijn commissie.
Deelname aan deze commissie zou impact kunnen hebben op mijn aanzien als klinisch professional binnen mijn vakgebied. De mate van impact kan ik niet overzien |
Geen actie; NB-blaasspoelingen worden niet besproken in de richtlijn |
|
Schweitzer |
Gynaecoloog UMC Utrecht, Bergman Clinics Hilversum vrouwenzorg |
Trainer KNOV-hechtcursus. Trainer hechtcursus Leiderdorp NVOG voor beiden ontvang ik een vergoeding |
Bij Bergman Clinics zien we patiënten met chronische pijn in buik en bekken mogelijk dat er een toename van pte gaat komen
Deelname aan deze het ontwikkelen van de richtlijn kan ervoor zorgen dat collega vaker gaan verwijzen vanwege meer bekendheid |
Geen |
|
Felt - Bersma |
MDL-arts Amsterdam UMC, locatie VUMC |
MDL-arts Proctoskliniek te Bilthoven MDL-arts MCV de Veluwe, Apeldoorn |
ROAD-studie, een studie met een medicament versus placebo ter preventie van recidief diverticulitis |
Geen |
|
Van den Bos |
1. Bekkenfysiotherapeut MSPT (Master of Specialised Physical Therapy) bij AdFysio te De Lier 0.6 fte 2. Bekkenfysiotherapeut MSPT LUMC, afd. urologie 0.2 fte onbezoldigd 3. Voorzitter BB4All (Bekkenbodem4All), vrijwilliger |
Lid MAR (Medische Advies Raad) Lichen Sclerosis Nederland: reiskostenvergoeding Lid MAR Lichen Planus Vereniging Nederland: reiskostenvergoeding Penningmeester zorggroep FEL (Fysiotherapie 1e Lijn) Zuid-Holland West: onkostenvergoeding |
Geen |
Geen |
|
Klankbordgroep |
|
|
|
|
|
Tebbe (klankbordgroep) |
Wetenschappelijk adviseur KNOV (ZZP) verloskundige |
Communicatie + tekstschrijver (ZZP) |
Geen |
Geen |
|
Andriesse (klankbordgroep) |
Voorzitter van de Interstitiële cystitis vereniging, ICP |
Ik ben vrijwilliger niet betaald |
Geen |
Geen |
|
Consten (klankbordgroep) |
chirurg, meander medisch centrum MMC en hoogleraar universitair medisch centrum Groningen UMCG in de chirurgie aandachtsgebied robotica en computer geassisteerde chirurgie |
voorzitter werkgroep coloproctologie opleideer heelkunde mmc |
arts in tertiair bekkenbodem centrum van het meander medisch centrum te Amersfoort |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door middel van een afgevaardigde patiëntenvereniging in de werkgroep en in de klankbordgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen. Er zijn geen indicatoren ontwikkeld bij deze richtlijn.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende partijen/vertegenwoordigers van relevante stakeholders via een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Per uitgangsvraag werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen in de bijlagen.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld bij deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Kennisinstituut van de Federatie Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Utrecht, 2015.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/werkwijze/richtlijnen_3_0.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E.,... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Ovid Medline
1 exp pelvic pain/ or dysmenorrhea/ or pelvic girdle pain/ or piriformis muscle syndrome/ or Pelvic Floor Disorders/ or pudendal Neuralgia/ (9507)
2 ((pelvic or pelvis or pudendal) adj3 (pain* or syndrome or neuralgia or myalgia)).ti,ab,kf. (10481)
3 ((prostatitis or prostate or "levator ani" or constipation or puborectalis) adj3 (neuralgia* or pain* or sydrome* or spasm*)).ti,ab,kf. (2731)
4 (prostatalgia or prostatodynia or orchialgia or dyssynergia or Coccydynia or coccygodynia or proctalgia or vestibulodynia or dysmenorrhea* or dysmenorrhoea or vulvodynia or Dyspareunia or "Pyriformis syndrome").ti,ab,kf. (11482)
5 ((bladder or testicular or urethral or scrotal or groin or epididymal or "post vasectom*" or genital or coccyx or sacrococcygeal or anal or anorectal or vestibular or vulvar or "Fissure in Ano" or perineal) adj3 pain*).ti,ab,kf. (8623)
6 (((interstitial or recurrent) adj2 (cystitides or cystitis)) or ((suprapubic or abdominal or endometriosis) adj3 (neuralgia* or pain*))).ti,ab,kf. (61213)
7 ((proctitis or defecation or hemorrhoid* or haemorrhoid*or diverticulitis or PID or "pelvic inflammatory disease*") adj3 (neuralgia* or pain*)).ti,ab,kf. (851)
8 ((voiding or prostat* or menstrual or menstruation or childbirth or vaginal or vulvar or urethral or "cauda equina") adj3 (neuralgia* or pain*)).ti,ab,kf. (5104)
9 ("pelvic floor" adj3 (overactivity or dysfunction or "resting tone" or hypertonicity)).ti,ab,kf. (1025)
10 or/1-9 (91351)
11 exp Chronic Disease/ or (chronic or chronically or persistent or constant* or continuing or sustained or lasting or refractory or refractories or ((interstitial or recurrent) adj2 (cystitides or cystitis))).ti,ab,kf. or Chronic Pain/ (2181918)
12 10 and 11 (22388)
13 (Groin/ or exp Testicular Diseases/ or Scrotum/ or Pelvic Floor/) and Chronic Pain/ (140)
14 12 or 13 (22412)
15 exp Serotonin Uptake Inhibitors/ or (ssri or serotonin reuptake inhibitor or serotonin specific reuptake inhibitor* or serotonin uptake inhibitor*).ti,ab,kf. (43738)
16 exp Antidepressive Agents, Tricyclic/ or tricyclic antidepress*.ti,ab,kf. (34938)
17 exp Cannabinoids/ or cannabinoid*.ti,ab,kf. (23780)
18 exp Palmitic Acids/ or (impulsin or palmidrol or palmitoylethanolamide).ti,ab,kf. (15154)
19 exp Gabapentin/ or (ci 945 or ci945 or dineurin or gabalept or gabaliquid geriasan or gabapentin or gabatin or gantin or go 3450 or go3450 or goe 3450 or goe3450 or gralise or kaptin or keneil or neurontin or neurotonin or nupentin).ti,ab,kf. (6612)
20 Pregabalin/ or (3 aminomethyl 5 methylhexanoic acid or 3 isobutyl 4 aminobutyric acid or 3 isobutyl gaba or 3 isobutylgaba or 4 amino 3 isobutylbutyric acid or ci 1008 or ci1008 or lyrica or lyrica cr or pd 144723 or pd144723 or pregabalin).ti,ab,kf. (3687)
21 exp Analgesics, Opioid/ or (opiate antagonist or opiate receptor antagonist or opiate receptor blocker or opiate receptor blocking agent or opioid antagonist or opioid receptor antagonist or opioid receptor blocker or opioid receptor blocking agent).ti,ab,kf. (116272)
22 Ketamine/ or (ketamin* or esketamin* or ketanest s or vesierra).ti,ab,kf. (18905)
23 exp Tapentadol/ or (bn 200 or bn200 or cg 5503 or cg5503 or nucynta or palexia or palexias or tapentadol or yantil).ti,ab,kf. (469)
24 or/15-23 (247516)
25 14 and 24 (579)
26 limit 25 to yr="1999 -Current" (500)
27 limit 26 to english language (458)
28 "15247722".mp. (mp=title, abstract, original title, name of substance word, subject heading word, floating sub-heading word, keyword heading word, organism supplementary concept word, protocol supplementary concept word, rare disease supplementary concept word, unique identifier, synonyms) (1)
29 27 and 28 (1)
30 ((meta-analysis/ or meta-analysis as topic/ or (metaanaly* or metanaly* or meta-analy* or meta synthes* or metasynthes* or (pooled adj3 analysis)).ti,ab,kf. or ((systematic* or scoping or evidence based) adj3 (review* or overview*)).ti,ab,kf. or ((evidence or research) adj3 synthesis).ti,kf. or systematic review.pt. or (prisma or (("structured literature" or comprehensive or "quantitative literature" or evidence-based) adj2 (search or review)) or "systematic search" or ((systemic or systematized) adj3 review) or "systematic research synthesis" or (review* adj3 independent*))).ti,ab,kf. or (((quantitative or rapid or short or critical* or structured or comparative or comparitive or evidence or comprehensive) adj3 (review* or overview*)).ti. and search.ab.) or "Review Literature as Topic"/ or cochrane.jw. or (cochrane or embase or medline or cinahl or cinhal or cancerlit).ab. or (("selection criteria" or "data extraction").ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (335799)
31 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1873255)
32 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (3214241)
33 27 and 30 (26)
34 27 and 31 (125)
35 27 and 32 (110)
Embase
|
No. |
Query |
Results |
|
#21 |
#15 AND #18 |
141 |
|
#20 |
#14 AND #18 |
347 |
|
#19 |
#13 AND #18 |
89 |
|
#18 |
#17 NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
955 |
|
#17 |
#16 NOT ('conference abstract':it OR 'conference paper':it) |
987 |
|
#16 |
#12 AND (1-1-1999)/sd |
1004 |
|
#15 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (studyOR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
4819150 |
|
#14 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2257217 |
|
#13 |
('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
438791 |
|
#12 |
#10 AND #11 |
1072 |
|
#11 |
(('pelvic pain'/exp/mj OR 'dysmenorrhea'/exp/mj OR 'pelvic girdle pain'/exp/mj OR 'piriformis syndrome'/exp/mj OR 'pelvic floor disorder'/exp/mj OR 'pudendal neuralgia'/exp/mj OR (((pelvic OR pelvis OR pudendal) NEAR/3 (pain* OR syndrome OR neuralgia OR myalgia)):ti,ab) OR (((prostatitis OR prostate OR 'levator ani' OR constipation OR puborectalis) NEAR/3 (neuralgia* OR pain* OR sydrome* OR spasm*)):ti,ab) OR prostatalgia:ti,ab OR prostatodynia:ti,ab OR orchialgia:ti,ab OR dyssynergia:ti,ab OR coccydynia:ti,ab OR coccygodynia:ti,ab OR proctalgia:ti,ab OR vestibulodynia:ti,ab OR dysmenorrhea*:ti,ab OR dysmenorrhoea:ti,ab OR vulvodynia:ti,ab OR dyspareunia:ti,ab OR 'pyriformis syndrome*':ti,ab OR (((bladder OR testicular OR urethral OR scrotal OR groin OR epididymal OR 'post vasectom*' OR genital OR coccyx OR sacrococcygeal OR anal OR anorectal OR vestibular OR vulvar OR 'fissure in ano' OR perineal) NEAR/3 pain*):ti,ab) OR (((suprapubic OR abdominal OR endometriosis) NEAR/3 (neuralgia* OR pain*)):ti,ab) OR (((voiding OR prostat* OR menstrual OR menstruation OR childbirth OR vaginal OR vulvar OR urethral OR 'cauda equina') NEAR/3 (neuralgia* OR pain*)):ti,ab) OR (('pelvic floor' NEAR/3 (overactivity OR dysfunction OR 'resting tone' OR hypertonicity)):ti,ab) OR (((proctitis OR defecation OR hemorrhoid* OR haemorrhoid* OR diverticulitis OR pid OR 'pelvic inflammatory disease*') NEAR/3 (neuralgia* OR pain*)):ti,ab)) AND ('chronic disease'/exp OR 'chronic pain'/exp OR (((interstitial OR recurrent) NEAR/2 (cystitides OR cystitis)):ti,ab) OR 'chronic inflammatory pain'/exp OR chronic:ti,ab OR chronically:ti,ab OR persistent:ti,ab OR constant*:ti,ab OR continuing:ti,ab OR sustained:ti,ab OR lasting:ti,ab OR refractor*:ti,ab) OR (('inguinal region'/exp/mj OR 'testis disease'/exp/mj OR 'pelvis floor'/exp/mj) AND 'chronic pain'/exp) OR 'chronic scrotal pain'/exp) AND (english)/lim AND ((embase)/lim OR (pubmed-not-medline)/lim) NOT 'conference abstract':it |
16347 |
|
#10 |
#1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9 |
434162 |
|
#9 |
'tapentadol'/exp OR 'bn 200':ti,ab OR 'bn200':ti,ab OR 'cg 5503':ti,ab OR 'cg5503':ti,ab OR 'nucynta*':ti,ab OR 'palexia*':ti,ab OR 'tapentadol':ti,ab OR 'yantil':ti,ab |
1432 |
|
#8 |
'esketamine'/exp OR esketamin*:ti,ab,kw |
428 |
|
#7 |
'opiate antagonist'/exp OR 'opiate antagonist':ti,ab,kw OR 'opiate receptor antagonist':ti,ab,kw OR 'opiate receptor blocker':ti,ab,kw OR 'opiate receptor blocking agent':ti,ab,kw OR 'opioid antagonist':ti,ab,kw OR 'opioid receptor antagonist':ti,ab,kw OR 'opioid receptor blocker':ti,ab,kw OR 'opioid receptor blocking agent':ti,ab,kw |
93894 |
|
#6 |
'pregabalin'/exp OR '3 aminomethyl 5 methylhexanoic acid':ti,ab,kw OR '3 isobutyl 4 aminobutyric acid':ti,ab,kw OR '3 isobutyl gaba':ti,ab,kw OR '3 isobutylgaba':ti,ab,kw OR '4 amino 3 isobutylbutyric acid':ti,ab,kw OR 'ci 1008':ti,ab,kw OR 'ci1008':ti,ab,kw OR 'lyrica':ti,ab,kw OR 'lyrica cr':ti,ab,kw OR 'pd 144723':ti,ab,kw OR 'pd144723':ti,ab,kw OR 'pregabalin':ti,ab,kw |
13196 |
|
#5 |
'gabapentin'/exp OR 'ci 945':ti,ab,kw OR 'ci945':ti,ab,kw OR 'dineurin':ti,ab,kw OR 'gabalept':ti,ab,kw OR 'gabaliquid geriasan':ti,ab,kw OR 'gabapentin':ti,ab,kw OR 'gabatin':ti,ab,kw OR 'gantin':ti,ab,kw OR 'go 3450':ti,ab,kw OR 'go3450':ti,ab,kw OR 'goe 3450':ti,ab,kw OR 'goe3450':ti,ab,kw OR 'gralise':ti,ab,kw OR 'kaptin':ti,ab,kw OR 'keneil':ti,ab,kw OR 'neurontin':ti,ab,kw OR 'neurotonin':ti,ab,kw OR 'nupentin':ti,ab,kw |
29290 |
|
#4 |
'palmidrol'/exp OR 'impulsin':ti,ab,kw OR 'palmidrol':ti,ab,kw OR 'palmitoylethanolamide':ti,ab,kw OR 'n palmitoylethanolamine':ti,ab,kw |
1316 |
|
#3 |
'cannabinoid'/exp OR cannabinoid*:ti,ab,kw |
69629 |
|
#2 |
'tricyclic antidepressant agent'/exp OR 'tricyclic antidepressant*':ti,ab,kw OR 'tricyclic antidepressive agent*':ti,ab,kw |
113251 |
|
#1 |
'serotonin uptake inhibitor'/exp OR 'ssri':ti,ab,kw OR 'selective serotonin reuptake inhibitor*':ti,ab,kw OR 'serotonin reuptake inhibitor*':ti,ab,kw OR 'serotonin specific reuptake inhibitor*':ti,ab,kw OR 'serotonin uptake inhibitor*':ti,ab,kw |
248853 |
