Botuline toxine injecties bij chronische bekkenpijn
Uitgangsvraag
Wat is waarde van botulinetoxine injecties in de behandeling van patiënten met chronische bekkenpijn?
Aanbeveling
Overweeg een behandeling met intradetrusor botuline toxine A (BTX-A) bij patiënten met chronische bekkenpijn die blaaspijnsyndroom/ interstitiële cystitis hebben waarbij alle conservatieve therapieën niet succesvol zijn geweest.
Indien een behandeling met intradetrusor BTX-A-injecties overwogen wordt, dient het individuele risico op complicaties zoals de kans op een urineretentie en urineweginfecties te worden meegenomen in de indicatiestelling.
Overweeg BTX-A-injecties op andere locaties, zoals prostaat, anale sfincter (met uitzondering van fissura ani), pelvic floor trigger points, puboprectalis en/of pubococcygeus spieren alleen in studieverband.
Volg voor behandeling met botulinetoxine bij anale pijn ten gevolge van fissura ani de richtlijn Proctologie (zie de module Fissura ani in de richtlijn Protocologie).
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Botulinetoxine injecties in de blaas
Op basis van de beschikbare literatuur is het onduidelijk wat het effect van botulinetoxine injecties in de blaas is op de pijnintensiteit 1 maand na behandeling. De bewijskracht is gegradeerd als ‘zeer laag’ vanwege beperkingen in de onderzoeksopzet, inconsistentie en imprecisie. Drie maanden na behandeling lijkt het erop dat botulinetoxine injecties in de blaas de pijnintensiteit verminderen bij patiënten met interstitiële cystitis en/of blaaspijnsyndroom, vergeleken met placebo. De bewijskracht voor de uitkomstmaat pijnintensiteit 3 maanden na behandeling is gegradeerd als ‘laag’, vanwege beperkingen in de onderzoeksopzet en omdat het betrouwbaarheidsinterval van het gepoolde effect overlapt de grens van klinische relevantie (imprecisie).
Het is onduidelijk wat het effect is op de kwaliteit van leven 1 maand na behandeling, de bewijskracht is gegradeerd als ‘zeer laag’ vanwege beperkingen in de onderzoeksopzet en imprecisie. Het is onbekend wat het effect van botulinetoxine injecties in de blaas bij patiënten met chronische bekkenpijn is voor de belangrijke uitkomstmaten patiënttevredenheid en complicaties. De overall bewijskracht is gelijk aan de laagst gevonden bewijskracht voor de cruciale uitkomstmaat pijnintensiteit. De overall bewijskracht voor botulinetoxine injecties in de blaas komt hiermee uit op ‘laag’.
Behandeling met botulinetoxine injecties bij patiënten met blaaspijnsyndroom/interstitiële cystitis zou overwogen kunnen worden wanneer alle conservatieve therapieën ineffectief zijn gebleken.
Botulinetoxine injecties in de prostaat
Op basis van de beschikbare literatuur komt naar voren dat 1, 3 en 6 maanden na botulinetoxine injecties in de prostaat de pijnintensiteit waarschijnlijk vermindert en de kwaliteit van leven verbetert bij mannen met chronische prostatitis en/of chronische bekkenpijn, vergeleken met placebo. De bewijskracht voor de uitkomstmaten pijnintensiteit en complicaties is gegradeerd als ‘redelijk’ vanwege imprecisie (beperkt aantal geïncludeerde patiënten). Het is onbekend wat het effect van botulinetoxine injecties in de prostaat bij patiënten met chronische bekkenpijn is voor de belangrijke uitkomstmaten patiënttevredenheid en complicaties. De overall bewijskracht is gelijk aan de laagst gevonden bewijskracht voor de cruciale uitkomstmaat pijnintensiteit. De overall bewijskracht voor botulinetoxine injecties in de prostaat komt hiermee uit op ‘redelijk’.
Omdat er in Nederland weinig ervaring is botulinetoxine injecties in de prostaat bij chronische bekkenpijn wordt deze toepassing alleen in studieverband geadviseerd.
Botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren
Op basis van de beschikbare literatuur is het onbekend wat het effect van botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren voor de cruciale uitkomstmaat pijnintensiteit, en de belangrijke uitkomstmaten patiënttevredenheid, complicaties en kwaliteit van leven. De bewijskracht kon niet worden gegradeerd doordat er geen studies werden gevonden waarin botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren werden bestudeerd bij patiënten met chronische bekkenpijn. De overall bewijskracht voor botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren kon niet worden bepaald.
Omdat er in Nederland weinig ervaring is met botulinetoxine injecties in andere locaties bij chronische bekkenpijn, zoals in de anale sfincter (met uitzondering van fissura ani), pelvic floor trigger points, puborectalis en/of pubococcygeus spieren wordt deze toepassing alleen in studieverband geadviseerd. Voor botulinetoxine behandeling bij anale pijn ten gevolge van fissura ani wordt geadviseerd de richtlijn Procotologie te volgen (zie de module Fissura ani in de richtlijn Protocologie).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voorafgaand aan een behandeling met BTX-A moet de patiënt worden geïnformeerd over de mogelijke complicaties van de intradetrusor BTX-A-injecties. Een van de mogelijke complicaties die negatief effect kan hebben op kwaliteit van leven is residu na mictie, bacteriurie en urineweginfecties en het tijdelijk moeten katheteriseren.
Het aanleren van zelf-katheterisatie voorafgaand aan de behandeling kan worden overwogen om een weloverwogen keuze om wel of niet een BTX-A-behandeling te willen ondergaan.
Kosten (middelenbeslag)
Er zijn geen studies bekend over kosteneffectiviteit voor BTX-A-behandeling bij patiënten met chronische bekkenpijn.
Aanvaardbaarheid voor de overige relevante stakeholders
Het is onbekend of er bezwaren zijn van relevante stakeholders.
Haalbaarheid en implementatie
De heterogeniteit van de patiëntengroep met chronische bekkenpijn maken de groep patiënten groot en complex wat betreffende toepassingen van botuline toxine A (BTX-A) injecties. BTX-A wordt in veel klinieken voor verschillende indicaties toegepast. Daarmee is er alleen opschaling nodig om het benodigde aantal behandelingen te kunnen doen.
Rationale/ balans tussen de argumenten voor en tegen de interventie
De behandeling van CBP is door de complexe, multifactoriële pathogenese moeilijk. Het gebrek aan duidelijk bewijs voor welke behandeling dan ook maakt dat botuline toxine A (BTX-A) te overwegen is bij patiënten met chronische bekkenpijn. Als wordt gekeken naar de huidige bewijslast, dan is er alleen een aanbeveling te doen voor BTX-A-injecties voor patiëntengroep met blaaspijnsyndroom/ interstitiële cystitis en voor chronisch prostaatpijn syndroom.
Met name voor intradetrusor BTX-A-injecties dient te worden afgewogen wat het individuele risico is op urineretentie en urineweginfecties.
Onderbouwing
Achtergrond
De behandeling van patiënten met chronisch bekkenpijn is lastig omdat de oorzaak vaak niet bekend is. Omdat de klachten een enorme impact kunnen hebben op kwaliteit van leven worden veel behandelingen geprobeerd. De pathogenese van chronisch bekkenpijn is complex en multifactorieel, dit heeft geresulteerd in afwezigheid van een gestructureerde behandelstrategie. Er worden verschillende therapieën ingezet en soms combinaties van therapieën waarbij de vraag is of er ruimte is voor alle therapieën die op dit moment voor handen zijn. Botuline toxine A (BTX-A) wordt in de urologie onder andere gebruikt voor patiënten met een overactieve blaas, en voor blaaspijnsyndroom/ interstitiële cystitis en chronisch prostaatpijn syndroom. BTX-A-injecties worden verder ook toegepast bij andere aandoeningen die chronische bekkenpijn veroorzaken zoals chronisch anaal pijnsyndroom, hypertone bekkenbodem en trigger points in de bekkenbodemmusculatuur.
Conclusies / Summary of Findings
Botulinetoxine injecties in de blaas
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van botulinetoxine injecties in de blaas op pijnintensiteit 1 maand na behandeling bij patiënten met interstitiële cystitis en/of blaaspijnsyndroom.
Bronnen: (Akiyama, 2015; Pinto, 2018) |
|
Laag GRADE |
Botulinetoxine injecties in de blaas lijken de pijnintensiteit 3 maanden na behandeling enigszins te kunnen verminderen bij patiënten met interstitiële cystitis en/of blaaspijnsyndroom.
Bronnen: (Gottsch, 2011; Kaysan, 2012; Kuo, 2009; Kuo, 2015; Manning, 2014; Pinto, 2018) |
|
- GRADE |
Het is onbekend wat het effect is van botulinetoxine injecties in de blaas op de patiënttevredenheid en het vóórkomen van complicaties bij patiënten met chronische bekkenpijn. |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van botulinetoxine injecties in blaas op kwaliteit van leven 1 maand na behandeling bij patiënten met interstitiële cystitis.
Bronnen: (Akiyama, 2015). |
Botulinetoxine injecties in de prostaat
|
Redelijk GRADE |
Bij mannen met chronische prostatitis en/of chronische bekkenpijnsyndroom verminderen botuline toxine A (BTX-A) injecties in de prostaat waarschijnlijk de pijnintensiteit 1, 3 en 6 maanden na behandeling.
Bronnen: (Falahatkar, 2015) |
|
- GRADE |
Het is onbekend wat het effect is van botulinetoxine injecties in de prostaat op de patiënttevredenheid en het vóórkomen van complicaties bij patiënten met chronische bekkenpijn. |
|
Redelijk GRADE |
Bij mannen met chronische prostatitis en/of chronische bekkenpijnsyndroom verbeteren botuline toxine A (BTX-A) injecties in de prostaat waarschijnlijk de kwaliteit van leven 1, 3 en 6 maanden na behandeling.
Bronnen: (Falahatkar, 2015) |
Botuline toxine injecties in de pelvic floor trigger points, puborectalis en/of pubococcygeus spieren
|
- GRADE |
Het is onbekend wat het effect is van botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren op de pijnintensiteit, patiënttevredenheid, complicaties en kwaliteit van leven bij patiënten met chronische bekkenpijn. |
Samenvatting literatuur
Beschrijving studies
In totaal werd één systematische review en meta-analyse (Shim, 2016) en werden drie losse RCT’s (Akiyama, 2015; Falahatkar, 2015; Pinto, 2018) opgenomen in de literatuuranalyse. Drie studies beschreven botulinetoxine injecties in de blaas (Akiyama, 2015; Shim, 2016; Pinto, 2018) en één studie beschreef botuline toxine A (BTX-A) injecties in de prostaat (Falahatkar, 2015). Er werden geen studies geïncludeerd waarin botulinetoxine injecties in de pelvic floor trigger points, puborectalis en/of pubococcygeus spieren werden bestudeerd.
Shim (2016) voerde een systematische review en meta-analyse uit naar de effectiviteit en veiligheid van intradetrusor botuline toxine A (BTX-A) bij patiënten met IC of BPS werd vergeleken met een placebo. De search werd verricht in 2015 (exacte datum onbekend) in de databases MEDLINE, Embase, Cochrane Library en in the Prostatic Diseases and Urologic Malignancies Groups specialized registry. Er werden in totaal 5 RCT’s geïncludeerd (Gottsch, 2011; Kasyan, 2009; Kuo, 2009; Kuo, 2015; Manning, 2014).
In totaal werden 229 patiënten beschreven die een intradetrusor BTX-A-injectie of placebo kregen voor de behandeling van IC/BPS. De meeste patiënten waren vrouwen en alle patiënten hadden hardnekkige klachten waarbij conventionele behandeling eerder gefaald had. De duur van de pijnklachten werd niet gerapporteerd door Shim (2016). Alle studies beschreven de resultaten 12 weken na behandeling, behalve Kuo (2015) na 8 weken. Tabel 1 beschrijft een beknopt overzicht van de vergeleken behandelingen. Voor een uitgebreid overzicht van de behandelingen wordt verwezen naar de bijgevoegde evidence tabellen.
Akiyama (2015) beschreef een RCT waarin patiënten met therapieresistente interstitiële cystitis werden behandeld met BTX-A 100 U injecties in de blaas. Inclusiecriteria betrof patiënten met een minimale pijnscore van 4 op een VAS-schaal (0 tot 10), een minimale score van 6 op de O’Leary and Sant’s symptoom- en probleemindex (OSSI/OSPI) en patiënten rapporteerden nog steeds klachten, ondanks minimaal één eerdere hydrodistensie en medicamenteuze behandeling. In totaal werden 34 patiënten geïncludeerd: de interventiegroep kreeg meteen de behandeling (n=18; 4 mannen, 14 vrouwen; gemiddelde leeftijd 64,3 jaar (SD 13,2 jaar)), de controlegroep kreeg geen behandeling op baseline, maar kreeg één maand later dezelfde behandeling (n=16; 4 mannen, 12 vrouwen; gemiddelde leeftijd 65,6 jaar (SD 14,5)). Tijdens de BTX-A-injectie werd hydrodistensie zo veel mogelijk vermeden. Gemiddelde duur van interstitiële cystitis was 6,2 jaar (SD 3,9) in de interventiegroep en 7,1 jaar (SD 4,9) in de controlegroep.
Falahatkar (2015) beschreef een dubbelblind, placebogecontroleerde RCT waarin mannen met chronische prostatitis en/of chronische bekkenpijnsyndroom werden behandeld met transurethrale intraprostatische BTX-A-injecties. Inclusiecriteria betrof mannen met een klinische diagnose chronische prostatitis en/of chronische bekkenpijnsyndroom, waarbij 4 tot 6 weken behandeling met fluoroquinolones, α-blokkers, anti-inflammatoire medicijnen en spierontspanners eerder geen effect had. Daarnaast hadden alle mannen een geaggregeerde score van ≥ 10 op de pijn- en urineweg symptomen schaal en een score van ≥ 8 op de subschaal pijn van de National Health Institute - Chronic Prostatitis Symptom Index (NIH-CPSI) vragenlijst. In totaal werden 60 patiënten geïncludeerd: de interventiegroep kreeg een behandeling met botulinum toxine type A (< 100 IU voor prostaatvolume < 30 mL; 200 IU voor prostaatvolume 30 tot 60 mL) (n=30; gemiddelde leeftijd 42,7 jaar (SD 11,2)). De controlegroep (n=30; gemiddelde leeftijd 38,2 jaar (SD 11,8)) ontving een injectie met 2 mL zoutoplossing. Gemiddelde duur van de klachten werd niet gerapporteerd. Er werden geen verschillen op baseline gerapporteerd, behalve dat de baseline kwaliteit van leven score hoger was in de interventiegroep dan de controlegroep.
Pinto (2018) beschreef een dubbelblind, placebogecontroleerde RCT waarin vrouwen met blaaspijnsyndroom en/of interstitiële cystitis werden behandeld met intratrigonale onabotulinum toxine A injecties van de blaas. Inclusiecriteria betrof vrouwen 18 tot 60 jaar met > 6 maanden blaaspijnsyndroom en/of interstitiële cystitis, met pijnklachten > 4 op een VAS-schaal (0 tot 10, geen tot maximale pijn). Eerdere behandeling had geen effect. In totaal werden 21 patiënten geïncludeerd, 2 patiënten werden na afloop alsnog geëxcludeerd (1 uit de interventie-, 1 uit de controlegroep). Eén vrouw werd geëxcludeerd omdat ze > 60 jaar was en één vrouw omdat ze 20 jaar eerder een operatie aan het bekken bleek te hebben gehad. Het was onduidelijk in welke groepen deze vrouwen zaten en het was onduidelijk waarom dit niet bekend was vóór de interventie werd gestart. In totaal werden 19 patiënten geanalyseerd: de interventiegroep kreeg 10 keer een 10 U intratrigonale onabotulinum toxine A injecties van de blaas (n=10; gemiddelde leeftijd 44,3 (SD 9,9)). De controlegroep kreeg 10 keer een injectie met 1 mL 0,9% zoutoplossing (n=9; gemiddelde leeftijd 47,4 (SD 11,1)). Gemiddelde duur van de klachten was 8,6 jaar (SD 8,4) in de interventiegroep, en 7 jaar (SD 3,6) in de controlegroep. Er werden geen verschillen op baseline gerapporteerd. Dit betrof een door de industrie gesponsorde studie.
Tabel 1 Beknopte beschrijving interventie en controle geïncludeerde studies in Shim (2016)
|
Auteur (jaartal) |
Patiëntpopulatie |
Interventie (n) |
Controle (n) |
|
Gottsch (2011) |
Vrouwen met hardnekkige pijn in het bekken van de blaas, urethra, vagina, perineum en/of blaas. |
Onabotulinum toxine 50 U (n=9) |
2 cm3 zoutoplossing (n=11) |
|
Kuo (2009) |
Voornamelijk vrouwen (84%) met IC/BPS die eerder geen baat hadden bij conventionele behandeling. |
Groep 1: Onabotulinum toxine 200 U (n=15) Groep 2: Onabotulinum toxin 100 U (n=29) |
Cystoscopische hydrodistensie van de blaas |
|
Manning (2014) |
Vrouwen met langdurige, hardnekkige IC/BPS die eerder geen baat hadden bij conventionele behandeling. |
Abobotulinum toxine 500 U (aangenomen werd dat dit gelijk was aan onabotulinum toxine 200 U) |
30 mL zoutoplossing |
|
Kuo (2015) |
Voornamelijk vrouwen (87%) met IC/BPS die in de afgelopen 6 maanden geen baat hadden bij conventionele behandeling. |
Onabotulinum toxine 100 U |
Zoutoplossing (mL onbekend) gevolgd door cystoscopische hydrodistensie van de blaas |
|
Kasyan (2012) |
Vrouwen met BPS/IC. |
Onabotulinum toxin 100 U |
Standaard hydrodistensie van de blaas |
Afkortingen: BPS: blaaspijnsyndroom; IC: interstitiële cystitis.
Resultaten
In totaal werd één systematische review en meta-analyse (Shim, 2016) en werden drie losse RCT’s (Akiyama, 2015; Falahatkar, 2015; Pinto, 2018) opgenomen in de literatuuranalyse. Drie studies beschreven botulinetoxine injecties in de blaas (Akiyama, 2015; Shim, 2016; Pinto, 2018) en één studie beschreef botuline toxine A (BTX-A) injecties in de prostaat (Falahatkar, 2015). Er werden geen studies geïncludeerd waarin botulinetoxine injecties in de pelvic floor trigger points, puborectalis en/of pubococcygeus spieren werden bestudeerd.
De resultaten uit de studies worden hieronder beschreven per uitkomstmaat, gestratificeerd voor de locatie van de injectie (blaas en prostaat). Resultaten worden zo veel mogelijk gepoold in een meta-analyse, met subgroep analyses voor de dosering van de injectie.
1. Pijnintensiteit
1.1 Botulinetoxine injecties in de blaas
Zeven studies beschreven de uitkomstmaat pijnintensiteit na botulinetoxine injecties in de blaas (Akiyama, 2015; Gottsch, 2011; Kaysan, 2012; Kuo, 2009; Kuo, 2015; Manning, 2014; Pinto, 2018). Twee studies beschreven het effect na 1 maand (Akiyama, 2015; Pinto, 2018), één studie na 8 weken (Pinto, 2018) en zes studies rapporteerden na 3 maanden (Gottsch, 2011; Kaysan, 2012; Kuo, 2009; Kuo, 2015; Manning, 2014; Pinto, 2018). In alle studies werd de gemiddelde pijnscore gerapporteerd op basis van een VAS-schaal van 0 tot 10, geen tot maximale pijn.
Akiyama (2015) rapporteerde dat het gemiddelde verschil in pijnscore één maand na behandeling -2,1 (95%BI -3,48 tot -0,72) was, vergeleken tussen patiënten die met BTX-A (n=18) of placebo (n=16) werden behandeld. Pinto (2018) rapporteerde dat er niet-significante verschillen één maand post-injectie werden gezien, maar rapporteerde niet het daadwerkelijke gemiddelde verschil tussen de groepen.
Daarnaast rapporteerde Pinto (2018) ook dat er niet-significante verschillen 8 weken post-injectie werden gezien, maar rapporteerde niet het daadwerkelijke gemiddelde verschil tussen de groepen.
Figuur 1 presenteert het gepoolde, gewogen gemiddelde verschil in de pijnintensiteit tussen patiënten die met botulinetoxine injecties dan wel placebo werden behandeld. De overall verbetering in pijnscore na behandeling met botulinetoxine injecties was -1,50 (95% BI -2,13 tot -0,87). Subgroepanalyses van de dosering van de injectie (50, 100 en 200 U) lieten allen een effect in dezelfde richting zien.
Figuur 1 Forest plot uitkomstmaat ‘pijnintensiteit na 3 maanden’ op basis van het gewogen gemiddelde verschil tussen de interventie en controlegroep bij de behandeling door middel van botulinetoxine injecties
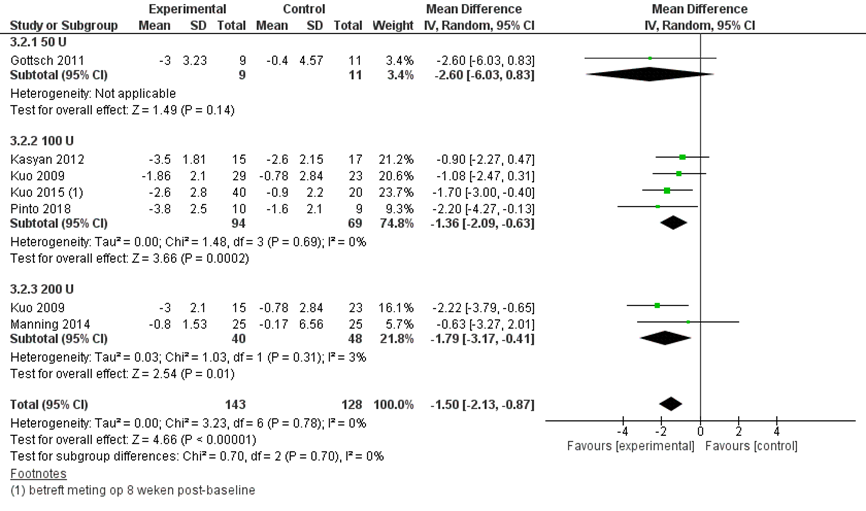
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
1.2 Botulinetoxine injecties in de prostaat
Eén studie rapporteerde de uitkomstmaat pijnintensiteit 1, 3 en 6 maanden na BTX-A-injecties in de prostaat (Falahatkar, 2015). De gemiddelde pijnscore werd gerapporteerd op basis van een VAS-schaal van 0 tot 10, geen tot maximale pijn.
Falahatkar (2015) rapporteerde het gemiddelde verschil in pijnscore na BTX-A-injecties in de prostaat (n=30) vergeleken met een placebo (n=30) op 1, 3 en 6 maanden post-injectie. Gemiddeld verschil in pijnscore na 1 maand was -5,20 (95%BI -5,40 tot -5,00), 3 maanden: -6,13 (95%BI -6,34 tot -5,93); 6 maanden: -7,00 (95%BI -7,19 tot -6,81).
1.3 Botuline toxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren
Er werden geen studies geïncludeerd waarin botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren werden bestudeerd bij patiënten met chronische bekkenpijn.
2. Patiënttevredenheid
Er werden geen studies geïncludeerd waarin de uitkomstmaat patiënttevredenheid werd beschreven na botulinetoxine injecties in de blaas, prostaat, pelvic floor trigger points, puborectalis en/of pubococcygeus spieren.
3 Complicaties
3.1 Botulinetoxine injecties in de blaas
Vier studies rapporteerden complicaties (Akiyama, 2015; Kuo, 2009; Kuo, 2015; Pinto, 2018). De resultaten worden hieronder beschrijvend gepresenteerd.
Tabel 2 presenteert het vóórkomen van adverse events in de studies van Kuo (2009) en Kuo (2015) tezamen. Dysurie kwam significant vaker voor na BTX-A-injecties dan placebo (31 versus 5%; P=0,001). Andere complicaties kwamen vaker voor in de interventiegroep, maar hierin werd geen statistisch verschil gezien.
Tabel 2 Overzicht complicaties na BTX-A-injecties van de blaas, zoals gerapporteerd in Shim (2016) door Kuo (2009) en Kuo (2015)
|
Complicatie |
Interventiegroep (n=84) |
Controlegroep (n=43) |
P-waarde |
|
Hematurie |
3 (3,6%) |
0 |
0,55 |
|
Urineweginfectie |
5 (6%) |
0 |
0,166 |
|
Dysurie |
26 (31%) |
2 (4,7%) |
0,001 |
|
Groot post-void residual volume |
7 (8,3%) |
0 |
0,094 |
|
Urineretentie |
6 (7,1%) |
0 |
0,095 |
Akiyama (2015) rapporteerde dat er geen complicaties ernstiger dan graad III van de Clavien Classificatie van Chirurgische Complicaties werden gezien. Problemen met het legen van de blaas werden gerapporteerd bij 10 van de 34 (29%) patiënten: na 1 week (n=1), na 1 maand (n=5), na 2 maanden (n=3), na 3 maanden (n=1). In totaal hadden 3 patiënten (9%) een post-void residual volume van > 100 ml in de eerste 2 maanden, dit verdween spontaan zonder intermitterend katheteriseren. Daarnaast rapporteerde één patiënt (3%) macroscopische hematurie na 2 weken, wat spontaan verdween zonder interventies. Tot slot rapporteerden 2 patiënten (6%) symptomatische afebriele urineweginfecties na 1 maand, wat met antibiotica werd behandeld.
Pinto (2018) rapporteerde dat alle adverse events graad 1 Clavien-Dindo waren. Vijf patiënten (onduidelijk welke groep) kregen een urineweginfectie tussen week 4 en 12 van de behandeling. Alle patiënten waren symptomatisch en reageerden goed op behandeling met antibiotica. Er waren geen patiënten met urinewegretentie.
3.2 Botulinetoxine injecties in de prostaat
Eén studie beschreef het vóórkomen van complicaties na BTX-A-injecties van de blaas (Falahatkar, 2015). De resultaten worden beschrijvend gepresenteerd.
Falahatkar (2015) rapporteerde geen grote systemische of lokale complicaties. Er werd in twee patiënten in de interventiegroep (7%) milde macroscopische hematurie < 6 uur gerapporteerd, welke conservatief werd behandeld.
3.3 Botuline toxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren
Er werden geen studies geïncludeerd waarin botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren werden bestudeerd bij patiënten met chronische bekkenpijn.
4. Kwaliteit van leven
4.1 Botulinetoxine injecties in de blaas
Twee studies beschreven de uitkomstmaat kwaliteit van leven na botulinetoxine injecties in de blaas (Akiyama, 2015; Pinto, 2018). Akiyama (2015) rapporteerde dit 1 maand na behandeling op basis van de QOL-index van de International Prostate Symptom Score (IPSS) (schaal 1 tot 6, geen tot ernstige beperking in kwaliteit van leven door aandoening). Pinto (2018) rapporteerde de kwaliteit van leven op 4, 8 en 12 weken na Onabotuline toxine injecties op basis van de IPSS QOL index (schaal 0 tot 6, geen tot ernstige beperking in kwaliteit van leven door aandoening). Het daadwerkelijke verschil tussen de groepen in de verandering tussen de pre- en post-baseline scores werd niet door Pinto (2018) gerapporteerd.
Akiyama (2015) rapporteerde een gemiddeld verschil in kwaliteit van leven van -1,00 (95%BI -2,05 tot 0,05) tussen de interventie (n=18) en controlegroep (n=16) 1 maand na BTX-A-injecties.
4.2 Botulinetoxine injecties in de prostaat
Eén studie beschreef de uitkomstmaat kwaliteit van leven na BTX-A-injecties in de prostaat (Falahatkar, 2015). Falahatkar (2015) rapporteerde dit 1, 3 en 6 maanden post-injectie op basis van de QOL-index van de the National Institutes of Health -Chronic Prostatitis Symptom Index (NIH-CPSI), schaal 0 tot 6 van geen tot ernstige beperking in kwaliteit van leven door aandoening.
Falahatkar (2015) rapporteerde een gemiddeld verschil in kwaliteit van leven na BTX-A-injecties in de prostaat (n=30) vergeleken met een placebo (n=30) op 1, 3 en 6 maanden post-injectie: gemiddeld verschil in kwaliteit van leven na 1 maand was -2,20 (95%BI -2,33 tot -2,07), 3 maanden -3,10 (-3,23 tot -2,97); 6 maanden: -3,47 (-3,61 tot -3,32).
4.3 Botuline toxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren
Er werden geen studies geïncludeerd waarin botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren werden bestudeerd bij patiënten met chronische bekkenpijn.
Bewijskracht van de literatuur
Botulinetoxine injecties in de blaas
Pijnintensiteit (1 maand follow up):
RCT’s beginnen op een hoog niveau van bewijskracht. De bewijskracht voor de uitkomstmaat pijnintensiteit 1 maand na botulinetoxine injecties in de blaas is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijke blindering (Akiyama, 2015) en onduidelijke exclusie van 2 patiënten na afloop (Pinto, 2018)), inconsistentie (geïncludeerde studies spreken elkaar tegen) en het geringe aantal patiënten (imprecisie). Hierdoor kwam de bewijskracht uit op een GRADE zeer laag.
Pijnintensiteit (3 maanden follow up):
RCT’s beginnen op een hoog niveau van bewijskracht. De bewijskracht voor de uitkomstmaat pijnintensiteit 3 maanden na botulinetoxine injecties in de blaas is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijke exclusie van 2 patiënten na afloop (Pinto, 2018)) en het betrouwbaarheidsinterval van het gepoolde effect overlapt de grens van klinische relevantie (imprecisie). Hierdoor kwam de bewijskracht uit op een GRADE laag.
Patiënttevredenheid:
De bewijskracht voor de uitkomstmaat patiënttevredenheid kon niet worden gegradeerd door middel van GRADE doordat er geen studies werden geïncludeerd waarin deze uitkomstmaat werden bestudeerd bij patiënten met chronische bekkenpijn die behandeld werden met botulinetoxine injecties van de blaas.
Complicaties:
De bewijskracht voor de uitkomstmaat complicaties kon niet worden gegradeerd door middel van GRADE doordat de geïncludeerde studies onvoldoende informatie rapporteerden.
Kwaliteit van leven:
RCT’s beginnen op een hoog niveau van bewijskracht. De bewijskracht voor de uitkomstmaat kwaliteit van leven 1 maand na botulinetoxine injecties in de blaas is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijke blindering (Akiyama, 2015)) en omdat het betrouwbaarheidsinterval van het effect overlapt met de grens van klinische relevantie (imprecisie). Hierdoor kwam de bewijskracht uit op een GRADE zeer laag.
Botulinetoxine injecties in de prostaat
RCT’s beginnen op een hoog niveau van bewijskracht. De bewijskracht voor de uitkomstmaat pijnintensiteit 1, 3 en 6 maanden na botulinetoxine injecties in de prostaat is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie). Hierdoor kwam de bewijskracht uit op een GRADE redelijk.
De bewijskracht voor de uitkomstmaat patiënttevredenheid kon niet worden gegradeerd door middel van GRADE doordat er geen studies werden geïncludeerd waarin deze uitkomstmaat werden bestudeerd bij patiënten met chronische bekkenpijn die behandeld werden met botulinetoxine injecties van de prostaat.
De bewijskracht voor de uitkomstmaat complicaties kon niet worden gegradeerd door middel van GRADE doordat de geïncludeerde studies onvoldoende informatie rapporteerden.
RCT’s beginnen op een hoog niveau van bewijskracht. De bewijskracht voor de uitkomstmaat kwaliteit van leven 1, 3 en 6 maanden na botulinetoxine injecties in de prostaat is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie). Hierdoor kwam de bewijskracht uit op een GRADE redelijk.
Botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren
De bewijskracht voor de uitkomstmaten pijnintensiteit, patiënttevredenheid, complicaties en kwaliteit van leven konden niet worden gegradeerd door middel van GRADE. Er werden geen studies geïncludeerd waarin botulinetoxine injecties in pelvic floor trigger points, puborectalis en/of pubococcygeus spieren werden bestudeerd bij patiënten met chronische bekkenpijn.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit (en veiligheid) van botuline toxine A injecties in de blaas, prostaat, muscle trigger points of bekkenbodemspieren vergeleken met placebo voor de behandeling van patiënten met chronische bekkenpijn?
P: patiënten met chronische bekkenpijn (duur van de pijn ≥ 6 maanden);
I: behandeling door middel van botulinetoxine injecties (onabotuline toxine en abotuline toxine) in de blaas, prostaat, pelvic floor trigger points, puborectalis en pubococcygeus spieren;
C: standaardbehandeling, operaties, sham of placebo;
O: pijnintensiteit, patiënttevredenheid, complicaties, kwaliteit van leven.
Relevante uitkomstmaten
De werkgroep achtte pijnintensiteit een voor de besluitvorming cruciale uitkomstmaat; en patiënttevredenheid, complicaties, kwaliteit van leven voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep hield de GRADE-default grenzen (25% voor dichotome uitkomstmaten en 0,5 SD voor continue uitkomstmaten) aan als een klinisch (patiënt) relevant verschil (Schüneman, 2013).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (Elsevier) is op 15 augustus 2019 met relevante zoektermen gezocht naar systematische reviews, randomized controlled trials (RCT’s) en observationele cohortstudies waarin was gekeken naar de effectiviteit en veiligheid van behandeling van chronische bekkenpijn door middel van botulinetoxine injecties (onabotuline toxine en abotuline toxine). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 277 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: 1) studie betrof patiënten met chronische bekkenpijn (duur pijn ≥ 6 maanden); 2) studie betrof een RCT waarin botulinetoxine injecties (onabotuline toxine en abotuline toxine) werden vergeleken met een andere behandeling of placebo behandeling; 3) minimaal één van de volgende uitkomstmaten werd gerapporteerd: pijnintensiteit, patiënttevredenheid, complicaties, kwaliteit van leven. Op basis van titel en abstract werden in eerste instantie 106 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 98 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 8 studies geselecteerd. Dit betroffen 5 systematische reviews en/of meta-analyses (Mangera, 2014; Ochoa Vargas, 2018; Shim, 2016; Tirumuru 2010; Wang, 2016). Vergeleken met de andere vier reviews, beschrijft het review van Shim (2016) het meest gedetailleerd de resultaten van de studies. Het review van Ochoa Vargas (2018) bevatte geen nieuwe studies vergeleken met Shim (2016). Er werd daarom voor gekozen om de data uit Shim (2016) te extraheren en alle relevante studies die sindsdien waren geïdentificeerd (Akiyama, 2015; Falahatkar, 2015; Pinto, 2018). In totaal werden er 4 studies definitief opgenomen in de literatuuranalyse (Akiyama, 2015; Falahatkar, 2015; Shim, 2016; Pinto, 2018).
Resultaten
In totaal werd één systematische review en meta-analyse (Shim, 2016) en werden drie losse RCTs (Akiyama, 2015; Falahatkar, 2015; Pinto, 2018) opgenomen in de literatuuranalyse.
Referenties
- Akiyama Y, Nomiya A, Niimi A, Yamada Y, Fujimura T, Nakagawa T, Fukuhara H, Kume H, Igawa Y, Homma Y. Botulinum toxin type A injection for refractory interstitial cystitis: A randomized comparative study and predictors of treatment response. Int J Urol. 2015 Sep;22(9):835-41.
- Falahatkar S, Shahab E, Gholamjani Moghaddam K, Kazemnezhad E. Transurethral intraprostatic injection of botulinum neurotoxin type A for the treatment of chronic prostatitis/chronic pelvic pain syndrome: results of a prospective pilot double-blind and randomized placebo-controlled study. BJU Int. 2015 Oct;116(4):641-9.
- Pinto RA, Costa D, Morgado A, Pereira P, Charrua A, Silva J, Cruz F. Intratrigonal OnabotulinumtoxinA Improves Bladder Symptoms and Quality of Life in Patients with Bladder Pain Syndrome/Interstitial Cystitis: A Pilot, Single Center, Randomized, Double-Blind, Placebo Controlled Trial. J Urol. 2018 Apr;199(4):998-1003.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Shim SR, Cho YJ, Shin IS, Kim JH. Efficacy and safety of botulinum toxin injection for interstitial cystitis/bladder pain syndrome: a systematic review and meta-analysis. Int Urol Nephrol. 2016 Aug;48(8):1215-1227.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question:
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Shim, 2016
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to 2015 (exact date not reported)
A: Gottsch, 2011 B: Kuo, 2009 C: Manning, 2014 D: Kuo, 2015 E: Kasyan, 2012
Study design: All RCT (parallel)
Setting and Country: A: setting not reported, USA B: setting not reported, Taiwan C: setting not reported, Australia D: setting not reported, Taiwan E: setting not reported, Russia
Source of funding and conflicts of interest: Shim, 2016: Source of funding: “This research was supported by the Next-generation Medical Device Development Program for Newly-Created Market of the National Research Foundation (NRF) funded by the Korean government, MSIP (No. 2015M3D5A1065926) and supported by Soonchunhyang University Research Fund.” Conflict of interest: authors declare no conflict of interest.
Per included study: Not reported.
|
Inclusion criteria SR: (1) reported outcome measurements included a structured questionnaire, (2) interventions included administration of BoNTA and placebo, (3) participants included those diagnosed with IC/BPS, and (4) reasonable intention-to-treat (ITT) analysis was performed in RCTs
Exclusion criteria SR: not reported.
5 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi,...
N, mean age (SD not reported) A: I: n=9, mean 43.9 years C: n=11, mean 47.7 years B: I1: n=15, mean 45.7 years I2: n=29, mean 47.7 years I3: n=23, mean 52.2 years. C: I: n=25, mean 54 years C: n=25, mean 53 years. D: I: n=40, mean 52.9 years C: n=20, mean 50.2 years. E: I: n=15, mean age not reported. C: n=17, mean age not reported.
Sex: A: 100% female (n=20) B: 84% female (n=67) C: 100% female (n=54) D: 87% female (n=52) E: 100% female (n=32)
Population description: A: Refractory pelvic pain in the bladder, ure- thra, vagina, perineum, and pain with bladder filling or voiding, and urinary frequency B: Patients with IC/BPS who had not benefitted from conventional treatments. Suprapubic pain related to bladder filling, accompanied by daytime and nighttime urinary frequency C: female patients with longstanding refractory IC/BPS who had not benefitted from conventional treatments D: IC/BPS patients who had not benefitted from at least 6 months of conventional treatment E: female patients with BPS/IC.
Mean duration of pain: Not reported per study in Shim, 2016.
Groups comparable at baseline? Not reported, but mean age appears to differ between groups. |
Describe intervention:
A: Onabotulinum toxin 50 U diluted in 2 cm3 normal saline. The injection sites were in the same horizontal plane as the urethra in the region of the bladder neck; 1 cm3 of solution was delivered at each site B: Group 1: Onabotulinum toxin 200 U Group 2: Onabotulinum toxin 100 U. The injection inserted 1 mm into the urothelium at 40 sites in the posterior and lateral walls of the bladder. Each injection site received 5 and 2.5 U in a volume of 0.5 mL. 2 weeks after BoNTA injections, patients underwent cystoscopic HD C: Abobotulinum toxin 500 U (assumed equivalent to onabotulinum toxin 200 U) diluted in 30 ml normal saline. BoNTA + hydrodistention and normal saline + hydrodistention (control) were injected at 30 sites in the bladder wall D: Onabotulinum toxin 100 U diluted in 10 ml normal saline The injection inserted 1 mm into the urothelium at the posterior and lateral wall of the bladder, sparing the trigone. Each injection site received 5U of BoNTA or 0.5 ml of N/S at 20 sites E: Onabotulinum toxin 100 U diluted in 10 ml normal saline. Trigone of the bladder only
|
Describe control:
A: 2 cm3 normal saline B: cystoscopic bladder hydrodistention C: 30 ml normal saline D: normal saline immediately followed by cystoscopic hydrodistention E: standard hydrodistention
|
End-point of follow-up:
A: 12 weeks B: 12 weeks C: 12 weeks D: 8 weeks E: 12 weeks
For how many participants were no complete outcome data available? (intervention/control) A: No patients in either group dropped out B: The dropout rates of each group due to AE were similar (BoNTA 200 U 2/17, BoNTA 100 U 0/29, bladder hydrodistention 1/24) C: The dropout rates of each group due to AE were similar (BoNTA 1/26, normal saline 2/27) D: No patients dropped out in either group E: No patients dropped out from either group
|
Outcome measure-1: Pain score Defined as pain as reported on VAS score (0-10, least to worst pain (assumed)).
Effect measure: mean difference (SD): see figure 3d for individual results.
Pooled effect (random effects model): -0.49 (95% CI -0.74 to -0.23) favoring BTX. Heterogeneity (I2): I2 not reported. P=0.689
Subgroup analysis performed for dosage: The SMD changes of VAS improvement were −0.62 (95 % CI −1.52, 0.29) for 50 U, −0.51 (95 % CI −0.86, −0.17) for 100 U, and −0.46 (95 % CI −1.15, 0.24) for 200 U.
Outcome measure-2: patient satisfaction Not reported.
Outcome measure-3: complications A, C & E: did not describe adverse events.
B & D: data were presented for both studies together Per adverse event data were presentend as: I: n (%) versus. C: n (%) (P test for difference):
Outcome measure-4: quality of life Not reported.
|
Facultative:
Brief description of author’s conclusion:
“Although BoNTA is not regulatory approved indication, this first evidence-based systematic review and meta-analysis of BoNTA injection for IC/BPS showed significant differences in efficacy of treatment compared with placebo, especially for pain control, and also showed no differences in the rate of procedure-related adverse events”
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
“There was no evidence of publication bias.”
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
Abbreviations: BoNTA: botulinum toxin A; BTX: botox; SMD: standardized mean difference.
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Akiyama, 2015 |
Type of study: RCT
Setting and country: single centre, University hospital, Japan.
Funding and conflicts of interest: This study was financially supported by Japanese Health Labor Sciences Research grant (H22-047). The authors thank Dr Masayoshi Zaitsu and Dr Koji Ichihara for their helpful advice in data analysis and figure preparation.
The authors declare no conflict of interest. |
Inclusion criteria: IC patients who had received HD at least once and medical treatment of one or more oral drugs or intravesical agents, yet remained to be symptomatic; six points or higher for OSSI/OSPI, and four points or higher for VAS (0–10) for pain. Diagnosis of IC was made according to clinical guidelines for interstitial cystitis and hypersensitive bladder syndrome. All patients fulfilled the National Institute of Diabetes and Digestive and Kidney Diseases criteria.
Exclusion criteria: Patients were excluded from the present study when they had urinary tract infection, bladder cancer, neurogenic disorder, urinary calculi, voiding difficulty with post-voided residual ≥100 mL, past treatment with BoNT-A, anticholinergic agents within 1 month before treatment, systemic diseases of neuromuscular junction, severe respiratory dysfunction and allergy to BoNT-A.
N total at baseline: 34 Intervention: 18 Control: 16
Important prognostic factors2: For example age ± SD: I: 64.3 (13.2) C:65.6 (14.6)
Sex: I: 4/14 M/F C: 4/12 M/F
Duration of IC: I: 6.2 (3.9) years C: 7.1 (4.9) years.
Groups comparable at baseline? Yes.
|
Describe intervention (treatment/procedure/test):
BoNT-A 100 U
Under general anesthesia and cystoscopic control, BoNT-A (onabotulinumtoxin-A, Allergan, Irvine, CA, USA) 100 U, diluted in 15 mL normal saline, was injected suburothelially at 30 sites by 0.5 mL each in the trigonal area of the bladder through a 25-G needle (Olympus, Tokyo, Japan). Instilled saline volume was minimized to avoid hydrodistension. The first- or second-generation cephem antibiotic was administered perioperatively. AE were closely monitored by urinalysis and interviews, beginning 2 weeks after injection, and every month thereafter throughout the study period. |
Describe control (treatment/procedure/test):
1 month delayed BoNT-A 100 U |
Length of follow-up: 1 month.
Loss-to-follow-up: Intervention: 0 N (%) Reasons (describe)
Control: 0 N (%) Reasons (describe)
Incomplete outcome data: Intervention: 0 N (%) Reasons (describe)
Control: 0 N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure-1: Pain score Defined as pain as reported on VAS score (0-10, least to worst pain (assumed)).
Mean difference (SD): I: -2.2 (2.0) C: -0.1 (2.1)
Outcome measure-2: patient satisfaction Not reported.
Outcome measure-3: complications Descriptive presentation of reported complications:
“No complications worse than grade III in the Clavien Classification of Surgical Complications were reported in any of participants. A total of 10 of 34 patients complained of voiding difficulty during the first week (n = 1), first month (n = 5), second month (n = 3) or third month (n = 1) after the treatment. Three patients had post-void residual more than 100 mL for the first 2 months, which resolved spontaneously without clean intermittent catheterization. Other adverse events included transient gross hematuria at 2 weeks (n = 1), which also resolved spontaneously without any interventions, and symptomatic afebrile urinary tract infection requiring antibiotics at the first month (n = 2).”
Outcome measure-4: quality of life QOL index (1-6) based on the QOL index of the International Prostate Symptom Score (IPSS).
Mean difference (SD): I: -0.9 (SD 1.5) C: 0.1 (SD 1.6) |
Author conclusion: “Botulinum toxin type A injection could be an alternative treatment option for patients with interstitial cystitis refractory to conventional therapies, especially for those who have received repeated hydrodistensions and transurethral fulguration.” |
|
Falahatkar, 2015 |
Type of study: prospective, double-blind randomized placebo-controlled study.
Setting and country: single centre, University hospital, Iran.
Funding and conflicts of interest: No details on funding reported. Authors declare no conflict of interest. |
Inclusion criteria: men aged ≥18 years with clinical diagnosis of CP/CPPS and refractory to 4–6 weeks of medical therapy including fluoroquinolons, α-blockers, anti-inflammatory agents and muscle relaxants were enrolled. In addition, an aggregate of pain and urinary symptom scale scores ≥10 along with a pain subscale score of ≥8 on the NIH-Chronic Prostatitis Symptom Index (CPSI) questionnaire.
Exclusion criteria: previous or concurrent malignancy; inflammatory bowel disease; history of pelvic radiation and systemic or intravesical chemotherapy; previous pelvic and rectal surgery or trauma; presence of a neurological disorder affecting the bladder; bladder stones; urethral stricture; history of prostate surgery or biopsy; UTI or sexually transmitted disease in the last 3 months; neuromuscular junction disorder; consumption of anticongestives, anticholinergics or any medicine affecting the neuromuscular junction in the last 2 weeks; coagulopathy; intake of antiplatelet agents in the last 10–14 days, anticoagulants in the last 7 days or steroids or sex hormones in the last 4 months; opioid or drug or alcohol abuse during the last 5 years; serum PSA level > age-specific range; abnormal DRE with family history of prostate cancer; serum creatinine >2mg/dl; abnormal urinary cytology with haematuria; post-voiding urine residue >200mL;indwelling urinary catheter, cystostomy or nephrostomy; penile prosthesis or artificial urinary sphincter; previous injection of BoNT-A; and hypersensitivity to BoNT-A.
N total at baseline: 60 Intervention: 30 Control: 30
Important prognostic factors2: For example age ± SD: I: 42.7 (SD 11.2) C: 38,2 (SD 11,8)
Sex: I: 100% M C: 100% M
Duration of pain: Not reported.
Groups comparable at baseline? Yes, except baseline QoL was higher in the treatment group than control group.
|
Describe intervention (treatment/procedure/test):
100 IU of BoNT-A (onabotulinum-A) diluted in 2 mL of normal saline (0.9% sodium chloride) and administered 100 IU of BoNT-A for prostate volumes <30 mL and 200 IU for prostate volumes 30–60mL.
All patients underwent local anaesthesia by delivering 10 mL of lidocaine gel (2%) into the urethra 10 min before injection. The injections were then performed at three different sites of each lateral lobe of the prostate using a 23-gauge endoscopic needle and rigid cystoscopy in both groups. The injecting needle was inserted deeply into each transition lobe of the prostate but did not penetrate the bladder. The same urologist carried out all injections. A 16-F Foley catheter was fixed for 12h after injection and oral ciprofloxacin 500 mg twice a day were administered for 7 days. All medications for CP/CPPS were discontinued from 1 month before injection to the end of the follow-up period. |
Describe control (treatment/procedure/test):
2 mL of normal saline was administered for every patient.
All patients underwent local anaesthesia by delivering 10 mL of lidocaine gel (2%) into the urethra 10 min before injection. The injections were then performed at three different sites of each lateral lobe of the prostate using a 23-gauge endoscopic needle and rigid cystoscopy in both groups. The injecting needle was inserted deeply into each transition lobe of the prostate but did not penetrate the bladder. The same urologist carried out all injections. A 16-F Foley catheter was fixed for 12h after injection and oral ciprofloxacin 500 mg twice a day were administered for 7 days. All medications for CP/CPPS were discontinued from 1 month before injection to the end of the follow-up period. |
Length of follow-up: 1, 3 and 6 months follow-up.
Loss-to-follow-up: 0 Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: 0 Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure-1: Pain score Defined as pain as reported on VAS score (0-10, least to worst pain (assumed)).
NB: contrast to other studies, here post-injections scores were subtracted from baseline scores.
Baseline versus. 1 month post-injection: Mean difference (SD): I: 5.133 (SD 0.538) C: -0.067 (SD 0.179)
Baseline versus. 3 month post-injection: Mean difference (SD): I: 5.967 (SD 0.539) C: -0.167 (SD 0.204)
Baseline versus. 6 month post-injection: Mean difference (SD): I: 6.767 (SD 0.504) C: -0.2337 (SD 0.190)
Outcome measure-2: patient satisfaction Not reported.
Outcome measure-3: complications
Descriptive information: “No major systemic or local complications, such as respiratory depression, hyposthenia, prolonged or extensive haematuria, UTI or incontinency occurred in either group. Mild gross haematuria lasting <6h and managed conservatively occurred in two patients in the treatment group.”
Outcome measure-4: quality of life Modified QoL index (0-6) based on the National Institutes of Health -Chronic Prostatitis Symptom Index (NIH-CPSI).
NB: contrast to other studies, here post-injections scores were subtracted from baseline scores.
Baseline versus. 1 month post-injection: Mean difference (SD): I: 2.167 (SD 0.359) C: 0.033 (SD 0.102)
Baseline versus. 3 month post-injection: Mean difference (SD): I2.833 (SD 0.339) C: -0.267 (SD 0.151)
Baseline versus. 6 month post-injection: Mean difference (SD): I: 3.033 (SD 0.373) C: -0.433 (SD 0.141) |
|
|
Pinto, 2018 |
Type of study: phase II, Randomized, Double-Blind, Placebo Controlled Trial
Setting and country: single centre, type of centre not reported, Portugal.
Funding and conflicts of interest: Supported by an unrestricted grant from Allergan. No direct or indirect commercial incentive associated with publishing this article. NB: Author conflict of interests not reported. |
Inclusion criteria: women 18 to 60 years old with a diagnosis of BPS/IC for more than 6 months in duration according to ESSIC (European Society for the Study of BPS) criteria. The women had BPS/IC refractory to common treatments administered for at least 6 months before study inclusion. Patients had to be willing to initiate clean intermittent catheterization if deemed necessary. Pain was referable to the bladder, urethra or perineum that was related to bladder filling with a VAS score of at least 4 on a 0 - no pain to 10 - maximum pain scale at baseline screening. Patients had to discontinue PPS, amitriptyline or hydroxyzine for at least 15 days and intravesical medications (heparinoids, PPS, chondroitin sulfate or dimethyl sulfoxide) for at least 3 months prior to screening. If patients had received OnaBotA or resiniferatoxin in the past, more than 12 months had to elapse prior to screening. None of these treatments could be started during the study. Patients receiving paracetamol, nonsteroidal anti-inflammatory drugs, gabapentin and pregabalin were allowed to enter the study but the dose had to remain constant throughout the study. If women were off analgesic medication, new analgesic medication was not allowed during the study. If necessary, patients had to withdraw from the study.
Exclusion criteria: pregnancy, breast feeding, inadequate birth control methods by women with childbearing potential, women with current or frequent UTIs (more than 2 in the last 6 months as documented by urine culture) or those receiving prophylactic antibiotics to prevent UTI or a history of bladder tumor with or without additional intravesical chemotherapy/immunotherapy, pelvic radiotherapy, urinary tract tuberculosis or ketamine exposure. Patients with current or previous noninvestigated hematuria could enter the study after urological or renal pathology was ruled out to the satisfaction of the investigator. Women who underwent surgery due to bladder stones, stress incontinence, endometriosis, uterine prolapse, rectocele, cystocele or any pelvic surgery were excluded. Also excluded were women with cardiac, pulmonary, hematological or other conditions that contraindicated safe general anesthesia or who were at high risk for thrombotic events for which suspension of antiplatelet or anticoagulant treatment added significant risk. Patients with an estimated creatinine clearance rate lower than 30 ml per minute as calculated by the Cockcroft-Gault formula, PVR greater than 100 ml at screening, a history of neurological disorders including but not limited to myasthenia gravis and Lambert-Eaton syndrome or amyotrophic lateral sclerosis, or a known allergy to OnaBotA or who had received the toxin for reasons other than BPS/IC in the previous 12 weeks were also excluded.
N total at baseline: 19 Intervention: 10 Control: 9
Important prognostic factors2: For example age ± SD: I: 44.3 ± 9.9 C: 47.4 ± 11.1
Sex: I: 100% F C:100 % F
Symptom duration (mean years ± SD): I: 8.6 ± 8.4 C: 7 ± 3.6
Groups comparable at baseline? Yes, no differences were reported at baseline (P>0.05) |
Describe intervention (treatment/procedure/test): Patients randomized to OnaBotA received 10 injections of 1 ml 0.9% sodium chloride containing 10 U OnaBotA (total 10 ml and 100 U, respectively).
Antibiotic prophylaxis was initiated with levofloxacin 500 mg on the day of treatment and prolonged for an additional 5 days
|
Describe control (treatment/procedure/test): Patients randomized to placebo received 10 injections of 1 ml 0.9% sodium chloride only
Antibiotic prophylaxis was initiated with levofloxacin 500 mg on the day of treatment and prolonged for an additional 5 days
|
Length of follow-up: 2,4,8 and 12 weeks post-treatment.
Loss-to-follow-up: no patients were lost to follow-up, but initially 21 patients were included and n=2 were excluded afterwards. It is unclear whether the reasons described refer to the correct groups (not explicitly reported).
Intervention: N (%) 1 (1/11=9%) Reasons (describe) because age exceeded the exclusion limit at the end of treatment.
Control: unclear N (%)1 (1/10=10%) Reasons (describe) due to pelvic surgery 20 years
Incomplete outcome data: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure-1: Pain score Defined as pain as reported on VAS score (0-10, least to worst pain (assumed)).
Non-significant differences of 1 and 2 points were seen at 4 and 8 weeks (data presented in figure, not reported as exact data in mean difference between groups).
Baseline versus. 12 month post-injection: Mean difference (SD): I: -3.8 (SD 2.5) C: -1.6 (SD 2.1)
Outcome measure-2: patient satisfaction Not reported.
Outcome measure-3: complications Adverse events were reported descriptively, as follows:
“All AEs were Clavien-Dindo grade I. The most common AE during the study period was UTI, which was present in 5 patients between weeks 4 and 12. All patients were symptomatic and all responded well to antibiotics as confirmed by posterior negative urine cultures. No urinary retention developed.”
Outcome measure-4: quality of life QoL index (0-6) based on the adapted I-PSS (International Prostate Symptom Score). On this scale 0 indicated that “my bladder condition does not affect my life” and 6 meant that “my bladder conditions affects my life terribly.”
Mean difference not reported.
Baseline QoL score: I: 5.2 (SD 0.9) C: 5.0 (SD 0.9)
8 week follow-up QoL score: I: 1.9 (SD 2.1) C: 3.9 (SD 1.3)
12 week follow-up QoL score: I: 1.9 (SD 2.3) C: 4.1 (SD 1.3) |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Shim, 2016 |
Yes, “To investigate the overall treatment efficacy and safety of botulinum toxin type A (BoNTA) injections compared with placebo in interstitial cystitis/bladder pain syndrome (IC/BPS).” |
Yes |
Yes |
Yes |
Not applicable (RCTs) |
Yes, Cochrane RoB tool. |
Yes, subgroup analysis for dosage. |
Yes |
No, not reported per individual study. |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera.).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question:
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Akiyama 2015 |
Randomization was carried out through central registration using an allocation table. |
Unclear, presumably it was not possible to blind participants (immediate or delayed treatment) |
Unclear, presumably it was not possible to blind participants (immediate or delayed treatment) |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Falahatkar, 2015 |
Concealed numbered envelopes were used for group assignment, which were opened after gathering the baseline values |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear, not reported. |
Unlikely |
|
Pinto, 2018 |
Eligible patients were randomized to OnaBotA 100 U or placebo using a predefined randomization sequence.
|
Unlikely |
Unlikely |
Unlikely |
Unlikely, “Blinding was maintained by a numbering system and the investigator who prepared the study medication did not meet the patients before or after treatment” |
Unclear, 2 patients were excluded afterwards as they did not adhere to patient characteristics. Reasons for exclusion were reported but not specified what reason in which group. |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Abbott 2006 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Abbott, 2009 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Abdel-Meguid, 2018 |
geen RCT (prospectieve observationele studie met controlegroep) |
|
Adelowo, 2013 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Almeida, 2019 |
guideline |
|
Amundsen, 2014 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Apostolidis 2009 |
literature review zonder RoB beoordeling |
|
Apostolidis, 2008 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Atkin 2011 |
Voldoet niet aan PICO (geen interventie met botox, betreft studie naar patiëntkenmerken bij anorectale pijn) |
|
Bertolasi 2008 |
narrative review |
|
Bhide 2013 |
narrative review |
|
Bibi, 2016 |
geen RCT (observationeel onderzoek zonder controlegroep) |
|
Butrick, 2009 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Chuang 2006 |
narrative review |
|
Chuang 2017 |
voldoet niet aan PICO (spoeling in plaats van injecties) |
|
Chuang, 2016 |
narrative review |
|
Chung, 2012 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Chung, 2015 |
narrative review |
|
Cruz, 2012 |
editorial (les) |
|
Damsted-Petersen, 2009 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
De Andres, 2016 |
narrative review |
|
Dellis, 2014 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
El-Enen, 2015 |
geen RCT (non-controlled study) |
|
El-Khawand, 2013 |
narrative review |
|
Fall, 2008 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Fang, 2016 |
narrative review |
|
Finamore, 2008 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Gao, 2015 |
geen RCT (observationeel onderzoek) |
|
Giannantoni, 2006 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Giannantoni, 2008 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Giannantoni, 2010 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Giannantoni, 2010 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Giannantoni, 2012 |
Review van Shim 2016 gekozen als uitgangspunt |
|
Gottsch 2011 |
artikel reeds geïncludeerd in Shim 2016 (review) |
|
Gottsch 2011 |
geïncludeerd in Shim 2016 |
|
Gottsch, 2010 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Gray, 2016 |
narrative review |
|
Halder, 2017 |
geen RCT (observationeel onderzoek) |
|
Hanno 2015 |
Guideline behandeling en diagnose IC/BPS |
|
Hanno, 2011 |
guideline |
|
Hedebo Hansen, 2019 |
geen RCT (observationeel onderzoek zonder controlegroep) |
|
Hollingshead, 2011 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Jabbari 2011 |
narrative review |
|
Jarvi, 2018 |
guideline |
|
Jarvis, 2004 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Jeon, 2013 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Jhang, 2018 |
narrative review |
|
Jiang, 2018 |
voldoet niet aan PICO (gaat over locatie injecties, niet over effectiviteit van injectie) |
|
Khambati, 2014 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Kuo 2009 |
artikel reeds geïncludeerd in Shim 2016 (review) |
|
Kuo 2016 |
artikel reeds geïncludeerd in Shim 2016 (review) |
|
Kuo, 2005 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Kuo, 2013 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Kuo, 2013 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Kuo, 2015 |
voldoet niet aan PICO (gaat over voorspellers behandeling) |
|
LeClaire, 2018 |
voldoet niet aan PICO (gaat over pijnstilling tijdens injectie) |
|
Lee 2019 |
voldoet niet aan PICO (geen injectie maar spoeling) |
|
Lee, 2013 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Lee, 2015 |
geen RCT (prospectieve observationele studie zonder controlegroep) |
|
Leippold, 2003 |
narrative review |
|
Liu, 2007 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Lorenzo, 2016 |
geen RCT (prospectieve observationele studie zonder controlegroep) |
|
Lusty, 2018 |
voldoet niet aan PICO (gaat niet over injecties) |
|
Malde, 2018 |
guideline |
|
Mangera 2011 |
oudere versie van Mangera 2014 |
|
Mangera 2014 |
systematisch review, geïncludeerde studies zitten ook in Shim 2016. |
|
Manning 2014 |
artikel reeds geïncludeerd in Shim 2016 (review) |
|
Meng, 2018 |
narrative review |
|
Miranda Varella Pereira, 2018 |
sys review, geïncludeerd artikel over botox voldoet niet aan PICO (provoked vestibulodynia) |
|
Miyagawa, 2010 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Morrissey, 2015 |
geen RCT (prospectieve observationele studie zonder controlegroep) |
|
Namazi, 2008 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Ochoa Vargas 2018 |
systematisch review, geïncludeerde studies zitten ook in Shim 2016. |
|
Ooijevaar, 2019 |
geen RCT (prospectieve observationele studie zonder controlegroep) |
|
Patel, 2006 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Pazin 2016 |
voorkeur voor systematisch review van Shim 2016 (methodologisch superieur) |
|
Pinto 2010 |
Voldoet niet aan PICO (geen controlegroep) |
|
Pinto, 2013 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Pinto, 2014 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Ramsay, 2007 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Rao, 2009 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Rappaport, 2018 |
voldoet niet aan PICO (gaat over spoeling, niet injecties) |
|
Russell, 2013 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Safarpour, 2018 |
literature review zonder RoB over algemene populatie |
|
Seth, 2013 |
narrative review |
|
Shie, 2013 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Sinha, 2007 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Sinha, 2008 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Smith, 2004 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Smith, 2005 |
gepubliceerd binnen search periode van Shim 2016 en Pereira 2018 |
|
Tandon, 2019 |
geen RCT (observationeel onderzoek zonder controlegroep) |
|
Tirumuru 2010 |
systematisch review, geïncludeerde studies zitten ook in Shim 2016. |
|
Tomoe, 2015 |
editorial comment |
|
Tu, 2005 |
methodologisch review |
|
Wang 2016 |
systematisch review, geïncludeerde studies zitten ook in Shim 2016. |
|
Wein, 2011 |
editorial comment |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-08-2021
Beoordeeld op geldigheid : 31-08-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Urologie (NVU) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVU is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Botulinetoxine injecties |
NVU |
2020 |
2025 |
Elke 5 jaar |
NVU |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
De richtlijn is ontwikkeld in samenwerking met:
- Nederlandse Vereniging van Maag-Darm-Leverartsen
- Nederlandse Vereniging voor Anesthesiologie
- Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Nederlandse Vereniging voor Bekkenfysiotherapie
- Nederlandse Vereniging voor Heelkunde
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie
- Nederlands Instituut van Psychologen
- Landelijke Vereniging Medische Psychologie
- Koninklijke Nederlandse Organisatie van Verloskundigen
- Nederlands Huisartsen Genootschap
- Verpleegkundigen & Verzorgenden Nederland
- Stichting Bekkenbodem4All
- Interstitiële Cystitis Patiëntenvereniging
Doel en doelgroep
Doel
Het ontwikkelen van een evidence based richtlijn over chronische bekkenpijn volgens richtlijnen 2.0.
Doelgroep
Patiënten met chronische bekkenpijn. Alle zorgverleners die betrokken zijn bij de zorg voor patiënten met chronische bekkenpijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in december 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met chronische bekkenpijn.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. E.J. (Bert) Messelink, uroloog-seksuoloog NVVS, NVU (voorzitter).
- Dr. A. (Afina) Glas, uroloog, NVU
- Dr. J. (Jacqueline) Groeneweg, gynaecoloog, NVOG
- Dr. D. (Dick) Janssen, arts-onderzoeker urologie, NVU
- Drs. K. (Karlijn) Schweitzer, gynaecoloog, NVOG
- Drs. V. (Wafa) Rezvani, anesthesioloog-pijnbestrijder, NVA
- Dr. R.J.F. (Richelle) Felt-Bersma, maag-darm-leverarts, NVMDL
- Dr. R.J. (Remmie) Hammers, huisarts, kaderarts urogynaecologie, NHG
- Drs. G. (Gidia) Jacobs, gezondheidszorgpsycholoog, pedagoog, seksuoloog NVVS, NVVS, NIP, LVMP.
- Drs. C. (Corine) Adamse, geregistreerd bekkenfysiotherapeut, NVFB
- (Ana) dos Santos, MSc, geregistreerd bekkenfysiotherapeut, NVFB
- H.J. (Henk-Jan) Mulder, verpleegkundig specialist urologie, V&VN
- C.W.L. (Tine) van den Bos, MSPT, belangenbehartiger patiënten namens Stichting Bekkenbodem4All, voorzitter Stichting Bekkenbodem4All, geregistreerd bekkenfysiotherapeut, Stichting Bekkenbodem4All
Klankbordgroep
- Prof. dr. E.J.C. (Esther) Consten, chirurg, NVvH
- B.B.M. (Brigitte) Tebbe, verloskundige, KNOV
- H.M.T. Andriesse-Walhain, patiëntvertegenwoordiger, ICP
Met ondersteuning van
- Dr. I. (Irina) Mostovaya, senior-adviseur en teamleider, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A (Anne) Bijlsma-Rutte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (José) Maas, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Y.J. (Yvonne) Labeur, MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Monique) Wessels, MSc, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
* Messelink |
Uroloog - Seksuoloog NVVS Medisch Centrum Leeuwarden |
Verzorgen onderwijs: SOMT Amersfoort. Opleiding Bekkenfysiotherapeuten, 1,5 dag/jaar. Betaald RINO Utrecht. Opleiding seksuologie, 0,5 dag/jaar. Betaald Opleiding Stomaverpleegkundige Groningen. 2 uur/jaar. Betaald
Europese cursus: Chronic Pelvic Pain, European Association of Urology. Halve dag 1x/jaar. Betaald |
* Voorzitter Pelvic Floor Network, een non-profit organisatie die zich inzet voor het structureren van landelijk onderwijs en het opzetten van een zorg-netwerk betreffende chronische bekkenpijn. * Lid medische adviesraad van de patiëntenverenigingen: BB4All, PVVN. * Vice-chairman EAU Guideline panel Chronic Pelvic Pain. |
Geen |
|
Groeneweg |
gynaecoloog IJsselland ziekenhuis 0,625 fte expert gynaecologie Zorginstituut Nederland 0,2 fte |
bestuurslid werkgroep Bekkenbodem NVOG onbetaald
|
vanuit werkgroep Bekkenbodem ben ik de contactpersoon voor de patiëntenorganisatie BB4all |
Geen |
|
Schaapveld |
Voorzitter Bekkenbodem4all |
Lid cliëntenraad Residentie Molenwijck |
Niet van toepassing |
Geen |
|
Glas |
Uroloog, vrij gevestigd. ZaansMC |
Geen |
Ben betrokken bij opzet onderzoek naar blaasspoelingen bij preventie van urineweginfecties. Dit onderzoek wordt mogelijk gefinancierd (aanvraag unrestricted grant) door bedrijf dat ook blaasspoelingen verkoopt voor indicatie chronische bekkenpijn
Ik hoop dat eerder ontwikkelde standpunt BPS/ic waar ik actief betrokken bij ben geweest een plaats krijgt, qua inhoud, inde de nieuw te ontwikkelen richtlijn bekkenpijn.
Het meehelpen bij ontwikkelen van een dergelijke richtlijn, zal voor mij persoonlijke een intellectueel gewin opleveren. In die zin dat ik er ook iets hoop van te leren.
Het mee ontwikkelen van de richtlijn zal denk ik een gunstige invloed hebben op mijn rol als specialist met affiniteit voor de patiëntengroep en het ziektebeeld. |
Geen actie; NB-blaasspoelingen worden niet besproken in de richtlijn |
|
Adamse |
Bekkenfysiotherapeut en klinisch Epidemiologie Docent EBP en begeleider onderzoekstagiaires Antonius ziekenhuis Sneek |
Bekkenfysiotherapeut: Alle klinische en poliklinische zorg rondom bekken patiënten deelname aan multidisciplinair overleg met gynaecologie, urologie en chirurgie. Deelname aan seksuologisch spreekuur en MDO. samenwerking met MDL-artsen en gespecialiseerde verpleegkundigen. klinisch epidemioloog/ docent EBP/ begeleider onderzoekstherapie lesgeven en ondersteunen van onderzoeksvragen op het gebied van EBP voor zowel fysiotherapeuten als verpleegkundigen. Evidence based practise docent (gastdocent) NHL/stenden hogeschool Leeuwarden |
nee, behalve dat richtlijn mogelijk meer werk/aandacht oplevert voor bekkenfysiotherapie in het ziekenhuis
mogelijk meer aandacht voor bekkenfysiotherapie en de NVFB. Review gedaan naar chronische pijn en effectiviteit van e-health toepassingen en gepubliceerd (2017) |
Geen |
|
Santos |
Geregistreerd bekkenfysiotherapeut MSc bij PelviCentrum- Centrum voor Bekkenfysiotherapie Leiden Eigenaresse van PelviCentrum - Centrum l voor Bekkenfysiotherapie Leiden |
Lid van NVFB Wetenschappelijke Commissie. Vergoeding van de reiskosten en bijwonen van vergaderingen.
In samenwerking met verloskundigenpraktijk en Mamacafe Leiden geef ik workshops aan zwangeren en vrouwen postpartum. Deze werkzaamheden zijn onbetaald. |
Deelname aan het ontwikkelen van de richtlijn kan ervoor zorgen dat collega vaker gaan verwijzen naar mijn praktijk vanwege meer bekendheid. |
Geen |
|
Hammers |
Waarnemend huisarts Kaderhuisarts Urogyneacologie |
Lid medische adviesraad stichting Bekkenbodem4All. Onkostenvergoeding |
Ik ben de afgevaardigde vanuit de UgynHag (kaderhuisartsenartsen urogynaecologie) |
Geen |
|
Jacobs |
Gezondheidszorgpsycholoog, seksuoloog NVVS in vrijgevestigde praktijk: centrum voor psychische, relationele en seksuele gezondheid te Voorschoten. Gezondheidspsycholoog seksuoloog NVVS in deeltijd bij proctosklinkiek te Bilthoven Hoofdopleider post-big-opleiding seksuologie rino te Utrecht |
Lid van Tuchtrechtcommissietucht van de NVVS onbezoldigd. Adviseur van het bestuur van PFN onbezoldigd. Lesgeven bij diverse organisaties bv. SOMT, ZEL. (bezoldigd) |
Adviseur van het bestuur van PFN ik neem deel uit interesse voor het complexe vakgebied met als doelgroep patiëntenzorg te verbeteren. |
Geen |
|
Mulder |
Verpleegkundig specialist urologie Martini Ziekenhuis Groningen |
Lid van Adviesraad Hollister BV. |
|
Geen actie; NB (thuiszorg) hulpmiddelen worden niet besproken in de richtlijn |
|
Rezvani |
Anesthesioloog/pijnbestrijder, werkzaam in het St. Antonius ziekenhuis Nieuwegein/Utrecht in een maatschap |
Lid ledenraad NVA-sectie pijnbestrijding, onbetaald. |
|
Geen |
|
Janssen |
Arts bij Gynos vrouwenkliniek Den Haag, blaaspijn/bps-spreekuur (onderdeel van Andros klinieken)
Arts-onderzoeker, afdeling urologie, Radboudumc
|
Coördinator en docent Technische Geneeskunde Faculteit, Universiteit Twente.
- Medische adviesraad (MAR) patiëntenvereniging ICP |
Te vermelden voor openheid van zaken:
- Werkzaam in 2 medische centra (Radboudumc & Gynos vrouwenkliniek) die patiëntenzorg op dit deelgebied verlenen.
Meegeschreven aan NVU-standpunt BPS 2017 (onbetaald).
- In verleden tegen betaling eenmalig advies gegeven voor Bene Arzneimittel GMBH farmaceuticals, producent van Elmiron, medicijn voor blaaspijn syndroom.
- In 2017 tegen eenmalige vergoeding gesproken op European Association of Urology congres op gesponsorde sessie door IBSA farmaceuticals (producent GAG-therapie voor blaaspijnsyndroom)
- Eigenaar eenmanszaak dr. Dr. D.A.W. Janssen, Urology Science & Healthcare (KvK nr. 77488881). Geen bezit van patenten, geen (incl. toekomstige beloften voor) financieel gewin door participatie aan deze richtlijn commissie.
Deelname aan deze commissie zou impact kunnen hebben op mijn aanzien als klinisch professional binnen mijn vakgebied. De mate van impact kan ik niet overzien |
Geen actie; NB-blaasspoelingen worden niet besproken in de richtlijn |
|
Schweitzer |
Gynaecoloog UMC Utrecht, Bergman Clinics Hilversum vrouwenzorg |
Trainer KNOV-hechtcursus. Trainer hechtcursus Leiderdorp NVOG voor beiden ontvang ik een vergoeding |
Bij Bergman Clinics zien we patiënten met chronische pijn in buik en bekken mogelijk dat er een toename van pte gaat komen
Deelname aan deze het ontwikkelen van de richtlijn kan ervoor zorgen dat collega vaker gaan verwijzen vanwege meer bekendheid |
Geen |
|
Felt - Bersma |
MDL-arts Amsterdam UMC, locatie VUMC |
MDL-arts Proctoskliniek te Bilthoven MDL-arts MCV de Veluwe, Apeldoorn |
ROAD-studie, een studie met een medicament versus placebo ter preventie van recidief diverticulitis |
Geen |
|
Van den Bos |
1. Bekkenfysiotherapeut MSPT (Master of Specialised Physical Therapy) bij AdFysio te De Lier 0.6 fte 2. Bekkenfysiotherapeut MSPT LUMC, afd. urologie 0.2 fte onbezoldigd 3. Voorzitter BB4All (Bekkenbodem4All), vrijwilliger |
Lid MAR (Medische Advies Raad) Lichen Sclerosis Nederland: reiskostenvergoeding Lid MAR Lichen Planus Vereniging Nederland: reiskostenvergoeding Penningmeester zorggroep FEL (Fysiotherapie 1e Lijn) Zuid-Holland West: onkostenvergoeding |
Geen |
Geen |
|
Klankbordgroep |
|
|
|
|
|
Tebbe (klankbordgroep) |
Wetenschappelijk adviseur KNOV (ZZP) verloskundige |
Communicatie + tekstschrijver (ZZP) |
Geen |
Geen |
|
Andriesse (klankbordgroep) |
Voorzitter van de Interstitiële cystitis vereniging, ICP |
Ik ben vrijwilliger niet betaald |
Geen |
Geen |
|
Consten (klankbordgroep) |
chirurg, meander medisch centrum MMC en hoogleraar universitair medisch centrum Groningen UMCG in de chirurgie aandachtsgebied robotica en computer geassisteerde chirurgie |
voorzitter werkgroep coloproctologie opleideer heelkunde mmc |
arts in tertiair bekkenbodem centrum van het meander medisch centrum te Amersfoort |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door middel van een afgevaardigde patiëntenvereniging in de werkgroep en in de klankbordgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen. Er zijn geen indicatoren ontwikkeld bij deze richtlijn.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende partijen/vertegenwoordigers van relevante stakeholders via een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Per uitgangsvraag werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen in de bijlagen.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld bij deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Kennisinstituut van de Federatie Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Utrecht, 2015.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/werkwijze/richtlijnen_3_0.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E.,... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Embase
|
No. |
Query |
Results |
|
#10 |
#4 AND #7 |
123 |
|
#9 |
#4 AND #6 |
49 |
|
#8 |
#4 AND #5 |
166 |
|
#7 |
cohort:ab,ti OR (case:ab,ti AND (control:ab,ti OR controll*:ab,ti OR comparison:ab,ti OR referent:ab,ti)) OR risk:ab,ti OR causation:ab,ti OR causal:ab,ti OR 'odds ratio':ab,ti OR etiol*:ab,ti OR aetiol*:ab,ti OR 'natural history':ab,ti OR predict*:ab,ti OR prognos*:ab,ti OR outcome:ab,ti OR course:ab,ti OR retrospect*:ab,ti OR 'epidemiology'/de |
7526909 |
|
#6 |
('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
446412 |
|
#5 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract'/it |
2273685 |
|
#4 |
#3 AND (1-1-1999)/sd |
344 |
|
#3 |
#1 AND #2 |
344 |
|
#2 |
(('pelvic pain'/exp/mj OR 'dysmenorrhea'/exp/mj OR 'pelvic girdle pain'/exp/mj OR 'piriformis syndrome'/exp/mj OR 'pelvic floor disorder'/exp/mj OR 'pudendal neuralgia'/exp/mj OR (((pelvic OR pelvis OR pudendal) NEAR/3 (pain* OR syndrome OR neuralgia OR myalgia)):ti,ab) OR (((prostatitisOR prostate OR 'levator ani' OR constipation OR puborectalis) NEAR/3 (neuralgia* OR pain* OR sydrome* OR spasm*)):ti,ab) OR prostatalgia:ti,ab OR prostatodynia:ti,ab OR orchialgia:ti,ab OR dyssynergia:ti,ab OR coccydynia:ti,ab OR coccygodynia:ti,ab OR proctalgia:ti,ab OR vestibulodynia:ti,ab OR dysmenorrhea*:ti,ab OR dysmenorrhoea:ti,ab OR vulvodynia:ti,ab OR dyspareunia:ti,ab OR 'pyriformis syndrome*':ti,ab OR (((bladder OR testicular OR urethral OR scrotal OR groin OR epididymal OR 'post vasectom*' OR genital OR coccyx OR sacrococcygeal OR analOR anorectal OR vestibular OR vulvar OR 'fissure in ano' OR perineal) NEAR/3 pain*):ti,ab) OR (((suprapubic OR abdominal OR endometriosis) NEAR/3 (neuralgia* OR pain*)):ti,ab) OR (((voiding OR prostat* OR menstrual OR menstruation OR childbirth OR vaginal OR vulvar OR urethral OR 'cauda equina') NEAR/3 (neuralgia* OR pain*)):ti,ab) OR (('pelvic floor' NEAR/3 (overactivity OR dysfunction OR 'resting tone' OR hypertonicity)):ti,ab) OR (((proctitis OR defecation OR hemorrhoid* OR haemorrhoid* OR diverticulitis OR pid OR 'pelvic inflammatory disease*') NEAR/3 (neuralgia* OR pain*)):ti,ab)) AND ('chronic disease'/exp OR 'chronic pain'/exp OR (((interstitial OR recurrent) NEAR/2 (cystitides OR cystitis)):ti,ab) OR 'chronic inflammatory pain'/exp OR chronic:ti,ab OR chronically:ti,ab OR persistent:ti,ab OR constant*:ti,ab OR continuing:ti,ab OR sustained:ti,ab OR lasting:ti,ab OR refractor*:ti,ab) OR (('inguinal region'/exp/mj OR 'testis disease'/exp/mj OR 'pelvis floor'/exp/mj) AND 'chronic pain'/exp) OR 'chronic scrotal pain'/exp) AND (english)/lim AND ((embase)/lim OR (pubmed-not-medline)/lim) NOT 'conference abstract':it |
16505 |
|
#1 |
'botulinum toxin a'/exp OR 'btxa' OR 'bont a' OR 'bont serotype a' OR 'clostridium botulinum neurotoxin a' OR 'clostridium botulinum neurotoxin type a' OR 'clostridium botulinum type a neurotoxin' OR 'abobotulinumtoxin a' OR 'abobotulinumtoxina' OR 'azzalure' OR 'bocouture' OR 'botox' OR 'botulin a' OR 'botulin toxin a' OR 'botulinum a exotoxin' OR 'botulinum a toxin' OR 'botulinum neurotoxin a' OR 'botulinum neurotoxin type a' OR 'botulinum toxin a' OR 'botulinum toxin type a' OR 'clostridium botulinum a toxin' OR 'clostridium botulinum endotoxin' OR 'clostridium botulinum toxin type a' OR 'daxibotulinumtoxin a' OR 'daxibotulinumtoxina' OR 'dwp 450' OR 'dwp450' OR 'dyslor' OR 'dysport' OR 'evabotulinum toxin a' OR 'evabotulinumtoxin a' OR 'evabotulinumtoxina' OR 'evosyal' OR 'incobotulinum toxin a' OR 'incobotulinumtoxin a' OR 'incobotulinumtoxina' OR 'jeuveau' OR 'letibotulinumtoxin a' OR 'letibotulinumtoxina' OR 'meditoxin' OR 'mt 10109' OR 'mt10109' OR 'nabota' OR 'nivobotulinum toxin a' OR 'nivobotulinumtoxin a' OR 'nivobotulinumtoxina' OR 'nt 201' OR 'nt201' OR 'oculinum' OR 'onabotulinum toxin a' OR 'onabotulinumtoxin a' OR 'onabotulinumtoxina' OR 'onaclostox' OR 'prabotulinumtoxin a' OR 'prabotulinumtoxin a xvfs' OR 'prabotulinumtoxina' OR 'prabotulinumtoxina xvfs'OR 'prabotulinumtoxina-xvfs' OR 'prosigne' OR 'purtox' OR 'reloxin' OR 'rtt 150' OR 'rtt150' OR 'vistabel' OR 'vistabex' OR 'xeomeen' OR 'xeomin'OR 'botulinium a toxin' OR 'botulinum toxins, type a' |
22407 |
|
|
1 |
exp pelvic pain/ or dysmenorrhea/ or pelvic girdle pain/ or piriformis muscle syndrome/ or Pelvic Floor Disorders/ or pudendal Neuralgia/ |
9626 |
|
|
2 |
((pelvic or pelvis or pudendal) adj3 (pain* or syndrome or neuralgia or myalgia)).ti,ab,kf. |
10582 |
|
|
3 |
((prostatitis or prostate or "levator ani" or constipation or puborectalis) adj3 (neuralgia* or pain* or sydrome* or spasm*)).ti,ab,kf. |
2752 |
|
|
4 |
(prostatalgia or prostatodynia or orchialgia or dyssynergia or Coccydynia or coccygodynia or proctalgia or vestibulodynia or dysmenorrhea* or dysmenorrhoea or vulvodynia or Dyspareunia or "Pyriformis syndrome").ti,ab,kf. |
11580 |
|
|
5 |
((bladder or testicular or urethral or scrotal or groin or epididymal or "post vasectom*" or genital or coccyx or sacrococcygeal or anal or anorectal or vestibular or vulvar or "Fissure in Ano" or perineal) adj3 pain*).ti,ab,kf. |
8705 |
|
|
6 |
(((interstitial or recurrent) adj2 (cystitides or cystitis)) or ((suprapubic or abdominal or endometriosis) adj3 (neuralgia* or pain*))).ti,ab,kf. |
61668 |
|
|
7 |
((proctitis or defecation or hemorrhoid* or haemorrhoid*or diverticulitis or PID or "pelvic inflammatory disease*") adj3 (neuralgia* or pain*)).ti,ab,kf. |
855 |
|
|
8 |
((voiding or prostat* or menstrual or menstruation or childbirth or vaginal or vulvar or urethral or "cauda equina") adj3 (neuralgia* or pain*)).ti,ab,kf. |
5151 |
|
|
9 |
("pelvic floor" adj3 (overactivity or dysfunction or "resting tone" or hypertonicity)).ti,ab,kf. |
1046 |
|
|
10 |
or/1-9 |
92084 |
|
|
11 |
exp Chronic Disease/ or (chronic or chronically or persistent or constant* or continuing or sustained or lasting or refractory or refractories or ((interstitial or recurrent) adj2 (cystitides or cystitis))).ti,ab,kf. or Chronic Pain/ |
2195861 |
|
|
12 |
10 and 11 |
22566 |
|
|
13 |
(Groin/ or exp Testicular Diseases/ or Scrotum/ or Pelvic Floor/) and Chronic Pain/ |
142 |
|
|
14 |
12 or 13 |
22590 |
|
|
15 |
exp Botulinum Toxins, Type A/ |
8624 |
|
|
16 |
(btxa or bont a or bont serotype a or clostridium botulinum neurotoxin a or clostridium botulinum neurotoxin type a or clostridium botulinum type a neurotoxin or abobotulinumtoxin a or abobotulinumtoxina or azzalure or bocouture or botox or botulin a or botulin toxin a or botulinum a exotoxin or botulinum a toxin or botulinum neurotoxin a or botulinum neurotoxin type a or botulinum toxin a or botulinum toxin type a or clostridium botulinum a toxin or clostridium botulinum endotoxin or clostridium botulinum toxin type a or daxibotulinumtoxin a or daxibotulinumtoxina or dwp 450 or dwp450 or dyslor or dysport or evabotulinum toxin a or evabotulinumtoxin a or evabotulinumtoxina or evosyal or incobotulinum toxin a or incobotulinumtoxin a or incobotulinumtoxina or jeuveau or letibotulinumtoxin a or letibotulinumtoxina or meditoxin or mt 10109 or mt10109 or nabota or nivobotulinum toxin a or nivobotulinumtoxin a or nivobotulinumtoxina or nt 201 or nt201 or oculinum or onabotulinum toxin a or onabotulinumtoxin a or onabotulinumtoxina or onaclostox or prabotulinumtoxin a or prabotulinumtoxin a xvfs or prabotulinumtoxina or prabotulinumtoxina xvfs or prabotulinumtoxina-xvfs or prosigne or purtox or reloxin or rtt 150 or rtt150 or vistabel or vistabex or xeomeen or xeomin or botulinium a toxin or botulinum toxins, type a).ti,ab,kf. |
9115 |
|
|
17 |
15 or 16 |
11744 |
|
|
18 |
14 and 17 |
202 |
|
|
19 |
limit 18 to yr="1999 -Current" |
200 |
|
|
20 |
limit 19 to english language |
189 |
|
|
21 |
((meta-analysis/ or meta-analysis as topic/ or (metaanaly* or metanaly* or meta-analy* or meta synthes* or metasynthes* or (pooled adj3 analysis)).ti,ab,kf. or ((systematic* or scoping or evidence based) adj3 (review* or overview*)).ti,ab,kf. or ((evidence or research) adj3 synthesis).ti,kf. or systematic review.pt. or (prisma or (("structured literature" or comprehensive or "quantitative literature" or evidence-based) adj2 (search or review)) or "systematic search" or ((systemic or systematized) adj3 review) or "systematic research synthesis" or (review* adj3 independent*))).ti,ab,kf. or (((quantitative or rapid or short or critical* or structured or comparative or comparitive or evidence or comprehensive) adj3 (review* or overview*)).ti. and search.ab.) or "Review Literature as Topic"/ or cochrane.jw. or (cochrane or embase or medline or cinahl or cinhal or cancerlit).ab. or (("selection criteria" or "data extraction").ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) |
341212 |
|
|
22 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
1886948 |
|
|
23 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3242823 |
|
|
24 |
20 and 21 |
29 |
|
|
25 |
20 and 22 |
87 |
|
|
26 |
20 and 23 |
61 |
