Leefstijltraject rondom een metabole chirurgie bij behandeling van obesitas
Uitgangsvraag
Wat is de rol van het leefstijl traject rondom een metabole chirurgie?
Aanbeveling
Aanbeveling 1
Verwijs een patiënt naar een gecombineerd leefstijlinterventie programma met begeleiding door de hierbij betrokken paramedici en/ of leefstijlcoaches als uit de multidisciplinaire screening blijkt dat patiënt:
- onvoldoende kennis over voeding en/of een sterk onregelmatig voedingspatroon heeft;
- een onvolwaardige leefstijl heeft (met betrekking tot beweging, stress en/ of slapen);
- moeite heeft met het opvolgen van dieet- en beweegadviezen, of onvoldoende therapietrouw toont.
Aanbeveling 2
Maak voorafgaand aan de operatie een inschatting van de benodigde zwaarte van de postoperatieve leefstijlinterventie.
Bied een patiënt laagdrempelig postoperatieve leefstijlinterventie aan wanneer er:
- onvoldoende gewichtsverlies wordt bereikt dan wel gewicht weer aanzienlijk toeneemt;
- onvolwaardige leefstijlverandering wordt bereikt;
- aanwijzingen zijn dat patiënt moeite heeft met het volgen van beweeg- en dieetadviezen.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de beschikbare wetenschappelijke evidentie is de bewijskracht voor het effect van leefstijl interventies voor en na metabole chirurgie laag tot zeer laag. Hierbij is literatuur die betrekking heeft op de maagband expliciet weggelaten.
De reden voor de lage bewijskracht zit hem in het beperkt aantal studies, de diversiteit van interventies en uitkomstmaten die gebruikt worden en methodologische beperkingen in de studies. Daarnaast verschillen de studies sterk in de follow-up termijn en wie er geïncludeerd worden. Sommige studies includeren alle patiënten terwijl andere studies alleen patiënten includeren die onvoldoende compliant zijn aan dieet- en beweegadviezen of onvoldoende afvallen. Interventies waar nu weinig bewijs voor wordt gevonden zouden mogelijk effectiever blijken te zijn wanneer aangeboden aan een geselecteerde patiëntenpopulatie. De hoogste bewijskracht (lage GRADE) wordt gevonden voor het effect van leefstijlinterventies op gewichtsverlies.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Doel van leefstijl interventies rondom metabole chirurgie is het optimaliseren van de resultaten op de korte en langere termijn door compliance aan dieet- en beweegadviezen te vergroten. Het is bekend dat een grote groep patiënten zich niet houdt aan dieet- en beweegadviezen (Aarts, 2015; De Jong, 2017).
Hoewel het bij een deel van de patiënten niet noodzakelijk is om leefstijlinterventies aan te bieden in aanvulling op metabole chirurgie zal een significante subgroep wel degelijk gebaat zijn bij extra zorg om de noodzakelijke gedragsverandering door te voeren en vol te houden. Er zijn aanwijzingen vanuit de literatuur dat deelname aan een leefstijlprogramma een meerwaarde heeft als het gaat om gewichtsafname en het behoud daarvan en het in remissie blijven van co-morbiditeiten als diabetes (Jurgensen, 2019). Voor een one-size-fits-all benadering lijkt geen steun te bestaan bij patiënten noch in de wetenschappelijke literatuur.
Kosten (middelenbeslag)
Wanneer metabole chirurgie niet tot duurzaam gewichtsverlies leidt zijn er nauwelijks nog alternatieven, met alle persoonlijke en maatschappelijke gevolgen van dien. Van groot belang is dat patiënten optimaal en langdurig profiteren van de metabole ingreep.
Hoewel een deel van de patiënten voldoende heeft aan een chirurgische ingreep zal een aanzienlijk aantal patiënten baat hebben bij aanvullende leefstijl interventies om zich aan te passen aan het veranderd eet- en beweegpatroon. De kosten van de leefstijlinterventies aan deze groep patiënten zijn aanzienlijk minder dan de kosten en het verlies in kwaliteit van leven wanneer patiënten opnieuw chirurgisch ingrijpen nodig hebben en/of ernstig overgewicht houden wat vaak gepaard gaat met diverse co-morbiditeiten en andere zorgvragen.
Aanvaardbaarheid voor de overige relevante stakeholders
De werkgroep voorziet geen bezwaar van overige relevante stakeholders voor het aanbieden van pre- of postmetabole leefstijlinterventies.
Haalbaarheid en implementatie
Voor het tijdig kunnen aanbieden van leefstijl interventies aan patiënten die daar daadwerkelijk baat bij kunnen hebben omdat zij (dreigen) niet optimaal (te) profiteren van metabole chirurgie is het nodig om gewicht, eet- en beweeggedrag en compliance aan dieet- en beweegadviezen routinematig te monitoren. De intake fase voor de chirurgie kan gebruikt worden om die patiënten te selecteren die maximaal effect van een leefstijlinterventie zullen hebben.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Aanbeveling-1
De bewijskracht voor de geselecteerde uitkomstmaten is laag tot zeer laag. De ervaring leert dat sommige patiëntgroepen gebaat zullen zijn bij een preoperatieve leefstijlinterventie. Hiervoor zijn enkele indicaties geformuleerd. Er is niet een eenduidige invulling van een leefstijlinterventie om aan te bevelen. De invulling van de leefstijlinterventie zal afhangen van de behoeften van de patiënt.
In het kader van ‘matched care’ is het goed om na te gaan of de patiënt qua leefstijl iets te verbeteren heeft en baat kan hebben bij een leefstijlinterventie. Indien dat het geval is, verwijs dan naar een gecombineerd leefstijlinterventie programma met begeleiding door de hierbij betrokken paramedici en/of leefstijlcoaches. Bij onvoldoende effect kan dan naar oordeel van de zorgverlener tijdig opgeschaald worden naar farmacotherapie of metabole chirurgie.
Aanbeveling-2
De bewijskracht voor de geselecteerde uitkomstmaten is laag tot zeer laag. De ervaring leert dat sommige patiëntgroepen gebaat zullen zijn bij een postoperatieve leefstijlinterventie (Jurgensen, 2019). Hiervoor zijn enkele indicaties geformuleerd. Er is niet een eenduidige invulling van een leefstijlinterventie om aan te bevelen. De invulling van de leefstijlinterventie zal afhangen van de behoeften van de patiënt.
Onderbouwing
Achtergrond
Ernstig overgewicht kan reden zijn voor bariatrisch ingrijpen. Het ontstaan van het ernstige overgewicht als mede de effectiviteit van bariatrisch ingrijpen is vaak multifactorieel bepaald waarbij therapietrouw aan dieet- en beweegadviezen voor de lange termijn resultaten van groot belang is. De leefstijl interventies gegeven aan patiënten voor en na metabole chirurgie om therapietrouw te optimaliseren zijn echter zeer divers in Nederland. Het verminderen van de praktijkvariatie op basis van wetenschappelijke evidentie en de beste behandeling, gebaseerd op klinische expertise, is nodig zodat patiënten de juiste zorg krijgen. De leefstijlinterventie heeft als doel de uitkomsten van de metabole operatieve ingreep te versterken en is een aanvulling op de chirurgische ingreep. Veel patiënten hebben naast onvoldoende kennis van gezond gedrag, onvoldoende inzicht in eigen voedingspatroon, eetgedrag en ontbreekt het aan voldoende voedselvaardigheden. Dit kan een risico vormen voor succes op de lange termijn dat vermindert door een leefstijlinterventie.
Conclusies / Summary of Findings
Uitkomstmaat 1. Gewichtsverlies (cruciaal)
|
Laag GRADE |
Een leefstijlinterventie, zowel pre- als postoperatief, resulteert mogelijk in meer gewichtsverlies na metabole chirurgie vergeleken met standaard zorg.
Bronnen: (Bond, 2015; Camolas, 2016; Kalarchian, 2013; Kalarchian, 2016 Macron, 2017; Ren, 2018; Stewart, 2015 ) |
Uitkomstmaat 2. Verbetering co-morbiditeiten (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van een leefstijlinterventie op verbetering van co-morbiditeiten na metabole chirurgie vergeleken met standaard zorg
Bronnen: (Camolas, 2016; Ren, 2018; Stewart, 2015) |
Uitkomstmaat 3. Kwaliteit van leven (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van een leefstijlinterventie op de kwaliteit van leven na metabole chirurgie vergeleken met standaard zorg.
Bronnen: (Bond, 2015; Camolas, 2016; Kalarchian, 2016) |
Uitkomstmaat 4. Leefstijlverandering (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van een leefstijlinterventie op leefstijlverandering na metabole chirurgie vergeleken met standaard zorg.
Bronnen: (Bond, 2015; Kalarchian, 2016; Ren, 2018) |
Uitkomstmaat 5. compliance (belangrijk)
|
- GRADE |
Er is geen GRADE-beoordeling voor deze uitkomstmaat in verband met het ontbreken van studies. |
Samenvatting literatuur
Beschrijving studies
De systematische review van Stewart (2015) zocht naar RCT’s of studies met een quasi-experimenteel design gericht op gedragsverandering (gerelateerd aan dieet of fysieke activiteit) en een minimum follow-up van 6 maanden. Elf studies werden geïncludeerd, waarvan er vier RCT’s voldeden aan de PICO. De overige studies boden alleen een psychologische interventie (zie de module 'Psychologie rondom metabole chirurgie') of includeerden >10% patiënten met een maagband zonder de resultaten afzonderlijk te presenteren. Van de 4 studies bood er 1 studie (Solomon, 2009) een preoperatieve interventie, waarbij 50 patiënten gevraagd werden om meer dan 10 % excess weight loss te verliezen voor de operatie versus 50 patiënten in de controle groep. Drie studies boden een postoperatieve interventie; één RCT (Coen, 2015) vergelijk 66 patiënten die gezondheidseducatie sessies plus een oefenprogramma met supervisie ontvingen met 62 patiënten die alleen gezondheidseducatie sessies kregen, één RCT (Nijamkin, 2012) vergeleek 72 patiënten die dieetadvies kregen met het advies 1000-1400 kcal en 60 tot 70 gram eiwitten per dag met 72 patiënten die geprinte instructies kregen over gezond eten en fysieke activiteit, een andere RCT (Swenson, 2007) vergeleek 19 patiënten die een eiwitrijk dieet kregen (South Beach Diet) met 13 patiënten die een standaard postoperatief dieet met weinig vet kregen. De follow-up duur varieerde van 6 tot 12 maanden.
De systematische review van Ren (2018) zocht naar RCT’s of studies met een quasi-experimenteel design specifiek gericht op lichaamsbeweging na metabole chirurgie. Acht studies werden geïncludeerd, waarvan er zes RCT’s voldeden aan de PICO. Eén van deze RCT’s (Coen, 2015) werd ook geïncludeerd in het review van Stewart (2015). De vijf overige RCT’s vergeleken diverse therapieën gericht op het verhogen van lichaamsbeweging met een controle groep bij totaal 227 patiënten. De follow-up duur varieerde van 3 tot 24 maanden.
Kalarchian (2013) beschreef resultaten van een RCT waarbij 119 patiënten die standaard zorg kregen werden vergeleken met 121 patiënten die ongeveer 6 maanden een leefstijlinterventie kregen met 8 face-to-face sessies gevolgd door 16 weken telefonische coaching voorafgaand aan een metabole operatieve ingreep. De leefstijlinterventie bestond uit een dieet van 1200 tot 1400 calorieën per dag, een programma gericht op lichaamsbeweging (bijvoorbeeld zwemmen of wandelen) en leefstijladviezen kregen, bijvoorbeeld over een actievere leefstijl (traplopen), zelfmanagement betreffende postoperatief gewichtscontrole, eetgedrag en gemoedstoestand. 15% in de interventiegroep en 29% in de controle groep viel uit na randomisatie en werd geëxcludeerd in de analyse.
Bond (2015) beschreef een RCT waarbij 38 patiënten die standaard zorg kregen werden vergeleken met 42 patiënten die een fysieke activiteiten interventie kregen voorafgaand aan een metabole operatieve ingreep. De interventie bestond uit 6 opeenvolgende wekelijkse face-to-face counseling sessies, waarbij patiënten gedrags- en cognitieve strategieën geleerd werden om de interventiedoelen te bereiken, waaronder hoeveel gewandeld zou worden en huiswerkopdrachten gericht op gedragsverandering. 5% in de interventiegroep en 8% in de controle groep viel uit na randomisatie en werd geëxcludeerd in de analyse.
Camolas (2016) beschreef resultaten van een RCT waarbij 79 patiënten die standaard zorg kregen werden vergeleken met 68 patiënten die ongeveer 6 maanden een leefstijlinterventie kregen voorafgaand aan metabole chirurgie. De leefstijlinterventie was gebaseerd op ‘INDIVIDUO’s’ procedures en werd gegeven door voedingsdeskundigen. Het doel van de interventie was om de energiedichtheid van het dieet te verlagen, een regelmatig eetpatroon aan te nemen, de eetsnelheid te verlagen en fysieke activiteit te verhogen. 24% in de interventiegroep en 23% in de controle groep viel uit na randomisatie en werd geëxcludeerd in de analyse.
Macron (2017) beschreef resultaten van een driearmige RCT, waarbij 22 patiënten gedurende 4 maanden een beweegprogramma met lage intensiteit kregen, waarvan twee keer per week met supervisie, 22 patiënten kregen hetzelfde beweegprogramma plus een support groep programma voor leefstijlaanpassingen (één keer per week) met een cognitief-gedragsmatige benadering en 22 patiënt standaard zorg voorafgaand aan metabole chirurgie. Geen van de patiënten in de oefeningengroep, 23% in de oefeningen plus leefstijlgroep en 18% in de controle groep viel uit na randomisatie en werd geëxcludeerd in de analyse.
Kalarchian (2016) beschreef resultaten van een pilot RCT waarbij 20 patiënten een 4 maanden durende gestructureerde dieetinterventie kregen, waarbij onder andere maaltijden werden thuis werden bezorgd werden vergeleken met 20 patiënten in een controlegroep. Patiënten die tussen de 10 en 14 maanden metabole chirurgie hadden ondergaan werden geïncludeerd.
Tabel 1 Overzicht van geïncludeerde studies
|
Studie |
Interventie |
Controle |
|
Preoperatief |
||
|
Solomon, 2009 (in systematische review) |
Gewichtsverlies |
Geen |
|
Kalarchian, 2013 |
Dieetadvies, beweegprogramma en leefstijladvies |
Standaard zorg |
|
Bond, 2015 |
Fysieke activiteiten met gedrags- en cognitieve strategieën |
Standaard zorg |
|
Camolas, 2016 |
Leefstijladviezen over dieet en fysieke activiteit |
Standaard zorg |
|
Macron, 2017 |
Beweegprogramma met of zonder support groep voor leefstijlaanpasisngen |
Standaard zorg |
|
Postoperatief |
||
|
Kalarchian, 2016 |
Gestructureerde dieetinterventie |
Korte instructie over gewichtscontrole na metabole chirurgie |
|
Nijamkin, 2012 (in Stewart, 2015) |
Dieetadvies |
Geprinte instructies |
|
Swenson, 2007 (in Stewart, 2015) |
Eiwitrijk dieet |
Standaard dieet met weinig vet |
|
Coen, 2015 (in Stewart, 2015 en Ren, 2018) |
Gezondheidseducatie sessies plus een beweegprogramma |
Gezondheidseducatie sessies |
|
Castello, 2011 (in Ren, 2018) |
Beweegprogramma |
Standaard zorg |
|
Coleman 2016 (in Ren, 2018) |
Beweegprogramma |
Standaard zorg |
|
Hassannejad 2017 (in Ren, 2018) |
Beweegprogramma |
Geen |
|
Mundbjerg 2018 (in Ren, 2018) |
Beweegprogramma |
Standaard informatie over het belang van fysieke activiteit |
|
Herring 2017 (in Ren, 2018) |
Beweegprogramma |
Standaard zorg |
Resultaten
Uitkomstmaat 1. Gewichtsverlies (cruciaal)
Vier studies rapporteerden het percentage excess weight change. Bij zowel de pre- als postoperatieve interventies had de interventiegroep een grotere excess weight change. Het gepoolde gemiddelde verschil was -8,70 (95% BI -12,94 tot -4,45) bij preoperatieve leefstijlinterventies en -8,42 (95% BI -24,50 tot 7,66) bij postoperatieve leefstijlinterventies (figuur 1).
Figuur 1 Percentage excess weight change leefstijl interventie versus standaard zorg
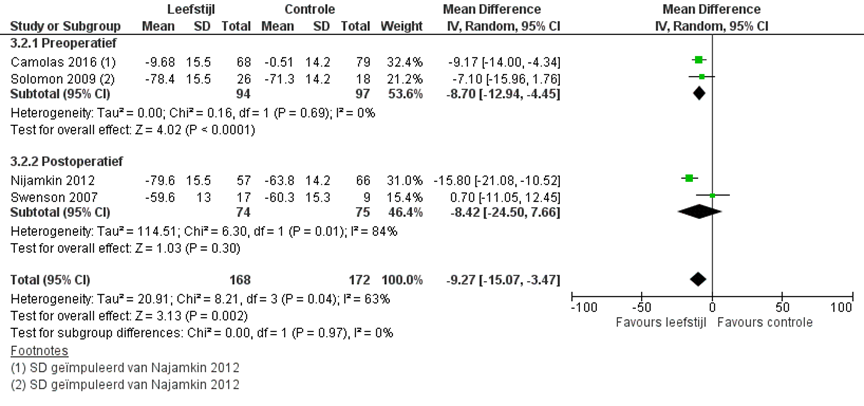
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Elf studies rapporteerden het gewicht na de interventie of het verschil tussen het baseline gewicht en het follow-up gewicht. Bij studies met postoperatieve interventies was het gepoolde gemiddelde verschil in gewichtsverlies -3,66 kg (95% BI -7,90 tot 0,59) in het voordeel van de interventiegroep. Bij studies met preoperatieve interventies was het gepoolde gemiddelde verschil in gewichtsverlies -2,44 kg (95% BI -3,69 tot -1,19) in het voordeel van de interventiegroep (figuur 2).
Figuur 2 Gewichtsverlies (kg) leefstijl interventie versus standaard zorg
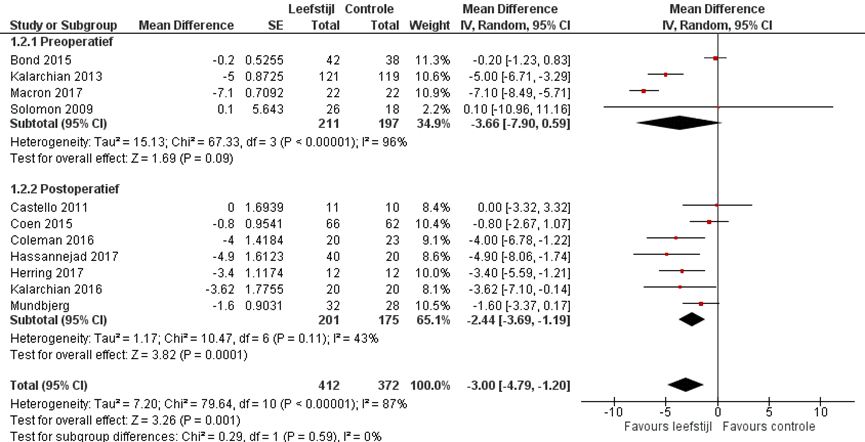
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat gewichtsverlies was afkomstig uit RCT’s en begint op hoog. De bewijskracht is met twee niveaus verlaagd naar laag; één niveau verlaagd voor risk of bias (onduidelijke allocatie concealment, hoog aantal lost to follow-up, geen intention to treat analyse), één niveau vanwege klinische en statistische inconsistentie (verschillen in interventies, rapportage van gewichtsverlies, verschillende resultaten).
Uitkomstmaat 2. Verbetering co-morbiditeiten (cruciaal)
Solomon (2009) rapporteerde het gemiddelde aantal co-morbiditeiten. Dit was na 1 jaar follow-up 0,3 in de leefstijlgroep (n=50) versus 0,7 in de controle groep (n=50). De andere studies rapporteerden niet over co-morbiditeiten. Wel werden er een aantal waarden gerapporteerd.
Bloeddruk
Camolas (2016) rapporteerden de afname in bloeddruk ten opzichte van baseline na een preoperatieve interventie. De systolische druk nam met 0,45 (95% BI -2,97 tot 3,87) mm Hg meer af in de controle groep (figuur 3) en de diastolische bloeddruk nam met 0,18 (95% BI -3,39 tot 3,03) mm Hg meer af in de interventiegroep (figuur 4). Dit is geen klinisch relevant verschil.
Vier studies rapporteerde de systolische en diastolische bloeddruk na een postoperatieve leefstijlinterventie. Het gepoolde gemiddelde verschil voor de systolische bloeddruk was -3,35 (95% BI -5,91 tot -0,78) mm Hg (figuur 3) in het voordeel van de interventiegroep en het gepoolde gemiddelde verschil voor de diastolische bloeddruk was -3,84 (95% BI -6,48 tot -1,20) mm Hg (figuur 4) in het voordeel van de interventiegroep.
Figuur 3 Systolische bloeddruk leefstijl interventie versus standaard zorg
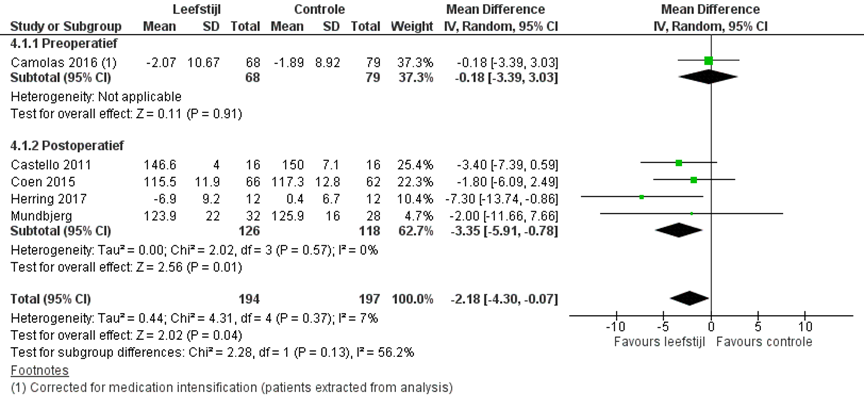
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 4 Diastolische bloeddruk leefstijl interventie versus standaard zorg
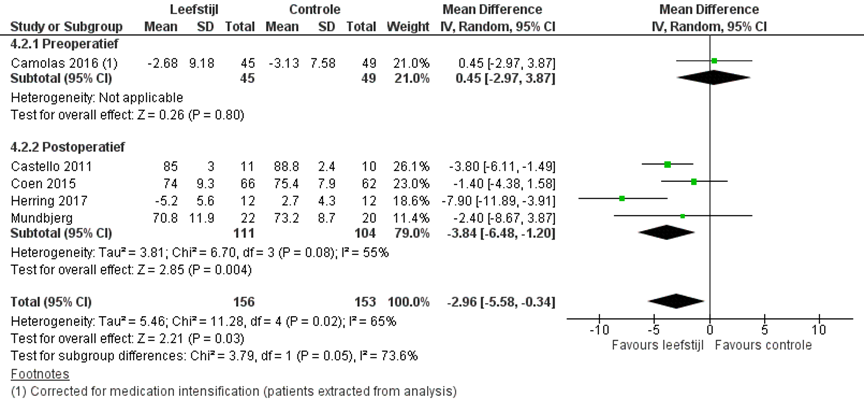
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Totaal cholesterol
Drie studies rapporteerden het totaal cholesterol. Macron (2017) vond een gemiddeld verschil van -0,31 (95% BI -0,98 tot 0,36) in het voordeel van een interventiegroep. Twee studies vonden een gepoold gemiddeld verschil van -0,31 (95% BI -0,98 tot 0,36) in het voordeel van de controle groep (figuur 5).
Figuur 5 Totaal cholesterol (mmol/L) leefstijl interventie versus standaard zorg
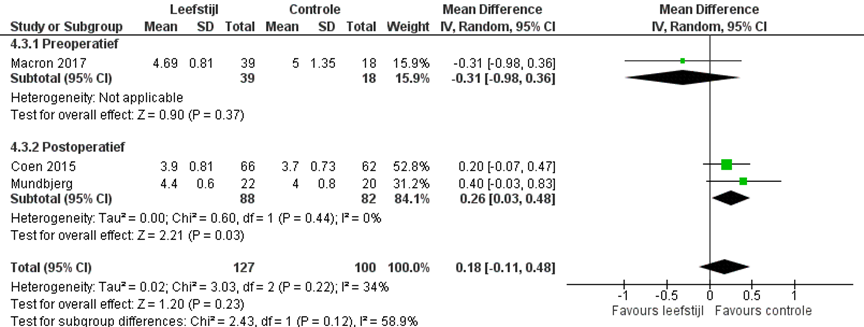
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Hemoglobine A1c (HbA1c)
Eén studie (Camolas, 2016) rapporteerde de afname in het HbA1c percentage ten opzichte van baseline. Dit was -0,13 (SD 0,33) in de interventiegroep versus -0,05 (SD 0,18) in de controlegroep. Eén studie in het review van Ren (2018) rapporteerde de HbA1c in mmol/L na twee jaar follow-up. De HbA1c was 34,1 (SD 4,1) in de interventiegroep versus 36,6 (SD 7,5) in de controlegroep.
Nuchtere glucose
Eén studie (Camolas, 2016) rapporteerde de afname in nuchtere glucose ten opzichte van baseline. Dit was -0,11 (SD 0,37) in de interventiegroep versus 0,07 (SD 0,48) in de controlegroep.
Eén studie in het review van Ren (2018) rapporteerde de nuchtere glucose na 4 maanden follow-up. Dit was 4,67 (SD 0,44) in de interventiegroep versus 4,75 (SD 0,62) in de controlegroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat verbetering van co-morbiditeiten was afkomstig uit RCT’s en begint op hoog. De bewijskracht is met drie niveaus verlaagd naar zeer laag; één niveau verlaagd voor risk of bias (onduidelijke allocatie concealmeant, geen intention-to-treat analyse, hoog aantal lost to follow-up), één niveau vanwege klinische en statistische inconsistentie (verschillende vragenlijsten, tegenstrijdige resultaten, verschillende interventies) en met één niveau vanwege imprecisie (gering aantal patiënten).
Uitkomstmaat 3. Kwaliteit van leven (belangrijk)
De systematische reviews rapporteerden geen kwaliteit van leven. Drie aanvullende RCT’s rapporteerden dit wel. Bond (2015) rapporteerde een gemiddelde physical component score van 44,3 (SD 9,1) in de leefstijlgroep (n=42) versus 39,6 (SD 9,2) in de controle groep (n=38) (gemiddeld verschil 4,70; 95% BI 0,68 tot 8,72). De mentale componentscore was 49,2 (SD 10,1) in de leefstijlgroep versus 47,7 (SD 13,3) in de controle groep (gemiddeld verschil 1,50; 95% BI -3,72 tot 6,72).
Camolas (2016) rapporteerde verbetering in kwaliteit van leven op de ORWELL-R totale score. In de leefstijlgroep verbeterden patiënten met 11,04 punten (n=68) en in de controle groep met 6,58 punten (n=117).
Kalarchian (2016) rapporteerde de kwaliteit van leven op de Participant Impact of Weight on Quality of Life (IWQOL-Lite). Dit was 91,6 (SD 2,1) in de leefstijlgroep (n=20) versus 89,1 (SD 2,2) in de controle groep (n=20) (gemiddeld verschil 2,50 (95% BI 1,17 tot 3,83).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven was afkomstig uit RCT’s en begint op hoog. De bewijskracht is met drie niveaus verlaagd naar zeer laag; één niveau verlaagd voor risk of bias (onduidelijke allocatie concealment, geen intention-to-treat analyse, hoog aantal lost to follow-up), één niveau vanwege klinische en statistische inconsistentie (verschillende vragenlijsten, tegenstrijdige resultaten, verschillende interventies) en met één niveau vanwege imprecisie (gering aantal patiënten).
Uitkomstmaat 4. Leefstijlverandering (belangrijk)
Bond (2014) rapporteerde verandering in dagelijkse matig-tot-vitale fysieke activiteit gemeten met een SenseWear armband. In de leefstijlgroep (n=42) bewogen patiënten gemiddeld 16,6 (SD 20,7) minuten per dag extra ten opzichte van baseline. In de controle groep (n=38) was dit -0,3 (SD 12,7) minuten per dag.
Eén studie in het review van Ren (2018) rapporteerde het verschil in dagelijkse matig-tot-vitale fysieke activiteit na 24 weken follow-up vergeleken met baseline. In de interventiegroep werd er een toename gezien van 7,5 (SD 19,8) minuten per dag (n=12) vergeleken met een afname van -3,4 (SD 16,2) minuten per dag in de controlegroep (n=12). Wel hadden de patiënten in de controlegroep een grotere toename in het aantal stappen per dag vergeleken met de interventiegroep. Dit was een toename van 242,7 (SD 2358,1) stappen in de interventiegroep versus 530,4 (SD 2300,2) stappen in de controlegroep.
Kalarchian (2016) rapporteerde verandering in calorie inname. Na 4 maanden nam de leefstijlgroep 108 calorieën minder (n=20) in ten opzichte van baseline versus 116 calorieën die de controle groep (n=20) extra innam ten opzichte van baseline. Na 6 maanden werd er geen significant verschil meer gevonden tussen de groepen (aantal calorieën werd niet gerapporteerd).
Eén studie in het review van Ren (2018) rapporteerde het verschil in calorie inname na 24 weken follow-up vergeleken met baseline. In de interventiegroep werd er een afname in calorie inname gezien van -209,2 (SD 478,5) kcal (n=12) vergeleken met een toename van 152,4 (SD 560,7) in de controlegroep (n=12).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat leefstijlverandering was afkomstig uit RCT’s en begint op hoog. De bewijskracht is met drie niveaus verlaagd naar zeer laag; één niveau verlaagd voor risk of bias (onduidelijke allocatie concealmeant, geen intention-to-treat analyse, hoog aantal lost to follow-up), één niveau vanwege klinische en statistische inconsistentie (verschillende vragenlijsten, tegenstrijdige resultaten, verschillende interventies) en met één niveau vanwege imprecisie (gering aantal patiënten).
Uitkomstmaat 5. compliance (belangrijk)
Deze uitkomstmaat werd niet gerapporteerd in de gevonden studies.
Bewijskracht van de literatuur
Er is geen GRADE-beoordeling voor de uitkomstmaat ‘compliance’ in verband met het ontbreken van studies.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van een leefstijlinterventie rondom metabole chirurgie vergeleken met een andere leefstijlinterventie of standaard zorg bij patiënten met een indicatie voor metabole chirurgie of die metabole chirurgie hebben ondergaan?
P: patiënten met een indicatie voor metabole chirurgie of die metabole chirurgie hebben ondergaan;
I: interventie gericht op leefstijlverandering rondom metabole chirurgie;
C: andere leefstijlinterventie/ standaard zorg;
O: (behoud van) gewichtsverlies (uitgedrukt in % Total Body Weight Loss of % Excess Weight Loss), verbetering van co-morbiditeit, kwaliteit van leven, leefstijlverandering.
Relevante uitkomstmaten
De werkgroep achtte (behoud van) gewichtsverlies en verbetering van co-morbiditeit voor de besluitvorming cruciale uitkomstmaten en kwaliteit van leven, leefstijlverandering, compliance voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde voor geen van de uitkomstmaten klinische (patiënt) relevante verschillen. We hanteerden daarom, indien van toepassing, de onderstaande grenzen voor klinische relevantie en vergeleken de resultaten met deze grenzen: RR < 0,75 of > 1,25) (GRADE-recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot). De interpretatie van continue uitkomstmaten is sterk context gebonden en hiervoor werden a priori geen grenzen voor klinische relevantie benoemd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 20 december 2018 met relevante zoektermen gezocht naar systematische reviews en RCT’s die een leefstijlinterventie vergeleken met een andere leefstijlinterventie of standaard zorg bij patiënten met een indicatiestelling voor bariatrie of die een metabole operatieve ingreep hebben ondergaan. Op 7 januari 2019 is een aanvullende bredere search gedaan in Embase. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Daarnaast werden referentielijsten van reviews bekeken. De literatuurzoekactie leverde 1570 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- RCT’s die elke vorm van leefstijlverandering (voeding- en/ of beweegcomponent) vergelijken met standaard zorg of een andere leefstijlinterventie.
- Vergelijking bij patiënten met een indicatiestelling voor metabole chirurgie of die een metabole operatieve ingreep hebben ondergaan.
Studies die > 10% patiënten includeerde met revisie chirurgie, biliopancreatic diversion met duodenal switch of maagband zonder de resultaten afzonderlijk te rapporteren zijn geëxcludeerd.
Op basis van titel en abstract werden in eerste instantie 18 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens elf studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en zeven studies definitief geselecteerd.
Resultaten
Twee systematische reviews en vijf aanvullende studies zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Aarts F, Geenen R, Gerdes VE, van de Laar A, Brandjes DP, Hinnen C. Attachment anxiety predicts poor adherence to dietary recommendations: an indirect effect on weight change 1 year after gastric bypass surgery. Obes Surg. 2015 Apr;25(4):666-72. doi: 10.1007/s11695-014-1423-7. PubMed PMID: 25204408.
- Bond DS, Thomas JG, King WC, Vithiananthan S, Trautvetter J, Unick JL, Ryder BA, Pohl D, Roye GD, Sax HC, Wing RR. Exercise improves quality of life in bariatric surgery candidates: results from the Bari-Active trial. Obesity (Silver Spring). 2015 Mar;23(3):536-42. doi: 10.1002/oby.20988. Epub 2015 Jan 22. PubMed PMID: 25611582; PubMed Central PMCID: PMC4339393.
- Camolas J, Santos O, Moreira P, do Carmo I. INDIVIDUO: Results from a patient-centered lifestyle intervention for obesity surgery candidates. Obes Res Clin Pract. 2017 Jul - Aug;11(4):475-488. doi: 10.1016/j.orcp.2016.08.003. Epub 2016 Aug 25. PubMed PMID: 27569864.
- de Jong MMC, Hinnen C. Bariatric surgery in young adults: a multicenter study into weight loss, dietary adherence, and quality of life. Surg Obes Relat Dis. 2017 Jul;13(7):1204-1210. doi: 10.1016/j.soard.2017.02.026. Epub 2017 Mar 7. PubMed PMID: 28396129.
- Jurgensen JA, Reidt W, Kellogg T, Mundi M, Shah M, Collazo Clavell ML. Impact of Patient Attrition from Bariatric Surgery Practice on Clinical Outcomes. Obes Surg. 2019;29(2):579-584. doi:10.1007/s11695-018-3565-5
- Kalarchian MA, Marcus MD, Courcoulas AP, Cheng Y, Levine MD. Preoperative lifestyle intervention in bariatric surgery: initial results from a randomized, controlled trial. Obesity (Silver Spring). 2013 Feb;21(2):254-60. doi: 10.1002/oby.20069. PubMed PMID: 23404832; PubMed Central PMCID: PMC3610845.
- Kalarchian MA, Marcus MD, Courcoulas AP, Lutz C, Cheng Y, Sweeny G. Structured dietary intervention to facilitate weight loss after bariatric surgery: A randomized, controlled pilot study. Obesity (Silver Spring). 2016 Sep;24(9):1906-12. doi: 10.1002/oby.21591. Epub 2016 Jul 28. PubMed PMID: 27466039.
- Marcon ER, Baglioni S, Bittencourt L, Lopes CL, Neumann CR, Trindade MR. What Is the Best Treatment before Bariatric Surgery? Exercise, Exercise and Group Therapy, or Conventional Waiting: a Randomized Controlled Trial. Obes Surg. 2017 Mar;27(3):763-773. doi: 10.1007/s11695-016-2365-z. PubMed PMID: 27620342.
- Ren ZQ, Lu GD, Zhang TZ, Xu Q. Effect of physical exercise on weight loss and physical function following bariatric surgery: a meta-analysis of randomized controlled trials. BMJ Open. 2018 Oct 31;8(10):e023208. doi: 10.1136/bmjopen-2018-023208. PubMed PMID: 30385445; PubMed Central PMCID: PMC6252776.
- Stewart F, Avenell A. Behavioural Interventions for Severe Obesity Before and/or After Bariatric Surgery: a Systematic Review and Meta-analysis. Obes Surg. 2016 Jun;26(6):1203-14. doi: 10.1007/s11695-015-1873-6. Review. PubMed PMID: 26342482.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Kalarchian, 2013 |
Type of study: RCT
Setting and country: Bariatric Center of Excellence at a large, urban medical center, USA
Funding and conflicts of interest: Research supported by R01DK077102 from the National Institute of Diabetes and Digestive and Kidney Diseases. The authors have no conflicts of interest. |
Inclusion criteria: All patients who were at least 18 years of age and seeking bariatric surgery at a Bariatric Center of Excellence.
Exclusion criteria: 1) Mental retardation or psychosis; 2) Previously diagnosed genetic obesity syndrome; 3) Participation in a weight management program in the 6 months prior to study enrollment; 4) Uncontrolled psychiatric symptomatology sufficiently severe to require immediate treatment; 5) Pregnant or lactating in the previous 6 months; 6) Taking a medication known to affect body weight in the previous 6 months (e.g., second generation antipsychotics); 8) Any previous weight loss surgery; 9) Medical condition requiring a specialized preoperative regimen (e.g., nonambulatory, on oxygen therapy for chronic obstructive pulmonary disease); and 10) Participation in a conflicting research protocol.
N total at baseline: Intervention: 121 Control: 119
Important prognostic factors2: Age 45.2 SD 11 years
Sex: 86.7% female
BMI, mean 47.9 SD 6.7 kg/m2
Groups comparable at baseline? Patients randomized to LIFESTYLE and USUAL CARE did not differ significantly in baseline BMI or demographic characteristics. However, only characteristics of all participants are provided. |
Describe intervention (treatment/procedure/test):
LIFESTYLE patients participated in an intervention adapted from the behavioral weight management program. Adaptations included providing information about how surgery facilitates weight loss, emphasizing the role of self-management, and addressing factors that have been related to postoperative weight control such as eating behaviors and mood.
The objective of the behavioral intervention was to decrease calorie intake through diet and increase energy expenditure through physical activity. Participants were given a goal of 1200–1400 calories per day and instructed to stay within the range while maintaining a balanced diet consistent with nutritional guidelines for bariatric surgery. Participants were prescribed an exercise program based on their choice of activity (e.g., walking or swimming). Strategies for increasing lifestyle activity (e.g., taking the stairs or getting off the bus a stop early) were emphasized. Participants were assisted in self-monitoring and setting small, incremental goals for behavior change. The skills required to make the recommended changes in diet and physical activity were modeled, practiced, and reinforced throughout the intervention.
The lifestyle intervention lasted approximately 6 months (8 weekly face-to-face sessions, followed by 16 weeks of alternating face-to-face sessions and telephone coaching). A combination of face-to-face sessions and telephone coaching was utilized to minimize participant burden and maximize the intensity of counseling. Face-to-face sessions lasted 1 hour, consisting of a weigh-in, review of self-monitoring records, a didactic presentation, and homework. Telephone coaching was shorter in duration (15 – 20 minutes) and included a review of progress, problem solving and goal setting. Interventionists received training in behavioral and surgical management of obesity and regular supervision. |
Describe control (treatment/procedure/test):
USUAL CARE patients did not have any additional contact with the study staff until the 6 month assessment. As required by health insurance carriers, patients completed a non-standardized, physician-supervised diet and activity program in the context of routine presurgical care. Most patients were seen once a month for 6 months, either in group sessions provided under |
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: 18 (15%) Reasons: inactivated after randomization: 7 provided specific reasons, 11 unknown
Control: 36 (29%) Reasons: inactivated after randomization: 7 provided specific reasons, 11 unknown 1 died
|
Outcome measures and effect size (include 95%CI and p-value if available):
Weight loss Defined as weight loss between baseline and 6 months follow-up (kg) I: 8.3 SD 7.8 kg C: 3.3 SD 5.5 kg F(1,182) = 23.6, p < 0.0001 |
Author’s conclusion A behavioral lifestyle intervention for severely overweight individuals leads to clinically significant weight loss prior to bariatric surgery. Post-surgery follow-up will allow us to examine the impact of the preoperative intervention on postoperative outcomes. |
|
Bond, 2015 |
Type of study: RCT
Setting and country: USA
Funding and conflicts of interest: This research was supported by a grant from the National Institutes of Health/National Institute of Diabetes & Digestive & Kidney Diseases (DK083438, PI: Bond).
The authors have no competing interests. |
Inclusion criteria: Participants were 80 ambulatory individuals aged 18–70 years old with severe obesity (body mass index (BMI) ≥35 kg/m2) who were seeking bariatric surgery. Participants had to report being able to walk ≥2 blocks unassisted, but report insufficient PA (i.e. <150 MVPA minutes/week accumulated in bouts ≥10 minutes as per national guidelines).
Exclusion criteria: Individuals were deemed ineligible if they were scheduled for a bariatric operation within 10 weeks of initial screening or during the intervention period, currently participating in another PA or weight loss program, intended to move to another geographic location during the course of the study, or had medical, psychiatric, or language barriers that would interfere with ability to participate in and follow the study protocol.
N total at baseline: Intervention: 42 Control: 38
Important prognostic factors2: Age, mean (SD): I: 44.2 (9.2) C: 48.1 (8.1)
Sex: I: 15% M C: 11.4% M
BMI, mean (SD) I: 45.6 (7.0) C :44.4 (5.8)
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Physical activity intervention (PAI) consisted of 6 consecutive weekly individual face-to-face counseling sessions with the primary author at a single site (in addition to receiving standard pre-surgical care). Sessions lasted 30–45 minutes, were conducted using a counselor manual and lesson handouts for participants, and included the following activities: reviewing participants’ PA self-monitoring records; problem-solving barriers to achieving intervention goals; teaching behavioral and cognitive strategies to achieve intervention goals; setting weekly bout-related walking exercise and step goals; developing an action plan for when, where, and how the target amount of bout-related walking exercise would be achieved; and explaining homework assignments focusing on application of PA behavior change strategies. PAI strategies were drawn from the Diabetes and Prevention Program and Look AHEAD trials, and health behavior change theories that have been successfully applied to increase PA in obese individuals.
|
Describe control (treatment/procedure/test):
Standard care participants attended scheduled preoperative clinic visits and received standard preoperative care. Surgeons and support staff advised participants to adopt an active lifestyle but did not provide a formal prescription or behavioral tools (e.g., pedometer) and strategies to increase PA.
|
Length of follow-up: ~6 weeks (post-intervention)
Loss-to-follow-up: Intervention: 2 (5%) Had surgery prior to completion
Control: 3 (8%) 2 had surgery prior to completion, 1 had family emergency
|
Outcome measures and effect size (include 95%CI and p-value if available):
Weight loss change I: −0.1 ±2.4 kg C: 0.1 ± 2.3 kg
Quality of life PCS, mean (SD) I: 44.3 (9.1) C: 39.6 (9.2)
MCS, mean (SD) I: 49.2 (10.1) C: 47.7 (13.3)
Lifestyle changes Defined as change in daily bout-related moderate-to-vigorous physical activity measured with a SenseWear Armband I: 16.6 ± 20.7 min/d C: −0.3 ± 12.7 min/d |
Author’s conclusion Increasing physical activity preoperatively improves physical and mental HRQoL in bariatric surgery candidates. Future studies should examine whether this effect improves surgical safety, weight loss outcomes, and postoperative HRQoL. |
|
Camolas, 2016 |
Type of study: RCT
Setting and country: Obesity Treatment Unit of a Portuguese hospital
Funding and conflicts of interest: Funding not reported.
The authors declare that they have no competing interests. |
Inclusion criteria: patients with obesity Class III or Class II (in this case, with at least one comor-bidity) were considered eligible for obesity surgery and included.
Exclusion criteria: Pregnant patients and/or patients with diagnosed mental impairment were excluded.
N total at baseline: Intervention: 68 Control: 79
Important prognostic factors2: age ± SD: I: 46.31 ± 13.65 C: 43.53 ± 13.92
Sex: I: 82.2% female C: 79.6% female
BMI, mean ± SD I: 42.81 ± 4.96 C: 43.45 ± 7.04
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Nutritionists received training/ supervision regarding INDIVIDUO’s procedures. INDIVIDUO is based our on principles from the transtheoretical model of health behavior change, the self-determination theory and motivational interviewing. Four main techniques define the interaction with patients: asking open questions; expressing empathy; signaling discrepancy, and; contributing to enhanced self-efficacy. As an example, nutritionists may use an adapted version of the usual twenty-four hour food recall (or usual24-h food recall), based on: (a) open question, to identify established habits/routines; (b) active listening, enabling discussion about perceptions and beliefs on eating behavior, and; (c) empathy for perceived constraints, regarding food access and choices (clinical, economic, cultural, etc.). Tailored dietary advice would: (a) promote awareness of discrepancies between eating behaviours and related values, (b) value the patients’ past/present strategies that are convergent with health-gain needs, (c) contribute to the patients’ perception of self-efficacy and (d) enhance change-talk.
INDIVIDUO uses three key principles for nutritional strategy selection and goal setting: (a) basic nutritional needs satisfaction; (b) therapeutic (weight and metabolic control) needs, and; (c) adequacy to individuals’ daily routines and constraints (personal agenda and values, financial limitations, et cetera.). |
Describe control (treatment/procedure/test):
the control-group intervention was restricted to a health literacy-promoting intervention, within the con-text of a formal appointment with a nutritionist. This health-education intervention was based on the delivery and discussion of two documents: a leaflet with a list of weight-reduction strategies(similar to the ones proposed for the intervention group) and another leaflet describing a standard hypocaloric dietary plan, providing about 1800 kcal/day divided across six meals (similar to baseline recommendations used for intervention group, without personalisation of the meal plan). The main characteristics of the interaction with controls took into consideration the national guidelines, which establish that multidisciplinary evaluation prior to obesity surgery must include nutritional guidance about healthy dietary habits and their modifications after surgery. Accordingly, participants of the control group were also informed about the typical diet after obesity surgery.
|
Length of follow-up: 6 months
Incomplete outcome data: Before baseline measurement Intervention: 23 (32%) 16 no-shows 6 declined 1 BMI< 35
Control: 30 (31%) 22 no-shows 3 declined 5 BMI<35
After baseline measurement Intervention: 16 (24%) 1 declined further follow-up 15 missed 2 appointments
Control: 18 (23%) 3 declined further follow-up 15 missed 2 appointments
|
Outcome measures and effect size (include 95%CI and p-value if available):
Percentage of excessive weight loss I: 9.68% C: 0.51%
Resolution of comorbidities Fasting glycemia* (mg/dl), mean (SD) I: −1.91 (6.72) C: 1.24 (8.65)
Hemoglobin A1c (%)* I: −0.13 (0.33) C: −0.05 (0.18)
Systolic blood pressure (mmHg)* I: −2.07 (10.67) C: −1.89 (8.92)
Diastolic blood pressure (mmHg)* I: −2.68 (9.18) C: −3.13 (7.58)
*corrected for medication intensification (patients extracted from analysis)
Quality of life Defined as improvement on ORWELL-R total score I: −11.04 C: −6.58 Favoring intervention |
Author’s conclusion Results on weight and metabolic control support INDIVIDUO as a valuable clinical tool for obesity surgery candidates counseling. Additionally, intervention associated with perceived competence for weight-control behaviours and autonomous regulation. |
|
Macron, 2017 |
Type of study: RCT
Setting and country: Bariatric Surgery Department, Hospital de Clinicas de Porto Alegre, Brazil
Funding and conflicts of interest: The study was supported by the Hospital de Clínicas de Porto Alegre Research and Events Incentive Fund (FIPE), Higher Education Coordination of Improvement (CAPES).
The authors declare that they have no conflict of interest. |
Inclusion criteria: morbidly obese patients (grade III or severe obesity) who participated in the bariatric surgery program at Hospital de Clínicas de Porto Alegre, Brazil, from August 2011 to September 2014. Eligible participants were all adults aged 18 years or over with BMI >40 kg/m2, on medical treatment for more than 2 years (according Brazilian Health System Guidelines), who were referred for bariatric surgery and agreed to participate in the study.
Exclusion criteria: Contraindication to physical activity or being currently engaged in any type of supervised exercise, patients with cardiovascular disease with reduced functional capacity (classes III and IV of the New York Heart Association), orthopedic problems, severe retinopathy, severe neuropathy, drug addiction, severe mental illness, or major metabolic decompensation characterized by fasting blood glucose above 250 mg/dL, or blood pressure imbalance characterized by systolic pressure above 200 mmHg or diastolic pressure above 100 mmHg. In cases of uncontrolled hypertension and diabetes, the patient was initially controlled and their eligibility in the study was reevaluated after stabilization.
N total at baseline: Intervention1: 22 Intervention2: 22 Control: 22
Important prognostic factors2: age ± SD: I1: 43.4 ± 2.3 I2: 50.1 ± 2.8 C: 42.5 ± 2.7
Sex: I1: 81.8% female I2: 100% C: 88.9% female
BMI, mean ± SD I1: 50.8 ± 9.6 I2: 45 ± 4.1 C: 47.1 ± 7.6
Weight I1: 131 SE 6.5 I2: 112.6 SE 4.6 C: 121 SE 5.8
Glucose I1: 110.2 SE 9.2 I2: 107.2 SE 11.1 C: 105 SE 7.1
Total cholesterol I1: 186.9 SE 7.4 I2: 190.8 SE 5.7 C: 188 SE 10.6
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
I1: Exercise group Routine treatment at the bariatric surgery outpatient clinic + 4-month low-intensity exercise program twice-weekly supervised exercise program of 25 minutes
I2: Exercise + lifestyle modification group Routine treatment at the bariatric surgery outpatient clinic + 4-month low-intensity exercise program twice-weekly supervised exercise program of 25 minutes + support group program for lifestyle modification, with a cognitive-behavioral approach, once a week.
|
Describe control (treatment/procedure/test):
Control group Routine treatment at the bariatric surgery outpatient clinic |
Length of follow-up: 19 weeks
Loss-to-follow-up: After randomization, 5 individuals in the I2 withdrew from treatment after 2 or 3 sessions (1 because surgery was anticipated and 4 were unable to attend intervention) and were therefore excluded from the analysis.
In the CONTROL, 4 individuals did not participate in the final assessment (1 changed address and 3 were contacted repeatedly but did not attend the assessment).
All patients in I1 completed the program and were analysed.
Adherence to program I1: 80.9 (SD 10.8) I2: 75.1 (SD 13.6) |
Outcome measures and effect size (include 95%CI and p-value if available):
Weight I1: 123.5 SE 6.5 I2: 108.5 SE 4.7 C: 124 SE 6
Resolution of comorbidities Glucose I1: 99 SE 6.3 I2: 102.6 SE 9.8 C: 116.1 SE 8.5
Total cholesterol I1: 178.6 SE 6.7 I2: 185.1 SE 7.6 C: 194.3 SE 12.3
|
Author’s conclusion A 4-month, twice-weekly supervised program of low-intensity physical activity that encourages individuals to adopt a more active lifestyle can positively interfere with weight loss and improvement in functional capacity and cardiometabolic parameters of morbidly obese individuals with and without the aid of support group sessions. |
|
Kalarchian, 2016 |
Type of study: Pilot RCT
Setting and country: USA
Funding and conflicts of interest: Research supported by a grant from Nutrisystem administered by The Obesity Society.
1 author reports serving as a Scientific Advisory Board member for Weight Watchers International, Inc. 1 author reports grants from Covidien/ Ethicon and serving as a project consultant to Apollo Endosurgery. 2 authors report no potential conflicts of interest. |
Inclusion criteria: Gastric bypass between 10 and 14 months previously; 18 to 65 years of age; and no other weight-related research study or weight loss program in previous 6 months.
Exclusion criteria: food allergies (e.g., peanut, soy) or major medical condition that would restrict diet; pregnant or planning to become pregnant in next 6 months; currently taking weight altering medications (such as oral steroids or antipsychotic agents); and severe mental health issues (such as psychosis or other uncontrolled symptoms requiring immediate treatment).
N total at baseline: Intervention: 20 Control: 20
Important prognostic factors2: age ± SD: I: 47.8 (12.1) C: 46.0 (10.2)
Sex: I: 85% female C: 85% female
BMI ± SD I: 31.1 (5.7) C: 31.4 (5.2)
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
See control + 4-month structured dietary intervention including home deliveries of portion-controlled foods and a personalized menu plan that incorporated fresh grocery items. The prepackaged, portion-controlled foods were selected individually by each participant. Participants also received menus that incorporated three small meals and one to two snacks per day, accommodating individual patient preferences and dietary restrictions. The standard Nutrisystem program instructed customers to add two to four high quality proteins, one to two low-glycemic, nutrient-rich carbohydrates, and four servings of vegetables. Participants were provided a list of foods and serving sizes for each of these categories and were informed that they did not need to eat all of the food provided and to focus on maintaining adherence to standard postsurgery dietary guidelines. |
Describe control (treatment/procedure/test):
All participants received brief instruction in behavioral weight control adapted for bariatric surgery patients, which included one 60-min group session and handouts emphasizing self-monitoring and behavioral strategies including goal setting, stimulus control, and self-reinforcement. Surgery-specific strategies included eating slowly, chewing well, eating protein first, limiting liquid calories and avoiding grazing. All patients were provided with standard postoperative dietary recommendations and calorie goals for 1 to 2 pounds weekly weight loss based on initial body weight (approximately 1,250–1,500 kcal). |
Length of follow-up: 6 months postintervention
Loss-to-follow-up: Intervention: 3 missed assessment
Control: 5 missed assessment
|
Outcome measures and effect size (include 95%CI and p-value if available):
Weight loss at 6 months I: -4.07% C: 0.14% P=0.05
Quality of life Defined as Participant Impact of Weight on Quality of Life (IWQOL-Lite) (100 represents the best quality of life) I: 91.6 (SD 2.1) C: 89.1 (SD 2.2)
Calorie intake Change from baseline at 4 months: I: -108 C: 116
At 6 months, change in average daily calorie consumption from baseline did not differ significantly between intervention and control participants. |
Author’s conclusion A structured dietary intervention increased weight loss and reduced calorie intake when initiated 1 year following Roux-en-Y gastric bypass. This approach holds promise for optimizing postsurgery lifestyle change. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias assessment
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Stewart 2016 |
Yes |
Yes |
Included: yes, excluded: no |
Yes |
Not applicable |
Yes |
Yes |
Unclear |
Review: yes, included studies: unclear |
|
Ren 2018 |
Yes |
Yes |
Included: yes, excluded: no |
No, BMI/ weight not reported |
Not applicable |
Yes |
Yes |
Yes |
Review: yes, included studies: unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Kalarchian, 2013 |
Participants were block randomized to behavioral lifestyle intervention or usual preoperative care, with stratification by BMI. |
Unclear |
Likely |
Likely |
Unclear |
Likely |
Likely |
Likely |
|
Bond, 2015 |
Participants were randomly assigned 1:1 to PAI or SC using a computer-generated random sequence. Condition assignment was revealed to the participant after completion of the baseline assessment. |
Unclear |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
Likely |
|
Camolas, 2017 |
Eligible patients were stratified by sex and age groups (Younger: <40 years old; Middle-aged: 40—59years; Older: >59 years old), from which (subsample group) patients were randomly assigned to either the intervention or control group. |
Unclear |
Likely |
Likely |
Unclear |
Unlikely |
Likely |
Likely |
|
Macron 2017 |
The randomization sequence was created before the start of the trial using blocks of 12 participants and concealed in opaque, sealed envelopes by an investigator with no involvement in patient selection and who was blinded to the results of baseline ssessments (single blind). |
Unlikely |
Likely |
Likely |
Unclear |
Unlikely |
Likely |
Likely |
|
Kalarchian, 2016 |
After completing a baseline assessment, participants were stratified by body mass index (BMI) (< or ≥30 kg/m2) and randomly assigned to either a 4-month structured dietary intervention or to a comparison group. |
Unclear |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Kushner 2015 |
Geen systematisch review of origineel artikel |
|
Rudolph 2013 |
Recenter review beschikbaar |
|
Beck 2012 |
Voldoet niet aan PICO: alleen monodisciplinaire interventie (psychologie) |
|
Roman 2018 |
Geen systematisch review of origineel artikel |
|
Kim 2014 |
Voldoet niet aan PICO: effect van compliance follow-up |
|
Kalarchian 2012 |
Voldoet niet aan PICO: inclusie patiënten die >3 jaar geleden metabole ingreep hebben gehad |
|
Brandenburg 2005 |
Geen vergelijkende studie |
|
Lauti 2018 |
Voldoet niet aan PICO: geen multidisciplinaire interventie |
|
Woodlief 2015 |
Posthoc analyses van Coen 2015 |
|
Coen 2015 |
Posthoc analyses van Coen 2015 |
|
Burguera 2015 |
Voldoet niet aan PICO: nonsurgical approaches versus bariatrie |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-10-2020
Beoordeeld op geldigheid : 28-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Leefstijl-interventies |
NVvH |
2020 |
2025 |
1x per 3 jaar |
NVvH |
? |
|
[1] Naam van de module [2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) [3] Maximaal na vijf jaar [4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar [5] Regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft |
||||||
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en/of andere bron. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om tot een richtlijn te komen waarin de meest recente kennis omtrent de chirurgische zorg voor patiënten met obesitas is vastgelegd.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met ernstige obesitas (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. F.J. Berends, chirurg, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Dr. I.F. Faneyte, chirurg, ZiekenhuisGroep Twente, Almelo/Hengelo, Nederlandse Vereniging voor Heelkunde
- Dr. R. Schouten, chirurg, Flevoziekenhuis, Almere, Nederlandse Vereniging voor Heelkunde
- Dr. F.M.H. van Dielen, chirurg, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. van Heurn, hoogleraar kinderchirurgie, chirurg, Amsterdam UMC locatie AMC, Amsterdam, plaats, Nederlandse Vereniging voor Heelkunde
- Dr. S. Bouma- de Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.C.E. Vreugdenhil, kinderarts, MUMC+, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.P. van Beek, internist, UMCG, Groningen, Nederlandse Internisten Vereniging
- Dr. J.S. Burgerhart, internist i.o., Erasmus MC, Rotterdam tot 31 december 2019, vanaf 1 januari 2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk, Nederlandse Internisten Vereniging
- Dr. M.J.M. Groenen, MDL-arts, Rijnstate, Arnhem, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. S.V. Koenen, gynaecoloog, Elisabeth-TweeSteden-Ziekenhuis, Tilburg, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Drs. M.S.Q. Kortenhorst, gynaecoloog i.o. UMC Utrecht, Utrecht, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. R.C. Painter, gynaecoloog, Amsterdam UMC, locatie AMC, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. J.O.E.H. van Laar, gynaecoloog, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
- Dr. C. Hinnen, klinisch psycholoog, LUMC, Leiden, Nederlands Instituut van Psychologen
- E. Govers BSc., diëtist, Amstelring, Amsterdam, Nederlandse Vereniging van Diëtisten
Klankbordgroep
- Prof. dr. E.F.C. van Rossum, internist, Erasmus MC, Rotterdam, Nederlandse Internisten Vereniging
Met ondersteuning van
- Dr. A. Bijlsma, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. W.A. van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot oktober 2018)
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Drs. A.A. Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- J.C.F. Ket, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- I. van Dusseldorp, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- E. Delvaux, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam WG-lid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie (voorstel) |
|
Berends (voorzitter) |
Freelance chirurg |
Consultant Johnson & Johnson tot september 2018 (betaald) |
De firma Johnson & Johnson heeft een "baratric and metabolic board" waarvan ik lid ben. (Betaald) |
geen |
geen |
|
geen |
24-11-2017 |
Geen. Er staan geen producten van Johnson in deze richtlijn. |
|
Hinnen |
Oncologisch centrum, LUMC, afdeling medische psychologie en ziekenhuis-psychiatrie, MC Slotervaart |
Bestuur Nederlandse Behavioral Medicine Federatie (onbetaald) |
geen |
geen |
geen |
geen |
geen |
31-10-2017 |
Geen |
|
Schouten |
Chirurg, Flevoziekenhuis te Almere |
geen |
geen |
geen |
geen |
geen |
geen |
8-11-2017 |
Geen |
|
Groenen |
Maag Darm Leverarts, werkzaam in Rijnstate Ziekenhuis te Arnhem |
Concilium Gastroenterolgicum, onbetaald |
geen |
geen |
Betrokken bij onderzoek betreffende Chronische darmontsteking (Crohn en Colitis Ulcerosa) waarbij ondersteuning door industrie. |
geen |
geen |
9-11-2017 |
Geen, gefinancierde onderzoeken/ training gaan niet over obesitas |
|
Faneyte |
Chirurg 75% ZiekenhuisgroepTwente |
geen |
geen persoonlijke financiële belangen behoudens eigen werk als vrijgevestigd bariatrisch chirurg |
geen |
geen |
geen |
geen |
9-11-2017 |
Geen |
|
Govers |
Diëtist, Stichting Amstelring (inmiddels niet meer werkzaam) |
Voorzitter Kenniscentrum Diëtisten Overgewicht en Obesitas, Amsterdam, |
geen |
geen |
geen |
geen |
- |
26-11-2017 |
Geen |
|
Van Laar |
gynaecoloog |
Assistant professor TU/e |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Koenen |
Gynaecoloog, UMC Utrecht (vanaf 1 januari 2018 ETZ, Tilburg) 1,0 FTE werkzaam |
Voorzitter Werkgroep Otterlo NVOG (werkgroep die verantwoordelijk is voor richtlijnen over de Verloskunde). Onbetaald |
geen |
geen |
geen |
geen |
nee |
12-12-2017 |
Geen |
|
Painter |
Gynaecoloog, Afdeling Verloskunde, AMC, Amsterdam 0,9 FTE |
• Affiliatie: Gynaecoloog Amsterdam UMC • lid van de werkgroep modulaire richtlijn Zwangerschap en Obesitas (NVOG). • vice voorzitter van de NVOG Pijler FMG Wetenschapscommissie • voorzitter SIG NVOG Diabetes, Obesitas en Zwangerschap • lid van de Koepel Wetenschap NVOG • lid van de RIVM Commissie Programma Nationale Hielprik Screening (namens de NVOG) • lid stuurgroep James Lind Alliance PSP 'Hyperemesis Gravidarum' |
geen |
geen |
CVON/ Nederlandse Hartstichting, WOMB project (hoofdaanvrager prof Roseboom) AMC-VuMc Alliantie OiO (mede aanvrager dr AE Budding) |
Lid Wetenschappelijke Advies Raad Stichting ZEHG (Hyperemesis Gravidarum patiënten vereniging) |
geen |
29-11-2017 |
Geen, de onderzoeken betreffen onderwerpen die buiten de afbakening van de richtlijn vallen. |
|
Kortenhorst |
Gynaecoloog-in-opleiding Wilhelmina Kinderziekenhuis |
geen |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Cnossen |
Ervaringsdeskundige werkgroep bariatrie van de Nederlandse stichting Over Gewicht -(Onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
19-1-2018 |
Geen |
|
Burgerhart |
internist- vasculair geneeskundig i.o. in opleiding Erasmus MC Rotterdam t/m 31-12-2019. Vanaf 1-1-2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk |
geen |
geen |
geen |
geen |
geen |
geen |
18-5-2018 |
Geen |
|
Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
geen |
geen |
geen |
geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische |
geen |
28-2-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
|
Beek |
internist-endocrinoloog (100%) in het UMC Groningen. |
geen |
geen |
geen |
Select studie. Effecten op cardiovasculaire uitkomsten bij patiënten met overgewicht of obesitas (Novo Nordisk). Het betreft een multicenter trial waarbij in totaal 17500 patiënten worden geïncludeerd. Mijn centrum zal 25 patiënten includeren en NL in totaal 250. Ik ben National Leader in deze studie die is gestart 24-10-2018. Uitkomsten worden verwacht in 2023. Geen belangen verstrengeling zowel inhoudelijk (resultaten nog niet bekend) als financieel. |
geen |
geen |
13-7-2018 |
Geen
Uitkomsten van de studie worden verwacht in 2023. Redelijkerwijs zal deze studie dus geen belangenverstrengeling opleveren omdat er geen uitkomsten nog van de studie zijn. |
|
Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
geen |
geen |
geen |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). Voorlopige startdatum 1 september 2018 |
geen |
6-3-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Stichting Over Gewicht (voorheen Nederlandse Obesitas Vereniging) plaats te laten nemen in de werkgroep. De volgende patiëntenorganisaties zijn uitgenodigd voor de Invitational conference: Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht. Een verslag van deze bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie (uitgevoerd op 18 december 2017) werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende stakeholders tijdens een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (GIN-database), systematische reviews, literatuur over patiëntvoorkeuren en patiëntrelevante uitkomstmaten (Medline, Comet-initiative en COSMIN database). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens is aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in het aanverwante product Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Kennisinstituut. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. 2015
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Embase.com 20 dec 2018
|
No. |
Query |
Results |
|
#21 |
#14 AND #20 NOT (#19 OR #15 OR #17) |
42 |
|
#20 |
'case report'/exp OR 'case study'/exp OR case:ti,ab,kw OR cases:ti,ab,kw |
5420230 |
|
#19 |
#14 AND #18 NOT (#15 OR #17) |
356 |
|
#18 |
cohort:ti,ab,kw OR (case:ti,ab,kw AND (control:ti,ab,kw OR controll*:ti,ab,kw OR comparison:ti,ab,kw OR referent:ti,ab,kw)) OR risk:ti,ab,kw OR causation:ti,ab,kw OR causal:ti,ab,kw OR 'odds ratio':ti,ab,kw OR etiol*:ti,ab,kw OR aetiol*:ti,ab,kw OR 'natural history':ti,ab,kw OR outcome:ti,ab,kw OR course:ti,ab,kw OR retrospect*:ti,ab,kw OR 'epidemiology'/de OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw |
7662230 |
|
#17 |
#14 AND #16 NOT #15 |
122 |
|
#16 |
'clinical' AND 'trial' OR 'clinical trial'/exp OR random* |
2597172 |
|
#15 |
#8 AND #14 |
348 |
|
#14 |
#13 NOT ('conference abstract'/it OR 'conference paper'/it OR 'letter'/it OR 'note'/it) |
1018 |
|
#13 |
#12 NOT ((animals)/lim NOT (humans)/lim) AND (1-1-1995)/sd |
1753 |
|
#12 |
#3 AND #10 AND #11 |
1776 |
|
#11 |
'support group'/exp OR 'patient compliance'/de OR 'dietary compliance'/exp OR 'physical activity'/exp OR 'ambulatory care'/de OR 'lifestyle modification'/exp OR 'behavior modification'/exp OR 'cognitive therapy'/exp OR comply:ti,kw OR complian*:ti,kw OR multidisciplin*:ti,kw OR interdisciplin*:ti,kw OR 'multi disciplin*':ti,kw OR 'inter disciplin*':ti,kw OR 'life styl*':ti,ab,kw OR lifestyl*:ti,ab,kw OR 'office visit*':ti,ab,kw OR ((physical* NEAR/3 activ*):ti,ab,kw) |
800211 |
|
#10 |
'bariatric surgery'/exp/mj OR 'roux y anastomosis'/exp/mj OR 'gastrojejunostomy'/exp/mj OR 'gastroplasty'/exp/mj OR 'weight loss surgery'/exp/mj OR 'bariatric surg*':ti,ab,kw OR 'metabolic surg*':ti,ab,kw OR 'stomach stapl*':ti,ab,kw OR 'gastric bypass*':ti,ab,kw OR 'roux en y':ti,ab,kw OR 'roux en ys':ti,ab,kw OR 'gastroileal bypass*':ti,ab,kw OR gastrojejunostom*:ti,ab,kw OR gastroplast*:ti,ab,kw OR 'jejunoileal bypass*':ti,ab,kw OR 'jejuno ileal bypass*':ti,ab,kw OR 'ileojejunal bypass*':ti,ab,kw OR 'intestinal bypass*':ti,ab,kw OR 'weight loss surg*':ti,ab,kw OR 'gastric sleev*':ti,ab,kw OR 'sleeve gastrectom*':ti,ab,kw |
53381 |
|
#8 |
'meta-analysis' OR 'meta analysis'/exp OR 'review'/exp OR review |
3975881 |
|
#3 |
'postoperative care'/exp OR 'postoperative period'/de OR 'post operat*':ti,ab,kw OR (((after OR following) NEAR/3 surg*):ti,ab,kw) OR postbariatr*:ti,ab,kw OR postoperat*:ti,ab,kw |
1109153 |
PubMed 20 dec 2018
|
Search |
Query |
Items found |
|
#28 |
((#20 AND #27) NOT (#22 OR #24 OR #26)) |
13 |
|
#27 |
"Case Reports" (Publication Type) OR case(tiab) OR cases(tiab) |
4203564 |
|
#26 |
((#20 AND #25) NOT (#22 OR #24)) |
354 |
|
#25 |
(("Epidemiologic Studies"(Mesh) OR "Prognosis"(Mesh) OR cohort(tiab) OR (case(tiab) AND (control(tiab) OR controll*(tiab) OR comparison(tiab) OR referent(tiab))) OR risk(tiab) OR causation(tiab) OR causal(tiab) OR "odds ratio"(tiab) OR etiol*(tiab) OR aetiol*(tiab) OR "natural history"(tiab) OR predict*(tiab) OR prognos*(tiab) OR outcome(tiab) OR course(tiab) OR retrospect*(tiab) OR follow up(tiab) OR followup(tiab) OR prognos*(tiab))) |
6646498 |
|
#24 |
(#20 AND #23 NOT #22) |
254 |
|
#23 |
("Randomized Controlled Trial"(Publication Type) OR "Controlled Clinical Trial"(Publication Type) OR random*(tiab) OR placebo(tiab) OR "Drug Therapy"(Subheading) OR trial(tiab) OR groups(tiab)) |
4595774 |
|
#22 |
(#20 AND #21) |
299 |
|
#21 |
((review(tiab) OR "Review"(Publication Type) OR "Meta-Analysis as Topic"(Mesh) OR meta-analysis(tiab) OR "Meta-Analysis "(Publication Type)) NOT ("Letter"(Publication Type) OR "Editorial"(Publication Type) OR "Comment"(Publication Type))) |
3011591 |
|
#20 |
(#19 NOT ("Animals"(Mesh) NOT "Humans"(Mesh)) AND ("1995"(Date - Entrez) : "3000"(Date - Entrez))) |
1003 |
|
#19 |
(#16 AND #17 AND #18) |
1027 |
|
#18 |
"Self-Help Groups"(Mesh:NoExp) OR "Patient Compliance"(Mesh:NoExp) OR "Exercise"(Mesh:NoExp) OR "Physical Conditioning, Human"(Mesh) OR "Ambulatory Care"(Mesh) OR "Life Style"(Mesh) OR comply(ti) OR complian*(ti) OR multidisciplin*(ti) OR interdisciplin*(ti) OR multi disciplin*(ti) OR inter disciplin*(ti) OR comply(ot) OR complian*(ot) OR multidisciplin*(ot) OR interdisciplin*(ot) OR multi disciplin*(ot) OR inter disciplin*(ot) OR life styl*(tiab) OR lifestyl*(tiab) OR office visit*(tiab) OR physical activ*(tiab) OR physically activ*(tiab) |
442110 |
|
#17 |
"Postoperative Period"(Mesh) OR "Postoperative Care"(Mesh) OR post operat*(tiab) OR ((after(tiab) OR following(tiab)) AND surg*(tiab)) OR postbariatr*(tiab) OR postoperat*(tiab) |
1125600 |
|
#16 |
"Bariatric Surgery"(Mesh) OR bariatric surg*(tiab) OR metabolic surg*(tiab) OR stomach stapl*(tiab) OR gastric bypass*(tiab) OR roux en y*(tiab) OR gastroileal bypass*(tiab) OR gastrojejunostom*(tiab) OR gastroplast*(tiab) OR jejunoileal bypass*(tiab) OR jejuno ileal bypass*(tiab) OR ileojejunal bypass*(tiab) OR intestinal bypass*(tiab) OR weight loss surg*(tiab) OR gastric sleev*(tiab) OR sleeve gastrectom*(tiab) |
35894 |
Wiley/Cochrane Library 20 dec 2018
|
ID |
Search |
Hits |
|
#1 |
("bariatric surg*" OR "metabolic surg*" OR "stomach stapl*" OR "gastric bypass*" OR "roux en y*" OR "gastroileal bypass*" OR gastrojejunostom* OR gastroplast* OR "jejunoileal bypass*" OR "jejuno ileal bypass*" OR "ileojejunal bypass*" OR "intestinal bypass*" OR "weight loss surg*" OR "gastric sleev*" OR "sleeve gastrectom*"):ti,ab,kw |
1812 |
|
#2 |
("post operat*" OR ((after OR following) NEAR/3 surg*) OR postbariatr* OR postoperat*):ti,ab,kw |
109495 |
|
#3 |
(comply OR complian* OR multidisciplin* OR interdisciplin* OR "multi disciplin*" OR "inter disciplin*" OR "life styl*" OR lifestyl* OR "office visit*" OR (physical* NEAR/3 activ*)):ti,ab,kw |
67842 |
|
#4 |
#1 AND #2 AND #3 with Cochrane Library publication date from Jan 1995 to present |
108 |
Aantallen per bron en per studietype na ontdubbelen
Embase: 851
PubMed: 453
Cochrane Library/CENTRAL: 46
SR's: 489
RCT's: 294
Cohort studies: 518
Case reports: 49
Aanvulling Embase.com 7 jan 2019
|
No. |
Query |
Results |
|
#14 |
#6 AND #13 NOT (#8 OR #10 OR #12) |
25 |
|
#13 |
'case report'/exp OR 'case study'/exp OR case:ti,ab,kw OR cases:ti,ab,kw |
5427832 |
|
#12 |
#6 AND #11 NOT (#8 OR #10) |
160 |
|
#11 |
cohort:ti,ab,kw OR (case:ti,ab,kw AND (control:ti,ab,kw OR controll*:ti,ab,kw OR comparison:ti,ab,kw OR referent:ti,ab,kw)) OR risk:ti,ab,kw OR causation:ti,ab,kw OR causal:ti,ab,kw OR 'odds ratio':ti,ab,kw OR etiol*:ti,ab,kw OR aetiol*:ti,ab,kw OR 'natural history':ti,ab,kw OR outcome:ti,ab,kw OR course:ti,ab,kw OR retrospect*:ti,ab,kw OR 'epidemiology'/de OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw |
7676608 |
|
#10 |
#6 AND #9 NOT #8 |
62 |
|
#9 |
'clinical' AND 'trial' OR 'clinical trial'/exp OR random* |
2601853 |
|
#8 |
#6 AND #7 |
182 |
|
#7 |
'meta-analysis' OR 'meta analysis'/exp OR 'review'/exp OR review |
3998494 |
|
#6 |
#5 NOT ('conference abstract'/it OR 'conference paper'/it OR 'letter'/it OR 'note'/it) |
512 |
|
#5 |
#4 NOT ((animals)/lim NOT (humans)/lim) AND (1-1-1995)/sd |
956 |
|
#4 |
#1 AND #2 AND #3 |
971 |
|
#3 |
'exercise'/exp OR exercis*:ti,ab,kw OR effort*:ti,ab,kw OR exerti*:ti,ab,kw OR fitness*:ti,ab,kw OR ((physical NEAR/3 conditioning*):ti,ab,kw) |
927583 |
|
#2 |
'bariatric surgery'/exp/mj OR 'roux y anastomosis'/exp/mj OR 'gastrojejunostomy'/exp/mj OR 'gastroplasty'/exp/mj OR 'weight loss surgery'/exp/mj OR 'bariatric surg*':ti,ab,kw OR 'metabolic surg*':ti,ab,kw OR 'stomach stapl*':ti,ab,kw OR 'gastric bypass*':ti,ab,kw OR 'roux en y':ti,ab,kw OR 'roux en ys':ti,ab,kw OR 'gastroileal bypass*':ti,ab,kw OR gastrojejunostom*:ti,ab,kw OR gastroplast*:ti,ab,kw OR 'jejunoileal bypass*':ti,ab,kw OR 'jejuno ileal bypass*':ti,ab,kw OR 'ileojejunal bypass*':ti,ab,kw OR 'intestinal bypass*':ti,ab,kw OR 'weight loss surg*':ti,ab,kw OR 'gastric sleev*':ti,ab,kw OR 'sleeve gastrectom*':ti,ab,kw |
53439 |
|
#1 |
'postoperative care'/exp OR 'postoperative period'/de OR 'post operat*':ti,ab,kw OR (((after OR following) NEAR/3 surg*):ti,ab,kw) OR postbariatr*:ti,ab,kw OR postoperat*:ti,ab,kw |
1110683 |
Aantallen aanvulling Embase per studietype na ontdubbelen
Embase: 220
SR's: 96
RCT's: 20
Cohort studies: 87
Case reports: 15
