Moleculaire technieken detectie CIN2+
Uitgangsvraag
Wat is de waarde van triage met aanvullende moleculaire technieken in personen met klachten met een hrHPV positieve PAP2/PAP3a1 voor detectie van CIN2+?
Aanbeveling
Voer standaard hrHPV 16/18/other genotypering uit bij personen met klachten en een hrHPV-positief uitstrijkje met PAP2/PAP3a1.
- Indien hrHPV 16/18 positief: verwijs voor een diagnostisch vervolgonderzoek.
- Indien hrHPV other: herhaal na 12 maanden het cytologisch onderzoek.
Voer niet standaard een aanvullende methyleringstest uit bij personen met klachten en een hrHPV-positief uitstrijkje met PAP2/PAP3a1.
Cave: niet alle gynaecologische ziektebeelden zijn hrHPV gerelateerd of te diagnosticeren middels een cervixuitstrijkje. Derhalve dient, ongeacht de uitslag van het uitstrijkje, te worden overwogen om de patiënt met abnormaal vaginaal bloedverlies of overige gynaecologische klachten te verwijzen naar de gynaecoloog. Zie ook NHG standaard Vaginaal bloedverlies.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
hrHPV16/18 genotypering
Bij patiënten met een vermoeden op CIN2+ laesies op basis van co-testing met cytologie en hrHPV test, heeft toevoegen van hrHPV16/18 genotypering mogelijk een redelijke sensitiviteit (tussen de 40 en 75%) en hoge specificiteit (tussen de 61 en 90%) voor het detecteren van CIN2+ met colposcopie en biopt. Negatief voorspellende waarde (NVW) is daarmee mogelijk hoog (tussen de 84 en 99%), terwijl de positief voorspellende waarde (PVW) laag is (tussen de 27 en 30%). De bewijskracht hiervoor is laag om verschillende redenen. Ten eerste door zorgen rondom verschillen in prevalentie van CIN2+ tussen de studies (van 5% in Lin (2015) tot 20% in Khunamornpong (2016)), ten tweede doordat er mogelijk risico op bias was door onduidelijkheid in de blindering van de testafnemers. In een studie was het onduidelijk hoeveel tijd verstreken was tussen sampling voor cytologie en uitvoer van colposcopie (Khunamornpong, 2016), bij een andere studie zat er meerdere maanden tussen (Dick, 2022). Dit kan kans op misclassificatie bias verhogen, maar omdat het ziekteproces langzaam gaat, is hier niet voor afgewaardeerd. Ten derde zijn de resultaten rondom CIN3+ niet direct vertaalbaar naar die voor CIN2+ (Dick 2022).
Ondanks de lage bewijskracht, lijkt het, in synergie met de reeds ingevoerde hrHPV 16/18 triage in het bevolkingsonderzoek baarmoederhalskanker, wenselijk om hrHPV16/18 genotypering in te voeren bij de indicatieve cytologie, te beginnen bij personen met hrHPV positieve uitstrijk met pap2/3a1. Dit wordt nog eens makkelijk gemaakt doordat veel hrHPV testen reeds de mogelijkheid hebben onderscheid te maken in hrHPV16/18/other en hier dus geen extra kosten aan zitten maar wel de reeds beschreven potentiële voordelen.
FAM19A4/miR124-2 methylering
Bij patiënten met een vermoeden op CIN2+ laesies op basis van co-testing met cytologie en hrHPV is het onduidelijk of toevoegen van FAM19A4/miR124-2 methylering bijdraagt aan de diagnose CIN2+. De resultaten van de enige studie naar CIN2+ (Bonde, 2021) lieten voor CIN2+ een sensitiviteit van 61% en een specificiteit van 77% zien (NVW van 82% en PVW van 53%). Voor CIN3+ lag het iets hoger, met een sensitiviteit tussen de 70 en 75% en een specificiteit tussen de 66 en 73% (NWV tussen de 90 en 94% en PVW tussen de 33-34%) (Dick, 2022; Bonde, 2021). De bewijskracht hiervoor is laag door zorgen rondom de minimale omschrijving van patiënt flow en referentie standaard (Bonde, 2021) en toepasbaarheid van de resultaten rondom CIN3+ voor CIN2+ (Dick, 2022).
Alhoewel er onvoldoende bewijs is een aanvullende methyleringstest te adviseren in duidelijk gedefinieerde klinische groepen, kan een aanvullende methyleringstest zeker toegevoegde waarde hebben voor individuele patiënten. De gynaecoloog kan in specifieke groepen (bijvoorbeeld bij toekomstige kinderwens) overwegen een aanvullende methyleringstest te verrichten. Bij hrHPV-positieve personen met p ap2/3a1 en een negatieve methyleringstest, wordt het korte termijn risico op een CIN3+ zeer laag geacht. In deze gevallen kan de methyleringstest een afwachtend beleid ondersteunen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Toevoeging van hrHPV16/18 genotypering dan wel methyleringstest (FAM19A4/miR124-2 methylering) leidt niet tot extra handelingen voor de patiënt, want deze tests kunnen gedaan worden op basis van hetzelfde uitstrijkje als in de eerste stappen in het huidige diagnostische traject (co-test cytologie en hrHPV test). De mogelijk hoge NVW van hrHPV16/18 genotypering en methylering geeft aan dat patiënten met een negatieve uitslag (hrHPV other en/of methylering negatief) geen verwijzing of diagnostisch vervolgonderzoek (colposcopie) nodig hebben, en voorkomt dus onterechte doorverwijzingen naar de gynaecoloog. Onterechte doorverwijzingen zijn ongewenst, daar dit veel onrust geeft en leidt tot onnodige inwendige en mogelijk weefselafname. Uit onderzoek is bekend dat er een relatie is tussen (volume van) cervicale weefselafname (in kader van behandeling maar ook in kader van diagnostiek) en negatieve zwangerschapsuitkomsten (Loopik, 2021). Een lager aantal verwijzingen voor colposcopie zal leiden tot een lager aantal weefselafnames.
Overigens blijft de colposcopie altijd nodig als vervolg op een hrHPV16/18-positieve uitslag en/of positieve methyleringstest om definitief de diagnose te kunnen stellen of uitsluiten.
Kosten (middelenbeslag)
Het is de werkgroep niet bekend dat er kosteneffectiviteitsanalyses zijn gedaan. Dit zou dan voornamelijk de methyleringstesten betreffen, want hrHPV-genotypering is bij de meeste huidige hrHPV assays al geïncorporeerd. De verwachting is dat bij inzet van hrHPV16/18 genotypering voor de algemene gezondheidszorg de kosten zullen dalen, omdat er minder colposcopieën zullen worden verricht met verminderd aantal inzendingen voor weefseldiagnostiek.
Voor de pathologielaboratoria stijgen de kosten door inzet van een extra methyleringstest. Deze zou bekostigd kunnen worden door vergoeding vanuit de ziektekostenverzekeraar ten behoeve van add-on voor een prognostische moleculaire test.
Aanvaardbaarheid, haalbaarheid en implementatie
De hrHPV-genotypering is vaak al geïntegreerd in de hrHPV-assay en is vaak als zodanig geautomatiseerd/ gerobotiseerd. De verwachting is dat de test landelijk aanvaardbaar, haalbaar en te implementeren is.
De methyleringstest betreft vooralsnog een manuele test en is nog niet volledig geautomatiseerd en overal beschikbaar. Aanvullende (lab-)expertise, competenties van analisten en apparatuur is nodig voor zowel de implementatie, uitvoerbaarheid als de interpretatie van de resultaten. Wanneer kleine aantallen patiënten worden verwacht, kan het nodig zijn regionale afspraken te maken om de diagnostiek kosteneffectief uit te kunnen voeren in relatie tot acceptabele doorlooptijd tot het verkrijgen van een testuitslag.
Er zijn extra kosten verbonden aan het uitvoeren van de test door de pathologielaboratoria, terwijl de verwachte kostenreductie in aantal colposcopieën en weefseldiagnostiek op andere plekken in het zorgsysteem terugkomen. Voor de implementatie is het daarom belangrijk dat gekeken wordt door betrokken beroepsverenigingen, ziektekostenverzekeraars en NZA hoe deze extra kosten gedragen kunnen worden.
Rationale van de aanbeveling: weging van argumenten voor en tegen de diagnostische procedure
Vanwege de hoge negatief voorspellende waarde, kan hrHPV16/18 genotypering bijdragen aan het identificeren van personen met een lager risico op het hebben van onderliggende CIN2+. Door deze test toe te voegen aan de standaard test bij personen in de indicatieve setting, kunnen onnodige colposcopieën mogelijk worden voorkomen. Bovendien worden er vervolgens ook minder weefselafnames gedaan met bijbehorende diagnostiek. Personen die hrHPV16/18 positief testen, kunnen aan de andere kant snel worden doorverwezen. Een bijkomend voordeel van het toevoegen van hrHPV-genotypering in de indicatieve setting, is dat dit in overeenstemming is met de reeds doorgevoerde hrHPV genotypering in het Bevolkingsonderzoek Baarmoederhalskanker. Dit maakt de communicatie met gynaecologen, huisartsen en patiënten eenduidiger. Ook het verwijsadvies is daarom in lijn gebracht met het advies van het Bevolkingsonderzoek: direct doorverwijzen indien hrHPV16/18 positief en controleonderzoek na 12 maanden en indien positief voor andere hrHPV-types. Het blijft echter belangrijk om alert te blijven; indien klinisch sterk verdacht of bij persisterende klachten, kan er laagdrempelig worden doorverwezen.
Een aanvullende methyleringstest wordt niet standaard geadviseerd vanwege de nog onduidelijke diagnostische accuratesse, onduidelijkheid over de meerwaarde ten opzichte van hrHPV16/18 genotypering en praktische overwegingen. Echter kan een aanvullende methyleringstest bij hrHPV positieve personen met Pap2/3a1 wel toegevoegde waarde hebben voor specifieke patiënten. Bij een negatieve methylering bij personen met pap2/3a1 en hrHPV is de kans op (de ontwikkeling van) CIN3+ zeer laag en kan een afwachtend beleid gevoerd worden door de gynaecoloog. De werkgroep laat daarom ruimte aan de gynaecoloog om in specifieke gevallen zoals CIN in de zwangerschap of bij aanhoudende of hernieuwde hrHPV positieve PAP2/PAP3a1 en kinderwens, een aanvullende methyleringstest serieus te overwegen bijvoorbeeld als eerder een CIN3+ is uitgesloten maar de cytologische afwijkingen persisteren. Aangezien de negatief voorspellende waarde van een methyleringstest nooit 100% is, kan de methyleringstest nooit de plek van de gouden standaard (biopt) innemen. Gezien de specifieke indicatiestelling (individuele patiënt afhankelijk) en complexe klinische interpretatie van de resultaten, ligt het besluit om een methyleringstest in te zetten, bij de gynaecoloog.
Onderbouwing
Achtergrond
This module focuses on molecular techniques. The literature search includes data from groups of women with complaints (“symptomatic”) as well as screening populations, as it is assumed that clinically relevant hrHPV-related cervical abnormalities have similar cytological and molecular profiles in both groups. The considerations and recommendations focus on women with gynaecologic symptoms.
Conclusies / Summary of Findings
hrHPV16/18 genotyping
Sensitivity
|
Low GRADE |
The evidence suggests that additional hrHPV16/18 genotyping in hrHPV positive and PAP2/PAP3a1 cervical samples may not be sensitive in diagnosing patients suspected of having CIN2+ lesions.
Source: Dick 2022, Lin 2015, Khunamornpong 2016 |
Specificity
|
Low GRADE |
The evidence suggests that additional hrHPV16/18 genotyping in hrHPV positive and PAP2/PAP3a1 cervical samples may be specific in excluding patients suspected of having CIN2+ lesions.
Source: Dick 2022, Lin 2015, Khunamornpong 2016 |
FAM19A4/miR124-2 methylation
Sensitivity
|
Low GRADE |
The evidence suggests that additional FAM19A4/miR124-2 methylation in hrHPV positive and PAP2/PAP3a1 cervical samples may not be sensitive in diagnosing patients suspected of having CIN2+ lesions.
Source: Dick 2022, Bonde 2021 |
Specificity
|
Low GRADE |
The evidence suggests that additional FAM19A4/miR124-2 methylation in hrHPV positive and PAP2/PAP3a1 cervical samples may be specific in excluding patients suspected of having CIN2+ lesions.
Source: Dick 2022, Bonde 2021 |
Samenvatting literatuur
Description of studies
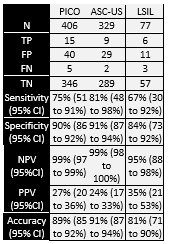
Bonde (2021) is a multicenter retrospective observational study that reported performance of FAM19A4/miR124-2 methylation as an additional triage test for CIN2+ in hrHPV-positive women of four European population-based screening cohorts from Scotland, Denmark, Slovenia and the Netherlands (total n = 2384). Inclusion criteria were (i) hrHPV positive on a validated hrHPV screening assay and (ii) sufficient material for cytology and methylation testing. Exclusion criteria were (i) ≥CIN2 detected after 2 years; (ii) <29 years of age and (iii) inadequate cytology at baseline. Country specific exclusion criteria for Slovenia were (a) hrHPV vaccination, (b) early therapeutic intervention, or (c) no colposcopy data available. 224 samples from the Danish cohort (aged 60 to 64 years) were directly referred to colposcopy upon hrHPV positive screening and thus did not have concurrent cytology. Dutch samples without follow-up data until 2017 were excluded. Overall, 2384 unique, valid samples were included (Scotland n=161, Slovenia n=928, Denmark n=424, the Netherlands n=871). Mean age of the included samples was 40.7 years (range 29 to 76 years). 899 also had histologies available, of these 527 had no disease or CIN1 (≤CIN1), 124 (5.2%) CIN2, 228 (9.6%) CIN3 and 20 (0.8%) were cervical cancers. For the analyses, the authors combined no histological data with normal histology or CIN1 histology into a ≤CIN1 group. The authors report sensitivity, specificity, PPV and NPV for different triage options using genotyping in an hrHPV positive population regardless of cytology outcome (n = 2384). Enough information is given to calculate the sensitivity, specificity, negative predictive value, positive predictive value and accuracy for the hrHPV positive and ASC-US/LSIL population (n=382) defined in the search question (MedCalc version 22.013, 2023).
Dick (2022) is an observational study that reported diagnostic accuracy of hrHPV16/18 genotyping and FAM19A4/miR124-2 methylation for CIN3+ in hrHPV-positive women with a borderline or mild dyskaryosis (BMD) cytology from a post-hoc analysis of two Dutch population-based screening trials (VUSA screen trial and POBASCAM trial, total n = 294).
The VUSA-screen trial included asymptomatic women aged 30- 60 years screened between October 2003 and August 2005. Cervical scrapes were classified according to the CISOE-A classification and hrHPV testing was done with HC2 high-risk HPV DNA test (QIAGEN, Hilden, Germany). hrHPV-positive women with BMD were directly referred for colposcopy (= reference standard). In the post hoc analysis, only hrHPV-positive women with BMD cytology were included (n=123). For the post-hoc analysis HC2-positive samples were tested with GP5+/6+ PCR-EIA.
The POBASCAM trial included asymptomatic women aged 30- 60 screened between January 1999 and September 2002. Cervical scrapes were classified according to the CISOE-A classification and hrHPV-testing was done with GP5+/6+ PCR-EIA. The trial was designed to evaluate the effectiveness for CIN3+ detection of combined hrHPV and cytology testing in the intervention group compared with sole cytology testing and blinded hrHPV testing in the control group. Women with BMD in the control group were referred for colposcopy (= reference standard) if repeat cytology at 6 or 18 months showed BMD or worse. In this post hoc analysis, only hrHPV-positive women with BMD cytology from the control group were included (n=171).
On average histologic diagnoses were made 0,7 years (inter quartile range: 0,2–1,3 years) after cytology diagnosis. The VUSA trial had immediate referral for colposcopy, so the delay was mostly within the POBASCAM trial group. This is a relatively long period between reference standard and index test and may have introduced misclassification bias.
The authors report sensitivity and specificity of the hrHPV16/18 genotyping and methylation for CIN3+ detection in the population of interest. Enough information is given to calculate the negative predictive value, positive predictive value and accuracy (MedCalc version 22.013, 2023).
Khunamornpong (2016) is an observational study that examined the performance of hrHPV16/18 genotyping for detection of cervical precancer in a colposcopy referral population with minor cytological abnormalities. From October 2010 to February 2014, 238 women with minor cytological abnormalities (ASC-US or LSIL irrespective of the hrHPV test result) who were referred to the Colposcopy Clinic at Chiang Mai University (Thailand) were invited to participate. Exclusion criteria were pregnancy, having had a hysterectomy or any history of cervical epithelial lesion or abnormal cytology. Fifteen women were excluded due to lack of cervical histology (n=10 no biopsy because of no abnormality seen on colposcopy) or lacking hrHPV genotyping (n=5), leaving 223 samples for analysis. The authors report sensitivity, specificity, PPV and NPV for different triage options using genotyping in the ASC-US and L-SIL population regardless of hrHPV test result. Enough information is given to calculate the sensitivity, specificity, negative predictive value, positive predictive value and accuracy for the hrHPV positive population with hrHPV16/18 genotyping results (n=127) defined in the search question (MedCalc version 22.013, 2023).
Lin (2015) is an observational study that examined the performance of hrHPV16/18 genotyping for detection of CIN2+ in hrHPV-positive women with atypical squamous cells of undetermined significance (ASC-US) or low-grade squamous intraepithelial lesions (LSIL). From July 2006 to April 2007, 4215 women aged 15–54 years were included across three rural (Shanxi, Xinjiang and Henan) and two urban sites (Beijing and Shanghai) in China. Based on cytology, 406 women (329 ASC-US and 77 LSIL) were included in the analyses. Women living in the rural areas who tested positive for hrHPV or LSIL or higher and women living in the urban areas with ASC-US and positive for hrHPV or LSIL or higher received a colposcopy. Thus, the reference standard (CIN classification based on histology) was available for the entire population of interest. hrHPV-positive samples detected by HC2 were genotyped by the Linear Array® (LA) test.
The authors report sensitivity, specificity, PPV and NPV of hrHPV16/18 genotyping for CIN2+ detection separately for the ASC-US and LSIL populations. Enough information is given to calculate the sensitivity, specificity, NPV, PPV and accuracy for the population defined in the search question (MedCalc version 22.013, 2023).
Results
hrHPV16/18 genotyping
Sensitivity and specificity
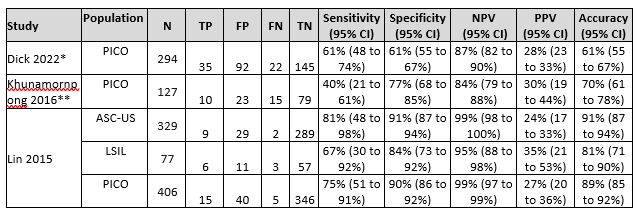
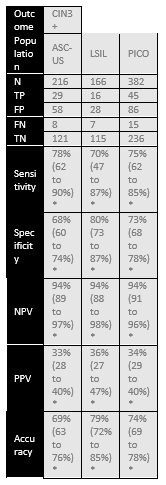
Dick (2022) assessed accuracy of hrHPV16/18 genotyping for distinguishing CIN3+ in 294 hrHPV positive and PAP2/PAP3a1 samples. Histology was used as a reference standard and identified 57 CIN3+ and 237 non-CIN3+ cases in this population (prevalence CIN3+ is 19% with 95% CI from 15 to 24%). The sensitivity of hrHPV16/18 genotyping was 61% and specificity 61%. Adding HPV16/18 genotyping in women with PAP2/PAP3a1 and hrHPV, resulted in a risk difference of 14.4 % for CIN3+ in hrHPV16/18-positive (absolute CIN3+ risk 27.6%) versus hrHPV16/18-negative women (absolute CIN3+ risk 13.2%). Results are shown in Table 1.
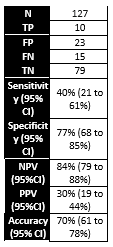
Khunamornpong (2016) assessed accuracy of hrHPV16/18 genotyping for distinguishing CIN2+ in a colposcopy referral population with 127 hrHPV-positive LSIL and ASC-US women. Histology was used as a reference standard and identified 25 CIN2+ and 102 non-CIN2+ cases in this population (prevalence CIN2+ is 20% with 95% CI from 13 to 28%). The sensitivity of hrHPV16/18 genotyping was 40% and specificity 77%. Results are shown in Table 1.
Lin (2015) assessed accuracy of hrHPV16/18 genotyping for distinguishing CIN2+ in 406 hrHPV positive and PAP2/PAP3a1 samples. Histology was used as a reference standard and identified 20 CIN2+ and 386 non-CIN2+ cases in this population (prevalence CIN2+ is 5% with 95% CI from 3 to 8%). The sensitivity of hrHPV16/18 genotyping was 75% and specificity 90%. Results are shown in Table 1.
Table 1. Sensitivity and specificity for diagnosing CIN2+ or CIN3+ based on hrHPV16/18 genotyping in hrHPV positive and PAP2/PAP3a1 samples
Abbreviations: N= number of participants in study, TN = true negatives, TP = true positives, FN = false negatives, FP = false positives, CI= confidence interval, NPV = negative predictive value, PPV = positive predictive value, accuracy = overall probability that a patient is correctly classified (calculation: sensitivity x prevalence + specificity x (1 – prevalence)).
* Dick (2022) reported on CIN3+ instead of CIN2+. Sensitivity and specificity were reported by the authors, enough information was available to calculate the NPV, PPV and accuracy (MedCalc version 22.013, 2023).
** Khunamornpong 2016 did not report diagnostic accuracy measures in the PICO population (hrHPV positive and PAP2/PAP3a1), but enough information was available to calculate the sensitivity, specificity, NPV and PPV for the population of interest (MedCalc version 22.013, 2023)
DNA methylation
Sensitivity and specificity
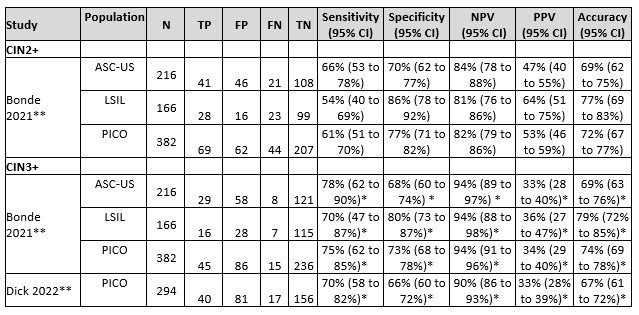
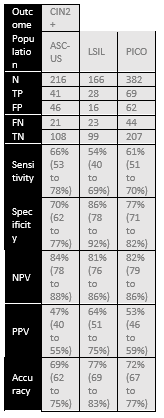
Bonde (2021) assessed accuracy of FAM19A4/miR124-2 methylation for distinguishing CIN2+ in 382 hrHPV positive and PAP2/PAP3a1 samples. Histology was used as a reference standard and identified 113 CIN2+ and 269 non-CIN2+ cases in this population (prevalence CIN2+ is 30% with 95% CI from 25 to 34%). The sensitivity of FAM19A4/miR124-2 methylation was 61% and specificity 77%. For CIN3+ prevalence is 16% (95% CI from 12 to 20%) based on 60 CIN3+ and 322 non-CIN3+ cases. The sensitivity of FAM19A4/miR124-2 methylation was 75% and specificity 73%. Results are shown in Table 2.
Dick (2022) assessed accuracy of FAM19A4/miR124-2 methylation for distinguishing CIN3+ in 294 hrHPV positive and PAP2/PAP3a1 samples. Histology was used as a reference standard and identified 57 CIN3+ and 237 non-CIN3+ cases in this population (prevalence CIN3+ is 19% with 95% CI from 15 to 24%). The sensitivity of FAM19A4/miR124-2 methylation was 70% and specificity 66%. Results are shown in Table 2.
Table 2. Sensitivity and specificity for diagnosing CIN2+ or CIN3+ based on FAM19A4/miR124-2 methylation in hrHPV positive and PAP2/PAP3a1 samples
Abbreviations: N= number of participants in study, TN = true negatives, TP = true positives, FN = false negatives, FP = false positives, CI= confidence interval, NPV = negative predictive value, PPV = positive predictive value, accuracy = overall probability that a patient is correctly classified (calculation: sensitivity x prevalence + specificity x (1 – prevalence)).
* These are CIN3+ results. Dick (2022) only reported on CIN3+ instead of CIN2+. Bonde (2021) provided enough information to calculate diagnostic accuracy for both CIN2+ and CIN3+. For comparison with Dick (2022) the CIN3+ outcomes are included and indicated by *.
** Bonde (2021) did not report diagnostic accuracy measures in the PICO population (hrHPV positive and PAP2/PAP3a1) and Dick (2022) only reported sensitivity and specificity. But enough information was available to calculate the sensitivity, specificity, NPV and PPV for the population of interest (MedCalc version 22.013, 2023)
Level of evidence of the literature
hrHPV16/18 genotyping
The evidence was derived from three observational studies (Dick 2022, Lin 2015, Khunamornpong 2016). The level of evidence for all reported outcome measures started at ‘high quality’.
Sensitivity
The level of evidence regarding the outcome measure sensitivity was downgraded by two levels to low because of study limitations related to heterogeneity in CIN2/3+ prevalence and uncertainty about the blinding of the researchers (-1 risk of bias) and applicability with reporting on CIN3+ instead of CIN2+ (-1 bias due to indirectness).
Specificity
The level of evidence regarding the outcome measure specificity was downgraded by two levels to low because of study limitations related to heterogeneity in CIN2/3+ prevalence and uncertainty about the blinding of the researchers (-1 risk of bias) and applicability with reporting on CIN3+ instead of CIN2+ (-1 bias due to indirectness).
DNA methylation
The evidence was derived from two observational studies that examined FAM19A4/miR124-2 methylation (Bonde 2021, Dick 2022). The level of evidence for all reported outcome measures started at ‘high quality’.
Sensitivity
The level of evidence regarding the critical outcome measure sensitivity was downgraded by two levels to low, because of study limitations related unclarity about design and patient flow in the screening cohorts (Bonde 2021) (-1 risk of bias) and applicability with reporting on CIN3+ instead of CIN2+ (-1 bias due to indirectness).
Specificity
The level of evidence regarding the important outcome measure specificity was downgraded by two levels to low because of study limitations related unclarity about design and patient flow in the screening cohorts (Bonde 2021) (-1 risk of bias) and applicability with reporting on CIN3+ instead of CIN2+ (-1 bias due to indirectness).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the diagnostic accuracy of additional hrHPV16/18 genotyping or methylation compared to the current diagnostic pathway (co-test cytology and hrHPV) in women with hrHPV positive PAP2/PAP3a1 for detection of CIN2+?
| P (Patients) | Women with hrHPV positive PAP2/PAP3a1 or equivalent LSIL/ASC-US |
| I (Index) | Additional typing on hrHPV16/18 genotyping or methylation markers |
| C (Comparator) | Usual care (current diagnostic pathway with cytology and hrHPV determination) |
| R (Reference standard) | Detection of CIN2+ with histology (this includes also CIN3+, AISs and adenocarcinomas) |
| O (Outcome measure) | Sensitivity, specificity |
| T/S (Timing and setting) | Complement to cytology and hrHPV determination on the uterine smear |
Relevant outcome measures
The guideline development group considered sensitivity as critical outcome measure for decision making and specificity as important outcome measure for decision making. The aim is to prevent false negatives, therefore a high sensitivity is critical. Next to that there is a clinical need to prevent unnecessary colposcopy referrals by better identification of women with transformative CIN2+.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined as a minimal clinically important difference:
- Sensitivity of ≥80%
- Specificity of ≥70%
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms for systematic reviews, RCTs and observational studies about triage, hrHPV16/18 genotyping and methylation markers until 26-07-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 360 hits.
Studies were selected based on the following criteria:
- systematic reviews (searched in at least two databases, detailed search strategy with search date, in- and exclusion criteria, exclusion table, risk of bias assessment and results of individual studies available), RCTs or observational studies;
- full-text English language publication; and
- studies according to the PICROTS.
29 studies were initially selected based on title and abstract screening. After reading the full text, 25 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 4 studies were included.
Results
Four observational studies were included in the analysis of the literature (Bonde 2021, Dick 2022, Lin 2015, Khunamornpong 2016). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- 1 - Dick, S., Vink, F. J., Heideman, D. A. M., Lissenberg-Witte, B. I., Meijer, C. J. L. M., & Berkhof, J. (2022). Risk-stratification of HPV-positive women with low-grade cytology by FAM19A4/miR124-2 methylation and HPV genotyping. British journal of cancer, 126(2), 259–264. https://doi.org/10.1038/s41416-021-01614-4.
- 2 - Khunamornpong, S., Settakorn, J., Sukpan, K., Srisomboon, J., Intaraphet, S., & Siriaunkgul, S. (2016). High performance of combined HPV testing and genotyping for HPV16/18/52/58 in triaging women with minor cervical cytological abnormalities in northern Thailand. Journal of medical virology, 88(1), 135–143. https://doi.org/10.1002/jmv.24290.
- 3 - Lin, C. Q., Cui, J. F., Zhang, X., Pan, Q. J., Chen, W., & Qiao, Y. L. (2015). Human Papillomavirus Genotyping to Predict the Risk of Cervical Precancerous Lesions or Cancer in Women with Minor Abnormal Cytology in China. Acta cytologica, 59(5), 405–411. https://doi.org/10.1159/000441290
Evidence tabellen
Evidence table for diagnostic test accuracy studies
Research question: What is the diagnostic accuracy of additional hrHPV16/18 genotyping and methylation compared to the current diagnostic pathway (co-test hrHPV and cytology) in women with hrHPV positive PAP2/PAP3a1 for detection of CIN2+?
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Dick 2022 |
Type of study[1]: Observational cohort study.
Setting and country: Post-hoc analysis of two Dutch screening trials (VUSA and POBASCAM)
Funding and conflicts of interest: Several research grants supported the work, Horizon 2020 (project ID 666800), CoheaHr (EC FP7 Health 2013 Innovation 1 CoheaHr), RISCC Network (847845) and the Dutch Cancer Society (KWF VU 2014-7238).
Authors report the following conflicts of interest: “CJLMM and DAMH are minority stockholders of Self-screen BV, a spin-off company of VUmc, which develops, manufactures and licences the high-risk HPV assay and methylation marker assays for cervical cancer screening and holds patents on these tests. CJLMM is part-time director of Self-screen BV. He has been on the speakers bureau and served occasionally on the scientific advisory board (expert meeting) of GSK, QIAGEN, SPMSD/Merck. He has been co-investigator on a SPMSD sponsored trial, of which his institute received research funding. CJLMM has a very small number of shares of MDxHealth and previously had shares of QIAGEN. DAMH has been on the speaker’s bureau of QIAGEN and serves occasionally on the scientific advisory boards of Pfizer and Bristol-Myers Squibb. SD, FJV, BLW and JB have no competing interests.” |
Inclusion criteria: asymptomatic women aged 30-60. Only HPV-positive women with BMD cytology.
Exclusion criteria: None described in article.
N= 294 (VUSA n = 123, POBASCAM n=171)
Prevalence: 56 CIN3 and 1 cervical carcinoma, 19%.
Median age: 35.0 years (range: 29–60 years) |
Describe index test-1: Addition of HPV16/18 genotyping. All EIA-positive samples were typed with reverse line blot (RLB) assay for 14 high-risk HPV types (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, and 68).
Cut-off point(s) -1: Samples either HC2 or EIA positive, but negative on RLB for HPV type 16, 18, 31, 33 and 45 were considered negative for HPV16/18/31/33/45.
Describe index test-2: Addition of FAM19A4/miR124-2 methylation using the QIAsure Methylation Test® (Qiagen, Hilden, Germany) (VUSA) or its prototype version (POBASCAM).
Cut-off point(s) -2: QIAsure Methylation Test® result exceeded the preset ΔΔCt value threshold for methylation positivity according to the manufacturer’s instructions.
Comparator test[2]: co-test on cervical scrapes with cytology and hrHPV with either HC2 high-risk HPV (QIAGEN, Hilden, Germany) (VUSA) or GP5+/6+ PCR-EIA (POBASCAM). VUSA-Screen trial HC2-positive samples were tested with GP5+/6+ PCR-EIA.
Cut-off point(s):
Cytology: CISOE-A classification, which can be translated into the Bethesda classification system. A borderline or mild dyskaryosis (BMD) cytology (comparable with atypical squamous cells of undetermined significance (ASC- US) and low-grade squamous intraepithelial neoplasia (LSIL) in the Bethesda classification).
HPV: Samples either HC2 or EIA positive. |
Describe reference test[3]: Histology based on colposcopy. Histopathologic follow-up data were collected through the nationwide network and registry of histopathology and cytopathology (PALGA).
Cut-off point(s): In both trials, histology results were classified as no dysplasia, CIN grade 1, 2, 3, or cervical cancer. Adenocarcinoma in situ was classified as CIN3. |
Time between the index test en reference test: CIN3+ detection was 0.7 years (IQR: 0.2–1.3 years). The VUSA trial had immediate referral for colposcopy. The included control group in the POBASCAM trial were referred for colposcopy (= reference standard) if repeat cytology at 6 or 18 months showed BMD or worse.
There was complete data for all included patients. |
Outcome measures and effect size4:
|
Authors indicate that gynaecological reports were not collected. Therefore it is unknow how many women complied with colposcopy, which could potentially lead to an underestimation of CIN3+ risks. |
|
Lin 2015 |
Type of study: multicenter, population-based, cross-sectional study.
Setting and country: three rural (Shanxi, Xinjiang and Henan) and two urban sites (Beijing and Shanghai) in China.
Funding and conflicts of interest: The authors declare no conflict of interest. Study was sponsored by the Cleveland Clinic Foundation. |
Inclusion criteria: women aged 15–54 years who provided informed consent were eligible for this study (parental consent was obtained for those <18 years old). In the analyses only ASC-US or LSIL were included.
Exclusion criteria: Women who were pregnant or <3 months postpartum, seropositive for HIV or had a history of hysterectomy or treatment for cervical cancer at the time of enrolment.
N= 4215 women were enrolled; 406 included (329 ASC-US and 77 LSIL)
Prevalence CIN2+: 5% with 95% CI from 3 to 8% in overall population. 3.34% ASC-US group (11/329; 95% CI: 1.40– 5.29%) and 11.69% in LSIL group (9/77; 95% CI: 4.51–18.86%).
Mean age ± SD: ASC-US 37,85 years (SD 9,52; range 20–54). LSIL 36,08 years (SD 9,85; range 19–53).
Other important characteristics: |
Describe index test: HPV genotyping was performed using Linear Array HPV Genotyping Test (Roche Molecular System, Inc.).
Comparator test: co-test on cervical scrapes with cytology and hrHPV (Hybrid Capture 2 (HC2)). |
Describe reference test: A colposcopy was done following the Preventive Oncology International microbiopsy protocol. If abnormalities were identified, a quadrant biopsy was performed. For quadrants with normal colposcopic impressions, one random biopsy was obtained at the squamocolumnar junction. All histological slides were reviewed by a pathologist from the Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College. Select histology slides were sent to the USA for qualitative control by the international pathology review panel.
|
Time between the index test en reference test: Unclear, not reported by authors. Although sample for the reference test was taken after the sample for the index test.
There was complete data for all included patients. Rural women who tested positive for HRHPV or LSIL< and urban women with ASC-US and positive for HRHPV or LSIL< received a colposcopy |
Outcome measures and effect size:
|
The study description is very minimal, thus difficult to assess risk of bias and determine relevant study characteristics such as study population and time between index and reference test. |
|
Khunamornpong 2016 |
Type of study: Cross- sectional observational study.
Setting and country: Women referred to the Colposcopy Clinic at Chiang Mai University. One- third of the study population consisted of women from a population-based screening in Chiang Mai.
Funding and conflicts of interest: Funded by a university grant (National Research University Project, under Thailand’s Office of the Higher Education Commission; Grant sponsor: Faculty of Medicine, Chiang Mai University). The authors declare no conflict of interest. |
Inclusion criteria:
Exclusion criteria: Women who were pregnant, had a previous hysterectomy, or had a previous history of any cervical epithelial lesion or abnormal cytology were excluded.
N= 223
Prevalence: CIN2+ in 20% PICO population with 95% CI from 13 to 28%.
Mean age: 43,8 years (SD 9,5; (range 19–68 years)
ASC–US in 113 women (50.7%) and LSIL in 110 women (49.3%). |
Describe index test: HPV genotyping was performed using Linear Array HPV Genotyping Test (Roche Molecular System, Inc., Branchburg, NJ) according to manufacturer’s instructions.
Comparator test: co-test on cervical scrapes with cytology and hrHPV (Hybrid Capture 2 (HC2) (Qiagen, Hilden, Germany) according to the manufacturer’s instructions).
Cut-off point(s): A positive HC2 test was defined with a quantitative threshold of relative light unit/positive control ratio ≥1.0. The use of 1.0 cut-off ratio was based on the manufacturer’s instructions. |
Describe reference test: Histologic diagnoses were made by a team of gynaecologic pathologists. The histologic diagnosis of HSIL+ was based on consensus of at least 3 pathologists.
Cut-off point(s): standard histomorphologic criteria.
|
Time between the index test en reference test: Cervical specimens for HPV DNA testing and HPV genotyping were collected at colposcopy (2/3 of the population) or at screening by co-testing (1/3 of the population), using a plastic spatula and a cytobrush.
There was complete data for all included patients. |
Outcome measures and effect size:
|
The study description is very minimal and fragmented, thus difficult to assess risk of bias and determine relevant study characteristics such as study population and time between index and reference test. |
|
Bonde 2021 |
Type of study[4]: Observational cohort study.
Setting and country: Post-hoc analysis of four European cohorts (Scotland, Denmark, Slovenia, the Netherlands)
Funding and conflicts of interest: The project was funded by the SME Instrument of the European Com- mission in the HORIZON2020 (Valid-screen contract ID: 666800).
Authors report the following conflicts of interest: “Jesper Bonde's institution has received research funding or con- sumables at reduced price or for free to support research from BD Diagnostics, Agena Bioscience, Genomica SAU, LifeRiver Biotech and QIAGEN. He has received honoraria for lectures from BD Diagnostics and Hologic Ltd. Jesper Bonde is an appointed member of the National Danish Cervical Screening Committee by the Danish Health Authority, and a member of the cervical screening steering committee of the Capital Region of Denmark. Kate Cuschieri institution has received research funding or gratis consumables to support research from the following commercial entities in the last 3 years: Cepheid, Genomica, LifeRiver, Euroimmun, GeneFirst, SelfScreen, Qiagen, Hiantis and Hologic. Grazyna Stanczuk received diagnostic tests from Roche and travel sponsorship and speaker's fee from Roche and Abbott. DAMH has been on the speaker's bureau of QIAGEN, serves occasionally on the scientific advisory board of Pfizer and Bristol-Meyers Squibb, and has minority stake in Self-screen B.V., a spin-off company of VU University Medical Center (currently known as Amsterdam UMC, Vrije Universiteit Amsterdam). Self-screen B.V. develops, manufactures and licenses the high-risk HPV assay and methylation marker assays for cervical cancer screening and holds patents on these tests. Chris J. L. M. Meijer is minority shareholder and part-time CEO of Self-screen B.V., a spin-off company of VUmc, which develops, manufactures and licenses the high-risk HPV assay and methylation marker assays for cervical cancer screening and holds patents on these tests. CJLMM has a very small number of shares of QIAGEN and MDXHealth, has received speakers' fees from GSK, QIAGEN, and SPMSD/Merck, and served occasionally on the scientific advisory boards (expert meeting) of these companies. Anja Oštrbenk Valencˇak has received reimbursement of travel expenses for attending conferences and honoraria for speaking from Abbott Molecular, Qiagen and Seegene. Arno Floore, Saskia Doorn and Albertus Hesselink are employed by Self-screen B.V. All other authors report no conflict of interest.” |
Inclusion criteria: (a) cervical scrapes derived from a screening cohort being hrHPV positive by a validated HPV screening assay; (b) containing sufficient material for cytology (where cytology was applicable) and valid methylation testing in concordance with the manufacturer's specification.
Exclusion criteria: (a) women <29 years of age; (b) inadequate cytology at baseline (where cytology was applicable); (c) HPV negative or invalid test results at baseline, or insufficient material for methylation testing.

 |
Describe index test: Addition of FAM19A4/miR124-2 methylation using the QIAsure Methylation Test (QIAGEN).
Cut-off point(s): According to the manufacturer’s instructions.
Comparator test[5]: co-test on cervical scrapes with cytology and hrHPV.
Cut-off point(s): Cytology: grading was translated into the Bethesda classification system.
HPV: According to manufacturer’s instructions
|
Describe reference test[6]: Histology based on colposcopy.
Cut-off point(s): Histology results were classified as no dysplasia, CIN grade 1, 2, 3, or cervical cancer. |
Time between the index test and reference test: Unclear, not reported
There was complete data for all included patients. |
Outcome measures and effect size4:
|
Authors did not provide information about the patient flow and reference standard collection per cohort/country. Thus difficult to assess risk of bias and determine relevant study characteristics such as time between index and reference test. |
[1] In geval van een case-control design moeten de patiëntkarakteristieken per groep (cases en controls) worden uitgewerkt. NB; case control studies zullen de accuratesse overschatten (Lijmer et al., 1999)
[2] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[3] De referentiestandaard is de test waarmee definitief wordt aangetoond of iemand al dan niet ziek is. Idealiter is de referentiestandaard de Gouden standaard (100% sensitief en 100% specifiek). Let op! dit is niet de “comparison test/index 2”.
4 Beschrijf de statistische parameters voor de vergelijking van de indextest(en) met de referentietest, en voor de vergelijking tussen de indextesten onderling (als er twee of meer indextesten worden vergeleken).
[4] In geval van een case-control design moeten de patiëntkarakteristieken per groep (cases en controls) worden uitgewerkt. NB; case control studies zullen de accuratesse overschatten (Lijmer et al., 1999)
[5] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[6] De referentiestandaard is de test waarmee definitief wordt aangetoond of iemand al dan niet ziek is. Idealiter is de referentiestandaard de Gouden standaard (100% sensitief en 100% specifiek). Let op! dit is niet de “comparison test/index 2”.
4 Beschrijf de statistische parameters voor de vergelijking van de indextest(en) met de referentietest, en voor de vergelijking tussen de indextesten onderling (als er twee of meer indextesten worden vergeleken).
Risk of bias assessment diagnostic accuracy studies (QUADAS II, 2011)
Research question: What is the diagnostic accuracy of additional HPV16/18 genotyping and methylation compared to the current diagnostic pathway (co-test hrHPV and cytology) in women with hrHPV positive PAP2/PAP3a1 for detection of CIN2+?
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Dick 2022 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unclear, not described in article
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? CIN3+ detection was 0.7 years (IQR: 0.2–1.3 years). However, the development of the disease takes (much) longer, so it is plausible dat misclassification bias is lowis .
The VUSA trial had immediate referral for colposcopy. The included control group in the POBASCAM trial were referred for colposcopy (= reference standard) if repeat cytology at 6 or 18 months showed BMD or worse.
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes, CIN3+ instead of CIN2+. Moreover, authors indicate that gynaecological reports were not collected. Therefore, it is unknow how many women complied with colposcopy, which could potentially lead to an underestimation of CIN3+ risks. |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Lin 2015 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear, not reported.
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Khunamornpong 2016 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear, specimens for HPV genotyping were collected at colposcopy (2/3 of the population) or at screening by co-testing (1/3 of the population). For 1/3 unclear how long between index and reference.
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Bonde 2021 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear, not described by authors.
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Unclear, not described by authors.
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? Yes, unclear how patient flow for the reference standard was regulated. The authors included women with no histological data in the ≤CIN1 group.
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Arbyn, M., Xu, L., Verdoodt, F., Cuzick, J., Szarewski, A., Belinson, J. L., Wentzensen, N., Gage, J. C., & Khan, M. J. (2017). Genotyping for Human Papillomavirus Types 16 and 18 in Women With Minor Cervical Lesions: A Systematic Review and Meta-analysis. Annals of internal medicine, 166(2), 118–127. https://doi.org/10.7326/M15-2735 |
Wrong population (only reported for ASC-US/LSIL separately instead of combined), wrong study design (does not report enough information about studies, including for studies for which the authors obtained additional information from authors, for an analysis conform current PICO) |
|
Adcock, R., Nedjai, B., Lorincz, A. T., Scibior-Bentkowska, D., Banwait, R., Torrez-Martinez, N., Robertson, M., Cuzick, J., Wheeler, C. M., & New Mexico HPV Pap Registry Steering Committee (2022). DNA methylation testing with S5 for triage of high-risk HPV positive women. International journal of cancer, 151(7), 993–1004. https://doi.org/10.1002/ijc.34050 |
wrong study design (stratified sample to over- represent CIN2+) |
|
Gage, J. C., Schiffman, M., Solomon, D., Wheeler, C. M., Gravitt, P. E., Castle, P. E., & Wentzensen, N. (2013). Risk of precancer determined by HPV genotype combinations in women with minor cytologic abnormalities. Cancer epidemiology, biomarkers & prevention : a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology, 22(6), 1095–1101. https://doi.org/10.1158/1055-9965.EPI-12-1455 |
Wrong design (RCT to compare triage strategies that do not include the strategy of interest), wrong population (HPV16/18+ in whole LSIL/ASC-US, not within already hrHPV+ population) |
|
Guo, Z., Jia, M. M., Chen, Q., Chen, H. M., Chen, P. P., Zhao, D. M., Ren, L. Y., Sun, X. B., & Zhang, S. K. (2019). Performance of Different Combination Models of High-Risk HPV Genotyping in Triaging Chinese Women With Atypical Squamous Cells of Undetermined Significance. Frontiers in oncology, 9, 202. https://doi.org/10.3389/fonc.2019.00202 |
Wrong population (HPV16/18+ in whole LSIL/ASC-US, not within already hrHPV+ population) |
|
Iwata, T., Hasegawa, T., Ochiai, K., Takizawa, K., Umezawa, S., Kuramoto, H., Ohmura, M., Kubushiro, K., Arai, H., Sakamoto, M., Motoyama, T., Watanabe, K., & Aoki, D. (2015). Human Papillomavirus Test for Triage of Japanese Women With Low-Grade Squamous Intraepithelial Lesions. Reproductive sciences (Thousand Oaks, Calif.), 22(12), 1509–1515. https://doi.org/10.1177/1933719115589408 |
wrong study design, wrong population (only LSIL, no ASC-US) |
|
Lee, B., Suh, D. H., Kim, K., No, J. H., & Kim, Y. B. (2015). Utility of Human Papillomavirus Genotyping for Triage of Patients with Atypical Squamous Cells of Undetermined Significance by Cervical Cytology. Anticancer research, 35(7), 4197–4202. |
wrong study design, wrong population (only ASC-US) |
|
Leeman, A., Del Pino, M., Marimon, L., Torné, A., Ordi, J., Ter Harmsel, B., Meijer, C. J. L. M., Jenkins, D., Van Kemenade, F. J., & Quint, W. G. V. (2019). Reliable identification of women with CIN3+ using hrHPV genotyping and methylation markers in a cytology-screened referral population. International journal of cancer, 144(1), 160–168. https://doi.org/10.1002/ijc.31787 |
wrong study design (examine combination in entire LSIL/ASC-US population independent of hrHPV status) |
|
Li, N., Hu, Y., Zhang, X., Liu, Y., He, Y., van der Zee, A. G. J., Schuuring, E., & Wisman, G. B. A. (2021). DNA methylation markers as triage test for the early identification of cervical lesions in a Chinese population. International journal of cancer, 148(7), 1768–1777. https://doi.org/10.1002/ijc.33430 |
wrong population, wrong study design |
|
Li, S. R., Wang, Z. M., Wang, Y. H., Wang, X. B., Zhao, J. Q., Xue, H. B., & Jiang, F. G. (2015). Value of PAX1 Methylation Analysis by MS-HRM in the Triage of Atypical Squamous Cells of Undetermined Significance. Asian Pacific journal of cancer prevention : APJCP, 16(14), 5843–5846. https://doi.org/10.7314/apjcp.2015.16.14.5843 |
wrong study design, wrong population (ASC-US only, no combination with hrHPV status for methylation) |
|
Lie, A. K., Tropé, A., Skare, G. B., Bjørge, T., Jonassen, C. M., Brusegard, K., & Lönnberg, S. (2018). HPV genotype profile in a Norwegian cohort with ASC-US and LSIL cytology with three year cumulative risk of high grade cervical neoplasia. Gynecologic oncology, 148(1), 111–117. https://doi.org/10.1016/j.ygyno.2017.10.031 |
wrong study design (calculates prevalence and proportion, not enough information to derive sens and spec) |
|
Liou, Y. L., Zhang, Y., Liu, Y., Cao, L., Qin, C. Z., Zhang, T. L., Chang, C. F., Wang, H. J., Lin, S. Y., Chu, T. Y., Zhang, Y., & Zhou, H. H. (2015). Comparison of HPV genotyping and methylated ZNF582 as triage for women with equivocal liquid-based cytology results. Clinical epigenetics, 7(1), 50. https://doi.org/10.1186/s13148-015-0084-2 |
wrong study design, wrong population (HPV and methylation in whole LSIL/ASC-US, not within already hfHPV+ population) |
|
Lorincz, A. T., Brentnall, A. R., Vasiljević, N., Scibior-Bentkowska, D., Castanon, A., Fiander, A., Powell, N., Tristram, A., Cuzick, J., & Sasieni, P. (2013). HPV16 L1 and L2 DNA methylation predicts high-grade cervical intraepithelial neoplasia in women with mildly abnormal cervical cytology. International journal of cancer, 133(3), 637–644. https://doi.org/10.1002/ijc.28050 |
wrong study design, wrong population (HPV16+ instead of hrHPV+) |
|
Nakamura, Y., Matsumoto, K., Satoh, T., Nishide, K., Nozue, A., Shimabukuro, K., Endo, S., Nagai, K., Oki, A., Ochi, H., Morishita, Y., Noguchi, M., & Yoshikawa, H. (2015). HPV genotyping for triage of women with abnormal cervical cancer screening results: a multicenter prospective study. International journal of clinical oncology, 20(5), 974–981. https://doi.org/10.1007/s10147-015-0789-4 |
wrong study design |
|
Oranratanaphan, S., Kobwitaya, K., Termrungruanglert, W., Triratanachat, S., Kitkumthorn, N., & Mutirangura, A. (2020). Value of CCNA1 promoter methylation in triaging ASC-US cytology. Asian Pacific journal of cancer prevention : APJCP, 21(2), 473–477. https://doi.org/10.31557/APJCP.2020.21.2.473 |
wrong study design, wrong population (ASC-US only, not hrHPV+) |
|
Pan, D., Dong, B., Gao, H., Mao, X., Xue, H., & Sun, P. (2020). The Triage Effectiveness of an Extended High-Risk Human Papillomavirus Genotyping Assay for Women with Cytology Showing Atypical Squamous Cells of Undetermined Significance in China. Risk management and healthcare policy, 13, 1747–1756. https://doi.org/10.2147/RMHP.S270265 |
wrong study design, wrong population (ASC-US only) |
|
Schiffman, M., Boyle, S., Raine-Bennett, T., Katki, H. A., Gage, J. C., Wentzensen, N., Kornegay, J. R., Apple, R., Aldrich, C., Erlich, H. A., Tam, T., Befano, B., Burk, R. D., & Castle, P. E. (2015). The Role of Human Papillomavirus Genotyping in Cervical Cancer Screening: A Large-Scale Evaluation of the cobas HPV Test. Cancer epidemiology, biomarkers & prevention : a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology, 24(9), 1304–1310. https://doi.org/10.1158/1055-9965.EPI-14-1353 |
wrong study design, wrong population (ASC-US only or negative cytology for hrHPV+ population) |
|
Solé-Sedeno, J. M., Mancebo, G., Miralpeix, E., Lloveras, B., Bellosillo, B., Alameda, F., & Carreras, R. (2018). Utility of Human Papillomavirus Genotyping in the Management of Low-Grade Squamous Intraepithelial Lesions. Journal of lower genital tract disease, 22(1), 13–16. https://doi.org/10.1097/LGT.0000000000000354 |
Wrong population (LSIL only and HPV16/18+ not within already hrHPV+ population) |
|
Stoler, M. H., Wright, T. C., Jr, Sharma, A., Apple, R., Gutekunst, K., Wright, T. L., & ATHENA (Addressing THE Need for Advanced HPV Diagnostics) HPV Study Group (2011). High-risk human papillomavirus testing in women with ASC-US cytology: results from the ATHENA HPV study. American journal of clinical pathology, 135(3), 468–475. https://doi.org/10.1309/AJCPZ5JY6FCVNMOT |
Wrong population (ASC-US only) |
|
Tao, X., Austin, R. M., Yu, T., Zhong, F., Zhou, X., Cong, Q., Sui, L., & Zhao, C. (2022). Risk stratification for cervical neoplasia using extended high-risk HPV genotyping in women with ASC-US cytology: A large retrospective study from China. Cancer cytopathology, 130(4), 248–258. https://doi.org/10.1002/cncy.22536 |
Wrong population (ASC-US only and not for HPV16/18+ only separate hrHPV) |
|
Wang, W., Zhang, H., Lin, L., Yang, A., Yang, J., Zhao, W., Wang, Z., Zhang, L., Su, X., Wang, Z., Wang, C., Zhang, H., Feng, B., Li, D., Liu, H., Niu, X., Wang, J., Song, J., Li, L., Lv, W., … Hao, M. (2021). Efficient combination of Human Papillomavirus Genotyping for the triage of women with Atypical Squamous Cells of Undetermined Significance in Chinese rural population: A population-based study. Journal of Cancer, 12(10), 2815–2824. https://doi.org/10.7150/jca.55771 |
Wrong population (ASC-US only) |
|
Wang, Y., Gao, S., Wang, Y., Chen, F., Deng, H., & Lu, Y. (2020). The Efficiency of Type-Specific High-Risk Human Papillomavirus Models in the Triage of Women with Atypical Squamous Cells of Undetermined Significance. Cancer management and research, 12, 5265–5275. https://doi.org/10.2147/CMAR.S254330 |
Wrong population (ASC-US only and not for HPV16/18+ only separate hrHPV+) |
|
Wong, O. G., Lo, C. K., Szeto, E., & Cheung, A. N. (2011). Efficacy of Abbott RealTime High Risk HPV test in evaluation of atypical squamous cells of undetermined significance from an Asian screening population. Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology, 51(2), 136–138. https://doi.org/10.1016/j.jcv.2011.03.010 |
wrong study design, wrong population (ASC-US only and not in HPV+ population) |
|
Wright, T. C., Jr, Stoler, M. H., Parvu, V., Yanson, K., Cooper, C., & Andrews, J. (2019). Risk detection for high-grade cervical disease using Onclarity HPV extended genotyping in women, ≥21 years of age, with ASC-US or LSIL cytology. Gynecologic oncology, 154(2), 360–367. https://doi.org/10.1016/j.ygyno.2019.05.012 |
Wrong population (not for HPV16/18+ only separate hrHPV+) |
|
Xu, L., Benoy, I., Cuschieri, K., Poljak, M., Bonde, J., & Arbyn, M. (2019). Accuracy of genotyping for HPV16 and 18 to triage women with low-grade squamous intraepithelial lesions: a pooled analysis of VALGENT studies. Expert review of molecular diagnostics, 19(6), 543–551. https://doi.org/10.1080/14737159.2019.1613890 |
wrong study design, wrong population (LSIL only) |
|
Xue, H., Gao, H., Zheng, J., Chen, Y., Chen, J., Pan, D., Dong, B., & Sun, P. (2021). Use of extended HR-HPV Genotyping in improving the Triage Strategy of 2019 ASCCP recommendations in Women with positive HR-HPV diagnosis and Simultaneous LSIL Cytology Results. Journal of Cancer, 12(14), 4332–4340. https://doi.org/10.7150/jca.55826 |
wrong population (LSIL only) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 24-06-2025
Algemene gegevens
De voorliggende richtlijn betreft een gedeeltelijke herziening van de richtlijn Cervixcytologie uit 2016. Alle modules zijn beoordeeld op actualiteit. Vervolgens is een prioritering aangebracht welke modules een daadwerkelijke update zouden moeten krijgen. Hieronder staan de modules genoemd met de wijzigingen.
|
Onderwerpen |
Wijzigingen richtlijn 2024/2025 |
|
Module 1 Algemeen |
Vervangen door de startpagina |
|
Module 1.1 Procesbeschrijving |
Vervangen door de startpagina |
|
Module 2 Epidemiologie en pathofysiologie |
Onveranderd |
|
Module 3 Aanvraag, uitvoering en verwerking |
|
|
Module 3.1 Indicaties voor cervixcytologisch onderzoek |
Minimale (tekstuele) aanpassingen |
|
Module 3.2 Geldigheidsduur van het BVO-advies |
Minimale (tekstuele) aanpassingen |
|
Module 3.3 Vereiste klinische gegevens |
Minimale (tekstuele) aanpassingen |
|
Module 3.4 Methode afname materiaal |
Minimale (tekstuele) aanpassingen |
|
Module 3.5 Logistiek van het materiaal |
Onveranderd |
|
Module 3.6 Eerste opvang en verwerking laboratorium |
Minimale (tekstuele) aanpassingen |
|
Module 4 Diagnostiek |
|
|
Module 4.1 Keuze voor test/test traject |
Minimale (tekstuele) aanpassingen |
|
Module 4.1.1 Type cytologische test |
Minimale (tekstuele) aanpassingen |
|
Module 4.1.2 Nieuwe moleculaire en cytologische technieken detectie CIN2+ |
Nieuw ontwikkeld |
|
Submodule 4.1.2.1 Moleculaire technieken detectie CIN2+ |
Nieuw ontwikkeld |
|
Submodule 4.1.2.2 Cytologische technieken detectie CIN2+ |
Nieuw ontwikkeld |
|
Module 4.1.3 Primaire beoordeling van cervixcytologie |
Minimale (tekstuele) aanpassingen |
|
Module 4.1.4 Codering van de uitslag |
Minimale (tekstuele) aanpassingen |
|
Module 4.1.5 Beoordeelbaarheid |
Minimale (tekstuele) aanpassingen |
|
Module 4.1.6 Beoordeling bij atrofie |
Minimale (tekstuele) aanpassingen |
|
Module 4.2 Multiple screen protocol |
Onveranderd |
|
Module 4.3 Computer Ondersteunend Screenen (COS) en digitale cytologie met AI |
Nieuw ontwikkeld |
|
Module 4.4 hrHPV-test |
Minimale (tekstuele) aanpassingen |
|
Module 4.4.1 Type hrHPV-test/Keuze hrHPV-test |
Minimale (tekstuele) aanpassingen |
|
Module 4.4.2 Beoordeling resultaat van hrHPV-test |
Minimale (tekstuele) aanpassingen |
|
Module 4.4.3 Uitslag hrHPV-test en beoordeling cervixcytologie |
Komt te vervallen |
|
Module 4.5 Verslaglegging |
Minimale (tekstuele) aanpassingen |
|
Module 4.6 Rapportage |
Onveranderd |
|
Module 4.7 Wijziging in het verslag en versiebeheer |
Onveranderd |
|
Module 5 Follow-up |
|
|
Module 5.1 Follow-up na behandeling aan de cervix |
Komt te vervallen, met een verwijzing naar de CIN, AIS en VAIN richtlijn |
|
Module 5.2 Self sampling bij follow-up van behandelde cervicale laesies |
Komt te vervallen, met een verwijzing naar de CIN, AIS en VAIN richtlijn |
|
Module 5.3 Controle van de uitvoering van het advies |
Minimale (tekstuele) aanpassingen |
|
Module 6 Organisatie van zorg |
|
|
Module 6.1 Eisen aan de methodologie en setting |
Minimale (tekstuele) aanpassingen |
|
Module 6.2 Volumenormen |
Minimale (tekstuele) aanpassingen |
|
Module 6.3 Indicaties voor revisie |
Onveranderd |
|
Module 6.4 Bewaarcondities |
Minimale (tekstuele) aanpassingen |
|
|
|
|
Flowcharts |
|
|
Flowchart Cytologisch onderzoek en hrHPV bij klachten |
geüpdatet |
|
Flowchart Bevolkingsonderzoek |
geüpdatet |
Belangrijkste wijzigingen ten opzichte van vorige versie
Er zijn drie nieuwe (sub)modules aan de richtlijn toegevoegd, namelijk de module “Moleculaire technieken detectie CIN2+”, de module “Cytologische technieken detectie CIN2+” en de module “Computer Ondersteunend Screenen en digitale cytologie met AI”. De overige modules zijn opnieuw beoordeeld waarbij er aanpassingen zijn gedaan ter uniformering met het bevolkingsonderzoek baarmoederhalskanker, de NVOG richtlijn CIN, AIS en VAIN (2021) en de NHG standaard Vaginaal bloedverlies (versie januari 2024).
De herziening van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule(s).
Samenstelling werkgroep
Voor de herziening van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor personen die cervixcytologisch onderzoek krijgen.
Werkgroep
- Mw. dr. A.M. (Anne) Uyterlinde (voorzitter), klinisch patholoog (met pensioen per 01-01-2024), Amsterdam UMC, NVVP
- Mw. drs. L.F.S. (Loes) Kooreman, patholoog, Maastricht UMC+, NVVP
- Dhr. dr. A.J.C. (Adriaan) van de Brule, klinisch moleculair bioloog, Jeroen Bosch Ziekenhuis, NVVP
- Mw. C.H.M. (Lianne) Marijnissen - van Gils, teamleider cytologie, Pathologie Zuid-West Nederland, NVML
- Mw. L. (Liselore) Moenis, teamleider cytologie, Symbiant, NVML
- Mw. dr. N.E. (Nienke) van Trommel, gynaecoloog-oncoloog, Antoni van Leeuwenhoekziekenhuis, NVOG
- Mw. drs. A.M.L.D. (Anne-Marie) van Haaften-de Jong, gynaecoloog, HagaZiekenhuis, NVOG
- Mw. drs. R. (Roosmarijn) Luttmer, gynaecoloog, OLVG, NVOG
- Mw. dr. W.W. (Wieke) Kremer, gynaecoloog in opleiding, Amsterdam UMC, NVOG
- Dhr. ing. P.A. (Paul) Seegers, senior adviseur protocollen, Stichting Palga
- Dhr. dr. A.G. (Bert) Siebers, adviseur gegevensaanvragen, Stichting Palga
- Mw. drs. E. (Esther) Brouwer, senior programmamedewerker bevolkingsonderzoeken naar kanker, RIVM
- Mw. J. (Joyce) Nouwens, huisarts, Huisartsenpraktijk Jongsma & Nouwens, NHG
- Mw. ir. J.G. (Josée) Diepstraten, patiëntvertegenwoordiger, Stichting Olijf
Met ondersteuning van
- Mw. dr. E.V. (Ekaterina) Baranova - van Dorp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mw. dr. L. (Lotte) Houtepen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mw. dr. N. (Nikita) van der Zwaluw, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Adriaan van de Brule |
Klinisch Moleculair Bioloog in de Pathologie (KMBP), |
Beroepenveldcie. Fontys Hogescholen (onbetaald), |
Deel van eigen HPV onderzoek vindt plaats ism bedrijven, waarbij gratis testkits ter beschikking gesteld worden. Ikv. STZ erkenning HPV expertise-centrum Jeroen Bosch ziekenhuis, Kennis tbv eigen HPV-diagnostiek binnen Jeroen Bosch ziekenhuis en P-DNA
|
Geen restrictie (onderzoek CCDiagnostics: geen projectleider; onderzoek Hologic en Roche: niet gerelateerd aan uitgangsvraag module) |
|
Anne Uyterlinde (vz.) |
Universitair medisch specialist, patholoog (O-aanstelling sinds 1-1-2024) bij Amsterdam UMC locatie VUMC (onbetaald); Landelijke Referentie Functionaris Cytologie bij BVO Nederland (16 u/week, betaald) |
* Landelijke Referentiefunctionaris Bevolkingsonderzoek Baarmoederhalskanker, gedetacheerd bij Bevolkingsonderzoek Nederland (FSB), (0,4 FTE) vanuit Amsterdam UMC. Geen persoonlijke vergoeding *Technical Assessor Pathologie Laboratoira voor ISO 15189 (2022) ad hoc bij RVA. Beeordeling van werkzaamheden tijdens een audit. (betaald) |
Geen deelname aan onderzoek met extra financiering. Wel pilotonderzoek gecoördineerd als Landelijke Referentie Functionaris naar de inzet van COS binnen het bevolkingsonderzoek in opdracht van RIVM en screeningsorganisatie. De uitkomsten zijn beoordeeld en goedgekeurd door de Gezondheidsraad (2022). |
Geen restrictie |
|
Anne-Marie van Haaften-de Jong |
Gynaecoloog Haga Ziekenhuis (betaald) |
* Werkgroep NVVP - Cervixcytologie, modulaire revisie landelijke richtlijn, vacatiegelden |
Geen |
Geen restrictie |
|
Bert Siebers |
Adviseur gegevensaanvragen, Stichting Palga |
Geen |
"PREFER studie * ZonMW - Risk profiling in cervical cancer screening to reduce unnecessary referrals and follow-up - Geen projectleider" |
Geen restrictie |
|
Esther Brouwer |
Sr. programmamedewerker / projectleider (in dienstverband) RIVM-Centrum voor Bevolkingsonderzoek |
Niet van toepassing |
Werkzaam bij het Rijksinstituut voor Volksgezondheid en Milieu (RIVM), Centrum voor Bevolkingsonderzoek (CvB). Voor de positie van het RIVM en de taakomschrijving van het CvB zie: www.rivm.nl. |
Geen restrictie |
|
Josée Diepstraten |
Lid werkgroep Kwaliteit van Zorg van Stichting Olijf (onbetaald) |
Namens Stichting Olijf tevens betrokken bij Programmacommissie Bevolkingsonderzoek baarmoederhalskanker en bij andere richtlijnrevisies (onbetaald). |
Geen |
Geen restrictie |
|
Joyce Nouwens |
Functienaam: huisarts werkgever: NHG |
- Programma commissie baarmoederhalskanker, rol consulent vanuit NHG (vergoeding) |
Geen |
Geen restrictie |
|
Lianne van Gils |
Teamleider cytologie, Pathologie Zuid-West Nederland B.V. |
Niet van toepassing |
Geen |
Geen restrictie |
|
Liselore Moenis |
Teamleider Cytologie, Symbiant |
Geen |
Geen |
Geen restrictie |
|
Loes Kooreman |
Maastricht Universitair Medisch Centrum+, patholoog |
Voorzitter Nederlandse werkgroep gynaecopathologie, onbetaald. |
Roche PDL1 mamma, deelname aan onderzoek waarvoor vergoeding aan het ziekenhuis. Novartis PIK3CA mamma, deelname adviesraad eenmalig. SCEM 1x per jaar, vergoeding voor onderwijs gynaecopathologie WOG. * Roche - PDL1 interobserver studie mammacarcinoom - Geen projectleider * Novartis - Eenmalige adviesraad PIK3CA mammacarcinoom - Geen projectleider * SCEM – Onderwijs |
Geen advieswerk gedurende richtlijn traject. Extern gefinancierd onderzoek niet-gerelateerd. |
|
Nienke van Trommel |
Gynaecoloog- oncoloog |
kort project met RIVM in 2022/2023 over communicatie met 9-jarigen en hun ouders over HPV vaccinatie |
* KWF - Fertiliteit sparende behandeling cervix carcinoom - Projectleider * KWF - Kwaliteit van leven na fertiliteit sparende behandeling gynaecologische kanker - Geen projectleider * Maarten van der Weijden Stichting – vroege detectie ovariumcarcinoom |
Geen restrictie |
|
Paul Seegers |
Sr. Adviseur Landelijke Pathologie en Moleculaire protocollen |
Member of the digitalization working group of the Belgium Society of Pathology |
Geen |
Geen restrictie |
|
Roosmarijn Luttmer |
Gynaecoloog - Ziekenhuis Amstelland, Amstelveen |
Werkgroep preventie cervixcarcinoom Suriname |
Geen |
Geen restrictie |
|
Wieke Kremer |
Arts-assistent in opleiding tot gynaecoloog, Amsterdam UMC. |
2022-11 Online webinar op uitnodiging van Qiagen over gepubliceerd wetenschappelijk onderzoek over het gebruik van methyleringsmarkers (waaronder QiaSure) in behandeling van voorloperstadia van baarmoederhalskanker. Vergoeding uitbetaald aan werkgever. |
Concerve studie ZonMw - Preventing overtreatment of CIN2/3: role of methylation markers in predecting regression (CONCERVE) - Geen projectleider |
Geen presentaties/activiteiten voor commerciële partij gedurende richtlijntraject. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Stichting Olijf en Patiëntenfederatie Nederland voor de schriftelijke knelpuntenanalyse en afgevaardigde patiëntenvereniging (Stichting Olijf) in de werkgroep. Het verslag van de schriftelijke knelpuntenanalyse (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Stichting Olijf en de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de nieuwe richtlijnmodules is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Moleculaire technieken detectie CIN2+ |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (5.000 - 40.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die een uitstrijkje krijgen voor cervixcytologisch onderzoek. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule (NVVP, 2016) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door verschillende partijen via een schriftelijke uitvraag. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.