Streefwaarde van LDL-C bij CVRM
Uitgangsvraag
Welke streefwaarden van LDL-C dienen te worden gehanteerd bij de behandeling met lipidenverlagende medicatie bij personen met een (zeer) hoog risico op hart- en vaatziekten?
Aanbeveling
Streef naar een LDL-C <1,8 mmol/l bij patiënten met hart- en vaatziekten ≤70 jaar*.
Streef naar een LDL-C <2,6 mmol/l bij een van de (of combinatie van de) volgende situaties:
- een 10-jaars hart- en vaatziekte sterfterisico ≥5%**;
- patiënten met diabetes mellitus;
- patiënten met chronische nierschade
- ernstig verhoogde enkele risicofactor, in het bijzonder totaalcholesterol >8 mmol/l of bloeddruk ≥180mmHg.
* De genoemde leeftijdsgrens is geen absolute grens. Kwetsbaarheid is niet altijd gebonden aan de leeftijd van de patiënt.
** Op basis van een risicoscoretabel (zoals SCORE)
Overwegingen
LDL-C-streefwaarde
Hoewel strikt wetenschappelijk bewijs ontbreekt voor het verlagen van het risico op hart- en vaatziekten bij het streven naar een bepaald maximaal LDL-C-concentratie (2,6 mmol/l of 1,8 mmol/l) is in deze richtlijn toch gekozen voor drempel- en streefwaarden van LDL-C. De reden hiervoor is dat gebruik van streefwaarden in de praktijk hanteerbaar is en een eenduidig doel vormen voor behandelaren in 1e en 2e lijn en voor de patiënt, en een manier kan zijn om therapietrouw te bevorderen. Voor patiënten ≤70 jaar met hart- en vaatziekten bestaat bewijs dat intensieve lipidenverlaging gepaard gaat met een lager risico op hart- en vaatziekten, waarbij een LDL-C-streefwaarde <1,8 mmol/l een redelijk doel is, gezien de trials waarin intensieve lipidenverlaging met minder intensieve lipidenverlaging. Er moet worden gerealiseerd dat het behalen van een dergelijk behandeldoel aanzienlijke inspanning vergt van patiënt en behandelaar. Hoewel het niet onaannemelijk is, bestaat voor overige patiënten geen bewijs dat intensieve lipidenverlaging tot een lager risico leidt in vergelijking met gemiddelde lipidenverlaging. Een LDL-C-streefwaarde <2,6 mmol/l is bij deze patiënten daarom een redelijk doel. Uiteraard is het belangrijk om de patiënt te betrekken bij de afweging en beslissing om te starten met lipidenverlagende therapie en gezamenlijk het therapie doel vast te stellen.
Mocht een patiënt door de lipidenverlagende medicatie aanzienlijk lagere LDL-C-waarden bereiken dan de streefwaarde, maar de behandeling wel goed verdragen, dan kan dat worden geaccepteerd. Er bestaan namelijk aanwijzingen dat het bereiken van een LDL-C (veel) lager dan de streefwaarde veilig is en mogelijk zelfs gepaard gaat met een (nog) lager risico op hart- en vaatziekten.
Bij mensen die niet tot een risicocategorie behoren op basis van een eerdere hart- en vaatziekte, diabetes, nierfunctiestoornissen of een ernstig verhoogde totaalcholesterol of bloeddrukwaarde en ook geen verhoogd risico hebben door een combinatie van risicofactoren (10-jaars hart- en vaatziekten sterfterisico <5% op basis van een risicoscoretabel (zoals SCORE)) lijkt het redelijk om te streven naar een LDL-C <3,0 mmol/l (non-HDL-C <3,8 mmol/l) middels leefstijlmaatregelen (vetbeperkt dieet, lichamelijke activiteit, gezond gewicht).
Voor patiënten boven de 70 jaar zijn de aanbevelingen omtrent lipidenverlagende behandeling anders. Dit is uitvoerig gemotiveerd en beschreven in de module Dyslipidemie bij ouderen bij CVRM. In essentie komen de aanbevelingen neer op een restrictiever beleid ten aanzien van het starten van lipidenverlagende therapie, waarbij aanwezigheid van ernstige risicofactoren en/of een hoog geschat hart- en vaatziekten risico (zoals een eerder doorgemaakt hartinfarct of TIA/herseninfarct), maar ook kwetsbaarheid en resterende levensverwachting moeten worden gewogen. (Inter)Nationaal is er discussie over de LDL-streefwaarden bij ouderen met een doorgemaakte hart- en vaatziekte, waarbij sommige (inter)nationale richtlijnen adviseren om ook voor ouderen >70 jaar met een hart- of vaatziekte een streefwaarde van 1,8 of lager aan te houden. De werkgroep is van mening dat er onvoldoende bewijs is om bij ouderen met hart- en vaatziekte deze lagere LDL-streefwaarde generiek aan te bevelen, maar bij goed verdragen van de medicatie kan een lagere streefwaarde dan 2,6 mmol/l wel overwogen worden. Ook hangt de intensiviteit van behandeling af van de motivatie van de patiënt en of de patiënt de therapie goed verdraagt.
Triglyceriden
Hypertriglyceridemie is een significante onafhankelijke risicofactor voor hart- en vaatziekten, maar de associatie is veel minder sterk dan bij hypercholesterolemie (Sarwar, 2007). Het risico is sterker geassocieerd met gematigde dan met zeer ernstige hypertriglyceridemie (>10 mmol/l), die als risicofactor voor pancreatitis geldt. Er zijn echter geen gerandomiseerde onderzoeken geweest die voldoende bewijs bieden om doelwaarden te kunnen vaststellen voor triglyceriden. Meta-analyses wijzen erop dat een gerichte aanpak van triglyceriden hart- en vaatziekten kan verlagen bij patiënten met diabetes mellitus met hoge triglyceriden en lage HDL-C. Op het moment worden nuchtere triglyceriden >1,7 mmol/l gezien als een marker voor verhoogd risico op hart- en vaatziekten, maar er is onvoldoende bewijs voor specifieke triglyceriden-verlagende behandeling om het risico op hart- en vaatziekten te verlagen.
Zeer hoge plasmatriglyceridewaarden (>10 mmol/l) waar geen duidelijke onderliggende oorzaak voor kan worden aangewezen (bijvoorbeeld alcohol of slechte glycemische controle bij diabetes mellitus) vereisen nadere diagnostische analyse, in gespecialiseerde klinieken, naar specifieke oorzaken waaronder genetische mutaties (zoals familiaire dysbètalipoproteïnemie, LPL-deficiëntie). Voor meer informatie wordt verwezen naar de richtlijn (erfelijke) dyslipidemie in de 2e en 3e lijn.
HDL-C
Laag HDL-C is onafhankelijk geassocieerd met een hoger risico op hart- en vaatziekten (Chapman, 2011). Laag HDL-C is mogelijk even ernstig als hypercholesterolemie (door hoge concentraties LDL-C) als een risicofactor voor ischemische hartziekten (Fruchart, 2008). De combinatie van matig verhoogde triglyceriden en lage concentraties HDL-C komt veel voor bij patiënten met type 2 diabetes mellitus, abdominale obesitas en insulineresistentie en bij personen die fysiek weinig actief zijn. Dit lipidenpatroon wordt ook gekenmerkt door de aanwezigheid van kleine, relatief zware, atherogene LDL-deeltjes. Een HDL-C-spiegel <1,0 mmol/l bij mannen en <1,2 mmol/l bij vrouwen kan worden gezien als een marker voor verhoogd risico. Recente Mendeliaanse randomisatieonderzoeken hebben echter vraagtekens gezet bij de causale rol van HDL-C bij hart- en vaatziekten (Voight, 2012). Specifieke farmacologische interventies om HDL-C te verhogen leidden bij grote gerandomiseerde onderzoeken niet tot verlaging van het risico op hart- en vaatziekten. Lichaamsbeweging en andere leefstijlfactoren blijven belangrijk als methoden om de HDL-C-spiegels te laten stijgen. Zeer lage HDL-C-plasmaspiegels (<0,60 mmol/l) kunnen, wanneer er geen zeer hoge TG-spiegel is, worden veroorzaakt door een onderliggende stoornis in de metabolisme van HDL-C, zoals mutaties in de apoA-, LCAT- of ABCA1-genen en rechtvaardigt verder onderzoek in gespecialiseerde klinieken. Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn verwezen.
Lipoproteïne(a)
Lipoproteïne(a) (Lp(a)) is een low-density lipoproteïne waar een extra proteïne aan bevestigd is, het zogeheten apolipoproteïne(a). Hoge concentraties Lp(a) worden geassocieerd met een verhoogd risico op ischemische hartklachten, TIA en herseninfarct; Mendeliaanse randomisatieonderzoeken hebben de causale rol van Lp(a) bij hart- en vaatziekten aangetoond. Er is nog geen gerandomiseerd interventieonderzoek dat aantoont dat verlaging van Lp(a) leidt tot een vermindering van het risico op hart- en vaatziekten (Nordestgaard, 2010). Op dit moment is er nog geen rechtvaardigingsgrond om de algemene bevolking te screenen op Lp(a), maar dit kan worden overwogen voor patiënten met een matig verhoogd risico om de risicobeoordeling te verfijnen, bij patiënten met onverklaard prematuur of progressief vaatlijden of bij personen met familiaire voorgeschiedenis van vroegtijdige hart- en vaatziekten. Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de 2e en 3e lijn verwezen.
Apolipoproteïnen
Apolipoproteïnen zijn structuureiwitten op lipoproteïnen. ApoB zit op VLDL- en LDL-partikels en apoA zit op HDL-partikels. Het routinematig meten van apolipoproteïnen (zoals apoA of apoB) wordt niet aanbevolen. In bijzondere situaties kan de hoogte van het apoB in samenhang met plasma lipiden gebruikt worden om een specifieke lipidendiagnose te stellen. Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn verwezen.
Uitsluiting van secundaire oorzaken van dyslipidemie
De aanwezigheid van dyslipidemieën die secundair zijn aan andere aandoeningen moet worden uitgesloten voor begin van de behandeling, want behandeling van de onderliggende aandoeningen leidt tot verbetering van hyperlipidemie zonder dat er lipidenverlagende medicatie nodig is. Dit geldt vooral voor hypothyroïdie en nefrotisch syndroom. Secundaire dyslipidemieën kunnen ook worden veroorzaakt door overmatig alcoholgebruik, diabetes mellitus, syndroom van Cushing, leveraandoeningen en geneesmiddelen (bijvoorbeeld corticosteroïden). Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn verwezen.
Onderbouwing
Achtergrond
Cholesterol is een van de belangrijkste risicofactoren voor het ontwikkelen van hart- en vaatziekten. Verlaging van cholesterol vermindert de kans op hart- en vaatziekten. De streefwaarden voor LDL-C kunnen voor verschillende groepen patiënten verschillen en is mede afhankelijk van de hoogte van het baseline vasculaire risico.
Lipiden, zoals cholesterol en triglyceride, circuleren in het bloedplasma als lipoproteïnen, waarbij de lipiden zijn verbonden aan eiwitten (met name apolipoproteïnen). De belangrijkste drager van cholesterol in plasma (LDL-C) is atherogeen. De rol van triglyceriderijke lipoproteïnen wordt momenteel actief onderzocht: chylomicronen en grote very-low-density lipoproteïnen (VLDL's) lijken niet atherogeen, maar zeer hoge concentraties van deze triglyceriderijke lipoproteïnen kunnen pancreatitis veroorzaken. Restanten van lipoproteïnen (totaalcholesterol − (LDL-C + HDL-C)) zijn in Mendeliaanse randomisatie-onderzoeken onlangs geïdentificeerd als pro-atherogene lipoproteïnen.
Totaal en low-density lipoproteïnecholesterol
De meeste cholesterol wordt normaal gesproken vervoerd in LDL-C. Binnen een brede reeks plasmacholesterolconcentraties is er een krachtige en gegradeerde positieve associatie tussen totaal en LDL-C en het risico op hart- en vaatziekten (Neaton, 1992). Die associatie geldt voor zowel mannen als vrouwen en zowel voor personen met- als zonder hart- en vaatziekten.
Het bewijs dat vermindering van plasma LDL-C het risico op hart- en vaatziekten vermindert is ondubbelzinnig; de resultaten van epidemiologische onderzoeken en onderzoeken naar statines, ezetimib of PCSK9-antilichamen met klinische eindpunten bevestigen dat verlaging van LDL-C een belangrijk doel is bij de preventie van (recidief) hart- en vaatziekten (Reiner, 2011).
Meta-analyses van meerdere onderzoeken naar statines tonen aan dat er een dosis-afhankelijke relatieve vermindering van hart- en vaatziekten bestaat bij verlaging van LDL-C. Elke vermindering van LDL-C met 1,0 mmol/l is geassocieerd met een corresponderende 20 tot 25% reductie in mortaliteit ten gevolge van hart- en vaatziekten en niet-fatale MI (Mihaylova, 2012).
LDL-C kan rechtstreeks worden gemeten, maar in de meeste onderzoeken en in veel laboratoria wordt LDL-C berekend aan de hand van de Friedewald-formule (Friedewald, 1972):
In mmol/l: LDL-C = totaalcholesterol − HDL-C − (0,45 × triglyceriden)
Veel laboratoria hanteren een triglyceridengrens van 4,5 mmol/l tot waar het LDL-C automatisch wordt berekend, maar LDL-C kan met de Friedewald formule betrouwbaar worden uitgerekend tot een triglyceriden concentratievan 8 mmol/l (Demacker, 1996).
Zeer hoge plasmaconcentraties LDL-C (>95ste percentiel in geslacht/leeftijdscategorie) in combinatie met een familiaire voorgeschiedenis van vroegtijdige hart- en vaatziekten en/of verhoogd cholesterol, en/of klinische kenmerken (peesxanthomen of arcus lipoides bij een leeftijd jonger dan 40 jaar) kunnen verder genetische evaluatie naar Familiaire Hypercholesterolemie rechtvaardigen (zie module Diagnostiek van dyslipidemieën uit de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn).
Steeds meer laboratoria berekenen en rapporteren automatisch non-HDL-C (= totaalcholesterol – HDL-C) net zoals LDL-C (berekend met Friedewald-formule). Veel clinici zijn vertrouwd met LDL-C-streefwaarden. Waar in deze module LDL-C-streefwaarden staan, kan ook non-HDL-C worden gelezen. In grote populaties komt gemiddeld een LDL-C 1,8 mmol/l overeen met non-HDL-C 2,6 mmol/l, en LDL-C 2,6 mmol/l komt gemiddeld overeen met non-HDL-C 3,4 mmol/l (zie ook de module ‘Non-HDL-cholesterol’).
Conclusies
Hart- en vaatziekten
|
Redelijk GRADE |
Het risico op hart- en vaatziekten bij een intensieve behandeling met lipidenverlagende medicatie is waarschijnlijk lager dan bij een minder intensieve behandeling bij patiënten met hart- en vaatziekten.
Bronnen (A-Z; IDEAL; PROVE-IT; TNT; IMPROVE-IT; FOURIER; SPIRE-1/2) |
Mortaliteit
|
Laag GRADE |
Het risico om te overlijden ten gevolge van hart- en vaatziekten bij een intensieve behandeling met lipidenverlagende medicatie is mogelijk gelijk aan het risico bij een minder intensieve behandeling bij patiënten met hart- en vaatziekten gedurende de looptijd van de trials (mediane follow-up van 10 maanden tot 6 jaar).
Bronnen (A-Z; IDEAL; TNT; IMPROVE-IT; FOURIER; SPIRE-1/2) |
Bijwerkingen die resulteren in het stoppen van behandeling
|
Laag GRADE |
Het risico op een bijwerking gedurende de looptijd van de trials (mediane follow-up van 10 maanden tot 6 jaar) is mogelijk hoger bij een intensieve behandeling met lipidenverlagende medicatie dan bij een minder intensieve behandeling bij patiënten met hart- en vaatziekten.
Bronnen (A-Z; IDEAL; PROVE-IT; TNT; IMPROVE-IT; FOURIER; SPIRE-1/2) |
Samenvatting literatuur
Beschrijving studies
Chan (2011) ondernam een meta-analyse naar het effect van intensieve lipidenverlaging door statines op hart- en vaatziekten bij patiënten met een verhoogd risico op hart- en vaatziekten. RCT’s met ten minste een jaar follow-up kwamen in aanmerking als het intensief verlagen van lipiden werd onderzocht en de LDL-C-streefwaarde in de buurt van 2,1 mmol/L lag. De auteurs doorzochten de databases Medline en Embase tot april 2009.
Nuβbaumer (2016) ondernam een systematische review naar de effectiviteit en veiligheid van ezetimib toegevoegd aan statine op het voorkomen van hart- en vaatziekten bij patiënten met hyperlipidemie en atherosclerose en/of diabetes mellitus. Medline, EMBASE en de Cochrane Library werden tot juli 2015 doorzocht voor relevante artikelen. In totaal kwamen negen gerandomiseerde gecontroleerde trials in aanmerking. Alle RCT’s vergeleken ezetimib (10 milligram) in combinatie met een statine met alleen een statine.
Schmidt (2017) kwantificeerde de korte en langetermijneffecten van PCSK9-antilichamen op lipidenmarkers en de incidentie van hart- en vaatziekten. De auteurs doorzochten tot mei 2016 CENTRAL, Medline, Embase en Web of Science. Lopende studies werden tijdens de selectie geïdentificeerd, waarvan drie in maart 2017 gepubliceerd waren. Deze studies zijn aan de review toegevoegd. Alleen gerandomiseerde, gecontroleerde trials met een follow-up tijd van ten minste 24 weken kwamen in aanmerking. In totaal werden 20 studies geïncludeerd en beschreven. Van deze 20 studies bleken vijf studies alleen gepubliceerd te zijn als een congresabstract. Deze vijf studies zijn verder buiten beschouwing gelaten.
Personen zonder hart- en vaatziekten ≤70 jaar
Verlaging van LDL-C bij personen zonder hart- en vaatziekten jonger dan 70 jaar is effectief om het risico op hart- en vaatziekten te verlagen. Er zijn geen trials gedaan bij personen zonder hart- en vaatziekten die een intensieve behandeling met lipidenverlagende medicatie vergeleek met een minder intensieve behandeling, met als primaire uitkomst hart- en vaatziekten.
Patiënten met hart- en vaatziekten ≤70 jaar
In totaal evalueerden zeven trials het effect van een intensieve behandeling met lipidenverlagende medicatie met een minder intensieve behandeling bij patiënten met hart- en vaatziekten en als primaire uitkomst hart- en vaatziekten hadden. Het ging om de volgende studies: A tot Z-trial, IDEAL-trial, PROVE-IT-trial, TNT-trial, IMPROVE-IT-trial, FOURIER-trial en SPIRE-1/2-trial. In tabel 1 wordt een overzicht weergegeven van baseline en bereikte LDL-C-waarden.
Tabel 1 Overzicht van de LDL-verandering per trial
|
Trial |
Interventie (I) /controle (C) |
N patienten |
Initieel LDL-C (mmol/l) |
Gemiddelde LDL-C tijdens behandeling (mmol/l) |
|
A-Z |
I: Simvastatine 40 mg, 1m/ 80 mg |
2265 |
2,90 (mediaan) |
1,71 (mediaan) |
|
|
C: placebo, 4m/ simvastatine 20 mg |
2232 |
2,87 (mediaan) |
2,10 (mediaan) |
|
PROVE-IT |
I: Atorvastatine 80 mg |
2099 |
2,74 (mediaan) |
1,60 |
|
|
C: Pravastatine 40 mg |
2063 |
2,74 (mediaan) |
2,46 |
|
IDEAL |
I: Atorvastatine 80 mg |
4439 |
3,14 |
2,07 |
|
|
C: Simvastatine 20 mg |
4449 |
3,14 |
2,58 |
|
TNT |
I: Atorvastatine 80 mg |
4995 |
2,51 |
1,99 |
|
|
C: Atorvastatine 10 mg |
5006 |
2,53 |
2,61 |
|
IMPROVE-IT |
I: Simvastatine 40 mg + ezetimib 10 mg |
9067 |
2,4 |
1,4 |
|
|
C: Simvastatine 40 mg + placebo |
9077 |
2,4 |
1,8 |
|
FOURIER |
I: Evolocumab (background therapy: statin) |
13784 |
2,4 (mediaan) |
0,8 |
|
|
C: Placebo (background therapy: statin) |
13780 |
2,4 (mediaan) |
2,3 |
|
SPIRE-1 |
I: Bococizumab (background therapy: statin) |
8408 |
2,4 |
1,5 |
|
|
C: Placebo (background therapy: statin) |
8409 |
2,4 |
2,4 |
|
SPIRE-2 |
I: Bococizumab (background therapy: statin) |
5312 |
3,5 |
2,3 |
|
|
C: Placebo (background therapy: statin) |
5309 |
3,4 |
3,7 |
Resultaten
1. Hart- en vaatziekten
De resultaten van het risico op hart- en vaatziekten bij een intensieve behandeling versus een minder intensieve behandeling staan in figuur 1 weergegeven. Gepoold is het risico op een event gedurende follow-up 13% lager bij een intensieve behandeling vergeleken met een minder intensieve behandeling (HR 0,87 95%BI: 0,83 tot 0,92). De follow-up duur per trial is gemiddeld genomen 3 jaar. In deze 3 jaar wordt een absolute risicoreductie van 1,4% bereikt. Een lineair verband aannemend is deze risicoreductie over 10 jaar ongeveer 4,2%. De bijbehorende NNT is 24. Dit effect is klinisch relevant volgens de MID van 2% over 10 jaar.
Figuur 1 Meta-analyse van trials met patiënten met hart- en vaatziekten en het risico op hart- en vaatziekten
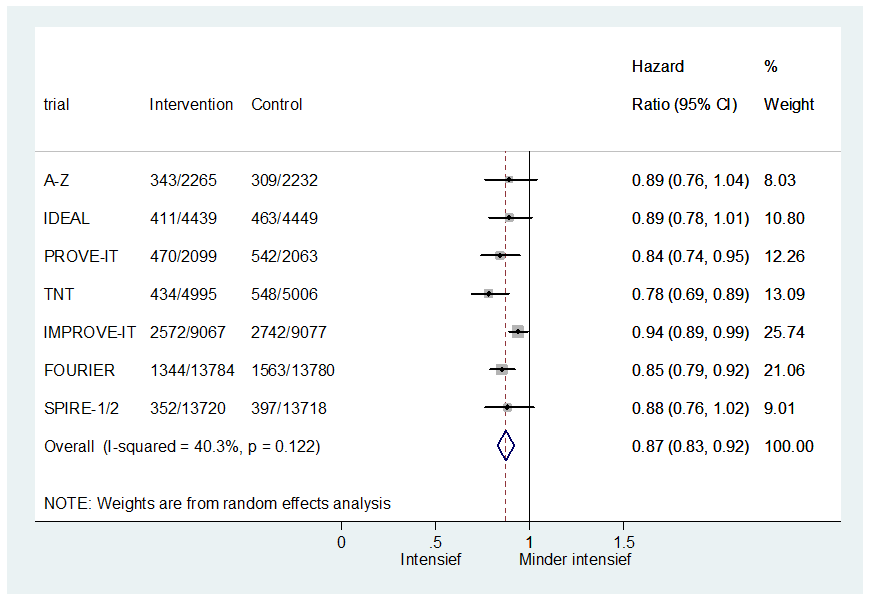
2. Mortaliteit hart- en vaatziekten
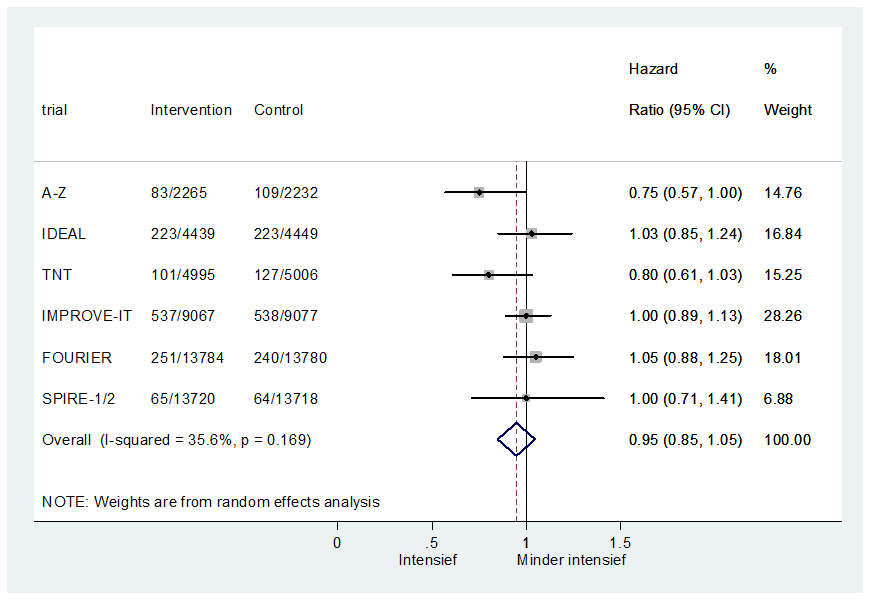
Op een trial na rapporteerden de trials gegevens over mortaliteit van hart- en vaatziekten die een meta-analyse mogelijk maakte. In figuur 2 is te zien dat het risico om te overlijden gedurende follow-up bij een intensieve behandeling gelijk is aan een minder intensieve behandeling (HR 0,95 95%BI: 0,85 tot 1,05).
Figuur 2 Meta-analyse van trials met patiënten met hart- en vaatziekten en het risico om te overlijden aan hart- en vaatziekten
3. Bijwerkingen die resulteren in het stoppen van behandeling
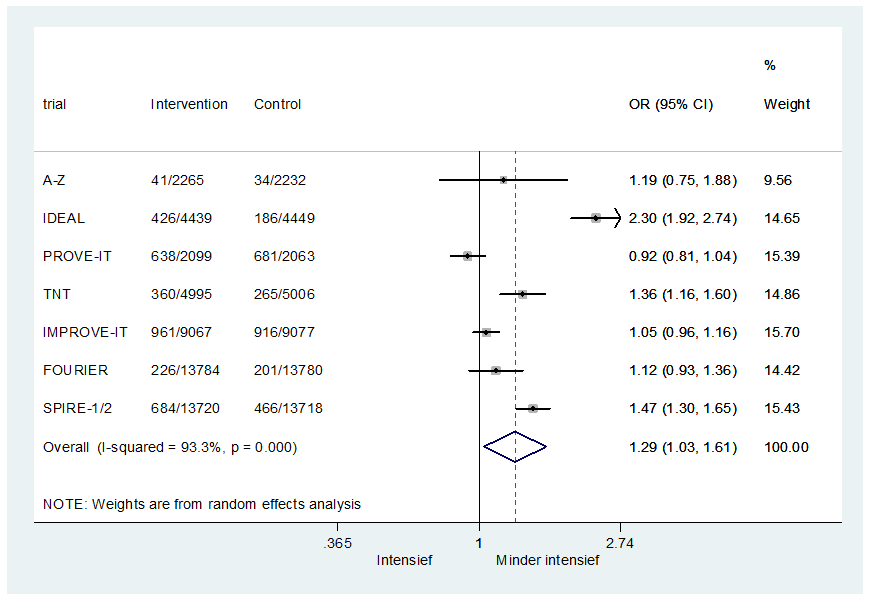
Alle zeven trials hebben gegevens gerapporteerd over bijwerkingen die resulteerden in het stoppen met behandeling. De trial specifieke resultaten als ook het gepoolde resultaat is in figuur 3 weergegeven. De odds ratio voor bijwerkingen resulterend in het stoppen van behandeling was 1,29 (95%BI: 1,03 tot 1,61). Aangezien deze uitkomst niet frequent voorkwam, kan de odds ratio als een risk ratio worden geïnterpreteerd. Met andere woorden, het risico op een bijwerking resulterend in het stoppen van behandeling was 29% hoger bij een intensieve behandeling dan bij een minder intensieve behandeling (OR 1,29 95%BI: 1,03 tot 1,61) waarbij moet worden aangetekend dat het absolute verschil in stoppen met medicatie vanwege bijwerking tussen de intensieve en minder intensieve behandeling betrekkelijk laag was. Tevens moet worden aangetekend dat voor deze analyse trials met intensieve statine behandeling of toevoegen van ezetimib of PCSK9-antilichamen zijn gepoold. Bijwerkingen in de SPIRE1/2 trials hebben ertoe geleid dat bococizumab niet verder wordt ontwikkeld en niet klinisch beschikbaar komt. De gepoolde schatting van bijwerkingen die resulteerden in stoppen van de behandeling zonder het resultaat uit de SPIRE-1/2-trial was OR 1,26 95%BI 0,97 tot 1,63.
Figuur 3 Meta-analyse van trials met patiënten met hart- en vaatziekten en het risico op bijwerkingen die resulteren in het stoppen van behandeling
Bewijskracht van de literatuur
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met een niveau verlaagd vanwege indirectheid (geen trials beschikbaar waar specifieke streefwaarden voor LDL-C met elkaar worden vergeleken).
Mortaliteit: De bewijskracht voor de uitkomstmaat mortaliteit is met twee niveaus verlaagd gezien imprecisie (betrouwbaarheidsinterval overschrijdt de grenzen van klinisch relevant verschil) en indirectheid (geen trials beschikbaar waar specifieke streefwaarden voor LDL-C met elkaar worden vergeleken).
Bijwerkingen die resulteren in het stoppen van behandeling: De bewijskracht voor de uitkomstmaat bijwerkingen is met twee niveaus verlaagd gezien heterogeniteit (I2 hoger dan 90% en verschil in effectschattingen (drie trials suggereren geen verschil in het risico en vier suggereren een verhoogd risico op een bijwerking)) en indirectheid (geen trials beschikbaar waar specifieke streefwaarden voor LDL-C met elkaar worden vergeleken).
Patiënten met diabetes mellitus zonder hart- en vaatziekten
Verlaging van LDL-C bij patiënten met diabetes mellitus is effectief om het risico op hart- en vaatziekten te verlagen (Kearney, 2008). Er zijn geen trials gedaan bij patiënten met diabetes mellitus zonder hart- en vaatziekten waarbij een intensieve behandeling met lipidenverlagende medicatie is vergeleken met een minder intensieve behandeling, met hart- en vaatziekten als primaire uitkomst.
Patiënten met chronische nierschade
Verlaging van LDL-C bij patiënten met chronische nierschade zonder nierfunctievervangende therapie, is waarschijnlijk effectief om het risico op hart- en vaatziekten te verlagen (Baigent, 2010). Er zijn geen trials gedaan bij patiënten met chronische nierschade waarbij een intensieve behandeling met lipidenverlagende medicatie is vergeleken met een minder intensieve behandeling, met als primaire uitkomst hart- en vaatziekten.
Patiënten met of zonder hart- en vaatziekten >70 jaar
De literatuur bij patiënten boven de 70 jaar met en zonder hart- en vaatziekten is apart beschreven in de module Dyslipidemie bij ouderen bij CVRM.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Welke streefwaarde van LDL-C dient te worden gehanteerd bij de behandeling van patiënten met een verhoogd risico op het hart- en vaatziekten?
P: patiënten met een verhoogd risico op hart- en vaatziekten;
I: behandeling onder streefwaarde 1 van LDL-C;
C: behandeling onder streefwaarde 2 van LDL-C;
O: morbiditeit en mortaliteit van hart- en vaatziekten, bijwerkingen.
Relevante uitkomstmaten
De werkgroep achtte het risico op hart- en vaatziekten en bijwerkingen voor de besluitvorming kritieke uitkomstmaten; en mortaliteit van hart- en vaatziekten voor de besluitvorming belangrijke uitkomstmaten.
Morbiditeit en mortaliteit van hart- en vaatziekten: De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Deze definities komen overigens erg vaak overeen.
Klinische relevantie
De werkgroep definieerde een minimale absolute risicoreductie >2% over 10 jaar als een klinisch relevant verschil. De corresponderende NNT is 50. Een hart- en vaatziekte-event wordt voorkomen wanneer 50 personen behandeld worden voor 10 jaar. De absolute risicoreductie moet tegen mogelijke nadelen van dagelijks medicatie gebruik, kans op bijwerkingen en eventueel kosten worden afgewogen. Hierdoor kan een hogere of een lagere absolute risicoreductie relevant zijn.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 26 juni 2017 met relevante zoektermen gezocht naar systematische reviews. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 828 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Systematische review van RCT’s met de vergelijking tussen verschillende streefwaarden voor LDL-C met een gedetailleerde zoekstrategie en evidence-tabellen.
Op basis van titel en abstract werden in eerste instantie 29 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 29 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en geen studies definitief geselecteerd. Er zijn geen gerandomiseerde studies gedaan waar specifieke streefwaarden voor LDL-C met elkaar zijn vergeleken.
Echter, er is wel literatuur beschikbaar over het effect van intensieve lipiden-verlaging (zoals hoge dosis atorvastatine (40 of 80 mg) of rosuvastatine (20 of 40 mg) of combinatie van gemiddelde dosis statine en ezetimib of PCSK9-antilichaam) met minder intensieve lipidenverlagende medicatie op morbiditeit en mortaliteit van hart- en vaatziekten. Ondanks dat dit niet voldoet aan de opgestelde PICO, kunnen de resultaten van deze studies wel een deel van de vraag beantwoorden.
Drie systematische reviews konden een deel van de vraag beantwoorden:
- Chan (2011) beschreef de resultaten van een systematische review naar een intensieve behandeling met een hoge dosis statine vergeleken met een normale dosis statine.
- Nuβbaumer (2016) ondernam een systematische zoekactie naar trials die ezetimib in combinatie met statine vergeleken met alleen statine.
- Schmidt (2017) beschreef een systematische review van studies die een behandeling met PCSK9-antilichamen vergeleken met placebo bovenop reguliere behandeling (statine met of zonder ezetimib).
De resultaten van de geïncludeerde trials zullen per trial beschreven worden. Een additioneel criterium is dat de trials als primaire uitkomst hart- en vaatziekten benoemd moeten hebben.
Voor de uitwerking van de resultaten wordt er geen onderscheid gemaakt in het type lipidenverlagende medicatie; in de samenvatting literatuur zal alleen over lipidenverlagende medicatie worden gesproken. Meta-analyses laten zien dat de risicoreductie op hart- en vaatziekten recht evenredig is met de daling in LDL-C. Hoe deze LDL-C-daling bereikt wordt, blijkt niet veel uit te maken.
De resultaten zijn per subgroep beschreven. Het gaat om de volgende subgroepen:
- personen zonder hart- en vaatziekten ≤70 jaar;
- patiënten met hart- en vaatziekten ≤70 jaar;
- patiënten met diabetes mellitus zonder hart- en vaatziekten;
- personen met chronische nierschade.
De literatuur bij patiënten boven de 70 jaar met en zonder hart- en vaatziekten is apart beschreven in de sub-module Dyslipidemie bij ouderen bij CVRM.
Referenties
- Baigent C, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376:16701681.
- Chan DK, O'Rourke F, Shen Q, et al. Meta-analysis of the cardiovascular benefits of intensive lipid lowering with statins. Acta Neurol Scand. 2011;124(3):188-95. doi: 10.1111/j.1600-0404.2010.01450.x. Epub 2010 Oct 27. PubMed PMID: 20979581.
- Chapman MJ, Ginsberg HN, Amarenco P, et al. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J. 2011;32:13451361.
- Demacker PN, Toenhake-Dijkstra H, de Rijke YB, Stalenhoef AF, Stuyt PM, Willems HL. On the presumed inaccuracy of the Friedewald formula in hypertriglyceridemic plasma: a role for imprecise analysis? Clin Chem. 1996 Sep;42(9):1491-4. PubMed PMID: 8787712.
- Friedewald WT, Levy RI, Fredrickson DS. Estimation of the concentration of low density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem. 1972;18:499502.
- Giugliano RP, Pedersen TR, Park JG, et al. Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial. Lancet. 2017;390(10106):1962-1971. doi: 10.1016/S0140-6736(17)32290-0. Epub 2017 Aug 28. PubMed PMID: 28859947.
- Kearney PM, Blackwell L, Collins R, et al. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet. 2008;371(9607):117-25. doi: 10.1016/S0140-6736(08)60104-X. PubMed PMID: 18191683.
- Mihaylova B, Emberson J, Blackwell L, et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012;380:581590.
- Neaton JD, Blackburn H, Jacobs D, et al. Serum cholesterol level and mortality findings for men screened in the Multiple Risk Factor Intervention Trial. Multiple Risk Factor Intervention Trial Research Group. Arch Intern Med. 1992;152:14901500.
- Nordestgaard BG, Chapman MJ, Ray K, et al. Lipoprotein(a) as a cardiovascular risk factor: current status. Eur Heart J. 2010;31:28442853.
- Nußbaumer B, Glechner A, Kaminski-Hartenthaler A, et al. Ezetimibe-Statin Combination Therapy. Dtsch Arztebl Int. 2016;113(26):445-53. doi: 10.3238/arztebl.2016.0445. PubMed PMID: 27412989; PubMed Central PMCID: PMC4946327.
- Preis SR, Hwang SJ, Coady S, et al. Trends in all-cause and cardiovascular disease mortality among women and men with and without diabetes mellitus in the Framingham Heart Study, 1950 to 2005. Circulation 2009;119:17281735.
- Reiner Z, Catapano AL, De Backer G, et al. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) the European Atherosclerosis Society (EAS). Eur Heart J. 2011;32:17691818.
- Sarwar N, Danesh J, Eiriksdottir G, et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262,525 participants in 29 Western prospective studies. Circulation 2007;115:450458.
- Schmidt AF, Pearce LS, Wilkins JT, et al. PCSK9 monoclonal antibodies for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2017;4:CD011748. doi: 10.1002/14651858.CD011748.pub2. Review. PubMed PMID: 28453187.
- Voight BF, Peloso GM, Orho-Melander M, et al. Plasma HDL cholesterol and risk of myocardial infarction: a mendelian randomisation study. Lancet. 2012;380:572580.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Schmidt, 2017
(individual study characteristics deduced from Schmidt, 2017 )
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to May 2016
D: FOURIER S: SPIRE 1/2
Study design: All were RCTs
Setting: For all: outpatient care
Source of funding: All RCTs were funded by pharmaceutical companies.
|
Inclusion criteria SR:
Exclusion criteria SR:
20 studies included, of which five studies were only published as conference abstracts. These studies were excluded. A further 13 were excluded as the primary endpoint was not cardiovascular disease.
Important patient characteristics at baseline:
N, mean age D: 27564 patients, 63 (SD 9) yrs S: 27438 patients, 63 (SD 9) yrs
Sex: D: 75% Male S: 70% Male
History of CVD: D: 27564 (100%) S: 23198 (85%)
Participants with FH: D: NA S: 1072 (4%) |
D: Evolocumab S: Bococizumab
Background therapy: D: Statin therapy S: Statins and/or ezetimib
|
D: Placeb S: Placebo
|
End-point of follow-up:
D: 157 weeks S: 143 weeks
For how many participants were no complete outcome data available? (intervention/control) D: Unclear S: Unclear
|
Outcome measure-1 Defined as LDL
Results on LDL levels were deduced from the individual trial publications
Outcome measure-2 Defined as CVD
Results on LDL levels were deduced from the individual trial publications
Outcome measure-3 Defined as mortality due to CVD
Results on LDL levels were deduced from the individual trial publications
Outcome measure-4 Defined as adverse events
Results on LDL levels were deduced from the individual trial publications
|
S: Many participants were lost to follow-up due to antidrug antibody response |
|
Nusbaumer, 2016
(individual study characteristics deduced from Nusbaumer, 2016 )
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
See the full article for all relevant information https://www-ncbi-nlm-nih-gov.eur.idm.oclc.org/pubmed/27412989
|
|
|
|
|
|
|
|
Chan, 2011
(individual study characteristics deduced from Chan, 2011)
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to April 2009
A: De Lemos, 2004 B: Cannon, 2004 C: Pedersen, 2005 E: LaRosa, 2005
Study design: RCT (parallel)
Setting and Country: Not reported
Source of funding: Not reported for included studies; unclear what kind of funding the review received. |
Inclusion criteria SR:
7 studies included of which 3 were excluded as the primary endpoint was not cardiovascular disease
Important patient characteristics at baseline:
N, mean age A: 4497 patients, 61 yrs B: 4162, 58 yrs C: 8888, 62 yrs E: 10001, 61 yrs
Sex: Not reported
Criteria: A: Post acute coronary syndrome B: Post acute coronary syndrome C: Previous MI E: Clinically evident CHD, LDL<3.4 |
A: Simvastatin 40 mg, 1m/80 mg B: Atorvastatin 80 mg C: Atorvastatin 80 mg E: Atorvastatin 80 mg
|
A: placebo, 4 m/ simvastatin 20 mg B: Pravastatin 40 mg C: Simvastatin 20 mg E: Atorvastatin 10 mg
|
End-point of follow-up:
A: 0.5 to 2 years, median 2.0 years B: 1.5 to 3 years, mean 2 years C: 4.0 to 5.9 years, median 4.8 years E: Median 4.9 years
For how many participants were no complete outcome data available? (intervention/control) Not reported
|
Outcome measure-1 Defined as LDL-concentration, percent change from baseline (%) (mean LDL level during treatment (mmol/l)
A: I: -41.03 (1.71) C: -27.18 (2.10) B: I: -41.61 (1.60) C: -10.22 (2.46) C: I: -34.08 (2.07) C: -17.83 (2.58) E: I: -20.72 (1.99) C: 3.16 (2.61)
Outcome measure-2 Defined as major coronary events*, odds ratio (95%CI)
A: 0.88 (0.75 to 1.03) B: 0.86 (0.74 to 0.99) C: 0.77 (0.70 to 0.85) E: 0.79 (0.68 to 0.91)
Outcome measure-3 Defined as cardiovascular/coronary heart disease deaths, odds ratio (9%CI)
A: 0.74 (0.55 to 0.99) B: 0.78 (0.45 to 1.35) C: 0.98 (0.80 to 1.22) E: 0.79 (0.61 to 1.03)
Outcome measure-4 Defined as treatment discontinuation due to side effects, odds ratios (95%CI)
A: 1.19 (0.75 to 1.88) B: 0.89 (0.78 to 1.01) C: 2.43 (2.04 to 2.91) E: 1.39 (1.18 to 1.64)
|
* Definition of major cardiovascular events was not only an event of CVD, but also deaths.
Authors’ conclusions: In those at high risk of cardiovascular events, intensive lipid lowering with statins to LDL-C level <2.1 mmol/l significantly reduces risk of stroke, major coronary events and CVD or CHD deaths compared to LDL-C level ≥2.1 mmol/l.
Remarks:
|
Risk of Bias tabel
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Schmidt, 2017 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Nuβbaumer, 2016 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
No |
Yes |
|
Chan, 2011 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, Risk of Bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 06-03-2019
Laatst geautoriseerd : 06-03-2019
Geplande herbeoordeling : 01-01-2021
Uiterlijk in 2020 bepalen het bestuur van het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt van de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie zijn regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Nederlands Huisartsen Genootschape en het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd door het Nederlands Huisartsen Genootschap en de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze multidisciplinaire richtlijn is het optimaliseren van de preventie van hart- en vaatziekten met specifieke focus op individuen met een verhoogd risico op hart- en vaatziekten.
Doelgroep
Deze multidisciplinaire richtlijn is geschreven voor alle zorgverleners die betrokken zijn bij cardiovasculair risicomanagement
Samenstelling werkgroep
In 2016 is een multidisciplinaire werkgroep ingesteld, bestaand uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de preventie van hart- en vaatziekten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. A.W. (Arno) Hoes, klinisch epidemioloog, werkzaam in het Julius Centrum van het UMC Utrecht te Utrecht (voorzitter)
- Dr.ir. I. (Ineke) van Dis, epidemioloog en voedingswetenschapper, werkzaam bij de Hartstichting te Den Haag, Hartstichting
- Y.A. (Yvette) Henstra, verpleegkundig specialist vasculaire geneeskunde, werkzaam in het OVLG te Amsterdam, NVHVV
- Dr. H.M. (Heleen) den Hertog, neuroloog, werkzaam in het Isala Ziekenhuis te Zwolle, NVN
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij Hartenraad te Den Haag, Harteraad
- Dr. A.H. (AnHo) Liem, cardioloog, werkzaam in het Franciscus Gasthuis & Vlietland te Rotterdam, NVVC
- Dr. F.M.A.C. (Fabrice) Martens, cardioloog, werkzaam in het Deventer Ziekenhuis te Deventer, NVVC
- Prof. dr. Y.M. (Yvo) Smulders, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
- Drs. A. (Anne-Margreet) Strijbis, relatiemanager zorg, werkzaam bij Harteraad te Den Haag, Harteraad
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Prof. dr. F.L.J. (Frank) Visseren, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
Met ondersteuning van:
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, NIV
- Dr. Tj. (Tjerk) Wiersma, senior-wetenschappelijk medewerker, NHG
- Dr. W. (Wouter) de Ruijter, wetenschappelijk medewerker, NHG tot augustus 2017
- Drs. M. (Martijn) Sijbom, wetenschappelijk medewerker, NHG vanaf augustus 2017
- Dr. I.M. (Iris) Wichers, wetenschappelijk medewerker, NHG
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van FMS
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van FMS tot april 2018
- Dr. A. (Aleid) Wirix, adviseur, Kennisinstituut van FMS vanaf april 2018
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van FMS tot januari 2018
- J. (Jill) Heij, junior projectsecretaresse, Kennisinstituut van FMS vanaf februari 2018
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hoes (voorzitter) |
|
|
- |
Geen |
|
Konings |
Kaderhuisarts hart- en vaatziekten |
- |
- |
Geen |
|
Tjin-A-Ton |
Kaderhuisarts hart- en vaatziekten |
|
- |
Geen |
|
Visseren |
|
|
Deelname aan fase II en II multicenter trials oer PSCK9-antilichamen. Betrokken bij patiënteninclusie, geen data-analyse |
Geen |
|
Smulders |
|
|
- |
Geen |
|
Liem |
|
|
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Martens |
Cardioloog |
Bestuurslid Werkgroep Cardiologische centra Nederland (WCN) |
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Den Hertog |
Neuroloog |
|
- |
Geen |
|
Henstra |
Verpleegkundig Specialist Vasculaire geneeskunde |
- |
Advies aan industrie lancering nieuwe medicatie bij FH |
Geen; valt buiten het bestek van de richtlijn |
|
Strijbis |
Relatiemanager Hartenraad |
Werkgroeplid Hypertensie in de tweede en derde lijn |
- |
Geen |
|
Van Laarhoven |
|
Werkgroeplid (erfelijke) dyslipidemie in de tweede en derde lijn |
- |
Geen |
|
Van Dis |
|
Lid van de werkgroep Voeding van de European Heart Network |
Hartstichting heeft een samenwerkingscontract met Unilever |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardiging van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Hartenraad en Hartstichting.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. CVRM-indicatoren zijn separaat aan de herziening van deze richtlijn ontwikkeld en te vinden op https://www.nhg.org/themas/publicaties/download-indicatoren-archief.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stapsgewijze beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Voor het herzien van de Nederlandse multidisciplinaire richtlijn CVRM heeft de werkgroep besloten uit te gaan van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016. Deze richtlijn was op het moment van starten de meest recente richtlijn met de meest recente evidence. De werkgroep beoordeelde de aanbevelingen uit de eerder genoemde richtlijn op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens een Invitational conference door Diabetesvereniging Nederland, IGZ, FMCC, Hartenraad (voorheen De Hart&Vaatgroep), KNGF, KNMP, NHG, NVAB, NVALT, NVR, NVVC, Verenso en InEen. De werkgroep stelde vervolgens een lijst met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, en (3) de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse hebben de voorzitter en de ondersteuners concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming over aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep in ieder geval voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar onderzoeken aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar onderzoeken met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. Deze geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënte perspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele onderzoeken
Individuele onderzoeken werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende onderzoeksresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de ‘Risk of Bias’ (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottawa – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal onderzoeken en overeenkomstigheid (homogeniteit) tussen de onderzoeken werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt)relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor Risk of Bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De uiteindelijke bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling worden naast (de kwaliteit van) het wetenschappelijke bewijs ook andere belangrijke aspecten meegewogen, zoals de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat de werkgroep toekent aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken deel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en heeft de werkgroep de richtlijn definitief vastgesteld. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
