Streefwaarde bloeddruk bij (kwetsbare) ouderen
Uitgangsvraag
Welke bloeddrukstreefwaarde dient te worden gehanteerd bij de behandeling van hypertensie bij (kwetsbare) ouderen (>70 jaar)?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de effectiviteit van antihypertensiva bij (kwetsbare) oudere patiënten met hypertensie?
- Wat is de effectiviteit van een intensieve behandeling met antihypertensiva bij (kwetsbare) oudere patiënten?
Aanbeveling
Vitale ouderen
Streef naar de systolische bloeddruk <150 mmHg bij vitale ouderen.
Overweeg bij het verdragen en het niet optreden van bijwerkingen van de medicatie bij vitale ouderen de systolische bloeddruk stapsgewijs nog verder te verlagen onder 140 mmHg. Monitor de bijwerkingen bij iedere controle.
Pas de medicatie aan bij het optreden van bijwerkingen bij vitale ouderen door bijvoorbeeld het verlagen van de dosering, het switchen van medicatie of het stoppen van medicatie.
Kwetsbare ouderen
Streef naar een systolische bloeddruk <150 mmHg bij kwetsbare ouderen onder de voorwaarde van voorzichtig titreren.
Overweeg te stoppen met het verder intensiveren van bloeddrukverlagende behandeling en overweeg het verlagen van de dosering bij kwetsbare ouderen met een diastolische bloeddruk <70 mmHg ongeacht de hoogte van de systolische bloeddruk.
Monitor het optreden van eventuele bijwerkingen bij kwetsbare ouderen.
Overwegingen
Gezien het effect van antihypertensiva op bloeddruk en cardiovasculaire morbiditeit en mortaliteit dienen zowel vitale als kwetsbare ouderen te starten met antihypertensiva; de vraag is welke bloeddrukstreefwaarde gehanteerd dient te worden. In de Europese richtlijn (Visseren, 2021) wordt een systolische bloeddruk < 140 mmHg geadviseerd bij ouderen > 70 jaar en tot 130 mmHg als het goed verdragen wordt. Dit met de kanttekening dat bij ouderen > 80 jaar en de kwetsbaren er minder sterk bewijs is om strikte streefwaarden te handhaven.
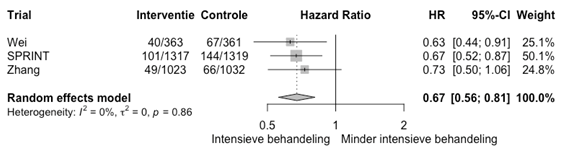
De meta-analyse van intensieve behandeling of strike streefwaarde uit de literatuuranalyse toont een gunstig resultaat op hart- en vaatziekten (zie Figuur 1) met een redelijke GRADE. Ook is het risico op waarschijnlijke dementie mogelijk verlaagd (lage GRADE). Er is geen nieuw bewijs met betrekking tot kwetsbare ouderen.
Een trapsgewijze aanpak van verlaging van de bloeddruk lijkt dus met deze mate van bewijs te verantwoorden, waarbij afhankelijk van kwetsbaarheid, leeftijd en medische voorgeschiedenis en bijwerkingen de streefwaarden kunnen worden bepaald. Het staat de zorgverlener vrij om, in overleg met de patiënt, te bepalen hoeveel lager dan 150 mmHg de systolische bloeddruk idealiter zou moeten worden. Hierbij worden het verwachte behandelvoordeel, het optreden van bijwerkingen, kwetsbaarheid en de wensen van patiënt meegenomen in de beslissing om een lagere streefwaarde aan te houden.
Het is aangetoond dat een lage diastolische bloeddruk geassocieerd is met het risico op cardiovasculaire morbiditeit en mortaliteit bij patiënten met hart- en vaatziekten van 65 jaar en ouder. Echter, er zijn geen studies die deze resultaten hebben aangetoond bij (kwetsbare) ouderen van 70 jaar en ouder. Wel blijkt uit observationele studies bij kwetsbare ouderen dat een lage (diastolische) bloeddruk geassocieerd is met een verhoogd mortaliteitsrisico (van Bemmel, 2006) en aan verminderde functie (Muller, 2013; Muller, 2014; Sabayan, 2012). Verscheidene met name observationele studies hebben laten zien dat een diastolische bloeddruk onder de 60 tot 70 mmHg is geassocieerd met een hoger mortaliteitsrisico (Post-Hospers, 2015) en een hoger risico op cardiale events (McEvoy, 2016; Messerli, 2006). Er zijn aanwijzingen dat dit komt door de hoge polsdruk zelf als risicofactor en niet zozeer door bloeddruk behandeling (Franklin, 2015; Kalkman, 2017).
In deze observationele studies is vaak sprake van confounding by indication, waardoor mogelijk een hoge mortaliteit wordt geregistreerd. In ieder geval zijn gerandomiseerde, gecontroleerde trials nodig om het effect van bloeddrukbehandeling te onderzoeken.
Duur van behandeling en follow-up
Bloeddrukverlagende behandeling moet voor onbepaalde tijd gehandhaafd worden. Bij stopzetting van de behandeling bij hypertensieve patiënten keert de bloeddruk meestal terug naar het niveau van voor de behandeling. Voor sommige patiënten, bij wie de behandeling gepaard gaat met een effectieve bloeddrukverlaging gedurende langere tijd, is het mogelijk het aantal en/of dosering van de geneesmiddelen te verlagen. Hier is vooral sprake van wanneer de bloeddrukverlaging gepaard gaat met een gezondere leefstijl en gewichtsverlies. De medicatie moet geleidelijk worden gereduceerd en de patiënt moet regelmatig worden gecontroleerd omdat de kans bestaat dat de hypertensie terugkeert.
Follow-up van patiënten wordt uitgevoerd door een team van zorgverleners. Bij een stabiele instelling (streefwaarden zijn bereikt en geen of acceptabele bijwerkingen) zijn laag frequente controles voldoende. Bij niet goed ingestelde patiënten is een hogere frequentie nodig. Het zelf meten van de bloeddruk is effectief in het verbeteren van de bloeddrukcontrole en leidt tot minder medicatiegebruik en spreekuurbezoeken (Verberk, 2007). De meerwaarde van thuismetingen geldt vooral voor diegenen met een belangrijk wittejaseffect en voor patiënten met zogeheten gemaskeerde hypertensie. Thuismeten betrekt patiënten meer bij hun behandeling en kan met behulp van telemonitoring ook op afstand plaatsvinden. Telemonitoring bij patiënten met hypertensie zorgt voor een –2,5 tot –3,5 mmHg sterkere bloeddrukdaling dan bij controlemetingen in de praktijk (Castelijn, 2022). De optimale frequentie voor het thuismonitoren van de bloeddruk is niet bekend. Zowel protocollen waarbij een maal per week op gestandaardiseerde momenten de bloeddruk wordt gemeten als protocollen waarbij voorafgaand aan het spreekuurbezoek een serie gestandaardiseerde metingen wordt verricht, zijn in omloop. Voor die patiënten waarbij thuismetingen moeilijk zijn, kan een 30 minuten meting in de praktijk een alternatief zijn bij de bloeddrukcontrole als er twijfel is over wittejashypertensie (Van der Wel, 2011).
Definitie vitale ouderen
Ofschoon genoemde studies vitale ouderen en kwetsbare ouderen hebben geïncludeerd staat in deze module niet de definitie van wat een vitale/ kwetsbare oudere is. Hier zijn richtlijnen voor gemaakt door de NVKG, waar wij naar verwijzen (richtlijn Comprehensive Geriatric Assessment (CGA).
Samen beslissen
De inhoudelijke basis, nodig voor het samen beslissen om al dan niet met een bloeddrukverlager te starten, kan verder besproken worden op basis van een risicoscore tabel zoals die besproken wordt in module ‘Schatten van het risico op hart- en vaatziekten
Onderbouwing
Achtergrond
Op basis van de literatuur blijkt behandeling van hypertensie effectief te beschermen tegen hart- en vaatziekten bij 70-plussers. Er is echter discussie over de streefwaarden van bloeddruk bij ouderen. De oude richtlijn beveelt aan om bij niet-kwetsbare ouderen te streven naar een systolisch bloeddruk < 150 mmHg en indien goed verdragen, < 140 mmHg. De Europese richtlijn (Visseren, 2021) beveelt aan om bij ouderen te streven naar een bloeddruk van systolisch bloeddruk < 140 mmHg en indien goed verdragen, tot < 130 mmHg.
Conclusies / Summary of Findings
1 Vergelijking: antihypertensiva versus placebo
Hart- en vaatziekten
|
Redelijk GRADE |
Oudere patiënten die antihypertensiva gebruiken hebben waarschijnlijk een lager risico op hart- en vaatziekten vergeleken met placebo.
Bronnen (Beckett, 2008; Staessen, 1998) |
Kwaliteit van leven
|
- GRADE |
Vanwege het ontbreken van data is het niet mogelijk een conclusie te formuleren over het effect van een intensieve behandeling met een strikte bloeddruk op kwaliteit van leven vergeleken met een standaardbehandeling en matige bloeddrukcontrole. |
Cognitief functioneren
|
Laag GRADE |
Risico op het optreden van dementie is mogelijk lager bij gebruik van antihypertensiva door patiënten met hypertensie van 80 jaar of ouder in vergelijking met placebo.
Bronnen (Peters, 2008; Forette, 1998) |
Bijwerkingen
|
Laag GRADE |
Het risico op een ernstig ongewenst voorval bij gebruik van antihypertensiva is mogelijk lager vergeleken met het gebruik van een placebo.
Bronnen (Beckett, 2008) |
Mortaliteit
|
Redelijk GRADE |
Het risico op overlijden binnen 6,5 jaar is waarschijnlijk lager bij gebruik van antihypertensiva vergeleken met placebo bij oudere patiënten met hypertensie.
Bronnen (Beckett, 2008; Staessen, 1998) |
|
Redelijk GRADE |
Ten gevolge van hart- en vaatziekten Het risico op overlijden binnen 6,5 jaar ten gevolge van hart- en vaatziekten is waarschijnlijk lager bij gebruik van antihypertensiva vergeleken met placebo bij oudere patiënten met hypertensie.
Bronnen (Beckett, 2008; Staessen, 1998) |
Bloeddruk
|
Redelijk GRADE |
Oudere patiënten die antihypertensiva krijgen, hebben waarschijnlijk ten minste een 12 mmHg lagere systolische bloeddruk en een 5 mmHg lagere diastolische bloeddruk vergeleken met patiënten die een placebo krijgen.
Bronnen (Beckett, 2008; Staessen, 1998) |
2 Vergelijking: Intensieve behandeling versus standaardbehandeling
Hart- en vaatziekten
|
Redelijk GRADE |
Het risico op hart- en vaatziekten is waarschijnlijk lager bij een intensieve behandeling met strikte bloeddrukcontrole vergeleken met een standaardbehandeling en een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar.
Bronnen (Wei, 2013; SPRINT, 2015; Zhang, 2021) |
Kwaliteit van leven
|
- GRADE |
Vanwege het ontbreken van data is het niet mogelijk een conclusie te formuleren over het effect van een intensieve behandeling met een strikte bloeddruk op kwaliteit van leven vergeleken met een standaardbehandeling en matige bloeddrukcontrole. |
Functioneren
|
Laag GRADE |
Het risico op waarschijnlijke dementie is mogelijk verlaagd bij een intensieve behandeling met strikte bloeddrukcontrole vergeleken met een standaardbehandeling en een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar.
Bronnen (SPRINT, 2015) |
Bijwerkingen
|
Redelijk GRADE |
Het voorkomen van ernstige ongewenste voorvallen is waarschijnlijk niet verschillend tussen een intensieve behandeling met een strikte bloeddrukcontrole en een standaardbehandeling met een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar met hypertensie.
Bronnen (Ogihara, 2010; SPRINT, 2015) |
Mortaliteit
|
Redelijk GRADE |
Het risico op overlijden binnen drie jaar is waarschijnlijk lager bij een intensieve behandeling met een strikte bloeddrukcontrole vergeleken met een standaardbehandeling en een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar met hypertensie.
Bronnen (Wei, 2013; Ogihara, 2010; SPRINT, 2015) |
|
Zeer laag GRADE |
Ten gevolge van hart- en vaatziekten Het is onduidelijk of het risico op overlijden binnen drie jaar ten gevolge van hart- en vaatziekten verschillend is tussen een intensieve behandeling met een strikte bloeddrukcontrole en een standaardbehandeling met een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar met hypertensie.
Bronnen (Wei, 2013; Ogihara, 2010) |
Bloeddruk
|
Redelijk GRADE |
Een intensieve behandeling met een strikte bloeddrukcontrole resulteert waarschijnlijk in een lagere systolische bloeddruk vergeleken met standaardbehandeling en een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar.
Bronnen (Wei, 2013; Ogihara, 2010) |
Samenvatting literatuur
Beschrijving studies
1 Vergelijking: antihypertensiva versus placebo
Ouderen met of zonder hart- en vaatziekten
Beckett (2008) ondernam een gerandomiseerd, gecontroleerde trial naar de effectiviteit en veiligheid van antihypertensiva bij patiënten van 80 jaar of ouder. Patiënten met hypertensie, gedefinieerd als een aanhoudende systolische bloeddruk boven 160 mmHg, kwamen in aanmerking. Voor de start van de trial werden alle patiënten gevraagd om te stoppen met antihypertensiva en een placebo tablet te gaan slikken voor ten minste twee maanden. Na randomisatie ontvingen 1933 patiënten 1,5 milligram indapamide en 1912 patiënten een vergelijkbare placebo. Patiënten werden in het eerste jaar minstens driemaandelijks gezien en daarna elk half jaar. Tijdens elk bezoek kon perindopril (2 of 4 mg) worden toegevoegd om de bloeddrukstreefwaarde (onder 150/80 mmHg) te halen. Bloeddruk werd jaarlijks gemeten. De mediaan follow-up was 1,8 jaar (bereik: 0 tot 6,5). De trial was vroegtijdig gestopt vanwege ethische redenen (een onverwachte reductie op het risico om te overlijden bij gebruik van antihypertensiva). Data over cognitief functioneren waren beschikbaar in een publicatie van Peters (2008).
Staessen (1998) onderzocht de voordelen van antihypertensiva onder oudere patiënten met hypertensie. Patiënten kwamen in aanmerking bij een leeftijd van ten minste 60 jaar en de systolische bloeddruk tussen 160 en 219 mmHg tijdens het nemen van een placebo voor deelname aan de trial. In totaal werden 4695 patiënten gerandomiseerd met gemiddelde leeftijd van 70 jaar; 2398 ontvingen nitrendipine (10 tot 40 mg/d) en 2297 een vergelijkbare placebo. Indien nodig werd nitrendipine gecombineerd met of vervangen door enalapril (5 tot 20 milligram/dag) of hydrochlorothiazide (12,5 tot 25 mg/d) of beide. De bloeddrukstreefwaarde was 150 mmHg. Patiënten werden per drie maanden gezien. De mediane follow-up was 2,0 jaar (bereik van 1 maand tot 97 maanden). De trial was vroegtijdig gestopt vanwege reductie op het risico op een beroerte bij gebruik van antihypertensiva. Data over cognitief functioneren waren beschikbaar in een publicatie van Forette (1998).
Resultaten
1. Hart- en vaatziekten
Beckett (2008) observeerde dat het risico op hart- en vaatziekten gedurende follow-up bij gebruik van antihypertensiva verlaagd was vergeleken met placebo (HR 0,66 95%BI: 0,53 tot 0,82). 138 patiënten onder actieve behandeling kregen hart- en vaatziekten vergeleken met 193 patiënten onder de controle behandeling.
Staessen (1998) rapporteerde dat 137 patiënten bij gebruik van antihypertensiva hart- en vaatziekten kregen (rate 23,3 per 1000 patiëntjaren) vergeleken met 186 patiënten die een placebo kregen (rate 33,9 per 1000 patiëntjaren). Het risico om tijdens follow-up hart- en vaatziekten te kregen was 31% lager bij gebruik van antihypertensiva (HR 0,69 95%BI: 0,55 tot 0,86).
Het gepoolde risico op hart- en vaatziekten tijdens follow-up was 33% lager in het voordeel van antihypertensiva (HR 0,67 95%BI: 0,58 tot 0,79).
2. Kwaliteit van leven
Beckett (2008) en Staessen (1998) rapporteerden geen data over kwaliteit van leven.
3. Functioneren
De HYVET-trial (Peters, 2008) observeerde een verbetering in MMSE met 0,7 punten (SD 4,0) ten opzichte van baseline bij gebruik van antihypertensiva vergeleken met een afname met 1,1 punten (SD 3,9) bij een placebo (p=0,08). Het risico op dementie was potentieel 14% verlaagd bij gebruik van antihypertensiva (HR 0,86 95%BI: 0,67 tot 1,09).
Forette (1998) rapporteerde in totaal 32 personen die gedurende de studie dementie ontwikkelden, waarvan 21 in de placebogroep en 11 in de antihypertensivagroep. Gedurende vijf jaar was de frequentie om dementie te ontwikkelen 50% lager bij gebruik van antihypertensiva vergeleken met placebo (RR 0,50 95%BI: 0,22 tot 1,08). De resultaten van het risico op dementie was gepoold. Het risico op dementie is potentieel 18% verlaagd (RR 0,82 95%BI: 0,65 tot 1,04).
De resultaten van het risico op dementie zijn gepoold. Het risico om dementie te ontwikkelen gedurende studie was potentieel 18% verlaagd bij gebruik van antihypertensiva vergeleken met placebo (RR 0,82 95%BI: 0,65 tot 1,04).
Tabel 2.30 Overzicht met resultaten
|
Auteur (jaar) |
Dementie (95%BI) |
|
Peters (2008) |
HR 0,86 (0,67 tot 1,09) |
|
Forette (1998) |
RR 0,50 (0,22 tot 1,08) |
|
Gepoold |
RR 0,82 (0,65 tot 1,04) |
4. Bijwerkingen
Beckett (2008) observeerde dat 358 (19%) patiënten een ernstig ongewenst voorval kregen tijdens het gebruik van antihypertensiva vergeleken met 448 (23%) patiënten tijdens het gebruik van een placebo. Het absolute verschil was 5% met een 95% BI lopend van 2% tot 8%. Het is echter onbekend om welke ernstige ongewenste voorvallen het gaat.
Staessen (1998) rapporteerde geen gegevens over mogelijke bijwerkingen of ongewenste voorvallen bij gebruik van antihypertensiva.
5. Mortaliteit
In de trial van Beckett (2008) kwamen 196 patiënten onder actieve behandeling te overlijden (rate 24 per 1000 patiëntjaren) vergeleken met 235 patiënten die een placebo kregen (rate 60 per 1000 patiëntjaren). Het risico om te overlijden gedurende follow-up was 21% lager bij gebruik van antihypertensiva vergeleken met placebo (HR 0,79 95%BI: 0,65 tot 0,95). Ook het risico om te overlijden ten gevolge van hart- en vaatziekten was verlaagd (HR 0,77 95%BI: 0,60 tot 1,01).
Staessen (1998) observeerde dat 123 patiënten (rate van 20,5 per 1000 patiëntjaren) bij gebruik van antihypertensiva tijdens follow-up kwamen te overlijden vergeleken met 137 patiënten (rate 24,0 per 1000 patiëntjaren). Het risico om te overlijden tijdens follow-up was mogelijk 14% lager bij gebruik van antihypertensiva vergeleken met placebo (HR 0,86 95%BI: 0,67 tot 1,10). Het risico om te overlijden aan hart- en vaatziekten tijdens follow-up is potentieel 27% verlaagd (HR 0,73 95%BI: 0,52 tot 1,03). In totaal overleden 59 patiënten (rate 9,8 per 1000 patiëntjaren) die antihypertensiva gebruikten en 77 patiënten (rate 13,5 per 1000 patiëntjaren) die placebo kregen.
De gepoolde hazard ratio voor mortaliteit was 0,82 (95%BI: 0,70 tot 0,95). Het risico om te overlijden tijdens follow-up is 18% lager bij gebruik van antihypertensiva. Het gepoolde effect voor mortaliteit ten gevolge van hart- en vaatziekten was 0,76 (95%BI: 0,61 tot 0,93) en daarom 24% lager in het voordeel van antihypertensiva.
Tabel 2.31 Overzicht met resultaten
|
Auteur (jaar) |
All-cause mortaliteit (95%BI) |
Mortaliteit hart- en vaatziekten (95%BI) |
|
Beckett (2008) |
HR 0,79 (0,65 tot 0,95) |
HR 0,77 (0,60 tot 1,01) |
|
Staessen (1998) |
HR 0,86 (0,67 tot 1,10) |
HR 0,73 (0,52 tot 1,03) |
|
Gepoold |
HR 0,82 (0,70 tot 0,95) |
HR 0,76 (0,61 tot 0,93) |
6. Bloeddruk
In de trial van Beckett (2008) was na twee jaar onder actieve behandeling de systolische bloeddruk gemiddeld gedaald met 29,5 mmHg (SD 15,4) ten opzichte van baseline (diastolische bloeddruk met 12,9 mmHg (SD 9,5)). Patiënten onder placebo behandeling zagen een daling in systolische bloeddruk van 14,5 mmHg (SD 18,5) (diastolische bloeddruk met 6,8 mmHg (SD 10,5)).
Staessen (1998) rapporteerde het effect op systolische en diastolische bloeddruk na de mediaan follow-up (twee jaar). Onder actieve behandeling nam de systolische bloeddruk met gemiddeld 23 mmHg af (SD 16) en de diastolische bloeddruk met 7 mmHg (SD 8) en onder placebo met respectievelijk 13 mmHg (SD 17) en 2 mmHg (SD 8). De systolische bloeddruk nam gemiddeld af met 10,1 mmHg (95%BI: 8,8 tot 11,4) in het voordeel van actieve behandeling en de diastolische bloeddruk met 4,5 mmHg (95%BI: 3,9 tot 5,1).
Tabel 2.32 Overzicht van resultaten
|
Bloeddruk (mmHg) |
Antihypertensiva |
Placebo |
Gemiddeld verschil (95%BI) |
|
Systolische |
|
|
|
|
Beckett (2008) |
-29,5 (SD 15,4) |
-14,5 (SD 18,5) |
-15,0 (-16,1 tot -13,9) |
|
Staessen (1998) |
-23 (SD 16) |
-13 (SD 17) |
-10,1 (-11,4 tot -8,8) |
|
Gepoold |
|
|
-13,0 (-13,8 tot -12,2) |
|
Diastolische |
|
|
|
|
Beckett (2008) |
-12,9 (SD 9,5) |
-6,8 (SD 10,5) |
-6.1 (-6.7 tot -5.5) |
|
Staessen (1998) |
-7 (SD 8) |
-2 (SD 8) |
-4,5 (-5,1 tot -3,9) |
|
Gepoold |
|
|
-5,3 (-5,7 tot -4,9) |
Gebruik van antihypertensiva resulteert na twee jaar in een afname in systolische bloeddruk van 13,0 mmHg (95%BI: 12,2 tot 13,8) en een afname in diastolische bloeddruk van 5,3 (95%BI: 4,9 tot 5,7).
Kwetsbare patiënten
Warwick (2015) heeft de studiepopulatie van de HYVET-trial gestratificeerd op basis van de Frailty Index. De Frailty Index was berekend aan het begin van de trial en op basis van aan- of afwezigheid van 60 condities. Het aantal aanwezige stoornissen werd gedeeld door 60 om de score van Frailty Index te geven. De resultaten voor de uitkomst mortaliteit en hart- en vaatziekten werd gestratificeerd per 0,1 interval van de Frailty Index Score. Het risico om te overlijden of het krijgen van hart- en vaatziekten tijdens follow-up nam af met elke toename in kwetsbaarheid. Echter, het aantal deelnemers met een hoge score en daarmee kwetsbaar is relatief klein met als gevolg brede betrouwbaarheidsintervallen. Daarnaast is de vraag of deze groep van kwetsbare patiënten een weerspiegeling is van de kwetsbare oudere patiënt uit de algemene populatie.
Bewijskracht van de literatuur
Vergelijking: antihypertensiva versus placebo
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; 1 trial met bijna 50% lost to follow-up).
Kwaliteit van leven: Vanwege het ontbreken van gegevens is het niet mogelijk om de bewijskracht te graderen voor de uitkomstmaat kwaliteit van leven.
Functioneren: De bewijskracht voor de uitkomstmaat cognitie is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; bijna 50% lost to follow-up).
Bijwerkingen: De bewijskracht voor de uitkomstmaat bijwerkingen is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; bijna 50% lost to follow-up).
Mortaliteit: De bewijskracht voor de uitkomstmaat all-cause mortaliteit en mortaliteit ten gevolge van hart- en vaatziekten is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; 1 trial met bijna 50% lost to follow-up).
Bloeddruk: De bewijskracht voor de uitkomstmaat bloeddruk is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; 1 trial met bijna 50% lost to follow-up).
2 Vergelijking: Intensieve behandeling versus standaardbehandeling
Ouderen zonder hart- en vaatziekten
Wei (2013) onderzocht of een intensieve bloeddrukbehandeling met een streefwaarde van minder dan 140 over 90 mmHg vergeleken met een behandeling en een streefwaarde van minder dan 150 over 90 mmHg cardiovasculaire uitkomsten in Chinese hypertensieve patiënten ouder dan 70 jaar kon verbeteren. Patiënten ouder dan 70 jaar kwamen in aanmerking voor deelname als de systolische bloeddruk gelijk of hoger dan 150 mmHg was en de diastolische bloeddruk gelijk of hoger dan 90 mmHg was (tweemaal gemeten op verschillende dagen) of patiënten waren al gediagnosticeerd met hypertensie en gebruikte reeds antihypertensiva. In totaal deden 724 patiënten mee waarvan 363 werden gerandomiseerd naar de intensieve behandeling en 361 naar de standaardbehandeling. Gerandomiseerde patiënten startte met één geneesmiddel (ACE-remmer: enalapril 10 milligram/ dag, β-blokker: bisoprolol 2,5 tot 5 milligram of metoprolol 50 tot 100 mg/ dag, calcium kanaal blokker: amlodipine 5 tot 10 milligram/ dag of diurecticum: indapamide 1,5 tot 2,5 mg/ dag). Om de bloeddrukstreefwaarde te halen werd stapsgewijs één, twee of drie antihypertensiva toegevoegd. Mocht de bloeddrukstreefwaarde niet worden gehaald bij vier middelen, werd het verhogen van de dosering geadviseerd. Na het starten van de studie werd bloeddruk na de vierde week, na de derde maand en na de zesde maand gemeten. Vervolgens werd elke zes maanden de bloeddruk gemeten. Patiënten waren gemiddeld voor vier jaar gevolgd.
Ouderen met of zonder hart- en vaatziekten
Ogihara (2010) bepaalde of een strikte bloeddrukcontrole (lager dan 140 mmHg) beter was dan matige bloeddrukcontrole (bloeddruk tussen 140 en 150 mmHg) in het verlagen van cardiovasculaire mortaliteit en morbiditeit bij ouderen patiënten met geïsoleerd systolische hypertensie. Patiënten van 70 tot 85 jaar met geïsoleerd systolische hypertensie (SBP >160 mmHg en DBP <90 mmHg) werden gerekruteerd. In totaal waren 1627 patiënten gerandomiseerd naar de strikte bloeddrukcontrole en 1633 naar matige bloeddrukcontrole. In beide groepen had 13% van de patiënten eerder hart- en vaatziekten gehad. Patiënten begonnen met een angiotensinereceptorblokkers eenmaal daags. Bij het niet behalen van de streefwaarde bloeddruk in een à twee maanden, kon de dosering worden verhoogd of ander typen antihypertensiva worden bijgegeven. Bloeddruk werd minimaal elke drie maanden gemeten gedurende twee jaar. Uiteindelijk waren patiënten gemiddeld voor 2,85 jaar gevolgd.
SPRINT (2015) onderzocht de hypothese dat een lagere systolische bloeddrukstreefwaarde van <120 mmHg het risico op klinisch events verlaagt vergeleken met een streefwaarde van <140 mmHg. Patiënten ten minste 50 jaar met een systolische bloeddruk tussen 130 en 180 mmHg en een verhoogd risico op hart- en vaatziekten werden geïncludeerd. In totaal kregen 1317 deelnemers een intensieve behandeling met een streefwaarde van lager dan 120 mmHg en 1319 deelnemers een standaardbehandeling met een streefwaarde van 140 mmHg. Alle deelnemers werden maandelijks gezien gedurende de eerste drie maanden en daarna elke drie maanden. De medicatie van patiënten onder intensieve behandeling werd maandelijks bijgesteld om een streefwaarde van 120 mmHg te halen. Bij deelnemers onder een standaardbehandeling werd de medicatie bijgesteld om een streefwaarde van 135 tot 139 mmHg te halen. Bij een bloeddruk onder 130 mmHg tijdens een follow-up moment of onder 135 mmHg tijdens twee momenten werd de dosering verlaagd. Bloeddruk werd bepaald op basis van drie metingen terwijl de deelnemer zat en na vijf minuten rust. De mediaan follow-up was 3,26 jaar. De trial was vroegtijdig gestopt nadat de resultaten voor de primaire uitkomst op twee tijdpunten de monitoring grens overschreven.
Gezien de gemiddelde leeftijd van de deelnemers ongeveer 67 jaar bedroeg, werd voor het uitwerken van deze vraag alleen een subgroep analyse van 75 jaar en ouder beschreven.
Zhang (2021) onderzocht de bloeddrukstreefwaarde ter verlaging van het risico op hart- en vaatziekten bij patiënten met hypertensie. Patiënten in de leeftijd van 60 tot 80 jaar met een bloeddruk boven 140 mmHg kwamen in aanmerking. In totaal werden 4243 toegewezen naar een target tussen 110 en 130 mmHg en 4268 naar een target van 130 tot 150 mmHg. De primaire uitkomstmaat was een samenstelling van beroerte, acuut coronair syndroom (acuut myocardinfarct en ziekenhuisopname wegens onstabiele angina pectoris), acuut gedecompenseerd hartfalen, coronaire revascularisatie, atriumfibrilleren, of overlijden door cardiovasculaire oorzaken. De gemiddelde leeftijd was 66 jaar en 47% was man. De mediane follow-uptijd was 3,34 jaar. Gedurende deze periode werd in de target van 110-130 een gemiddelde bloeddruk van 126,7 mmHg behaald en bij een target van 130-150 een gemiddelde bloeddruk van 135,9 mmHg.
Gezien de gemiddelde leeftijd van de deelnemers 66 jaar bedroeg, werd voor het uitwerken van deze vraag alleen een subgroepanalyse van 70 jaar tot 80 jaar beschreven. In deze leeftijdsgroep kregen 1023 (24%) patiënten een target tussen 110 en 130 mmHg toegewezen en 1032 (24%) een target van 130-150 mmHg.
Resultaten
1. Hart- en vaatziekten
In de trial van Wei (2013) kregen in totaal 107 patiënten hart- en vaatziekten gedurende vier jaar, waarvan 40 (11%) patiënten onder een intensieve behandeling. Het risico op hart- en vaatziekte was 37% lager bij een bloeddrukstreefwaarde van lager dan 140 over 90 mmHg vergeleken met een streefwaarde van 150 over 90 mmHg (RR 0,63 95%BI: 0,44 tot 0,92).
Ogihara (2010) rapporteerde geen gegevens over het aantal hart- en vaatziekten.
SPRINT (2015) observeerden dat gedurende 3,26 jaar 101 (8%) deelnemers onder intensieve behandeling hart- en vaatziekten kregen vergeleken met 144 (11%) deelnemers onder standaardbehandeling. Daarmee was het risico op hart- en vaatziekten 33% verlaagd bij een bloeddrukstreefwaarde van <120 mmHg vergeleken met een streefwaarde van <140 mmHg (HR 0,67 95%BI: 0,51 tot 0,86).
Zhang (2021) rapporteerde dat 49 (4,7%) onder een bloeddrukstreefwaarde 110 mmHg tot 130 mmHg hart- en vaatziekten kregen, vergeleken met 66 (6,4%) bij een bloeddrukstreefwaarde van 130 tot 150 mmHg (HR 0,73 95%BI 0,50 tot 1,05).
Het onderstaande figuur 1 laat de meta-analyse van de resultaten zien. Het gepoolde effect op hart- en vaatziekten is een relatief risico van 0,67 (95%BI 0,56 tot 0,81).
Figuur 1. Meta-analyse van intensieve behandeling versus minder intensief met corresponderende streefwaarde voor bloeddruk en het risico op hart- en vaatziekten.
2. Kwaliteit van leven
Wei (2013), Ogihara (2010) en SPRINT (2015) rapporteerden geen data over kwaliteit van leven.
3. Functioneren
Wei (2013) en Ogihara (2010) rapporteerden geen data over functioneren.
SPRINT (2015) rapporteerde gegevens over waarschijnlijke dementie in de subgroepanalyse (≥ 75 jaar). Waarschijnlijke dementie werd aan de hand een stappenplan bepaald. In dit stappenplan werd gebruik gemaakt van testen voor het bepalen van de globale cognitieve functie (Montreal Cognitive Assessment [MoCA]; range, 0-30), leren en geheugen (Logical Memory forms I and II subtests of the Wechsler Memory Scale; ranges, 0-28 and 0-14), en verwerkingssnelheid (Digit Symbol Coding Test of the Wechsler Adult Intelligence Scale; range, 0-135).
In totaal werd bij 95 deelnemers onder intensieve behandeling waarschijnlijke dementie vastgesteld (17,8 gevallen per 100 persoonsjaren). Onder de minder intensieve behandeling werd bij 116 deelnemers waarschijnlijke dementie vastgesteld. Het risico op waarschijnlijke dementie was potentieel daarmee 12% verlaagd bij een intensieve behandeling vergeleken met een minder intensieve behandeling (HR 0,88 9% BI 0,66 tot 1,16).
4. Bijwerkingen
Wei (2013) rapporteerde geen data over bijwerkingen of ongewenste voorvallen.
Ogihara (2010) rapporteerde dat de frequentie van ernstige ongewenste voorvallen hetzelfde was in beide groepen (6% bij strikte bloeddrukcontrole en 5% bij matige bloeddrukcontrole). De meeste voorvallen waren gastro-intestinale symptomen of luchtweg gerelateerd en niet per se gerelateerd aan het gebruik van antihypertensiva.
SPRINT (2015) heeft het aantal ernstige ongewenste voorvallen voor de subgroep van 75 jaar en ouder beoordeeld. In totaal hadden 640 (49%) deelnemers onder intensieve behandeling een ernstig ongewenst voorval vergeleken met 638 (48%) deelnemers onder standaardbehandeling. Het risico op een ernstig ongewenst voorval was dus niet verschillend (HR=1,00; p=0,93). Dit hoefde niet per se voorvallen te zijn gerelateerd aan de interventie. In beide groepen was een val met een nadelige gevolgen een van de meest voorkomende ongewenste voorvallen (5% versus 6%).
5. Mortaliteit
Wei (2013) observeerde dat 51 (14%) patiënten onder intensieve behandeling kwamen te overlijden vergeleken met 87 (24%) patiënten onder standaardbehandeling. Het risico om te zijn overleden aan het eind van de trial was 37% lager bij een intensieve behandeling dan bij een standaardbehandeling (RR 0,63 95%BI: 0,46 tot 0,87). 25 (7%) patiënten onder intensieve behandeling overleden ten gevolge van hart- en vaatziekten vergeleken met 50 (14%) patiënten onder standaardbehandeling. Ook het risico om te overlijden ten gevolge van hart- en vaatziekten was daarmee lager bij een intensieve behandeling vergeleken met een standaardbehandeling (RR 0,53 95%BI: 0,33 tot 0,84).
In de trial van Ogihara (2010) kwamen 24 (2%) patiënten uit de strikte bloeddrukcontrole groep te overlijden vergeleken met 30 (2%) patiënten uit de matige bloeddrukcontrole groep. Het risico om te overlijden gedurende follow-up was mogelijk 22% lager bij een strikte bloeddrukcontrole vergeleken met een matige bloeddrukcontrole (HR 0,78 95%BI: 0,46 tot 1,33). Het risico was voor leeftijd, geslacht, BMI, roken, dyslipidemie, diabetes mellitus en gebruikte antihypertensiva gecorrigeerd. Het risico om te overlijden aan hart- en vaatziekten was niet verschillend (HR 0,97 95%BI: 0,42 tot 2,25).
SPRINT (2015) rapporteerde dat 73 (6%) deelnemers ouder dan 74 jaar onder intensieve behandeling en 106 (8%) onder standaardbehandeling kwamen te overlijden gedurende follow-up. Het risico om te overlijden gedurende follow-up was daarmee 32% lager bij een intensieve behandeling (HR 0,68 95%BI: 0,50 tot 0,92). Gegevens over dood ten gevolge van hart- en vaatziekten werden niet apart gerapporteerd voor 75-jarigen en ouder.
Gezien het verschil waarmee het effect wordt geschat in een studie en de wijze waarop gecorrigeerd is voor relevante variabelen, is ervoor gekozen om de resultaten niet te poolen, maar in een tabel weer te geven.
Tabel 2.33 Overzicht met resultaten
|
Auteur (jaar) |
All-cause mortaliteit (95%BI) |
Mortaliteit hart- en vaatziekten (95%BI) |
|
Wei (2013) |
RR 0,63 (0,46 tot 0,87) |
RR 0,53 (0,33 tot 0,84) |
|
Ogihara (2010)* |
HR 0,78 (0,46 tot 1,33) |
HR 0,97 (0,42 tot 2,25) |
|
SPRINT (2015) |
HR 0,68 (0,50 tot 0,92) |
- |
*Gecorrigeerd voor leeftijd, geslacht, BMI, roken, dyslipidemie, diabetes mellitus en gebruikte antihypertensiva
6. Bloeddruk
Wei (2013) heeft het effect op bloeddruk geëvalueerd door het gemiddelde te berekenen. Patiënten onder de intensieve behandeling hadden een gemiddelde systolische bloeddruk van 135,7 mmHg (SD 9,0) en een diastolische bloeddruk van 76,2 mmHg (SD 6,1) vergeleken met respectievelijk 149,7 mmHg (SD 11,0) en 82,1 mmHg (SD 7,5) bij patiënten onder standaardbehandeling aan het eind van de trial.
Ogihara (2010) rapporteerde na drie jaar de gemiddelde bloeddruk. Na drie jaar hadden patiënten met een strikte bloeddrukcontrole een gemiddeld systolische bloeddruk van 136,6 (SD 13,3) vergeleken met 142,0 mmHg (SD 12,5) onder patiënten met een matige bloeddrukcontrole. Een strikte bloeddrukcontrole resulteerde in afname van 5,4 mmHg vergeleken met matige bloeddrukcontrole (gemiddeld verschil: -5,4 mmHg 95%BI: -6,3 tot -4,5).
SPRINT (2015) heeft alleen de gemiddelde bloeddruk voor alle deelnemers gerapporteerd en niet voor de subgroep van 75-jarigen of ouder.
Tabel 2.34
|
Bloeddruk (mmHg) |
Strikte bloeddrukcontrole |
Matige bloeddrukcontrole |
Gemiddeld verschil (95%BI) |
|
Systolische |
|
|
|
|
Wei (2013) |
135,7 (SD 9,0) |
149,7 (SD 11,0) |
-14,0 (-15,5 tot -12,5) |
|
Ogihara (2010) |
136,6 (SD 13,3) |
142,0 (SD 12,5) |
-5,4 (-6,3 tot -4,5) |
|
Diastolische |
|
|
|
|
Wei (2013) |
76,2 (SD 6,1) |
82,1 (SD 7,5) |
-5,9 (-6,9 tot -4,9) |
|
Ogihara (2010)* |
- |
- |
|
*Gezien patiënten met alleen een systolische verhoogde bloeddruk werden geïncludeerd, worden de resultaten voor diastolische bloeddruk niet gepresenteerd.
Het gepoolde gemiddelde verschil in systolische bloeddruk aan het eind van follow-up was -7,8 mmHg (95%BI: -8,6 tot -7,0). In de studie van Ogihara (2010) waren deelnemers met alleen een verhoogde systolische bloeddruk geïncludeerd en wordt het resultaat van diastolische bloeddruk niet gepoold. Verder dient ook benoemd te worden dat gezien de brede betrouwbaarheidsintervallen een deel van de deelnemers in beide trials niet de gestelde streefwaarde gehaald hebben.
Vergelijking: Intensieve behandeling versus standaardbehandeling
Vanwege het ontbreken van gegevens is het niet mogelijk om de bewijskracht te graderen voor de uitkomstmaten kwaliteit van leven.
Functioneren (waarschijnlijke dementie): De bewijskracht voor de uitkomstmaat waarschijnlijke dementie is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment) en imprecisie (breed betrouwbaarheidsinterval).
Bijwerkingen: De bewijskracht voor de uitkomstmaat bijwerkingen is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment).
Mortaliteit: De bewijskracht voor de uitkomstmaat all-cause mortaliteit is met één niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment). De bewijskracht voor de uitkomstmaat mortaliteit ten gevolge van hart- en vaatziekten is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment) en tegenstrijdige resultaten (inconsistentie).
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment).
Bloeddruk: De bewijskracht voor de uitkomstmaat systolische bloeddruk is met één niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van een (intensieve) behandeling met antihypertensiva bij ouderen met en zonder hart- en vaatziekten vergeleken met een standaardbehandeling of geen behandeling?
PICO1
P1: ouderen (ouder dan 70 jaar) met en zonder hart- en vaatziekten;
I1: standaardbehandeling;
C1: placebo;
O1: kwaliteit van leven; functioneren waaronder cognitief; bijwerkingen; mortaliteit; hart- en vaatziekten; ziektevrij.
PICO2
P2: ouderen (ouder dan 70 jaar) met en zonder hart- en vaatziekten;
I2: intensieve behandeling met antihypertensiva of bloeddrukstreefwaarde A;
C2: standaardbehandeling met antihypertensiva of bloeddrukstreefwaarde B;
O2: kwaliteit van leven; functioneren waaronder cognitief; bijwerkingen; mortaliteit; hart- en vaatziekten; ziektevrij.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten, kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen en totale mortaliteit voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (Methode)
Zoekactie – april 2016
In de databases Medline (via OVID) en Embase (via Embase.com) is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd gecontroleerde trials. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1493 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews met een gedocumenteerde zoekstrategie, evidencetabellen en beoordeling van het risico op bias;
- gerandomiseerde, gecontroleerde trials waarbij of antihypertensiva vergeleken werd met placebo of een behandeling met een strikte bloeddrukcontrole werd vergeleken met standaard bloeddrukstreefwaarde bij patiënten ouder dan 70 jaar met een verhoogde bloeddruk (of een gemiddelde leeftijd van 70 jaar of een subgroepanalyse bij patiënten ouder dan 70 jaar).
Op basis van titel en abstract werden in eerste instantie 107 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 100 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en zeven artikelen (vijf studies) definitief geselecteerd. Een artikel (Forette, 1998) werd gevonden door het doorlopen van referenties van geïncludeerde artikelen.
Resultaten
Vijf onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Update – maart 2022
De zoekactie voor PICO2 is op 29-03-2022 herhaald met een paar wijzigingen (zie zoekverantwoording voor meer detail). De selectiecriteria zijn hetzelfde gebleven.
Op basis van titel en abstract werden in eerste instantie 223 studies voorgeselecteerd. Op basis van titel en abstract werden 200 artikelen geëxcludeerd. Na raadpleging van de volledige tekst werden vervolgens 21 studies geëxcludeerd (zie exclusietabel Update 2022 onder het tabblad Verantwoording) en twee studies definitief geselecteerd. Zhang (2021) en SPRINT (2015) zijn geïncludeerd en beschreven de vergelijking Intensieve behandeling versus standaardbehandeling.
Voor de uitwerking van de resultaten werd er geen onderscheid gemaakt in het type antihypertensiva.
Referenties
- Beckett NS, Peters R, Fletcher AE, et al. Treatment of hypertension in patients 80 years of age or older. N Engl J Med. 2008;358(18):1887-98.
- Van Bemmel T, Gussekloo J, Westendorp RG, et al. In a population-based prospective study, no association between high blood pressure and mortality after age 85 years. J Hypertens. 2006;24(2):287-92. PubMed PMID: 16508574.
- Casteleijn FM, Golyardi B. Is telemonitoring van hypertensie de toekomst? Huisarts Wet 2022;65 DOI:10.1007/s12445-022-2111-9.
- Franklin SS, Gokhale SS, Chow VH, Larson MG, Levy D, Vasan RS, Mitchell GF, Wong ND. Does low diastolic blood pressure contribute 157ot he risk of recurrent hypertensive cardiovascular disease events? The Framingham Heart Study. Hypertension. 2015 Feb;65(2):299-305. Doi: 10.1161/HYPERTENSIONAHA.114.04581. Epub 2014 Nov 24. PMID: 25421982; PMCID: PMC8375430.
- Forette F, Seux ML, Staessen JA, et al. Prevention of dementia in randomized double-blind placebo-controlled Systolic Hypertension in Europe (Syst-Eur) trial. Lancet. 1998;352(9137):1347-51. PubMed PMID: 9802273.
- Kalkman DN, Brouwer TF, Vehmeijer JT, Berger WR, Knops RE, de Winter RJ, Peters RJ, van den Born BH. J Curve in Patients Randomly Assigned to Different Systolic Blood Pressure Targets: An Experimental Approach to an Observational Paradigm. Circulation. 2017 Dec 5;136(23):2220-2229. Doi: 10.1161/CIRCULATIONAHA.117.030342. Epub 2017 Sep 22. PMID: 28939617.
- McEvoy JW, Chen Y, Rawlings A, et al. Diastolic Blood Pressure, Subclinical Myocardial Damage, and Cardiac Events: Implications for Blood Pressure Control. J Am Coll Cardiol. 2016;68(16):1713-1722. Doi: 10.1016/j.jacc.2016.07.754. PubMed PMID: 27590090; PubMed Central PMCID: PMC5089057.
- Messerli FH, Mancia G, Conti CR, et al. Dogma disputed: can aggressively lowering blood pressure in hypertensive patients with coronary artery disease be dangerous? Ann Intern Med. 2006;144(12):884-93. PubMed PMID: 16785477.
- Muller M, Smulders YM, de Leeuw PW, et al. Treatment of hypertension in the oldest old: a critical role for frailty? Hypertension. 2014;63(3):433-41. Doi: 10.1161/HYPERTENSIONAHA.113.00911. Review. PubMed PMID: 24324042.
- Muller M, Jochemsen HM, Visseren FL, et al; SMART-study group. Low blood pressure and antihypertensive treatment are independently associated with physical and mental health status in patients with arterial disease: the SMART study. J Intern Med. 2013;274(3):241-51. Doi: 10.1111/joim.12069. PubMed PMID: 23527863; PubMed Central PMCID: PMC3750200.
- Ogihara T, Saruta T, Rakugi H, et al. Target blood pressure for treatment of isolated systolic hypertension in the elderly: valsartan in elderly isolated systolic hypertension study. Hypertension. 2010;56(2):196-202.
- Peters R, Beckett N, Forette F, et al. Incident dementia and blood pressure lowering in the Hypertension in the Very Elderly Trial cognitive function assessment (HYVET-COG): a double-blind, placebo controlled trial. Lancet neurol. 2008;7(8):683-9.
- Post Hospers G, Smulders YM, Maier AB, et al. Relation between blood pressure and mortality risk in an older population: role of chronological and biological age. J Intern Med. 2015;277(4):488-97. Doi: 10.1111/joim.12284. PubMed PMID: 25041041.
- Sabayan B, Oleksik AM, Maier AB, et al. High blood pressure and resilience to physical and cognitive decline in the oldest old: the Leiden 85-plus Study. J Am Geriatr Soc. 2012;60(11):2014-9. Doi: 10.1111/j.1532-5415.2012.04203.x. PubMed PMID: 23126669.
- SPRINT Group SR, Wright JT, Jr., Williamson JD, et al. A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med. 2015;373(22):2103-16.
- SPRINT-MIND. Group, Williamson JD, Pajewski NM, Auchus AP, Bryan RN, Chelune G, et al. Effect of Intensive vs Standard Blood Pressure Control on Probable Dementia: A Randomized Clinical Trial. JAMA. 2019;321(6):553-61.
- Staessen JA, Fagard R, Thijs L, et al. Subgroup and per-protocol analysis of the randomized European Trial on Isolated Systolic Hypertension in the Elderly. Arch Intern Med. 1998;158(15):1681-91.
- Verberk WJ, Kroon AA, Lenders JW, Kessels AG, van Montfrans GA, Smit AJ, van der Kuy PH, Nelemans PJ, Rennenberg RJ, Grobbee DE, Beltman FW, Joore MA, Brunenberg DE, Dirksen C, Thien T, de Leeuw PW; Home Versus Office Measurement, Reduction of Unnecessary Treatment Study Investigators. Self-measurement of blood pressure at home reduces the need for antihypertensive drugs: a randomized, controlled trial. Hypertension. 2007 Dec;50(6):1019-25. doi: 10.1161/HYPERTENSIONAHA.107.094193. Epub 2007 Oct 15. PMID: 17938383.
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, Benetos A, Biffi A, Boavida JM, Capodanno D, Cosyns B, Crawford C, Davos CH, Desormais I, Di Angelantonio E, Franco OH, Halvorsen S, Hobbs FDR, Hollander M, Jankowska EA, Michal M, Sacco S, Sattar N, Tokgozoglu L, Tonstad S, Tsioufis KP, van Dis I, van Gelder IC, Wanner C, Williams B; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227-3337. Doi: 10.1093/eurheartj/ehab484. Erratum in: Eur Heart J. 2022 Nov 7;43(42):4468. PMID: 34458905.
- Warwick J, Falaschetti E, Rockwood K, et al. No evidence that frailty modifies the positive impact of antihypertensive treatment in very elderly people: an investigation of the impact of frailty upon treatment effect in the HYpertension in the Very Elderly Trial (HYVET) study, a double-blind, placebo-controlled study of antihypertensives in people with hypertension aged 80 and over. BMC Med. 2015;13:78.
- Wei Y, Jin Z, Shen G, et al. Effects of intensive antihypertensive treatment on Chinese hypertensive patients older than 70 years. J Clin Hypertens (Greenwich). 2013;15(6):420-7.
- van der Wel MC, Buunk IE, van Weel C, et al. A novel approach to office blood pressure measurement: 30-minute office blood pressure versus daytime ambulatory blood pressure. Ann Fam Med. 2011;9(2):128-35. doi: 10.1370/afm.1211. PubMed PMID: 21403139; PubMed Central PMCID: PMC3056860.
- Zhang W, Zhang S, Deng Y, Wu S, Ren J, Sun G, et al. Trial of Intensive Blood-Pressure Control in Older Patients with Hypertension. The New England journal of medicine. 2021;385(14):1268-79.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/ control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Comparison: Antihypertensive versus placebo |
|||||||
|
Beckett, 2008
Additional data from Peters, 2008 |
Type of study: RCT (parallel)
Setting: 195 centers
Country: 13 countries across Western and Eastern Europe, China, Australasia, and North Africa
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 1933 Control: 1912
Important prognostic factors2: Age ± SD: I: 83 (3) C: 83 (3)
Sex: I: 39% M C: 40% M
Groups comparable at baseline? Yes
|
Indapamide (sustained release, 1.5 mg)
The angiotensin-converting-enzyme inhibitor perindopril (2 or 4 mg), or matching placebo, was added if necessary to achieve the target blood pressure of 150/80 mmHg.
|
Matching placebo
|
Length of follow-up: Mean 2.1 years (range 0 to 6.5)
Loss-to-follow-up: Intervention: N = 847 (44%) Reasons: 196 died; 282 declined to participate; 4 were withdrawn by investigator; 27 had protocol withdrawal event and no open follow-up; 164 were at centers closed by data monitoring committee; 168 for other administrative reasons; 6 lost to follow-up
Control: N = 896 (47%) Reasons: 235 died; 266 declined to participate; 5 were withdrawn by investigator; 42 had protocol withdrawal event and no open follow-up; 166 were at centers closed by data monitoring committee; 171 for other administrative reasons; 11 lost to follow-up
Incomplete outcome data: Intervention: N = 847 (44%) Reasons: 196 died; 282 declined to participate; 4 were withdrawn by investigator; 27 had protocol withdrawal event and no open follow-up; 164 were at centers closed by data monitoring committee; 168 for other administrative reasons; 6 lost to follow-up
Control: N = 896 (47%) Reasons: 235 died; 266 declined to participate; 5 were withdrawn by investigator; 42 had protocol withdrawal event and no open follow-up; 166 were at centers closed by data monitoring committee; 171 for other administrative reasons; 11 lost to follow-up |
1. Quality of life Not reported
2. Functional status Cognition, measured with the MMSE*, mean change from baseline
I: 0.7 points (SD 4.0) C: -1.1 points (SD 3.9) P=0.08
Dementia, n I: 126 C: 137 HR 0.86 (95%CI: 0.67-1.09)
3. Adverse events Number of serious adverse events, n (%)
I: 358 (19) C: 448 (23) P=0.001
4. Mortality Measured as all-cause mortality or death due to a cardiovascular event, n (rate per 1000 patient years)
Total mortality, hazard ratio I: 196 (47) C: 235 (60) HR 0.79 (95%CI 0.65-0.95)
Death due to cardiovascular event, hazard ratio I: 99 (24) C: 121 (31) HR 0.77 (95%CI 0.60-1.01)
5. CVD Measured as all cardiovascular events, n (rate per 1000 patient years)
I: 138 (34) C: 193 (51) HR 0.66 (95%CI 0.53-0.82)
6. Blood pressure Blood pressure was measured annual, mean change from baseline in BP (SD) in mmHg
At two years, seated I: SBP 29.5 (15.4); DBP 12.9 (9.5) C: SBP 14.5 (18.5); DBP 6.8 (10.5)
|
Data on cognition was reported in the publication by Peters, 2008. *Data was available in 1687 under active treatment versus 1649 under placebo. |
|
Staessen, 1998 |
Type of study: RCT (parallel)
Setting: Patients with isolated systolic hypertension
Country: Belgium, Belorussia, Bulgaria, Croatia, Estonia, Finland, France, Germany, Greece, Ireland, Israel, Italy, Lithuania, Netherlands, Poland, Portugal, Romania, Russian Federation, Slovakia, Slovenia, Spain, United Kingdom
Source of funding: Industry
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 2398 Control: 2297
Important prognostic factors2: Age ± SD: 70.2 (6.7)
Sex: 33% M
Groups comparable at baseline? Cannot be judged |
Antihypertensive treatment – Nitrendipine (10-40 mg/d)
If necessary, the calcium channel blocker was combined with or replaced by enalapril maleate (5-20 mg/d) or hydrochlorothiazide (12.5-25 mg/d) or both drugs.
The study medications were stepwise titrated and combined to reduce sitting systolic blood pressure by 20 mmHg or more to less than 150 mmHg.
|
Control group – matching placebo
|
Length of follow-up: Median follow-up of 2.0 years (range 1 to 97 months)
Loss-to-follow-up: Intervention: N = 660 (28%) Reasons: 123 died; 174 supervised open follow-up; 242 unsupervised open follow-up; 121 unavailable for follow-up
Control: N = 780 (34%) Reasons: 137 died; 295 supervised open follow-up; 232 unsupervised open follow-up; 116 unavailable for follow-up
Incomplete outcome data: Intervention: N = 660 (28%) Reasons: 123 died; 174 supervised open follow-up; 242 unsupervised open follow-up; 121 unavailable for follow-up
Control: N = 780 (34%) Reasons: 137 died; 295 supervised open follow-up; 232 unsupervised open follow-up; 116 unavailable for follow-up
|
1. Quality of life Not reported
2. Functional status Not reported
3. Adverse events Not reported
4. Mortality Measured as all-cause mortality or death due to a cardiovascular event, n (rate per 1000 patient years)
Total mortality, hazard ratio I: 123 (20.5) C: 137 (24) HR 0.86 (95%CI 0.67-1.10)
Death due to cardiovascular event, hazard ratio I: 59 (9.8) C: 77 (13.5) HR 0.73 (95%CI 0.52-1.03)
5. CVD Measured as all cardiovascular events, n (rate per 1000 patient years)
I: 137 (23.3) C: 186 (33.9) HR 0.69 (95%CI 0.55-0.86)
6. Blood pressure Blood pressure was measured every three months, mean change from baseline in BP (SD) in mmHg
At median follow-up, seated I: SBP 23 (16); DBP 7 (8) C: SBP 13 (17); DBP 2 (8) Mean difference SBP: 10.1 (95CI: 8.8-11.4) Mean difference DBP: 4.5 (95%CI: 3.9-5.1) |
|
|
Comparison: intensive treatment versus standard treatment |
|||||||
|
Wei, 2013 |
Type of study: RCT (parallel)
Setting: Hypertensive patients
Country: China
Source of funding: Not stated |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 363 Control: 361
Important prognostic factors2: Age ± SD: I: 76 (5) C: 76 (5)
Sex: I: 67% M C: 66% M
Groups comparable at baseline? Yes
|
Intensive treatment (blood pressure target ≤140/90 mmHg)
|
Standard treatment (blood pressure target ≤150/90 mmHg)
|
Length of follow-up: 4 years
Loss-to-follow-up: Intervention: N = 2 (0.6%) Reasons: 1 consent withdrawal; 1 lost to follow-up
Control: N = 7 (2%) Reasons: 5 consent withdrawal; 2 lost to follow-up
Incomplete outcome data: Intervention: N = 2 (0.6%) Reasons: 1 consent withdrawal; 1 lost to follow-up
Control: N = 7 (2%) Reasons: 5 consent withdrawal; 2 lost to follow-up
|
1. Quality of life Not reported
2. Functional status Not reported
3. Adverse events Not reported
4. Mortality Measured as all-cause mortality or death due to a cardiovascular event, n (%)
Total mortality, risk ratio I: 51 (14) C: 87 (24) RR 0.63 (95%CI 0.46-0.87)
Death due to cardiovascular event, risk ratio I: 25 (7) C: 50 (14) RR 0.53 (95%CI 0.33-0.84)
5. CVD Measured as all cardiovascular events, n (%)
I: 40 (11) C: 67 (19) RR 0.63 (95%CI 0.44-0.92)
6. Blood pressure Blood pressure was measured every six months, mean BP (SD) in mmHg
I: SBP 135.7 (9.0); DBP 76.2 (6.1) C: SBP 149.7 (11.0); DBP 82.1 (7.5) Mean difference SBP 14; DBP 6, p<0.01) |
Patients were examined on at least two separate occasions, and BP was measured on the right upper arm at least twice per visit by the auscultatory method using a sphygmomanometer with the patients in the sitting position after 5 to 10 minutes of rest. If measured values differed by >4 mmHg, recalibration was required. BP measurements were performed at 8 AM to 11 AM and averaged for each visit. BP was monitored after enrollment, which was measured in the fourth week, the third month, the sixth month, and every 6 months thereafter. By the end of the study, all patients were followed-up an average of 10 times. |
|
Ogihara, 2010 |
Type of study: RCT (parallel)
Setting: Elderly with isolated systolic hypertension
Country: Japan
Source of funding: Non-commercial |
Inclusion criteria:
N total at baseline: Intervention: 1627 (1545 described) Control: 1633 (1534 described)
Important prognostic factors2: Age ± SD: I: 76 (4) C: 76 (4)
Sex: I: 38% M C: 37% M
Groups comparable at baseline? Yes
|
Strict control group
Valsartan, 40 to 80 mg once daily, was administrated as the first-step therapy. If the target BP in each group was not achieved within 1 to 2 months, the dose of valsartan was increased ≤160 mg, and/or other antihypertensive agents except other angiotensin II type 1 receptor blockers were added, for example, low-dose diuretics, Ca antagonists, and so on to maintain the target BP.
|
Moderate control group
|
Length of follow-up: Mean 2.85 years
Loss-to-follow-up: Intervention: N = 82 (5%) Reasons: 42 withdrew consent; 40 no follow-up just after randomization
Control: N = 99 (6%) Reasons: 45 withdrew consent; 54 no follow-up just after randomization
Incomplete outcome data: Intervention: N = 82 (5%) Reasons: 42 withdrew consent; 40 no follow-up just after randomization
Control: N = 99 (6%) Reasons: 45 withdrew consent; 54 no follow-up just after randomization
|
1. Quality of life Not reported
2. Functional status Not reported
3. Adverse events Measured as the rates of serious adverse events, percentage
I: 5.6% C: 5.2% P=0.61
4. Mortality Measured as all-cause mortality or death due to a cardiovascular event, n (%)
Total mortality, hazard ratio I: 24 (2) C: 30 (2) HR 0.78 (95%CI 0.46-1.33), adjusted for sex, age, BMI, smoking, dyslipidaemia, diabetes mellitus, and antihypertensive agents used before enrolment.
Death due to cardiovascular event, hazard ratio I: 11 (1) C: 11 (1) HR 0.97 (95%CI 0.42-2.25), adjusted for sex, age, BMI, smoking, dyslipidaemia, diabetes mellitus, and antihypertensive agents used before enrolment.
5. CVD Not reported
6. Blood pressure Blood pressure at the end of 36 months, mean BP (SD) in mmHg
I: SBP 136.6 (13.3); DBP 74.2 (8.8) C: SBP 142.0 (12.5); DBP 76.5 (8.9) Mean difference SBP 5.6; DBP 1.7, p<0.001) |
About 50% in each group were already taking antihypertensive drugs. |
|
The SPRINT research group, 2015
Additional data from SPRINT-MIND |
Type of study: RCT (parallel)
Setting: Patients at increased risk of CVD
Country: United States of America
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 4678 (1317 older than 74 yrs) Control: 4683 (1319 older than 74 yrs)
Important prognostic factors2: Age ± SD: I: 79 (4) C: 79 (4)
Sex: Not stated for the subgroup
Groups comparable at baseline?
|
Intensive treatment (blood-pressure target less than 120 mmHg)
|
Standard treatment (blood-pressure target less than 140 mmHg)
|
Length of follow-up: Median follow-up: 3.26 (not stated for the subgroup)
Loss-to-follow-up: Not stated for the subgroup
Incomplete outcome data: Not stated for the subgroup
|
1. Quality of life Not reported
2. Functional status Probable dementia, ascertained via MoCA, learning and memory and processing speed.
I: 95 (17.8 cases per 1000 Person-Years) C: 116 (22.0 cases per Person-Years) HR 0.88 (0.66-1.16)
3. Adverse events Measured as the rates of serious adverse events**, n (%)
I: 640 (49) C: 638 (48) HR 1.00, p=0.93
4. Mortality Measured as all-cause mortality or death due to a cardiovascular event, n (%)
Total mortality, hazard ratio I: 73 (6) C: 106 (8) HR 0.68 (95%CI 0.50-0.92), stratified according to clinic
Death due to cardiovascular event, hazard ratio I: 11 (1) C: 11 (1) HR 0.97 (95%CI 0.42-2.25), adjusted for sex, age, BMI, smoking, dyslipidaemia, diabetes mellitus, and antihypertensive agents used before enrolment.
5. CVD Measured as composite outcome: myocardial infarction, acute coronary syndrome, stroke, acute decompensated heart failure, or death from cardiovascular causes, n (%)
I: 101 (8) C: 144 (11) HR 0.67 (0.51-0.86)
I: 108 (8) C: 158 (12) HR 0.65 (0.50-0.85)
6. Blood pressure Not stated for the subgroup |
*Increased cardiovascular risk was defined by one or more of the following: clinical or subclinical cardiovascular disease other than stroke; chronic kidney disease, excluding polycystic kidney disease, with an estimated glomerular filtration rate (eGFR) of 20 to less than 60 ml per minute per 1.73 m2 of body surface area, calculated with the use of the four variable Modification of Diet in Renal Disease equation; a 10-year risk of cardiovascular disease of 15% or greater on the basis of the Framingham risk score; or an age of 75 years or older.
**In both groups, injurious falls was among the most frequent serious adverse events. Among patients under intensive treatment also frequent was acute kidney injury or acute renal failure.
|
|
Zhang, 2021 |
Type of study: RCT
Setting and country: Multiple clinical centers across China
Funding and conflicts of interest: Non-commercial. The companies that donated the drugs and devices had no role in the design of the trial or in the analysis of the data. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 4243 (of which 1023 are 70-80 years) Control: 4268 (of which 1032 are 70-80 years)
Important prognostic factors2: age ± SD: I: 66 (SD 5) C: 66 (SD 5)
Sex: I: 47% M C:46 % M
SBP: I: 146 (17) C: 146 (17)
|
Target SBP 110 to 130 mmHg
The patients were provided with antihypertensive drugs, including olmesartan (an angiotensin-receptor blocker), amlodipine (a calcium-channel blocker), and hydrochlorothiazide (a diuretic).
|
Target SBP 130 to 150 mmHg
The patients were provided with antihypertensive drugs, including olmesartan (an angiotensin-receptor blocker), amlodipine (a calcium-channel blocker), and hydrochlorothiazide (a diuretic).
|
Length of follow-up: 48 months
Loss-to-follow-up: Intervention: N 126 (3.0%) Reasons (102 lost-to-follow-up; 24 discontinued interventions)
Control: N 166 (3.9%) Reasons (132 lost-to-follow-up; 34 discontinued interventions)
Incomplete outcome data: Intervention: N 102 (2.4%) Reasons (not stated other than lost-to-follow-up)
Control: N 132 (3.1%) Reasons (not stated other than lost-to-follow-up)
|
Outcome measure-1: Defined as cardiovascular disease*
70-80 years I: 49 (4.7%) C: 66 (6.4%) HR 0.73 (95%CI 0.50 to 1.05), adjusted for clinical center
Outcome measure-2: Defined as mortality
Not stated for subgroup
Outcome measure-3: Defined as adverse events
Not stated for subgroup |
* The primary outcome was a composite of stroke (ischemic or hemorrhagic), acute coronary syndrome (acute myocardial infarction and hospitalization for unstable angina), acute decompensated heart failure, coronary revascularization, atrial fibrillation, or death from cardiovascular causes.
|
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Antihypertensive versus placebo |
||||||||
|
Beckett, 2008 (HYVET) |
“Randomization was stratified according to age and sex; permuted blocks of 4 and 6 of any 10 patients were used to ensure roughly equal assignment to each of the two groups within large centers.” |
Unclear. Not stated. |
Unlikely. Matching placebo was given |
Likely. Investigators were allowed to adjust the study medication according the blood pressure target. |
Unlikely. “All events that were possible end points were reviewed by an independent committee, unaware of the group assignment, using predefined definitions from the protocol.” |
Unclear. Trial was registered retrospectively; although outcomes stated were reported. |
Likely. Reasons for lost to follow-up were similar; however, total number was large and almost 50% in each group. |
Unlikely. “The primary analysis was performed according to the intention-to-treat principle.” |
|
Steassen, 1998 |
“Eligible patients were prospectively stratified by center, sex, and previous cardiovascular complications and thereafter randomized to double-blind treatment with active medication or placebo by means of a computerized random function.” |
Unclear. Not stated. |
Unlikely. Matching placebo was given. |
Unclear. Not stated. |
Unlikely. The End Point Committee, which was unaware of the patients’ treatment, (…).” |
Unclear. Not stated whether the trial was registered. |
Unclear. More participants withdrew from double-blind treatment in the control group; however, reasons are not stated. |
Unlikely. “The analysis by intention to treat included all end points occurring during double-blind and open follow-up, regardless of whether the patients were taking the treatment to which they had been randomized.” |
|
Intensive versus standard blood pressure control |
||||||||
|
The SPRINT research group, 2015 |
“Randomization was stratified according to clinical site.” |
Unclear. Not stated. |
Likely. “Participants and study personnel were aware of the study-group assignments, (…).” |
Likely. “Participants and study personnel were aware of the study-group assignments, (…).” |
Unlikely. “Participants and study personnel were aware of the study-group assignments, but outcome adjudicators were not.” |
Unlikely. Trial registered prospectively with reported outcome stated in publication |
Unclear. Not stated for the subgroup. |
Unlikely. “(…) with the use of the intention-to-treat approach for all randomly assigned participants; (…)” |
|
Wei, 2013 |
“(…) were randomly assigned to either intensive antihypertensive treatment or standard treatment by using a computer-generated table of random numbers.” |
Unclear. Not stated |
Likely. Participants were not blinded |
Likely. Care providers could not be blinded. |
Unlikely. “(…), endpoints were evaluated by the members of the Endpoint Evaluation Committee, who were blinded to the treatment assignments and the time course of BP.” |
Unclear. It was not reported whether the trial was registered. |
Unlikely. Although reasons for lost to follow-up were not clear, numbers were very small (<3%). |
Unlikely. “An intention-to-treat analysis was performed to ensure that all study participants were followed until the conclusion of the study, irrespective of whether the participant was still receiving or complying with the treatment.” |
|
Ogihara, 2010 |
“(…), the patients were randomly assigned by the VALISH data center according to the following factors: sex, age (<75 or ≥75 years), systolic BP (<175 or ≥175 mmHg), antihypertensive therapy, and institution (weighting coefficient: 2). |
Unclear. Not stated |
Likely. Participants were not blinded |
Likely. Care providers could not be blinded. |
Unlikely. “End points and adverse events were blindly evaluated according to the prospective, randomized, open-label, blinded end point design by the endpoint committee and the safety committee, respectively.” |
Unclear. It was not reported whether the trial was registered. |
Unclear. Reasons for withdrawal were not stated. |
Unlikely. “All of the registered study patients assigned to treatment were analysed on an intention-to-treat basis.” |
Research question:
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Zhang, 2021 |
Definitely yes
Reason: “Randomization was performed with the use of a central computerized randomization program on a Web-based interface, with stratification according to clinical center.” |
No information
Reason: No stated in article, supplementary appendix or trial register. |
Definitely no
Reason: “Investigators and patients were aware of the trial-group assignments. […] Members of the adjudication committee were unaware of the trial-group assignments.” |
Definitely yes
Reason: In both groups less than 4% did not complete assigned treatment with similar reasons. |
Probably yes
Reason: of the 12 outcomes reported in trial register, 9 were reported in the article. It seems likely the other outcomes will be reported in other articles. |
Definitely yes
Reason: The companies that donated the drugs and devices had no role in the design of the trial or in the analysis of the data. |
Low
Reason: Although the participants and researcher were not blinded, the outcomes were determined by committee masked to treatment assignment. |
Exclusietabel
Tabel 2022 Exclusie na het lezen van het volledige artikel
|
Reference |
Reason |
|
Signorini L, Zaza G, Gambaro G. The challenge of early glomerular filtration rate decline in response to antihypertensive treatment and chronic kidney disease outcomes. Nephrology, dialysis, transplantation: official publication of the European Dialysis and Transplant Association - European Renal Association. 2022;37(2):222-9. |
Narrative review |
|
Marcum ZA, Cohen JB, Zhang C, Derington CG, Greene TH, Ghazi L, et al. Association of Antihypertensives That Stimulate vs Inhibit Types 2 and 4 Angiotensin II Receptors with Cognitive Impairment. JAMA Network Open. 2022;5(1):E2145319. |
Comparison between types of medication, not target for BP |
|
Wright CB, Auchus AP, Lerner A, Ambrosius WT, Ay H, Bates JT, et al. Effect of Intensive Versus Standard Blood Pressure Control on Stroke Subtypes. Hypertension (Dallas, Tex : 1979). 2021;77(4):1391-8. |
Focus on stroke subtypes |
|
Olsen E, Holzhauer B, Julius S, Kjeldsen SE, Larstorp ACK, Mancia G, et al. Cardiovascular outcomes at recommended blood pressure targets in middle-aged and elderly patients with type 2 diabetes mellitus and hypertension. Blood Pressure. 2021;30(2):82-9. |
VALUE comparison of medication, not targets: Observational analysis of targets in diabetics |
|
Olsen E, Holzhauer B, Julius S, Kjeldsen SE, Larstorp ACK, Mancia G, et al. Cardiovascular outcomes at recommended blood pressure targets in middle-aged and elderly patients with type 2 diabetes mellitus compared to all middle-aged and elderly hypertensive study patients with high cardiovascular risk. Blood pressure. 2021;30(2):90-7. |
VALUE comparison of medication, not targets: Observational analysis of target in adults with a high risk of CVD |
|
Lee JY, Han SH. Blood pressure control in patients with chronic kidney disease. The Korean journal of internal medicine. 2021;36(4):780-94. |
Narrative review |
|
Ku E, Sarnak MJ, Toto R, McCulloch CE, Lin F, Smogorzewski M, et al. Effect of Blood Pressure Control on Long-Term Risk of End-Stage Renal Disease and Death Among Subgroups of Patients With Chronic Kidney Disease. Journal of the American Heart Association. 2019;8(16):e012749. |
Target to MAP |
|
Plante TB, Juraschek SP, Miller ER, 3rd, Appel LJ, Cushman M, Littenberg B. Comparison of Frequency of Atherosclerotic Cardiovascular and Safety Events With Systolic Blood Pressure <120mm Hg Versus 135-139mm Hg in a Systolic Blood Pressure Intervention Trial Primary Prevention Subgroup. The American journal of cardiology. 2018;122(7):1185-90. |
Analysis in patients without CVD -> observational data SPRINT already included |
|
Ó Hartaigh B, Szymonifka J, Okin PM. Achieving target SBP for lowering the risk of major adverse cardiovascular events in persons with diabetes mellitus. Journal of Hypertension. 2018;36(1):101-9 |
Achieved SBP in diabetes patients |
|
Berlowitz DR, Foy CG, Kazis LE, Bolin LP, Conroy MB, Fitzpatrick P, et al. Effect of intensive blood-pressure treatment on patient-reported outcomes. New England Journal of Medicine. 2017;377(8):733-44. |
Data from MIND already included. |
|
Mant J, McManus RJ, Roalfe A, Fletcher K, Taylor CJ, Martin U, et al. Different systolic blood pressure targets for people with history of stroke or transient ischaemic attack: PAST-BP (Prevention after Stroke-Blood Pressure) randomised controlled trial. BMJ (Online). 2016;352. |
PAST-BP, patients with a stroke, follow-up too short |
|
Shi S, Gouskova N, Najafzadeh M, Wei L-J, Kim DH. Intensive versus standard blood pressure control in type 2 diabetes: a restricted mean survival time analysis of a randomised controlled trial. BMJ open. 2021;11(9):e050335. |
ACCORD-trial participants with CVD included (~33%) |
|
Pajewski NM, Berlowitz DR, Bress AP, Callahan KE, Cheung AK, Fine LJ, et al. Intensive vs Standard Blood Pressure Control in Adults 80 Years or Older: A Secondary Analysis of the Systolic Blood Pressure Intervention Trial. Journal of the American Geriatrics Society. 2020;68(3):496-504. |
Subgroup analysis of > 80 years. (all participants between 75 and 80 were excluded making up to 55% of participants older than 75 years) |
|
Gitsels LA, Kulinskaya E, Bakbergenuly I, Steel N. Optimal SBP targets in routine clinical care. Journal of hypertension. 2019;37(4):837-43. |
Analysis and comparison of SPRINT and THIN (data from the UK), with THIN being observational data |
|
Aggarwal R, Petrie B, Bala W, Chiu N. Mortality Outcomes With Intensive Blood Pressure Targets in Chronic Kidney Disease Patients. Hypertension (Dallas, Tex : 1979). 2019;73(6):1275-82. |
4 trial analysis of participants with CKD of which two trials are separately included and two excluded |
|
Brouwer TF, Vehmeijer JT, Kalkman DN, Berger WR, Van Den Born BJH, Peters RJ, et al. Intensive blood pressure lowering in patients with and patients without type 2 diabetes: A pooled analysis from two randomized trials. Diabetes Care. 2018;41(6):1142-8. |
T2DM and BP targets -> ACCORD included participants with CVD and diabetes |
|
Beddhu S, Greene T, Boucher R, Cushman WC, Wei G, Stoddard G, et al. Intensive systolic blood pressure control and incident chronic kidney disease in people with and without diabetes mellitus: secondary analyses of two randomised controlled trials. The Lancet Diabetes and Endocrinology. 2018;6(7):555-63. |
CKD and SBP targets -> ACCORD included participants with CVD and diabetes |
|
Buckley LF, Dixon DL, Wohlford GFt, Wijesinghe DS, Baker WL, Van Tassell BW. Intensive Versus Standard Blood Pressure Control in SPRINT-Eligible Participants of ACCORD-BP. Diabetes care. 2017;40(12):1733-8. |
Participants with DM2 and SBP -> ACCORD included participants with CVD and diabetes |
|
Bath PM, Scutt P, Blackburn DJ, Ankolekar S, Krishnan K, Ballard C, et al. Intensive versus Guideline Blood Pressure and Lipid Lowering in Patients with Previous Stroke: Main results from the pilot prevention of Decline in Cognition after Stroke trial' (PODCAST) randomised controlled trial. PLoS ONE. 2017;12(1). |
Inclusion criteria for BP was 125-175 mmHg |
|
Odden MC, McClure LA, Sawaya BP, White CL, Peralta CA, Field TS, et al. Achieved Blood Pressure and Outcomes in the Secondary Prevention of Small Subcortical Strokes Trial. Hypertension (Dallas, Tex : 1979). 2016;67(1):63-9. |
Participants with stroke and association with achieved SBP |
Tabel 2016 Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Review filter |
|
|
Parsons, 2016 |
Gemiddelde leeftijd van 65 jaar of ouder; effect van behandeling op beroerte |
|
Peters, 2014 |
Type antihypertensiva |
|
Goeres, 2014 |
Geen meta-analyse; leeftijd niet allen boven 70 jaar; geen RoB beoordeling |
|
Sundstrom, 2014 |
Data gestratificeerd op risico en niet op leeftijd. |
|
Ahola, 2012 |
Observationele studie met data van twee databases en jonger dan 70 jaar; geen subgroepanalyse |
|
Schall, 2011 |
Geen evidence-tabel beschikbaar; geen bekende tool gebruikt voor Risk of Bias beoordeling, alleen benoemd items worden bekeken. Echter, er wordt in de tekst geen oordeel over gegeven. |
|
Bejan-Angoulvant, 2010 |
Niet systematisch gezocht, onduidelijk ook tot wanneer trials zijn geïncludeerd
|
|
Musini, 2009 |
Leeftijdsgrens 60 jaar of ouder |
|
Bulpitt, 2003 |
Resultaten van een pilot van de HYVET-studie, die reeds is geïncludeerd |
|
Messerli, 2001 |
Alleen gezocht in Medline en tot juni 1999 |
|
Gueyffier, 1999 |
Geïncludeerd studies zijn ook geïncludeerd door Schall, 2011 |
|
Pearce, 1995 |
Recentere reviews komen in aanmerking |
|
RCT-filter |
|
|
Omboni, 2015 |
Vergelijking tussen twee type antihypertensiva |
|
Moonen, 2015 |
Stoppen met antihypertensiva |
|
Tinetti, 2014 |
Observationele studie met data over hart- en vaatziekten en mortaliteit gerapporteerd (data reeds beschikbaar uit RCTs) |
|
Beckett, 2014 |
Trial reeds geïncludeerd, rapportage van niet relevant subgroepanalyse |
|
Zanchetti, 2014 |
Studieprotocol |
|
Williamson, 2014 |
Patiënten met diabetes en jonger dan 70 jaar |
|
Vagholkar, 2014 |
Geen relevante uitkomstmaten gerapporteerd |
|
Tinetti, 2014 |
Geen relevante uitkomstmaten |
|
Reboldi, 2014 |
Totale mortaliteit en hart- en vaatziekten in 1 uitkomstmaat gerapporteerd; gemiddelde leeftijd voor drie van vier groepen onder 70 jaar |
|
Mohebi, 2014 |
Gemiddelde leeftijd onder 70 jaar en geen subgroepanalyse beschikbaar; observationele studies, geen propensity score analyse |
|
Margolis, 2014 |
Patiënten met diabetes en jonger dan 70 jaar |
|
Peters, 2013 |
Trial reeds geïncludeerd; geen relevante uitkomstmaat |
|
Zhang, 2013 |
Geen relevante uitkomstmaten |
|
White, 2013 |
Studieprotocol |
|
Weir, 2013 |
Geen relevante uitkomstmaten |
|
Beckett, 2012 |
Open label extensie van een trial, met als vergelijking vroeg starten versus laat starten |
|
Zhang, 2011 |
Subgroepanalyse: 65> of 65≤ |
|
Group, 2010 |
Patiënten met diabetes en jonger dan 70 jaar |
|
Bangalore, 2010 |
Patiënten die een statine krijgen |
|
Aronow, 2009 |
Letter to editor/ reactie van auteur |
|
Verdecchia, 2009 |
Alleen subgroep analyse beschikbaar; reeds volledige artikel kunnen includeren |
|
Tardif, 2008 |
Geen relevante uitkomstmaten |
|
Rakugi, 2008 |
Narratieve review |
|
Ogiharam, 2008 |
Vergelijking tussen twee anithypertensiva |
|
Flack, 2008 |
Geen vergelijkende groep |
|
Ferguson, 2008 |
Geen relevante uitkomstmaten |
|
Patel, 2007 |
Patiënten met diabetes |
|
Kintscher, 2007 |
Vergelijking tussen verschillende antihypertensiva |
|
Kabakci, 2007 |
Risicofactoren voor hart- en vaatziekten |
|
Fagard, 2007 |
Relevante data reeds geïncludeerd |
|
Eijkelkamp, 2007 |
Geen relevante uitkomstmaten |
|
Agostini, 2007 |
Intensiteit van behandeling gedefinieerd aan de hand van de hoeveelheid klassen van antihypertensiva werden gebruikt |
|
Roumie, 2006 |
Geen relevante uitkomstmaten |
|
Perkovic, 2006 |
Geen relevante uitkomstmaten |
|
Group, 2005 |
Studieprotocol |
|
Gard, 2004 |
Narratieve review |
|
Ferrari, 2004 |
Geen relevante uitkomstmaten |
|
Lithell, 2004 |
Meerderheid van placebogroep kreeg add-on antihypertensiva binnen vier maanden na het starten van de trial |
|
Degl’Innoncenti, 2004 |
Meerderheid van placebogroep kreeg add-on antihypertensiva binnen vier maanden na het starten van de trial |
|
Mancia, 2003 |
Vergelijking tussen verschillende antihypertensiva |
|
Jungmann, 2003 |
Narratieve review |
|
Jonsson, 2003 |
Geen relevante uitkomstmaten gerapporteerd (kosteneffectiviteit in zweden) |
|
Lithell, 2003 |
Meerderheid van placebogroep kreeg add-on antihypertensiva binnen vier maanden na het starten van de trial |
|
Camisasca, 2002 |
Uitvoering van een richtlijn |
|
Hansson, 2001 |
Narratieve review |
|
Emeriau, 2001 |
Vergelijking tussen medicamenten |
|
Wassertheil-Smoller, 2000 |
Associatie tussen BMI, hypertensie en mortaliteit |
|
Wang, 2000 |
Effectschatter met betrouwbaarheidsinterval niet te extraheren (wordt alleen in een grafiek weergegeven) |
|
Trenkwalder, 2000 |
Narratieve review |
|
Perry, 2000 |
Subgroepanalyse niet beschikbaar |
|
Ogihara, 2000 |
Geen originele beschrijving van een studie |
|
Lindholm, 2000 |
Vergelijking tussen verschillende |
|
Lassila, 2000 |
Follow-up na een trial |
|
Bulpitt, 2000 |
Vergelijking van medicamenten bij hoge diastolische bloeddruk |
|
Brown, 2000 |
Vergelijking tussen antihypertensiva |
|
Fagard, 1999 |
Originele studie geïncludeerd. |
|
Alli, 1999 |
SBP en SBP als voorspellers van mortaliteit |
|
Berlowitz, 1998 |
Ontwikkeling van een soort predictie model over behandeling van hypertensie |
|
Zeng, 1998 |
Effect van medicatie op syncope |
|
Winther, 1998 |
Patiënten met cognitieve stoornissen en zonder hypertensie |
|
Whelton, 1998 |
Patiënten reeds op medicatie en vervolgens het effect van gewichtsverlies en beperkte zout inname |
|
Staessen, 1998 |
Originele studie geïncludeerd. |
|
Savage, 1998 |
Ontwikkeling van diabetes tijdens RCT |
|
Pahor, 1998 |
Patiënten met hypertensie en nierfalen |
|
Kostis, 1998 |
Over het stoppen van medicatie |
|
Hansson, 1993 |
Narratieve review |
|
Aagaard, 1984 |
Narratieve review |
|
Welzel, 1982 |
Narratieve review |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-09-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het herzien van de richtlijnmodule is in 2021 een multidisciplinaire cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van het cluster) die betrokken zijn bij de zorg voor patiënten met (een hoog risico op) hart-en vaatziekten.
Per geprioriteerde module wordt door het cluster bekeken welke expertise gewenst is bij de uitwerking en wordt gezamenlijk een verdeling gemaakt in mate van betrokkenheid van clusterleden. Alle clusterexpertiseleden die direct betrokken waren bij de modules, staan hieronder per module vermeld.
Stuurgroep
- Prof. dr. A.W. (Arno) Hoes (voorzitter), klinisch epidemioloog, werkzaam in het UMC Utrecht te Utrecht
- Prof. dr. Y.M. (Yvo) Smulders (vicevoorzitter), internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
- Drs. N.J.P. (Klaas) Borst, internist ouderengeneeskunde, werkzaam in het Isala ziekenhuis te Zwolle, NIV
- Dr. F.A.L. (Frans) van der Horst, klinisch chemicus, werkzaam in het Reinier Medisch Diagnostisch Centrum te Delft, NVKC
- Dr. A.H. (AnHo) Liem, cardioloog niet praktiserend, NVVC
- Prof. dr. F.M.A.C. (Fabrice) Martens, cardioloog, werkzaam in het Amsterdam UMC te Amsterdam, NVVC
- Prof. F. (Francesco) Mattace-Raso, klinisch geriater, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVKG
- Prof. E.P. (Eric) Moll van Charante, huisarts niet praktiserend, huisarts-onderzoeker, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NHG
- L.A.C. (Sanne) Ruigrok MSc, beleidsadviseur, werkzaam bij Harteraad te Den Haag, Harteraad
- Prof. dr. B.K. (Birgitta) Velthuis, radioloog, werkzaam in het UMC Utrecht te Utrecht, NVvR
- Prof. dr. F.L.J. (Frank) Visseren, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
- Dr. Tj. (Tjerk) Wiersma, senior-wetenschappelijk medewerker, werkzaam bij het Nederlands Huisartsen Genootschap te Utrecht, NHG
Betrokken expertisegroepleden bij cyclus 1
- Prof. Dr. B.J.H. (Bert-Jan) van den Born, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NIV
- Dr. J. (Jaap) Deinum, internist-vasculair geneeskundige, Radboud UMC, Nijmegen, NIV
- Dr. M.L. (Louis) Handoko, cardioloog, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NVVC
- Dr. O.W.H. (Olivier) van der Heijden, gynaecoloog-perinatoloog, werkzaam in het Radboud UMC te Nijmegen, NVOG
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- Drs. M. (Marco) Krukerink, huisarts, werkzaam in Huisartsenpraktijk Krukerink & De Wolde te Borne, NHG
- Dr. R.N. (Nils) Planken, radioloog, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NVvR
- Dr. C. (Calin) Popa, reumatoloog, werkzaam in de Sint Maartenskliniek te Nijmegen, NVR
- Dr. J.E. (Jeanine) Roeters van Lennep, internist-vasculair geneeskundige, werkzaam in het Erasmus MC te Rotterdam, NIV
- Dr. P. (Pernette) de Sauvage Nolting, cardioloog, werkzaam in Hartkliniek Rotterdam te Rotterdam, NVVC
- Drs. P. (Paul) Smits, kaderhuisarts hart- en vaatziekten, werkzaam bij De HOEDT-huisartsen te Zoetermeer, NHG
- Dr. M. (Melanie) Tan, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Dr. S.E. (Sarah) Vermeer, neuroloog, werkzaam in het Rijnstate Ziekenhuis te Arnhem, NVN
- Prof. dr. R. (Rozemarijn) Vliegenthart, radioloog, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NVvR
- Dr. A.J. (Bart) Voogel, cardioloog, werkzaam in het Spaarne Gasthuis te Hoofddorp, NVVC
- Dr. M.E. (Janneke) Wittekoek, cardioloog, werkzaam bij Stichting Heartlife klinieken te Utrecht, NVVC
Module Wanneer moet een verhoogde bloeddruk medicamenteus behandeld worden? & Module Streefwaarde bloeddruk bij (kwetsbare) ouderen & Module Bloeddruk streefwaarde bij volwassenen & Module Op welke manier moet een verhoogde bloeddruk behandeld worden?
- Prof. Dr. B.J.H. (Bert-Jan) van den Born, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NIV
- Dr. J. (Jaap) Deinum, internist-vasculair geneeskundige, Radboud UMC, Nijmegen, NIV
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Dr. S.E. (Sarah) Vermeer, neuroloog, werkzaam in het Rijnstate Ziekenhuis te Arnhem, NVN
- Dr. A.J. (Bart) Voogel, cardioloog, werkzaam in het Spaarne Gasthuis te Hoofddorp, NVVC
Met ondersteuning van:
- Dr. W.M. Lijfering, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2023)
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot augustus 2023).
- Dr. N.L. van der Zwaluw, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf april 2023)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen restrictie |
|
Hoes (voorzitter) |
Vice-voorzitter raad van bestuur / decaan, UMC Utrecht |
|
- |
Geen |
|
Smulders |
|
|
- |
Geen |
|
Visseren |
|
Voorzitter van de Task Force of the European Society of Cardiology for the 2021 European guidelines on cardiovascular disease prevention in clinical practice. |
Mede-initiatiefnemer van de U-Prevent website voor gebruik van risico algoritmes in de klinische praktijk. De website is eigendom van ORTEC. Betrokkenheid bestaat uit wetenschappelijk advies. |
Geen |
|
Borst |
Internist ouderengeneeskunde en vasculaire geneeskunde |
Lid Forum visitatorum (vacatievergoeding) |
- |
Geen |
|
Mattace-Raso |
|
2019-today: Aging Clinical and Experimental Research 2015-today: Clinical Interventions in Aging |
- |
Geen |
|
Liem |
Gepensioneerd cadioloog (eerder verbonden aan Franciscus gasthuis Rotterdam tot 31-12-2019)
|
- eerder lid richtlijnencommissie CVRM - eerder lid richtlijncommissie vetstofwisselingsstoornissen - lid Raad van Toezicht WCN (onbetaald) |
2018-2021: vergoeding op uurbasis voor presentaties en adviesraden op het gebied van CVRM Lipiden, antithrombotica, anti-diabetica) en Hartfalen. Deelname aan vele trials vanuit WCN. |
Geen, adviesraden zijn gestaakt gedurende het proces |
|
Martens |
Cardioloog Hoogleraar Preventieve Cardiologie |
Namens de NVVC voorzitter Werkgroep Geneesmiddelen Namens de DCVA voorzitter Commissie Preventie
|
Vergoeding voor presentaties op het gebied van CVRM (lipiden, antitrombotica en anti- diabetica), via bemiddeling bureau’s zoals Medcon, Sam Health, Health Investments, Springer Healthcare, Breau Prevents etc. |
Geen, adviesraden zijn gestaakt sinds lidmaatschap Stuurgroep CVRM |
|
Wiersma |
senior wetenschappelijk medewerker NHG |
- |
- |
Geen |
|
Moll van Charante |
Hoogleraar afdeling Huisartsgeneeskunde (0,5 fte) en afdeling Public & Occupational Health (0,5 fte) Amsterdam UMC. |
van VWS en het Deltaplan Dementie (ontwikkeld i.s.m Movisie, Nivel, Pharos, Trimbos-instituut en Vilans)
|
Betrokken bij de ontwikkeling van een app voor zelfmanagement van risicofactoren voor hartvaatziekten en dementie. Het aandeel van resp. Vital Health Software en Philips Vital Health in deze studie is gefinancierd vanuit een Europese grant. |
Geen |
|
Velthuis |
Radioloog |
|
Vergoedingen als spreker voor Nederlandse Vereniging voor Radiologie (NVvR). Philips research geld voor PhD onderzoeker vanaf 2023 |
Geen |
|
Van der Horst |
Laboratorium specialist klinische chemie en laboratoriumgeneeskunde
|
|
- |
Geen |
|
Ruigrok |
Beleidsadviseur |
Geen |
Geen |
Geen |
Expertisegroep
Module
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen restrictie |
|
Born, van den |
Internist-vasculair geneeskundige, |
|
|
Geen onderzoek betreft onderwerpen die niet in de herziene modules ter sprake komen.
|
|
De Sauvage Nolting |
Cardioloog |
- |
- |
Geen |
|
Deinum |
Internist Radboud UMC Nijmegen |
- |
- |
Geen |
|
Handoko |
Cardioloog |
Medical Lectures Handoko: |
Via Medical Lectures Handoko ontving/ontvang ik sprekersvergoeding / vergoeding voor advieswerk van Novartis, Boehringer Ingelheim, Daiichi Sankyo, Vifor Pharma, AstraZeneca, Bayer, MSD, Quin. |
Geen |
|
Heijden, van der |
Gynaecoloog-perinatoloog |
|
- |
Geen |
|
Konings |
|
Aspirant Directie-lid regionale zorggroep ZIO, betaald |
Schrijver van ECG-leerboek: ECG's beoordelen en begrijpen - De ECG 10+ methode – (royalties) |
Geen |
|
Krukerink |
Huisarts |
Podcastmaker, Huisartspodcast.nl gedeeltelijk betaald door vakblad H&W |
- |
Geen |
|
Planken |
Radioloog Amersterdam UMC, aandachtsgebied cardiovasculaire radiologie |
|
- Consultancy services: Bayer, Hemolens - Speakers fee: Bayer, Kalcio Healthcare |
Geen |
|
Popa |
Reumatoloog |
|
- |
Geen |
|
Roeters van Lennep |
Internist-vasculair geneeskundige |
|
Lokale PI bij verschillende internationale onderzoeken op het gebied van lipidenverlagende medicatie dat gefinancierd wordt door farmaceut. |
Geen |
|
Smits |
Huisarts |
|
- |
Geen |
|
Tan |
Internist-vasculair geneeskundige |
|
- |
Geen |
|
Tjin-A-Ton |
Huisarts - Huisartsenpraktijk Frakking & Tjin-A-Ton (40 uur) |
|
- |
Geen |
|
Vermeer |
Neuroloog Rijnstate |
- |
- |
Geen |
|
Vliegenthart |
Radioloog |
|
|
Geen |
|
Voogel |
Cardioloog Spaarne Gasthuis |
|
- |
Geen |
|
Wittekoek |
|
|
- |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Harteraad in de clusterstuurgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Streefwaarde bloeddruk ouderen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Module |
Uitkomst raming |
Toelichting |
|
Module Streefwaarde bloeddruk volwassenen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de betrokken wetenschappelijke verenigingen en patiëntenorganisaties zijn hier ook andere stakeholders voor benaderd in juni 2021.
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze module is geprioriteerd door het cluster.
Voor de geprioriteerde modules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. R studio (versie 2023.06.0+421) werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie www.gradeworkinggroup.org. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1948-apr. 2016
Engels |
1 (exp Hypertension/ or hypertensi*.ti,ab. or 'blood pressure'.ti,ab. or hbp.ti,ab. or Blood Pressure/) and (Antihypertensive Agents/ or antihypertensi*.ti,ab.) (62711) 2 exp Aged/ or aged.ti. or exp Frail Elderly/ or "Aged, 80 and over"/ or exp Aging/ or exp Geriatric Assessment/ or (elderly or geriatric or 'community dwelling' or frail* or ag?ing or septuagenarian* or octogenarian* or nonagenarian* or centenarian* or 'old people' or eldest or oldest or "biological age").ti,ab. (2834312) 3 1 and 2 (19119) 4 limit 3 to english (16115) 15 *Reference Values/ or (target* or threshold or (reference adj2 value*)).ab. /freq=2 or (goal* or target* or (reference adj2 value*)).ti. or intensi*.ti,ab. or ((pressure or BP) adj3 goal*).ab. /freq=2 or (elderly or "very old" or "oldest old" or "80 years").ti. (1054271) 16 4 and 15 (2710) 17 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (275361) 18 16 and 17 (98) 19 (randomized controlled trial/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or randomized controlled trial.pt. or random*.ti,ab. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (991935) 20 16 and 19 (1044) 21 20 not 18 (978) |
1491 |
|
Embase (Elsevier) |
'aged'/exp/mj OR 'geriatric assessment'/exp/mj OR aged:ti OR elderly:ab,ti OR geriatric*:ab,ti OR 'community dwelling':ab,ti OR frail*:ab,ti OR ageing:ab,ti OR aging:ab,ti OR septuagenarian*:ab,ti OR octogenarian*:ab,ti OR nonagenarian*:ab,ti OR centenarian*:ab,ti OR 'old people':ab,ti OR eldest:ab,ti OR oldest:ab,ti OR 'biological age' OR (individual NEAR/2 (patient* OR participant*) NEAR/2 data*):ab,ti
AND (english)/lim AND (embase)/lim
AND ('hypertension'/exp/mj OR 'blood pressure'/exp/mj OR hypertensi*:ab,ti OR 'blood pressure':ab,ti OR hbp:ab,ti) AND ('antihypertensive agent'/exp/mj OR antihypertensi*:ab,ti)
AND ('reference value'/exp OR goal*:ti OR target*:ti OR threshold:ti OR (reference NEAR/2 value*):ti OR intensi*:ab,ti OR elderly:ti OR 'very old':ti OR 'oldest old':ti OR '80 years':ti)
'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)
AND ('randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it (77)
'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) (658) |
Algemene informatie
|
Richtlijn: Cluster CVRM |
|
|
Uitgangsvraag: UV 3.2 en 3.3. Welke streefwaarden dienen te worden gehanteerd bij behandeling van verhoogde bloeddruk? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 29-3-2022 |
|
Periode: 2016- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: In overleg met de adviseur wordt besloten om UV 3.2 (kwetsbare ouderen) en UV 3.3 te combineren omdat er voor ca. 80% overlap is. Onderstaande Cochrane reviews worden als uitgangspunt gebruikt en worden aangevuld met de meest recente RCTs vanaf 2016. Er wordt gezocht met de volgende elementen: Hypertensie EN streefwaarden EN cardiovasculair risico EN antihypertensieve therapie. Alle sleutelartikelen worden gevonden in de basisset. Uiteindelijk wordt 1 artikel uit 2011 gemist vanwege de tijdslimiet.
Cochrane reviews Blood pressure targets in adults with hypertension Blood pressure targets for the treatment of people with hypertension and cardiovascular disease Blood pressure targets for hypertension in older adults
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 29-3-2022 met relevante zoektermen gezocht naar RCTs over de streefwaarden bij behandeling verhoogde bloeddruk. De literatuurzoekactie leverde 998 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
|
|
|
|
RCTs |
640 |
601 |
998 |
|
Observationele studies |
|
|
|
|
Overig |
|
|
|
|
Totaal |
|
|
998 |
Embase
|
No. |
Query |
Results |
|
#22 |
#13 NOT #12 RCT |
640 |
|
#21 |
#6 AND #20 sleutelartikelen gevonden |
3 |
|
#20 |
#16 OR #17 OR #18 OR #19 |
4 |
|
#19 |
effects AND of AND blood AND pressure AND lowering AND on AND outcome AND incidence AND in AND hypertension AND thomopoulos AND 2016 NOT treatment:ti |
1 |
|
#18 |
blood AND pressure AND lowering AND for AND prevention AND of AND cardiovascular AND disease AND death AND ettehad NOT european AND heart AND journal |
1 |
|
#17 |
a AND randomized AND trial AND of AND intensive AND versus AND standard AND 'blood pressure' AND control. AND 2015 AND wright NOT final:ti |
1 |
|
#16 |
the AND effects AND reduction AND of AND different AND 'pressure lowering' AND regimens AND on AND major AND cardiovascular AND events AND according AND to AND baseline AND blood AND pressure AND huxley AND 2011 |
1 |
|
#15 |
blood AND pressure AND targets AND for AND the AND treatment AND of AND people AND with AND hypertension AND cardiovascular AND disease AND saiz AND 2020 |
1 |
|
#14 |
#6 AND #11 |
2116 |
|
#13 |
#6 AND #8 |
821 |
|
#12 |
#6 AND #7 |
169 |
|
#11 |
#9 OR #10 |
14700940 |
|
#10 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
12982450 |
|
#9 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6974259 |
|
#8 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1891965 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
810492 |
|
#6 |
#5 AND [1-1-2016]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
2838 |
|
#5 |
#1 AND #2 AND #3 AND #4 |
11674 |
|
#4 |
'cardiovascular disease'/exp/mj AND ('prevention'/exp OR 'risk reduction'/exp OR prevent*:ti,ab,kw OR risk*:ti,kw) OR 'cardiovascular risk'/exp OR (((cardiovascular OR 'heart disease*') NEAR/3 risk*):ti,ab,kw) |
741126 |
|
#3 |
'antihypertensive agent'/exp OR 'antihypertensive therapy'/exp OR antihypertensi*:ti,kw OR 'anti hypertensi*':ti,kw |
837636 |
|
#2 |
'blood pressure regulation'/exp OR 'reference value'/exp OR (('blood pressure' NEAR/3 (control OR baseline* OR standard* OR level* OR regulati* OR target* OR reference OR threshold)):ti,ab,kw) OR 120:ti,ab,kw OR 130:ti,ab,kw OR 135:ti,ab,kw OR 140:ti,ab,kw OR 150:ti,ab,kw OR (((goal? OR intensive* OR strict* OR target* OR tight*) NEAR/4 (antihypertensive? OR hypertensive? OR bp OR dbp OR diastolic OR pressure? OR sbp OR systolic OR treat*)):ti,ab,kw) |
1435670 |
|
#1 |
'hypertension'/exp OR 'blood pressure'/exp OR hypertens*:ti,ab,kw OR 'blood pressure':ti,ab,kw |
1577203 |
Ovid/Medline
|
# |
Searches |
Results |
|
11 |
9 not 10 RCT |
601 |
|
10 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
555509 |
|
9 |
7 and 8 RCT |
773 |
|
8 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1362761 |
|
7 |
6 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
2625 |
|
6 |
limit 5 to yr="2016 -Current" |
2719 |
|
5 |
1 and 2 and 3 and 4 |
9575 |
|
4 |
(exp Cardiovascular Diseases/ and (Primary Prevention/ or Secondary Prevention/ or Risk Reduction Behavior/ or prevent*.ti,ab,kf. or risk*.ti,ab,kf.)) or exp Heart Disease Risk Factors/ or ((cardiovascular or heart disease*) adj3 risk*).ti,ab,kf. |
637071 |
|
3 |
exp Antihypertensive Agents/ or (antihypertensive or anti hypertensive).ti,ab,kf. |
288685 |
|
2 |
Reference Values/ or (blood pressure adj3 (control or baseline* or standard* or level* or regulati* or target* or reference or threshold)).ti,ab,kf. or "120".ti,ab,kf. or "130".ti,ab,kf. or "135".ti,ab,kf. or "140".ti,ab,kf. or "150".ti,ab,kf. or ((goal? or intensive* or strict* or target* or tight*) adj4 (antihypertensive? or hypertensive? or bp or dbp or diastolic or pressure? or sbp or systolic or treat*)).ti,ab,kf. |
1187049 |
|
1 |
exp Hypertension/ or exp Blood Pressure/ or hypertens*.ti,ab,kf. or blood pressure.ti,ab,kf. |
848734 |