Preoperatieve antibiotica bij borstprothesechirurgie
Uitgangsvraag
Wat is de plaats van profylactisch antibioticagebruik bij het plaatsen van borstprotheses?
Aanbeveling
Geef perioperatief eenmalig cefazoline (iv.) bij een mamma-augmentatie met prothese, namelijk 1000 mg bij ingrepen korter dan 60 minuten en 2000 mg bij ingrepen langer dan 60 minuten.
Geef perioperatief eenmalig clindamycine (iv.) bij een mamma-augmentatie met prothese, namelijk 600 mg als de vrouw allergisch is voor cefazoline.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de beschikbare literatuur is het onduidelijk of antibioticaprofylaxe de kans op een infectie van een prothese na een mamma-augmentatie verlaagt vergeleken met geen gebruik van antibioticaprofylaxe. Ook is het onduidelijk of langdurend antibioticagebruik de kans op een infectie verlaagt vergeleken met kortdurend antibiotica gebruik. Er waren geen studies die verschillende antibiotica met elkaar vergeleken en er was geen informatie beschikbaar over het effect van antibioticaprofylaxe op heroperaties of het verwijderen van de prothese.
De overall bewijskracht is zeer laag. Dit komt doordat de conclusies zijn gebaseerd op observationele studies. Deze studies rapporteerden ruwe data en corrigeerden niet voor confounding. Daarnaast was er een zeer gering aantal events (imprecisie), waardoor de bewijskracht op zeer laag uitkomt. Er ligt hier een kennislacune, die mogelijk beantwoord kan worden door een gerandomiseerd onderzoek. Echter, is de incidentie van infecties laag, waardoor er een grote studiepopulatie nodig zal zijn om dit vraagstuk te beantwoorden.
In settings met lage infectiepercentages is de toegevoegde waarde van peri-operatieve antibiotica om infecties te voorkomen waarschijnlijk beperkt of verwaarloosbaar. Het is echter de vraag of de centra die deelnamen aan de gepubliceerde studies representatief zijn voor het geheel aan klinieken dat protheses plaatst. Het is mogelijk dat in situaties met een hoger risico op infectie er wel een significant preventief effect is van peri-operatieve antibioticaprofylaxe.
Hoewel de incidentie van postoperatieve infecties na een mamma-augmentatie in de beschikbare literatuur laag is (0,25% tot 1,2%), zijn de consequenties van een infectie bij een borstprothese zoals heropname, langdurige antibioticagebruik of heroperatie belastend. Vanwege het gebrek aan bewijs in de beschikbare literatuur voor het gebruik van antibioticaprofylaxe bij mamma-augmentaties sluit de werkgroep zich aan bij de adviezen in de SWAB richtlijn peri-operatieve profylaxe (2019). Hier wordt het advies gegeven om bij schone procedures waarbij protheses worden ingebracht, eenmalig perioperatief cefazoline intraveneus (iv.) toe te dienen. De dosering is afhankelijk van de duur van de ingreep, namelijk 1000 mg bij ingrepen korter dan 60 minuten en 2000 mg bij ingrepen langer dan 60 minuten.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De vrouw ondervindt weinig nadeel bij een eenmalige perioperatieve intraveneuze toediening van antibiotica. Hiervoor hoeven geen extra medische handelingen worden uitgevoerd, want voor de inductie van anesthesie is een infuus al noodzakelijk. Daarnaast wordt de ligduur hierdoor niet verlengd. In het kader van een antibiotica-allergie geeft de SWAB richtlijn peri-operatieve profylaxe (2019) alternatieven aan. Bijwerkingen van antibiotica worden over het algemeen ervaren bij orale inname en niet bij intraveneuze toediening.
De aanbeveling vanuit de SWAB richtlijn wordt gerechtvaardigd geacht ondanks de afwezigheid van voldoende bewijs voor antibioticaprofylaxe bij mamma-augmentaties, aangezien de vrouw weinig nadeel ervaart bij een eenmalige intraveneuze toediening van antibiotica rondom de operatie, terwijl niet uit te sluiten valt dat er in bepaalde settings met hogere infectiepercentages mogelijk wel een infectie mee wordt voorkomen.
Kosten (middelenbeslag)
Kosten eenmalig antibiotica perioperatief:
De gemiddelde kosten van eenmalig perioperatieve intraveneuze antibiotica zijn €2,96 per injectie van 1000 mg cefazoline. Bij ingrepen langer dan 60 minuten wordt er 2000 mg aanbevolen en zijn de kosten dus €5,92 (Farmacotherapeutisch Kompas).
Kosten kortdurend antibioticagebruik (24 uur)
Bij kortdurend antibioticagebruik wordt er 2000 mg cefazoline (iv.) bij inductie gegeven en aanvullend twee doseringen van 1000 mg binnen 24 uur. Dit zijn dus vier doseringen van 1000 mg cefazoline, waarvan de kosten €11,84 zijn (Farmacotherapeutisch Kompas).
Kosten langdurend antibioticagebruik (5 dagen/ 7 dagen)
Bij langdurend antibioticagebruik worden tabletten amoxicilline-clavulaanzuur gegeven. De gemiddelde prijs per tablet amoxicilline-clavulaanzuur van 500/125 mg is €2,06 euro. Met drie doseringen per dag gedurende vijf dagen bedragen de kosten €30,90, voor zeven dagen bedragen de kosten €43,26 (Farmacotherapeutisch Kompas).
Mamma-augmentaties worden over het algemeen in twee settings gedaan, namelijk in een privé kliniek waarbij de vrouw dezelfde dag wordt ontslagen en naar huis gaat en in een ziekenhuis waarbij de vrouw over het algemeen één nacht in het ziekenhuis blijft. Toediening van 24 uur iv. antibiotica gebruik zou voor sommige vrouwen een verlengde ziekenhuisopname betekenen. Een verlengde kuur orale antibiotica heeft geen invloed op de opnameduur maar brengt potentieel wel vervelende bijwerkingen met zich mee en een groter risico op resistentieontwikkeling van bacteriën.
De extra kosten van eenmalig perioperatieve antibiotica zijn dermate laag in verhouding tot de kosten van een heropname, heroperatie of langdurig antibioticagebruik, dat deze acceptabel worden geacht ook in afwezigheid van bewijs van effectiviteit.
Aanvaardbaarheid voor de overige relevante stakeholders
De werkgroep voorziet geen bezwaren vanuit overige relevante stakeholders, omdat de aanbeveling aansluit bij de huidige SWAB richtlijn peri-operatieve profylaxe (2019).
Haalbaarheid en implementatie
Het feit dat er voldoende bewijs ontbreekt in de huidige literatuur uit zich in de variatie waarmee plastische chirurgen momenteel wel of geen antibiotica voorschrijven rondom mamma-augmentaties, variërend van geen antibioticagebruik tot perioperatief antibioticaprofylaxe (iv.) gevolgd door 7 dagen orale inname.
In principe geeft de voorgestelde aanbeveling geen problemen met zich mee om het gebied van implementatie of de haalbaarheid hiervan. Het betreft één handeling, het toedienen van antibiotica (iv.) bij de inductie van de anesthesie. De werkgroep voorziet geen bezwaren vanuit andere collega´s.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Op basis van de beschikbare literatuur is het onduidelijk of antibioticaprofylaxe de kans op een infectie van een prothese na een mamma-augmentatie verlaagt vergeleken met geen gebruik van antibioticaprofylaxe. De overall bewijskracht hiervoor is zeer laag.
Vanwege het gebrek aan bewijs sluit de werkgroep zich aan bij de adviezen in de SWAB richtlijn peri-operatieve profylaxe (2019). De aanbeveling vanuit de SWAB richtlijn wordt gerechtvaardigd geacht ondanks de afwezigheid van voldoende bewijs voor antibioticaprofylaxe bij mamma-augmentaties, aangezien de vrouw weinig nadeel ervaart bij een eenmalige intraveneuze toediening van antibiotica rondom de operatie. De extra kosten van eenmalig perioperatieve antibiotica zijn dermate laag in verhouding tot de kosten van een heropname, heroperatie of langdurig antibioticagebruik, dat deze acceptabel worden geacht ook in afwezigheid van bewijs van effectiviteit. In principe geeft de voorgestelde aanbeveling geen problemen met zich mee op het gebied van implementatie of de haalbaarheid hiervan. Het betreft één handeling, het toedienen van antibiotica (iv.) bij de inductie van de anesthesie. De werkgroep voorziet geen bezwaren vanuit andere collega´s.
Onderbouwing
Achtergrond
De praktijkvariatie rondom het gebruik van profylactische antibiotica bij het plaatsen van een borstprothese is groot, omdat duidelijke richtlijnen ontbreken: niet iedere plastisch chirurg gebruikt antibiotische profylaxe, en bij hen die het wel gebruiken bestaat er variatie in keuze van het middel, dosering, toedieningsweg en duur van de profylaxe. Zowel het toedienen van profylaxe als het niet toedienen van profylaxe zou potentieel kunnen leiden tot risico’s voor de vrouw, zoals een grotere kans op infectie van de prothese of bijwerkingen van het antibioticagebruik.
In deze module wordt het wetenschappelijk bewijs voor het gebruik van antibiotica profylaxe rondom esthetische borstprothese chirurgie geanalyseerd: wel antibioticaprofylaxe versus geen antibioticaprofylaxe, en langdurig gebruik (> 24 uur) versus kortdurend (<24 uur) of eenmalig. De potentiële voor- en nadelen van (langdurige) antibiotica profylaxe zullen worden afgewogen.
Conclusies / Summary of Findings
PICO 1 - kortdurend versus langdurend antibiotica gebruik
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van langdurig antibioticagebruik (> 24 uur) in vergelijking met kortdurend antibioticagebruik (max. 24 uur), bij het plaatsen van borstprotheses omwille van een augmentatie, op de kans op het ontwikkelen van een infectie.
Bronnen: (Mirzabeigi, 2012; Khan, 2010) |
|
- GRADE |
Vanwege het ontbreken van studies waarin kortdurend antibioticagebruik (max. 24 uur) rondom de operatie bij het plaatsen van borstprotheses omwille van een augmentatie wordt vergeleken met langdurig antibioticagebruik (>24 uur) en gerapporteerd wordt over heroperatie of verwijderen van de prothese was het niet mogelijk om een conclusie te trekken voor deze uitkomstmaten. |
PICO 2 – wel of geen antibiotica gebruik
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van het gebruik van antibiotica rondom de operatie op de kans op een infectie van de prothese na het plaatsen van borstprotheses omwille van een augmentatie.
Bronnen: (Keramidas, 2016; LeRoy, 1991) |
|
- GRADE |
Vanwege het ontbreken van studies waarin antibioticagebruik rondom het plaatsen van borstprotheses omwille van een augmentatie wordt vergeleken met geen antibioticagebruik en gerapporteerd wordt over heroperatie of verwijderen van de prothese, was het niet mogelijk om een conclusie te trekken voor deze uitkomstmaten. |
Samenvatting literatuur
Beschrijving studies
Er werd één systematisch review geïncludeerd (Huang, 2015), deze resultaten werden aangevuld met één aanvullende studie (Keramidas, 2016) gepubliceerd na de zoek datum van de systematische review.
De systematische review van Huang (2015) includeerde studies die verschillende antibioticaprofylaxe-protocollen vergeleken of antibioticaprofylaxe vergeleek met een controlegroep bij het plaatsen van een borstprothese om cosmetische redenen of vanwege een reconstructie na een mammacarcinoom. Daarnaast moesten de studies uitkomstmaten rapporteren over de infectiegraad en/of de mate van kapselcontractie. Artikelen werden geëxcludeerd wanneer er geen borstprotheses waren ingebracht bij de operatie, zoals bij een borstverkleining, het een retrospectief cohort studie betrof zonder controlegroep, antibiotica voor behandelingsdoeleinden werden gebruikt in plaats van als profylaxe, het aantal vrouwen met een infectie en/of de mate van kapselcontractie niet duidelijk werd vermeld in de studie en wanneer studies alleen risicopatiënten includeerden, zoals patiënten met eerdere radiotherapie. In totaal werden er dertien studies geïncludeerd in de systematische review, waarvan er vier voldeden aan de PICO’s voor deze literatuursamenvatting. De overige studies werden geëxcludeerd, omdat ze vrouwen includeerden die een borstreconstructie hadden ondergaan. Van deze vier studies waren er drie retrospectieve cohort studies (Mirzabeigi,2012; Khan, 2010; LeRoy,1991) en één een prospectieve cohort studie (Gylbert, 1990).
Mirzabeigi (2012) vergeleek perioperatieve antibiotica plus postoperatieve antibiotica gedurende drie dagen met alleen perioperatieve antibiotica. Hiervoor werden 127 vrouwen geïncludeerd in de interventiegroep (peri- en post-) en 130 in de controlegroep (peri-). Het antibioticum dat primair werd gebruikt als interventie was een intraveneuze dosis van één gram cefalosporine, 60 minuten voor de eerste incisie. De uitkomstmaat infectie werd gedefinieerd als een positieve bacteriekweek. Wanneer een steriele kweek niet mogelijk was, werden er ook klinische indicatoren van een infectie gebruikt, zoals pijn, erytheem, koorts, leukocyten en/of een andere lokale inflammatoire respons symptomatologie.
Khan (2010) vergeleek perioperatieve antibiotica plus postoperatieve antibiotica gedurende vijf dagen met alleen perioperatieve antibiotica. Hiervoor werden 1.219 vrouwen geïncludeerd in de interventiegroep (peri- en post-) en 409 vrouwen in de controlegroep (peri-). De interventie bestond uit een eenmalige intraveneuze dosis cefalosporine plus een orale kuur voor vijf dagen. De controle behandeling bestond uit of een eenmalige intraveneuze dosis cefalosporine of een eenmalige intraveneuze dosis cefalosporine met een orale kuur voor een tijdsbestek van 24 uur. De uitkomstmaat infectie werd klinisch vastgesteld door de aanwezigheid van pijn, afscheiding, zwelling en roodheid van de borsten.
LeRoy (1991) vergeleek het gebruik van perioperatieve plus postoperatieve antibiotica met geen antibioticagebruik. Hiervoor werden 60 vrouwen geïncludeerd in de interventiegroep (peri- en post-) en 132 in de controlegroep (geen antibiotica). De interventie bestond uit een eenmalige intraveneuze toediening van cefalosporine met een orale kuur van ten minste 24 uur. Een definitie van de uitkomstmaat infectie werd niet gerapporteerd.
Gylbert (1990) vergeleek perioperatieve antibiotica met een placebo. Hiervoor werden 38 vrouwen geïncludeerd in de interventiegroep en 34 in de controlegroep. De interventie bestond uit een intraveneuze toediening van 20 mL benzylpenicilline en 20 mL dicloxacilline opgelost in 500 mL fysiologisch zoutoplossing, één uur voor de operatie. De controle bestond uit een intraveneuze toediening van 40 mL steriel water in 500 mL fysiologisch zoutoplossing, één uur voor de operatie. Een positieve bacteriekweek van een aerobe of anaerobe bacterie werd gebruikt als een proxy voor de uitkomstmaat infectie. Resultaten van de uitkomstmaat infectie werd gerapporteerd per borst in plaats van per vrouw.
De aanvullende prospectieve cohort studie (Keramidas, 2016) vergeleek het effect van antibiotica profylaxe met een controlegroep op de incidentie van infectie en kapselcontractuur na een primaire bilaterale borstvergroting.
De interventie bestond uit een eenmalige intraveneuze dosis van cefalosporine tijdens de inductie van de narcose. Het gekozen antibioticum was 750 mg cefuroxim zoals vermeld stond in de algemene richtlijn. De controlegroep kreeg geen antibioticum toegediend.
In totaal werden er 90 vrouwen geïncludeerd in de interventiegroep en 90 vrouwen in de controlegroep. De gemiddelde leeftijd was 31 jaar (range 21 tot 45) in de interventiegroep en 29 jaar (range 19 tot 45) in de controlegroep was. Verder was de gemiddelde body mass index in beide groepen 26 en waren er in de interventiegroep 13 vrouwen die tussen de 14 en 20 sigaretten rookten per dag en in de controlegroep 15 vrouwen die tussen de 2 en 21 sigaretten rookten per dag. De cohort werd voor één jaar gevolgd.
Resultaten
PICO 1 - kortdurend versus langdurend antibiotica gebruik
1. Infectie van de prothese
De uitkomstmaat “infectie van prothese” werd gerapporteerd in twee studies. 14 van de 1.346 vrouwen (1%) in de interventiegroep en 4 van de 539 vrouwen (0,7%) in de controlegroep kreeg een infectie (risico verschil -0,00, 95% betrouwbaarheidsinterval (BI) -0,04 tot 0,03). Dit is geen klinisch relevant verschil.
Figuur 1 Infectie van prothese bij kortdurende versus langdurende antibiotica in volwassen vrouwen
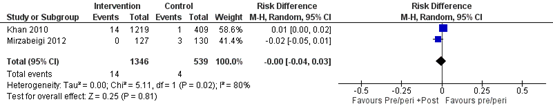
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
2. Heroperatie vanwege infectie
Geen enkele studie heeft de uitkomstmaat “heroperatie vanwege infectie” gerapporteerd.
3. Heroperatie (elke reden)
Geen enkele studie heeft de uitkomstmaat “heroperatie (elke reden)” gerapporteerd.
4. Verwijderen van prothese vanwege infectie
Geen enkele studie heeft de uitkomstmaat “verwijderen van prothese vanwege infectie” gerapporteerd.
5. Verwijderen van de prothese (elke reden)
Geen enkele studie heeft de uitkomstmaat “verwijderen van de prothese (elke reden)” gerapporteerd.
PICO 2 - wel versus geen antibiotica gebruik
1. Infectie van de prothese
De uitkomstmaat “infectie van prothese” werd in de systematische review van Huang (2015) en in de studie van Keramidas (2016) gerapporteerd. In totaal werden 150 vrouwen geïncludeerd in de interventiegroep en 222 vrouwen in de controlegroep. Het risicoverschil was -0,01 (95% BI -0,04 tot 0,01) in het voordeel van de interventiegroep. Dit verschil is niet klinisch relevant.
Figuur 2 Infectie van prothese bij wel of geen gebruik van antibiotica in volwassen vrouwen
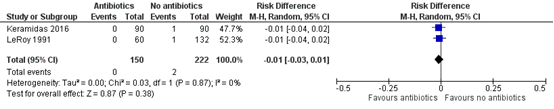
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Verder rapporteerde Gylbert (1990) het aantal borsten met een aerobe of anaerobe bacterie. Resultaten werden gerapporteerd per borst en niet per vrouw. In de interventiegroep werd in 5 van de 76 borsten (6,6%) een bacterie gevonden en in de controlegroep werd in 54 van de 68 borsten (79,4%) een bacterie gevonden. Er werd een risicoverschil van 73% gevonden met een betrouwbaarheidsinterval van 62% tot 84%, in het voordeel van de interventie.
2. Heroperatie vanwege infectie
Geen enkele studie heeft de uitkomstmaat “heroperatie vanwege infectie” gerapporteerd.
3. Heroperatie (elke reden)
Geen enkele studie heeft de uitkomstmaat “heroperatie (elke reden)” gerapporteerd.
4. Verwijderen van prothese vanwege infectie
Geen enkele studie heeft de uitkomstmaat “verwijderen van prothese vanwege infectie” gerapporteerd.
5. Verwijderen van de prothese (elke reden)
Geen enkele studie heeft de uitkomstmaat “verwijderen van de prothese (elke reden)” gerapporteerd.
Bewijskracht van de literatuur
PICO 1 - kortdurend versus langdurend antibiotica gebruik
De bewijskracht voor de uitkomstmaat “infectie van prothese” is afkomstig uit een observationele studie en begint zodoende op laag. De bewijskracht is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (geen correctie voor confounding) en het zeer geringe aantal events (imprecisie). De bewijskracht komt uiteindelijk uit op zeer laag.
Vanwege het ontbreken van studies die de uitkomsten “heroperatie vanwege infectie”, “heroperatie (elke reden)”, “verwijderen van prothese vanwege infectie” en “verwijderen van de prothese (elke reden)” rapporteren is de bewijskracht voor de uitkomsten “heroperatie vanwege infectie”, “heroperatie (elke reden)”, “verwijderen van prothese vanwege infectie” en “verwijderen van de prothese (elke reden)” rapporteren, kon de bewijskracht niet gegradeerd worden.
PICO 2 - wel of geen antibiotica gebruik
De bewijskracht voor de uitkomstmaat “infectie van prothese” is afkomstig uit een observationele studie en begint zodoende op laag. De bewijskracht is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (geen correctie voor confounding) en het zeer geringe aantal events (imprecisie). De bewijskracht komt uiteindelijk uit op zeer laag.
Vanwege het ontbreken van studies die de uitkomsten “heroperatie vanwege infectie”, “heroperatie (elke reden)”, “verwijderen van prothese vanwege infectie” en “verwijderen van de prothese (elke reden)” rapporteren is de bewijskracht voor de uitkomsten “heroperatie vanwege infectie”, “heroperatie (elke reden)”, “verwijderen van prothese vanwege infectie” en “verwijderen van de prothese (elke reden)” rapporteren, kon de bewijskracht niet gegradeerd worden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
1. Wat zijn de (on)gunstige effecten van antibioticagebruik rondom de operatie bij het plaatsen van borstprotheses omwille van een augmentatie in vergelijking met geen antibiotica gebruik?
P: volwassen vrouwen zonder geschiedenis van mammacarcinoom bij wie borstprotheses zijn geplaatst omwille van een augmentatie;
I: antibioticagebruik tijdens de plaatsing van de prothese (intraveneus binnen een uur tot aan de incisie, indien oraal in principe 2 uur voor operatie);
C: geen antibioticagebruik of placebo;
O: infectie van de prothese, heroperatie vanwege infectie, heroperatie (elke reden), verwijderen van prothese vanwege infectie, verwijderen van de prothese (elke reden).
2. Wat zijn de (on)gunstige effecten van kortdurend antibioticagebruik (max. 24 uur) rondom de operatie bij het plaatsen van borstprotheses omwille van een augmentatie in vergelijking met langdurig antibioticagebruik van > 24 uur?
P: volwassen vrouwen zonder geschiedenis van mammacarcinoom bij wie borstprotheses zijn geplaatst omwille van een augmentatie;
I: kortdurend antibioticagebruik (<24 uur) tijdens de plaatsing van de prothese (intraveneus binnen een uur tot aan de incisie, indien oraal in principe 2 uur voor operatie);
C: langdurend antibioticagebruik (> 24 uur) tijdens de plaatsing van de prothese (intraveneus binnen een uur tot aan de incisie, indien oraal in principe 2 uur voor operatie);
O: infectie van de prothese, heroperatie vanwege infectie, heroperatie (elke reden), verwijderen van prothese vanwege infectie, verwijderen van de prothese (elke reden).
Relevante uitkomstmaten
De werkgroep achtte infectie van de prothese een voor de besluitvorming cruciale uitkomstmaat; en heroperatie vanwege infectie, heroperatie (elke reden), verwijderen van prothese vanwege infectie, verwijderen van de prothese (elke reden) voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep hanteerde de onderstaande grenzen voor klinische relevantie en vergeleek de resultaten met deze grenzen: RR < 0,80 of > 1,25) (GRADE recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Elsevier) is op 22 mei 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd onderzoek in het Engels vanaf 1980. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuur zoekactie leverde 450 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: vergelijkend (observationeel of gerandomiseerd) onderzoek naar het antibiotica gebruik tijdens de plaatsing van een prothese bij volwassen vrouwen zonder geschiedenis van mammacarcinoom bij wie vanwege cosmetische redenen een borstprothese is geplaatst. Op basis van titel en abstract werden in eerste instantie 69 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 67 studies geëxcludeerd (zie exclusie tabel onder het tabblad Verantwoording), en 2 studies definitief geselecteerd.
Resultaten
Twee onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studie karakteristieken en resultaten zijn opgenomen in de evidence tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-bias tabellen.
Referenties
- Huang, N., Liu, M., Yu, P., & Wu, J. (2015). Antibiotic prophylaxis in prosthesis-based mammoplasty: a systematic review. International Journal of Surgery, 15, 31-37.
- Farmacotherupeutisch Kompas (cited 2019 Aug 29) Available from: https://www.farmacotherapeutischkompas.nl/
- Keramidas, E., Lymperopoulos, N. S., & Rodopoulou, S. (2016). Is antibiotic prophylaxis in breast augmentation necessary? A prospective study. Plastic Surgery, 24(3), 195-198.
- SWAB (2019) SWAB Richtlijn Peri-operatieve profylaxe. (cited 2019 Aug 29) Available from: https://www.swab.nl/.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account8
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Huang, 2015 |
Yes; The purpose of this systematic review was to synthesis the current evidence on both systemic and topical antibiotic prophylaxis in prosthesis-based breast surgery. By comparing postoperative complications such as SSI and CC, we verified that extended systemic antibiotic prophylaxis and topical antibiotic irrigation were beneficial for patients underwent prosthesis-based breast surgery. |
Yes |
No, no reference of excluded studies |
Yes |
No, no adjustment was performed in the individual studies |
Yes |
No, antibiotic regimens differ among studies |
Yes |
Systematic review: Yes Included studies: unclear |
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Keramidas, 2016 |
Unlikely |
Unclear, number of patients loss to follow-up is not reported. |
Unlikely |
Likely |
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Huang, 2015
|
SR and meta-analysis of RCTs and cohort studies
Literature search up to June 2014
A: Mirzabeigi, 2012 B: Khan, 2010 C: LeRoy, 1991 D: Gylbert, 1990
Study design: Prospecitve double-blind RCT, Retrospective CT, Retrospective RCT
Source of funding and conflicts of interest: None
|
Inclusion criteria SR: (1) Patients who underwent breast surgery in which prosthesis were involved, including aesthetic augmentation and reconstructive mammoplasty; (2) Both prospective and retrospective studies were included; (3) Intervention group and control group had different antibiotic prophylaxis regimens including placebo and blank control. Antibiotics could be used as systemic or topical; (4) Study outcome demonstrated infection rate and/or capsule contracture rate.
Exclusion criteria SR: (1) Studies that did not involve breast prosthesis, such as breast reduction; (2) Retrospective studies that did not have a control group; (3) Antibiotics for treatment purpose but not prophylaxis purpose; (4) The number of patients who developed infection and/ or capsule contracture was not clearly stated in the study; (5) Studies that included high-risk patients only, such as patients with previous radiotherapy.
4 studies included
Important patient characteristics at baseline: Number of patients A: I: 127 patients C: 130 patients
B: I: 1219 patients C: 409 patients
C: I: 60 patients C: 132 patients D: I: 38 patients C: 34 patients
Age, years (range) A: I: 37,4 C: 36,8
B: I: NR C: NR
C: I: 32 (18-50) C: 28 (18-55)
D: I + C: 33 (19-55)
Groups comparable at baseline? Unclear |
Describe intervention:
A: Pre + postoperative 3 d (Cefazolin/clindamycin/ciprofloxacin/azithromycin)
B: Peri + postoperative 5 d (Cephalosporin + oral 5 days)
C: Pre + postoperative (Cephalosporin + oral >24h)
D: Preoperative (20 mL benzylpenicillin + 20 mL dicloxacillin) |
Describe control:
A: Preoperative
B: Perioperative (Cephalosporin / Cephalosporin + oral <24h)
C: None
D: Placebo (40 mL sterile water)
|
End-point of follow-up:
A: 6-42 months B: NR C: 1.5 – 36 months D: 12 months (median follow-up time)
For how many participants were no complete outcome data available? Not reported
|
1. Infection of prosthetic
Effect measure: RD (95% CI): A: -0.02 (-0.05, 0.01) B: 0.01 (0.00,0.02) C: -0.01 (-0.04, 0.02) D: Not reported
2. Reoperation due to infection Not reported
3. Reoperation (due to any reason) Not reported
4. Removal of the prosthetic due to infection Not reported
5. Removal of the prosthetic (due to any reason) Not reported
|
Facultative:
Brief description of author’s conclusion: Our review demonstrates that extended systemic antibiotic prophylaxis (24 h postoperatively) will significantly reduce SSI risk, especially in implant breast reconstruction. Topical antibiotic irrigation would decrease CC risk, while might not be able to reduce infection rate. Cephalosporin is generally recommended as antibiotic prophylactic regimen which covers the most commonly identified implant-associated bacteria. Risk factors such as chest irradiation and diabetes should be take into consideration when prescribing antibiotic prophylaxis.
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Keramidas, 2016 |
Type of study: Prospective cohort study
Setting and country: Not reported
Funding and conflicts of interest: The authors have no financial disclosures or conflicts of interest to declare. |
Inclusion criteria: underwent primary bilateral breast augmentation from September 2004 to November 2010 who consented
Exclusion criteria: Patients with diabetes, peripheral vascular disease, paraplegia and previous breast surgery
N total at baseline: Intervention: 90 Control: 90
Important prognostic factors2: Age, mean (range): I: 31 (21 – 45) C: 29 (19 – 45)
Body mass index, kg/m2, mean: I: 26 C: 26
Smokers. Cigarettes/day, n (range): I: 13 (14-20) C: 15 (12 – 21)
Implant volume, mL, mean (range): I: 270 (200 – 375) C: 290 (200 – 400)
Groups were comparable at baseline. Yes. |
Describe intervention: Only one dose of cephalosporin was given during the induction of general anesthesia. The antibiotic of choice was 750 mg of cefuroxime as common guidance.
|
Describe control: No antibiotics were given;
|
Length of follow-up: 1 year
Loss-to-follow-up: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Wound infection, n: I: 0 C: 1
Implant infection, n: I: 0 C: 0
Hematoma, n: I: 0 C: 0
Capsular contracture, n: I: 0 C: 0
|
Authors conclusion: The number of patients who underwent primary breast augmentation without antibiotics (n=90) was insufficient to draw any definitive conclusions. However, the present prospective study demonstrated that prophylactic use of antibiotics in breast augmentation had no significant effect on infection and capsular contracture rates. Further randomized clinical trials, in combination with guidelines from aesthetic plastic surgery societies, appear to be warranted. |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Gigliofiorito, 2014 |
Reactie op Hardwicke (2013) |
|
Hardwicke, 2013 |
Geen onderscheidt gemaakt tussen borstreductie en protheses |
|
Sajid, 2012 |
Studies geïncludeerd met vrouwen met verschillende chirugische handelingen ondergaan, dus zowel reconstructie als mastectomie. Verkeerde populatie. Geen protheses voor cosmetische redenen. |
|
Elhassan, 2019 |
Geen profylaxe |
|
Philips, 2016 |
Verkeerde populatie |
|
Barr, 2016 |
Verkeerde populatie |
|
Hardwicke, 2014 |
Reactie |
|
Philips, 2013 |
Verkeerde populatie |
|
Lynch, 2018 |
Geen profylaxe |
|
Zapata-Copete, 2017 |
Verkeerde populatie |
|
Horsnell, 2017 |
Geen profylaxe |
|
Drinane, 2017 |
Geen profylaxe |
|
Wang, 2016 |
Verkeerde populatie |
|
McHugh, 2011 |
Geen profylaxe |
|
Philips, 2016 |
Verkeerde populatie |
|
Steiert, 2013 |
Narrative review |
|
Franchelli, 2012 |
Verkeerde populatie |
|
Veiga, 2009 |
Geen profylaxe |
|
Olsen, 2008 |
Verkeerde populatie |
|
Ng, 2007 |
Survey over het gebruik van antibiotica profylaxe in general practice |
|
Gutowski, 1997 |
Voldoet niet aan PICO: gaat over saline protheses |
|
Franchelli, 1993 |
Verkeerde populatie |
|
Exner, 1992 |
Geen vergelijkende studie |
|
Vieira, 2016 |
Verkeerde populatie |
|
Mendes, 2015 |
Geen profylaxe |
|
Lewin, 2015 |
Verkeerde populatie |
|
Drinane, 2013 |
Geen profylaxe |
|
Gravante, 2008 |
Niet systematische review |
|
Scuderi, 2006 |
Verkeerde populatie |
|
Zambacos, 2004 |
In vitro studie |
|
Mahabir, 2004 |
Geen profylaxe |
|
Embrey, 1999 |
Voldoet niet aan PICO: vergelijkt interventie tegen capsulaire contractie |
|
Burkhardt, 1995 |
Geen profylaxe |
|
Santorelli, 2019 |
Voldoet niet aan PICO: vergelijkt 2 protocollen met elkaar |
|
Newman 2018 |
Voldoet niet aan deze PICO funnel versus geen funnel |
|
Sherif 2017 |
Voldoet niet aan PICO: AB bij infectie (niet profylactisch) |
|
Henderson 2017 |
Voldoet niet aan PICO: The commonest procedure was immediate reconstruction (58%; 70/121), geen uitkomsten gerapporteerd maar alleen wel/ geen gebruik van preventieve maatregelen |
|
Benito-Ruiz 2017 |
Voldoet niet aan PICO (nipple shield versus geen nipple shield) |
|
Swanson 2016 |
Voldoet niet aan PICO: geen vergelijking van AB gebruik |
|
Flugstad 2016 |
Voldoet niet aan PICO: funnel versus geen funnel |
|
Drinane 2016 |
Voldoet niet aan deze PICO: spoelen met AB versus spoelen met saline |
|
Townley 2015 |
Voldoet niet aan PICO: implant-based breast reconstruction |
|
Cohen 2015 |
Voldoet niet aan PICO: gekeken welke bacteriën aanwezig zijn bij infectie --> mogelijk wel nuttig voor overwegingen |
|
Harris 2014 |
Voldoet niet aan PICO: geen vergelijking van AB gebruik |
|
Giordano 2013 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Blount 2013 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Wixtrom 2012 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Mazzocchi 2012 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Spear 2010 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Huang 2010 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Feldman 2010 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Pfeiffer 2009 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Carlesimo 2009 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Wiener 2007 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Scuderi 2007 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Adams 2006 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Kainer 2005 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Spear 2003 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Hunter 1996 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Hoflehner 1994 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Brand 1993 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Shad 1982 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
|
Burkhardt 1981 |
gepubliceerd voor zoekdatum Huang (met bredere PICO) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 16-10-2020
Beoordeeld op geldigheid : 16-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Plastische Chirurgie (NVPC) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Plastische Chirurgie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Preoperatieve antibiotica |
NVPC |
2020 |
2025 |
5-jaarlijks |
NVPC |
beschikbaarheid nieuwe wetenschappelijk data |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn is bedoeld om een multidisciplinair evidence-based beleid voor de zorg voor vrouwen met esthetische borstprothese chirurgie.
Doelgroep
De richtlijn is geschreven voor medisch specialisten en andere zorgprofessionals die betrokken zijn bij de bij zorgverlening rondom borstprothese chirurgie. Dit zijn onder andere plastisch chirurgen, chirurgen, radiologen, pathologen, internisten en microbiologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor vrouwen met esthetische borstprothese chirurgie.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Drs. F.V.M. (Felicia) Smits, plastisch chirurg, Velthuiskliniek, Amsterdam, Nederlandse Vereniging voor Plastische Chirurgie (voorzitter)
- Drs. W.J. (Wouter) van der Pot, plastisch chirurg, Spaarne Gasthuis, Haarlem, Nederlandse Vereniging voor Plastische Chirurgie (vice-voorzitter)
- Dr. T. (Tiara) Lopez Penha, plastisch chirurg, Rode Kruis Ziekenhuis, Beverwijk, Nederlandse Vereniging voor Plastische Chirurgie
- Dr. L.H. (Laura) Zaal, plastisch chirurg, Velthuiskliniek, Amsterdam,Nederlandse Vereniging voor Plastische Chirurgie
- Drs. M. (Mintsje) de Boer, AIOS plastische chirurgie, VieCuri Medisch Centrum, Venlo, Nederlandse Vereniging voor Plastische Chirurgie
- Drs. K.M. (Katya) Duvivier, radioloog, Amsterdam UMC, Amsterdam, Nederlandse Vereniging voor Radiologie
- Prof. dr. D. (Daphne) de Jong, hematopatholoog, Amsterdam UMC, Amsterdam, Nederlandse Vereniging voor Pathologie
- Dr. P.W.B. (Prabath) Nanayakkara, internist, Amsterdam UMC, Nederlandse Internisten Vereniging
- Dr. E.J.T. (Ernest) Luiten, oncologisch chirurg, Amphia Ziekenhuis, Breda, Nederlandse Vereniging voor Heelkunde
- Dr. M.B. (Miquel) Ekkelenkamp, arts-microbioloog, Universitair Medisch Centrum, Utrecht, Nederlandse Vereniging voor Medische Microbiologie
- Dr. T.C. (Tim) van de Grift, arts-assistent psychiatrie, GGZ inGeest, Amsterdam, op persoonlijke titel
- Drs. M.L.S. (Madeleine) Ensink, Adviseur patiëntenbelang, Patiëntenfederatie Nederland, Utrecht
Klankbordgroep:
- Dr. C. H. (Carolien) Smorenburg, internist, Antoni van Leeuwenhoek, Amsterdam, Nederlandse Internisten Vereniging
Met ondersteuning van:
- Dr. J. (Jolanda) Prins, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot en met juni 2019)
- Dr. S.N. (Stefanie) Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf juli 2019)
- Drs. R. (Romy) Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf juli 2019)
- Drs. L. (Linda) Niesink-Boerboom, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Smits |
Plastisch chirurg |
Bestuurslid NVEPC, Reputatiegroep |
Geen |
Geen actie |
|
Van der Pot |
Plastisch chirurg |
Geen |
Geen |
Geen actie |
|
Lopez Penha |
Plastisch chirurg |
Lid richtlijn commissie en kwaliteit commissie NVPC |
Geen |
Geen actie |
|
Zaal |
Plastisch chirurg |
Geen |
Geen |
Geen actie |
|
De Boer |
AIOS plastische chirurgie |
Geen |
Geen |
Geen actie |
|
Duvivier |
Radioloog |
Screeningsradioloog en lid mammasectie |
Geen |
Geen actie |
|
De Jong |
Hematopatholoog |
Associate editor Histopathology (betaald) Wetenschappelijk voorzitter Lunenburg Lymphoma Biomarker Consortium (onbetaald) Lid thesauruscommissie PALGA (betaald) Voorzitter European Association for Haematopathology (onbetaald) |
Geen |
Geen actie |
|
Nanayakkara |
Internist |
Geen |
Geen |
Geen actie |
|
Luiten |
Oncologisch chirurg |
Consultant Agendia BV |
Geen |
Geen actie |
|
Ekkelenkamp |
Arts-microbioloog |
Schrijver/essayist |
Geen |
Geen actie |
|
Van de Grift |
AIOS psychiatrie |
lid DSD werkgroep; algemeen lid ter bevordering van zorg voor mensen met disorder of sex development (onbetaald) wetenschappelijk adviseur kwartiermaker transgenderzorg, extern adviseur t.a.v. methodologie veldonderzoek (betaald) bestuurslid kunstenaarsverblijf in GGZ, Het Vijfde Seizoen (onbetaald) |
Geen |
Geen actie |
|
Ensink |
Adviseur patiëntenbelang |
Geen |
Geen |
Geen actie |
|
Smorenburg (klankbordgroep) |
Internist |
Voorzitter landelijke richtlijn Borstkanker |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken, of omdat er al voldoende ondersteunende maatregelen actief zijn in de zorgpraktijk.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Plastische Chirurgie, Nederlandse Vereniging voor Radiologie, Zorginstituut Nederland, Zorgverzekeraars Nederland, Inspectie Gezondheidszorg en Jeugd en Meldpunt Klachten Siliconen bij de Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de vrouw relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, systematische reviews, en literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de vrouw afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de vrouw (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken of omdat er geen harde aanbevelingen gedaan konden worden door ontbreken van literatuur met hoge bewijskracht.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Kennisinstituut van de Federatie Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Utrecht, 2015.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/werkwijze/richtlijnen_3_0.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1980 – mei 2019
|
1 exp *Mammaplasty/ or exp Breast Implantation/ or exp *Breast Implants/ or (augmentation or mammoplasty or mammaplasty or breast enlargement or breast implant* or cpg device or ideal implant* or memoryshape or natrelle or sientra or easthetic breast surgery or breast implant surgery).ti. (26869) 2 exp *Antibiotic Prophylaxis/ or exp *Wound Healing/ or exp *Povidone-Iodine/ or exp *Chlorhexidine/ or exp *Anti-Infective Agents/ or antibiotic*.ti. or antiinfective.ti. or (prophyla* or irrigat* or flush* or iodine or chlorhexidine or keller or funnel or sleeve or nipple guard* or nipple shield* or wound protect* or door movement* or operating room* or airflow or air flow or 14 step* or 14 point*).ti,ab,kw. (1312834) 3 exp Infection/ or infect*.ti,ab,kw. or complicat*.ti,ab,kw. (2880663) 4 1 and 2 and 3 (576) 5 limit 4 to (english language and yr="1980 -Current") (539) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1859890) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (395576) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3186827) 9 5 and 7 (22) 10 5 and 6 (81) 11 10 not 9 (68) 12 5 and 8 (313) 13 12 not 9 not 11 (256) 14 9 or 11 or 13 (346)
= 346 |
450 |
|
Embase (Elsevier) |
('breast reconstruction'/exp/mj OR 'breast augmentation'/exp OR 'breast implant'/exp/mj OR augmentation:ti OR mammoplasty:ti OR mammaplasty:ti OR 'breast enlargement':ti OR 'breast implant*':ti OR 'cpg device':ti OR 'ideal implant*':ti OR memoryshape:ti OR natrelle:ti OR sientra:ti OR 'easthetic breast surgery':ti OR 'breast implant surgery':ti) AND ('antibiotic prophylaxis'/exp/mj OR antibiotic*:ti OR antiinfective:ti OR prophyla*:ti,ab OR 'wound care'/exp/mj OR 'povidone iodine'/exp/mj OR 'chlorhexidine'/exp/mj OR 'antiinfective agent'/exp/mj OR irrigat*:ti,ab OR flush*:ti,ab OR iodine:ti,ab OR chlorhexidine:ti,ab OR 'keller procedure'/exp OR 'nipple shield'/exp OR 'wound protector'/exp OR keller:ti,ab OR funnel:ti,ab OR sleeve:ti,ab OR 'nipple guard*':ti,ab OR 'nipple shield*':ti,ab OR 'wound protect*':ti,ab OR 'door movement*':ti,ab OR 'operating room*':ti,ab OR airflow:ti,ab OR 'air flow':ti,ab OR '14 step*':ti,ab OR '14 point*':ti,ab) AND ('infection'/exp OR infect*:ti,ab OR complicat*:ti,ab) AND (1980-2019)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 29
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 77
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 181
= 287 |
