Directe reconstructie en radiotherapie
Uitgangsvraag
Wat is het effect van een directe autologe reconstructie gevolgd door radiotherapie op postoperatieve complicaties en patiëntgerapporteerde uitkomsten in vergelijking met een directe implantaat reconstructie gevolgd door radiotherapie?
Aanbeveling
Informeer de patiënt over de korte termijn complicaties van een directe autologe en implant reconstructie in het geval van een bestralingsindicatie en weeg dit af tegen de lange termijns uitkomsten. Betrek hierin ook consequenties voor patiënt gerapporteerde uitkomstmaten, ligduur en herstelduur. Bij de keuze directe autologe reconstructie versus implant reconstructie, moeten ook de voor- en nadelen van de optie uitgestelde reconstructie besproken worden (zie module Uitgestelde borstreconstructie en radiotherapie).
Deze uitkomsten en expertise zullen per centrum kunnen verschillen; indien de keuze van patiënt niet uitgevoerd kan worden in het behandelend centrum dient verwijzing naar een ander centrum besproken te worden.
De volgende keuzehulpen zijn beschikbaar om de mogelijkheden te vergelijken:
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft een literatuurstudie verricht naar de uitkomsten van directe autologe reconstructie gevolgd door radiotherapie in vergelijking met directe implantaat reconstructie gevolgd door radiotherapie. Op basis van de geselecteerde literatuur lijkt de postoperatieve complicatiekans na een directe autologe reconstructie gevolgd door bestraling lager dan na een directe implantaat reconstructie gevolgd door bestraling. De bewijskracht werd beoordeeld als zeer laag vanwege het risico op bias en imprecisie.
Er werden geen vergelijkende studies gevonden waarin is gekeken naar het effect van directe autologe reconstructie in vergelijking met directe implantaat reconstructie op patiënt gerapporteerde uitkomsten (PROMs). Wel heeft Jagsi (2018) de complicaties en PROMs prospectief vergeleken in een multicenter cohort van 622 bestraalde en 1625 niet bestraalde patiënten die een implant danwel autologe reconstructie hebben ondergaan tussen 2012-2015. In de groep patiënten die een autologe reconstructie onderging, werd gezien dat bestraling het risico op complicaties niet verhoogt. Daarnaast werd gezien dat in de groep patiënten die bestraling heeft gekregen, een autologe reconstructie geassocieerd is met minder complicaties dan een implant reconstructie (OR 0.47, 95% CI =0.27 to 0.82, p = 0.007) en een hogere BREAST-Q tevredenheid score (63.5 vs 47.7, p = 0.002). Het is in deze studie echter niet duidelijk welke patiënten een directe reconstructie gehad hebben, wat maakt dat we hiermee onze onderzoeksvraag niet direct kunnen beantwoorden. Echter, het grootste deel (83% van de patiënten met een implant reconstructie, en 95.7% van de patiënten met een autologe reconstructie) van de patiënten in de bestraalde groep onderging een directe reconstructie, dus op basis daarvan lijken de resultaten wel geschikt om mee te nemen in de overwegingen en aanbeveling. Ook in deze studie werd niet vermeld of de complicatie voor of na de bestraling plaatsvond.
Het Oncoplastic Breast Consortium (groot internationaal panel met oncologisch chirurgen, plastisch chirurgen, radiotherapeuten en patiënten) kwam in 2021 samen voor een consensus meeting. Op basis van de beschikbare literatuur en ervaringen kwam men tot de overeenstemming dat postoperatieve radiotherapie geen contra-indicatie is voor een directe borstreconstructie, ondanks de hogere kans op complicaties. Het panel gaf de voorkeur aan een autologe reconstructie boven een implantaatreconstructie vanwege de lagere kans op lange termijn complicaties (Weber, 2022).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Patiënten (en behandelaars) moeten in staat zijn om het risico op korte termijn complicaties en de voordelen van de verschillende reconstructiemethoden op lange termijn tegen elkaar af te wegen om op die manier (samen) een weloverwogen beslissing te nemen volgens de vier stappen van samen beslissen en de inzet van een time out. Hierbij moet gedacht worden aan de opname duur, de duur van de ingreep en de kans op re-interventies (ook op lange termijn), en patiëntgerapporteerde uitkomsten.
Voor de subgroep patiënten waarbij een autologe reconstructie niet mogelijk is, geldt bovenstaande niet.
Kosten (middelenbeslag)
Vanwege de veelal langere duur van de chirurgische ingreep bij een autologe reconstructie, zullen de kosten hiervoor hoger zijn. Patiënten liggen vaak ook langer opgenomen indien zij een autologe reconstructie hebben ondergaan. Kouwenberg (2021) en collega’s voerden een cost utility analyse uit waarbij borstsparend behandeling, amputatie, en amputatie met implantaat of autologe reconstructie werden vergeleken. De kosten tot 10 jaar na de behandeling werden hierin meegenomen. Een autologe reconstructie bleek minder kosten effectief dan een implantaat reconstructie, dit werd met name veroorzaakt door de hoge kosten in deze groep als er sprake was van een complicaties. Mogelijk gaan op de langere termijn (>10 jaar) deze kosten minder uiteenlopen omdat dan de patiënten met een implantaat reconstructie mogelijk opnieuw geopereerd moeten worden.
Aanvaardbaarheid, haalbaarheid en implementatie
Waarschijnlijk zal deze richtlijn tools zoals een keuzehulp nodig hebben voor acceptatie en implementatie. Er zijn al enkele keuzehulpen ontwikkeld zoals:
- Keuzehulp Borstreconstructie PATIENT+ | Borstkankervereniging Nederland
- Keuzehulp Borstreconstructie ZorgKeuzeLab | Borstkankervereniging Nederland
Het uitvoeren van een directe reconstructie is een logistieke uitdaging omdat altijd minstens twee behandelaren (chirurg en plastisch chirurg) beschikbaar moeten zijn. Hierbij vergt een direct autologe reconstructie meer tijd, apparatuur en zorgverleners dan een implant reconstructie, waardoor het soms logistiek nog lastiger haalbaar is om een mastectomie met directe autologe reconstructie tijdig te laten plaatsvinden dan met een implant reconstructie. Door de langere operatieduur en de beperkte capaciteit is het voor de meeste ziekenhuizen niet mogelijk om alle patiënten een directe autologe reconstructie aan te bieden. Indien de benodigde expertise voor een autologe reconstructie ontbreekt, dient patiënten de mogelijkheid tot verwijzing aangeboden te worden.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies.
Een indicatie voor postoperatieve bestraling na een borstamputatie is geen contra-indicatie voor een directe borstreconstructie. De behandelaar bespreekt de verschillende mogelijkheden met de patiënt. Er zijn diverse procedures die kunnen worden uitgevoerd voor een directe borstreconstructie. Deze kunnen in grote lijnen worden verdeeld in implant reconstructies en autologe reconstructies. Beide methoden verschillen van elkaar wat betreft duur van de ingreep, duur van opname, duur van herstel, aantal/soort complicaties, en patiënt gerapporteerde uitkomsten. Een directe autologe reconstructie gecombineerd met bestraling lijkt minder complicaties te geven en betere PROMs dan een directe reconstructie met implantaat. Wel is er een langere duur van de ingreep, langere opnameduur en een langere hersteltijd dan na een implantaat reconstructie (zie tabel hieronder).
Mocht er vanwege logistieke redenen geen capaciteit zijn om aan de wens van patiënt te voldoen, dan bespreekt behandelaar met patiënt de mogelijkheid om naar een kliniek te verwijzen waar dit wel kan.
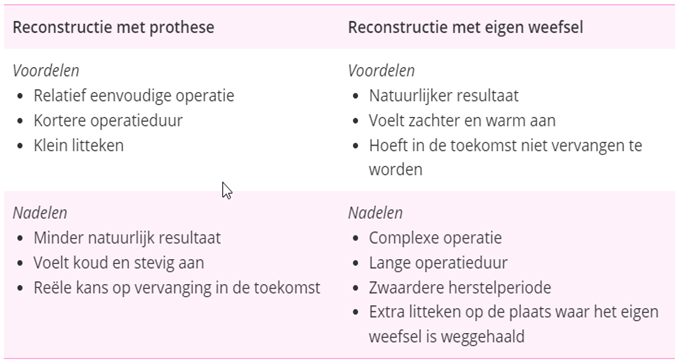
Uit keuzehulp mammareconstructie Zorgkeuzelab.
De literatuur aangaande dit onderwerp is van zeer lage kwaliteit. Er zijn weinig studies die beide directe reconstructies direct met elkaar vergelijken en vaak zijn de patiëntengroepen en de uitkomsten heterogeen. Gezien de soms tegenstrijdige resultaten in de literatuur, wordt verondersteld dat de uitkomsten ook sterk afhankelijk zijn van de lokale expertise; als een centrum veel ervaring heeft met een bepaalde reconstructie, laat deze aanpak daar ook vaak de beste uitkomsten zien.
Onderbouwing
Achtergrond
Het aantal patiënten dat een reconstructieve ingreep na een borstamputatie wenst neemt toe. Verschillende studies laten zien dat radiotherapie na ablatieve chirurgie de uitkomsten van een borstreconstructie verslechtert; zo is er meer kans op complicaties en chirurgische re-interventies en kunnen de cosmetische uitkomsten minder goed zijn. Daarnaast is er met name bij implant reconstructies meer kans op falen van de reconstructie (tot 30%) (Jagsi, 2018; Reinders, 2020). Desalniettemin bestaat ook in geval van een indicatie voor radiotherapie bij veel patiënten de wens voor een borstreconstructie. Hierbij kan er gekozen worden de reconstructie direct te doen of in een later stadium (zie module Uitgestelde borstreconstructie en radiotherapie. Indien wordt gekozen voor een directe reconstructie, dan kan dit middels een implantaat reconstructie, wel of niet in combinatie met een autologe reconstructie (hybride reconstructie).
Deze module beoogt duidelijkheid te geven over de complicatiekansen en de patiëntgerapporteerde uitkomsten voor patiënten die directe reconstructieve chirurgie ondergaan gevolgd door radiotherapie, waarbij de autologe reconstructie met de implantaat reconstructie wordt vergeleken.
In deze module wordt onder autologe reconstructie verstaan: een reconstructie met gevasculariseerd eigen weefselverplaatsing, en geen volledige reconstructie middels lipofilling.
Conclusies / Summary of Findings
Postoperative complications1
|
Very low GRADE |
Immediate autologous reconstruction followed by radiotherapy may be less detrimental regarding postoperative complications when compared with immediate implant reconstruction followed by radiotherapy in patients with an indication for radiotherapy after mastectomy, but the evidence is very uncertain.
Source: Sacotte, 2016; Manyam, 2019 |
1 overall complication rate, infection, necrosis, wound dehiscence, soft tissue damage (contractures and implant extrusion), implant deflation, implant leakage.
Patient-reported outcomes (PROMs)
|
- GRADE |
We are uncertain of the effect of immediate autologous reconstruction followed by radiotherapy on patient-reported outcomes (PROMs) when compared with immediate implant reconstruction followed by radiotherapy in patients with an indication for radiotherapy after mastectomy. These endpoints were not reported.
Source: - |
Samenvatting literatuur
Description of studies
Sacotte (2016) performed a retrospective study to assess the long-term complication rate and timing (time from the beginning of radiation therapy until the first note in the electronic medical record mentioning a complication) of the complications associated with postmastectomy radiation therapy (PMRT) following immediate breast reconstruction. Patients who underwent mastectomy for invasive carcinoma of the breast (stages I through IIIC) with immediate reconstruction followed by adjuvant radiation therapy between November 1997 and May 2010 were included. In total, 145 patients were identified for analysis of which 23 patients received autologous reconstruction (AR) and 111 patients underwent tissue expander/implant-based reconstruction (TE/I) reconstruction. Of the 23 patients who received AR, eighteen had transverse rectus abdominis muscle flaps, four had latissimus dorsi flaps, and one had a deep inferior epigastric perforator flap. Major complications, defined as complications requiring a surgical procedure that was separate and distinct from that planned as part of the reconstruction process, were reported.
Manyam (2019) performed a retrospective study to compare the complication rates requiring reoperation and reconstruction failure between immediate autologous reconstruction (I-AR), immediate tissue expander/implant-based reconstruction (I-TE/I), delayed autologous reconstruction (D-AR) and delayed tissue expander/implant-based reconstruction (D-TE/I) in patients who received postmastectomy radiation therapy (PMRT). For this module, only the comparison between I-AR and I-TE/I reconstruction was of interest with immediate reconstruction defined as AR or TE/I reconstruction on the same day as mastectomy followed by PMRT. Patients who received mastectomy, AR or TE/I reconstruction and PMRT for breast cancer between 2000 and 2008 were included. AR included transverse rectus abdominis (TRAM) flap, deep inferior epigastric perforator (DIEP) flap, or latissimus dorsi flap. Exclusion criteria were patients who received prior breast conservation therapy (lumpectomy and whole-breast radiotherapy) and subsequent mastectomy and reconstruction for recurrence, reirradiation for recurrence, mantle field radiotherapy for lymphoma, or combined TE/I reconstruction and AR. In total, 159 patients received immediate reconstruction of which 90 patients who underwent AR and 69 patients who underwent TE/I reconstruction. Important outcome measures were postoperative complications.
Results
It should be noted that in none of the studies it was reported whether the event occurred prior to administration of radiotherapy or after radiotherapy. Consequentially, it is difficult to conclude whether the complications were due to radiotherapy or to the surgical procedure only, and to value the absolute complication rate.
Postoperative complications
-
- Overall rate of complications
Sacotte (2016) reported that patients who underwent AR had a complication rate of 30.4% while patients who received TE/I reconstruction had a complication rate of 47.7%. The relative risk was not reported.
Manyam (2019) reported the overall rate of complications requiring reoperation (CRR). The overall rate of CRR was 20.0% (18/90 patients) in the AR group and 29.1% (27/69 patients) in the TE/I group. This difference (RR = 0.51, 95% CI = 0.31 to 0.85) was clinically relevant in favour of patients who underwent AR.
-
- Infection
Sacotte (2016) reported an infection in one of the 23 patients (4.3%) who underwent AR and in five of the 111 patients (4.5%) who underwent TE/I reconstruction. This difference (RR = 0.97, 95% CI = 0.12 to 7.88) was not clinically relevant.
Manyam (2019) reported wound infections that required IV antibiotics. Of the 90 patients who received AR, six patients (6.7%) needed IV antibiotics as compared to five of the 69 patients (7.2%) who underwent TE/I reconstruction. This difference (RR = 0.92, 95% CI = 0.29 to 2.89) was not clinically relevant. However, in thirteen of the 69 patients (18.5%) who underwent TE/I reconstruction, the implant was removed for infection.
-
- Necrosis
Sacotte (2016) reported that skin necrosis occurred in nine of the 111 patients (8.1%) who underwent TE/I reconstruction. No skin necrosis was observed in patients who received AR. The type of necrosis (mastectomy skin flap necrosis or total flap necrosis) was not specified.
Manyam (2019) reported skin/flap necrosis and fat necrosis. Nine of the 90 patients (10.0%) who underwent AR and one of the 69 patients (1.4%) who received TE/I reconstruction had skin/flap necrosis. This difference was considered clinically relevant, but was not statistically significant (RR = 6.90, 95% CI = 0.90 to 53.17). In addition, 22 of the 90 patients (24.4%) who underwent AR had fat necrosis.
-
- Wound dehiscence
Manyam (2019) reported that seven of the 90 patients (7.8%) who received AR got wound dehiscence as compared to eleven of the 69 patients (15.9%) who underwent TE/I reconstruction. This difference was considered clinically relevant, but was not statistically significant (RR = 0.49, 95% CI = 0.20 to 1.19).
-
- Soft tissue damage
Sacotte (2016) reported complications resulting from soft tissue damage: contractures and implant extrusion. Contractures were reported in six of the 23 patients (26%) who underwent AR and in 26 of the 111 patients (23.4%) who underwent TE/I reconstruction. This difference (RR = 1.11, 95% CI = 0.52 to 2.40) was not clinically relevant. Besides, extrusion only occurred in nine of the 111 patients (8.1%) who underwent TE/I reconstruction.
Manyam (2019) reported that seventeen patients (24.6%) had a capsular contracture (Baker grade 3 or 4) and ten patients (14.5%) had extrusion of the implant of the 69 patients that underwent TE/I reconstruction.
-
- Implant deflation
Sacotte (2016) reported implant deflation. Of the 23 patients who received TE/I reconstruction, four patients (17.4%) had implant deflation.
-
- Implant leakage
Manyam (2019) reported that one patient (1.4%) had leakage of the implant of the 69 patients that underwent TE/I reconstruction.
Manyam (2019) reported an overall rate of reconstruction failure of 24.6% of the patients who received TE/I reconstruction, and of 4.4% of the patients who received AR.
Patient-reported outcomes (PROMs)
The systematic review did not report results of studies that assessed PROMs of patients who underwent an immediate autologous reconstruction followed by radiotherapy compared to PROMs of patients who underwent an immediate implant reconstruction followed by radiotherapy.
Level of evidence of the literature
The level of evidence of observational cohort studies is considered low according to the GRADE methodology. Therefore, the level of evidence of these cohort studies starts at low GRADE.
The level of evidence regarding the outcome measure postoperative complications was downgraded to very low because of risk of bias (-1; study limitations) and imprecision (-1; low number of included patients).
The level of evidence regarding the outcome measure patient-reported outcomes (PROMs) could not be graded as no studies reported the PROMs of patients who underwent an immediate autologous reconstruction followed by radiotherapy compared to PROMs of patients who underwent an immediate implant reconstruction followed by radiotherapy.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of an immediate autologous reconstruction followed by radiotherapy versus an immediate implant reconstruction followed by radiotherapy on postoperative complications and patient-reported outcomes?
P: Patient with indication for radiotherapy after mastectomy
I: Immediate autologous reconstruction followed by radiotherapy
C: Immediate implant reconstruction followed by radiotherapy
O: Postoperative complications, patient-reported outcomes (PROMs) on the short and on the long (>1-2 years) term
Relevant outcome measures
The guideline development group considered postoperative complications and patient related outcomes as critical outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The guideline development group defined the following differences as a minimal clinically (patient) important difference:
- Postoperative complications: relative risk (RR) <0.80 or RR>1.25
- Patient-reported outcome measures: RR<0.80 or RR>1.25
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2012 until 24-06-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 2481 hits. Studies were selected based on the following criteria:
- Systematic reviews, randomized controlled trials, or observational comparative studies;
- Full-text English language publication;
- Complying with the PICO criteria.
The guideline development group screened the 251 systematic reviews. Fifteen studies were initially selected based on title and abstract screening. After reading the full text, fourteen studies were excluded (see Table of excluded studies), and 1 study was included. The systematic review and network meta-analysis of O’Donnell 2021 defined a broader PICO than the PICO defined for this module. Therefore, two retrospective studies included in the systematic review and network meta-analysis of O’Donnell 2021 that matched with our PICO were selected for the literature analysis (Sacotte, 2016; Manyam, 2019).
Results
Two retrospective studies included in the systematic review and network meta-analysis of O’Donnell 2021 (Sacotte, 2016; Manyam, 2019) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- 1 - Damen TH, Wei W, Mureau MA, Tjong-Joe-Wai R, Hofer SO, Essink-Bot ML, Hovius SE, Polinder S. Medium-term cost analysis of breast reconstructions in a single Dutch centre: a comparison of implants, implants preceded by tissue expansion, LD transpositions and DIEP flaps. J Plast Reconstr Aesthet Surg. 2011 Aug;64(8):1043-53. doi: 10.1016/j.bjps.2010.12.028. Epub 2011 Feb 12. PMID: 21317054.
- 2 - Jagsi R, Momoh AO, Qi J, Hamill JB, Billig J, Kim HM, Pusic AL, Wilkins EG. Impact of Radiotherapy on Complications and Patient-Reported Outcomes After Breast Reconstruction. J Natl Cancer Inst. 2018 Feb 1;110(2):157–65. doi: 10.1093/jnci/djx148. PMID: 28954300; PMCID: PMC6059091.
- 3 - Kouwenberg CAE, Mureau MAM, Kranenburg LW, Rakhorst H, de Leeuw D, Klem TMAL, Koppert LB, Ramos IC, Busschbach JJ. Cost-utility analysis of four common surgical treatment pathways for breast cancer. Eur J Surg Oncol. 2021 Jun;47(6):1299-1308. doi: 10.1016/j.ejso.2020.11.130. Epub 2020 Nov 28. PMID: 33349523.
- 4 - Manyam BV, Shah C, Woody NM, Reddy CA, Weller MA, Juloori A, Naik M, Valente S, Grobmyer S, Durand P, Djohan R, Tendulkar RD. Long-Term Outcomes After Autologous or Tissue Expander/Implant-Based Breast Reconstruction and Postmastectomy Radiation for Breast Cancer. Pract Radiat Oncol. 2019 Nov;9(6):e497-e505. doi: 10.1016/j.prro.2019.06.008. Epub 2019 Jun 22. PMID: 31238166.
- 5 - O'Donnell JPM, Murphy D, Ryan ÉJ, Gasior SA, Sugrue R, O'Neill BL, Boland MR, Lowery AJ, Kerin MJ, McInerney NM. Optimal reconstructive strategies in the setting of post-mastectomy radiotherapy - A systematic review and network meta-analysis. Eur J Surg Oncol. 2021 Nov;47(11):2797-2806. doi: 10.1016/j.ejso.2021.07.001. Epub 2021 Jul 9. PMID: 34301444.
- 6 - Sacotte R, Fine N, Kim JY, Alghoul M, Bethke K, Hansen N, Khan SA, Kulkarni S, Strauss J, Hayes JP, Donnelly ED. Assessing long-term complications in patients undergoing immediate postmastectomy breast reconstruction and adjuvant radiation. Pract Radiat Oncol. 2017 Mar-Apr;7(2):e91-e97. doi: 10.1016/j.prro.2016.10.017. Epub 2016 Oct 30. PMID: 28274406.
- 7 - Weber WP, Shaw J, Pusic A, Wyld L, Morrow M, King T, Mátrai Z, Heil J, Fitzal F, Potter S, Rubio IT, Cardoso MJ, Gentilini OD, Galimberti V, Sacchini V, Rutgers EJT, Benson J, Allweis TM, Haug M, Paulinelli RR, Kovacs T, Harder Y, Gulluoglu BM, Gonzalez E, Faridi A, Elder E, Dubsky P, Blohmer JU, Bjelic-Radisic V, Barry M, Hay SD, Bowles K, French J, Reitsamer R, Koller R, Schrenk P, Kauer-Dorner D, Biazus J, Brenelli F, Letzkus J, Saccilotto R, Joukainen S, Kauhanen S, Karhunen-Enckell U, Hoffmann J, Kneser U, Kühn T, Kontos M, Tampaki EC, Carmon M, Hadar T, Catanuto G, Garcia-Etienne CA, Koppert L, Gouveia PF, Lagergren J, Svensjö T, Maggi N, Kappos EA, Schwab FD, Castrezana L, Steffens D, Krol J, Tausch C, Günthert A, Knauer M, Katapodi MC, Bucher S, Hauser N, Kurzeder C, Mucklow R, Tsoutsou PG, Sezer A, Çakmak GK, Karanlik H, Fairbrother P, Romics L, Montagna G, Urban C, Walker M, Formenti SC, Gruber G, Zimmermann F, Zwahlen DR, Kuemmel S, El-Tamer M, Vrancken Peeters MJ, Kaidar-Person O, Gnant M, Poortmans P, de Boniface J. Oncoplastic breast consortium recommendations for mastectomy and whole breast reconstruction in the setting of post-mastectomy radiation therapy. Breast. 2022 Jun;63:123-139. doi: 10.1016/j.breast.2022.03.008. Epub 2022 Mar 18. PMID: 35366506; PMCID: PMC8976143.
- 8 - Reinders FCJ, Young-Afat DA, Batenburg MCT, Bruekers SE, van Amerongen EA, Macaré van Maurik JFM, Braakenburg A, Zonnevylle E, Hoefkens M, Teunis T, Verkooijen HM, van den Bongard HJGD, Maarse W. Higher reconstruction failure and less patient-reported satisfaction after post mastectomy radiotherapy with immediate implant-based breast reconstruction compared to immediate autologous breast reconstruction. Breast Cancer. 2020 May;27(3):435-444. doi: 10.1007/s12282-019-01036-4. Epub 2019 Dec 19. PMID: 31858435.
Evidence tabellen
Evidence table for intervention studies
Research question: What is the effect of an immediate autologous reconstruction followed by radiotherapy versus an immediate implant reconstruction followed by radiotherapy on postoperative complications and patient-reported outcomes?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Manyam, 2019 |
Type of study: Retrospective study
Setting and country: Cleveland Clinic, USA
Funding and conflicts of interest: No specific funding. |
Inclusion criteria: Patients who received mastectomy, autologous reconstruction (AR) or tissue expander/implant-based reconstruction (TE/I), and postmastectomy radiation therapy (PMRT) for breast cancer between 2000 to 2008
Exclusion criteria: Prior breast conservation therapy (lumpectomy and whole-breast RT) and subsequent mastectomy and reconstruction for recurrence, reirradiation for recurrence, mantle field RT for lymphoma, or combined TE/I and AR.
N total at baseline: Intervention: 127 (n=90 for immediate reconstruction) Control: 77 (n=69 for immediate reconstruction)
Important prognostic factors2: Median age (range): I: 45 (21-65) C: 48 (27-78)
Groups comparable at baseline, except for timing of reconstruction (immediate versus delayed) |
Describe intervention (treatment/procedure/test): Autologous reconstruction (AR). AR included transverse rectus abdominis (TRAM) flap, deep inferior epigastric perforator (DIEP) flap, or latissimus dorsi flap.
For both intervention and control group Interested in immediate reconstruction: AR of TE/I on the same day as mastectomy followed by PMRT
- Surgery performed at single tertiary-care comprehensive cancer center by breast oncologic surgeons and plastic surgeons specializing in breast reconstruction, with a yearly volume of 400 to 450 breast reconstructions. - Patients received neoadjuvant or adjuvant chemotherapy at the discretion of the treating oncologist. - Recommendation for PMRT was made based on clinical staging or after surgery based on final pathologic staging. - Patients underwent 2-dimensional fluoroscopy based planning or 3-dimensional conformal RT with computed tomography based planning, depending on the technology available at the time of treatment. -Patients were treated to the chest wall ± regional lymph nodes as clinically indicated. - The dose and fractionation of PMRT was at the discretion of the treating radiation oncologist and ranged from 48.6 to 50.4 Gy at 1.8 to 2.0 Gy per fraction. Radiation was delivered at the same institution as surgery or at an outside facility. |
Describe control (treatment/procedure/test): Tissue expander/implant-based reconstruction (TE/I)
|
Length of follow-up [median and range]: I: 84 (3-181) months C: 97 (3-177) months
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not reported.
|
Outcome measures and effect size (include 95%CI and p-value if available): Postoperative complications - Wound infection requiring IV antibiotics I: 6 (6.7%) C: 5 (7.2%) P = 0.99 - Wound dehiscence I: 7 (7.8%) P = 0.13 - Skin/flap necrosis I: 9 (10.0%) P = 0.81 - Fat necrosis I: 22 (24.4%) C: 0 - Overall rate of complications requiring reoperation (CRR): I: 18/90 (20%) C: 27/69 (39.1) P = 0.007
Implant removed for infection* C: 13 (18.5%)
Capsular contracture (Baker grade 3 or 4)* C: 17 (24.6%)
Implant extrusion* C: 10 (14.5%)
Implant leak* C: 1 (1.4%)
*outcome measures related to tissue expander/implant-based reconstruction |
Author’s conclusion: With PMRT, TE/I reconstruction in the immediate and delayed setting is associated with higher CRR and reconstruction failure compared with AR.
Limitations: Not adjusted for therapies used in the management of recurrence and does not indicate how this might affect the occurrence of late complications and may confound the results.
|
|
Sacotte, 2016 |
Type of study: Retrospective study
Setting and country: USA (Chicago)
Funding and conflicts of interest: Not supported, funded, or sponsored by any extrainstitutional source, nor are there any actual or potential conflicts of interest with the production and publication. No author has a direct or indirect commercial financial incentive associated with publishing this article. |
Inclusion criteria: - Patients who underwent mastectomy for invasive carcinoma of the breast with immediate reconstruction followed by adjuvant radiation therapy within the institution between November 1997 and May 2010 - Patients with stage IA-IIIC disease, treated with curative intent to a reconstructed breast
Exclusion criteria: Not reported.
N total at baseline: I: 23 C: 111
Important prognostic factors2: No descriptive characteristics for ATR and TE/I separately
Unclear if groups were comparable at baseline |
Describe intervention (treatment/procedure/test): Autologous tissue reconstructions (ATR)
Mastectomy procedures included simple mastectomy, modified radical mastectomy, and nipplesparing mastectomy.
-Reconstructed breasts were treated with external beam radiation therapy with the most common dose being 50.4 Gy (range 43.2-50.6) in 1.8 Gy fractions. - Depending on the clinical scenario, regional axillary lymphatic and internal mammary nodes were also included at the discretion of the treating radiation oncologist. - Bolus material was also utilized dependent on the discretion of the treating radiation oncologist. |
Describe control (treatment/procedure/test): Tissue expander/implant-based reconstruction (TE/I) |
Length of follow-up Median follow-up for all patients was 77.4 months (range 6-185)
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not reported. |
Outcome measures and effect size (include 95%CI and p-value if available): Postoperative complications: Complication rate: I: 30.4% C: 47.7% P = 0.168
- Implant deflation I: 0 - Contracture: I: 6 (26%) - Necrosis I: 0 - Extrusion I: 0 C: 9 (8.1%) - Infection I: 1 (4.3%) C: 5 (4.5%) |
Author’s conclusion: The risk of first major complications and reconstruction loss in patients undergoing PMRT on immediately reconstructed breasts is greatest within 1 year of beginning radiation therapy and decreases significantly with time. Immediate autologous tissue reconstruction followed by PMRT can be performed with reasonable complication rates.
Limitations Small number of autologous reconstructions: underpowered in ability to detect a statistically significant difference between reconstruction groups |
Risk of bias table
Research question: What is the effect of an immediate autologous reconstruction followed by radiotherapy versus an immediate implant reconstruction followed by radiotherapy on postoperative complications and patient-reported outcomes?
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors? |
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables? |
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
Manyam, 2019 |
Definitely yes
Reason: Patients identified from database |
Definitely yes
Reason: Derived from database |
Definitely no
Reason: Outcome was already known at the start of the study because of retrospective patient selection |
Probably yes
Reason: Patient, radiation, and surgical characteristics were reported |
Definitely yes
Reason: Controlled for potential confounders by multivariate analysis |
Probably yes
Reason: Definitions of outcomes provided and derived from database |
Probably yes
Reason: Outcome data seems to be complete for comparison between autologous and tissue expander/implant reconstruction |
Probably yes
Reason: No difference in other intervention (chemotherapy) |
Low |
|
Sacotte, 2016 |
Definitely yes
Reason: Patients identified from electronic medical record |
Definitely yes
Reason: Derived from electronic medical record |
Definitely no
Reason: Outcome was already known at the start of the study because of retrospective patient selection |
Probably no
Reason: No patient characteristics were reported for autologous and tissue expander/implant reconstruction separately |
Probably no
Reason: Only assessed association between patient and treatment characteristics with major complications (but not for autologous and tissue expander/implant reconstruction separately) |
Probably yes
Reason: Outcomes derived from electronic medical record |
Probably yes
Reason: Outcome data seems to be complete |
No information
Reason: information about other treatments is provided, but not separately for autologous and tissue expander/implant reconstruction |
High |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Berbers J, van Baardwijk A, Houben R, Heuts E, Smidt M, Keymeulen K, Bessems M, Tuinder S, Boersma LJ. 'Reconstruction: before or after postmastectomy radiotherapy?' A systematic review of the literature. Eur J Cancer. 2014 Nov;50(16):2752-62. doi: 10.1016/j.ejca.2014.07.023. Epub 2014 Aug 26. PMID: 25168640. |
Wrong intervention (timing of reconstruction). |
|
El-Sabawi B, Ho AL, Sosin M, Patel KM. Patient-centered outcomes of breast reconstruction in the setting of post-mastectomy radiotherapy: A comprehensive review of the literature. J Plast Reconstr Aesthet Surg. 2017 Jun;70(6):768-780. doi: 10.1016/j.bjps.2017.02.015. Epub 2017 Feb 28. PMID: 28416138. |
Wrong comparisons. |
|
Fuertes V, Francés M, Casarrubios JM, Fernández-Palacios J, González JM, Loro-Ferrer JF. Implant-based immediate breast reconstruction: failure rate when radiating the tissue expander or the permanent implant-a meta-analysis. Gland Surg. 2020 Apr;9(2):209-218. doi: 10.21037/gs.2020.01.20. PMID: 32420244; PMCID: PMC7225490. |
Wrong comparison (PMRT to tissue expander versus PMRT to permanent implant). |
|
Liew B, Southall C, Kanapathy M, Nikkhah D. Does post-mastectomy radiation therapy worsen outcomes in immediate autologous breast flap reconstruction? A systematic review and meta-analysis. J Plast Reconstr Aesthet Surg. 2021 Dec;74(12):3260-3280. doi: 10.1016/j.bjps.2021.08.005. Epub 2021 Aug 28. PMID: 34565703. |
Wrong comparison (radiotherapy versus no radiotherapy after immediate autologous reconstruction). |
|
Magill LJ, Robertson FP, Jell G, Mosahebi A, Keshtgar M. Determining the outcomes of post-mastectomy radiation therapy delivered to the definitive implant in patients undergoing one- and two-stage implant-based breast reconstruction: A systematic review and meta-analysis. J Plast Reconstr Aesthet Surg. 2017 Oct;70(10):1329-1335. doi: 10.1016/j.bjps.2017.05.057. Epub 2017 Jun 9. PMID: 28743588. |
Wrong comparison (radiotherapy versus no radiotherapy after immediate implant reconstruction). |
|
Nava MB, Benson JR, Audretsch W, Blondeel P, Catanuto G, Clemens MW, Cordeiro PG, De Vita R, Hammond DC, Jassem J, Lozza L, Orecchia R, Pusic AL, Rancati A, Rezai M, Scaperrotta G, Spano A, Winters ZE, Rocco N. International multidisciplinary expert panel consensus on breast reconstruction and radiotherapy. Br J Surg. 2019 Sep;106(10):1327-1340. doi: 10.1002/bjs.11256. Epub 2019 Jul 18. PMID: 31318456. |
Wrong publication type (expert panel consensus). |
|
Pu Y, Mao TC, Zhang YM, Wang SL, Fan DL. The role of postmastectomy radiation therapy in patients with immediate prosthetic breast reconstruction: A meta-analysis. Medicine (Baltimore). 2018 Feb;97(6):e9548. doi: 10.1097/MD.0000000000009548. PMID: 29419662; PMCID: PMC5944685. |
Wrong comparison (radiotherapy versus no radiotherapy after immediate implant reconstruction). |
|
Ribuffo D, Monfrecola A, Guerra M, Di Benedetto GM, Grassetti L, Spaziani E, Vitagliano T, Greco M. Does postoperative radiation therapy represent a contraindication to expander-implant based immediate breast reconstruction? An update 2012-2014. Eur Rev Med Pharmacol Sci. 2015 Jun;19(12):2202-7. PMID: 26166643. |
Wrong publication type (non-systematic). |
|
Ricci JA, Epstein S, Momoh AO, Lin SJ, Singhal D, Lee BT. A meta-analysis of implant-based breast reconstruction and timing of adjuvant radiation therapy. J Surg Res. 2017 Oct;218:108-116. doi: 10.1016/j.jss.2017.05.072. Epub 2017 Jun 15. PMID: 28985836. |
Wrong comparison (PMRT to tissue expander versus PMRT to permanent implant). |
|
Rubilar F, Navia A, Dagnino B. Autologous versus prosthetic reconstruction for women with breast cancer who will undergo post-reconstruction radiotherapy. Medwave. 2019 Nov 29;19(11):e7728. Spanish, English. doi: 10.5867/medwave.2019.10.7727. PMID: 31821317. |
Article in Spanish. |
|
Schaverien MV, Macmillan RD, McCulley SJ. Is immediate autologous breast reconstruction with postoperative radiotherapy good practice?: a systematic review of the literature. J Plast Reconstr Aesthet Surg. 2013 Dec;66(12):1637-51. doi: 10.1016/j.bjps.2013.06.059. Epub 2013 Jul 22. PMID: 23886555. |
Wrong comparison (radiotherapy versus no radiotherapy after immediate autologous reconstruction). |
|
Shah C, Kundu N, Arthur D, Vicini F. Radiation therapy following postmastectomy reconstruction: a systematic review. Ann Surg Oncol. 2013 Apr;20(4):1313-22. doi: 10.1245/s10434-012-2689-4. Epub 2012 Oct 8. PMID: 23054122. |
Wrong publication type (non-systematic). |
|
Wolter A, Fertsch S, Lisboa BW, Andree C. Rekonstruktives Vorgehen zum Brustwiederaufbau bei geplanter Bestrahlung [Breast Reconstruction Strategies in Case of Planned Radiotherapy]. Handchir Mikrochir Plast Chir. 2022 Aug;54(4):279-296. German. doi: 10.1055/a-1826-2992. Epub 2022 Jun 21. PMID: 35728602. |
Article in German. |
|
Zugasti A, Hontanilla B. The Impact of Adjuvant Radiotherapy on Immediate Implant-based Breast Reconstruction Surgical and Satisfaction Outcomes: A Systematic Review and Meta-analysis. Plast Reconstr Surg Glob Open. 2021 Nov 5;9(11):e3910. doi: 10.1097/GOX.0000000000003910. PMID: 34765389; PMCID: PMC8575424. |
Wrong comparison (radiotherapy versus no radiotherapy after immediate implant reconstruction). |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-12-2023
Beoordeeld op geldigheid : 01-11-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor de patiënt met (verdenking op) borstkanker of voor hen die voor screening in aanmerking komen. De richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de screening, diagnostiek, behandeling en nazorg van borstkanker. Tevens wordt deze richtlijn gebruikt voor het maken van informatiemateriaal voor patiënten, in samenwerking met kanker.nl en thuisarts.nl. Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van deze richtlijn hebben bijgedragen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met borstkanker.
|
Werkgroeplid |
Namens |
|
dr. M.A.W.M.C. (Marlene) Hoynck van Papendrecht |
BVN |
|
drs. C. (Cristina) Guerrero Paez |
BVN |
|
drs. M.A. (Marjolein) Scholten |
BVN |
|
C.M. (Marco) van Esterik |
Contactgroep Phyllodes |
|
M. (Michelle) Verseveld MSc |
KNGF |
|
prof. dr. G.H. (Truuske) de Bock |
NHG |
|
dr. B.E.P.J. (Birgit) Vriens |
NIV |
|
dr. A. (Agnes) Jager |
NIV |
|
dr. C.H. (Carolien) Smorenburg, voorzitter |
NIV |
|
dr. H. (Hiltje) de Graaf |
NIV |
|
dr. J.R. (Judith) Kroep |
NIV |
|
dr. H.H. (Huub) van Rossum |
NVKC |
|
dr. ir. C. (Christiaan) van Swol |
NVKF |
|
dr. F. (Frederiek) van den Bos |
NVKG |
|
dr. C.D.L. (Carine) Bavelaar-Croon |
NVNG |
|
dr. L.A.E. (Leonie) Woerdeman |
NVPC |
|
prof. dr. M.A.M. (Marc) Mureau |
NVPC |
|
dr. A.N. (Astrid) Scholten |
NVRO |
|
dr. H.J.G.D. (Desiree) van den Bongard |
NVRO |
|
dr. J.H. (John) Maduro |
NVRO |
|
dr. M.J.C. (Maurice) van der Sangen |
NVRO |
|
dr. N. (Nina) Bijker |
NVRO |
|
prof. dr. L.J. (Liesbeth) Boersma |
NVRO |
|
dr. D.J.P. (Dominique) van Uden |
NVvH |
|
dr. E.L. (Emily) Postma |
NVvH |
|
dr. J.H. (José) Volders |
NVvH |
|
dr. L.J.A. (Luc) Strobbe |
NVvH |
|
mr. dr. F.H. (Frederieke) van Duijnhoven |
NVvH |
|
drs. E.M. (Elise) Bekers |
NVVP |
|
dr. A.I.M. (Inge-Marie) Obdeijn |
NVvR |
|
dr. C.E. (Claudette) Loo |
NVvR |
|
dr. M.B.I. (Marc) Lobbes |
NVvR |
|
dr. C. (Carla) Meeuwis |
NVvR |
|
drs. L.M.H. (Lidy) Wijers |
NVvR |
|
drs. M.W. (Mechli) Imhof-Tas |
NVvR |
|
A. (Angelie) van den Bosch |
V&VN |
|
C. (Celine) Zoetbrood |
V&VN |
|
A.M.J. (Antoinette) Holterman |
V&VN oncologie |
|
drs. J.M. (Margriet) Collée |
VKGN |
Met ondersteuning van
Drs. S.N. (Sarah) van Duijn
Dr. L. (Linda) Oostendorp
Drs. M. (Miriam) te Lintel Hekkert
Dr. N. (Nadine) Zielonke
Dr. J. (Joppe) Tra
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
|
Smorenburg (voorzitter) |
* Internist-oncoloog Antoni van Leeuwenhoek (0,9 fte - betaald) |
Lid Bestuur gasthuis Antoni van Leeuwenhoek (onbetaald) |
In 2018 een vergoeding van €1,307,00 ontvangen van Pfizer.
|
|
Guerrero Paez |
Directeur Borstkanker Vereniging Nederland |
Lid Raad van Toezicht SPL te Leiden (onbetaald) |
Als patiëntenorganisatie leveren wij vanuit patïëntenperspectief advies aan. Persoonlijk ben ik alleen betrokken bij het Covid consortium waar we onderzoek doen naar Covid en Borstkanker. Trekker is IKNL (geen rol als projectleider). Verder werken wij met de PAG samen en allerlei vrijwilligers. Wij ontvangen van de farmacie gelden voor specifieke projecten op het gebied van informatievoorziening en/of lotgenotencontact. Deze zijn multisponsored en worden altijd opgenomen in het transparantieregister. |
|
Vriens |
Internist-oncoloog Catherinaziekenhuis Eindhoven |
In 2018 een vergoeding van €870,00 ontvangen van Novartis. |
|
|
Mureau |
Plastisch chirurg, Erasmus MC, Universitair Medisch Centrum Rotterdam |
* Maatschapslid AZR>SFG, werkzaamheden als plastisch chirurg (betaald) |
Polytech Health & Aesthetics GmbH - Long-term results of breast reconstruction with polyurethane covered implants: a multicenter randomized controlled trial - Projectleider |
|
Lobbes |
* Radioloog - Zuyderland Medisch Centrum, afdeling Medische Beeldvorming (0,9 fte) |
Lid wetenschappelijke adviesraad LRCB - Lid wetenschappelijke raad Zuyderland Medisch Centrum |
* GE Healtcare - Rapid Access to Contrast-Enchanced mammography in Recalls form breast cancer screening (RACER) – Projectleider * Boegbeeldfunctie wereldwijd van contrast-enhance mammography (CEM) * Betrokkenen heeft financiële vergoedingen gekregen voor het verzorgen van workshops, presentatie en deelname van medical advisory boards van onder andere GE Healthcare, Hologic, Tromp Medical, Suazio, Bayer |
|
Bosch, van den |
Verpleegkundig specialist mammacarcinoom in het Catherinaziekenhuis te Eindhoven |
Gast-docent HBO-V studenten aan Fontys Hogeschool te Eindhoven (betaald) |
Geen |
|
Bongard, van den |
Radiotherapeut-oncoloog, Amsterdam UMC |
* Lid NABON bestuur (onbetaald) |
* KWF/ Pink Ribbon - Eenmalige hoge dosis radiotherapie mammacarcinooom (ABLATIVE project, 2013 en 2020) - Projectleider; VARIAN grant voor Adaptive Radiotherapy in Breast Cancer patients (BREAST-ART, 2020) - Projectleider. * Lid landelijke werkgroep hypofractionering mammacarcinoom |
|
Van Swol |
* Klinisch Fysicus, St. Antonius Ziekenhuis (0,9 fte) |
Voorzitter Bestuur Stichting Opleiding Klinische Fysica - onbetaald. Zie www.stichtingokf.nl |
Geen |
|
Van Duijnhoven |
Chirurg-oncoloog, Nederlands Kanker Instituut / Antoni van Leeuwenhoek Ziekenhuis |
* European Organization for Research and Treatment of Cancer, secretary of the Breast Cancer Group |
* Innovatiefonds Zorgverzekeraars - Towards omitting breast surgery in patients with a complete response to neoadjuvant chemotherapy - biopten past NAC ter evaluatie respons onderzoek inmiddels afgerond- Geen projectleider, co-PI * KWF - Management of low risk ductal carcinoma in situ (low-risk DCIS): a non-randomized, multicenter, non-inferiority trial between standard therapy approach versus active surveillance - clinical trial ongoing - Geen projectleider, co-PI * KWF - Clinically node negative breast cancer patients undergoing breast conserving therapy: Sentinel lymph node procedure versus follow-up - randomized clinical trial, accural complete January 2022 - Geen projectleider, local PI * EORTC-quality of life group - Follow-up in Early and Locally Advanced Breast Cancer Patients: An EORTC QLG-BCG-ROG Protocol - clinical study in which quality of life data are registered in patients treated for breast cancer < 3 years ago - Geen projectleider, local PI * Als arts ook betrokken bij de patiëntenvereniging voor Phyllodes tumoren van de borst, wat 1 van de geformuleerde knelpunten vanuit onze beroepsvereniging is. |
|
Volders |
Oncologische chirurg |
* Bestuurslid werkgroep Mammachirurgie NVCO - onbetaald |
Geen |
|
Van der Sangen |
Radiotherapeut-oncoloog, afdeling Radiotherapie, Catharina Ziekenhuis Eindhoven |
Bestuurslid BOOG (Borstkanker Onderzoeksgroep Nederland), onbetaald |
NVRO/IKNL - Retrospectief onderzoek naar het gebruik van radiotherapie in Nederland - Geen projectleider |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
|
Bavelaar-Croon |
Nucleair Geneeskundige - Ziekenhuis Gelderse Vallei in Ede |
* Voorzitter werkgroep mammacarcinoom NVNG (Nederlandse Vereniging Nucleaire Geneeskunde) |
Geen |
|
Imhof-Tas |
Mammaradioloog en screeningsradioloog Radboud UMC (100%) |
Geen |
Geen |
|
Obdeijn |
Mammaradioloog in het Erasmus MC |
Geen |
* ZonMw - KWF, Sisters Hope, Pink Ribbon Stichting… - MRI versus mammography for breast cancer screening in women with familial risk (FAMRIsc: a multicentre randomised, controlled trial (Lancet Oncology 2019) |
|
Wijers |
Mamma- en neuroradioloog Alrijne Zorggroep (Leiderdorp - Leiden - Alphen) |
* Lid NABON |
In 2020 een vergoeding van €1270,00 ontvangen van Bayer. |
|
Collée |
Klinisch geneticus, Erasmus MC Rotterdam |
Geen |
* KWF - Nationwide infrastructure integrating research and health care to improve management for Dutch women with familial breast cancer risk Infrastructure Initiatives – * KWF Building in the Archipelago of Ovarian Cancer Research - Geen projectleider |
|
Rossum, van |
Laboratorium specialist Klinische Chemie, Afdeling Algemeen Klinisch Laboratorium Antoni van Leeuwenhoek Ziekenhuis Amsterdam |
* Eigenaar en directeur Huvaros B.V. (onbetaald) |
* Health Holland - Subsidie voor vingerprik bloedafname systeem voor Covid-19 serologie - Projectleider
|
|
Bock, de |
Hoogleraar oncologische epidemiologie en interim afdelingshoofd afdeling Epidemiologie van het UMCG (voltijds aanstelling) |
* Lid werkgroep herziening richtlijn familiaire en erfelijke eierstokkanker |
* W.J. Thijnstichting - STIC, het begin of het einde - Projectleider samen met gynaecoloog
|
|
Bos, van den |
Internist-ouderengeneeskunde LUMC |
Voorzitter kerngroep ouderen NIV (onbetaald) |
SKMS - Keuzehulpen nij patiënten met multimorbiditeit - Projectleider
|
|
Verseveld |
* Bestuurslid Nederlandse Vereniging voor fysiotherapie bij Lymfologie en Oncologie, portefeuilehouder Wetenschap Oedeem en Oncologie: 8 uur per week |
* NVFL: vrijwillige functie |
Geen |
|
Loo |
Radioloog, gespecialiseerd mammaradiologie & screening BVO (regio midden west). NKI-AVL (Nederlands Kanker Instituut, Antoni van Leeuwenhoek) en BVO midden west |
* Wetenschappelijke cie NBCA (deels betaals/vacatie) |
In 2019 een vergoeding van €1749,00 ontvangen van Bayer. |
|
Meeuwis |
Mammaradioloog Ziekenhuis Rijnstate |
* NABON - werkgroep standaardisatie verslaglegging (onbetaald) |
* SENO medical - Echografie gecombineerd met laserlicht voor de diagnostiek bij verdachte massa's in de borst - Projectleider
|
|
Louwe |
Gynaecoloog, 0,9 aanstelling Leids Universitair Medisch Centrum |
Geen |
Geen |
|
Graaf, de |
Internist-oncoloog MCL |
Lid commissie kwaliteit NVMO. Medisch manager Oncologisch Netwerk Friesland (ONF) Coach Coassistenten Lid raad van toezicht zorg en welzijn |
Geen |
|
Jager |
Internist-oncoloog Erasmus MC Kanker Instituut Rotterdam |
* Voorzitter Stichting BOOG (Borstkanker onderzoeksgroep) - onbezoldigd |
* KWF - Prediction of Breast Cancer chemotherapy response in patients by determination of chemosensitivity in tumor tissue ex vivo - Projectleider In 2019 een vergoeding van €980,00 ontvangen van Roche Pharma. |
|
Strobbe |
Borstkankerchirurg CWZ Nijmegen fulltime staflid |
Geen |
Geen |
|
Maduro |
Radiotherapeut oncoloog, Universitaire Medische Centrum Groningen en Prinses Maxima Centrum voor kinderoncologie |
Bestuur BOOG, onbetaald |
EU - HARMONIC, gevolgen straling bij kinderen - Geen projectleider
|
|
Boersma |
Radiotherapeut-oncoloog Maastro, Maastricht |
* Klinische werkzaamheden en wetenschappelijke werkzaamheden * Voorzitter van Landelijk Platform Protonentherapie en lid van commissie kwaliteit NVRO |
ZonMw - MOVE project: verbeteren zorgpaden protonentherapie; SKMS project: INNOVATE: verbeteren implementatie van innovaties. KWF: Descartes studie: de-escalatie van bestraling bij patiënten met pCR na Neoadjuvante chemotherapie
|
|
Scholten |
Radiotherapeut-oncoloog, NKI-AVL |
- |
KWF - PPAPBI-2 trial - Projectleider
|
|
Postma |
Oncologisch chirurg Antonius Ziekenhuis Nieuwegein |
Geen |
Geen |
|
Uden |
Fellow chirurgische oncologie: per 17-1-2022 te Gelre Ziekenhuizen (hiervoor fellow chirurgische oncologie in het Rijnstate Ziekenhuis) |
Niet van toepassing |
Onbetaald en ongefinancierd promotie onderzoek naar inflammatoir mammacarcinoom: nu geen aandachtspunt voor de revisie. |
|
Bijker |
Radiotherapeut-oncoloog Amsterdam UMC |
* Kartrekker lateralisatie mammazorg AmsterdamUMC, onbetaald |
* KWF 12900 - Reduction of organ motion during radiotherapy by non-invasive mechanical ventilation supported berating control - Geen projectleider
|
|
Kroep |
Internist-Oncoloog, LUMC |
Betaald adviseurschap: AstraZeneca, GSK, Eisai, Lilly, MSD, Novartis |
* AstraZeneca - FAB, DOMEC en MMRd-GREEN studie; behandeling ovariumca (FAB) en endometrium carcinoom (DOMEC en MMRd-GREEN) drugs (olaparib, durvalumab) en onregstricted grant - Projectleider * Novartis - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. ribociclib en unregstricted grant - Projectleider * Philips - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. unrestricted grant - Projectleider |
|
Woerdeman |
Plastisch chirurg Antoni van Leeuwenhoek Amsterdam |
* Hoofd afdeling plastische chirurgie Antoni van Leeuwenhoek |
Dutch Cancer Society, Grand/Award Number: - Ontwikkeling borst reconstructie keuzehulp - Projectleider
|
|
Esterik, van |
Tot 2014 zelfstandige als Invalbakker |
* Brood en Banker Bakker |
Geen |
|
Scholten, M |
* Belangenbehartiger bij BVN (Borstkankervereniging), 50% |
* Zitting in Medische Advies Raad Parkinsonvereniging (vrijwillig) |
Geen |
|
Hoynck van Papendrecht |
Vrijwilligster BVN |
* Gepensioneerd arts |
Geen |
|
Bekers |
Patholoog, Antoni van Leeuwenhoek Ziekenhuis |
Geen |
Geen |
|
Zoetbrood |
|
|
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de Borstkankervereniging Nederland (BVN) uit te nodigen voor de invitational conference en de werkgroep. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan BVN en de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK). De eventueel aangeleverde commentaren zijn bekeken en waar mogelijk verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module HER2-gerichte therapie in adjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module HER2-gerichte therapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in gemetastaseerde setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module directe borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, directe borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module uitgestelde borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, uitgestelde borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module nacontrole: detectie van nieuwe carcinoom manifestaties |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>5.000 patiënten jaarlijks in nacontrole voor borstkanker), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Phyllodestumoren – beeldvorming en pathologie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren - radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – resectiemarges |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – systemische therapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Phyllodestumoren - nacontrole |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met indicatie screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in neoadjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in neoadjuvante setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep schriftelijk de knelpunten in de zorg voor patiënten met borstkanker. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model met behulp van Review Manager 5.4. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: Borstkanker |
|
|
Uitgangsvragen: 1. Wat is na ablatio het beleid rondom directe borstreconstructie en radiotherapie? 2. Wat is de plaats van een uitgestelde borstreconstructie bij indicatie voor radiotherapie na ablatio? |
|
|
Database(s): Embase, Pubmed |
Datum Update vanaf 2012 |
|
Periode: nvt |
Talen: nvt |
|
Literatuurspecialist: Eugenie Delvaux |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen: Met de adviseur Miriam te Lintel Hekkert besproken dat alleen UV1 wordt ge-update aangezien voor UV2 uitgegaan kan worden van de NICE Guideline uit 2018.
PICO 1 Er is gezocht met de volgende elementen: ‘Borstreconstructie’ EN ’Radiotherapie’. De 2 sleutelartikelen van Olinger et al. en Jagsi R komen uit de search. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase.com en Pubmed is op 24-06-2022 met relevante zoektermen gezocht naar RCT’s en Systematic Reviews en Observationele studies over Borstreconstructie en EN Readiotherapie. De literatuurzoekactie leverde 2.481 (SR+RCT+OBS) unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID Medline |
Ontdubbeld |
|
SRs |
150 |
174 |
251 |
|
RCTs |
111 |
248 |
248 |
|
OBS |
966 |
1559 |
1982 |
|
Totaal |
1.227 |
1.981 |
2.481 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#13 |
#11 NOT #10 NOT #9 (OBS) |
966 |
|
#12 |
#9 NOT #10 (RCT) |
111 |
|
#11 |
#5 AND #8 |
1315 |
|
#10 |
#5 AND #7 |
401 |
|
#9 |
#5 AND #6 (SR) |
150 |
|
#8 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
7107738 |
|
#7 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3561580 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
834494 |
|
#5 |
#4 AND [1-1-2012]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
2245 |
|
#4 |
#1 AND #2 AND #3 |
4640 |
|
#3 |
'breast tumor'/exp OR 'bilateral breast neoplasm*':ti,ab,kw OR 'bilateral breast tumor*':ti,ab,kw OR 'bilateral breast tumour*':ti,ab,kw OR 'breast gland tumor*':ti,ab,kw OR 'breast gland tumour*':ti,ab,kw OR 'breast mass':ti,ab,kw OR 'breast neoplasia':ti,ab,kw OR 'breast neoplasm*':ti,ab,kw OR 'breast tumor*':ti,ab,kw OR 'breast tumorigenesis':ti,ab,kw OR 'breast tumour*':ti,ab,kw OR 'mamma tumor*':ti,ab,kw OR 'mamma tumour*':ti,ab,kw OR 'mammary neoplasm*':ti,ab,kw OR 'mammary tumor*':ti,ab,kw OR 'mammary tumour*':ti,ab,kw OR 'mastectomy'/exp OR 'breast amputation':ti,ab,kw OR 'breast resection':ti,ab,kw OR 'mammectomy':ti,ab,kw OR 'mastectomy':ti,ab,kw |
649448 |
|
#2 |
'radiotherapy'/exp OR 'bioradiant therapy':ti,ab,kw OR 'bucky ray':ti,ab,kw OR 'bucky therapy':ti,ab,kw OR 'radio therapy':ti,ab,kw OR 'radio treatment':ti,ab,kw OR 'radiohypophysectomy':ti,ab,kw OR 'radiotherapy':ti,ab,kw OR 'roentgen therapy':ti,ab,kw OR 'roentgen treatment':ti,ab,kw OR 'rontgen therapy':ti,ab,kw OR 'therapeutic radiology':ti,ab,kw OR 'x radiotherapy':ti,ab,kw OR 'x ray therapy':ti,ab,kw OR 'x ray treatment':ti,ab,kw OR 'x-ray therapy':ti,ab,kw OR irradiati*:ti,ab,kw OR radiati*:ti,ab,kw |
1170927 |
|
#1 |
'reconstructive surgery'/exp OR 'operative reconstruction':ti,ab,kw OR 'reconstruction surgery':ti,ab,kw OR 'reconstructive surgery':ti,ab,kw OR 'reconstructive surgical procedure*':ti,ab,kw OR 'surgical reconstruction':ti,ab,kw OR 'breast reconstruction'/exp OR 'breast plastic operation':ti,ab,kw OR 'breast reconstruction*':ti,ab,kw OR 'cosmetic breast operation':ti,ab,kw OR 'mammoplast*':ti,ab,kw OR 'mastoplasty':ti,ab,kw OR 'breast endoprosthesis'/exp OR 'breast endoprosthesis':ti,ab,kw OR 'breast implant*':ti,ab,kw OR 'internal breast prosthes*':ti,ab,kw OR 'mamma endoprosthesis':ti,ab,kw OR 'mammary endoprosthesis':ti,ab,kw OR 'silicone gel/saline-filled breast implant':ti,ab,kw OR 'breast augmentation'/exp OR 'augmentation mammoplasty':ti,ab,kw OR 'breast augmentation':ti,ab,kw OR 'breast enlargement':ti,ab,kw OR 'breast implantation*':ti,ab,kw OR 'surgical flaps'/exp OR 'surgical flap*':ti,ab,kw |
91139 |
Ovid Medline
|
# |
Searches |
Results |
|
1 |
exp Reconstructive Surgical Procedures/ or exp Mammaplasty/ or exp Breast Implantation/ or exp Breast Implants/ or (prostheses and implants).ti,ab,kf. or (breast* adj3 reconstruction*).ti,ab,kf. or exp Surgical Flaps/ or surgical flap*.ti,ab,kf. or (free tissue adj2 flap*).ti,ab,kf. |
286938 |
|
2 |
exp Radiotherapy/ or (bioradiant therapy or bucky ray or bucky therap* or radio therap* or radio treatment or radiohypophysectomy or radiotherap* or roentgen therap* or roentgen treatment or rontgen therap* or therapeutic radiology or x radiotherapy or x ray therap* or x ray treatment or x-ray therapy or irradiati* or radiati*).ti,ab,kf. |
776744 |
|
3 |
exp Breast Neoplasms/ or exp Neoplasms/ or ((breast* adj6 cancer) or (breast* adj6 neoplasm*) or (breast* adj6 carcinoma*) or (breast* adj6 tumour) or (breast* adj6 tumor*) or mastectom*).ti,ab,kf. or exp Mastectomy/ or exp.mp. or (mamma adj6 tumor*).ti,ab,kf. or (mamma adj6 tumour*).ti,ab,kf. or (mammary adj6 neoplasm*).ti,ab,kf. or mammary tumor*.ti,ab,kf. or (mammary adj6 tumour*).ti,ab,kf. or exp Mastectomy/ or mastectomy.ti,ab,kf. or breast amputation.ti,ab,kf. or breast resection.ti,ab,kf. |
3799882 |
|
4 |
1 and 2 and 3 |
6548 |
|
5 |
limit 4 to yr="2012 -Current" |
3262 |
|
6 |
5 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
3136 |
|
7 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
573240 |
|
8 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2468096 |
|
9 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort*.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
4216522 |
|
10 |
6 and 7 (SR) |
174 |
|
11 |
6 and 8 |
290 |
|
12 |
6 and 9 |
1807 |
|
13 |
11 not 10 (RCT) |
248 |
|
14 |
12 not 11 not 10 (OBS) |
1559 |

