Beleid zwangerschap vanaf 41 weken
Uitgangsvraag
Wat zijn de effecten van inductie van de baring bij 41 weken zwangerschapsduur in een laag risico populatie met een kind in hoofdligging vergeleken met expectatief beleid?
Aanbeveling
Bied de zwangere vrouw met een éénling in hoofdligging de mogelijkheid van inleiding van de baring aan vanaf 41 weken (287 dagen amenorrhoe) naast de mogelijkheid om af te wachten.
Counsel met behulp van de bij de module behorende keuzekaarten* en benoem daarbij de effecten op perinatale uitkomsten zoals perinatale sterfte en NICU opnames en het mogelijk verhoogde risico voor nullipara ten opzichte van multipara. Hierbij dienen de voor- en nadelen van zowel inleiding als afwachtend beleid te worden besproken.
*Keuzekaart Inleiden of afwachten en Keuzekaart Andere mogelijkheden
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Inductie bij 41 weken vergeleken met expectatief beleid na 41 weken is geassocieerd met minder perinatale sterfte, minder NICU opnamen en minder sectio caesarea. De overige cruciale maternale uitkomstmaten mortaliteit en postpartum bloedverlies en cruciale perinatale uitkomstmaten infectie en Apgar score waren niet verschillend tussen de twee groepen. Deze conclusies gelden voor de groep van 41 weken vergeleken met de groep na 41 weken waarbij ook oude studies werden geïncludeerd waarbij een afwachtend beleid werd gevoerd tot 44 weken.
Aangezien dit in Nederland niet de gangbare situatie (praktijkvoering) is, is er tevens een subanalyse verricht waarbij inleiden bij 41 weken werd vergeleken met afwachtend beleid tot 42 weken. Waar verder in de tekst over subanalyse wordt gesproken wordt de groep tot 42 weken bedoeld. In deze subanalyse werden de studies van Keulen (2019) en Wennerholm (2019) geïncludeerd en voor een aantal uitkomstmaten aangevuld met data van Gelisen (2005) en Sahraoui (2005). Uit deze subanalyse bleek dat inductie bij 41 weken vergeleken met expectatief beleid na 41 weken (tot maximaal 42 weken) geassocieerd is met minder perinatale sterfte en minder NICU opnames. Omdat alleen voor de uitkomst ‘partusmodus sectio’ de subanalyse verschilt voor de twee aparte zwangerschapsperiodes (inleiden bij 42 weken versus afwachten > 42 weken), is deze in de conclusies apart benoemd. Er werd geen verschil in sectio’s gevonden als er naar de resultaten van de trials gekeken wordt die afwachtend beleid tot 42 weken hanteren (subgroepanalyse). Bij alle andere conclusies veranderde de subanalyse het resultaat niet, waardoor er gekozen is om deze niet telkens apart te vermelden. Opvallend was dat de zwangerschapsduur tussen beide groepen niet veel van elkaar verschilde. Gemiddeld was de zwangerschapsduur 2 dagen korter in inductie groep; 287 in de inductie groep versus 289 dagen in de expectatief beleid groep.
Het absolute risico van perinatale sterfte en NICU-opnames is laag waardoor het verschil tussen inductie en expectatieve groep klein is, echter wel klinisch relevant gezien de impact van deze twee uitkomstmaten. Verder betreft het hier een a-priori gezonde populatie (zwangerschap zonder complicaties), anders dan alleen de zwangerschapsduur. In sommige studies was er een andere definitie dan de Nederlandse definitie voor NICU-opname. Een opname op een kinderafdeling danwel een NICU is een ongewenste en onverwachte uitkomst ongeacht de definitie voor NICU opname.
Op basis van de huidige analyse zouden er 395 vrouwen ingeleid dienen te worden bij 41 weken om 1 perinatale sterfte te voorkomen (NNT 395, 95%BI 329 tot 813, op basis van gepoolde data) en 79 vrouwen ingeleid dienen te worden bij 41 weken om 1 NICU opname te voorkomen (NNT 79, 95%BI 46 tot 397 op basis van gepoolde data). De number needed tot treat moet met enige voorzichtigheid worden geïnterpreteerd omdat deze afhankelijk is van het basisrisico van de patiëntengroep.
Uit de overige belangrijke uitkomstmaten bleek dat er in de inductiegroep meer, maar niet klinisch relevant, gebruik werd gemaakt van pijnstilling.
In een meta analyse en individual patient data analyse van Alkmark (2020) zijn de studies van Keulen (2019) en Wennerholm (2019) (en deels Gelisen, 2005) opgenomen (voor IPD alleen eerste 2 studies).
De primaire uitkomstmaat is een samengestelde uitkomstmaatcomposite outcome van perinatale sterfte en ernstige neonatale morbiditeit (composite: 5 min AS <4, hypoxische-ischemische encephalopathie (graad II-III), intracraniële bloeding, convulsies en MAS (meconium aspiratie syndroom). Secundaire neonatale uitkomstmaten zijn onder andere alle individuele parameters en tevens 5 min AS< 7, opname neonaat > 4 dagen, geboorte gewicht (SGA/LGA), infecties, humerus fractuur en congenitale afwijkingen.
IOL versus afwachtend beleid resulteerde in een significante afname van ernstige slechte perinatale uitkomst (0,4% versus 1,0%; NNT 175 (95%CI 94 tot 1267). Perinatale sterfte kwam significant minder vaak voor bij IOL versus afwachtend beleid (< 0,1% versus 0,4%; NNT 326 (95%CI 177 tot 2014). Ook neonatale opname > 4 dagen kwam significant minder vaak voor in de IOL-groep (1,1% versus 1,92,0%; NNT 103 (95%CI 59 tot 385). Er was geen verschil in andere belangrijke perinatale uitkomsten of in manier van bevallen (inclusief sectio). Wel werd in de IOL-groep significant (50,5% versus 46,4%) meer pijnstilling gebruikt en waren er significant minder vrouwen met hypertensieve aandoeningen (1,1% versus 2,9%; NNT 57 (95%CI 39 tot 106). Er is een subanalyse verricht. Hierbij werd een significant behandel effect gevonden voor pariteit. In nullipara was er een significante afname van ernstige perinatale uitkomst (0,3% versus 1,6%; NNT 79 (95%CI 49 tot 201), terwijl dit effect niet werd gevonden voor multipara (0,6% versus 0,3%). Voor perinatale sterfte was het niet mogelijk om een analyse naar interactie voor pariteit uit te voeren omdat het overall sterftepercentage laag is. In de overige analyses voor subgroepen (leeftijd/BMI) werden geen verschillen gevonden.
In Nederland is het gangbare beleid (praktijkvoering) om bij 42 weken (294 dagen amenorrhoe) een inleiding te bespreken versus afwachten en een verwijzing naar de gynaecoloog te organiseren, hoewel er op dit moment geen richtlijn over is wat leidt tot veel praktijkvariatie. Op basis van de landelijke perined cijfers van 2018 blijkt 16,5% van de vrouwen tussen 41 en 42 weken zwangerschap te bevallen en 1,2% na 42 weken zwangerschap. Dit is anders dan het beleid in de meeste andere landen met kwalitatief vergelijkbare zorgsystemen, waarbij de grens op 41 weken (287 dagen of 41 weken, 3 dagen, 290 dagen) ligt. Een deel van deze vrouwen bevalt al in de tweede lijn. In de studies die zijn meegenomen in de review van Middleton (2018) zijn ook een aantal studies die tot 44 weken zwangerschapsduur afwachten. Dit zijn oudere studies. Uit de review kwam naar voren dat het aantal perinatale sterftes en aantal sectio caesarea ’s lager was in de inductie groep ten opzichte van de expectatieve groep, echter werden er meer kunstverlossingen gezien. De apgar score < 7 was in de expectatieve groep hoger.
Als bij een zwangerschapsduur tussen de 41 en 42 weken de ouders verzoeken om inleiden van de baring zonder dat risicofactoren aanwezig lijken, kan de zwangerschap worden beëindigd door inleiden van de baring na voorlichting over inleiding. Er is echter een grote praktijkvariatie in de voorlichting omtrent inleiden en afwachten tussen 41 en 42 weken in Nederland. Dit geldt voor zowel de termijn waarop voorlichting gegeven wordt als de inhoud van de voorlichting, bijvoorbeeld welke voor- en nadelen van afwachten versus inleiden worden benoemd. Met de beschreven counselingspunten en de keuzekaarten (Keuzekaart Inleiden of afwachten en Keuzekaart Andere mogelijkheden) trachten we meer uniformiteit in de voorlichting te bewerkstellingen. Daarnaast is het per ziekenhuis verschillend wat het beleid is omtrent de foetale bewaking na 41 weken. Hiervoor verwijzen we naar de module ‘Antepartum foetale bewaking vanaf 41 weken bij expectatief beleid’.
De studie van Keulen (2019) is uitgevoerd in de huidige Nederlandse setting en vergelijkt inleiden bij 41 weken met afwachten tot 42 weken. In deze Nederlandse studie werd een verlaging van de samengestelde perinatale uitkomst gezien bij een gelijk aantal sectio caesarea ’s. Het aantal NICU opnames was lager in de interventiegroep. De overige maternale en perinatale uitkomstmaten waren niet verschillend tussen de twee groepen. Deze resultaten zijn in dezelfde lijn als de review van Middleton, met als verschil dat er geen reductie in het aantal sectio’s gezien werd en het aantal kunstverlossingen gelijk was. De perinatale sterfte was niet statistisch significant verschillend maar hiervoor had de studie op voorhand al niet voldoende power.
In de studie van Wennerholm (2019) in een Zweedse populatie werd gerandomiseerd in een laag risico groep tussen afwachten volgens lokaal beleid versus inleiden op 41 weken zwangerschap. De inleiding werd binnen 24 uur gepland na randomisatie. Tijdens de interim analyse werd de studie voortijdig gestopt omdat er in de expectatieve groep 6 kinderen overleden versus geen overleden kinderen in de inductie groep. Dit dient te worden gezien in het licht van een laag absoluut risico maar wel voor ernstige adverse neonatal outcomes. Tevens waren de NICU opname in de interventiegroep lager dan in de afwachtende groep. Dit is overeenkomend met de resultaten uit de studie van Keulen (2019). Een aantal kanttekeningen bij de studie van Wennerholm (2019) zijn dat de studie is gestopt bij een inclusie van 2.700 patiënten terwijl deze gepowerd was voor 10.000 patiënten. Er werden, anders dan in de Nederlandse situatie geen controles uitgevoerd na 41 weken. De sterfte in de studiepopulatie was hoger dan in de Nederlandse populatie. Daarnaast werd er geen verschil gerapporteerd in de primaire uitkomstmaat van deze studie, een samengestelde uitkomstmaat van mortaliteit en morbiditeit. Ten aanzien van de perinatale sterfte bleken met name de nullipara een risicogroep. Dit is een gegeven dat meegenomen kan worden in de counseling van de zwangere vrouw.
Samenvattend laat de beschikbare literatuur die voldoet aan de PICO voor de cruciale uitkomstmaten perinatale sterfte en NICU opnames een significante verlaging zien bij de inductiegroep, met een redelijke bewijskracht. Dit dient te worden gezien in het licht van een laag absoluut risico maar wel voor ernstige adverse neonatal outcomes. Tijdens het proces van Shared Decision Making zijn er ook andere punten die besproken moeten worden in de counseling van de zwangere, zodat een wel overwogen besluit kan worden gemaakt.
Waarden en voorkeuren van patiënten/cliënten (en eventueel hun verzorgers)
Er is onvoldoende literatuur beschikbaar over de ervaringen en voorkeuren van vrouwen zonder medische indicatie voor inleiding. Er is één gerandomiseerde studie bekend over de patiënttevredenheid ten aanzien van inleiden bij 41 weken versus expectatief beleid. Patiënten werden gerandomiseerd tussen inleiden bij 41 weken en expectatief beleid met foetale monitoring. 74% van de vrouwen in de inductiegroep gaf na 6 tot 8 maanden aan bij een volgende zwangerschap hetzelfde beleid te willen tegenover 38% in de afwachtende groep.
In observationele studies onder vrouwen waarbij de bevalling op medische gronden werd ingeleid hebben vrouwen een hoger risico op een hemorraghia postpartum, uterusruptuur, hyperstimulatie waardoor foetale nood en perineumrupturen (Miller, 2016). Daarnaast maken barenden die worden ingeleid vanwege een medische reden vaker gebruik van medicinale pijnbestrijding (OR 2,3; 95%BI 1.4 tot 3.8), zijn ze vaker beperkt in hun bewegingsvrijheid en hebben ze vaker een langere bevalling en negatieve bevallingservaring (Hildingsson, 2011; Shetty, 2005). Daarnaast blijkt dat vrouwen met een inleiding op medische indicatie vaker ontevreden zijn en zich van tevoren meer zorgen maken over de bevalling (Shetty, 2005; Henderson, 2013). Vrouwen waren vaker bang bij een inleiding van de baring dat de baby beschadigd zou worden in vergelijking met vrouwen met een spontane bevalling (OR 2,1 95% BI 1.2 tot 3.9) (Hildingson, 2011). Het is nog onbekend of vrouwen die kiezen voor een inleiding andere ervaringen hebben dan vrouwen die op medische gronden worden ingeleid.
Ten aanzien van het gebruik van synthetische oxytocine zijn er een aantal studies die een mogelijke negatieve associatie laten zien op borstvoeding en de maternale psyche (Kroll-Desrosiers, 2017; Bell, 2014; Gu, 2016; Brimydr, 2015; Erikson, 2017; Gomes, 2018; Olza-Fernandez, 2014) .
Uit de studies van Keulen (2019) en Wennerholm (2019) is bekend dat respectievelijk 70% en 80% van de vrouwen niet gerandomiseerd wilden worden voor deelname in de studie. Vanuit de Index-studie is bekend dat de meeste vrouwen niet gerandomiseerd wilden worden omdat zij een afwachtend beleid prefereerden.
Met vrouwen die wensen af te wachten na 41 weken zal besproken worden hoe en wanneer er controles zullen plaatsvinden (zie ook de module ‘Antepartum foetale bewaking vanaf 41 weken bij expectatief beleid’). Ook niet medische methoden van inleiding, zoals strippen, kunnen hierbij besproken worden. In de conceptrichtlijn methodes inductie van de baring (NVOG) staat: overweeg strippen als alternatieve methode van inductie van de baring om het bereiken van een AD van 42 weken te verminderen. Het moederlijk discomfort en het vaginaal bloedverlies geassocieerd met de procedure en het feit dat de uitkomst van de zwangerschap niet verbetert, moeten worden afgewogen tegen het geanticipeerde voordeel. Beveel geen andere alternatieve methoden voor inductie van de baring aan.
In de recente Cochrane review (Finucane, 2020) staat dat strippen effectief kan zijn om een spontane bevalling te bewerkstelligen, maar het bewijs hiervoor was onzeker. In vergelijking met afwachtend beleid vermindert het mogelijk de incidentie van formele inleidingen van de bevalling. Het blijft de vraag of er een optimaal aantal keer strippen is, om de hoeveel tijd en bij welke zwangerschapsduur, om het inleiden van de bevalling te vergemakkelijken.
Uit de review van Akuamoah-Boateng (2018) bleek dat vrouwen duidelijke, gedetailleerde en objectieve informatie nodig hebben over de achtergrond, de alternatieven en procedures om tot een besluit te komen. In het proces om tot een keuze te komen worden vrouwen beïnvloed door zorgverleners, familie en hun risicoperceptie. Deze studie-uitkomsten onderschrijven het belang van objectieve counseling en keuzevrijheid voor de vrouw.
Zowel in de Cochrane review van Middleton (2018) als in de WHO recommendations: intrapartum care for a positive childbirth wordt geconcludeerd dat vrouwen betrokken moeten worden bij beslissingen voor goede zorg. In Nederland wordt besluitvorming via Shared Decision Making (SDM) gefaciliteerd, waarbij counseling het inhoudelijke deel van SDM is.
Bij de counseling van zwangeren over het beleid > 41 weken zwangerschap is het belangrijk dat opgenomen punten objectief en volledig met de zwangere besproken worden (volgens bijvoorbeeld de BRAINS-methode (zie de bijlage ‘Counseling volgens BRAINS-methode’). Tevens kan gebruik gemaakt worden van de keuzekaarten (Keuzekaart Inleiden of afwachten en Keuzekaart Andere mogelijkheden) en animatiefilm (in ontwikkeling).
Kosten (middelenbeslag)
Inleiden bij 41 weken zal meer capaciteit vragen van het verloskundig systeem. De uitkomsten wijzen op een verlaging van de perinatale sterfte en het aantal NICU opnamen voor deze specifieke groep. Mogelijk verantwoordt dit potentieel de capaciteitstoename. Dit dient wel gealloceerd en gemonitord te worden doordat het om kleine aantallen gaat. Er zijn binnen de huidige beschikbare literatuur geen kosteneffectiviteitsanalyses bekend. Wel zijn in eerdere Nederlandse studies zoals de Digitat-trial en de Hypitat-trial kosteneffectiviteitsanalyses verricht. In de Digitat-trial bleek dat inductie voor de 38 weken de kosten lager zijn in de expectatieve groep en na 38 weken in de inductiegroep (Vijgen, 2010). De analyse van de Hypitat-trial liet zien dat inleiden bij hypertensieve aandoeningen in de a-terme periode kosteneffectiever was dan expectatief beleid (Vijgen, 2010). In deze studies was er sprake van hoogrisico vrouwen, waardoor er voor de beschreven patiëntengroep in deze richtlijn een kosteneffectiviteitsanalyse nodig is om inzicht te geven in de kosten en middelenbeslag op nationaal niveau.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is geen procesevaluatie gedaan naar de haalbaarheid en aanvaardbaarheid van de interventie. Het is niet geheel te voorspellen welk percentage van de zwangere vrouwen tussen 41 weken en 42 weken zal kiezen voor inleiden danwel expectatief beleid. Hierdoor is inzicht in de haalbaarheid en de implementatie door een toename van het aantal inleidingen moeilijk te voorspellen. Inductie kost meer tijd en doet mogelijk een groter beroep op de gezondheidszorg dan wanneer iemand spontaan in partu komt. Hierdoor zijn er mogelijk vaker vollere ziekenhuizen en is er mogelijk minder tijd voor continue begeleiding van zorgverleners voor vrouwen in het ziekenhuis, echter een groot deel van de zwangeren boven de 41 weken zwangerschap bevalt nu ook al in de tweede lijn. Aan de andere kant kan een afwachtend beleid tevens zorgen voor meer herhaalconsulten. Geëvalueerd moet worden wat de effecten zijn van aanpassing van het beleid voor deze groep vrouwen op de algehele populatie.
Onderbouwing
Achtergrond
Na het bereiken van de à terme datum neemt het risico op perinatale sterfte en meconiumaspiratie syndroom (MAS) toe. In de NVOG richtlijn serotiniteit uit 2007 staat als aanbeveling dat indien de ouders verzoeken om inleiden van de baring tussen de 41 en 42 weken zonder dat risicofactoren aanwezig lijken, de zwangerschap kan worden beëindigd door inleiden van de baring na voorlichting over inleiding. Dit leidt niet tot meer kunstverlossingen en leidt mogelijk tot minder sectio's. Er is echter een grote praktijkvariatie in het beleid omtrent het inleiden tussen 41 en 42 weken. Volgens de data van Perined uit 2018 bevalt ruim 26000 (16.5 % van het totaal aantal zwangerschappen boven 22 weken) van de vrouwen tussen de 41 en 42 weken Hiervan start de bevalling bij ruim 18000 vrouwen (70%) spontaan. Boven de 42 weken bevallen 2000 vrouwen (1.2%) waar bij een kwart de baring spontaan begint en driekwart middels inleiding. Hieruit voortkomend is de volgende uitgangsvraag geformuleerd: “Wat zijn de effecten van inleiden van de baring bij 41 weken zwangerschapsduur in een laag risico populatie met een kind in hoofdligging zonder sectio in anamnese vergeleken met expectatief beleid?”
Conclusies / Summary of Findings
Neonatal outcomes
|
Moderate GRADE |
It is likely that the risk of perinatal mortality is lower with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Middleton, 2018; Keulen, 2019; Wennerholm, 2019) |
|
Low GRADE |
The evidence suggests there is no difference in risk of perinatal infection with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Keulen, 2019; Wennerholm, 2019) |
|
Low GRADE |
The evidence suggests there is no difference in Apgar-scores less than seven at five minutes with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Middleton, 2018; Keulen, 2019; Wennerholm, 2019) |
|
Moderate GRADE |
It is likely that there are fewer NICU admissions with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Middleton, 2018; Keulen, 2019; Wennerholm, 2019) |
|
Very low GRADE |
It is unclear if there is a difference in risk on shoulder dystocia with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: Middleton, 2018; Keulen, 2019; Wennerholm, 2019 |
Maternal outcomes
Mode of delivery- Cesarean delivery
|
Moderate GRADE |
It is likely that there are fewer cesarean deliveries with labor induction at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
It is likely that there is no difference in cesarean deliveries with labor induction at 41 weeks compared to expectant management until 42 wk for women with an uncomplicated singleton pregnancy.
Sources: (Middleton, 2018; Keulen, 2019; Wennerholm, 2019) |
Mode of delivery- Operative vaginal delivery
|
Moderate GRADE |
It is likely that there is no difference in operative vaginal delivery with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Middleton, 2018; Keulen, 2019; Wennerholm, 2019) |
|
Low GRADE |
The evidence suggests there is no difference in maternal mortality with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Keulen, 2019; Wennerholm, 2019) |
|
Moderate GRADE |
It is likely that there is no difference in postpartum hemorrhage with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Middleton, 2018; Keulen, 2019; Wennerholm, 2019) |
|
Low GRADE |
The evidence suggests that there is a statistically significant, however not clinically relevant difference in need for analgesia with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Middleton, 2018; Keulen, 2019; Wennerholm, 2019) |
|
Low GRADE |
The evidence suggests there is no difference in severe perineal trauma with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Middleton, 2018; Keulen, 2019; Wennerholm, 2019) |
|
Very low GRADE |
It is unclear if there is a difference in the outcome maternal satisfaction with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Heimstad, 2007) |
|
Very low GRADE |
The evidence suggests there is no difference in the outcome breastfeeding at discharge with induction of labor at 41 weeks compared to expectant management for women with an uncomplicated singleton pregnancy.
Sources: (Wennerholm, 2019) |
|
- GRADE |
No GRADE-assessment for the outcome measures breastfeeding at discharge and maternal neonatal bonding because of lack of data (none of the included studies reported on the outcome breastfeeding or maternal neonatal bonding. |
Samenvatting literatuur
Description of studies
The analysis of the literature is based on the Cochrane systematic review of Middleton (2018) and updated with two recent randomized controlled trials (Keulen, 2019; Wennerholm, 2019).
The systematic review of Middleton (2018) included RCTs and excluded quasi-RCTs, and trials using a cross-over design. Middleton (2018) included 30 trials of which 19 trials compared expectant management to induction of labor at gestational age of ≥ 41 weeks (Augensen, 1987; Bergsjo, 1989; Chanrachakul, 2003; Cohn, 1992; Dyson, 1987; Gelisen, 2005; Hannah, 1992; Heimstad, 2007; Henry, 1969; Herabutya, 1992; James, 2001; Kortekaas, 2014; Martin, 1989; NICHHD, 1994; Ocon, 1997; Roach, 1997; Sahraoui, 2005; Suikkari, 1983; Witter, 1987).
Timing of induction
Five trials reported that they induced women at 41 completed weeks (41+0 or 287 days (Gelisen, 2005; James, 2001; Kortekaas, 2014; Martin, 1989) or 41+3 or 290 days (Chanrachkul, 2003)). In 15 trials (Augensen, 1987; Bergsjo, 1989; Cohn, 1992; Dyson, 1987; Hannah, 1992; Heimstad, 2007; Henry, 1969; Herabutya, 1992; Kortekaas, 2014; NICHHD, 1994; Ocon, 1997; Roach, 1997; Sahraoui, 2005; Suikkari, 1983; Witter, 1987), women were generally induced after 41 completed weeks (after 287 days) up to 42 completed weeks (294 days), with Kortekaas (2014) spanning induction across 41−2+2 weeks and the NICHHD (1994) trial extending from 41 to 43 completed weeks (287 or 301 days).
Expectant management
Expectant management included various combinations of fetal heart rate monitoring, ultrasound for amniotic fluid measurements and, in earlier studies, biochemical tests.
No gestational age limit for induction was imposed or reported in eight of the trials (Cohn, 1992; Dyson, 1987; Henry, 1969; James, 2001; Ocon, 1997; Roach, 1997; Suikkari, 1983; Witter, 1987). In 11 trials, women were induced at the following times (unless they went into spontaneous labour earlier) in the expectant management groups.
- 42 weeks (Gelisen, 2005; Kortekaas, 2014; Sahraoui, 2005).
- 42 to 43 weeks (Augensen, 1987; Heimstad, 2007).
- 43 weeks (Bergsjo, 1989; Martin, 1989).
- 44 weeks (Chanrachakul, 2003; Hannah, 1992; Herabutya, 1992; NICHHD, 1994).
The study of Kortekaas (2014) reported preliminary results of the INDEX-trial. In the literature review results of this study are not reported, and have been updated with the results from the publication of Keulen (2019).
The study of Keulen (2019) is an open label, multi-center randomized controlled non-inferiority trial that compared induction of labour at 41 weeks with expectant management until 42 weeks in low risk women in the Netherlands. Exclusion criteria for the study were age younger than 18 years, ruptured membranes or in labour, or both, non-reassuring fetal status (eg, no fetal movements, or abnormal fetal heart rate and/or expected intrauterine growth restriction), known fetal abnormalities (including abnormal karyotype) that could influence perinatal outcome, contraindications to induction (including previous caesarean section), or contraindications to expectant management (eg, pregnancy induced hypertension). N=1801 low risk women with an uncomplicated singleton pregnancy were randomised to induction (n=900) or to expectant management until 42 weeks (n=901). After written informed consent had been obtained, the study participants underwent digital vaginal examination to determine the Bishop score. Sweeping of the membranes was optional. Induction took place at 41 weeks (scheduled at 41 weeks+0 days-41 weeks+1 day) or expectant management was initiated until 42 weeks with induction if necessary.
The study of Wennerholm (2019) is a multi-center randomized controlled trial that compared induction of labor at 41 weeks with expectant management and induction of labor at 42 weeks in women with a low risk pregnancy in 14 hospitals in Sweden. n=1381 women were assigned to the induction group and n=1379 were assigned to the expectant management group. Enrollment was excluded if women had a previous caesarean delivery or other uterine surgery, pregestational and insulin dependent gestational diabetes, hypertensive disorder of pregnancy, known oligohydramnios (amniotic fluid index < 50 mm or deepest vertical pocket < 20 mm) or small for gestational age fetus (estimated fetal weight ≤ 2 standard deviations according to the sex and gestational age specific Swedish reference) diagnosed fetal malformation, contraindication to vaginal delivery, and any other maternal condition affecting the progress of the pregnancy to 42 weeks. Five (Stockholm region) of the 14 centers performed an additional 41w ultrasound scan before enrollment to identify a ‘normal’ pregnancy by normal amniotic fluid and a fetal abdominal diameter > 110mm. Induction of labor was carried out in the same way in both groups. After randomization, no monitoring was offered within the framework of the trial. The Wennerholm study was stopped early at the interim analysis owing to a significantly higher rate of perinatal mortality in the expectant management group.
The studies comparing induction of labour at 41 weeks with expectant management until 42 weeks were reported as subgroup because this is in line with current practice in the Netherlands.
Results
Neonatal outcomes
Outcome measure 1. Perinatal death
The outcome measure perinatal death was reported in 15 trials (Augensen, 1987; Bergsjo, 1989; Chanrachakul, 2003; Dyson, 1987; Gelisen, 2005; Hannah, 1992; Heimstad, 2007; Henry, 1969; Herabutya, 1992; James, 2001; Keulen, 2019; Martin, 1989; NICHHD, 1994; Sahraoui, 2005; Suikkari, 1983). Middleton (2018) defined perinatal death as intrauterine deaths plus neonatal deaths in the first week of life. Keulen (2019) defined perinatal mortality as fetal death, intrapartum death, and neonatal death until 28 days. Wennerholm (2019) defined perinatal mortality as stillbirth and neonatal death (days 0 to 27).
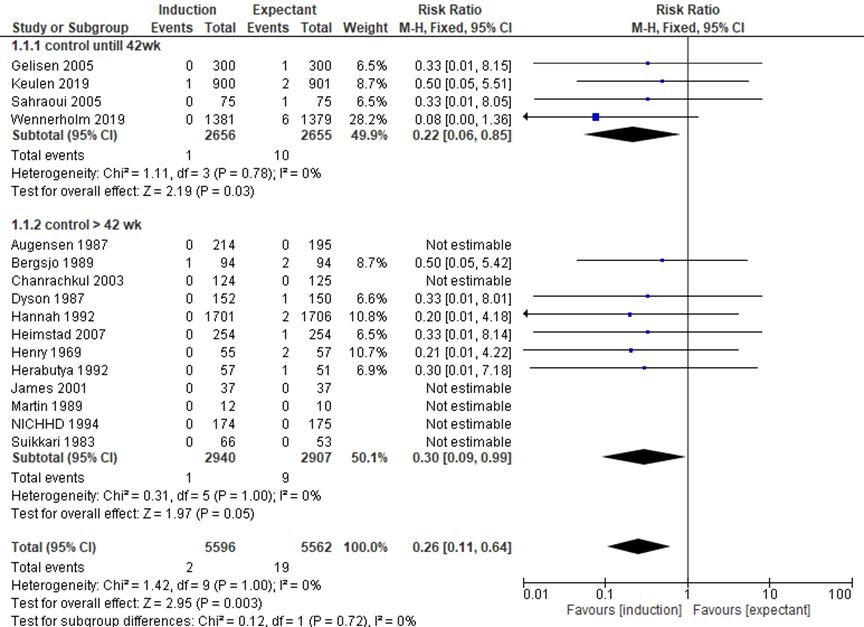
There were fewer perinatal deaths in the induction group (2/5596) compared to the expectant management group (19/5562) (pooled RR 0.26, 95% CI 0.11 to 0.64). In the subgroup expectant management until 42 weeks, there were fewer perinatal deaths in the induction group (1/2656) compared to the expectant management group (10/2655) (pooled RR 0.22, 95%CI 0.06 to 0.84).
Figure 1 Perinatal mortality (source: Middleton, 2018; Keulen, 2019; Wennerholm, 2019)
Outcome measure 2. Neonatal infection
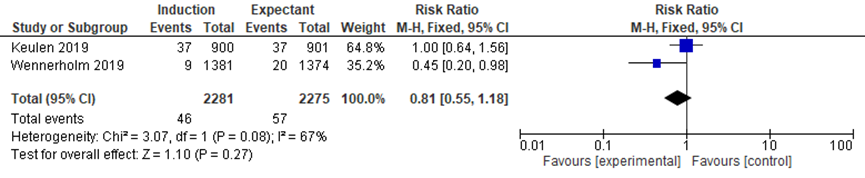
Keulen (2019) defined the outcome neonatal infection/sepsis as clinical suspected findings or proved positive blood culture result. There was no difference in the outcome neonatal infection between the induction group (37/900) and the expectant management group (37/901) (RR 1.00, 95%CI 0.64 to 1.56, p=1.00).
Wennerholm (2019) reported the outcome sepsis. There were fewer cases of sepsis in the induction group (9/1381) compared to the expectant management group (20/1374) (RR 0.45 95%CI 0.20 to 0.98, p=0.06). The pooled RR 0.81 (95%CI 0.55 to 1.18).
Figure 2 Neonatal infection (source: Keulen, 2019; Wennerholm, 2019)
Outcome measure 3. Apgar-score of less than 7 at 5 minutes
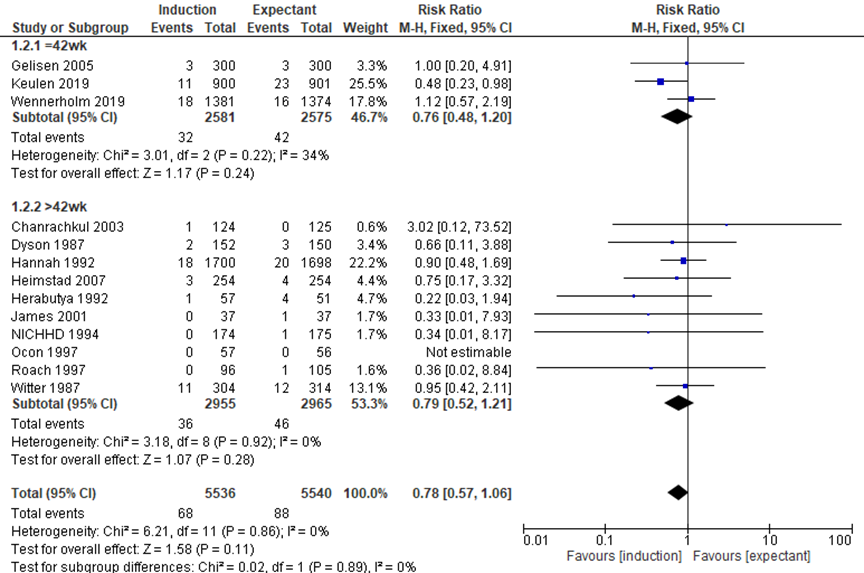
The outcome Apgar score of less than 7 at 5 minutes was reported in 13 trials (figure 3). There was no difference in reported Apgar score < 7 at 5 minutes between the induction groups (68/5536) and the expectant management groups (88/5540) (RR 0.78, 95%CI 0.57 to 1.06). In the subgroup expectant management until 42 weeks, there was no difference in reported Apgar score < 7 at 5 minutes between the induction group (32/2581) compared to the expectant management group (42/2575) (pooled RR 0.76, 95%CI 0.48 to 1.20).
Figure 3 Apgar score of less than 7 at 5 minutes (source: Middleton, 2018; Keulen, 2019; Wennerholm, 2019)
Outcome measure 4. NICU/hospital admission
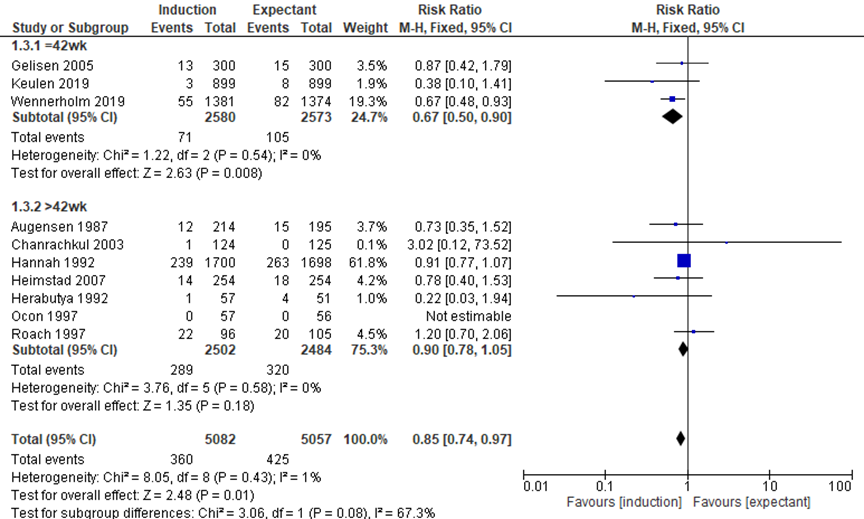
The outcome NICU admission was reported in 10 trials. There were fewer NICU admissions in the induction groups (330/5082) compared to the expectant management groups (425/5057) (pooled RR 0.85, 95%CI 0.74 to 0.97). In the subgroup expectant management until 42 weeks, there were fewer NICU admissions in the induction groups (71/2580) compared to the expectant management groups (105/2573) (pooled RR 0.67, 95%CI 0.50 to 0.90).
Figure 4 NICU admission (source: Middleton, 2018; Keulen, 2019; Wennerholm, 2019)
Outcome measure 5. Shoulder dystocia
Gelisen (2005) reported no significant difference in the outcome shoulder dystocia between the induction group (1/300) and the expectant management group (7/300).
Wennerholm (2019) reported no difference in shoulder dystocia between the induction group 0.4% (6/1381) and the expectant management group 0.3% (4/1379) (RR 1.50, 95%CI 0.42 to 5.30).
Maternal outcomes
Outcome measure 6. Mode of delivery - Cesarean
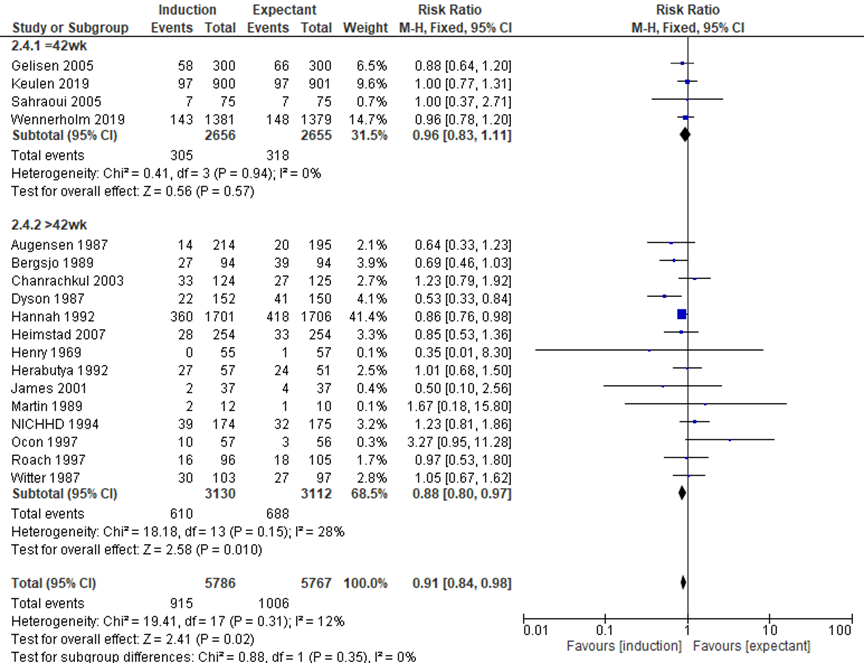
The outcome caesarean section was reported in 18 trials. There were fewer caesarean sections in the induction groups (915/5786) compared with the expectant management groups (1006/5767) (pooled RR 0.91, 95% CI 0.84 to 0.98). This difference was statistically significant. For the subgroup expectant management until 42 weeks (Gelisen, 2005; Keulen, 2019; Sahraoui, 2005; Wennerholm, 2019) there was no statistical significant difference in caesarean sections in the induction groups (305/2656) compared with the expectant management groups (318/2655) (pooled RR 0.96, 95% CI 0.83 to 1.11).
Figure 5 Mode of delivery - Caesarean (Source: Middleton, 2018; Keulen, 2019; Wennerholm, 2019)
Outcome measure 7. Mode of delivery - Operative vaginal birth (forceps or ventouse)
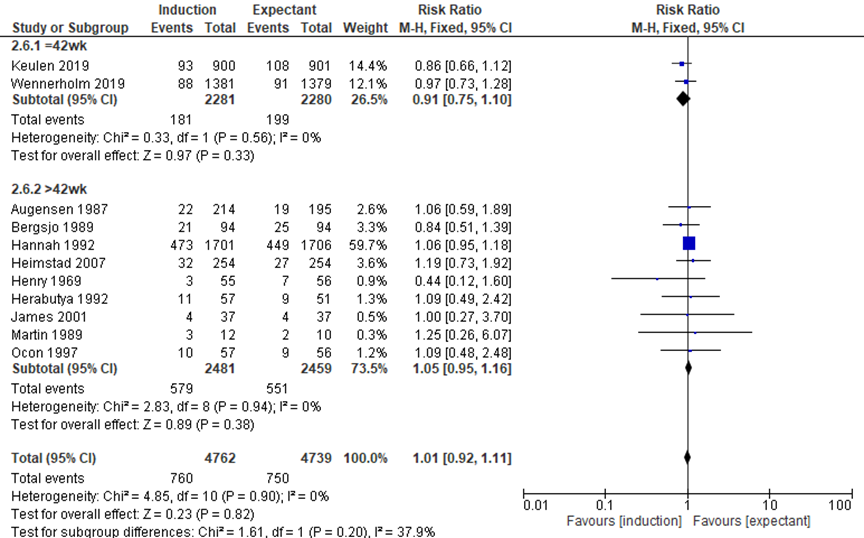
The outcome operative vaginal birth was reported in 11 trials. There was no difference in the outcome operative vaginal birth (forceps or ventouse) between the induction groups (760/4762) compared to the expectant management groups (750/4739) (RR 1.01, 95%CI 0.92 to 1.11). For the subgroup expectant management until 42 weeks there was no difference in the outcome operative vaginal birth (forceps or ventouse) between the induction groups (181/2281) compared to the expectant management groups (199/2280) (RR 0.91, 95%CI 0.75 to 1.10).
Figure 6 Mode of delivery - operative vaginal birth (source: Middleton, 2018; Keulen, 2019; Wennerholm, 2019)
Outcome measure 8. Indication for Cesarean section
Keulen (2019) reported indications for cesarean section. Failure to progress at first stage was 29.9% in the induction group and 21.6% in the expectant management group (RR 1.38, 95%CI 0.85 to 2.25). Failure to progress at second stage was 12.4% in the induction group and 18.6% in the expectant management group (RR 0.67, 95%CI 0.34 to 1.31). Suspected fetal distress was 24.7% in the induction group and 21.6% in the expectant management group (RR 1.14, 95%CI 0.68 to 1.91).
Wennerholm (2019) reported indications for emergency cesarean sections.
Failed induction was 5.8% (8/138) in the induction group and 4.8% (7/146) in the expectant management group. Failure to progress at first stage was 43.5% (60/138) in the induction group and 36.3% 53/146 in the expectant management group. Fetal distress at first stage was 25.4% (35/138) in the induction group and 19.2% (28/146) in the expectant management group. Other indication at first stage was 3.6% (5/138) in the induction group and 3.4% (5/146) in the expectant management group. Failure to progress at second stage was 8.0% (11/138) in the induction group and 15.8% (23/146) in the expectant management group. Fetal distress at second stage was 4.3% (6/138) in the induction group and 5.5% (8/146) in the expectant management group.
Outcome measure 9. Maternal death
Keulen (2019) and Wennerholm (2019) reported no maternal deaths in both study groups (induction group: 0/2281, expectant management group 0/2272). The outcome maternal mortality was not reported in the other studies.
Outcome measure 10. Postpartum hemorrhage
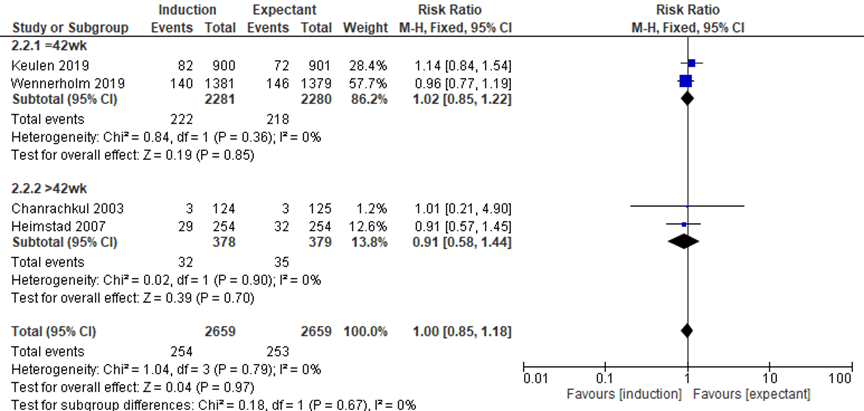
Four studies reported postpartum hemorrhage (Charanchakul, 2003; Heimstad, 2007; Keulen, 2019; Wennerholm, 2019). Charanchakul (2003) did not define the outcome, Heimstad (2007) reported blood loss > 500ml, Keulen (2019) and Wennerholm (2019) reported blood loss >= 1000ml. There was no difference in the outcome postpartum hemorrhage between the induction groups and the expectant management groups (pooled RR 1.00, 95%CI 0.85 to 1.18). For the subgroup expectant management until 42 weeks there was no difference in the outcome postpartum hemorrhage between the induction groups and the expectant management groups (pooled RR 1.02, 95%CI 0.85 to 1.22).
Figure 7 Hemorrhage (Source: Middleton, 2018; Keulen, 2019; Wennerholm, 2019)
Outcome measure 11. Analgesia
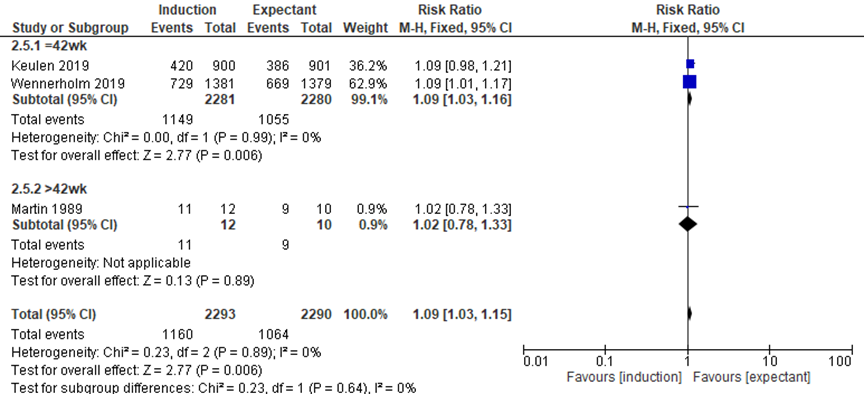
Three studies reported on the outcome analgesia used (Keulen, 2019; Martin, 1989; Wennerholm, 2019). Keulen (2019) reported on remifentanil, opiates, epidural and other. Martin (1989) defined analgesia as local, pudendal, epidural and general. Wennerholm reported use of epidural anaesthesia. There was a statistically significant, however not clinically relevant difference in the outcome use of analgesia between the induction groups and the expectant management groups (pooled RR 1.09, 95%CI 1.03 to 1.15). For the subgroup expectant management until 42 weeks there was a statistically significant, however not clinically relevant difference in the outcome use of analgesia between the induction groups and the expectant management groups (pooled RR 1.09, 95%CI 1.03 to 1.16).
Figure 8 Analgesia (Source: Middleton, 2018; Keulen, 2019; Wennerholm, 2019)
Outcome measure 12. Perineal trauma
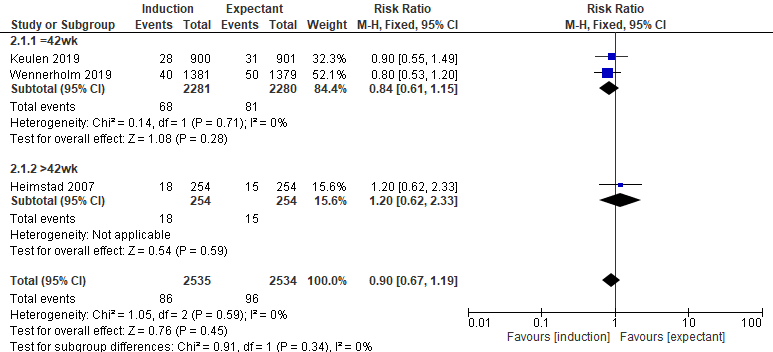
Three studies reported on perineal trauma (Heimstad, 2007; Keulen, 2019; Wennerholm, 2019). Heimstad (2007) defined severe perineal lacerations as third and fourth-degree perineal laceration during delivery. Keulen (2019) defined perineal trauma as severe perineal injury (third or fourth degree perineal tear, obstetrical anal sphincter injuries - OASIS -). Wennerholm (2019) reported perineal tear grade 3 or 4. There was no difference in the outcome perineal trauma between the induction groups (86/2535) and the expectant management groups (96/2534) (pooled RR 0.90, 95%CI 0.67 to 1.19). For the subgroup expectant management until 42 weeks there was no difference in the outcome perineal trauma between the induction groups (68/2281) and the expectant management groups (81/2280) (pooled RR 0.84, 95%CI 0.61 to 1.15).
Figure 9 Perineal trauma (source: Middleton, 2018; Keulen, 2019; Wennerholm, 2019)
Outcome measure 13. Maternal satisfaction
One study, Heimstad (2007), reported maternal satisfaction defined as ‘hoping to be randomized to the same trial arm as they had been in this study’. More women reported maternal satisfaction in the induction group (184/250) compared to the expectant management group (94/246) (RR 1.93, 95%CI 1.62 to 2.30).
Outcome measure 14. Breastfeeding at discharge
Wennerholm (2019) reported the outcome breastfeeding at discharge from delivery hospital. There was no difference between the induction group 96.9% (987/1019) and the expectant management group 96.7% (981/1014) (RR 1.00, 95%CI 0.99 to 1.02, p=0.98).
Outcome measure 15. Maternal-neonatal bonding
None of the included studies reported on the outcome bonding.
Level of evidence of the literature
Neontatal outcomes
The level of evidence regarding the outcome measure perinatal death was downgraded by 1 level because of imprecision (low number of cases and early termination of the Swepis study) (-1) to moderate. The confidence intervals do not cross the clinical decision threshold between recommending and not recommending the intervention. However, the optimal information size is not met and the event rate is very low. Although the sample size is large, the early termination of the Swepis study could also lead to impresicion.
The level of evidence regarding the outcome measure neonatal infection was downgraded by 2 levels because of study limitations (risk of bias) (-1) and inconsistency (-1) to low.
The level of evidence regarding the outcome measure Apgar-score was downgraded by 2 levels because of study limitations (risk of bias, no blinding possible) (-1) and imprecision (crossing the line of clinical relevance) (-1) to low.
The level of evidence regarding the outcome measure NICU admission was downgraded by 1 level because of study limitations (risk of bias) (-1) to moderate.
The level of evidence regarding the outcome measure shoulder dystocia was downgraded by 3 levels because of study limitations (risk of bias) (-1), and imprecision (wide 95% confidence interval crossing the line of no (clinically relevant) effect) (-2) to very low.
Maternal outcomes
The level of evidence regarding the outcome measure mode of delivery - operative vaginal birth was downgraded by 1 level because of study limitations (risk of bias) (-1) to moderate.
The level of evidence regarding the outcome measure mode of delivery - cesarean delivery was downgraded by 1 level because of study limitations (risk of bias) (-1) to moderate.
The level of evidence regarding the outcome measure indication for cesarean section was downgraded with two levels because of imprecision (wide 95% confidence interval crossing the line of no (clinically relevant) effect) (-2) to low.
The level of evidence regarding the outcome measure maternal mortality was downgraded by 2 levels because of imprecision (number of cases) (-2) to low.
The level of evidence regarding the outcome measure hemorrhage was downgraded by 1 level because of study limitations (risk of bias) (-1) moderate.
The level of evidence regarding the outcome measure analgesia was downgraded by 2 levels because of study limitations (risk of bias) (-1) and clinical heterogeneity (-1) to low.
The level of evidence regarding the outcome measure perineal trauma was downgraded by 2 levels because of study limitations (risk of bias) (-1) and confidence intervals crossing the line of no effect (imprecision) (-1) to low.
The level of evidence regarding the outcome measure satisfaction was downgraded by 3 levels because of study limitations (risk of bias) (-1) and imprecision (only one study) (-2) to very low.
The level of evidence regarding the outcome measure breastfeeding at discharge was downgraded by 3 levels because of study limitations (risk of bias) (-1) and imprecision (only one study) (-2) to very low.
The level of evidence was not determined for the outcome measure maternal neonatal bonding because of lack of data (none of the included studies reported on the outcome maternal neonatal bonding, no GRADE assessment).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
P: patients low risk, uncomplicated singleton pregnancy at a gestational age of 41 weeks with the child in cephalic position;
I: intervention induction of labor;
C: control expectant management;
O: outcome measure at least one of the following:
Neonatal outcomes
- perinatal mortality;
- infection;
- Apgar-score < 7 at 5 minutes;
- hospital/ Neonatal Intensive Care Unit (NICU) admission;
- shoulder dystocia.
Maternal outcomes
- maternal mortality;
- mode of delivery (spontaneous, instrumental, or cesarean section);
- indications for cesarean section (failure to progress, or fetal distress);
- postpartum hemorrage;
- analgesia;
- perineal trauma;
- patient satisfaction;
- breastfeeding.
Relevant outcome measures
Neonatal outcomes
The guideline development group considered perinatal mortality, infection/sepsis, Apgar-score < 7 at 5 minutes and hospital/ Neonatal Intensive Care Unit (NICU) admission as critical outcome measures for decision making, and shoulder dystocia as important outcome measures for decision making.
Maternal outcomes
The guideline development group considered mode of delivery and indications for cesarean delivery, maternal mortality, and postpartum blood loss as critical outcome measures for decision making; and analgesia, perineal trauma, patient satisfaction, breastfeeding, and maternal neonatal bonding as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the GRADE default - a difference of 25% in the relative risk for dichotomous outcomes (Schünemann, 2013) and 0.5 standard deviation for continuous outcomes - as a minimal clinically (patient) important difference. For the critical outcome measures mortality (neonatal and maternal), NICU admission, Apgar-score < 7, and cesarean delivery statistical significant differences were considered clinically relevant.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until November 25th 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 204 hits. Studies were selected based on the following criteria systematic reviews (search conducted in at least 2 databases, detailed search strategy, and risk of bias assessment available or randomized controlled trials comparing induction of labour with expectative management including at least one of the selected outcome measures in women with low risk, uncomplicated singleton pregnancy at a gestational age of 41 weeks with the child in cephalic position. 40 studies were initially selected based on title and abstract screening. After reading the full text, 37 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 3 studies were included.
Results
In the analysis of the literature 3 studies were included. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Alkmark, M., Keulen, J. K., Kortekaas, J. C., Bergh, C., van Dillen, J., Duijnhoven, R. G., ... & Saltvedt, S. (2020). Induction of labour at 41 weeks or expectant management until 42 weeks: A systematic review and an individual participant data meta-analysis of randomised trials. PLoS medicine, 17(12), e1003436.
- Finucane, E. M., Murphy, D. J., Biesty, L. M., Gyte, G. M., Cotter, A. M., Ryan, E. M., ... & Devane, D. (2020). Membrane sweeping for induction of labour. Cochrane Database of Systematic Reviews, (2).
- Keulen JK, Bruinsma A, Kortekaas JC, van Dillen J, Bossuyt PM, Oudijk MA, Duijnhoven RG, van Kaam AH, Vandenbussche FP, van der Post JA, Mol BW, de Miranda E. (2019). Induction of labour at 41 weeks versus expectant management until 42 weeks (INDEX): multicentre, randomised non-inferiority trial. BMJ. 20;364:l344. doi: 10.1136/bmj.l344.
- Middleton P, Shepherd E, Crowther CA. (2018). Induction of labour for improving birth outcomes for women at or beyond term. Cochrane Database Syst Rev. 9;5:CD004945. doi: 10.1002/14651858.
- Wennerholm UB, Saltvedt S, Wessberg A, Alkmark M, Bergh C, Wendel SB, Fadl H, Jonsson M, Ladfors L, Sengpiel V, Wesström J, Wennergren G, Wikström AK, Elden H, Stephansson O, Hagberg H. (2019). Induction of labour at 41 weeks versus expectant management and induction of labour at 42 weeks (SWEdish Post-term Induction Study, SWEPIS): multicentre, open label, randomised, superiority trial. BMJ. 20;367:l6131. doi: 10.1136/bmj.l6131.
- Vijgen SM, Koopmans CM, Opmeer BC, Groen H, Bijlenga D, Aarnoudse JG, Bekedam DJ, van den Berg PP, de Boer K, Burggraaff JM, Bloemenkamp KW, Drogtrop AP, Franx A, de Groot CJ, Huisjes AJ, Kwee A, van Loon AJ, Lub A, Papatsonis DN, van der Post JA, Roumen FJ, Scheepers HC, Stigter RH, Willekes C, Mol BW, Van Pampus MG; HYPITAT study group. (2010). An economic analysis of induction of labour and expectant monitoring in women with gestational hypertension or pre-eclampsia at term (HYPITAT trial). BJOG. 117(13).
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Keulen, 2019 |
Type of study: RCT
Setting and country: 123 primary care midwifery practices and 45 hospitals, the Netherlands
Funding and conflicts of interest: Funding: This study was supported by a grant from the Netherlands Organisation for Health Research and Development ZonMw
Competing interests: BWM is supported by a National Health and Medical Research Council practitioner fellowship (GNT1082548) and reports consultancy for ObsEva, Merck, and Guerbet; no support from any other organisation for the submitted work; no financial relationships with any organisations that might have an interest in the submitted work in the previous three years, no other relationships or activities that could appear to have influenced the submitted work. |
Inclusion criteria: Women were eligible for the study if they had a low risk, uncomplicated singleton pregnancy with the child in a stable cephalic position at a certain gestational age of 40 weeks+5 days to 41 weeks+0 days and no contraindications to expectant management until 42 weeks. Gestational age had to be determined by ultrasonography before a gestational age of 16 weeks.
Exclusion criteria: Exclusion criteria for the study were age younger than 18 years, ruptured membranes or in labour, or both, non-reassuring fetal status (eg, no fetal movements, or abnormal fetal heart rate and/or expected intrauterine growth restriction), known fetal abnormalities (including abnormal karyotype) that could influence perinatal outcome, contraindications to induction (including previous caesarean section), or contraindications to expectant management (eg, pregnancy induced hypertension).
N total at baseline: N=1801 Intervention: n=900 Control: n=901
Important prognostic factors2: Mean (SD) maternal age (years): I: 30.6 (4.8) C: 30.2 (4.6)
Parity: Nulliparous I: 457 (50.8) C: 511 (56.7)
Bishop score at study entry
Nulliparous women: ≥6 I: 47/457 (10.3) C: 71/511 (13.9) <6 I: 360/457 (78.8) C: 365/511 (71.4) Missing I: 50/457 (10.9) C: 75/511 (14.7)
Multiparous women: ≥6 I: 71/443 (16.0) C: 46/390 (11.8) <6 I: 310/443 (70.0) C: 294/390 (75.4) Missing I: 62/443 (14.0) C: 50/390 (12.8)
Groups comparable at baseline? Baseline characteristics were comparable between the groups, except for nulliparity.
|
Describe intervention (treatment/procedure/test):
Women allocated to induction were scheduled for the procedure at 41 weeks+0 days-41 weeks+1 day. All women were primed or induced, or both according to local protocols. Women with a Bishop score of less than 6 received cervical priming with prostaglandin E1 (misoprostol, oral or vaginal), prostaglandin E2 (dinoprostone), Foley catheter or double balloon catheter, or a combination of these until amniotomy could be performed. Amniotomy was followed by intravenous oxytocin if required.
|
Describe control (treatment/procedure/test):
Women in primary and secondary care who were allocated to expectant management awaited spontaneous onset of labour until 42 weeks+0 days in their initial care setting, with monitoring according to local protocol. Monitoring typically involved a combination of cardiotocography, and sonographic assessment of amniotic fluid in secondary care at 41-42 weeks. Women in the expectant management group with ongoing pregnancies were scheduled for induction at 42 weeks+0 days in secondary care, following a similar induction protocol to the intervention group. |
Length of follow-up: Not specified
Loss-to-follow-up: Intervention: - Control: -
Incomplete outcome data: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Neonatal outcome:
Perinatal mortality Perinatal mortality was defined as fetal death, intrapartum death, and neonatal death until 28 days
Stillbirth I: 1 (0.1) C: 2 (0.2) RR=0.50 (95%CI 0.05 to 5.51) P=1.00
Neonatal death post-partum I: 0 (0.0) C: 0 (0.0) NA
Neonatal infection/sepsis Defined as clinical suspected findings or proved positive blood culture result. C: 37 (4.1) RR=1.00 (95%CI 0.64 to 1.56) P=1.00
Apgar score 5 mins post-partum <7 I: 11 (1.2) C: 23 (2.6) RR: 0.48 (0.23 to 0.98) P=0.038
Neonate admitted to NICU I: 3/899 (0.3) C: 8/899 (0.9) RR=0.38 (0.10 to 1.41) P=0.23
Medium care I: 59 (6.6) C: 60 (6.7) RR=0.98 (95%CI 0.69 to 1.39) P=0.90
Mean (SD) birthweight (g) I: 3685 (417.4) C: 3741 (430.0) MD: −56.6 (−95.8 to −17.4) P=0.005
Plexus brachialis injury I: 0 (0.0) C: 0 (0.0)
Maternal outcome:
Mode of delivery Spontaneous vaginal I: 710 (78.9) C: 696 (77.2) RR 1.02 (0.97 to 1.07) P=0.40
Operative vaginal I: 93 (10.3) C: 108 (12.0) RR 0.86 (0.66 to 1.12) P=0.27
(Secondary) caesarean section I: 97 (10.8) C: 97 (10.8) RR 1.00 (0.77 to 1.31) P=0.99
Indication for secondary caesarean section: n=97 n=97
(failure to progress, or fetal distress),
Failure to progress at first stage 29 (29.9) 21 (21.6) 1.38 (0.85 to 2.25) 0.19 Failure to progress at second stage 12 (12.4) 18 (18.6) 0.67 (0.34 to 1.31) 0.24
Failed operative vaginal delivery 6 (6.2) 12 (12.4) 0.50 (0.20 to 1.28) 0.22‡
Suspected fetal distress 24 (24.7) 21 (21.6) 1.14 (0.68 to 1.91) 0.61
Suspected fetal distress and failure to progress at first stage 7 (7.2) 8 (8.3) 0.75 (0.17 to 3.26) 1.00
Suspected fetal distress and failure to progress at second stage 4 (4.1) 3 (3.1) 1.00 (0.26 to 3.88) 1.00‡
Maternal complication or other 15 (15.5) 14 (14.4) 0.93 (0.48 to 1.83) 0.84
Maternal death I: 0 (0.0) C: 0 (0.0) NA
Postpartum blood loss (mL) Median (interquartile range) I: 300 (200-500) C: 300 (250-500)
Pain treatment during labour I: 420 (46.7) C: 386 (42.8) RR 1.09 (0.98 to 1.20) P=0.10
Perineal trauma severe perineal injury (third or fourth degree perineal tear (obstetrical anal sphincter injuries (OASIS)
Third degree tear I: 15 (1.9) C: 19 (2.4) RR 0.79 (0.40 to 1.54) P=0.49
Fourth degree tear I: 8 (1.0) C: 7 (0.9) RR 1.14 (0.41 to 3.14) P=0.80
Obstetrical anal sphincter injuries I: 28 (3.5) C: 31 (3.9) RR 0.90 (0.55 to 1.49) P= 0.69
Total I: 51/900 C: 57/901
Patient satisfaction not reported
Breastfeeding not reported
Bonding not reported |
Primary outcome: Composite outcome defined as perinatal mortality (fetal death, intrapartum death, and neonatal death until 28 days) or perinatal morbidity (a 5 minute Apgar score <7, and/or meconium aspiration syndrome, and/or plexus brachialis injury, and/or intracranial haemorrhage, and/or NICU admission). |
|
Wennerholm, 2019 |
Type of study: RCT
Setting and country: 14 hospitals, Sweden
Funding and conflicts of interest:
“This study was supported by the Swedish state. The funders had no role in study design, data collection, data analysis, data interpretation, or writing of the report. The researchers were independent of the funders.”
Competing interests: All authors have completed the ICMJE uniform disclosure form at www.icmje.org/coi_disclosure.pdf and declare: no support from any organisation for the submitted work; no financial relationship with any organisation that might have an interest in the submitted work in the previous three years; no other relationships or activities that could appear to have influenced the submitted work. AKW has received free reagents (PlGF) from Roche for a prediction study of pre-eclampsia. |
Inclusion criteria: -age =>18 yr -a singleton pregnancy with a fetus in cephalic presentation - at 40 weeks+6 days to 41 weeks+1 day according to ultrasound based dating in the first or early second trimester or for pregnancies after assisted reproduction according to the day of oocyte retrieval -understanding of oral and written information
Exclusion criteria: -previous caesarean delivery or other uterine surgery -pregestational and insulin dependent gestational diabetes hypertensive disorder of pregnancy -known oligohydramnios (amniotic fluid index <50 mm or deepest vertical pocket <20 mm) -small for gestational age fetus (estimated fetal weight ≤2 standard deviations according to the sex and gestational age specific Swedish reference) -diagnosed fetal malformation -contraindication to vaginal delivery -any other maternal condition affecting the progress of the pregnancy to 42 weeks
N total at baseline: N=2762 Intervention: n=1381 Control: n=1379
Important prognostic factors2: Mean (SD) maternal age (years): I: 31.2 (4.7) C: 31.2 (4.5)
Parity: Nulliparous I: 55.2% C: 54.6%
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Randomisation was done between 40 weeks+6 days and 41 weeks+1 day.
In the induction group, labour was induced within 24 hours of randomisation (ie, same or next day) but not earlier than 41 weeks+0 days
Induction of labour was carried out in the same way in both groups.
Amniotomy was performed if the fetal head was well engaged and the cervix was ripe (Bishop score ≥6 for primiparous women and ≥5 for multiparous women), followed by oxytocin infusion after 1-2 hours without spontaneous regular contractions. If the fetal head was not engaged or the cervix was less ripe, any of the following methods was used according to local routines: mechanical dilation with a Foley-like catheter, prostaglandin E1 (misoprostol, oral or vaginal), or prostaglandin E2 (dinoprostone, vaginal).
After randomisation, no monitoring was offered within the framework of the trial.
In Sweden, most antenatal clinics offer one follow-up visit after term, usually around 41 weeks, including measurement of blood pressure, fundal height, and fetal heart rate by doptone.
|
Describe control (treatment/procedure/test):
In the expectant management group, labour was induced at 42 weeks+0 days to 42 weeks+1 day
|
Length of follow-up: Not reported
Loss-to-follow-up: Intervention:n=2 Reason: Withdrew consent before intervention Control: n=0
Incomplete outcome data: - |
Outcome measures and effect size (include 95%CI and p-value if available):
Neonatal outcome:
Perinatal/neonatal mortality (stillbirth+neonatal mortality), n (%) I: 0/1381 (0.0) C: 6/1379 (0.4) P=0.03
Apgar score <7 at 5 minutes (of live births), n (%) I: 18/1381 (1.3) C: 16/1374 (1.2) RR 1.12 (95%CI 0.57 to 2.19) p=0.88
NICU admittance, n (%) I: 55/1381 (4.0) C: 82/1374 (6.0) RR 0.67 (95%CI 0.48 to 0.93) p=0.02
Sepsis, n (%) I: 9/1381 (0.7) C: 20/1374 (1.5) RR 0.45 (95%CI 0.20 to 0.98) p=0.06
Birth weight, Mean (sd): I: n=1381 3815 g (409) C: n=1379 3875 g (436) MD: −60.1 (−91.8 to −29.6)
Maternal outcome
Mode of delivery
Caesarean section, N (%) I: 143/1381 (10.4) C: 148/1379 (10.7) RR 0.96 (95%CI 0.78 to 1.20) P=0.79
Indication for emergency caesarean, N (%)
Failed induction I: 8/138 (5.8) C: 7/146 (4.8)
Failure to progress at first stage I: 60/138 (43.5) C: 53/146 (36.3)
Fetal distress at first stage I: 35/138 (25.4) C: 28/146 (19.2)
Failure to progress and fetal distress at first stage I: 6/138 (4.3) C: 7/146 (4.8)
Other indication at first stage I: 5/138 (3.6) C: 5/146 (3.4)
Failure to progress at second stage I: 11/138 (8.0) C: 23/146 (15.8)
Fetal distress at second stage I: 6/138 (4.3) C: 8/146 (5.5)
Failure to progress and fetal distress at second stage I: 0 (0.0) C: 3/146 (2.1)
Failure of operative vaginal delivery I: 7/138 (5.1) C: 12/146 (8.2)
Assisted vaginal, N (%) I: 88/1381 (6.4) C: 91/1379 (6.6) RR 0.97 (95%CI 0.73 to 1.28) P=0.87
Use of epidural anaesthesia, N (%) I: 729/1381 (52.8) C: 669/1379 (48.5) RR 1.09 (95%CI 1.01 to 1.17) p=0.03
Shoulder dystocia, N (%) I: 6 (0.4) C: 4 (0.3) RR 1.50 (95%CI 0.42 to 5.30) P= 0.76
Perineal tear grade 3 or 4, N (%) I: 40 (2.9) C: 50 (3.6) RR: 0.80 (95%CI 0.53 to 1.20) P=0.33
Postpartum haemorrhage (>1000 mL), N (%) I: 140 (10.1) C: 146 (10.6) RR 0.96 (95%CI 0.77 to 1.19) P=0.75
Maternal death, N (%) I: 0 (0.0) C: 0 (0.0) |
The study was stopped early owing to a significantly higher rate of perinatal mortality in the expectant management group. |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Middleton, 2018 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
Yes |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
|
Keulen, 2019 |
‘Participants were randomly allocated by a web based program (ALEA) using randomly permuted block sizes of 4 and 2, stratified by centre to induction of labour at 41 weeks+0 days-1 week or to expectant management with subsequent induction if necessary at 42 weeks+0 days.’ |
unlikely |
Blinding not possible |
Blinding not possible |
unlikely, ‘the statistician who performed the analyses was blinded to the allocation of the participants’ |
unlikely |
unlikely |
unlikely |
|
|
Wennerholm, 2019 |
‘Allocation to a trial group, 1:1, was done with central online randomisation by dynamic allocation, a method that actively minimises the imbalance between the groups for each new patient that is randomised. Centre and parity (primiparity versus multiparity) were used as minimisation variables. The Swedish Pregnancy Register set up the randomisation module, which was incorporated in the register but separate from the register data. Access to the randomisation module used a separate log-in system.’ |
Unlikely |
Blinding not possible |
Blinding not possible |
unclear |
unlikely |
unlikely |
unlikely |
|
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Rydahl, 2019 |
SR included quasi experimental studies |
|
Kortekaas, 2014 |
in SR Middleton |
|
Hussain, 2011 |
Review before SR Middleton 2018 (included same studies) |
|
Sanchez-Ramos, 2003 |
Review before SR Middleton 2018 |
|
Pavicic, 2009 |
Retrospective review of two non-randomized contemporaneous cohorts |
|
Hermus, 2009 |
retrospective matched cohort study |
|
Daskalakis, 2014 |
Wrong design, Quasi-RCT |
|
Heimstad, 2007 |
in SR Middleton |
|
Gelisen, 2005 |
in SR Middleton |
|
Fok, 2006 |
Policy change |
|
Siozos, 2005 |
Narrative |
|
Proctor, 2017 |
Policy change |
|
Arif, 2015 |
Does not meet PICO criteria, does not compare induction to expectant management |
|
Rydahl, 2014 |
Protocol |
|
Myers, 2002 |
Dated, Does not meet current practice |
|
Greve, 2011 |
Does not meet PICO criteria, wrong comparison |
|
Bleicher, 2017 |
Policy change |
|
Thangarajah, 2016 |
Does not meet PICO criteria |
|
Hedegaard, 2015 |
retrospective cohort, policy change, groep>37 wk |
|
Gibson, 2015 |
Commentary |
|
Parikh, 2014 |
Narrative, |
|
Hedegaard, 2014 |
retrospective cohort, policy change |
|
Heimstad, 2007 |
in SR Middleton |
|
Cleary-Goldman, 2006 |
Does not meet PICO criteria, not comparative research |
|
Menticoglou, 2002 |
No original research |
|
Oros, 2012 |
Quasi experimental |
|
Heimstad, 2008 |
No comparative research |
|
Treger, 2002 |
Does not meet PICO criteria, wrong comparison |
|
Otoide, 2001 |
Does not meet PICO criteria, I: no induction |
|
Klefstad, 2014 |
Does not meet PICO criteria, P: high risk |
|
Kearns, 2008 |
No original research, abstract Cochrane review |
|
Mahapatro, 2015 |
Does not meet PICO criteria, results not reported for different GA |
|
Chanrachakul, 2003 |
in SR Middleton |
|
Caughey, 2013 |
Commentary |
|
Burgos, 2012 |
Quasi experimental |
|
Sobande, 2003 |
Wrong design, no RCT |
|
Alexander, 2000 |
Does not meet PICO criteria, wrong comparison |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-02-2021
Beoordeeld op geldigheid : 15-02-2021
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Regiehouder(s)[1] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijnmodule[2] |
Frequentie van beoordeling op actualiteit[3] |
Wie houdt er toezicht op actualiteit[4] |
Relevante factoren voor wijzigingen in aanbeveling[5] |
|
NVOG |
2021 |
2026 |
Eens in vijf jaar |
NVOG |
Lopend onderzoek |
De andere aan deze richtlijnmodule deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
[1] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[2] Maximaal na vijf jaar
[3] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[4] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[5] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC, NVOG, voorzitter (vanaf 2020)
- Dr. A.C.C. (Annemiek) Evers, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVOG (voorzitter tot 2020)
- Dr. S.V. (Steven) Koenen, gynaecoloog, werkzaam in het ETZ, locatie Elisabeth Ziekenhuis, NVOG, lid stuurgroep.
- Dr. J.J. (Hans) Duvekot, gynaecoloog, werkzaam in het Erasmus MC, NVOG, lid stuurgroep
- Drs. E.C. (Eline) van der Wilk, gynaecoloog, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVOG
- Dr. S. (Sander) Galjaard, gynaecoloog, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVOG
- Dr. F. (Floris) Groenendaal, kinderarts/neonatoloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVK
- D.C. (Lianne) Zondag, MSc, beleidsmedewerker en eerstelijns verloskundige, KNOV
- A.M. (Sandra) Oomen van Dun, MSc, Physician assistant/klinisch verloskunde, werkzaam in het Elisabeth TweeSteden Ziekenhuis te Tilburg, KNOV
- H. (Hannah) de Klerk, MSc, zelfstandig waarnemend verloskundige, KNOV
- J.C. (Anne) Mooij, MSc, adviseur, Patientenfederatie Nederland
- M.A. (Marleen) van Driel, gastdocent en verpleegkundige, Stichting Zelfbewustzwanger
Met ondersteuning van
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
Actie |
|
Evers * |
Gynaecoloog, UMCU |
"Lid van Ciekwal, voorzitter 50 geboortemodules NVOG Werkgroep multidisciplinaire richtlijn extreme vroeggeboorte, NVOG" |
Geen |
Geen actie. |
|
Bax * |
Gynaecoloog-perinatoloog Amsterdam UMC 0,8FTE |
Gastvrouw Hospice Xenia Leiden (onbetaald) |
Geen |
Geen actie. |
|
Duvekot |
Gynaecoloog, Erasmus MC (full time) |
Directeur 'medisch advies en expertise bureau Duvekot', Ridderkerk, ZZP'er |
Geen |
Geen actie. |
|
Koenen
|
Gynaecoloog, ETZ , Tilburg |
incidenteel juridische expertise (betaald) |
Geen |
Geen actie. |
|
Galjaard |
Gynaecoloog ErasmusMC, Rotterdam, full-time |
Associate member Diabetes in Pregnancy Study Group (DPSG), onbesoldigd |
Geen |
Geen actie. |
|
Groenendaal |
Kinderarts-neonatoloog, associate professor, werkzaam bij het Universitair Medisch Centrum Utrecht |
"Lid landelijke werkgroep postmortaal onderzoek (onbetaald) lid landelijke werkgroep extreme vroeggeboorte (onbetaald) Lid landelijke werkgroep ""landelijke Neonatale Registratie' (Perined) (onbetaald)" |
Geen |
Geen actie. |
|
Van Driel |
Gastdocent en verpleegkundige, freelance |
Cliëntvertegenwoordiger namens Stichting Zelfbewustzwanger Voorlichting op middelbaar- en beroepsonderwijs betreffende seksualiteit, bloed/stamcel/orgaan donatie |
Geen |
Geen actie. |
|
De Klerk |
Zelfstandig waarnemend verloskundige, 1fte |
PhD-student Vumc afdeling Midwifery Science, onbetaald |
Geen |
Geen actie. |
|
Oomen-van Dun |
Physician assistant/klinisch verloskunde Elisabeth TweeSteden Ziekenhuis te Tilburg, 0,83fte |
Niet van toepassing |
Geen |
Geen actie. |
|
Mooij |
adviseur Patientenbelang, Patientenfederatie Nederland |
Niet van toepassing |
Geen |
Geen actie. |
|
Zondag |
"Beleidsmedewerker KNOV - 0,5fte Eerstelijns verloskundige – mede praktijkeigenaar verloskundige praktijk De Toekomst Geldermalsen 0,8fte |
"Begeleider literatuurstudies en MSc thesis bij MSc Klinische Verloskunde aan de Hogeschool Rotterdam (betaald) Bestuurslid Netwerk Rivierenland (onbetaald)" |
Geen |
Geen actie. |
|
Van der Wilk |
Gynaecoloog-perinatoloog Erasmus MC |
Niet van toepassing |
Geen |
Geen actie. |
*Voorzitter werkgroep
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vertegenwoordigers van de Patiëntenfederatie Nederland, Stichting Zelfbewustzwanger af te vaardigen in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de modules in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens is er een knelpunteninventarisatie gedaan in november 2018 middels een Invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen in de bijlage.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Kennisinstituut van de Federatie Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Utrecht, 2015.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/werkwijze/richtlijnen_3_0.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Uitgangsvraag: Wat zijn de effecten van inductie van de baring bij ad 41 weken in een laag risico populatie versus. afwachten? |
|
|
Database(s): Medline, Embase |
Datum: 17-04-2019 |
|
Periode: > 2000 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – april 2019
|
1 exp Labor, Induced/ or (induc* adj3 (labor or labour)).ti. (9618) 2 (beyond or post-term or postterm or late term or 41 week* or 42 week* or over mature or postmatur* or postmature or forty one or forty two or prolonged).ti. (72559) 3 1 and 2 (512) 4 limit 3 to (english language and yr="2000 - 2019") (173) 5 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1848687) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (390021) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3163636) 8 4 and 6 (16) 9 4 and 5 (63) 10 9 not 8 (53) 11 4 and 7 (82) 12 11 not 8 not 10 (55) 13 8 or 10 or 12 (124)
= 124 |
201 |
|
Embase (Elsevier) |
('labor induction'/exp OR ((induc* NEAR/3 (labor OR labour)):ti)) AND (beyond:ti OR 'post term':ti OR postterm:ti OR 'late term':ti OR '41 week*':ti OR '42 week*':ti OR 'over mature':ti OR 'postmaturity'/exp OR postmatur*:ti OR 'forty one':ti OR 'forty two':ti OR prolonged:ti) AND (2000-2019)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 21
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 83
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 91
= 195 |
|
Uitgangsvraag: Wat zijn de effecten van inductie van de baring bij ad 41 weken in een laag risico populatie versus. afwachten? |
|
|
Database(s): Medline, Embase |
Datum: 25-11-2019 |
|
Periode: > 2000 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – november 2019
|
1 exp Labor, Induced/ or (induc* adj3 (labor or labour)).ti. (9618) 2 (beyond or post-term or postterm or late term or 41 week* or 42 week* or over mature or postmatur* or postmature or forty one or forty two or prolonged).ti. (72559) 3 1 and 2 (512) 4 limit 3 to (english language and yr="2000 - 2019") (173) 5 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1848687) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (390021) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3163636) 8 4 and 6 (16) 9 4 and 5 (63) 10 9 not 8 (53) 11 4 and 7 (82) 12 11 not 8 not 10 (55) 13 8 or 10 or 12 (124) 14 3 and 6 (from 17-04-2019 to 25-11-2019) (1) 15 3 and 5 (from 17-04-2019 to 25-11-2019) (2) 16 8 or 10 or 12 or 14 or 15 (127)
= 127 |
210 |
|
Embase 2000 – november 2019
|
('labor induction'/exp OR ((induc* NEAR/3 (labor OR labour)):ti)) AND (beyond:ti OR 'post term':ti OR postterm:ti OR 'late term':ti OR '41 week*':ti OR '42 week*':ti OR 'over mature':ti OR 'postmaturity'/exp OR postmatur*:ti OR 'forty one':ti OR 'forty two':ti OR prolonged:ti) AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: (01-1-2000)/sd AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 22
RCT’s: (01-1-2000)/sd AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 89
Observationeel onderzoek: (01-01-2000 to 17-4-2019)/py AND ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 91
= 203 |

