Voorspellende waarde CTG voor foetale nood/uterusruptuur bij vrouwen met een eerdere keizerssnede
Uitgangsvraag
Is er plaats voor een microbloedonderzoek (MBO) na detectie van CTG afwijkingen bij een ‘Trial Of Labour’ bij een patiënte met een sectio in de voorgeschiedenis?
Deze klinische vraag omvat de volgende onderliggende sub vragen:
- Bij een vrouw met een sectio in de voorgeschiedenis, die vaginaal bevalt en die gedurende de bevalling een suboptimaal of abnormaal CTG heeft: is het beter om een interventie te verrichten op basis van het afwijkende CTG of is het beter om eerst een microbloedonderzoek (MBO) te verrichten gevolgd door een interventie op basis van het MBO?
- Bij een vrouw met een sectio in de voorgeschiedenis, die vaginaal bevalt: is een suboptimaal of abnormaal CTG voorspellend voor een uterusruptuur, en hoe dient dit besproken te worden met de patiënte?
Aanbeveling
Bewaak de foetale conditie bij vrouwen met een sectio in de voorgeschiedenis die een Trial Of Labour ondergaan met continue CTG bewaking. Overweeg afhankelijk van de klinische beoordeling aanvullend onderzoek middels MBO als diagnostiek naar hypoxie. Een MBO is echter niet een diagnosticum voor het aantonen danwel uitsluiten van een uterusruptuur.
Bespreek met de zwangere, bij voorkeur in de initiële counseling over TOLAC, dat CTG afwijkingen vaker voorkomen bij vrouwen die een uterusruptuur kregen maar dat het onderscheidend vermogen ten opzichte van vrouwen die geen ruptuur kregen zeer gering is en de voorspellende waarde daarom zeer beperkt is.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er zijn geen studies bekend die de voorspellende waarde van een microbloedonderzoek (MBO) hebben onderzocht voor het ontstaan van een Adverse Outcome (uterusruptuur en/of neonatale asfyxie) na een afwijkend CTG bij vrouwen met een sectio in de voorgeschiedenis die vaginaal bevallen.
De voorspellende waarde van een afwijkend CTG ten aanzien van het bestaan van foetale hypoxie en/of acidose is beperkt. Normaal is aanvullende diagnostiek in de vorm van microbloed onderzoek (MBO) aangewezen om betrouwbaar vast te stellen of er sprake is van foetale hypoxie en acidose. Indien een afwijkend CTG sterk voorspellend zou zijn voor uterusruptuur bij trial of labour (TOL) dan is aanvullende diagnostiek (MBO) overbodig en zal dit alleen maar tot onnodig tijdverlies leiden. Het gaat dus niet om de voorspellende (eventueel toegevoegde) waarde van de uitkomst van het MBO ten aanzien van de aanwezigheid van een uterusruptuur. De vraag is dan ook niet van toepassing bij een preterminaal CTG omdat dan in alle gevallen zal worden geopteerd voor onmiddellijke interventie middels een sectio. De vraag is wel wat de voorspellende waarde is van een suboptimaal of abnormaal CTG op het zich voordoen van uterusruptuur. Hoewel niet precies vast te stellen op grond van bekende studies lijkt het onderscheidend vermogen van een afwijkend CTG in elk geval niet groot (PICO 2). Er zijn twee studies van lage kwaliteit die laten zien dat vrouwen met een uterusruptuur vaker een afwijkend CTG hadden tijdens de bevalling dan vrouwen met een sectio in de voorgeschiedenis zonder uterusruptuur (Andersen, 2016; Desseauve, 2016). De studie van Desseauve laat zien dat CTG afwijkingen (FIGO 3 en vooral 4) vaker voorkwamen bij cases dan bij de controlegroep in de periode tot 60 minuten voor het diagnosticeren van de uterusruptuur (Desseauve, 2016). Een abnormaal CTG kwam echter in de groep vrouwen die geen uterusruptuur ontwikkelden ook veelvuldig voor. Volgens de studie van Andersen zelfs in een percentage van 50-80% bij de controlegroep. Daarnaast is door het case control design niet te zeggen hoeveel procent van de vrouwen met een afwijkend CTG uiteindelijk een uterusruptuur zal ontwikkelen. De bewijskracht van de gevonden studies is zeer laag. De voorspellende waarde van het CTG ten aanzien van het bestaan van foetale hypoxie is altijd al beperkt en daarom wordt vaak objectivering gezocht door het doen van aanvullend onderzoek middels een MBO. Uterus ruptuur is een zeldzame maar potentieel ernstige complicatie bij TOL en er zijn weinig voorspellende signalen tijdens de baring dat een uterusruptuur dreigt. De vraag is dan ook of het zich voordoen van CTG veranderingen alleen tijdens TOL voldoende voorspellende waarde heeft om op grond daarvan direct over te gaan tot repeat sectio. Een dergelijk beleid zal leiden tot interventie in 50-80% van de pogingen vaginaal te bevallen na sectio.
Patiëntvoorkeuren
In alle gevallen is counseling vooraf van groot belang alvorens een trial of labour te entameren en daarbij zullen vanzelfsprekend de factoren die geleid hebben tot de beslissing een SC te verrichten bij de eerdere baring zorgvuldig worden meegewogen. Indien patiënte en partner hulp nodig hebben bij besluitvorming kan de BRAINS methode een manier zijn om hen te helpen een gewogen afweging te maken.
In veel klinieken wordt bij de beslissing gebruik gemaakt van een keuzehulp. Enig risico op een ongunstige uitkomst is inherent aan de keuze voor zowel een trial of labour als bij electieve repeat SC. Zie hiervoor ook de richtlijn Indicatiestelling sectio caesarea.
Kosten
Het effect van het uitvoeren van een MBO bij een afwijkend CTG op de kosten is niet duidelijk. Er zijn geen kosteneffectiviteitsstudies die de toegevoegde waarde van een MBO bij een afwijkend CTG hebben onderzocht.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep verwacht geen problemen wat betreft de haalbaarheid of implementeerbaarheid van de aanbeveling.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
CTG afwijkingen (type 3) komen vaak voor tijdens de baring en zijn onvoldoende voorspellend ten aanzien van uterusruptuur. Zeer ernstige CTG afwijkingen (type 4 of preterminale traces) zullen altijd aanleiding zijn tot onmiddellijke interventie. De aanbeveling om zonder aanvullend onderzoek bij type 3 CTG afwijkingen direct een herhaalde sectio te verrichten zou zich in 50-80% van de pogingen tot TOL kunnen voordoen en is daarmee onvoldoende onderscheidend ten opzichte van de populatie die later een uterusruptuur blijkt te hebben.
Als CTG veranderingen alleen aanleiding zouden zijn tot het verrichten van spoed sectio, zou het wellicht beter zijn om in alle gevallen voor een electieve sectio te opteren (vanwege het hogere maternale risico bij een spoed sectio in vergelijking met gepland). De vooraf kans op uterusruptuur na een eerdere sectio wordt aangegeven als ongeveer 0.5% maar resulteert niet in alle gevallen in ernstige neonatale morbiditeit of sterfte.
Onderbouwing
Achtergrond
Er is in de afgelopen decennia een gestage toename van het aantal bevallingen middels sectio. De beste methode van bevallen bij een volgende zwangerschap wordt besproken tijdens een uitgebreide counseling waarbij o.a. gebruik kan worden gemaakt van een keuzehulp. Bij de keuze tussen een trial of labour of een electieve sectio dienen de voor- en nadelen te worden afgewogen. Zo geeft vaginale baring een hoger risico op een uterusruptuur, terwijl bij een geplande sectio complicaties kunnen optreden. Bekend is dat er weinig voortekenen zijn die informeren over een op handen zijnde uterusruptuur. Foetale bewaking tijdens een poging tot baring na eerdere sectio wordt geadviseerd (NVOG, 2010 Richtlijn Zwangerschap en bevalling na een voorgaande sectio caesarea). CTG veranderingen die te beschouwen zijn als preterminaal zullen in alle omstandigheden aanleiding zijn tot het onmiddellijk verrichten van een spoedsectio. CTG veranderingen waarbij de indicatie bestaat voor het objectiveren van het foetale welzijn door middel van MBO zijn wellicht voorspellend voor het zich voordoen van een uterusruptuur. De vraag is of deze afwijkingen voldoende onderscheidend zijn om in voorkomende gevallen direct te besluiten tot het verrichten van een spoedsectio, of dat het redelijk is eerst MBO te doen en alleen bij aangetoonde hypoxie/acidose een sectio uit te voeren.
Conclusies / Summary of Findings
PICO 1
|
No GRADE |
No evidence was found regarding the question: “In a woman with a prior caesarean section, who is undergoing a vaginal trial of labour with a non-reassuring CTG: is it better to intervene or to perform foetal scalp testing first and then intervene, only in the presence of an abnormal result?”
Sources: Anderson 2016 and Desseauve 2016 |
PICO 2
Critical outcome measure
|
Very low GRADE |
The evidence is very uncertain whether CTG during labour predicts uterine rupture.
Sources: Anderson 2016 and Desseauve 2016 |
Important outcome measures
|
No GRADE |
No evidence was found regarding the association between non-reassuring CTG in the foetus and the outcomes (2) type of delivery, (3) maternal mortality, (4) maternal postpartum haemorrhage, (5) foetal cerebral palsy, (6) intraventricular haemorrhage, (7) pH<7, (8) need for cooling therapy of the new born, (9) Infant Hypoxic Ischemic Encephalopathy (HIE), (10) convulsions, (11) perinatal mortality, (12) Apgar score <7.0 after 5 min., (13) NICU admission. |
Samenvatting literatuur
Description of studies
PICO 1
No studies were found for the analysis of PICO 1.
PICO 2
Two retrospective case series, Andersen (2016) and Desseauve (2016), assessed the association of a non-reassuring CTG and the risk of uterine rupture.
The case control study by Andersen (2016) investigated if CTG abnormalities during labour were more common in cases of complete uterine rupture after prior caesarean section compared with controls without uterine rupture with a prior caesarean section. Complete uterine rupture was defined as a full separation of the uterine wall (including the overlying serosa) and involvement of foetal membranes, resulting in a direct communication between the uterine cavity and peritoneum. A total of 53 cases of complete uterine rupture were identified from the Danish Medical Birth Registry and compared with 43 controls who were each subsequent to intended vaginal birth after prior Caesarean section from the registry. The CTG tracings were assessed by 19 independent experienced obstetricians who were blinded for the group, outcome and clinical data. Abnormalities were assessed according to the modified FIGO classification guidelines as normal (FIGO grade 1), suspicious (FIGO grade 2), pathological (FIGO grade 3) or preterminal (FIGO grade 4). CTGs were assessed separately for the first and second stage of labour. Odds ratios were calculated using 2x2 tables. The study did not report adjustment for confounding.
The case control study by Desseauve (2016) identified foetal heart rate abnormalities in the two hours preceding uterine rupture during trial of labour after a prior caesarean section. These were compared to foetal heart rate abnormalities in controls with a successful vaginal birth after prior caesarean section. Complete uterine rupture was defined according to Plauché or uterine scar dehiscence during labour (defined by rupture of the entire uterine wall with an intact serosa). A total of 22 uterine ruptures were identified from four French maternity wards and compared with 44 controls who were selected subsequent to a case of uterine rupture from a pool of patients with prior caesarean section, whatever the means of delivery. CTG tracings were anonymized, randomized and assessed by two experienced obstetricians separately, and in case of disagreement by a third expert. Abnormalities were assessed according to the modified FIGO classification guidelines as normal (FIGO grade 1), intermediate (FIGO grade 2), abnormal (FIGO grade 3) or preterminal (FIGO grade 4). CTGs were recorded from 120 minutes to uterine rupture or delivery and divided into strips of 20 minutes segments. With these segments an assessment of change in CTG deviations over time could be assessed using survival curve analyses with the Kaplan Meier method. The study did not report adjustment for confounding.
Results
PICO 1
No studies were found for the analysis of PICO 1.
PICO 2
Because different points in time before delivery were used in the two studies, results could not be pooled. Results will therefore be discussed separately for the first and second stage of labour (Andersen 2016) and for a time-interval analysis (Desseauve, 2016).
Critical outcome measure
(1) Uterine rupture
First stage of labour
1.1 Uterine rupture and non-reassuring CTG during first stage labour
Andersen (2016) reported that a pathological CTG (FIGO grade 3) was common in both groups during the first stage of labour. In 44/53 (77%) of cases compared with 23/43 (53%) of controls CTG tracings were determined FIGO grade 3 (1 trial, 96 women, OR 2.58, 95% CI 0.96 to 6.94). A preterminal CTG was reported in 3/53 (6%) of the cases, while none were present in the control group (OR not assessable) (Table 1 and Evidence table in the attachment).
Second stage of labour
1.2 Uterine rupture and non-reassuring CTG deviations during the second stage of labour
Also during the second stage of labour, Andersen (2016) reported that a pathological CTG (FIGO grade 3) was common in both groups. In 13/53 (72%) of cases compared with 28/43 (83%) of controls CTG tracings were determined FIGO grade 3 (1 trial, 96 women, OR 1.39, 95% CI 0.13 to 14.7). In addition, 2/18 (11%) were assessed as preterminal in the case group compared with none of the controls (OR not assessable) (Table 1 and Evidence table in the attachment).
Table 1. CTG deviations measured with modified FIGO classification and uterine rupture
|
Study ID |
Labour stage |
Classification CTG |
Cases (n=53) |
Controls (n=43) |
OR [95% CI] |
p-value |
Remarks |
|
Andersen 2016 |
First stage |
FIGO 3 – pathological CTG |
41 (77%) |
23 (53%) |
2.58 [0.96 to 6.94] |
0.07 |
|
|
FIGO 4 – preterminal CTG |
3 (6%) |
0 |
NA |
NA |
No control foetuses had a preterminal CTG |
||
|
|
Classification CTG |
Cases (n=18) |
Controls (n=34) |
OR [95% CI] |
p-value |
Remarks |
|
|
Second stage |
FIGO 3 – pathological CTG |
13 (72%) |
28 (82%) |
1.39 [0.13 to 14.7] |
0.85 |
|
|
|
FIGO 4 – preterminal CTG |
2 (11%) |
0 |
NA |
NA |
No control foetuses had a preterminal CTG |
Source: Andersen 2016, OR: Odds ratios calculated using 2x2 tables, CI: confidence interval.
Time interval analysis
1.3 Time interval relation between CTG deviations and uterine rupture
Desseauve (2016) reported significant changes in CTG deviations (FIGO grade 3 and 4) in the last 60, 40 and 20 minutes preceding the diagnosis of uterine rupture (Figure 1). A significant larger number of foetuses was assessed with a pathological CTG (FIGO grade 3) compared to the control group at time intervals: 41-60 minutes before delivery, 21-40 minutes before delivery and 0-20 minutes before delivery (1 trial, 66 women, OR 4.1, 95%CI 1.2 to 14.0, OR 4.3, 95%CI 1.4 to 13.0 and OR 3.7, 95%CI 1.2 to 11.3 respectively) (Table 2 and Evidence table in the attachment).
Figure 1. Time interval relation between CTG deviations measured with modified FIGO classification and uterine rupture
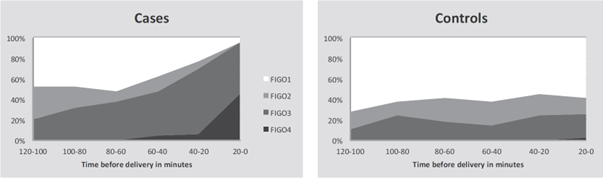
Source: Desseauve 2016 Breslow-Gehan-Wilcoxon test for assessing curves (p < 0.001).
Table 2. CTG deviations measured with FIGO classification and uterine rupture
|
Study ID |
Labour stage |
Classification CTG |
Cases (n=22) |
Controls (n=44) |
OR [95% CI] |
p-value |
Remarks |
|
Desseauve 2016 |
101–120 minutes before delivery |
FIGO 3 – pathological CTG |
4/19 (21%) |
4/36 (11%) |
2.1 [0.5 to 9.7] |
0.42 |
|
|
81-100 minutes before delivery |
FIGO 3 – pathological CTG |
6/19 (32%) |
9/37 (27%) |
1.4 [0.4 to 4.9] |
0.75 |
|
|
|
61-80 minutes before delivery |
FIGO 3 – pathological CTG |
8/21 (38%) |
7/38 (18%) |
2.7 [0.8 to 9.0] |
0.12 |
|
|
|
41-60 minutes before delivery |
FIGO 3 – pathological CTG |
9/21 (43%) |
6/39 (15%) |
4.1 [1.2 to 14.0] |
*0.03 |
|
|
|
21-40 minutes before delivery |
FIGO 3 – pathological CTG |
10/21 (52%) |
10/42 (24%) |
4.3 [1.4 to 13.0] |
*0.01 |
|
|
|
0-20 minutes before delivery |
FIGO 3 – pathological CTG |
11/22 (50%) |
10/44 (23%) |
3.7 [1.2 to 11.3] |
*0.02 |
|
Source: Desseauve 2016, OR: Odds ratios calculated using 2x2 tables, CI: confidence interval. *Statistically significant
Important outcome measures
No literature was found assessing the association between CTG deviations and the outcomes listed above.
Level of evidence of the literature
PICO 1
No studies were found for the analysis of PICO 1. Therefore no GRADE assessment could be done.
PICO 2
The level of evidence regarding the outcome measure (1) uterine rupture started on a ‘high GRADE’ and was downgraded by 3 levels to a ‘very low GRADE’ because of study limitations by 2 levels (see Table of quality assessment in the attachment) and imprecision by 1 level (less than 200 participants in both studies).
The level of evidence regarding the outcome measures (2) (maternal) type of delivery, (3) maternal mortality, (4) maternal postpartum haemorrhage, (5) foetal cerebral palsy, (6) intraventricular haemorrhage, (7) pH<7, (8) need for cooling therapy of the new born, (9) Infant Hypoxic Ischemic Encephalopathy (HIE), (10) convulsions, (11) perinatal mortality, (12) Apgar score <7.0 after 5 min. and (13) NICU admission could not be assessed because no literature was found.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
PICO 1
P: A woman with one prior caesarean section, who is undergoing a vaginal trial of labour and has a non-reassuring CTG
I: Intervention based on CTG
C: First foetal scalp testing, than intervention based on result (if necessary)
O: Maternal: uterine rupture, type of delivery, maternal mortality, postpartum haemorrhage. Foetal: cerebral palsy, intraventricular haemorrhage, pH<7, need for cooling therapy of the new born, Infant Hypoxic Ischemic Encephalopathy (HIE), convulsions, perinatal mortality, Apgar score <7.0 after 5 min., NICU admission.
PICO 2
P: A woman with one prior caesarean section, who is undergoing a vaginal trial of labour
I: non-reassuring CTG
C: Normal CTG
O: Maternal: uterine rupture, type of delivery, maternal mortality, postpartum haemorrhage. Foetal: cerebral palsy, intraventricular haemorrhage, pH<7, need for cooling therapy of the new born, Infant Hypoxic Ischemic Encephalopathy (HIE), convulsions, perinatal mortality, Apgar score <7.0 after 5 min., NICU admission.
Relevant outcome measures
The guideline development group considered (1) uterine rupture as a critical outcome measure for decision making; and (2) type of delivery, (3) maternal mortality, (4) maternal postpartum haemorrhage, (5) foetal cerebral palsy, (6) intraventricular haemorrhage, (7) pH<7, (8) need for cooling therapy of the new born, (9) Infant Hypoxic Ischemic Encephalopathy (HIE), (10) convulsions, (11) perinatal mortality, (12) Apgar score <7.0 after 5 min. and (13) NICU admission as important outcome measures for decision making.
The working group defined the outcome (1) uterine rupture as follows: a complete tear of the uterine wall during pregnancy or delivery (WHO 2005). The working group defined non-reassuring CTG as suspicious or pathological according to the then applicable FIGO classification.
The working group defined any significant difference as a minimal clinically (patient) important difference for ‘uterine rupture’ and ‘perinatal mortality’.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until May 4th, 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 220 hits. Studies were selected based on the following criteria:
- Involving women with (one or more) prior caesarean section, who are undergoing a vaginal trial of labour
- Comparing an intervention based on CTG findings alone with foetal scalp sampling to confirm the presence of foetal hypoxia or acidosis (PICO 1) on the prediction for an uterine rupture or foetal distress
- Assessing the predictive value of CTG abnormality for the presence of a uterine rupture or neonatal asphyxia (PICO 2)
- Involving the original study outcome data set
23 studies were initially selected based on title and abstract screening. After reading the full text, 21 studies were excluded (see the table providing the reasons for exclusion under the tab Methods), and 2 studies were included. No studies were found to answer clinical question 1. Therefore, the literature analysis and conclusions will focus on answering clinical question 2.
Results
PICO 1
No studies were found for the analysis of PICO 1.
PICO 2
Two studies were included in the analysis of the literature of PICO 2. Important study characteristics and results are summarized in the Evidence tables (attachment). The assessment of the risk of bias is summarized in the Table of quality assessment (attachment).
Referenties
- Andersen MM, Thisted DL, Amer-Wåhlin I, Krebs L; Danish CTG Monitoring during VBAC study group. Can Intrapartum Cardiotocography Predict Uterine Rupture among Women with Prior Caesarean Delivery?: A Population Based Case-Control Study. PLoS One. 2016;11(2):e0146347. Published 2016 Feb 12.
- Desseauve D, Bonifazi-Grenouilleau M, Fritel X, Lathélize J, Sarreau M, Pierre F. Fetal heart rate abnormalities associated with uterine rupture: a case-control study: A new time-lapse approach using a standardized classification. Eur J Obstet Gynecol Reprod Biol. 2016;197:16-21.
- WHO. Hofmeyr GJ, Say L, Gülmezoglu AM. WHO systematic review of maternal mortality and morbidity: the prevalence of uterine rupture. BJOG. 2005 Sep;112(9):1221-8.
Evidence tabellen
Research question: What is the predictive value of CTG deviations from normal during labour on foetal distress/uterine rupture in women with a prior caesarean section?
Predefined core set of confounders:
1. Higher maternal age
2. Earlier gestational age (preterm birth)
3. (More than one) prior caesarean section or uterine procedure
4. Less prior vaginal deliveries
|
Study reference |
Study characteristics |
Patient characteristics |
Prognostic factor(s) |
Follow-up
|
Estimates of prognostic effect |
Comments |
|
Andersen, 2016 |
Type of study: case control study
Setting and country: the Danish Medical Birth Registry, Denmark
Funding and conflicts of interest: no conflicts of interest |
Inclusion criteria: Cases: cases with complete uterine rupture during labour at term with a prior caesarean section
Controls: each subsequent two intended vaginal birth after caesarean section
Exclusion criteria: CTGs that were unreadable according to the authors objective judgement
N, cases: 53
Maternal age, mean (range): Cases: 32.5 (28–44) Controls: 33.34 (23–43)
Gestational age, mean (range): Cases: 40+4 (37+1–42+4) Controls: 40+4 (37+5–42+2)
Number of prior caesarean deliveries, mean (range) Cases: 1.00 (1) Controls: 1.02 (1-2)
Number of prior vaginal delivery, n/N (%) Cases: 13/53 (13%) Controls: 10/43 (23%)
Potential confounders or effect modifiers: groups were comparable in terms of maternal age, gestational age, number of prior caesarean deliveries and number of prior vaginal deliveries. |
Describe prognostic factor(s) and method of measurement: CTG deviation, assessed separately for the first and second stage of labour
A CTG deviation from normal based on the International Federation of Gynaecology and Obstetrics (FIGO) guidelines, categorized into: - Normal CTG - Suspicious CTG - Pathological CTG - Preterminal CTG
Tachycardia, categorized into: - No tachycardia - Presence of tachycardia - Tachycardia <60 min - Tachycardia ≥60 min
Variability, categorized into: - No presence of impaired variability - Presence of impaired variability - Impaired variability <40 min - Impaired variability ≥40 min
Decelerations, categorized into: - No decelerations - Decelerations – any kind - Late decelerations - <10 severe decelerations - ≥10 severe decelerations
|
Duration or endpoint of follow-up: until birth / retrospective database study
For how many participants were no complete outcome data available? N, cases (%): 4 (22.2%) (second stage CTG) Reasons: CTG tracing blinded for interpretation due to terminal bradycardia N, controls (%): 3 (8.8%) (second stage CTG) Reasons: CTG tracings not suitable for assessment because of poor quality
|
(Adjusted) Factor-outcome associations (include SEs or 95%CI and p-value if available):
First stage labour
Presence of pathological CTG (FIGO grade 3): Cases, n (%): 41 (77%) Controls, n (%): 23 (53%) OR [95% CI]: 2.58 [0.96 to 6.94] p-value: 0.07
Presence of preterminal CTG (FIGO grade 4): Cases, n (%): 3 (6%) Controls, n (%): 0 OR [95% CI]: not assessable
Second stage of labour
Presence of pathological CTG (FIGO grade 3): Cases, n (%): 13 (72%) Controls, n (%): 28 (82%) OR [95% CI]: 1.39 [0.13 to 14.7] p-value: 0.85
Presence of preterminal CTG (FIGO grade 4): Cases, n (%): 2 (11%) Controls, n (%): 0 OR [95% CI]: not assessable
|
Authors conclusion: “Our results confirm that the occurrence of pathological CTG tracings and severe variable decelerations may be predictors for uterine rupture. However, as the conditions are also present in a majority of controls, these findings could lead to a substantial increase in the rate of CD in women undergoing TOLAC, if used as the primary indicator of a uterine rupture.” |
|
Dessauve, 2015 |
Type of study: case control study
Setting and country: four maternity wards of the Poitou-Charentes region of France
Funding and conflicts of interest: no conflicts of interest |
Inclusion criteria: Cases: cases with complete uterine rupture during labour with a prior caesarean section. Only singleton pregnancies with a cephalic presentation, gestational age >34w and available foetal heart tracings were included.
Controls: each subsequent patient with trial of labour after prior caesarean section, whatever the means of delivery
Exclusion criteria: in utero foetal death and first or second stage labour arrest
N, cases: 22 N, controls: 44
Maternal age, mean ± sd: Cases: 32.5 ± 5.0 Controls: 30.9 ± 5.4
Gestational age, mean ± sd: Cases: 40.3 ± 1.2 Controls: 39.3 ± 1.2
>1 prior caesarean deliveries, n/N (%): not reported
Number of prior vaginal delivery, n/N (%) Cases: 3/22 (13.6%) Controls: 10/44 (22.7%)
Potential confounders or effect modifiers: groups were comparable in terms of maternal age and gestational age. Each case was matched to two controls based on the number of vaginal births following the last C-section. |
Describe prognostic factor(s) and method of measurement:
CTG deviation, assessed during the <2h time before uterine rupture in the case group and <2h before the onset of expulsive efforts or C-section in the control group.
A CTG deviation from normal, classified according to the FIGO (International Federation of Gynecology and Obstetrics) guidelines, as modified by Amer-Wahlin et al. - Normal FHR / FIGO 1 - Intermediate FHR / FIGO 2 - Abnormal FHR / FIGO 3 - Preterminal FHR / FIGO 4
|
Duration or endpoint of follow-up: until birth / birth registry study
For how many participants were no complete outcome data available? N (%): no incomplete outcome data reported Reasons: not reported |
(Adjusted) Factor-outcome associations (include SEs or 95%CI and p-value if available):
101-120 minutes before delivery
Presence of pathological CTG (FIGO grade 3): Cases, n (%): 4/19 (21%) Controls, n (%): 4/36 (11%) OR [95% CI]: 2.1 [0.5 to 9.7] p-value: 0.42
81-100 minutes before delivery
Presence of pathological CTG (FIGO grade 3): Cases, n (%): 6/19 (32%) Controls, n (%): 9/37 (27%) OR [95% CI]: 1.4 [0.4 to 4.9] p-value: 0.75
61-80 minutes before delivery
Presence of pathological CTG (FIGO grade 3): Cases, n (%): 8/21 (38%) Controls, n (%): 7/38 (18%) OR [95% CI]: 2.7 [0.8 to 9.0] p-value: 0.12
41-60 minutes before delivery
Presence of pathological CTG (FIGO grade 3): Cases, n (%): 9/21 (43%) Controls, n (%): 9/39 (15%) OR [95% CI]: 4.1 [1.2 to 14.0] p-value: 0.03*
21-40 minutes before delivery
Presence of pathological CTG (FIGO grade 3): Cases, n (%): 10/21 (52%) Controls, n (%): 10/42 (24%) OR [95% CI]: 4.3 [1.4 to 13.0] p-value: 0.01*
0-20 minutes before delivery
Presence of pathological CTG (FIGO grade 3): Cases, n (%): 11/22 (50%) Controls, n (%): 10/44 (23%) OR [95% CI]: 3.7 [1.2 to 11.3] p-value: 0.02* |
Authors conclusion: “This study found a significant association between grade-3 FHRA during TOLAC and uterine rupture, in the hour preceding its diagnosis.” |
Table of quality assessment
Based on: QUIPSA (Haydn, 2006; Haydn 2013)
|
Study reference
(first author, year of publication) |
Study participation
Study sample represents the population of interest on key characteristics?
(high/moderate/low risk of selection bias) |
Study Attrition
Loss to follow-up not associated with key characteristics (i.e., the study data adequately represent the sample)?
(high/moderate/low risk of attrition bias) |
Prognostic factor measurement
Was the PF of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to PF) |
Outcome measurement
Was the outcome of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to outcome) |
Study confounding
Important potential confounders are appropriately accounted for?
(high/moderate/low risk of bias due to confounding) |
Statistical Analysis and Reporting
Statistical analysis appropriate for the design of the study?
(high/moderate/low risk of bias due to statistical analysis) |
|
Andersen, 2016 |
Low risk: the study included women at term with a prior caesarean section with a complete uterine rupture (cases) compared to women with a prior caesarean section who intend to deliver vaginally. |
Low risk: an even number of women had a CTG during the second labour stadium that was unreadable or unsuitable for assessment, which was openly reported by the study authors. |
Low risk: 19 blinded and independent experienced obstetricians were asked to assess 20 randomly selected CTGs. |
Low risk: the obstetricians used the evaluation scheme for CTG as defined by the FIGO guidelines. |
Low risk: the authors did not use matching of the controls. Groups were comparable in the baseline characteristics maternal age, gestational age and number of prior caesarean deliveries. |
High risk: the calculated Odds ratios and p-values are not corresponding with the recalculated values by the working group using ReviewManager 5.3. It is unclear why the exact values differ, it seems plausible the authors corrected for a factor but did not report this. Besides this, the authors did not include an assessment of the change in CTG over time. |
|
Desseauve, 2015 |
Low risk: the study included women >34 weeks with a prior caesarean section with a complete uterine rupture compared to women with a prior caesarean section who intend to deliver vaginally. |
Moderate risk: the study did not report how many CTGs were not readable or assessable and were therefore lost to follow up. |
Low risk: 2 blinded and independent experienced obstetricians assessed the segments. In case of disagreement between the two assessors, a third senior expert was involved. |
Low risk: the obstetricians used the evaluation scheme for CTG as defined by the FIGO guidelines. |
Low risk: the authors used matching for the number of previous vaginal birth following the last caesarean section. The groups were comparable in maternal age and gestational age. However, the amount of previous caesarean sections was not reported. |
Moderate risk: the study did an assessment over time using the Kaplan-Meier method. The individual CTG parameters are missing. |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Alfirevic, 2017 |
Wrong participants: no previous caesarean section |
|
Andonovová, 2019 |
Wrong participants: no previous caesarean section, wrong language: Czech |
|
Ashwal, 2014 |
Wrong comparison: induction of labour versus spontaneous vaginal birth |
|
Ayres, 2001 |
Wrong comparison: control group missing, only cases. Wrong participants: also cases without history of caesarean section included. |
|
Ben-Aroya, 2002 |
Wrong comparison: PGE2-tablets versus foley catheter |
|
Caning, 2019 |
Wrong comparison: inter observer agreement on CTG |
|
Craver Pryor, 2007 |
No FIGO classification, wrong patient population (women with precious successful vaginal birth), high risk of bias, no correction for confounding |
|
Dy, 2019 |
Wrong design: guideline/narrative review. Background article |
|
East, 2015 |
Wrong participants: no previous caesarean section |
|
Ganer Herman, 2020 |
Wrong comparison: trial of labour after prior caesarean section versus elective repeat caesarean section. Non reassuring foetal heart rate pattern was an indication for caesarean section in women who attempted TOLAC. Uterine rupture not reported. |
|
Guiliano, 2014 |
Wrong comparison: no control group |
|
Holzmann, 2015 |
Wrong participants: no prior caesarean section. Wrong comparison: foetal scalp repetitive blood sampling versus occasional foetal scalp blood sampling. |
|
Jozwiak, 2013 |
Most recent version of West (2017) here below |
|
O'brien-Abel, 2003 |
Wrong design: narrative review |
|
Ouzounian, 2015 |
Wrong comparison: no control group |
|
Ridgeway, 2004 |
No FIGO classification, wrong patient population (women with precious successful vaginal birth), unclear correction for confounding (not reported, but odds ratios cannot be reproduced with original data) |
|
Sarreau, 2020 |
Wrong comparison: balloon catheter vs. oxytocin |
|
Tabassum, 2017 |
Wrong participants: only participants with caesarean section, 20% with repeat caesarean section. |
|
Vinueza, 2000 |
Wrong population: only 3 trial of labour after prior caesarean section. No subgroup analysis. |
|
West, 2017 |
Wrong comparison: only interventions for induction of labour compared. Foetal heart rate changes only used as an outcome |
|
Yap, 2001 |
Wrong comparison: control group missing, only cases. Wrong participants: also cases without history of caesarean section included |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-01-2023
Beoordeeld op geldigheid : 23-01-2023
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Waarde van MBO voor voorspellen kans op uterusruptuur |
NVOG |
2022 |
2027 |
5 jaar |
NVOG |
Nieuw wetenschappelijk onderzoek, veranderingen in organisatie van zorg |
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor vrouwen met hypertensieve aandoeningen in de zwangerschap.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG, voorzitter stuurgroep
- Dr. S.V. (Steven) Koenen, gynaecoloog, werkzaam in het ETZ, Tilburg, NVOG, lid stuurgroep
- Dr. J.J. (Hans) Duvekot, gynaecoloog, werkzaam in het Erasmus MC, NVOG, lid stuurgroep
- Dr. H.C.J. (Liesbeth), Scheepers, gynaecoloog, werkzaam in het Maastricht Universitair Medisch Centrum +, NVOG
- Msc. D.H. (Robert) Strigter, gynaecoloog, werkzaam in het Deventer Ziekenhuis, NVOG
- Dr. M.D. (Mallory) Woiski, gynaecoloog, werkzaam in het Radboud UMC, NVOG
- Dr. I.M. (Inge) Evers, gynaecoloog-perinatoloog, werkzaam in het Meander Medisch Centrum Amersfoort, NVOG
- Dr. L. (Lia) Wijnberger, gynaecoloog, werkzaam in het Rijnstate Ziekenhuis Arnhem, NVOG
- Dr. I.H. (Ingeborg) Linskens, gynaecoloog, werkzaam in het Amsterdam UMC, locatie AMC, NVOG
- Dr. S. (Sander) Galjaard, gynaecoloog, werkzaam in het Erasmus MC, NVOG
- Dr. R.C. (Rebecca) Painter, gynaecoloog, werkzaam in het Amsterdam Universitair Medisch Centrum, NVOG
- Drs. I.C.M. (Ingrid) Beenakkers, anesthesioloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVA
- Drs. M.L. (Mark) van Zuylen, anesthesioloog in opleiding in het Amsterdam UMC, NVA
- Dr. S. (Sabine) Logtenberg, klinisch verloskundige, werkzaam in OLVG Oost Amsterdam en Academie Verloskunde Amsterdam Groningen, KNOV
- Msc. J. (José) Hollander-Boer, verloskundige (np), werkzaam bij Academie Verloskunde Amsterdam Groningen, KNOV.
- Dr. V.C. (Vera-Christina) Mertens, secretaris Stichting Zelfbewustzwanger
- Msc. J. (Jacobien) Wagemaker, Care4Neo
- I. (Ilse) van Ee, adviseur patiëntenbelang, Patiëntenfederatie Nederland.
- MSc. J.C. (Anne) Mooij, adviseur, Patiëntenfederatie Nederland.
Meelezers
- Leden van de Otterlo- werkgroep (2020-2021)
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.A.C. (Marleen) van Son, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- MSc. Y.J. (Yvonne) Labeur, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bax (voorzitter stuurgroep) |
Gynaecoloog-perinatoloog Amsterdam UMC 0,8 fte |
Gastvrouw Hospice Xenia Leiden (onbetaald), Lid commissie kwaliteitsdocumenten NVOG, Voorzitter 50 modulenproject NVOG, Voorzitter commissie Otterlo NVOG, Penningmeester werkgroep infectieziekten NVOG, Lid kernteam NIPT consortium, Lid werkgroep voorlichting en deskundigheidsbevordering RIVM, Lid werkgroep implementatie scholing RIVM, Lid werkgroep nevenbevindingen NIPT RIVM |
Geen |
Geen |
|
Beenakkers |
Anesthesioloog UMCU/WKZ |
Geen |
Geen |
Geen |
|
Duvekot (lid stuurgroep) |
Gynaecoloog, Erasmus MC (full time) |
Directeur 'medisch advies en expertise bureau Duvekot', Ridderkerk, ZZP'er |
Geen |
Geen |
|
Evers |
Gynaecoloog, Meander Medisch Centrum |
Lid van Ciekwal, Werkgroep multidisciplinaire richtlijn extreme vroeggeboorte, NVOG |
Geen |
Geen |
|
Galjaard |
Gynaecoloog ErasmusMC, Rotterdam |
Associate member Diabetes in Pregnancy Study Group (DPSG, onbezoldigd) |
Geen |
Geen |
|
Hollander-Boer |
Docent verloskunde -> Academie Verloskunde Amsterdam Groningen (AVAG) 0.8 Fte, (Verloskundige -> oproepcontract Verloskundige stadspraktijk Groningen (zelden)), Wijziging oktober 2021: oproepcontract laten beëindigen. |
Geen |
Geen |
Geen |
|
Koenen (lid stuurgroep) |
Gynaecoloog, ETZ , Tilburg |
Incidenteel juridische expertise (betaald) |
Geen |
Geen |
|
Linskens |
Gynaecoloog-perinatoloog Amsterdam UMC |
Geen |
Geen |
Geen |
|
Logtenberg |
Academie Verloskunde Amsterdam Groningen: 3 dagen docent, OLVG Oost Amsterdam 1 dag in de week klinisch verloskundige |
Geen |
Geen |
Geen |
|
Mertens |
Patiëntvertegenwoordiger namens Stichting Zelfbewust zwanger (onbezoldigd) |
Geen |
Geen |
Geen |
|
Mooij |
Adviseur Patiëntenbelang, Patiëntenfederatie Nederland |
Geen |
Geen |
Geen |
|
Painter |
Gynaecoloog, aandachtsgebied maternale ziekte 0,8FTE, Associate Professor (voor de grootte van de aanstelling als gynaecoloog) Amsterdam UMC locatie AMC |
Voorzitter Special Invest group NVOG Zwangerschap en diabetes en obesitas onbetaald, Lid gezondheidsraad commissie Voeding en Zwangerschap vacatiegelden gaan naar mijn werkgever, lid richtlijncommissie Chirurgische behandeling van obesitas (NVVH) onbetaald, lid namens NVOG bij RIVM commissie Hielprikscreening onbetaald, Voorzitter organiserend comité congres ICHG 2019 onbetaald, cluster coördinator regio Noord-Holland NVOG Consortium 2, lid Wetenschapscommissie Pijler Obstetrie NVOG onbetaald, Lid koepel wetenschap namens Pijler Obstetrie |
Principal lnvestigator Leading the Change gefinancierd onderzoek TANGO DM. naar de afkapwaarde voor diabetes gravidarum, Project team lid Zon MW gefinancierd onderzoek SUGARDIP, naar diabetes gravidarum behandeling met orale medicatie versus insuline, Project team Nederlandse Hartstichting WOMB project naar de lange termijn uitkomsten van vrouwen die subfertiel waren en obesitas, Van geen van deze projecten wordt een belang van de financier/sponsor vermoed, Gepubliceerd op het gebied van obesitas en zwangerschap. Deze artikelen zouden genoemd kunnen worden in de richtlijn, Wetenschappelijk adviseur bij patiëntenvereniging stichting ZEHG (hyperemesis gravidarum) |
Geen betrokkenheid als schrijver of meelezer bij modules waarin de eigen artikelen van de werkgroeplid terug zouden kunnen komen in de systematische literatuuranalyse |
|
Scheepers |
Gynaecoloog/perinatoloog, MUMC |
Vicevoorzitter perinatale audit, onbetaald, Wetenschappelijk coördinator regioconsortium Limburg, onbetaald |
Projectleider SIMPLE studies, ontwikkeling keuzehulp vaginaal bevallen na eerdere keizersnede, geen huidige financiële belangen. |
Geen |
|
Stigter |
Waarnemend gynaecoloog vakgroep verloskunde & gynaecologie Deventer Ziekenhuis (0.2 FTE), waarnemend gynaecoloog vakgroep verloskunde & gynaecologie Gelre Ziekenhuizen locatie Apeldoorn (0.7 FTE) |
Lid werkgroep Otterlo tot 01-09-2020, onbetaald |
Geen |
Geen |
|
Van Ee |
Adviseur Patiëntenbelang, Patientenfederatie |
Vrijwilliger Psoriasispatiënten Nederland, - coördinator patiëntenparticipatie en onderzoek en redactie lid centrale redactie, - onbetaalde werkzaamheden (soms vacatiegelden) |
Geen |
Geen |
|
Van Zuylen |
Anesthesioloog i.o. Amsterdam UMC |
Geen |
Geen |
Geen |
|
Wagemaker |
Projectleider PATH in het Maasstad Ziekenhuis Rotterdam 0,55 fte, ZZP Adviseur, trainer, onderzoeker op Family Centered en Single Room Care wisselend aantal uren 0,25 - 0,50 fte |
Vrijwilliger Vereniging van Ouders van Couveusekinderen - ervaringsexpert richtlijnontwikkeling, promotie Kwaliteitskader Kwaliteitscriteria VOC - soms vacatiegelden, Vrijwilliger V&VN kinderverpleegkunde - ondersteuning in projecten, projectadvies op opleiding en bijscholing - soms vacatiegelden |
Geen |
Geen |
|
Wijnberger |
Gynaecoloog, perinatoloog, Rijnstate ziekenhuis Arnhem |
VSV werkgroepen, medisch coördinator, NVOG: Otterlo werkgroep, commissie wetenschap (alles onbetaald) |
Geen |
Geen |
|
Woiski |
Gynaecoloog |
Lid werkgroep Otterlo |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van patiëntvertegenwoordigers van verschillende patiëntverenigingen voor de Invitational conference en afvaardigen van patiëntenverenigingen in de clusterwerkgroep. Het verslag hiervan is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie per module ook ‘Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)’. De conceptrichtlijn wordt tevens ter commentaar voorgelegd aan de betrokken patiëntenverenigingen.
Implementatie
|
Aanbeveling |
Tijdspad voor implementatie: 1-3 jaar of >3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
Alle aanbevelingen van deze module |
<1 jaar |
Geen |
Kennis van richtlijn |
Geen kennis van richtlijn |
Kennis nemen van richtlijn |
NVOG |
|
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor vrouwen met een sectio in de voorgeschiedenis en obesitas in de zwangerschap. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen tijdens de Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaarden zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
|
Database |
Zoektermen |
|||||||||||||||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Vaginal Birth after Cesarean/ or vbac.ti,ab,kf. or 'vaginal birth after'.ti,ab,kf. (2074) 2 (exp Cesarean Section/ or cesarea*.ti,ab,kf. or caesarea*.ti,ab,kf. or 'c section*'.ti,ab,kf. or (abdominal adj3 deliver*).ti,ab,kf.) and (previous* or earlier or 'medical history' or preceding or prior or past or repeat*).ti,ab,kf. (14297) 3 1 or 2 (15027) 4 exp Cardiotocography/ or cardiotocograph*.ti,ab,kf. or cardio-tocograph*.ti,ab,kf. or ctg.ti,ab,kf. or ((fetal or foetal or fetus or foetus) adj2 'heart rate').ti,ab,kf. (11853) 5 3 and 4 (426) 6 limit 5 to (english language and yr="2000 -Current") (243) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (443097) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1975539) 9 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3419205) 10 6 and 7 (27) 11 (6 and 8) not 10 (41) 12 (6 and 9) not (10 or 11) (96) 13 10 or 11 or 12 (164) |

