Diepte Neuromusculair Blok
Uitgangsvraag
Wat is de plaats van een diep (deep) vs. matig (moderate) vs. oppervlakkig (single/usual care) neuromusculair blok (NMB) bij patiënten met obesitas die een abdominale ingreep ondergaan onder algehele anesthesie?
Aanbeveling
Gebruik niet standaard een diep neuromusculair blok tenzij de chirurgische condities (bijvoorbeeld adhesies, afwijkende anatomische kenmerken, duur van de chirurgie) of patiëntkarakteristieken (centrale obesitas) daar aanleiding toe geven.
Monitor de verslapping tijdens de ingreep bij het toepassen van een diep neuromusculair blok om de diepte van het neuromusculaire blok inzichtelijk te maken en aan te kunnen passen indien nodig
Zorg voor beschikbaarheid van Sugammadex bij het toepassen van een diep neuromusculair blok om de spierverslapping te kunnen antagoneren.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft een literatuuronderzoek verricht naar de vergelijking tussen diep, matig en oppervlakkig neuromusculair blok (NMB) in patiënten met obesitas die een abdominale ingreep ondergaan onder algehele anesthesie. Er werden één systematic review en twee randomized controlled trials geïncludeerd. In totaal werden data van vier studies geanalyseerd.
Diep versus matig:
De cruciale uitkomstmaten waren postoperatieve pijnscore, postoperatief opioïdgebruik en complicaties. Voor postoperatieve pijn en postoperatief opioïdgebruik is er waarschijnlijk geen verschil tussen de groepen diep NMB en matig NMB. De bewijskracht hiervoor was redelijk. Voor complicaties kunnen geen conclusies worden getrokken vanwege de zeer lage bewijskracht
De overall bewijskracht voor het verschil in effect tussen een diep en matig NMB is zeer laag. Dit wordt voornamelijk veroorzaakt doordat de betrouwbaarheidsintervallen breed of niet gerapporteerd waren.
Diep en matig versus oppervlakkig:
Ten aanzien van de cruciale uitkomstmaten voor het verschil tussen diep en oppervlakkig NMB of matig en oppervlakkig NMB is geen literatuur gevonden. Er bestaat een kennislacune over de effecten van een diep vs matig vs oppervlakkig neuromusculair blok.
De belangrijke uitkomstmaten waren intra-operatief opioïdgebruik, tevredenheid van chirurgische omstandigheden, restverslapping, aspiratie, awareness en kosten. Deze konden enige richting geven aan de besluitvorming. Een diep NMB maakt waarschijnlijk niet tot nauwelijks verschil in intra-operatief opioïdgebruik ten opzichte van een gemiddeld diep NMB (GRADE: redelijk). Redenen om af te waarderen waren problemen met de imprecisie vanwege brede betrouwbaarheidsintervallen en zeer weinig events.
Voor tevredenheid van chirurgische omstandigheden zal een diep NMB geen klinisch relevant verschil maken t.o.v. een gemiddeld diep of single NMB (GRADE: hoog).
Er werden geen studies geïncludeerd die de uitkomstmaten restverslapping, aspiratie, awareness en kosten rapporteerden. Daarom konden daar geen conclusies over worden getrokken.
De noodzaak en mate van spierverslapping kunnen tijdens een operatie variëren. Tijdens complexe of kritieke fasen van de operatie, of bij bepaalde patiëntkenmerken zoals adhesies of orgaangrootte, kan op verzoek van de operateur een diepere verslapping noodzakelijk zijn. Het is van essentieel belang dat er een goede communicatie plaatsvindt tussen de anesthesioloog en het chirurgische team om de optimale verslapping te bepalen. Het kunnen vaststellen wanneer een diep block geïndiceerd is, is dus multifactorieel en situatieafhankelijk. Daarom verdient een gepersonaliseerde benadering, waarin voor- en nadelen worden afgewogen, de voorkeur van de werkgroep boven gegeneraliseerd gebruik van een diepe neuromusculaire blokkade.
Om het gebruik van neuromusculaire blokkade veilig en effectief toe te passen, is neuromusculaire monitoring essentieel. Ten eerste stelt monitoring van de diepte van de neuromusculaire blokkade ons in staat om de juiste dosering en het optimale niveau van spierverslapping te bepalen. Ten tweede is het belangrijk om de Train-of-Four (TOF) ratio te evalueren bij het ontwaken van de patiënt, om ervoor te zorgen dat deze boven de 90% is voordat de extubatie plaatsvindt. Dit is essentieel voor een veilige procedure.
Het ontbreken van neuromusculaire monitoring tijdens de operatie verhoogt het risico op restverslapping in de postoperatieve fase. In verschillende landen wordt neuromusculaire monitoring echter wisselend toegepast. Uit de Europese POPULAR-studie bleek dat bij 10.000 van de 17.150 patiënten waarbij neuromusculaire blokkade werd gebruikt, geen monitoring rondom extubatie werd toegepast (Kirmeier, 2019).
De incidentie van restverslapping wordt in de literatuur geschat op 20-40% (Carvalho, 2020). Er zijn momenteel geen gegevens beschikbaar over het gebruik van neuromusculaire monitoring in Nederland.
Hoewel de TOF-methode over het algemeen wordt gebruikt voor monitoring van neuromusculaire blokkade bij ingrepen waarbij spierverslapping wordt gebruikt, is het mogelijk dat dit niet overal wordt toegepast. Hoewel het niet bewijsbaar is, is het redelijk om aan te nemen dat de incidentie van restverslapping in Nederland lager zal zijn dan in Europa als gevolg van het gebruik van TOF-monitoring. Mede doordat de Minimaal Invasieve Chirurgie (MIC) richtlijn ook aanraadt om monitoring van spierverslapping te verrichten indien er een diep NMB wordt gebruikt.
Het gebruik van spierverslappingsantagonisten, zoals Neostigmine of Sugammadex, vertoont ook variatie in de praktijk, zowel in dosering als in de mate van TOF-monitoring na toediening van de antagonist.
Onvoldoende antagonisatie van de spierverslapping is geassocieerd met postoperatieve pulmonale complicaties, waaronder aspiraties (Carvalho, 2020; Kirmeier, 2019). Hoewel de geïncludeerde studies geen uitspraak deden over aspiraties, wordt het afgeraden om een diepe blokkade toe te passen als er geen adequate opties beschikbaar zijn om deze met behulp van Sugammadex te kunnen antagoneren. Alleen beschikken over Neostigmine is een contra-indicatie voor het toepassen van een diep block.
Het kan in sommige gevallen noodzakelijk zijn om diepe neuromusculaire blokkade toe te passen. Dit kan vooral het geval zijn wanneer individuele patiëntkenmerken (zoals anatomische verhoudingen) of chirurgisch-technische problemen zich voordoen, om ervoor te zorgen dat de operatie veilig verloopt en het risico op extra complicaties minimaal blijft voor de patiënt.
Het gebruik van diepe neuromusculaire blokkade wordt op indicatie reeds toegepast in de abdominale laparoscopische chirurgie. Alhoewel gestandaardiseerde toepassing hiervan voor de patiënt met obesitas niet aantoonbaar zinvol is, kan dit dus in individuele gevallen wel worden overwogen, bijvoorbeeld bij wat langduriger complexe chirurgie of revisie chirurgie. De specifieke winst voor de patiënt met obesitas ten opzichte van een patiënt met een normaal gewicht is evenmin beschreven. Het verdient een extra aanbeveling om deze overweging toe te passen in een kliniek waar al ervaring is met diepe NMB.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De patiënt verdient de voorkeur om een behandeling te krijgen waarin de mate van spierverslapping aangepast kan worden naar gelang een optimale operatieve condities te creëren als dit op aangeven van een behandelaars gewenst blijkt te zijn. Waarbij als uitkomst een verbeterde kans bestaat om mogelijk opiaat- en pijnklachten en complicaties, door moeilijkere operatieve condities, te verminderen
Kosten (middelenbeslag)
Om een diep neuromusculaire blokkade te antagoneren is het beschikbaar zijn van Sugammadex een vereiste. Meestal wordt een dosis van 2 mg/kg gegeven om matige neuromusculaire blokkade te antagoneren en 4 mg/kg voor het antagoneren van een diep neuromusculaire blokkade. Een gemiddelde ampul van 200 mg kost 85 euro (Zorginstituut Nederland/ www.medicijnkosten.nl). Het voorkomen van complicaties als gevolg van restverslapping is van groot belang. De kosten van Sugammadex zijn daarom ook gerechtvaardigd in vergelijking met de mogelijke kosten van een complicatie.
Een punt van discussie met betrekking tot het gebruik van diepe neuromusculaire blokkade en de kosten van sugammadex is waar en door wie deze kosten moeten worden gedragen. De verhouding tussen kosten, bijvoorbeeld bij een bariatrische ingreep voor anesthesie (wat vaak vergelijkbaar is met andere chirurgische ingrepen), bedraagt gemiddeld €62,- per volledige anesthesie (gebaseerd op een inventarisatie binnen een bariatrisch ziekenhuis, inclusief alle benodigde materialen, medicatie, opiaten en, verbandmiddelen, handschoenen, spuiten, enz.). Dit staat in contrast met de kosten van een basis bariatrische kit, die gemiddeld €2400-3500 per ingreep bedragen.
Het toepassen van Sugammadex in relatie tot een specialisme als anesthesie is duurder dan het gebruik van een basisanesthesie in vergelijking met een chirurgische kit (137% versus 3.5-2.4% in kostenratio). Desalniettemin moet worden opgemerkt dat de keuze voor de kosten nooit ten koste mag gaan van de patiënt en dat overweging van diepe neuromusculaire blokkade met bijbehorende kosten altijd mogelijk moet zijn, met als doel een positieve uitkomst voor de patiënt.
De werkgroep is van mening dat Sugammadex vrijelijk beschikbaar moet zijn op OK en uitslaapkamer en op indicatie mag en moet worden gegeven. Het is belangrijk om erop te wijzen dat het patent op Sugammadex op 27 juli 2023 reeds is vervallen, waarmee de actuele kostprijs van Sugammadex ook aanzienlijk is gedaald.
Aanvaardbaarheid, haalbaarheid en implementatie
Het is belangrijk op te merken dat een TOF-meting overal aanwezig moet zijn daar waar spierverslapping wordt toegepast. Het gebruik van TOF-meting stelt anesthesiologen in staat om de mate van neuromusculaire blokkade nauwkeurig te controleren en de dosering van Sugammadex op een gepaste wijze aan te passen. Dit betekent dat de beschikbaarheid van Sugammadex niet langer een belemmering mag vormen voor het toepassen van diepe neuromusculaire blokkade in de klinische praktijk.
Verschillende soorten neuromusculaire blokkade kunnen bijdragen aan goede perioperatieve condities, op voorwaarde dat de anesthesioloog over alle benodigde materialen en middelen beschikt en deze adequaat en volgens de geldende richtlijnen kan toepassen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de cruciale uitkomstmaten die zijn onderzocht in de literatuursamenvatting kan er geen overall conclusie worden getrokken ten aanzien van de voor- en nadelen van een oppervlakkig, matig of diep neuromusculair blok vanwege de zeer lage overall bewijskracht. Wel is het vermeldingswaardig dat er waarschijnlijk geen verschil zal zijn in postoperatieve pijn en intra- en postoperatief opiaatgebruik bij toepassing van het diep of matig neuromusculair blok. Daarnaast is er geen verschil in tevredenheid over de chirurgische omstandigheden tussen het diep en matig, en diep en enkel blok.
De werkgroep is van mening dat bij specifieke situaties zoals langdurige gecompliceerde ingrepen, bepaalde patiëntkarakteristieken (zoals mogelijk anatomische veranderingen/ afwijkingen bijvoorbeeld bij obesitas) of ter verbetering van chirurgische omstandigheden, het toepassen van diepe neuromusculaire blokkade een potentieel voordeel kan bieden. Hier zijn geen directe wetenschappelijke karakteristieken van bekend. De beslissing om diepe neuromusculaire blokkade toe te passen, moet altijd gebaseerd zijn op een zorgvuldige afweging van de potentiële voordelen en risico’s, rekening houdend met de unieke behoeften van de patiënt en de expertise van het behandelteam. Het meten van de diepte van een neuromusculair blok en het beschikken over Sugammadex is ten alle tijde noodzakelijk om complicaties zoals restverslapping te voorkomen.
Onderbouwing
Achtergrond
Er bestaat veel praktijkvariatie ten aanzien van gebruik van spierverslapping gedurende een ingreep. Patiënten met obesitas zijn chirurgisch technisch lastiger te opereren i.v.m. ruimtegebrek (frequent geclassificeerd middels de Leiden-Surgical Rating Scale) en hebben een verhoogde kans op perioperatieve pulmonale complicaties. Extra verslapping met een diep neuromusculair blok (NMB) zou potentieel kunnen leiden tot minder complicaties, minder pijn, minder opiaatgebruik en sneller herstel.
In principe geldt dit voor zowel open chirurgie als laparoscopische chirurgie. Echter het voordeel zou potentieel vooral bij laparoscopische ingrepen te merken zijn.
Conclusies / Summary of Findings
|
Moderate GRADE |
A deep neuromuscular block probably results in little to no difference in postoperative pain when compared with a moderate neuromuscular block in patients with obesity undergoing an abdominal procedure under general anesthesia.
Source: Abu Yazed, 2019; Torensma, 2016. |
|
Moderate GRADE |
A deep neuromuscular block probably results in little to no difference in postoperative opioid consumption when compared with a moderate neuromuscular block in patients with obesity undergoing an abdominal procedure under general anesthesia.
Source: Abu Yazed, 2019; Torensma, 2016. |
|
A deep neuromuscular block probably results in little to no difference in intraoperative opioid consumption when compared with a moderate neuromuscular block in patients with obesity undergoing an abdominal procedure under general anesthesia.
Source: Abu Yazed, 2019; Baete, 2017; Torensma, 2016. |
|
Very low GRADE |
The evidence is very uncertain about the effect of a deep neuromuscular block on complications when compared with a moderate neuromuscular block in patients with obesity undergoing an abdominal procedure under general anesthesia.
Source: Abu Yazed, 2019; Baete, 2017; Leeman, 2021. |
|
High GRADE |
A deep neuromuscular block results in little to no difference in satisfaction of surgical conditions when compared with a moderate or single neuromuscular block in patients with obesity undergoing an abdominal procedure under general anesthesia.
Source: Baete, 2017; Leeman, 2021 Torensma, 2016. |
|
- GRADE |
No evidence was found regarding the effect of a deep neuromuscular block on residual postoperative neuromuscular block, aspiration, awareness, and costs when compared with a moderate neuromuscular block in patients with obesity undergoing an abdominal procedure under general anesthesia.
Source: - |
Samenvatting literatuur
Description of studies
A systematic review by Aceto (2022) was included in this analysis. Two of the described RCTs (Baete, 2017; Torensma, 2016) were included in the current analysis. Fuchs-Buder (2019) was excluded as this RCT did not report the outcomes of interest. Monk (2018) was excluded as the data from this RCT were not published by a peer-reviewed method.
All included RCTs compared deep NMB with moderate NMB in patients with obesity undergoing abdominal surgery under general anesthesia. Only Torensma (2016) added a third arm receiving a single NMB.
In addition to the systematic review, two RCTs were included in the analyses.
An RCT by Abu Yazed (2019) included sixty adult patients with severe obesity undergoing laparoscopic bariatric surgery. Half of them received a deep, and half of them received a moderate NMB. Both arms had a similar study population.
A second (pilot) RCT (Leeman, 2021) was performed to analyze whether deep NMB reduced intra-abdominal pressure and enough working space compared with moderate NMB.
Characteristics of the included studies are presented in Table 1.
All included studies presented low risk of bias.
Table 1. Overview of included studies.
|
Author, year |
N (I/C) |
Population |
Intervention |
Control |
Follow-up |
|
Randomized controlled trials from Aceto (2022) |
|||||
|
Baete, 2017 |
30/30 |
laparoscopic RYGB surgery, BMI >30
Age ± SD: I: 41 ± 13 C: 42 ± 11
Sex: I: 27% M C: 13% M
BMI ± SD: I: 40 ± 3 C: 41 ± 7 |
Deep NMB (rocuronium bolus and infusion maintaining a PTC of 1-2).
NMB was reversed with sugammadex 4 mg/kg. |
Moderate NMB (rocuronium bolus and top-ups maintaining a TOF count of 1-2).
NMB was reversed with a combination of neostigmine 50 μg/kg LBW and Glycopyrrolate. |
n.s. |
|
Torensma, 2016 |
50/50/50 |
Elective RYGB
Age ± SD: I: 47.2 ± 11.1 C: 46.9 ± 10.6
Sex: I: 22% M C: 18% M
BMI ± SD: I: 43.3 ± 5.1 C: 43.0 ± 4.5 |
Deep NMB (rocuronium 30 mg prior to intubation followed by repeated 10 mg intravenous dose until desired block level: 0 twitch count in the TOF, 1–2 twitch responses in the PTC).
NMB was reversed with sugammadex 4 mg/kg IBW. |
1) Moderate NMB (rocuronium 30 mg prior to intubation followed by repeated 10 mg intravenous dose; 1–2 thumb twitch response to the TOF stimulation of the ulnar nerve).
NMB was reversed with sugammadex 2 mg/kg IBW.
2) single NMB (single administration of rocuronium 30 mg at induction on top of Propofol/ remifentanil anesthesia). |
n.s. |
|
Additional randomized controlled trials |
|||||
|
Abu Yazed, 2019 |
30/30 |
laparoscopic bariatric surgery, BMI 40-50
Age ± SD: I: 37.2 ± 6.1 C: 35.3 ± 5.7
Sex: I: 36.7% M C: 30% M
BMI ± SD: I: 44.73 ± 3.05 C: 43.50 ± 3.10 |
Deep NMB (Rocuronium infusion at a dose of 0.6 mg/kg/hr LBW started after endotracheal intubation, to maintain a TOF count of 0, with PTC > 1).
When TOF count reached 3 or 4, NMB was reversed with sugammadex 2 mg/kg. |
Moderate NMB (repeated top-up doses 0.1 mgt/kg of rocuronium to keep the TOF count at 1–2).
When TOF count reached 3 or 4, NMB was reversed with neostigmine 0.05 mg/kg plus atropine 0.01 mg/kg. |
PACU discharge |
|
Leeman, 2021 |
17/16/16/13 |
primary laparoscopic RYGB
Age ± SD: I1: 49±12 I2: 48±13 C1: 43±11 C2: 49±8
Sex: I1: 41.2 % M I2: 12.5% M C1: 12.5% M C2: 0% M
BMI ± SD I1: 39.11±3.91 I2: 40.54±3.53 C1: 41.66±5.44 C2: 44.4±5.10 |
Deep NMB (Additional rocuronium until PTC 1-2; expected average dose of 70 mg after induction)
I1: standard IAP I2: low IAP
NMB was reversed with sugammadex 180–370 mg. |
Moderate NMB (Incremental doses of rocuronium when necessary, with an anticipated dose of 30–130 mg until TOF ratio 1-2)
C1: standard IAP C2: low IAP
NMB was reversed with sugammadex 100–200 mg. |
7 days |
BMI: body mass index; IAP: intraabdominal pressure; IBW: ideal body weight; LBW: lean body weight; NMB: neuromuscular block; n.s.: not specified; PTC: post-tetanic counts; RCT: randomized controlled trial; RYGB: Roux-and-Y gastric bypass; TOF: train-of-four.
Results
Postoperative pain score
Abu Yazed (2019) reported median pain scores measured on a visual analog scale (VAS) from 0 to 10. On admission to the post-anesthesia care unit (PACU), the median pain score in the deep NMB group was 1.5 (interquartile range (IQR) 1-3) and 2 (IQR 1-3) in the moderate NMB group. The median difference was 0.5 (95% CI unknown).
On PACU discharge (Mean time: 114.7 min vs. 117.6 min, intervention vs. control respectively), the pain score in the deep NMB group was 2 (IQR 1-2) and 2 (IQR 2-2) in the moderate NMB group. The median difference was 0 (95% CI unknown).
Torensma (2016) measured pain at a 10-point numeric rating scale in PACU (at 10 min intervals starting upon arrival; the reported pain score is the average of four scores). The mean pain score in the deep NMB group was 3.9 (95% CI 3.6 to 4.4) and 4.4 (95% CI 4.2 to 4.9) in the moderate NMB group. The MD was 0.5 (95% CI -0.85 to -0.15).
Overall, there is no clinically relevant difference in postoperative pain with deep NMB compared to moderate NMB.
Opioid consumption
Postoperative dose
Abu Yazed (2019) reported mean postoperative rescue pethidine consumption. In the deep NMB group, 52.4 mg (SD 10.9) was consumed versus 54.3 mg (SD 14.4) in the moderate NMB group. The MD was -1.90 mg (95% CI -8.36 to 4.56).
Torensma (2016) reported median piritramide dose in PACU. In the deep NMB group, 20 mg (range 10–25) was administered, and in the moderate NMB group, 24 mg (range 10–25). The difference was 4 mg (95% CI unknown).
Overall, there is no clinically relevant difference in postoperative opioid consumption with deep NMB compared to moderate NMB.
Intraoperative dose
Abu Yazed (2019) reported mean intraoperative fentanyl dose. In the deep NMB group, 2.41 μg/kg (SD 0.18) was administered versus 2.47 μg/kg (SD 0.17) in the moderate NMB group. The MD was -0.06 (95% CI -0.15 to 0.03).
Baete (2017) reported mean intraoperative remifentanil dose. In the deep NMB group, 22.0 μg/kg (SD 7.4) and in the moderate NMB group 23.4 μg/kg (SD 8.9) was administered. The MD was -1.40 (95% CI -5.54 to 2.74).
Torensma (2016) reported intraoperative remifentanil and piritramide doses. The dose of remifentanil administered was 1.1 mg (SD 0.4) for deep NMB and 1.0 mg (SD 0.4) for moderate NMB. The MD was 0.10 (95% CI -0.06 to 0.26). No difference was reported in the median dose of piritramide administered: for deep NMB 10 mg (range 10–10) and moderate NMB 10 mg (range 10–10) was reported.
Overall, there is no clinically relevant difference in intraoperative opioid consumption with deep NMB compared to moderate NMB.
Complications
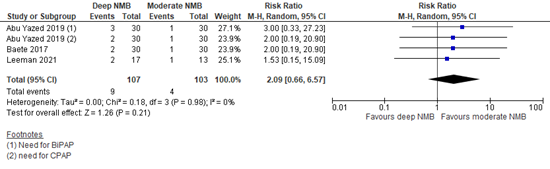
Three studies reported complications with Clavien Dindo classification three or higher. This included the need for CPAP (Abu Yazed, 20191; Baete, 2017), the need for BiPAP (Abu Yazed, 20192), and serious adverse events (Leeman, 2017), being, among others, intra-abdominal hematoma, staple line leakage at the gastro-enterostomy and iatrogenic bowel defects—the latter three of the serious adverse events required re-operation. A meta-analysis is shown in Figure 1. The relative risk (RR) was 2.09 (95% confidence interval (CI) 0.66 to 6.57). The number of complications was clinically relevant higher in the deep NMB group compared to the moderate NMB group.
Figure 1. Complications (level 3 or higher Clavien Dindo classification); deep versus moderate NMB
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
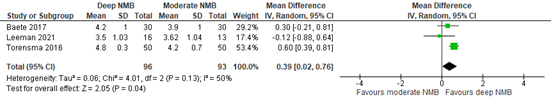
Satisfaction with surgical conditions
Three studies reported the surgeon’s rating of surgical conditions of deep versus moderate NMB. This was assessed on a 5-point surgical rating scale. The MD was 0.39 (95% CI 0.02 to 0.76; Figure 2). There is no clinically relevant difference in the Leiden-SRS score in deep NMB compared to moderate NMB.
Figure 2. Satisfaction of surgical conditions; deep versus moderate NMB
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
In addition to comparing deep versus moderate NMB, the study Torensma (2016) added a third arm of patients receiving a single NMB. This group had a mean Leiden-SRS score of 4.1 (SD: 0.6). MD of deep vs. single was 0.70 (95% CI 0.51 to 0.89), and MD moderate vs. single was 0.10 (95% CI -0.16 to 0.36). There is no clinically relevant difference in the Leiden-SRS score in single NMB compared to moderate or deep NMB.
Residual postoperative neuromuscular block
None of the included studies reported the outcome of ‘residual postoperative neuromuscular block’.
Aspiration
None of the included studies reported the outcome ‘aspiration’.
Awareness
None of the included studies reported the outcome of ‘awareness’.
Costs
None of the included studies reported the outcome ‘costs’.
Level of evidence of the literature
The level of evidence of all outcome measures started as high, as the included studies were RCTs.
The level of evidence regarding the outcome measure postoperative pain was downgraded by one level because of unclear confidence intervals (imprecision, -1). The level of evidence is moderate.
The level of evidence regarding the outcome measure postoperative opioid consumption was downgraded by one level because of unclear confidence intervals (imprecision, -1). The level of evidence is moderate.
The level of evidence regarding the outcome measure intraoperative opioid consumption was downgraded by one level because of wide confidence intervals (imprecision, -1). The level of evidence is moderate.
The level of evidence regarding the outcome measure complications was downgraded by three levels because of the pooled confidence interval crossing both thresholds of clinical relevance and a low number of events in a small sample size (imprecision, -3). The level of evidence is very low.
For deep vs. moderate NMB, the level of evidence regarding the outcome measure satisfaction of surgical conditions was not downgraded. The level of evidence is high.
For deep vs. single NMB, the level of evidence regarding satisfaction of surgical conditions was not downgraded. The level of evidence is high.
For moderate vs. single NMB, the level of evidence regarding satisfaction of surgical conditions was not downgraded. The level of evidence is high.
The level of evidence regarding the outcome measure residual postoperative neuromuscular block could not be graded as none of the included studies reported this outcome measure.
The level of evidence regarding the outcome measure aspiration could not be graded as none of the included studies reported this outcome measure.
The level of evidence regarding the outcome measure awareness could not be graded as none of the included studies reported this outcome measure.
The level of evidence regarding the outcome measure costs could not be graded as none of the included studies reported this outcome measure.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of a deep versus moderate versus single NMB in patients with obesity undergoing an abdominal procedure under general anesthesia?
P: Patients with obesity undergoing an abdominal procedure under general anesthesia
I: Deep neuromuscular block
C1: Moderate neuromuscular block
C2: Single neuromuscular block / usual care
O: Postoperative pain score, opioid consumption (intra- and postoperative), complications, the satisfaction of surgical conditions, residual postoperative neuromuscular block, aspiration, awareness during surgery, costs
Relevant outcome measures
The guideline development group considered postoperative pain score, postoperative opioid use, and complications as critical outcome measures for decision-making; and intraoperative opioid use, the satisfaction of surgical conditions, residual postoperative NMB, aspiration, and awareness during surgery as important outcome measures for decision-making.
A priori, the working group defined complications as level 3 or higher according to the Clavien-Dindo classification and reported within 30 days. Satisfaction of surgical conditions must be assessed as a continuous outcome measure using a Surgical Rating Scale (SRS) (Boon, 2019), and residual postoperative NMB was defined as a train-of-four (TOF) ratio below 0.9.
The working group did not define the other outcome measures listed above but used the definitions used in the studies.
The working group defined the following as a minimal clinically (patient) important difference:
Postoperative pain score: MD (mean difference) 10% of maximum score
Opioid consumption (intra- and postoperative): 20% difference compared to the control group
Complications: 0.91≥RR≥1.10
Satisfaction of surgical conditions: MD >1 point on a 5-point scale
Residual postoperative neuromuscular block: 0.8≥RR≥1.25
Aspiration: 0.91≥RR≥1.10
Awareness: 0.91≥RR≥1.10
Costs: 10% difference compared to the control group
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2010 until 5-10-2022 and updated with new search terms until 13-4-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 263 hits. Studies were selected based on the following criteria 1) a systematic review of RCTs or an RCT itself 2) published in 2010 or later, 3) studying patients with obesity undergoing an abdominal procedure under general anesthesia, 4) comparing deep vs. moderate and/or single NMB, 5) reporting the at least one of the outcomes defined above.
Fourteen studies were initially selected based on title and abstract screening. After reading the full text, eleven studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
One systematic review and two RCTs were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Abu Yazed MM, Ahmed SA. Deep versus moderate neuromuscular block in laparoscopic bariatric surgeries: effect on surgical conditions and pulmonary complications. Egyptian Journal of Anaesthesia. 2019 Oct 2;35(1):57-64.
- Aceto P, Perilli V, Modesti C, Sacco T, De Cicco R, Ceaichisciuc I, Sollazzi L. Effects of deep neuromuscular block on surgical workspace conditions in laparoscopic bariatric surgery: a systematic review and meta-analysis of randomized controlled trials. Minerva Anestesiol. 2020 Sep;86(9):957-964. Doi: 10.23736/S0375-9393.20.14283-4. Epub 2020 Apr 6. PMID: 32251573.
- Baete S, Vercruysse G, Vander Laenen M, De Vooght P, Van Melkebeek J, Dylst D, Beran M, Van Zundert J, Heylen R, Boer W, Van Boxstael S, Fret T, Verhelst H, De Deyne C, Jans F, Vanelderen P. The Effect of Deep Versus Moderate Neuromuscular Block on Surgical Conditions and Postoperative Respiratory Function in Bariatric Laparoscopic Surgery: A Randomized, Double Blind Clinical Trial. Anesth Analg. 2017 May;124(5):1469-1475. Doi: 10.1213/ANE.0000000000001801. PMID: 28107276.
- Boon M, Martini CH, Aarts LPHJ, Dahan A. The use of surgical rating scales for the evaluation of surgical working conditions during laparoscopic surgery: a scoping review. Surg Endosc. 2019 Jan;33(1):19-25. Doi: 10.1007/s00464-018-6424-5. Epub 2018 Sep 14. PMID: 30218262; PMCID: PMC6336757.
- Carvalho H, Verdonck M, Cools W, Geerts L, Forget P, Poelaert J. Forty years of neuromuscular monitoring and postoperative residual curarisation: a meta-analysis and evaluation of confidence in network meta-analysis. Br J Anaesth. 2020 Oct;125(4):466-482. Doi: 10.1016/j.bja.2020.05.063. Epub 2020 Jul 14. PMID: 32680607.
- Kirmeier E, Eriksson LI, Lewald H, Jonsson Fagerlund M, Hoeft A, Hollmann M, Meistelman C, Hunter JM, Ulm K, Blobner M; POPULAR Contributors. Post-anaesthesia pulmonary complications after use of muscle relaxants (POPULAR): a multicentre, prospective observational study. Lancet Respir Med. 2019 Feb;7(2):129-140. Doi: 10.1016/S2213-2600(18)30294-7. Epub 2018 Sep 14. Erratum in: Lancet Respir Med. 2018 Nov 6;: PMID: 30224322.
- Leeman M, Biter LU, Apers JA, Birnie E, Verbrugge SJC, Dunkelgrun M. Low-pressure pneumoperitoneum with deep neuromuscular blockade in metabolic surgery to reduce postoperative pain: a randomized pilot trial. Surg Endosc. 2021 Jun;35(6):2838-2845. Doi: 10.1007/s00464-020-07719-w. Epub 2020 Jun 18. PMID: 32556699.
- Manatakis DK, Georgopoulos N. Reducing the Cost of Laparoscopy: Reusable versus Disposable Laparoscopic Instruments. Minim Invasive Surg. 2014;2014:408171. Doi: 10.1155/2014/408171. Epub 2014 Jul 22. PMID: 25152814; PMCID: PMC4134811.
- Torensma B, Martini CH, Boon M, Olofsen E, In ‘t Veld B, Liem RS, Knook MT, Swank DJ, Dahan A. Deep Neuromuscular Block Improves Surgical Conditions during Bariatric Surgery and Reduces Postoperative Pain: A Randomized Double Blind Controlled Trial. PloS One. 2016 Dec 9;11(12):e0167907. Doi: 10.1371/journal.pone.0167907. PMID: 27936214; PMCID: PMC5148011.
- Zorginstituut. Medicijnkosten Sugammadex. Accessed 26 April, 2023 from: https://www.medicijnkosten.nl/zoeken?trefwoord=sugammadex
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention |
Comparison / control
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Aceto, 2020
[individual study characteristics deduced from [1st author, year of publication ]]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to September 2019
A: Baete, 2017 B: Torensma, 2016
Study design: RCT
Setting and Country: A: B: Netherlands
Source of funding and conflicts of interest: Nothing to declare
|
Inclusion criteria SR: RCTs and two-arm prospective studies comparing dNMB with moderate NMB
Exclusion criteria SR: Retrospective studies, letters, comments, editorials, reviews, and case reports
Four studies included, however in the current analysis 2 fulfilled our criteria and were included
Important patient characteristics at baseline:
N, mean age A: 30/30 patients, 41/42 yrs B: 50/50/50 patients, 47/47 yrs
Sex: A: 27/13% Male B: 22/18% Male
Groups comparable at baseline? Yes |
Describe intervention:
A: Deep NMB (rocuronium bolus and infusion maintaining a PTC of 1-2) B: Deep NMB (rocuronium 30 mg prior to intubation followed by repeated 10 mg intravenous dose; 0 twitch count in the TOF, 1–2 twitch responses in the PTC)
|
Describe control:
A: Moderate NMB (rocuronium bolus and top-ups maintaining a TOF count of 1-2) B:
2) single NMB (single administration of rocuronium 30 mg at induction on top of Propofol/ remifentanil anesthesia)
|
End-point of follow-up: A/B: not reported
For how many participants were no complete outcome data available? (intervention/control) A/B: not reported
|
Outcome measure
surgeon satisfaction scale, MD (95%CI) A: 0.30 (-0.21, 0.81) B: 0.60 (0.39, 0.81) P=0.47, I2=0%
Postoperative pain: “One study showed that dNMB also significantly decreased pain score (P=0.03).5 Pain was measured at 10-minute intervals in the post-anesthesia care unit for up to 40 minutes.”
Data on postoperative pain from the original publication by Torensma was extracted for the current analysis.
|
Risk of bias (high, some concerns or low): A: Some concerns B: Some concerns
Facultative:
author’s conclusion “It was found that dNMB helps improve surgical space conditions in patients undergoing laparoscopic bariatric surgery whereas it fails to shorten procedure duration. More high-quality large-sampled RCTs are needed to con- firm these results. The relationship between dNMB use and other clinical outcomes, such as complications occurrence, needs to be further investigated.”
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PloS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Aceto, 2022 |
Yes |
Yes
All relevant databases were searched in a comprehensive manner |
Yes |
Yes |
NA |
Yes
Using Cochrane’s risk of bias tool for RCTs |
Yes |
Yes
Publication mentions too few studies to assess funnel plot asymmetry |
Unclear
Not assessed for each individual RCT |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Abu Yazed, 2019 |
Probably yes;
Reason: computer-generated software was used |
Probably yes;
Reason: Closed, sealed envelopes were used. |
Probably no;
Reason: Patients and surgeon were blinded (anesthesiologist was not blinded and blinding of statistician not reported) |
Probably yes;
Reason: No loss to follow-up. |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW (all outcomes) |
|
Baete, 2017 |
Definitely yes;
Reason: Randomization by drawing envelopes by an anesthesiologist not involved in outcome assessment |
Probably yes;
Reason: Closed, unreadable envelopes were used |
Probably no;
Reason: Patients and surgeon were blinded. Anesthesiologist was not blinded, yet not involved in outcome assessment. Blinding of statistician is not reported. |
Probably yes;
Reason: No loss to follow-up. |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW (all outcomes) |
|
Leeman, 2019 |
Probably yes;
Reason: Patients were randomized by the principal investigator into one of four groups using variable block randomization software without stratification |
Probably no;
Reason: Allocation concealment is not described |
Probably no;
Reason: Patient and surgical team were blinded. The surgeon left the operating room for ten minutes after the TOP to ensure blinding. The anesthesiologist, could not be blinded coordinating the depth of NMB. Blinding of statistician not reported. |
Probably no;
Reason: Loss to follow-up is infrequent, yet reason for loss to follow-up are not reported for all cases. |
Definitely yes;
Reason: All relevant outcomes were reported; study protocol available. |
Definitely yes;
Reason: No other problems noted |
LOW (all outcomes) |
|
Torensma, 2016 |
Probably yes;
Reason: The anesthesiologist received the randomization code from an individual that was not part of the research team. It is unclear what method is used to generate this code. |
Probably yes;
Reason: The exact allocation concealment is not described, however an independent individual provided the randomization code to the surgeon |
Probably yes;
Reason: Patients were blinded. Surgeons and ward nurses were fully blinded. The anesthesiologist and anesthesia nurses could not be blinded, but were not involved in outcome assessment. The research team was fully blinded. |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW (all outcomes) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Baete S, Vercruysse G, Vander Laenen M, De Vooght P, Van Melkebeek J, Dylst D, Beran M, Van Zundert J, Heylen R, Boer W, Van Boxstael S, Fret T, Verhelst H, De Deyne C, Jans F, Vanelderen P. The Effect of Deep Versus Moderate Neuromuscular Block on Surgical Conditions and Postoperative Respiratory Function in Bariatric Laparoscopic Surgery: A Randomized, Double Blind Clinical Trial. Anesth Analg. 2017 May;124(5):1469-1475. Doi: 10.1213/ANE.0000000000001801. PMID: 28107276. |
Included in SR Aceto (2022) |
|
Choi BM, Ki SH, Lee YH, Gong CS, Kim HS, Lee IS, Kim BS, Kim BS, Noh GJ. Effects of depth of neuromuscular block on postoperative pain during laparoscopic gastrectomy: A randomized controlled trial. Eur J Anaesthesiol. 2019 Nov;36(11):863-870. Doi: 10.1097/EJA.0000000000001082. PMID: 31503037. |
Wrong population (non-obese) |
|
Fuchs-Buder T, Schmartz D, Baumann C, Hilt L, Nomine-Criqui C, Meistelman C, Brunaud L. Deep neuromuscular blockade improves surgical conditions during gastric bypass surgery for morbid obesity: A randomized controlled trial. Eur J Anaesthesiol. 2019 Jul;36(7):486-493. Doi: 10.1097/EJA.0000000000000996. PMID: 30985536. |
Wrong outcomes |
|
Huang H, Zhou L, Yu Y, Liu S, Xu H, Xu Z, Yang C, Liu C. Comparison of Deep and Moderate Neuromuscular Blockade on Intestinal Mucosal Barrier in Laparoscopic Gastrectomy: A Prospective, Randomized, Double-Blind Clinical Trial. Front Med (Lausanne). 2022 Feb 2;8:789597. Doi: 10.3389/fmed.2021.789597. PMID: 35186973; PMCID: PMC8847255. |
Wrong population (non-obese) |
|
Keating GM. Sugammadex: A Review of Neuromuscular Blockade Reversal. Drugs. 2016 Jul;76(10):1041-52. Doi: 10.1007/s40265-016-0604-1. PMID: 27324403. |
Wrong intervention, wrong comparator |
|
Kim HJ, Lee KY, Kim MH, Kim HI, Bai SJ. Effects of deep vs moderate neuromuscular block on the quality of recovery after robotic gastrectomy. Acta Anaesthesiol Scand. 2019 Mar;63(3):306-313. Doi: 10.1111/aas.13271. Epub 2018 Oct 15. PMID: 30324626. |
Wrong population (non-obese) |
|
Koo BW, Oh AY, Ryu JH, Lee YJ, Han JW, Nam SW, Park DJ, Seo KS. Effects of deep neuromuscular blockade on the stress response during laparoscopic gastrectomy Randomized controlled trials. Sci Rep. 2019 Aug 27;9(1):12411. Doi: 10.1038/s41598-019-48919-2. PMID: 31455832; PMCID: PMC6711963. |
Wrong population (non-obese) |
|
Lundstrøm LH, Duez CH, Nørskov AK, Rosenstock CV, Thomsen JL, Møller AM, Strande S, Wetterslev J. Avoidance versus use of neuromuscular blocking agents for improving conditions during tracheal intubation or direct laryngoscopy in adults and adolescents. Cochrane Database Syst Rev. 2017 May 17;5(5):CD009237. Doi: 10.1002/14651858.CD009237.pub2. PMID: 28513831; PMCID: PMC6481744. |
Wrong intervention, wrong comparator |
|
Niu L, Wang Y, Yao C, Sun Y, Yao S, Lin Y. Efficacy and Safety of Neuromuscular Blockade in Overweight Patients Undergoing Nasopharyngeal Surgery. Med Sci Monit. 2020 Sep 16;26:e926452. Doi: 10.12659/MSM.926452. PMID: 32936790; PMCID: PMC7519943. |
Wrong population, wrong intervention, wrong comparator |
|
Park SH, Huh H, Choi SI, Kim JH, Jang YJ, Park JM, Kwon OK, Jung MR, Jeong O, Lee CM, Min JS, Kim JJ, An L, Yang KS, Park S, Lee IO; Deep Neuromuscular Block on Oncologic Quality of Laparoscopic Surgery in Obese Gastric Cancer Patients (DEBLOQS_GC) Study Group. Impact of the Deep Neuromuscular Block on Oncologic Quality of Laparoscopic Surgery in Obese Gastric Cancer Patients: A Randomized Clinical trial. J Am Coll Surg. 2022 Mar 1;234(3):326-339. Doi: 10.1097/XCS.0000000000000061. PMID: 35213496. |
Wrong population |
|
Torensma B, Martini CH, Boon M, Olofsen E, In ‘t Veld B, Liem RS, Knook MT, Swank DJ, Dahan A. Deep Neuromuscular Block Improves Surgical Conditions during Bariatric Surgery and Reduces Postoperative Pain: A Randomized Double Blind Controlled Trial. PloS One. 2016 Dec 9;11(12):e0167907. Doi: 10.1371/journal.pone.0167907. PMID: 27936214; PMCID: PMC5148011. |
Included in SR Aceto (2022) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-04-2025
Beoordeeld op geldigheid : 09-04-2025
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de anesthesiologische zorg voor patiënten met obesitas.
Werkgroep
Dr. T.A. Brouwer, anesthesioloog, NVA
Drs. M.A.M. Siepel, anesthesioloog, NVA
Drs. A.D. Pot, anesthesioloog, NVA
Drs. S.D.X. Oei, AIOS anesthesiologie, NVA (vanaf september 2022)
Dr. B. Torensma, PhD, anesthesiemedewerker, NVAM
Drs. J.A. Apers, chirurg, NVvH
Dr. L. Freeman, gynaecoloog, NVOG (tot oktober 2022)
Dr. D.D.C.A. Henriquez, gynaecoloog, NVOG (vanaf oktober 2022)
Prof. dr. C. A. J. Knibbe, ziekenhuisapotheker, NVZA
Drs. M.A. Damhof, ziekenhuisapotheker, NVZA (vanaf december 2023)
Dr. H.J. Reesink, longarts, NVALT
Drs. H.L. Lutgers, internist-endocrinoloog, NIV (vanaf april 2023)
N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
Klankbordgroep
Dr. M. Klemt-Kropp, MDL-arts, NVMDL
Drs. Ö. Engin, oogarts, NOG
Dr. H. Buter, internist-intensivist, NVIC
N.J.C. Raeijmaekers, BSc, diëtist, NVD/NDBC
Met ondersteuning van
Drs. I. van Dusseldorp, literatuurspecialist, Kennisinstituut van de Federatie van Medisch Specialisten
Dr. J.C. Maas, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Drs. I. van Dijk, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Tammo Brouwer (voorzitter) |
Anesthesioloog, vrij ondernemer. |
Geen |
Geen |
Geen restricties |
|
Alice Dorien Pot |
Anesthesioloog in Meander Medisch Centrum Amersfoort |
Co-auteur boek 'klinische kinderanesthesiologie in de praktijk', initiatief vanuit NVA, uitgeverij Prelum (onbetaald). |
Geen |
Geen restricties |
|
Bart Torensma |
Klinisch epidemioloog en data scientist via eigen bedrijf Torensma Research Consultancy BV. |
"Dagelijks bestuurslid (penningmeester) Stichting COREON Algemeen bestuurslid Vereniging voor epidemiologen. Lesgeven aan de research verpleegkundige Breederode hogeschool Rotterdam
Masterclass gemaakt samen met Medtronic AUE over ERABS en team samenwerkingen." |
Voor PhD (<3 jaar geleden) onderzoek gedaan naar deep block verslapping bij patiënten met obesitas. Deze studie is destijds door MSD gesponsord in de vorm van gratis ampullen sugammadex.
|
Geen restricties |
|
Catherijne A.J. Knibbe |
Ziekenhuisapotheker-klinisch farmacoloog, St. Antonius ziekenhuis Nieuwegein en Utrecht, afdeling Klinische farmacie |
Lid CCMO, Lid Board ACCP |
Diverse studies gefinancierd door ZonMw of Antonius Onderzoeksfonds. De onderzoeken zijn niet gerelateerd aan de richtlijn. |
Geen restricties |
|
Dacia Henriquez |
Gynaecoloog, Amphia Ziekenhuis |
Geen |
Geen |
Geen restricties |
|
Helen Lutgers |
Internist in Ommelander Ziekenhuis Groningen |
Geen |
Geen |
Geen restricties |
|
Herre Reesink |
Longarts, OLVG Amsterdam |
Geen |
Geen |
Geen restricties |
|
Jan Apers |
Chirurg Franciscus Gasthuis & Vlietland |
NVGIC bestuur Dutch Obesity Academy |
Geen |
Geen restricties |
|
Liv Freeman |
Gynaecoloog Ikazia Ziekenhuis Rotterdam |
Voorzitter samenwerking obstetrie anesthesie (onbetaald)
|
Geen |
Geen restricties |
|
Michiel Damhof
|
Ziekenhuisapotheker Medisch Centrum Leeuwarden |
Geen |
Geen |
Geen restricties |
|
Muriel Arianne Michelle Siepel |
Anesthesioloog OLVG Amsterdam |
Geen |
Geen |
Geen restricties |
|
Nienke Cnossen |
Patiëntvertegenwoordiger |
Geen |
Geen |
Geen restricties |
|
Sander Oei |
Aios anesthesiologie. ErasmusMC |
SITdiensten Park Medisch Centrum, betaald. 1-2x/mnd ANWdiensten verpleeghuizen, betaald. 1x/mnd |
Geen |
Geen restricties |
|
Hanneke Buter |
Intensivist |
bestuurslid NVIC |
Geen |
Geen restricties |
|
Michael Klemt-Kropp |
MDL-arts |
Geen |
Geen |
Geen restricties |
|
Natascha Raeijmaekers |
Diëtist Obesitas Centrum, ETZ. Betaald. |
Bestuur Netwerk Diëtisten Bariatrische chirurgie, onbetaald. |
Geen |
Geen restricties |
|
Ozlem Engin |
Oogarts |
Geen |
Geen |
Geen restricties |
|
Irma van Dijk |
Adviseur kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
José Maas |
Adviseur kennisinstituut van de Federatie Medisch specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van een afvaardiging van de Nederlandse ‘Stichting ‘Overgewicht’ in de werkgroep. Het verslag van de knelpunteninventarisatie [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Stichting en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijn op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Diepte Neuromusculair Blok |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de anesthesiologische zorg voor patiënten met obesitas. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effect model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Uitgangsvraag: Wat is het (on)gunstige effect van een diep NMB versus minder diep NMB op patiënten met obesitas die een chirurgische ingreep ondergaan onder algehele anesthesie? |
|
|
Database(s): Ovid/Medline, Embase |
Datum:5-10-2022,13-4-2023 |
|
Periode: 2010- |
Talen: nvt |
Zoekopbrengst
|
13-4-2023 |
EMBASE |
OVID/MEDLINE |
Ontdubbeld t.o.v. Rayyan 5-10-2022 |
|
SRs |
37 |
5 |
7 |
|
RCTs |
183 |
43 |
45 |
|
Observationele studies |
|
|
|
|
Totaal in Rayyan |
|
|
263 |
|
5-10-2022 |
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
37 |
3 |
39 |
|
RCTs |
163 |
36 |
172 |
|
Observationele studies |
|
|
|
|
Totaal |
|
|
211 |
Zoekstrategie
Embase
13-4-2023
|
No. |
Query |
Results |
|
#23 |
#8 NOT #22 |
2 |
|
#22 |
#8 AND #17 Sleutelartikel leeman gevonden |
5 |
|
#21 |
#17 AND #19 NOT #20 RCT |
183 |
|
#20 |
#17 AND #18 SR |
37 |
|
#19 |
‘randomized controlled trial’/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 ‘clinical trial*’):ti,ab) OR (((‘non inferiority’ OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
2037821 |
|
#18 |
‘meta analysis’/exp OR ‘meta analysis (topic)’/exp OR metaanaly*:ti,ab OR ‘meta analy*’:ti,ab OR metanaly*:ti,ab OR ‘systematic review’/de OR ‘cochrane database of systematic reviews’/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR ‘structured literature’) NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR ‘data base*’) NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR ‘data base*’:ti,ab)) OR ((‘data extraction’:ti,ab OR ‘data source*’:ti,ab) AND ‘study selection’:ti,ab) OR (‘search strategy’:ti,ab AND ‘selection criteria’:ti,ab) OR (‘data source*’:ti,ab AND ‘data synthesis’:ti,ab) OR medline:ab OR pubmed:ab OR ochra:ab OR ochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR ‘data base*’:ab)) OR metasynthes*:ti,ab OR ‘meta synthes*’:ti,ab |
916835 |
|
#17 |
#16 AND [1-1-2010]/sd NOT (‘conference abstract’/it OR ‘editorial’/it OR ‘letter’/it OR ‘note’/it) NOT ((‘animal’/exp OR ‘animal experiment’/exp OR ‘animal model’/exp OR ‘nonhuman’/exp) NOT ‘human’/exp) |
633 |
|
#16 |
#15 NOT ((‘adolescent’/exp OR ‘child’/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT (‘adult’/exp OR ‘aged’/exp OR ‘middle aged’/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
1134 |
|
#15 |
#12 OR #14 |
1178 |
|
#14 |
#10 AND #13 |
689 |
|
#13 |
‘bariatric surgery’/exp OR ‘sleeve gastrectomy’/exp OR ‘gastric bypass surgery’/exp OR ‘roux-en-y gastric bypass’/exp OR ‘roux-en-y gastric bypass’:ti,ab,kw OR ‘roux-en-y gastric surgery’:ti,ab,kw OR ‘roux-en-y procedure’:ti,ab,kw OR ‘roux-en-y stomach bypass’:ti,ab,kw OR (((bariatr* OR metabolic* OR obes* OR ‘weight loss’ OR ‘weight reduc*’ OR ‘gastric sleeve’) NEAR/3 surg*):ti,ab,kw) OR ‘sleeve my*’:ti,ab,kw OR (((gastric OR stomach) NEAR/2 bypass):ti,ab,kw) |
80080 |
|
#12 |
#9 AND #10 AND #11 |
979 |
|
#11 |
‘abdominal surgery’/exp OR ‘surgical patient’/exp OR ‘surgical risk’/exp OR ‘surgery’/lnk OR surgic*:ti,kw OR surger*:ti,kw OR operation*:ti,kw OR operative:ti,kw OR presurg*:ti,kw OR preoperati*:ti,kw OR ‘pre-surg*’:ti,kw OR ‘pre-operati*’:ti,kw OR perisurg*:ti,kw OR perioperati*:ti,kw OR ‘peri-surg*’:ti,kw OR ‘peri-operati*’:ti,kw OR postsurg*:ti,kw OR postoperati*:ti,kw OR ‘post-surg*’:ti,kw OR ‘post-operati*’:ti,kw OR nonsurg*:ti,kw OR nonoperatic*:ti,kw OR ‘non-surg*’:ti,kw OR ‘non-operati*’:ti,kw OR laparoscop*:ti,kw |
3718027 |
|
#10 |
‘neuromuscular blocking’/exp OR ‘neuromuscular blocking agent’/exp OR (((myoneural OR ‘nerve musc*’ OR ‘neuro musc*’ OR neuromuscular) NEAR/3 (block* OR inhibition)):ti,ab,kw) |
103148 |
|
#9 |
‘obesity’/exp OR obes*:ti,ab,kw OR overweight*:ti,ab,kw OR ‘over weight*’:ti,ab,kw OR ‘adipositas’:ti,ab,kw OR ‘adiposity’:ti,ab,kw OR ‘excess body weight’:ti,ab,kw OR ‘corpulen*’:ti,ab,kw OR ‘fat overload syndrome’:ti,ab,kw OR bariatr*:ti,ab,kw |
799013 |
|
#8 |
#1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 sleutelartikelen |
7 |
|
#7 |
evaluation AND of AND surgical AND conditions AND during AND laparoscopic AND surgery AND in AND patients AND with AND moderate AND vs AND deep AND neuromuscular AND block NOT erratum:ti NOT corrigendum:ti |
1 |
|
#6 |
deep AND neuromuscular AND block AND to AND optimize AND surgical AND space AND conditions AND during AND laparoscopic AND surgery AND a AND systematic AND review AND ‘meta analysis’ AND bruintjes |
1 |
|
#5 |
effects AND deep AND neuromuscular AND block AND on AND surgical AND workspace AND conditions AND in AND laparoscopic AND bariatric AND surgery AND a AND systematic AND review AND ‘meta analysis’ AND of AND randomized AND controlled AND trials |
1 |
|
#4 |
‘low pressure’ AND pneumoperitoneum AND with AND deep AND neuromuscular AND blockade AND in AND metabolic AND surgery AND to AND reduce AND postoperative AND pain AND a AND randomized AND pilot AND trial NOT bariatric:ti |
1 |
|
#3 |
deep AND neuromuscular AND blockade AND improves AND surgical AND conditions AND during AND gastric AND bypass AND surgery AND for AND morbid AND obesity AND a AND ochranem AND controlled AND trial |
1 |
|
#2 |
impact AND the AND deep AND neuromuscular AND block AND on AND oncologic AND quality AND of AND laparoscopic AND surgery AND in AND obese AND gastric AND cancer AND patients AND a AND randomized AND clinical AND trial AND park AND 2022 NOT oncological:ti |
1 |
|
#1 |
deep AND neuromuscular AND block AND improves AND surgical AND conditions AND during AND bariatric AND surgery AND reduces AND postoperative AND pain AND a AND randomized AND double AND blind AND controlled AND trial |
1 |
Copyright © 2023 Elsevier Limited except certain content provided by third parties.
Embase
5-10-2022
|
No. |
Query |
Results |
|
#21 |
#8 NOT #20 3 sleutelartikelen niet gevonden. (algemeen, niet obesitas) |
3 |
|
#20 |
#8 AND #16 4 sleutelartikelen gevonden |
4 |
|
#19 |
#18 NOT #17 RCT |
163 |
|
#18 |
#15 AND #16 |
170 |
|
#17 |
#14 AND #16 SR |
37 |
|
#16 |
#13 AND [1-1-2010]/sd NOT (‘conference abstract’/it OR ‘editorial’/it OR ‘letter’/it OR ‘note’/it) NOT ((‘animal’/exp OR ‘animal experiment’/exp OR ‘animal model’/exp OR ‘nonhuman’/exp) NOT ‘human’/exp) |
591 |
|
#15 |
‘randomized controlled trial’/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 ‘clinical trial*’):ti,ab) OR (((‘non inferiority’ OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1967067 |
|
#14 |
‘meta analysis’/exp OR ‘meta analysis (topic)’/exp OR metaanaly*:ti,ab OR ‘meta analy*’:ti,ab OR metanaly*:ti,ab OR ‘systematic review’/de OR ‘cochrane database of systematic reviews’/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR ‘structured literature’) NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR ‘data base*’) NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR ‘data base*’:ti,ab)) OR ((‘data extraction’:ti,ab OR ‘data source*’:ti,ab) AND ‘study selection’:ti,ab) OR (‘search strategy’:ti,ab AND ‘selection criteria’:ti,ab) OR (‘data source*’:ti,ab AND ‘data synthesis’:ti,ab) OR medline:ab OR pubmed:ab OR ochra:ab OR ochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR ‘data base*’:ab)) OR metasynthes*:ti,ab OR ‘meta synthes*’:ti,ab |
864161 |
|
#13 |
#12 NOT ((‘adolescent’/exp OR ‘child’/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT (‘adult’/exp OR ‘aged’/exp OR ‘middle aged’/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
1090 |
|
#12 |
#9 AND #10 AND #11 |
1131 |
|
#11 |
‘abdominal surgery’/exp OR ‘surgical patient’/exp OR ‘surgical risk’/exp OR ‘surgery’/lnk OR ‘perioperative period’/exp OR surgic*:ti,ab,kw OR surger*:ti,ab,kw OR operation*:ti,ab,kw OR operative:ti,ab,kw OR presurg*:ti,ab,kw OR preoperati*:ti,ab,kw OR ‘pre-surg*’:ti,ab,kw OR ‘pre-operati*’:ti,ab,kw OR perisurg*:ti,ab,kw OR perioperati*:ti,ab,kw OR ‘peri-surg*’:ti,ab,kw OR ‘peri-operati*’:ti,ab,kw OR postsurg*:ti,ab,kw OR postoperati*:ti,ab,kw OR ‘post-surg*’:ti,ab,kw OR ‘post-operati*’:ti,ab,kw OR nonsurg*:ti,ab,kw OR nonoperatic*:ti,ab,kw OR ‘non-surg*’:ti,ab,kw OR ‘non-operati*’:ti,ab,kw OR laparoscop*:ti,ab,kw |
5582278 |
|
#10 |
‘neuromuscular blocking’/exp OR ‘neuromuscular blocking agent’/exp OR (((myoneural OR ‘nerve musc*’ OR ‘neuro musc*’ OR neuromuscular) NEAR/3 (block* OR inhibition)):ti,ab,kw) |
103148 |
|
#9 |
‘obesity’/exp OR obes*:ti,ab,kw OR overweight*:ti,ab,kw OR ‘over weight*’:ti,ab,kw OR ‘adipositas’:ti,ab,kw OR ‘adiposity’:ti,ab,kw OR ‘excess body weight’:ti,ab,kw OR ‘corpulen*’:ti,ab,kw OR ‘fat overload syndrome’:ti,ab,kw OR bariatr*:ti,ab,kw |
764397 |
|
#8 |
#1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 sleutelartikelen |
7 |
|
#7 |
evaluation AND of AND surgical AND conditions AND during AND laparoscopic AND surgery AND in AND patients AND with AND moderate AND vs AND deep AND neuromuscular AND block NOT erratum:ti NOT corrigendum:ti |
1 |
|
#6 |
deep AND neuromuscular AND block AND to AND optimize AND surgical AND space AND conditions AND during AND laparoscopic AND surgery AND a AND systematic AND review AND ‘meta analysis’ AND bruintjes |
1 |
|
#5 |
effects AND deep AND neuromuscular AND block AND on AND surgical AND workspace AND conditions AND in AND laparoscopic AND bariatric AND surgery AND a AND systematic AND review AND ‘meta analysis’ AND of AND randomized AND controlled AND trials |
1 |
|
#4 |
‘low pressure’ AND pneumoperitoneum AND with AND deep AND neuromuscular AND blockade AND in AND metabolic AND surgery AND to AND reduce AND postoperative AND pain AND a AND randomized AND pilot AND trial NOT bariatric:ti |
1 |
|
#3 |
deep AND neuromuscular AND blockade AND improves AND surgical AND conditions AND during AND gastric AND bypass AND surgery AND for AND morbid AND obesity AND a AND ochranem AND controlled AND trial |
1 |
|
#2 |
impact AND the AND deep AND neuromuscular AND block AND on AND oncologic AND quality AND of AND laparoscopic AND surgery AND in AND obese AND gastric AND cancer AND patients AND a AND randomized AND clinical AND trial AND park AND 2022 NOT oncological:ti |
1 |
|
#1 |
deep AND neuromuscular AND block AND improves AND surgical AND conditions AND during AND bariatric AND surgery AND reduces AND postoperative AND pain AND a AND randomized AND double AND blind AND controlled AND trial |
1 |
Ovid/Medline
13-4-2023
|
# |
Searches |
Results |
|
14 |
(10 and 12) not 13 RCT |
43 |
|
13 |
10 and 11 SR |
5 |
|
12 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. Or rct?.ti,ab. Or ((pragmatic or practical) adj “clinical trial*”).ti,ab,kf. Or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1603391 |
|
11 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. Or systematic review/ or ochrane.jw. or (prisma or prospero).ti,ab,kf. Or ((systemati* or scoping or umbrella or “structured literature”) adj3 (review* or overview*)).ti,ab,kf. Or (systemic* adj1 review*).ti,ab,kf. Or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. Or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. Or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. Or ((“data extraction” or “data source*”) and “study selection”).ti,ab,kf. Or (“search strategy” and “selection criteria”).ti,ab,kf. Or (“data source*” and “data synthesis”).ti,ab,kf. Or (medline or pubmed or ochra or ochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
661270 |
|
10 |
limit 9 to yr=”2010 -Current” |
153 |
|
9 |
8 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. Or child*.ti,ab,kf. Or schoolchild*.ti,ab,kf. Or infant*.ti,ab,kf. Or girl*.ti,ab,kf. Or boy*.ti,ab,kf. Or teen.ti,ab,kf. Or teens.ti,ab,kf. Or teenager*.ti,ab,kf. Or youth*.ti,ab,kf. Or pediatr*.ti,ab,kf. Or paediatr*.ti,ab,kf. Or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. Or man.ti,ab,kf. Or men.ti,ab,kf. Or woman.ti,ab,kf. Or women.ti,ab,kf.)) |
248 |
|
8 |
3 or 7 |
261 |
|
7 |
4 and 5 and 6 |
222 |
|
6 |
exp Surgical Procedures, Operative/ or exp Specialties, Surgical/ or su.fs. or exp Perioperative Period/ or surgic*.ti,ab,kf. Or surger*.ti,ab,kf. Or operation*.ti,ab,kf. Or operative.ti,ab,kf. Or presurg*.ti,ab,kf. Or preoperati*.ti,ab,kf. Or pre-surg*.ti,ab,kf. Or pre-operati*.ti,ab,kf. Or perisurg*.ti,ab,kf. Or perioperati*.ti,ab,kf. Or peri-surg*.ti,ab,kf. Or peri-operati*.ti,ab,kf. Or postsurg*.ti,ab,kf. Or postoperati*.ti,ab,kf. Or post-surg*.ti,ab,kf. Or post-operati*.ti,ab,kf. Or nonsurg*.ti,ab,kf. Or nonoperatic*.ti,ab,kf. Or non-surg*.ti,ab,kf. Or non-operati*.ti,ab,kf. Or laparoscop*.ti,ab,kf. |
5504339 |
|
5 |
Neuromuscular Blockade/ or exp Neuromuscular Blocking Agents/ or ((myoneural or ‘nerve musc*’ or ‘neuro musc*’ or neuromuscular) adj3 (block* or inhibition)).ti,ab,kf. |
30565 |
|
4 |
exp Obesity/ or obes*.ti,ab,kf. Or overweight*.ti,ab,kf. Or ‘over weight*’.ti,ab,kf. Or adipositas.ti,ab,kf. Or adiposity.ti,ab,kf. Or excess body weight.ti,ab,kf. Or corpulen*.ti,ab,kf. Or fat overload syndrome.ti,ab,kf. Or bariatr*.ti,ab,kf. |
462610 |
|
3 |
1 and 2 |
117 |
|
2 |
Neuromuscular Blockade/ or exp Neuromuscular Blocking Agents/ or ((myoneural or ‘nerve musc*’ or ‘neuro musc*’ or neuromuscular) adj3 (block* or inhibition)).ti,ab,kf. |
30565 |
|
1 |
exp Bariatric Surgery/ or exp Gastrectomy/ or roux-en-y.ti,ab,kf. Or ((bariatr* or metabolic* or obes* or weight loss or weight reduc* or gastric sleeve) adj3 surg*).ti,ab,kf. Or sleeve ochranemy*.ti,ab,kf. Or ((gastric or stomach) adj2 bypass).ti,ab,kf. |
85074 |
5-10-2022
|
# |
Searches |
Results |
|
10 |
6 and 8 |
36 |
|
9 |
6 and 7 |
3 |
|
8 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. Or rct?.ti,ab. Or ((pragmatic or practical) adj “clinical trial*”).ti,ab,kf. Or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1552453 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. Or systematic review/ or ochrane.jw. or (prisma or prospero).ti,ab,kf. Or ((systemati* or scoping or umbrella or “structured literature”) adj3 (review* or overview*)).ti,ab,kf. Or (systemic* adj1 review*).ti,ab,kf. Or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. Or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. Or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. Or ((“data extraction” or “data source*”) and “study selection”).ti,ab,kf. Or (“search strategy” and “selection criteria”).ti,ab,kf. Or (“data source*” and “data synthesis”).ti,ab,kf. Or (medline or pubmed or ochra or ochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
622598 |
|
6 |
limit 5 to yr=”2010 -Current” |
132 |
|
5 |
4 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. Or child*.ti,ab,kf. Or schoolchild*.ti,ab,kf. Or infant*.ti,ab,kf. Or girl*.ti,ab,kf. Or boy*.ti,ab,kf. Or teen.ti,ab,kf. Or teens.ti,ab,kf. Or teenager*.ti,ab,kf. Or youth*.ti,ab,kf. Or pediatr*.ti,ab,kf. Or paediatr*.ti,ab,kf. Or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. Or man.ti,ab,kf. Or men.ti,ab,kf. Or woman.ti,ab,kf. Or women.ti,ab,kf.)) |
206 |
|
4 |
1 and 2 and 3 |
215 |
|
3 |
exp Surgical Procedures, Operative/ or exp Specialties, Surgical/ or su.fs. or exp Perioperative Period/ or surgic*.ti,ab,kf. Or surger*.ti,ab,kf. Or operation*.ti,ab,kf. Or operative.ti,ab,kf. Or presurg*.ti,ab,kf. Or preoperati*.ti,ab,kf. Or pre-surg*.ti,ab,kf. Or pre-operati*.ti,ab,kf. Or perisurg*.ti,ab,kf. Or perioperati*.ti,ab,kf. Or peri-surg*.ti,ab,kf. Or peri-operati*.ti,ab,kf. Or postsurg*.ti,ab,kf. Or postoperati*.ti,ab,kf. Or post-surg*.ti,ab,kf. Or post-operati*.ti,ab,kf. Or nonsurg*.ti,ab,kf. Or nonoperatic*.ti,ab,kf. Or non-surg*.ti,ab,kf. Or non-operati*.ti,ab,kf. Or laparoscop*.ti,ab,kf. |
5391548 |
|
2 |
Neuromuscular Blockade/ or exp Neuromuscular Blocking Agents/ or ((myoneural or ‘nerve musc*’ or ‘neuro musc*’ or neuromuscular) adj3 (block* or inhibition)).ti,ab,kf. |
30343 |
|
1 |
exp Obesity/ or obes*.ti,ab,kf. Or overweight*.ti,ab,kf. Or ‘over weight*’.ti,ab,kf. Or adipositas.ti,ab,kf. Or adiposity.ti,ab,kf. Or excess body weight.ti,ab,kf. Or corpulen*.ti,ab,kf. Or fat overload syndrome.ti,ab,kf. Or bariatr*.ti,ab,kf. |
447410 |