Diagnostiek van ARDS
Uitgangsvraag
Hoe kan de diagnose ARDS gesteld worden?
Aanbeveling
Aanbeveling 1: Syndroomdiagnose/Ernst
Monitor de beademde patiënt met een PaO2/FiO2-ratio < 300 mmHg en een PEEP ≥ 5 cmH2O dagelijks op de ontwikkeling van ARDS.
Stel de syndroomdiagnose ARDS volgens de Berlin criteria.
Classificeer de ernst van ARDS volgens de Berlin criteria.
Aanbeveling 2: Identificeren etiologie ARDS
Maak gebruik van een diagnostisch algoritme om de etiologie te identificeren. Dit diagnostisch algoritme bevat:
- een tijdspad om de etiologische diagnose snel te stellen;
- een stappenplan met hierin verschillende diagnostische modaliteiten ingedeeld op basis van epidemiologie en noodzaak tot snelle diagnose;
- een beschrijving van het moment om diagnostiek elders te verrichten als deze lokaal niet beschikbaar is.
Aanbeveling 3: Fenotypering ARDS
Realiseer je dat ARDS een heterogene aandoening is, waarbij subclassificaties kunnen leiden tot een ander behandelbeleid.
Overwegingen
Voor- en nadelen van de interventie/methode van diagnose en de kwaliteit van het bewijs
Een diagnostisch algoritme voor ARDS is op te delen in 4 stappen:
- Het stellen van de syndroomdiagnose ARDS (ingangscriterium)
- Het classificeren van de ernst van ARDS (prognose)
- Het identificeren van de etiologie van ARDS (behandeling onderliggend lijden)
- Het bepalen van het subtype/fenotype van ARDS (effect van therapie)
Stellen van de diagnose ARDS
ARDS is een syndroom diagnose welke gesteld wordt volgens de Berlin criteria (ARDS Definition Task Force, 2012; Tabel 1). Dit is noodzakelijk als start criterium voor prognosticering en om te bepalen welke beademingsstrategie en behandelingen van toepassing zijn. Het screenen op ARDS kan dagelijks plaatsvinden door gebruik te maken van de PaO2/FiO2 ratio. Als deze <300 mmHg is, bij een patiënt met ≥ 5 cmH2O PEEP, dan is er mogelijk sprake van ARDS. Door vervolgens de overige criteria te controleren kan de definitieve diagnose ARDS gesteld worden. Hierbij is ook beeldvormende diagnostiek nodig, zodra er een redelijke verdenking op ARDS ontstaat. Daarbij dient het stellen van de diagnose altijd gepaard te gaan met het uitsluiten van hydrostatisch longoedeem (cardiogeen, hypervolemie), met de kanttekening dat ARDS ook kan bestaan bij patiënten met cardiaal falen.
Tabel 1: Berlin criteria:
|
‘Berlin Criteria’ voor ARDS |
|||
|
Tijd |
Respiratoire symptomen begonnen binnen 1 week na een bekende uitlokkende factor* voor ARDS of nieuwe/verslechterende kliniek in de afgelopen week. |
|
|
|
Beeldvorming |
Bilaterale opaciteit op een X-thorax of densiteit op een CT scan (niet volledig verklaard door atelectase, pleura-effusie, of nodi). |
|
|
|
Oorsprong van longoedeem |
Respiratoir falen niet volledig toe te schrijven aan cardiaal falen of volume overbelasting. Hydrostatisch pulmonaal oedeem moet uitgesloten worden indien er geen risicofactoren voor ARDS aanwezig zijn. |
|
|
|
Ernst o.b.v. mate van hypoxemie |
Mild |
200 < PaO2/FiO2 <300 mmHg (26 < PaO2/FiO2 < 40 kPa) bij PEEP ≥ 5 cmH2O |
|
|
Matig |
100 < PaO2/FiO2 <200 mmHg (13 < PaO2/FiO2 < 26 kPa) bij PEEP ≥ 5 cmH2O |
|
|
|
Ernstig |
PaO2/FiO2 <100 mmHg (PaO2/FiO2 < 13 kPa) bij PEEP ≥ 5 cmH2O |
|
|
|
* klinische risicofactoren: pneumonie, aspiratie, rookinhalatie, bijna verdrinking, sepsis, pancreatitis, trauma, grote chirurgische ingreep, bloedtransfusie (dan spreekt men van transfusion-related lung injury; TRALI). |
|
||
Classificeren van de ernst van ARDS
De ernst van ARDS wordt vastgesteld aan de hand van de PaO2/FiO2 ratio, zoals ook weergegeven in Tabel 1 en correleert met de prognose van ARDS. Voor deze classificatie geldt dat het PEEP niveau 5 cmH2O of hoger moet zijn. Dit maakt dat formeel de diagnose ARDS alleen gesteld kan worden in patiënten met (non)invasieve beademing. Dit is in tegenstelling tot de onlangs verschenen ARDS richtlijn van de ESICM, waarbij de diagnose ARDS ook overwogen kan worden bij non-invasieve beademing en ‘high flow zuurstoftherapie’. Onze richtlijn is specifiek voor invasieve beademing bij ARDS, waardoor de diagnose ARDS bij patienten met high flow zuurstoftherapie buiten de scope van deze richtlijn valt. Het is van belang de ernst van ARDS vast te stellen, daar studies naar de behandeling van ARDS vaak voornamelijk gericht zijn op patiënten met matig-ernstige of alleen ernstige ARDS en mogelijk niet van toepassing zijn op patiënten met milde ARDS.
Identificeren etiologie ARDS
Een groot deel van de behandelingen beschreven in deze richtlijn zijn ondersteunend en hebben als doel om additieve beademingsschade, ventilator induced lung injury (VILI), te voorkomen. Deze schade kan op zichzelf weer leiden tot (het verergeren van) ARDS. De behandeling is echter ook afhankelijk van het etiologische substraat. Er zijn meerdere etiologische substraten die kunnen resulteren in ARDS, met als meest voorkomende oorzaken bacteriele pneumonie, aspiratie en non-pulmonale sepsis. Dit spectrum loopt van infectieuze tot inflammatoire oorzaken, waarbij de behandeling bij infectieuze oorzaken gericht is op het bestrijden van het micro-organisme, en de behandeling bij inflammatoire oorzaken gericht is op het moduleren van de immuunrespons. Dit voorbeeld van twee wezenlijk andere behandelingen illustreert het belang om de onderliggende oorzaak van ARDS te identificeren. De complexiteit van deze diagnosestelling wordt vergroot doordat er sprake kan zijn van meerdere oorzaken of een evolutie van de ene aandoening naar de andere, inclusief het ontstaan van eerdergenoemde beademing gerelateerde schade.
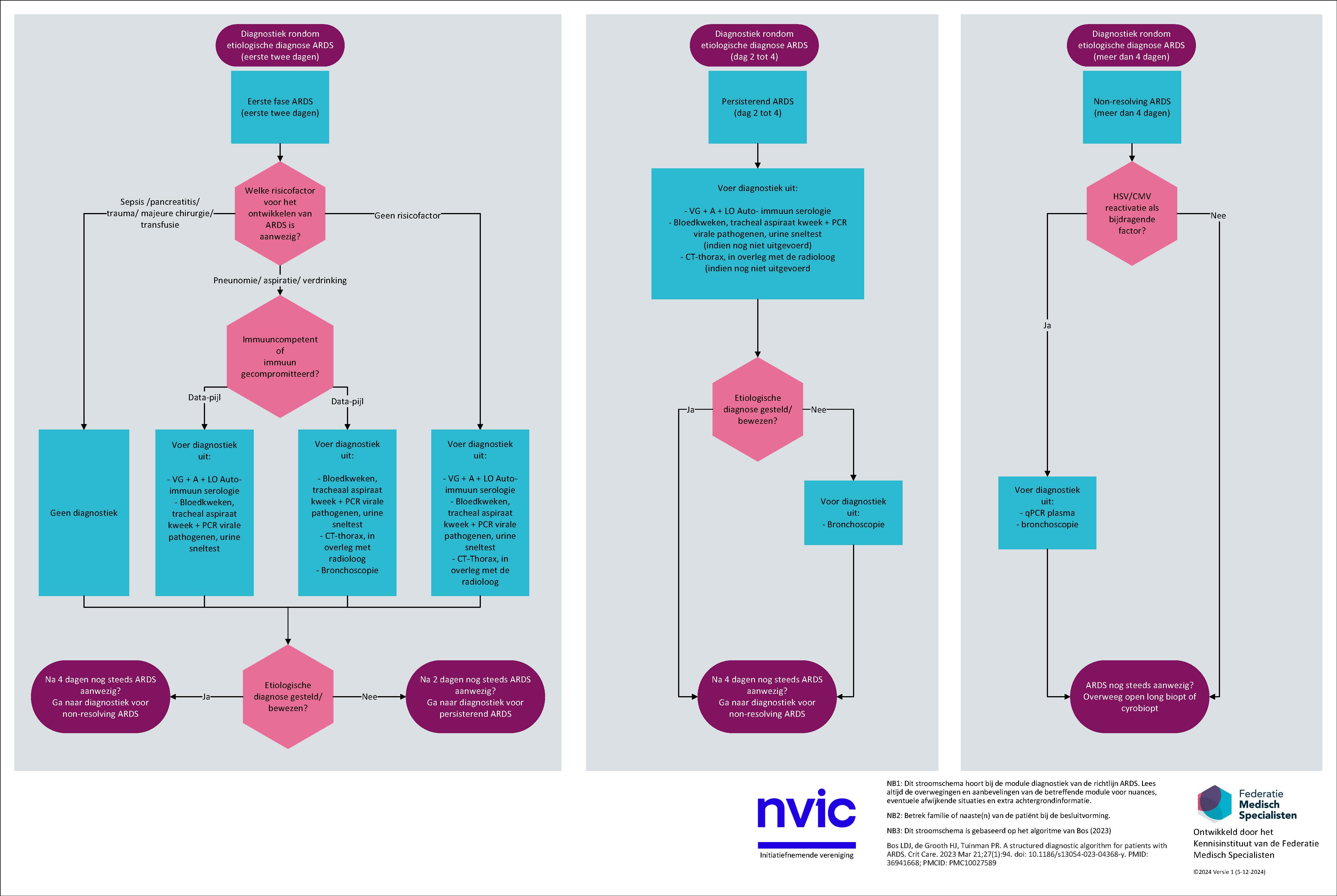
De werkgroep stelt voor een diagnostisch algoritme te gebruiken in elk ziekenhuis om de etiologische diagnose van ARDS te identificeren. Het doel van een algoritme is om binnen een beperkte tijdsduur de etiologische diagnose van ARDS vast te kunnen stellen. Als het ARDS-beeld niet herstelt (het zogenaamde “non-resolving” ARDS), zoek dan naar een onderhoudende of nieuwe factor die het aanhoudende ARDS-beeld kan verklaren (zoals infectieuze oorzaken als pneumonie obv verschillende bacteriele, virale en/of fungale verwekkers). Ook daarin kan een algoritme met een tijdsinterval ondersteunend zijn.
Tijd is een wezenlijk onderdeel van elk algoritme. Een algoritme omvat daarnaast de verschillende diagnostische modaliteiten die noodzakelijk zijn om de etiologische diagnose te stellen. De toepassing van deze modaliteiten is opgedeeld in verschillende stappen die afhankelijk zijn, van de epidemiologie van de initiële aandoening, de noodzaak tot snelle diagnose en de mate van invasiviteit en de bijkomende risico’s. Tot slot kan een algoritme helpen bij de beslissing wanneer een patiënt moet worden overgeplaatst naar een ander centrum voor aanvullende diagnostiek (bijvoorbeeld voor het nemen van een longbiopt).
Er is geen literatuur over wat het optimale algoritme is om de onderliggende oorzaak van ARDS te diagnostiseren. Derhalve heeft de werkgroep gezocht naar reeds in de Nederlandse situatie toegepaste algoritmes. Een voorbeeld van een dergelijk diagnostisch algoritme (Bos, 2023) dat kan worden gebruikt en waarin de werkgroep zich kan vinden, is opgenomen als Figuur 1. Dit algoritme kan worden aangepast aan de lokale mogelijkheden en protocollen, in samenspraak met ondersteunende specialismen (bijvoorbeeld welk radiologisch protocol gebruikt moet worden gericht op de vraagstelling). Let wel, dit alogoritme is een voorbeeld, de werkgroep wil hiermee met name het belang onderstrepen van de in de ogen van de werkgroep noodzaak tot identificeren van de onderliggende oorzaak van ARDS.
Bepalen van fenotype/subclassificatie van ARDS
Naast de verschillen in etiologie, bestaan er ook verschillende subgroepen, subphenotypes en endotypes die van invloed kunnen zijn op het succes van de behandeling van ARDS. Dit wordt ook als zodanig herkend en gedefineerd in de recente ESICM richtlijn ARDS. Hoewel het bepalen van deze fenotypes niet altijd even makkelijk is, en de relatie met de uitkomst van behandelingen nog maar beperkt onderzocht is, is de werkgroep van mening dat bewustwording van de huidige bekende verschijningsvormen kan bijdragen aan beter begrip van het ziektebeeld en het in de toekomst mogelijk te verwachten succes van interventies (Khan, 2021). Nu maken we ook al gebruik van subgroepen, namelijk op basis van de PaO2/FiO2 ratio om te bepalen of bepaalde interventies bij ARDS zinvol zijn. Retrospectieve analyse van de LOVS (Meade, 2008) en ExPress trials (Mercat, 2008) suggereert dat toepassing van een hoge PEEP positieve effecten heeft op de mortaliteit in patiënten met een oxygenatie response (>25 mmHg toename in PaO2/FiO2 ratio) (Goligher, 2014), met sterkere effecten in patiënten met ernstigere hypoxemie (slechtere PaO2/FiO2 ratio).
Vooralsnog zijn er twee wijze van fenotyperen goed beschreven: een inflammatoire en een morfologische manier van fenotyperen (Matthay et al., ICM 2020). De inflammatoire fenotypering wordt bepaald door een set van biomarkers en klinische karakteristieken. Het is nog onduidelijk of het inflammatoire type meer gevoelig is voor immuunmodulatie. Mogelijk hebben hyperinflammatoire fenotypes een betere outcome bij hoge PEEP (Calfee, 2014) en liberaler vochtbeleid (Famous, 2017). Een deel van deze biomarkers zijn niet in elk ziekenhuis te bepalen, wat de toepasbaarheid vooralsnog beperkt maakt. De morfologische fenotypering gebeurt aan de hand van een CT-scan. Dit kan helpen bepalen of een long minder of meer gevoelig is voor hogere PEEP (zie hiervoor de module ‘Module Methode van beademing – PEEP’).
Figuur 1: Voorbeeld van een diagnostisch algoritme voor de diagnosestelling van ARDS (op basis van Bos (2023). Afkortingen (van boven naar beneden, en van links naar rechts): Acute Respiratory Distress Syndrome (ARDS), voorgeschiedenis (VG), anamnese (A), lichamelijk onderzoek (LO), polymerase chain reaction (PCR), Herpes simplex virus (HSV), cytomegalovirus (CMV), Quantitative real time PCR (qPCR).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
ARDS wordt gekenmerkt door een hoge morbiditeit en mortaliteit, afhankelijk van ernst, fenotype, onderliggend lijden, uitlokkende factoren en bijkomend orgaanfalen. Voor de patiënt is een korte opnameduur, lage morbiditeit en mortaliteit het meest van belang, zodat de gevolgen voor hun kwaliteit van leven en gezondheid op de lange termijn zo beperkt mogelijk zijn. Voor patiënten is het juist stellen van de syndroomdiagnose, maar ook het identificeren van het onderliggend lijden van belang. Het identificeren van onderliggend lijden maakt een meer geïndividualiseerde behandeling mogelijk, die de prognose van het onderliggend lijden gunstig kan beïnvloeden. Het meest prangende voorbeeld is de patiënt met ARDS ten gevolge van een ventilator geassocieerde pneumonie met een goed gevoelig micro-organisme (goed te behandelen met antibiotica en reeële kans op herstel) tegenover de patiënt met een vergevorderd stadium van longfibrose (weinig tot geen behandelopties en mogelijkheden tot herstel).
Kosten (middelenbeslag)
Het juist stellen van de diagnose ARDS en het inschatten van de ernst kan gebruik worden gemaakt van de middelen die voor elke Intensive Care reeds beschikbaar zijn. Dit brengt geen extra kosten met zich mee.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep verwacht geen problemen ten aanzien van de aanvaardbaarheid, haalbaarheid en implementatie. Wel zal in het uitwerken van een diagnostisch algoritme aangepast voor de lokale situatie tijd en energie zitten met ook overleg in de eigen regio indien er afspraken gemaakt worden over niet direct beschikbare diagnostische modaliteiten (bijvoorbeeld het longbiopt).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Gezien de argumentatie dat het juist stellen van de syndroom diagnose ARDS en het stellen van de juiste onderliggende diagnose van invloed is op de behandeling en de prognose, lijkt het waarschijnlijk dat de voordelen van een diagnostisch algoritme opwegen tegen de belasting hiervan voor de patiënt.
Onderbouwing
Achtergrond
ARDS is in opzet een simpele syndroomdiagnose, doch wordt in de praktijk vaak gemist (LUNG SAFE studie, Bellani, 2016). In de praktijk wordt deze diagnose veelal alleen gesteld op basis van de PaO2/FiO2-ratio al dan niet in combinatie met beeldvorming. Het gevaar hiervan is dat de vertaling van behandelingen zoals beschreven in de literatuur alleen mogelijk zijn door ARDS en de ernst van ARDS op de juiste wijze te diagnosticeren en te classificeren volgens de Berlin-criteria.
ARDS is alleen een syndroomdiagnose en geen etiologische diagnose. De etiologische diagnose is wel van belang om adequate therapie in te stellen voor het onderliggend lijden.
Het gevaar van het louter stellen van de syndroomdiagnose ARDS is dat deze etiologische diagnose over het hoofd wordt gezien. Veel voorkomende etiologische diagnoses van ARDS zijn pneumonie, aspiratie en abdominale sepsis.
Tot slot is er een groeiend besef dat ARDS een heterogene aandoening is met meerdere fenotypes. Door deze te bepalen zou een meer geïndividualiseerde behandeling mogelijk moeten zijn. Dit hoofdstuk beschrijft hoe men de syndroomdiagnose ARDS kan stellen en hoe men de ernst kan classificeren. Daarnaast bevat het een voorstel voor een algoritme om de onderliggende diagnose te identificeren en geeft het een overzicht over de huidige mogelijkheden om fenotypes van ARDS te kunnen bepalen.
Zoeken en selecteren
Search and select
Due to limited resources, and a lack of guidelines and international accepted diagnostic algorithms, the working group decided not to perform a systematic literature search. Recommendations will be based on considerations that are drafted by members of the working group and based on expert opinion. If possible, statements will be substantiated by literature. The main goal of this algorithm is to identify the patient with ARDS, classify severity and search for underlying disease.
Referenties
- ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012 Jun 20;307(23):2526-33. doi: 10.1001/jama.2012.5669. PMID: 22797452
- Bellani G., Laffey, J.G., Pham, T., Fan, E.(2016). The LUNG SAFE study: a presentation of the Prevalence of ARDS according to the Berlin Definition! Critical Care, 20(1): 268.
- Bos LDJ, de Grooth HJ, Tuinman PR. A structured diagnostic algorithm for patients with ARDS. Crit Care. 2023 Mar 21;27(1):94. doi: 10.1186/s13054-023-04368-y. PMID: 36941668; PMCID: PMC10027589..
- Calfee CS, Delucchi K, Parsons PE, Thompson BT, Ware LB, Matthay MA; NHLBI ARDS Network. Subphenotypes in acute respiratory distress syndrome: latent class analysis of data from two randomised controlled trials. Lancet Respir Med. 2014 Aug;2(8):611-20. doi: 10.1016/S2213-2600(14)70097-9. Epub 2014 May 19. PMID: 24853585; PMCID: PMC4154544.
- Famous KR, Delucchi K, Ware LB, Kangelaris KN, Liu KD, Thompson BT, Calfee CS; ARDS Network. Acute Respiratory Distress Syndrome Subphenotypes Respond Differently to Randomized Fluid Management Strategy. Am J Respir Crit Care Med. 2017 Feb 1;195(3):331-338. doi: 10.1164/rccm.201603-0645OC. Erratum in: Am J Respir Crit Care Med. 2018 Dec 15;198(12):1590. Erratum in: Am J Respir Crit Care Med. 2019 Sep 1;200(5):649. PMID: 27513822; PMCID: PMC5328179.
- Khan YA, Fan E, Ferguson ND, Precision Medicine and Heterogeneity of Treatment Effect in Therapies for Acute Respiratory Distress Syndrome, CHEST (2021), doi: https://doi.org/10.1016/j.chest.2021.07.009.
- Goligher EC, Kavanagh BP, Rubenfeld GD, & Ferguson ND (2014). Oxygenation response to positive end-expiratory pressure predicts mortality in acute respiratory distress syndrome. A secondary analysis of the LOVS and ExPress trials. Am J Respir Crit Care Med.190(1):70-6
- Meade, M. O., Cook, D. J., Guyatt, G. H., Slutsky, A. S., Arabi, Y. M., Cooper, D. J., ... & Lung Open Ventilation Study Investigators, F. T. (2008). Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. Jama, 299(6), 637-645.
- Mercat, A., Richard, J. C. M., Vielle, B., Jaber, S., Osman, D., Diehl, J. L., ... & Brochard, L. (2008). Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. Jama, 299(6), 646-655.
- Matthay MA, Arabi YM, Siegel ER, Ware LB, Bos LDJ, Sinha P, Beitler JR, Wick KD, Curley MAQ, Constantin JM, Levitt JE, Calfee CS. Phenotypes and personalized medicine in the acute respiratory distress syndrome. Intensive Care Med. 2020 Dec;46(12):2136-2152. doi: 10.1007/s00134-020-06296-9. Epub 2020 Nov 18. PMID: 33206201; PMCID: PMC7673253.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 12-03-2024
Beoordeeld op geldigheid : 05-03-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met ARDS.
Werkgroep
- Dr. H. Endeman, internist-intensivist, NVIC
- Dr. R.M. Determann, internist-intensivist, NIV
- Drs. R. Pauw, longarts-intensivist, NVALT
- Drs. M. Samuels, anesthesioloog-intensivist, NVA
- Dr. A.H. Jonkman, klinisch technoloog, NVvTG
- J.W.M. Snoep, ventilation practitioner/IC-verpleegkundige, V&VN
- Drs. M.A.E.A. Brackel, patiëntvertegenwoordiger (tot 1-1-2022 bestuurslid FCIC/Voorzitter IC Connect), FCIC/IC Connect
Meelezers:
- Drs. F.Z. Ramjankhan, Cardio-thoracaal chirurg, NVT
- Dr. R.R.M. Vogels, Radioloog, NVvR
- Drs. R. ter Wee, Klinisch fysicus, NVKF
Met ondersteuning van:
- Drs. I. van Dusseldorp, literatuurspecialist, Kennisinsitituut van de Federatie van Medisch Specialisten
- Dr. S.N. Hofstede, senior-adviseur, Kennisinsitituut van de Federatie van Medisch Specialisten
- Dr. J.C. Maas, adviseur, Kennisinsitituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Endeman |
Internist-intensivist, opleider Intensive Care, Erasmus MC, Rotterdam |
Secretaris GIC, lid sectie IC NIV aanpassing juli 2022:
|
Travelgrant/speakers fee voor IC-symposium Kenya augustus 2018 door GETINGE
Advanced mechanical ventilation is een speerpunt van wetenschappelijk onderzoek van de Intensive Care van het Erasmus MC aanpassing juli 2022: gesponsord door Ventinova. Dat is een beademingsmachine. Open Lung Concept 2.0: Flow Controlled Ventilation |
Bij modules die specifiek gaan over apparatuur ontwikkeld door GETINGE: Wanneer dit onderwerp geprioriteerd wordt zal een vice-voorzitter worden aangewezen en werkgroeplid niet meebeslissen over dit onderwerp |
|
Pauw |
Intensivist longarts Martini Ziekenhuis Groningen |
Secretaris sectie IC NVALT (onbetaald), instructeur FCCS-cursus NVIC (vergoeding per gegeven cursus, gemiddeld 1-2x/jaar) |
Maart 2023: Spreker congres pulmonologie vogelvlucht: pulmonary year in review m.b.t. IC-onderwerpen |
Geen |
|
Jonkman |
* Technisch geneeskundige (klinisch technoloog), PhD kandidaat en research manager, afdeling Intensive Care Volwassenen, Amsterdam UMC, locatie Vumc (t/m 2021) * Research fellow dept. Critical Care Medicine, St. Michael’s Hospital, University of Toronto, Canada (gedetacheerd vanuit VUmc voor periode jan-dec 2020)
aanpassing juli 2022: |
Bestuurslid Nederlandse Vereniging voor Technische Geneeskunde (NVvTG), vice-voorzitter t/m mei 2021 |
Adviesfunctie (consultancy) bij Liberate Medical LLC (Kentucky, USA), een medical device company dat een niet-invasieve elektrische spierstimulator ontwikkelt voor het trainen van de expiratiespieren (buikspieren) tijdens kunstmatige beademing. Betaald consultancy werk, ongeveer 1-2 dagdelen per jaar (2018 -2020)
Deelname aan diverse nationale en internationale investigator-initiated wetenschappelijke onderzoeken naar gepersonaliseerde kunstmatige beademing middels advanced respiratory monitoring (o.a. ademspierfunctie en electrische impedantie tomografie) bij de IC-patiënt. Deels in het kader van voormalig promotieonderzoek Waaronder: * lid stuurgroep CAVIARDS-trial (Careful Ventilation in (COVID-19-induced) Acute Respiratory Distress Syndrome, NCT03963622), internationale investigator-initiated studie naar gepersonaliseerde beademingsstrategie bij ARDS, geen persoonlijke financiële vergoeding |
Onderwerpen niet-invasieve elektrische spierstimulatie en gepersonaliseerde kunstmatige beademing middels advanced respiratory monitoring worden niet behandeld in de richtijn. Mochten deze toch worden toegevoegd, dan zal werkgroep lid niet als auteur van deze specifieke modules worden aangesteld. |
|
Samuels |
Anesthesioloog – Intensivist, te Franciscus Gasthuis & Vlietland
aanpassing Juli 2022: Anesthesioloog-lntensivist, te HMC |
* MICU intensivist – betaald * FCCS teacher – betaald * bestuurslid sectie IC NVA
aanpassing Juli 2022: Waarnemer als lntensivist op de IC (betaald) Voorzitter sectie IC, NVA (onbetaald) |
Geen |
Geen |
|
De Graaff |
Intensivist – Internist, St Antonius ziekenhuis Nieuwegein, fulltime |
Bestuurslid Stichting NICE, vrijwilligerswerk |
Geen |
Geen |
|
Determann |
Intensivist OLVG |
Gastdocent Amstelacademie (betaald) |
Geen |
Geen |
|
Brackel-Welten |
* Voorzitter patiëntenorganisatie IC Connect, onbetaald, tot 1-1-2022 * Bestuurslid Stichting Family en patient centered Intensive Care (Stichting FCIC), onbetaald, tot 1-1-2022 * Jeugdarts KNMG, niet praktiserend * voormalig IC-patiënte |
Geen |
Voorzitterschap IC Connect, bestuurslid Stichting FCIC, tot 1-1-2022 |
Geen |
|
Snoep |
* Ventilation Practitioner 25% * IC-verpleegkundige 75%
aanpassing juli 2022: Leids Universitair Medisch Centrum
|
Hamilton Medicai expert panel Netherlands, sinds 2022. Onbetaald |
Geen |
Geen |
|
Ramjankhan |
Cardio-thoracaal chirurg UMCU |
Geen |
Geen |
Geen |
|
Ter Wee |
Klinisch Fysicus in opleiding - Medisch Spectrum Twente |
Geen |
Geen |
Geen |
|
Vogels |
*Radioloog met aandachtsgebied thoracale en abdominale radiologie * Fellow Thoraxradiologie
Maatschap Radiologie Oost Nederland (MRON) locatie MST Enschede
Toevoeging juli 2022: Radioloog met als aandachtsgebied thoracale en abdominale readiologie als maatschapslid bij MRON licatie ZGT Almelo/Hengelo |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland, Stichting FCIC, IC Connect en het Longfonds voor deelname aan de schriftelijke knelpunteninventarisatie en deelname van een afgevaardigde van Stichting FCIC en IC Connect in de werkgroep. De resultaten van de schriftelijke knelpunteninventarsiatie zijn besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Stichting FCIC, IC Connect en het Longfonds. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Diagnostiek van ARDS |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven.
|
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met ARDS. Tevens zijn IGJ, NFU, NHG, NVZ, Patiëntenfederatie Nederland, STZ, V&VN, NVIC, NVA, NIV, NVALT, NVvTG, NVVC, NVN, NVKF, Longfonds, FCIC/IC Connect en ventilation practitioners uitgenodigd om knelpunten aan te dragen via een enquête. Een overzicht hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties uit de werkgroep voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Grasselli G, Calfee CS, Camporota L, Poole D, Amato MBP, Antonelli M, Arabi YM, Baroncelli F, Beitler JR, Bellani G, Bellingan G, Blackwood B, Bos LDJ, Brochard L, Brodie D, Burns KEA, Combes A, D'Arrigo S, De Backer D, Demoule A, Einav S, Fan E, Ferguson ND, Frat JP, Gattinoni L, Guérin C, Herridge MS, Hodgson C, Hough CL, Jaber S, Juffermans NP, Karagiannidis C, Kesecioglu J, Kwizera A, Laffey JG, Mancebo J, Matthay MA, McAuley DF, Mercat A, Meyer NJ, Moss M, Munshi L, Myatra SN, Ng Gong M, Papazian L, Patel BK, Pellegrini M, Perner A, Pesenti A, Piquilloud L, Qiu H, Ranieri MV, Riviello E, Slutsky AS, Stapleton RD, Summers C, Thompson TB, Valente Barbas CS, Villar J, Ware LB, Weiss B, Zampieri FG, Azoulay E, Cecconi M; European Society of Intensive Care Medicine Taskforce on ARDS. ESICM guidelines on acute respiratory distress syndrome: definition, phenotyping and respiratory support strategies. Intensive Care Med. 2023 Jul;49(7):727-759. doi: 10.1007/s00134-023-07050-7. Epub 2023 Jun 16. PMID: 37326646; PMCID: PMC10354163.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.