C4 Herpes genitalis
C4.1 Algemeen
Genitale herpes is de meest voorkomende ulceratieve soa in de westerse wereld (Looker, 2015a; Looker, 2015b). Herpes genitalis en andere vormen van herpessimplexvirusinfectie worden in klassieke gevallen gekenmerkt door typische in groepjes gelegen blaasjes die soms overgaan in pijnlijke erosies, soms met korstvorming en/of pussig beslag. Het virus blijft latent aanwezig (zonder laesies) en kan vooral lokaal frequent recidieven vertonen.
C4.2 Ziekte
C4.2.1 Verwekker
Herpessimplexvirussen zijn dubbelstrengs DNA-virussen behorend tot de familie van de herpesvirussen. Er zijn meer dan 100 herpesvirussen, waarvan er minimaal 9 bij de mens kunnen voorkomen. De officiële benaming van herpesvirussen die infecties veroorzaken bij de mens is humaan herpesvirus (HHV), waarbij elk type een nummer heeft gekregen.
Bekende ziektebeelden zijn:
- herpes labialis (koortslip) door herpessimplexvirus type 1 (HSV-1, officieel HHV-1);
- herpes genitalis door zowel HSV-1 als HSV-2 (HHV-2);
- waterpokken en gordelroos door het varicellazostervirus (VZV, HHV-3);
- mononucleosis infectiosa door het epstein-barrvirus (EBV, HHV-4);
- cytomegalovirus (CMV, HHV-5);
- zesde ziekte (exanthema subitum, roseola infantum) (HHV-6 en -7);
- Kaposisarcoom (HHV-8).
De herpessimplexvirussen type 1 en type 2 zijn nauw aan elkaar verwant en vertonen dezelfde genoomstructuur (Pellet, 2013).
C4.2.2 Pathogenese
De pathogenese van genitale herpes, die door zowel HSV-1 als HSV-2 wordt veroorzaakt, verschilt niet van die van herpes labialis, die vooral wordt veroorzaakt door HSV-1. HSV dringt de slijmvliezen binnen van de orofarynx, genitaliën of conjunctiva en verspreidt zich van hieruit langs de perifere zenuwen naar de sensibele of autonome ganglia waar het virus latent verblijft. Tijdens een primaire infectie of primo-infectie met HSV wordt humorale en cellulaire afweer opgebouwd. Echter, dit voorkomt reactivatie niet, doordat het virus zich verspreidt via zenuwcellen die slecht toegankelijk zijn voor het immuunsysteem. Van hieruit vindt periodiek en kortdurend (sub)klinische of (a)symptomatische reactivatie plaats met virusuitscheiding langs de zenuw naar de huid of slijmvliezen in het verzorgingsgebied (Mark, 2008). Reactivatie van latent virus kan door verschillende stimuli worden veroorzaakt, zoals uv-licht, stress, menstruatie, koorts en immuunsuppressie. HSV-infecties kunnen worden onderverdeeld in eerste-episode-infecties (te onderscheiden in primaire en niet-primaire infecties) en recidieven (reactivaties) (Drake, 2000). Men spreekt van een primaire of primo-infectie wanneer er sprake is van een HSV-1 of -2-infectie bij een HSV (zowel -1 als -2)-seronegatieve patiënt. Is er in het verleden wel een labiale HSV-1 of -2-infectie geweest, dan spreekt men van een eerste-episode-herpes genitalis.
C4.2.3 Incubatieperiode
De incubatieperiode duurt 2 tot 12 dagen.
C4.2.4 Ziekteverschijnselen
De aard en ernst van de ziekteverschijnselen worden bepaald door het type HSV, gastheerspecifieke factoren zoals lokalisatie, vroegere niet-genitale HSV-infectie, geslacht, immuunstatus van de persoon en of er sprake is van een primo-infectie (meestal heftiger verloop) of een recidief. Er is geen verschil in ziekteverschijnselen tussen herpes genitalis door HSV-1 en HSV-2 (Holmes, 2008).
Volgens de literatuur is slechts 37% van de nieuwe (primo-) HSV-2-infecties symptomatisch; voor HSV-1 ligt dit rond 67%. De rest van de infecties, en dus de meerderheid van de genitale herpesinfecties, verloopt asymptomatisch of wordt niet als zodanig herkend. Bij mannen zijn de infecties vaker asymptomatisch dan bij vrouwen (Drake, 2000; Langenberg, 1999). Bij een symptomatische primo-infectie heeft 40% van de mannen en 70% van de vrouwen een prodromale fase, bestaande uit koorts, malaise en spierpijn (Holmes, 2008). Hierna volgen bij vrouwen klachten als pijn, jeuk, dysurie, vaginale afscheiding en regionale lymfadenopathie. Bij mannen komen ook urethritisklachten voor en kan de mictie zodanig pijnlijk verlopen dat urineretentie optreedt. Zes tot 7 dagen na de eerste symptomen volgen de huid- en slijmvliesafwijkingen met soms ontwikkeling van de karakteristieke, met helder vocht gevulde blaasjes. De laesies duren bij een primo-infectie 7-28 dagen en genezen zonder littekens. Men dient rekening te houden met atypische laesies, die zich presenteren als fissuren, furunkels, plaatselijke erytheem, lineaire ulceraties of excoriaties. Verder kan een herpetische proctitis ontstaan, met anorectale pijn, obstipatie en ulcererende herpetiforme laesies.
Bij mannen zijn de laesies voornamelijk gelegen op de schacht van de penis (met uitzondering van de anorectale herpes). Bij vrouwen zijn de laesies verspreid over de hele vulva en het perineum (Wald, 2001). Minder bekend is dat bij vrouwen ook de cervix uteri vaak betrokken is bij een primo-infectie. Dit kan zeer pijnlijk zijn, waardoor een onderzoek van de cervix in speculo niet goed mogelijk is en de diagnose gemist wordt.
HSV is in een veel uitgebreider gebied aantoonbaar dan alleen het gebied van de zichtbare laesies (Tata, 2010). De frequentie van de recidieven wisselt sterk, afhankelijk van het virustype en de lokalisatie. Het gemiddelde aantal recidieven is na een eerste episode zeer variabel met een mediaan van 4 per jaar voor HSV-2 en 1 per jaar voor HSV-1 (Laferty, 1987; Benedetti, 1994; Engelberg, 2003). Bij de meeste patiënten is er een afname in de tijd en in ernst, maar ook dit patroon is zeer variabel (Benedetti, 1999). Bij HSV-2 neemt het aantal recidieven af na het eerste jaar, maar blijft daarna vrij constant gedurende jaren (Phipps, 2011).
Complicaties van een genitale herpesinfectie treden vrijwel alleen op bij een primaire infectie met HSV-1 of HSV-2. Een voorbeeld is aseptische meningitis (nekstijfheid, hoofdpijn en fotofobie), die vaker bij HSV-2 dan bij HSV-1 voorkomt. Ook kan autonome disfunctie of myelitis transversa optreden. Symptomen van de autonome disfunctie kunnen zijn: hyperesthesie of anesthesie in de lumbale of sacrale regio en urineretentie (het syndroom van Elsberg) of obstipatie.
Zwangeren
Primaire infecties bij zwangeren kunnen asymptomatisch verlopen. Twee derde van de zwangeren, seropositief voor HSV-2, bleek geen ulceraties gehad te hebben (Westhoff, 2011).
Patiënten met constitutioneel eczeem
Zie de LCI-richtlijn Herpessimplexvirusinfecties.
Neonaten
HSV-1- en HSV-2-infecties kunnen bij neonaten milde tot zeer ernstige symptomen geven. Er zijn drie klinische verschijningsvormen van neonatale herpes te onderscheiden (James, 2015; Forsgren, 2009).
- De infectie blijft beperkt tot de huid en de slijmvliezen van ogen en/of mond (in de Engelstalige literatuur Skin Eye Mouth (SEM) disease genoemd). De gemiddelde incubatieduur is dan 7-12 dagen. Een lokale infectie heeft een veel betere prognose, maar kan gepaard gaan met oogschade, waaronder herpes keratitis. Neurologische schade, waaronder retinanecrose, kan later aan het licht komen (5-10%).
- Een infectie van het centraal zenuwstelsel met of zonder betrokkenheid van de huid/slijmvliezen. De gemiddelde incubatieduur is 2-6 weken. Bij alleen symptomen van een infectie van het centraal zenuwstelsel is de mortaliteit >50%; met aciclovir zakt dit naar 4% (Scott, 2015). De kans op neurocognitieve schade is groot; slechts eenderde van de kinderen met centraal zenuwstelsel-betrokkenheid heeft een normale ontwikkeling. HSV-2-infectie heeft een slechtere prognose dan HSV-1-infectie (Scott, 2015).
- Een gegeneraliseerde infectie waarbij zowel huid, slijmvliezen, lever, bijnieren, longen als centraal zenuwstelsel aangetast zijn. De incubatieduur is 4-11 dagen. De symptomen bij deze vorm zijn meestal algemene verschijnselen als koorts, sufheid, slecht drinken, braken en ademhalingsproblemen. In een later stadium kunnen verschijnselen optreden van acidose, shock, anemie, pneumonie, convulsies, hepatomegalie, encefalitis en meningitis. Bij een gegeneraliseerde infectie is de sterfte zonder antivirale therapie hoog (>80%) met fulminant leverfalen of multiorgaanfalen en bestaat er een grote kans op restverschijnselen. Met aciclovir zakt de kans op overlijden naar 29%, maar ook hier is de kans op neurocognitieve schade groot (Scott, 2015).
Slechts in ongeveer 50% van de gevallen van neonatale herpes zijn blaasjes aanwezig, zodat de diagnose vaak moeilijk te stellen is. Herkennen van de symptomen en snelle start van behandeling zijn van belang voor een goede uitkomst (Forsgren, 2009).
Kinderen en adolescenten
Bij oudere kinderen en adolescenten verloopt een infectie met HSV veelal asymptomatisch. Bij genitale herpes verloopt de infectie vergelijkbaar als bij volwassenen.
C4.2.5 Immuniteit
Na een primaire infectie ontstaan antistoffen die wel beschermen tegen een herinfectie, maar recidieven niet kunnen voorkomen. De IgG-antistoffen en specifieke geheugen-T-cellen worden transplacentair overgedragen (verticale transmissie). Het is echter onbekend welke mate van bescherming deze bieden voor het kind. Bovendien is het zo dat HSV-1 en -2 kruisreagerende antistoffen induceren, die gedeeltelijke kruisbescherming bieden en die de ernst van een eerste-ziekte-episode verminderen, maar geen invloed hebben op het aantal recidieven.
C4.3 Transmissie
C4.3.1 Reservoir
De mens. Er is geen tussengastheer.
C4.3.2 Transmissieroute
Genitale herpes ontstaat via seksueel contact: genitogenitaal, anogenitaal of orogenitaal. Dit laatste verklaart hoe HSV-1 genitale herpes kan veroorzaken en HSV-2 labiale herpes.
Verticale transmissie kan op de volgende manieren geschieden: prenataal (5% is transplacentair), durante partu (75-95% is ascenderend bij langdurig gebroken vliezen of tijdens de partus) of postnataal (Kimberlin, 2005).
Ook kan neonatale herpes ontstaan via besmetting door iemand anders met een labiale herpesinfectie, bijvoorbeeld door knuffelen of zoenen van het kind (‘kiss of death’).
Infectie van de handen van medisch of verpleegkundig personeel door contact met een HSV-drager, kan leiden tot fijt (bindweefselontsteking aan de binnenkant van een vingertop), ook wel ‘herpetic whitlow’ genoemd.
C4.3.3 Infectieuze periode
De infectieuze periode is niet goed vast te stellen. Bij aanwezigheid van laesies is tot 10 dagen na ontstaan nog HSV aantoonbaar. Ook zonder aanwezigheid van laesies kunnen patiënten echter nog besmettelijk zijn door asymptomatische uitscheiding.
C4.3.4 Overdraagbaarheid
De overdraagbaarheid is het hoogst vlak voor, tijdens en vlak na de symptomatische periode. Bij vaginale coïtus is de transmissiekans hoger van mannen naar vrouwen dan andersom. De transmissiekans is hoger bij frequenter seks zonder condoom of andere preventiemiddelen.
Bij monogame serodiscordante paren (waarvan bekend was dat er 1 partner HSV-seropositief was), varieerde de transmissiekans van 12-30% per jaar (Drake, 2000).
Bij symptomatische patiënten is bij 70% HSV-2 aantoonbaar; bij asymptomatische patiënten is dat 13%. Dat betekent dat dus ook bij asymptomatische patiënten virusuitscheiding plaats kan vinden. Asymptomatische uitscheiding neemt sterk af in het eerste jaar na een genitale HSV-1-infectie (Johnston, 2022). HSV wordt periodiek in episoden uitgescheiden, HSV-virusdetectie is mogelijk gedurende een periode van maximaal 9 dagen bij patiënten met laesies en maximaal 4 dagen bij patiënten zonder frequente laesies (Corey, 2004; Tronstein, 2011). De uitscheiding van HSV-2 wordt gekenmerkt door een snelle toe- en ook weer afname van virale load waarbij er een extreme variatie is in hoogte van virale load en de duur van verschillende episoden. Het netto-effect is zeer frequente perioden van uitscheiding met hoge virale loads (Schiffer, 2011). De meerderheid van de besmettingen blijkt via asymptomatische dragers te gebeuren.
Het herpessimplexvirus wordt snel geïnactiveerd bij kamertemperatuur en in droge omstandigheden. Aerogene besmetting vindt dan ook niet plaats. Borstvoeding is mogelijk indien er geen laesies zijn in dermatomen van het borstgebied (thoracaal 2 t/m 6) en actieve laesies elders zijn afgeplakt/gedekt (mondmasker) en goede handhygiëne wordt betracht.
C4.4 Diagnostiek
C4.4.1 Klinische diagnostiek
Met behulp van een goede (seksuele) anamnese en het klinische beeld kan bij een typisch verlopende herpesgenitalisinfectie een klinische diagnose gesteld worden. Het onderscheid tussen een primo/eerste-episode-infectie, of een heftig recidief is niet goed mogelijk omdat ook patiënten die een asymptomatische primo/eerste-episode-infectie hebben doorgemaakt zich kunnen presenteren met een (ernstig) recidief. Differentiaaldiagnostisch komen vooral de andere ulceratieve soa’s in aanmerking (Holmes, 2008; Langenberg, 1999).
De blaasjes doorlopen verschillende stadia. Een blaasje kan spontaan opengaan of door krabben, en zo het aspect van een ulcus aannemen. Als de blaasinhoud daarna opdroogt, treedt het crusteuze stadium in, waarin weinig tot geen infectieus virus meer wordt uitgescheiden. Daarna geneest de laesie doorgaans restloos. De totale duur kan variëren van 3 tot 7 dagen, maar bij een primo-infectie kan dit langer zijn (7-28 dagen).
Bij het opnemen van de anamnese zal men zeker vragen of de patiënt deze (vroege) symptomen herkent van een eerdere gelegenheid.
C4.4.2 Microbiologische diagnostiek
De eerste keus voor het aantonen van het virus is de nucleïnezuuramplificatietest (NAAT). Met een swab kan langs de basis van de laesie of het vocht van een blaasje worden gegaan. Deze techniek wordt aanbevolen als diagnosticum bij genitale herpes. NAAT is tevens betrouwbaar voor het onderzoek van liquor bij verdenking op HSV-meningitis (Patel, 2017). Hierbij bestaat de mogelijkheid in sommige laboratoria om een onderscheid te maken tussen type 1- en type 2-herpesvirus. Bij afwezigheid van laesies sluit een negatieve NAAT een HSV-infectie niet uit, aangezien het virus zich intermitterend verspreidt. Bij een orgaan- of gegeneraliseerde herpesinfectie zoals hepatitis is een HSV-viraleloadbepaling in bloed aangewezen.
De viruskweek, voorheen beschouwd als de gouden standaard, is minder sensitief dan nucleïnezuurtechnieken en meer afhankelijk van transportomstandigheden en stadium van de laesie. Viruskweek wordt daarom in de routine achterwege gelaten (Wald, 2003). Bij patiënten met afweerstoornissen of ernstige therapieresistente recidieven kan het van belang zijn om resistentiebepalingen uit te voeren op geïsoleerde stammen die via de conventionele celkweken zijn verkregen of met sequentietechnieken op de geïsoleerde virale nucleïnezuren (Pinninti, 2012; Van der Beek, 2012).
Bij vermoeden van intraoculaire herpesinfecties wordt door de oogarts materiaal uit het oog afgenomen middels een voorsteoogkamerpunctie of vitrectomie. Het materiaal wordt serologisch onderzocht op lokale productie van antistoffen door berekenen van een Goldmann Witmer-coëfficiënt. Er is sprake van een lokale productie van antistoffen als deze coëfficiënt groter is dan 3. Tevens wordt door middel van NAAT de aanwezigheid van DNA van HSV-1 of -2 bepaald.
Serologie
Het bepalen van HSV-typespecifieke antistoffen kent in de dagelijkse praktijk weinig toepassing. De serologie kan van nut zijn in sero-epidemiologische studies en indien men wil vaststellen of de klinische verschijnselen berusten op een primaire infectie of op een recidief. Met de huidige tests zijn bij een primaire infectie op het moment van de eerste klinische verschijnselen nog geen typespecifieke antistoffen aantoonbaar (soms pas >12 weken). Dit maakt dat ook bij de eerste recidieven serologie nog negatief kan zijn. Soms treedt er zelfs seroreversie (weer negatief worden) op, een probleem dat vooral bij zwangeren zou spelen (Arvaja, 1999; Eskild, 2000; Van Rooijen, 2016). Serologische analyses maken op basis van het typespecifieke glycoproteïne G (gG) onderscheid tussen HSV-1 (glycoproteïne G1) en HSV-2 (glycoproteïne G2). De sensitiviteit van deze glycoproteïne G-typespecifieke testen voor de detectie van HSV-antilichamen varieert tussen de 80% en 90% voor HSV-2 en tussen de 69 en 98% voor HSV-1. Foutnegatieve resultaten treden sneller op in het vroege stadium van de infectie. De specificiteit is 93-97% voor HSV-2 en 92-95% voor HSV-1 (Ashley-Morrow, 2004; Mark, 2007; Morrow, 2003; Summerton, 2007). Ondanks een redelijke specificiteit is bij lage prevalentie (geldt met name voor HSV-2) de positiefvoorspellende waarde laag. De aanwezigheid van HSV-2-typespecifieke antilichamen impliceert een anogenitale infectie. Bij gebrek aan symptomen kan een HSV-1-positieve uitslag geen onderscheid maken in anogenitale, orolabiale of een cutane infectie. Men dient rekening te houden dat zelfs testen met goede sensitiviteit en specificiteit matige positiefvoorspellende waarden hebben bij lage prevalenties.
De typespecifieke HSV-serologische testen kunnen zinvol zijn bij:
- een patiënt die niet bekend is met genitale herpes maar diens partner(s) wel;
- zwangeren indien er tijdens de zwangerschap of baring een verdenking is op (een) primo-infectie met herpes genitalis; vergelijk met serum van in het begin van de zwangerschap indien voorhanden;
- recidiverende genitale laesies zonder bekende oorzaak op moment dat deze niet zichtbaar zijn.
Diagnostiek bij neonatale herpes
Onderzoek van: EDTA-bloed, urine, nasofaryngeale uitstrijk, conjunctiva, huidblaasjes (indien aanwezig), en liquor cerebrospinalis voor HSV-NAAT. In geval van SEM wordt maar in 24% van de gevallen HSV-DNA gevonden in de liquor cerebrospinalis (na 48 uur, kolonisatie van de baby door de moeder in het geboortekanaal is dan niet meer te detecteren). Bij symptomen van centraal-zenuwstelselbetrokkenheid is dat in 76-78% van de gevallen, vooral in de vroege fase van de ziekte. Soms levert een herhaald liquoronderzoek alsnog een positieve NAAT op (Pinnitti, 2018). In combinatie met bloedonderzoek stijgt dit naar 90% (Kimberlin, 2007; Malm, 1999). Bij een verdenking op neonatale herpes dient een oogarts te worden betrokken om onder meer middels fundoscopie en onderzoek van oogvocht retinanecrose uit te sluiten.
Follow-up van de virale load in serum en in liquor geeft informatie over de effectiviteit van de behandeling en de prognose (Kimura, 2002). Serologisch onderzoek bij moeder en kind is niet van grote waarde in de acute fase.
Retrospectief kan 12-18 maanden na de geboorte onderzoek worden gedaan naar HSV-2-specifieke antilichamen. Dan zijn de maternale antilichamen niet langer aanwezig. HSV-1-besmetting kan ook postnataal of op vroege kinderleeftijd zijn opgetreden. HSV-1-antilichamen zijn om die reden minder informatief om een neonatale infectie op te sporen (Forsgren, 2009).
C4.5 Sleutelpopulatie
C4.5.1 Verhoogde kans op infectie
Zoals bij alle soa’s is de kans dat iemand wordt besmet afhankelijk van het aantal seksuele partners en de aard van seksuele activiteiten. Factoren die de kans op HSV-1-seropositiviteit vergroten zijn: vrouw, hogere leeftijd, migratieachtergrond en lager-gemiddeld educatieniveau. Factoren die de kans vergroten op HSV-2 zijn gelijk aan de factoren bij HSV-1 behalve dat HSV-2 vaker wordt gezien bij hogere educatieniveaus (Woestenberg, 2016). Inmiddels is goed gedocumenteerd in meerdere studies dat het hebben van genitale ulcera zoals bij herpes genitalis de transmissie van hiv bevordert. Genitale ulcera maken de patiënt ontvankelijker voor een hiv-infectie. Enkele studies laten zien dat patiënten met hiv met genitale ulcera een verhoogde uitscheiding van hiv laten zien, waarschijnlijk door synergistische mechanismen (Nagot, 2007; Gray, 2004; Schacker, 2002; Celum, 2005).
C4.5.2 Verhoogde kans op ernstig beloop
Zwangeren
Voor de zwangere vrouw verloopt de ziekte zelden ernstiger dan bij niet-zwangeren. Wel is het mogelijk dat het aantal recidieven hoger ligt bij zwangeren (Holmes, 2008). Factoren die de kans op genitale herpes tijdens de zwangerschap verhogen, zijn niet-westerse etniciteit en een leeftijd <20 jaar (van Oeffelen, 2018).
Neonaten
Neonatale herpes omvat prenataal, durante partu en postnataal verworven HSV-infecties (in twee derde van de gevallen veroorzaakt door HSV-1). Besmetting van het kind durante partu, door direct contact van het kind met vaginaal secreet of ascenderend bij langdurig gebroken vliezen, is de meest gebruikelijke transmissieroute (90% van de gevallen). Het ontbreken van passief via de moeder overgedragen antistoffen is waarschijnlijk een belangrijke factor voor een ernstig beloop van de infectie. Het betreft meestal een vlak voor de partus opgelopen eerste-episode-infectie bij de moeder, waardoor de moeder nog geen beschermende antistoffen kan doorgeven aan het kind. Een primaire infectie geeft een 10 tot 30 keer grotere kans op transmissie in vergelijking met een recidiverende infectie van de moeder.
Een prenataal verworven infectie komt zeer zelden voor en betreft casuïstiek van mogelijke transplacentaire besmetting bij ogenschijnlijk intacte vliezen. Daarnaast kan in zeldzame gevallen ook postnataal verworven HSV via de handen of mond van verzorgers tot ernstige infecties leiden bij neonaten (tot de leeftijd van ongeveer 1 maand). Neonatale ziekteverschijnselen bij transmissie durante partu beginnen ongeveer 5 dagen na de geboorte.
Immuno-incompetente personen
Personen met een gestoorde cellulaire immuniteit hebben vaker HSV-reactivaties en een hogere kans op een ernstiger beloop. De meeste studies rapporteren over personen met hiv met <200 CD4 cellen/ul, patiënten met maligniteiten en (hematopoëtische-stamcel)transplantatiepatiënten. Bij hen verlopen lokale (orale en genitale, primo en recidief) infecties vaak ernstiger. Ook kan een gedissemineerde infectie (betrokkenheid van diverse orgaansystemen waaronder pneumonie, colitis, oesophagitis, meningo-encefalitis, retinanecrose) met een hoge mortaliteit ontstaan (Quinnan, 1984; Bagdades 1992; Severson 1999).
C4.6 Epidemiologie
C4.6.1 Verspreiding in de wereld
Herpes genitalis komt overal in de wereld voor en is de belangrijkste ulceratieve soa in de westerse wereld met een geschatte prevalentie van 417 miljoen HSV-2-geïnfecteerden wereldwijd (WHO, 2016). In Groot-Brittannië is de incidentie (primo-infectie) in 5 jaar tijd met 15% toegenomen (in 1995 16.479 en in 2004 19.180 gerapporteerde gevallen). In de Verenigde Staten hebben naar schatting 40-60 miljoen mensen de infectie met een incidentie van 12 miljoen infecties en 600.000-800.000 klinische casussen per jaar. De prevalentie van genitale herpes in ontwikkelingslanden varieert van 2% tot 74% (Sen, 2007).
C4.6.2 Voorkomen in Nederland
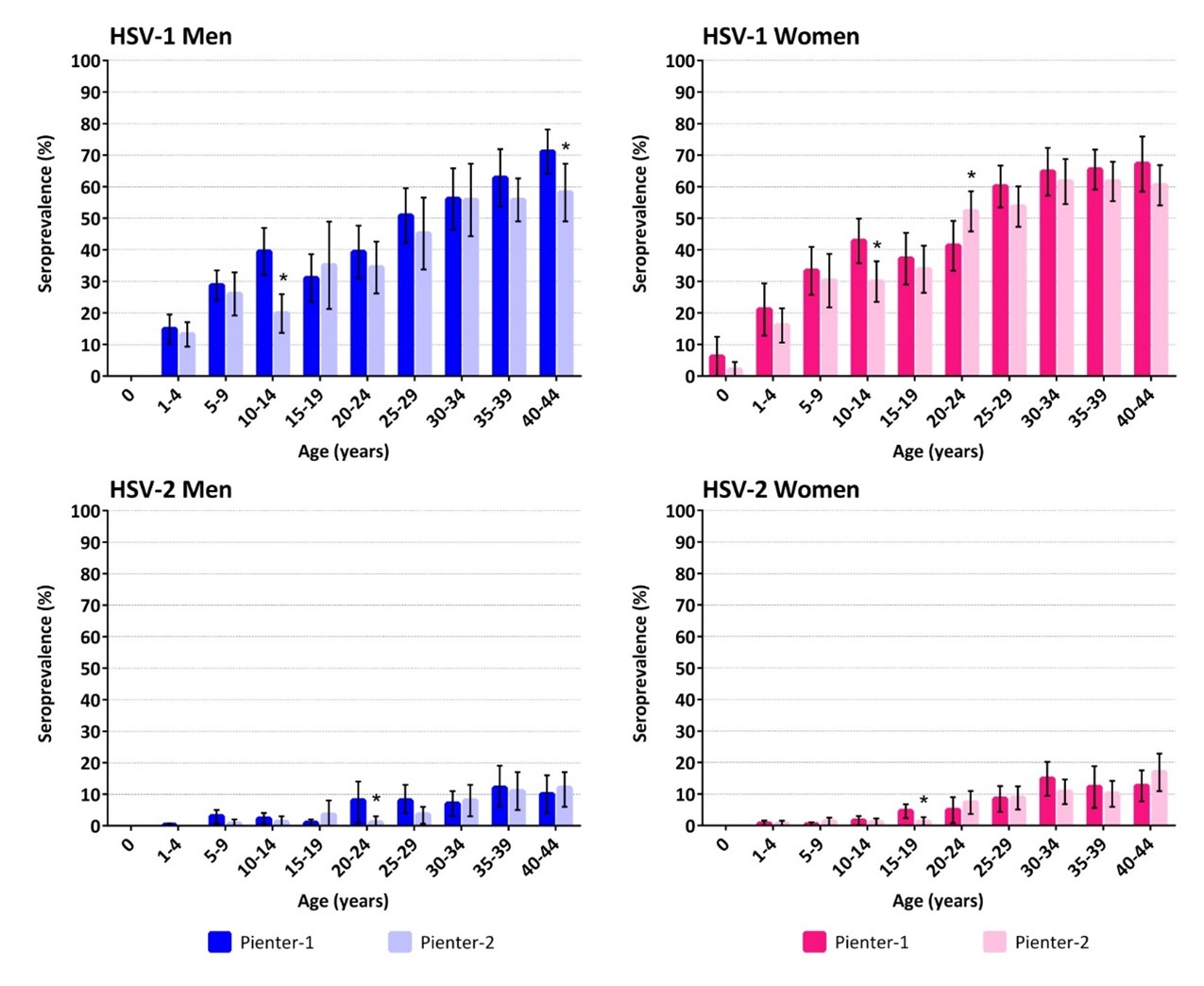
In 2021 was het aantal diagnoses van genitale herpes bij de Centra voor Seksuele Gezondheid (CSG’s) 540 (van Wees, 2022). CSG’s verrichten geen routinematig onderzoek naar genitale herpes. Genitale herpes wordt voornamelijk gediagnosticeerd bij de huisarts. In 2020 waren er naar schatting 29.300 diagnoses van genitale herpes (28.800 in 2019). In 2020 was het aantal meldingen van genitale herpesdiagnoses bij huisartsen 1,7 per 1.000 individuen. Dit was 2,5 per 1.000 voor vrouwen en 0,9 per 1.000 voor mannen. Het meldingspercentage voor vrouwen en mannen is hoger in de populatie van 25 jaar en ouder dan voor de groep onder de 25 jaar. Bij mannen was dit verschil het meest significant. Het aandeel genitale HSV-1 is in de huisartsenpraktijk aanzienlijk hoger bij met name jongere leeftijd en bij vrouwen (gegevens Brabant Zuid-Oost 2002-2010). Oorzaken voor meer genitale HSV-1 zouden kunnen zijn: frequenter orogenitaal contact en minder ‘beschermende’ immuniteit door pas op latere leeftijd in contact komen met herpes labialis. De beschikbare prevalentie- en incidentiegegevens zijn echter niet betrouwbaar omdat diagnostiek niet routinematig wordt uitgevoerd. Vanwege een hoog percentage asymptomatische infecties is onderrapportage zeer waarschijnlijk. Seroprevalentie voor HSV-1 en HSV-2 in Nederland uitgevoerd op Pienter-1 (1995-6) en Pienter-2 (2006-7) sera was respectievelijk 47,7 en 6,8% (Pienter-1) en 42,7% en 6% (Pienter-2) (zie ook Figuur 6). Een significant lagere seroprevalentie voor HSV-1 werd waargenomen in Pienter-2 vergeleken met Pienter-1 in de leeftijd van 10-14 jaar. Dit maakt dat jongvolwassenen een grotere kans hebben op een genitale HSV-1-infectie (Woestenberg, 2016). In de periode 2012-2015 was de incidentie van neonatale herpes in Nederland 4,8-6,5 per 100.000 geboorten (van Oeffelen, 2018). Hemelaar et al. constateren een suboptimale adherentie aan richtlijnen bij ondervraagde gynaecologen en kinderartsen betreffende neonatale herpes (Hemelaar, 2015).
Figuur 6: Seroprevalentie van HSV-1 en HSV-2 met geslacht, leeftijd en Pienter-studie. *Verschil in seroprevalentie tussen Pienter-1 en Pienter-2 is statistisch significant (p<0,05) (Woestenberg, 2016).
C4.7 Preventie
C4.7.1 Immunisatie
Er is vooralsnog geen effectief vaccin tegen HSV-1 en HSV-2 beschikbaar (Holmes, 2008; Mindel, 1998).
C4.7.2 Algemene preventieve maatregelen
Voorlichting en persoonlijke hygiëne vormen de basis van de preventieve maatregelen.
Contact met laesies of geïnfecteerd (lichaams)materiaal moet men proberen te vermijden.
Het gebruik van condooms kan de transmissiekans van HSV verlagen, maar transmissie niet geheel voorkomen.
C4.7.3 Desinfectie
Conform de LCI-richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Personeel op de kraam- of kinderafdeling met herpes labialis kan doorwerken met inachtneming van bepaalde hygiënische maatregelen: niet met de handen aanraken van de laesies, frequent handen wassen en dragen van een mondmasker bij de verzorging van een baby totdat de laesies zijn ingedroogd (WIP, 2011).
Een moeder met herpes labialis kan op de afdeling verpleegd worden. Personeel wordt aangeraden de handen goed te wassen. Voorwerpen en kleding die met laesies in aanraking zijn geweest, dienen als besmet te worden beschouwd. Het kind kan gewoon bij de moeder verblijven onder voorwaarde dat ze haar baby niet kust, goed de handen wast en een mondmasker draagt bij de verzorging, totdat de laesies zijn ingedroogd. Daarnaast dienen eventuele herpetische laesies elders op het lichaam bedekt te worden. Borstvoeding is toegestaan mits er geen laesies zijn aan de tepel (WIP, 2010).
C4.8 Maatregelen
C4.8.1 Meldingsplicht
Voor herpesvirusinfecties geldt sinds december 2008 alleen meldingsplicht voor alle artsen aan de GGD als zij een voor hun praktijk ongewoon aantal gevallen van HSV-infecties vaststellen, als die een gevaar vormen voor de volksgezondheid (Wet Publieke Gezondheid, Hfdst V paragraaf 2, Artikel 21.3).
C4.8.2 Contactonderzoek en partnernotificatie
Zie hoofdstuk D3 voor partnernotificatie en partnerbehandeling. In paragraaf D3.7 zijn tevens per soa (Tabel 10) en per syndroom (Tabel 11) de volgende zaken samengevat: wie en periode van inlichten, overdraagbaarheid na behandeling, advies seksuele onthouding en management sekspartner(s).
Gezien de hoge seroprevalentie voor HSV-1 in de bevolking en het grote aantal asymptomatische HSV-2-dragers, heeft contactonderzoek weinig zin; ‘don’t hunt the virus’.
Het kan in vaste relaties wel zinvol zijn om de partner(s) in te lichten en eventueel te testen. Zijn beide partners positief voor hetzelfde type HSV (aangetoond door kweek of NAAT of door typespecifieke serologie), dan hoeven binnen de relatie verder geen preventieve maatregelen genomen te worden. Bij mensen met hiv kan het ook nuttig zijn de HSV-status van de partner(s) te weten, als de immuniteit nog laag is (Van der Meijden, 1999).
Vanwege de mogelijke psychosociale belasting met negatieve impact op seksuele gezondheid is goede en duidelijke informatie over het (asymptomatische) beloop van de infectie en kans op recidieven belangrijk.
C4.8.3 Maatregelen ten aanzien van patiënt en contacten
Voor sommige patiënten is het hebben van herpes en specifiek de wetenschap dat recidieven en transmissie levenslang mogelijk zijn, omgeven met schaamte en met negatieve gevolgen voor mentale en seksuele gezondheid. Door deze gevoelens te bespreken, kan de zorgverlener de ziektelast verminderen.
Effectieve preventie van herpes labialis en genitalis is bijzonder lastig, gezien de mogelijke levenslange overdraagbaarheid en het feit dat herpes vaak overgedragen wordt door asymptomatische dragers. Toch kunnen bepaalde maatregelen genomen worden om de transmissiekans te verlagen.
Preventie van herpes labialis
Contact met actieve laesies of geïnfecteerd (lichaams)materiaal (kussen op de mond) moet men zoveel mogelijk vermijden. Daarnaast is goede handhygiëne van belang.
Preventie van herpes genitalis
Preventie van herpes genitalis omvat patiëntinstructies en gebruik van condooms. Chronisch profylactische behandeling draagt mogelijk bij aan vermindering van overdracht van herpes. Counseling na de gestelde diagnose herpes genitalis bevat het bespreken van mogelijkheden en beperkingen bij preventie van transmissie. Er moet worden uitgelegd dat transmissie kan plaatsvinden in afwezigheid van laesies. Indien er sprake is van een prodromale fase of als er actieve laesies zijn, wordt seksueel contact ontraden, ook met condoom (CDC, 2021).
Hoewel HSV-transmissie met condoomgebruik (ook in de asymptomatische fase) niet uitgesloten is, wegens uitscheiden van het virus op onbedekte slijmvliezen, wordt consistent condoomgebruik, ook in de asymptomatische fase, geadviseerd. Vooral bij wisselende of losse sekspartners.
Een andere benadering van preventie is die van de chronisch suppressieve behandeling bij discordante paren. In de praktijk moeten de voordelen van chronisch suppressieve behandeling (reductie van HSV-2-transmissie van 3,6% naar 1,9% in 8 maanden; Corey, 2004) afgewogen worden tegen de nadelen (medicalisering, kans op resistentieontwikkeling). Een langdurige behandeling in een vaste discordante relatie lijkt niet reëel noch zinnig (expert opinion). De (onderliggende) redenen van zorgen moet besproken worden, voordat er behandeld wordt.
Preventie van neonatale herpes
Onderstaande adviezen zijn afgeleid van verschillende richtlijnen (Foley, 2014).
Zwangerschap/baring
Het wordt aanbevolen om zwangeren met een anogenitale primo-infectie te verwijzen naar een gynaecoloog.
Bij de zwangere dient, naast een nucleïnezuuramplificatietest (NAAT) van een verdachte laesie, typespecifiek serologisch onderzoek naar HSV (immunoglobuline G-antilichamen tegen HSV-1 en HSV-2) te worden verricht als er tijdens de zwangerschap of baring verdenking is van (een) primo-infectie met herpes genitalis. Vergelijk met serum van in het begin van de zwangerschap indien voorhanden. Wanneer dezelfde typespecifieke antilichamen gevonden worden als het HSV geïsoleerd in de NAAT is een primo-infectie niet waarschijnlijk en kan een sectio caesarea achterwege blijven.
Bij een (vermoedelijke) primaire anogenitale HSV-infectie in de laatste 6 weken van de zwangerschap wordt een sectio caesarea aanbevolen.
Bij verdenking op herpes recidivans of na een primo-infectie ontstaan vóór 34 weken amenorroeduur kan een vaginale baring plaatsvinden. Bij aanwezigheid van verdachte laesies is het advies de vliezen zo lang mogelijk te laten staan en wordt het gebruik van invasieve monitoring; schedelelektrode en microbloedonderzoek afgeraden.
Neonaat
Bij neonaten van zwangeren met (een) voor herpes genitalis verdachte laesie(s) durante partu dient materiaal voor HSV-onderzoek te worden afgenomen. Ook dient rekening gehouden te worden met serodiscordante koppels waarbij de vrouw seronegatief kan zijn voor HSV-1 en HSV-2, maar de partner(s) seropositief is/zijn voor HSV-1 en/of HSV-2 (transmissiekans man-vrouw 3,7%) (Kimberlin, 2005).
Het is van belang materiaal af te nemen van zowel conjunctivae als orofarynx, bij voorkeur 24-48 uur post partum. Bij algemene verschijnselen ook NAAT-onderzoek van serum of plasma uitvoeren.
Ten aanzien van een ieder met een (recidiverende) herpes labialis die tijdens de geboorte of in de neonatale periode intensief met het kind omgaat (ouders, familie, ziekenhuispersoneel, kraamverzorgende, verloskundige):
- Voorkom direct contact tussen de laesie(s) en het kind (bijvoorbeeld niet kussen).
- Was de handen goed voor de verzorging van het kind.
- Bedek de laesies bij de verzorging van het kind met een mondmasker totdat de laesies zijn ingedroogd.
C4.8.4 Profylaxe
Het geven van profylaxe aan partners of andere contacten van personen met labiale en/of genitale herpeslaesies heeft over het algemeen weinig zin. Voor profylaxe dan wel vroegtijdige behandeling van neonatale herpes, zie onder paragraaf C4.8.3. Voor profylaxe dan wel onderhoudsbehandeling van patiënten, zie paragraaf C4.9.
Wering van werk, school, kinderdagverblijf en consultatiebureau
Wering van personen met herpes labialis is vanuit volksgezondheidsperspectief niet zinvol. Wel wordt aangeraden extra hygiënemaatregelen te treffen bij verzorgend personeel met actieve herpes labialis en werkzaam met neonaten (tot de leeftijd van 1 maand) of immuno-incompetenten (Roizman, 2007; American Academy of Pediatrics, 2006). Maatregelen betreffen het dragen van een mondkapje bij verzorgende werkzaamheden en het in acht nemen van goede handhygiëne.
De Nederlandse Werkgroep Infectie Preventie (WIP) raadde aan om personeel dat werkzaam is in de directe patiëntenzorg met een (zeldzame) actieve herpetische laesie aan de vinger (fijt, ‘herpetic whitlow’) een werkverbod op te leggen (Daha, 1997). Hoewel er geen vergelijkende studies zijn verricht over transmissie bij fijt, wordt door sommige experts aangenomen dat het dragen van handschoenen mogelijk niet voldoende is om transmissie te voorkomen, en wordt verzorging van neonaten (en immuno-incompetenten) door personeel met fijt afgeraden (Roizman, 2007; American Academy of Pediatrics, 2006).
Aangezien oudere, immunocompetente kinderen in principe geen kans meer hebben op het ontwikkelen van een ernstige herpesinfectie, zijn maatregelen voor personeel werkend met oudere kinderen (leidsters kinderdagverblijf, etc.) niet nodig.
Er zijn geen aanwijzingen dat personeelsleden met een herpes genitalis een besmettingskans vormen voor de patiënt bij handhaving van normale hygiëne.
C4.9 Behandeling
De indicaties voor behandeling bij herpes genitalis zijn een primo-infectie en hinderlijke recidieven. Therapie met nucleosideanalogen (van aciclovir afgeleide middelen) onderdrukt de replicatie van het virus, maar heeft geen effect op het latent aanwezige virus, zodat na stoppen van de behandeling HSV-reactivatie kan optreden. Dit wil zeggen dat alleen de duur en de ernst van de klachten erdoor worden bekort en de virusuitscheiding wordt beperkt. Mogelijk wordt ook de transmissiekans verkleind. Er is kortom, buiten het verkorten van de duur van de klachten, nog veel onduidelijk over de zin van behandelen.
C4.9.1 Primaire behandeling
Aanbevolen behandeling van HSV bij niet-zwangere volwassenen
Het starten van therapie bij het vermoeden van een primo-infectie wordt doorgaans uitsluitend op de klinische presentatie gedaan (binnen 5 dagen na start van de symptomen), omdat diagnostiek in de praktijk niet snel mogelijk is. Primo-infecties geven meestal meer klachten dan recidieven en worden behandeld met orale toediening van (val)aciclovir of een analoog middel (Patel, 2017).
Het advies om primo-infecties met milde klachten al dan niet in alle gevallen te behandelen, kan niet goed worden onderbouwd. Onduidelijk is of behandeling van een primo-infectie de recidiefkans verlaagt. Tevens is in veel gevallen een als zodanig aangeduide primo-infectie in feite een recidief. Anderzijds ontwikkelt een herpesinfectie zich geleidelijk en kan het enige tijd duren voor kan worden vastgesteld of er sprake is van een ernstige infectie, waardoor in dat geval vertraging optreedt alvorens gestart wordt met een behandeling. Een eenduidig advies is niet te geven. De arts besluit samen met de patiënt of bij primo-infecties met milde klachten of een behandeling wordt gestart of dat het beloop wordt afgewacht. Er is geen plaats voor topicale behandeling met nucleosideanalogons zoals aciclovircrème vanwege gebrek aan bewijs omtrent de werkzaamheid.
Immuuncompetente volwassenen (Patel, 2017; Patel, 2015):
- valaciclovir 500 mg p.o., 2 dd gedurende 5 dagen; of:
- aciclovir 400 mg p.o., 3 dd gedurende 5 dagen; of:
- famciclovir 250 mg p.o., 3 dd gedurende 5 dagen.
Immuno-incompetente volwassenen:
- valaciclovir 1000 mg p.o., 2 dd gedurende 10 dagen of tot re-epithelialisatie van de laesies; of:
- aciclovir 800 mg p.o., 3 dd gedurende 10 dagen of tot re-epithelialisatie van de laesies, of:
- famciclovir 500 mg p.o., 3 dd gedurende 10 dagen of tot re-epithelialisatie van de laesies.
Behandeling van HSV bij zwangerschap
Voor preventie van neonatale herpes, zie onder paragraaf C4.8.3. Zwangeren met een, al dan niet primaire, herpes genitalis die veel klachten veroorzaakt, kunnen met aciclovir, valaciclovir en famciclovir behandeld worden, onafhankelijk van de duur van de zwangerschap. Er is wel een voorkeur voor aciclovir, omdat daar de meeste gegevens over zijn (Foley, 2014; Westhoff, 2011).
Factoren die de kans op transmissie van HSV naar neonaat vergroten (Pinninti, 2014):
- type maternale infectie: eerste periode met primaire infectie HSV-1;
- maternale HSV-antistoffenstatus;
- wijze van partus (vaginaal of sectio caesarea);
- duur gebroken vliezen;
- integriteit huidbarrière (gebruik schedelelektrode en ander instrumentarium);
- type HSV (HSV-1 en HSV-2).
Primaire anogenitale HSV-infectie in zwangerschap
Het wordt aanbevolen om zwangeren met een anogenitale primo-infectie te verwijzen naar een gynaecoloog.
Behandeling:
- aciclovir 400 mg p.o., 3 dd gedurende 5 dagen; of:
- valaciclovir 500 mg p.o., 2 dd gedurende 5 dagen.
Overweeg aanvullend gedurende de laatste 4 weken van de zwangerschap: aciclovir 400 mg p.o., 3 dd OF valaciclovir 500 mg p.o., 2 dd.
Partusbeleid:
- Sectio caesarea wordt geadviseerd bij een zwangere met een primaire anogenitale HSV-infectie die <6 weken tot de partus is. Indien patiënt geen sectio wil, overweeg dan aciclovir 5 mg/kg, 3 dd, i.v., intrapartum met daarna behandeling neonaat. Vermijd tevens invasieve procedures zoals schedelelectrodes, microbloedonderzoek, kunstverlossing en het vroegtijdig breken van de vliezen, om de trasmissiekans zo klein mogelijk te houden.
- Bij asymptomatische excretie dient bij zwangeren foetale monitoring middels schedelelektrode en kunstverlossing vermeden te worden (Westhoff, 2011).
Vroeg gebroken vliezen:
- Weinig evidence: besluit is afhankelijk van gestatieduur. Daarom multidisciplinair overleg noodzakelijk.
- Bij besluit tot geboorte blijft er het voordeel van een sectio. Bij een conservatief beleid is aciclovir 5 mg/kg, 3 dd, i.v., intrapartum met daarna behandeling neonaat aangewezen.
Recidiverende anogenitale HSV-infectie in zwangerschap
Onafhankelijk van amenorroeduur:
- in principe geen antivirale behandeling, alleen ondersteunend;
- overweeg in de laatste 4 weken van de zwangerschap suppressieve therapie met: aciclovir 400 mg p.o., 3 dd.
Vroeg gebroken vliezen, <34 weken amenorroeduur:
- zeer lage kans op verticale transmissie. Vóór 34 weken is expectatief beleid gerechtvaardigd met start van orale therapie:
- aciclovir 400 mg p.o., 3 dd gedurende 5 dagen; of:
- valaciclovir 500 mg p.o., 2 dd gedurende 5 dagen.
Vroeg gebroken vliezen, >34 weken amenorroeduur:
- aanwezigheid van laesies heeft geen invloed op neonatale morbiditeit of mortaliteit.
Zwangere personen met hiv en anogenitale HSV-infectie
Een primaire infectie wordt behandeld conform de aanbevolen behandeling van HSV (zie hierboven).
Overweeg bij een voorgeschiedenis van recidiverende anogenitale HSV-infecties, met name bij zwangeren die vaginaal zullen gaan bevallen, suppressieve behandeling met:
- aciclovir 400 mg, p.o., 3 dd, vanaf 32 weken amenorroeduur.
Behandeling van HSV bij pasgeborenen en kinderen
Tijdens de baring wordt bij onverwachte aanwezigheid van verdachte laesies bij de zwangere durante partu materiaal afgenomen voor onderzoek op HSV:
- direct afname EDTA-bloed en liquor voor NAAT op HSV;
- na 24-48 uur swabs huid, conjunctiva, orofarynx en rectum (dit om directe contaminatie van moeder uit te sluiten);
- neonaten met een symptomatische herpessimplexinfectie, een significante klinische verdenking en/of met een positieve kweek of NAAT moeten direct behandeld worden met (i.v.) aciclovir.
Ouders, verzorgers, familie en vrienden krijgen een advies over de kans van postnatale transmissie van herpes bij actieve orale laesies.
Primaire infectie
Sectio:
- behandeling conservatief, geen afname van kweken, normale neonatale behandeling na 24 uur observatie.
Vaginaal:
- afname swabs huid, conjunctiva, orofarynx en rectum 24-48 uur na geboorte (dit om directe contaminatie van moeder uit te sluiten);
- start empirische behandeling (zie onder voor dosering) tot infectie met diagnostiek onwaarschijnlijk is gemaakt.
Recidiverende infectie
Geen afname van materiaal en geen actieve behandeling.
Congenitale HSV-infectie
Aterme neonaat:
- aciclovir 80 mg/kg/dag i.v., in 4 doses;
- behandelduur:
- CNS en verspreid: 21 dagen;
- beperkt tot lokaal huid, oog en mond: 14 dagen.
Herpes simplex encefalitis (Kinderformularium)
Premature neonaat (<37 weken):
- aciclovir 60 mg/kg/dag i.v., in 3 doses gedurende 21 dagen.
Aterme neonaat:
- aciclovir 80 mg/kg/dag i.v., in 3 doses gedurende 21 dagen.
1 maand tot 3 maanden:
- aciclovir 80 mg/kg/dag i.v., in 4 doses gedurende 14-21 dagen.
3 maanden tot 18 jaar:
- aciclovir 1500 mg/m² i.v., in 3 doses, gedurende 14-21 dagen
Behandeling van complicaties bij volwassenen
Indien er complicaties aanwezig zijn, is klinische behandeling aangewezen, eventueel met intraveneuze antivirale therapie. Intraveneuze antivirale therapie is ook aangewezen bij neurologische complicaties (onder andere meningo-encefalitis) en ernstige HSV-infectie:
- aciclovir 10 mg/kg i.v., elke 8 uur gedurende 14-21 dagen tot klinische verbetering optreedt.
Bij oogheelkundige herpesaandoeningen dient met spoed verwezen te worden naar de oogarts. Bij een herpetische keratitis kan de infectie in verschillende lagen van het hoornvlies tot uiting komen, waarvoor vaak tot 1 jaar orale systemische antivirale (valaciclovir) en lokale behandeling (steroïden, aciclovir) noodzakelijk is.
Herpesvirussen kunnen een uveitis anterior en/of immuunstromale keratitis veroorzaken waarvoor bij frequente recidieven ook minimaal 1 jaar, maar in sommige gevallen levenslang orale systemische antivirale (valaciclovir 500 mg 2 dd) en lokale behandeling (steroïden) gegeven worden.
Een acute retina necrose is de meest ernstige vorm. Een klinische behandeling met aciclovir 10 mg/kg i.v. elke 8 uur gedurende 14-21 dagen is aangewezen, eventueel na 1 week aangevuld met prednison om ontstekingsverschijnselen te temperen. Hierna volgt ook systemische antivirale behandeling voor minimaal 1 jaar.
C4.9.2 Behandeling bij recidief/onderhoudsbehandeling
Bij behandeling van een recidief kan als symptoombestrijding volstaan worden met een indrogende therapie, bijvoorbeeld indifferente crème met zinkoxide of zinksulfaat (zinkoxide vaselinecrème 10% FNA of zinksulfaat vaselinecrème 0,5% FNA) (Farmacotherapeutisch kompas, 2017). Bij veel pijnklachten kan pijnstilling worden gegeven (lokaal: lidocaïnecrème zinkoxidesmeersel 5% FNA/lidocaïnespray of in combinatie met systemische pijnstilling). Het is belangrijk alert te zijn op eventuele secundaire bacteriële infecties en deze te behandelen.
Over de behandeling bestaat een grote mate van consensus. In vrijwel alle richtlijnen worden dezelfde behandelschema’s gepresenteerd (Patel, 2017; Patel, 2015, CDC, 2021; Holmes, 2008). Bij deze recidiverende infecties wordt zo snel mogelijk, maar in ieder geval binnen 48 uur na het ontstaan van de eerste tekenen (prodromen), met de antivirale medicatie gestart om enig effect te kunnen bewerkstelligen. Het is dan ook aan te bevelen bij frequente en/of hinderlijk ervaren recidieven de patiënt een voorraad in huis te laten halen, om bij het begin van een volgende episode direct te kunnen starten.
Immuun(in)competente volwassenen (Patel, 2017):
- valaciclovir 500 mg p.o., 2 dd gedurende 5 dagen; of:
- aciclovir 400 mg p.o., 3 dd gedurende 5 dagen; of:
- famciclovir 125 mg p.o., 2 dd gedurende 5 dagen.
Korte therapieën zijn te overwegen bij frequente recidieven (Patel, 2017):
- valaciclovir 500 mg p.o., 2 dd gedurende 3 dagen; of:
- aciclovir 800 mg p.o., 3 dd gedurende 2 dagen; of:
- famciclovir 1000 mg p.o., 2 dd voor 1 dag.
Patiënten met zeer frequente recidiverende infecties (>6 per jaar) en veel klachten komen in aanmerking voor onderhoudstherapie met (val)aciclovir of een analoog middel. Antivirale therapie voor recidiverende herpes genitalis reduceert het aantal recidieven met 70-80% en verkort de duur van de laesies.
Onderhoudsbehandeling om recidieven te voorkomen:
- valaciclovir 500 mg p.o., 1 dd;
- valaciclovir 1000 mg p.o., 1 dd;
- aciclovir 400 mg p.o., 2 dd;
- famciclovir 250 mg p.o., 2 dd.
C4.9.3 Behandeling bij therapieresistente groepen
Helicase-primaseremmers (zoals amenamevir en pritelivir) vormen een nieuwe klasse van krachtige antivirale middelen. De werkzaamheid is daarmee anders dan die van de nucleosideverbindingen zoals aciclovir, valaciclovir en famciclovir (Kawashima, 2017). Hoewel klinische resistentie voor HSV-stammen zeldzaam is, blijkt in studies ongeveer 5% van de immuungecompromitteerde deelnemers toch resistent te zijn. Amenamevir blijkt een effectieve en veilige optie te zijn voor patiënten met recidiverende en therapieresistente HSV. Alhoewel de meeste doseringstudies zijn verricht voor de indicatie varicellazostervirusinfecties, is het bij genitale herpes effectief gebleken in een dagelijkse dosering van 100-200 mg gedurende 3-7 dagen of in een eenmalige hoge dosis van 1200 mg (Tyring, 2012). In Nederland is amenamevir (nog) niet geregisteerd.
C4.9.4 Nacontrole
Indien aanhoudende klachten, of wanneer complicaties of ernstig verloop wordt gevreesd (bijvoorbeeld vanwege een onderliggend lijden).
Indien keuze voor profylaxebehandeling: evalueer na 6-12 maanden en bespreek of medicatie op proef kan worden gestaakt. Hervat medicatie als na het staken frequent recidieven optreden (≥2 episoden in korte tijd) en evalueer vervolgens jaarlij
Onderbouwing
Referenties
- American Academy of Pediatrics. Herpes simplex. In: Pickering LK, Baker CJ, Long SS, McMillan JA. Red Book: 2006 Report of the Committee on Infectious Deseases. 27th Edition. American Academy of Pediatrics, 2006: 361-371.
- Arvaja M, Lehtinen M, Koskela P, Lappalainen M, Paavonen J, Vesikari T. Serological evaluation of herpes simplex virus type 1 and type 2 infections in pregnancy. Sex Transm Infect 1999; 75: 168-171.
- Ashley-Morrow R, Nollkamper J, Robinson NJ, Bishop N, Smith J. Performance of focus ELISA tests for herpes simplex virus type 1 (HSV-1) and HSV-2 antibodies among women in ten diverse geographical locations. Clin Microbiol Infect 2004; 10: 530-536.
- Bagdades EK, Pillay D, Squire SB, O'Neil C, Johnson MA, Griffiths PD. Relationship between herpes simplex virus ulceration and CD4+ cell counts in patients with HIV infection. AIDS. 1992 Nov;6(11):1317-20.
- Benedetti J, Corey L, Ashley R. Recurrence rates in genital herpes after symptomatic first-episode infection. Annals of Internal Medicine 1994; 121: 847-854.
- Benedetti JK, Zeh J, Corey L. Clinical reactivation of genital herpes simplex virus infection decreases in frequency over time. Annals of Internal Medicine 1999; 131: 14-20.
- CDC. Genital HSV infections. In: 2021 Sexually transmitted diseases treatment guidelines. Centers for Disease Control and Prevention, 2021. Herpes - STI Treatment Guidelines (cdc.gov).
- Celum CL, Robinson NJ, Cohen MS. Potential effect of HIV type 1 antiretroviral and herpes simplex virus type 2 antiviral therapy on transmission and acquisition of HIV type 1 infection. J Infect Dis 2005; 191 Suppl 1: S107-S114.
- Corey L, Wald A, Patel R, Sacks SL, Tyring SK, Warren T, Douglas JM Jr, Paavonen J, Morrow RA, Beutner KR, Stratchounsky LS, Mertz G, Keene ON, Watson HA, Tait D, Vargas-Cortes M. Once-daily valacyclovir to reduce the risk of transmission of genital herpes. N Engl J Med 2004; 350: 11-20.
- Daha, T. Herpes Simlex Virus. Tijdschrift Hygiëne en Infectiepreventie 1997; 4: 144.
- Drake S, Taylor S, Brown D, Pillay D. Improving the care of patients with genital herpes. BMJ 2000; 321: 619-623.
- Engelberg P, Carrell D, Krantz E, Corey L, Wald A. Natural history of genital herpes simplex virus type 1 infection. Sex Transm Dis 2003; 30: 174-177.
- Eskild A, Jeansson S, Hagen JA, Jenum PA, Skrondal A. Herpes simplex virus type-2 antibodies in pregnant women: the impact of the stage of pregnancy. Epidemiol Infect 2000; 125: 685-692.
- Farmacotherapeutisch kompas. 2017. https://www.farmacotherapeutischkompas.nl/
- Foley E, Clarke E, Beckett VA, Harrison S, Pillai A, FitzGerald M, Owen P, Low-Beer N, Patel R. Management of genital herpes in pregnancy. BASHH/RCOG, 2014.
- Forsgren M, Klapper PE. Herpes simplex virus type 1 and type 2. In: Zuckerman AJ, Banatvala JE, Schoub BD, Griffiths PD, Mortimer P. Principles and practice of clinical virology. 6th Edition. Wiley-Blackwell, 2009: 124-126.
- Gray RH, Li X, Wawer MJ, Serwadda D, Sewankambo NK, Wabwire-Mangen F, Lutalo T, Kiwanuka N, Kigozi G, Nalugoda F, Meehan MP, Robb M, Quinn TC. Determinants of HIV-1 load in subjects with early and later HIV infections, in a general-population cohort of Rakai, Uganda. J Infect Dis 2004; 189: 1209-1215.
- Hemelaar SJAL, Pouran J, Steegers EAP, van der Meijden W. Neonatal herpes infections in The Netherlands in the period 2006-2011. J Matern Fetal Neonatal Med 2015; 28: 905-909.
- Holmes KK, Sparling PF, Stamm WE, Piot P, Wasserheit JN, Corey L, Cohen MS, Watts DH. Sexually transmitted diseases. 4th Edition. Mc Graw-Hill, 2008.
- James SH, Kimberlin DW. Neonatal herpes simplex virus infection. Infect Dis Clin North Am 2015; 29: 391-400.
- Johnston C, Magaret A, Son H, Stern M, Rathbun M, Renner D, et al. Viral Shedding 1 Year Following First-Episode Genital HSV-1 Infection. JAMA. 2022 Nov 1;328(17):1730-1739. doi: 10.1001/jama.2022.19061.
- Kawashima M, Nemoto O, Honda M, Watanabe D, Nakayama J, Imafuku S, Kato T, Katsuramaki T; study investigators. Amenamevir, a novel helicase-primase inhibitor, for treatment of herpes zoster: A randomized, double-blind, valaciclovir-controlled phase 3 study. J Dermatol. 2017 Nov;44(11):1219-1227.
- Kimberlin DW. Herpes simplex infections in neonates and early childhood. Semin Pediatr Infect Dis 2005; 16: 271-281.
- Kimberlin DW. Herpes simplex infections of the newborn. Seminars in Perinatology 2007; 31: 19-25.
- Kimura H, Ito Y, Futamara M, Ando Y, Yabuta Y, Hoshino Y, Nishiyama Y, Morishima T. Quantitation of viral load in neonatal herpes simplex virus infections and comparison between type 1 and type 2. J Med Virol 2002; 67; 349-353.
- Lafferty WE, Coombs RW, Benedetti J, Critchlow C, Corey L. Recurrences after oral and genital herpes simplex virus infection. Influence of site of infection and viral type. N Engl J Med 1987; 316: 1444-1449.
- Langenberg AG, Corey L, Ashley RL, Leong WP, Straus SE. A prospective study of new infections with herpes simplex virus type 1 and type 2. N Engl J Med 1999; 341: 1432-1438.
- Looker KJ, Magaret AS, May MT, Turner KM, Vickerman P, Gottlieb SL, Newman LM. Global and regional estimates of prevalent and incident herpes simplex virus infection type 1 in 2012. PLos One 2015a; 10: e0140765.
- Looker KJ, Magaret AS, Turner KM, Vickerman P, Gotlieb SL, Newman LM. Global and regional estimates of prevalent and incident herpes simplex virus infection type 2 in 2012. PLoS One 2015b; 10: e114989.
- Malm G, Forsgren M. Neonatal herpes simplex infections: HSV DNA in cerebrospinal fluid and serum. Arch Dis Child Fetal Neonatal Ed 1999; 81: F24-F29.
- Mark HD, Nanda JP, Roberts J, Rompalo A, Melendez JH, Zenilman J. Performance of focus ELISA tests for HSV-1 and HSV-2 antibodies among university students with no history of genital herpes. Sex Transm Dis 2007; 34: 681-685.
- Mark KE, Wald A, Magaret AS, Selke S, Olin F, Huang ML, Corey L. Rapidly cleared episodes of herpes simplex virus reactivation in immunocompetent adults. J Infect Dis 2008; 198: 1141-1149.
- Mindel A. Genital herpes: how much of a public health problem? Lancet 1998; 351 (suppl 3): 16-18.
- Morrow RA, Friedrich D, Krantz E. Performance of the focus and kalon enzyme-linked immunosorbent assays for antibodies to herpes simplex virus type 2 glycoprotein G in culture-documented cases of genital herpes. J Clin Microbiol 2003; 41: 5212-5214.
- Nagot N, Ouédraogo A, Foulongne V, Konaté I, Weiss HA, Vergne L, Defer MC, Djagbaré D, Sanon A, Andonaba JB, Becquart P, Segondy M, Vallo R, Sawadogo A, Van de Perre P, Mayaud P. Reduction of HIV-1 RNA levels with therapy to suppress herpes simplex virus. N Engl J Med 2007; 356: 790-799.
- Patel R, Kennedy OJ, Clarke E, Geretti A, Nilsen A, Lautenschlager S, Green J, Donders G, van der Meijden W, Gomberg M, Moi H, Foley E. 2017 European guidelines for the management of genital herpes. Int J STD AIDS. 2017 Dec;28(14):1366-1379.
- Patel R, Green J, Clarke E, Seneviratne K, Abbt N, Evans C, Bickford J, Nicholson M, OFarrell N, Barton S, FitzGerald M, Foley E. 2014 UK national guidelines on the management of anogenital herpes. Int J STD AIDS 2015; 26: 763-776. https://www.bashh.org/guidelines.
- Pellet PE, Roizman B. Herpesviridae. In: Knipe DM, Howley PM. Fields Virology. 6th Edition. Wolters Kluwer/Lippincott Williams & Wilkins, 2013: 1802-1822.
- Phipps W, Saracino M, Magaret A, Selke S, Remington M, Huang ML, Warren T, Casper C, Corey L, Wald A. Persistent genital herpes simplex virus-2 shedding years following the first clinical episode. J Infect Dis 2011; 203: 180-187.
- Pinninti SG, Angara R, Feja KN, Kimberlin DW, Leach CT, Conrad DA, McCarthy CA, Tolan RW Jr. Neonatal herpes disease following maternal antenatal antiviral suppressive therapy: a multicenter case series. J Pediatr 2012 Feb 14.
- Pinninti SG, Kimberlin DW. Management of neonatal herpes simplex virus infection and exposure. Arch Dis Child Fetal Neonatal Ed 2014; 99: F240-F244.
- Pinninti SG, Kimberlin DW. Neonatal herpes simplex virus infections. Semin Perinatol. 2018; 42 (3): 168-175.
- Quinnan GV Jr, Masur H, Rook AH, Armstrong G, Frederick WR, Epstein J, Manischewitz JF, Macher AM, Jackson L, Ames J, et al. Herpesvirus infections in the acquired immune deficiency syndrome. JAMA. 1984 Jul 6;252(1):72-7.
- Roizman B, Knipe Dm, Whitley RJ. Herpes simplex viruses. In: Knipe DM, Howley PM. Fields virology. 5th Edition. Wolters Kluwer/Lippincott Williams & Wilkins, 2007: 2501.
- Schacker T, Zeh J, Hu H, Shaughnessy M, Corey L. Changes in plasma human immunodeficiency virus type 1 RNA associated with herpes simplex virus reactivation and suppression. J Infect Dis 2002; 186: 1718-1725.
- Schiffer JT, Wald A, Selke S, Corey L, Magaret A. The kinetics of mucosal herpes simplex virus-2 infection in humans: evidence for rapid viral-host interactions. J Infect Dis 2011; 204: 554-561.
- Scott JH & Kimberlin DW. Neonatal herpes simplex infection. Inf Dis Clin North Am 2015; 29: 391-400.
- Sen P, Barton SE. Genital herpes and its management: clinical review. BMJ 2007; 334: 1048-1052.
- Severson JL, Tyring SK. Relation between herpes simplex viruses and human immunodeficiency virus infections. Arch Dermatol. 1999 Nov;135(11):1393-7.
- Summerton J, Riedesel M, Laeyendecker O, Gaydos C, Maldeis NE, Hardick A, Morriw RA, Quinn TC. Effect of sexually transmitted disease (STD) coinfections on performance of three commercially available immunosorbent assays used for detection of herpes simplex virus type 2-specific antibody in men attending Baltimore, Maryland, STD clinics. Clin Vaccine Immunol 2007; 14: 1545-1549.
- Tata S, Johnston C, Huang ML, Selke S, Magaret A, Corey L, Wald A. Overlapping reactivations of herpes simplex virus type 2 in the genital and perianal mucosa. J Infect Dis 2010; 201: 499-504.
- Tronstein E, Johnston C, Huang M-L, Selke S, Magaret A, Warren T, Corey L, Wald A. Genital shedding of herpes simplex virus among symptomatic and asymptomatic persons with HSV-2 infection. JAMA 2011; 305: 1441-1449.
- Tyring S, Wald A, Zadeikis N, Dhadda S, Takenouchi K, Rorig R. ASP2151 for the treatment of genital herpes: a randomized, double-blind, placebo- and valacyclovir-controlled, dose-finding study. J Infect Dis. 2012 Apr 1;205(7):1100-10. doi: 10.1093/infdis/jis019. Epub 2012 Feb 20. PMID: 22351940.
- Van den Broek IVF, van Aar F, van Oeffelen AAM, Woestenberg PJ, Heijne JCM, den Daas C, Hofstraat SHI, Hoenderboom BM, van Wees D, van Sighem Al, Nielen MMJ, van Benthem BHB. Sexually transmitted infections in the Netherlands in 2015. RIVM Rapport 2015-0026. Rijksinstituut voor Volksgezondheid en Milieu, 2016. http://www.rivm.nl/Documenten_en_publicaties/Wetenschappelijk/Rapporten/2016/juni/Sexually_transmitted_infections_in_the_Netherlands_in_2015.
- Van der Beek MT, Laheij AM, Raber-Durlacher JE, von dem Borne PA, Wolterbeek, van der Blij-de Brouwer CS, van Loveren C, Claas EC, Kroes AC, de Soet JJ, Vossen AC. Viral loads and antiviral resistance of herpesviruses and oral ulcerations in hematopoietic stem cell transplant recipients. Bone Marrow Transplant 2012; 47: 1222-1228.
- Van der Meijden WI. Expertmeeting partnerwaarschuwing: zin en onzin van partnerwaarschuwing bij virale SOA. Notulen 1999.
- Van Rooijen MS, Roest W, Hansen G, Kwa D, de Vries HJ. False-negative type-specific glycoprotein G antibody responses in STI clinic patients with recurrent HSV-1 or HSV-2 DNA positive genital herpes, The Netherlands. Sex Transm Infect 2016; 92: 257-260.
- Van Oeffelen L, Biekram M, Poeran J et al. Update on neonatal herpes simplex epidemiology in the Netherlands: a health problem of increasing concern? Pediatr Infect Dis J. 2018; 37 (8): 806-813.
- Van Wees DA, Visser M, van Aar F, Op de Coul ELM, Staritsky LE, Sarink D, et al. Sexually transmitted infections in the Netherlands in 2021. RIVM Rapport 2022-0023. Rijkinstituut voor Volksgezondheid en Milieu, 2022.
- Wald A, Langenberg AG, Link K, Izu AE, Ashley R, Warren T, Tyring S, Douglas JM Jr, Corey L. Effect of condoms on reducing the transmission of herpes simplex virus type 2 from men to women. JAMA 2001; 285: 3100-3106.
- Wald A, Huang ML, Carrell D, Selke S, Corey L. Polymerase chain reaction for detection of herpes simplex virus (HSV) DNA on mucosal surfaces: comparison with HSV isolation in cell culture. J Infect. Dis 2003; 188: 1345-1351.
- Westhoff GL, Little SE, Caughey AB. Herpes simplex virus and pregnancy: a review of the management of antenatal and peripartum herpes infections. Gynecol Surv 2011; 66: 629-638.
- WHO. Guidelines for the treatment of genital herpes simplex virus. World Health Organizaion, 2016.
- WIP. Richtlijn Babyvoeding. Werkgroep Infectie Preventie, 2011.
- WIP. Richtlijn veilig werken op de afdeling Neonatologie. Werkgroep Infectie Preventie, 2011.
- Woestenberg PJ, Tjhie JH, de Melker HE, van der Klis FR, van Bergen JE, van der Sande MA, van Benthem BH. Herpes simplex virus type 1 and type 2 in the Netherlands: seroprevalence, risk factors and changes during a 12-year period. BMC Infect Dis 2016; 16: 364.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 27-03-2024
Laatst geautoriseerd : 27-03-2024
Geplande herbeoordeling :
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van het richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van deze richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Opmerking bij autorisatie:
Betreft ‘C.1.10: Paradigmashift testbeleid chlamydia bij asymptomatische patiënten’; deze paragraaf geeft aan dat er nieuwe inzichten zijn met betrekking tot het al dan niet testen op chlamydia bij personen zonder klachten, maar gaat niet over tot ontraden. De richtlijn geeft helder aan dat nog niet duidelijk is wat de consequenties zijn op de langere termijn als men stopt met het testen en dat een (maatschappelijk) gesprek over het nut en de noodzaak hiervan is geboden. De NVMM, de NIV en het NHG willen benadrukken dat een breed debat met alle stakeholders eerst moet plaatsvinden alvorens men deze richtlijn interpreteert als een advies om niet meer te testen op chlamydia bij personen zonder klachten.
Doel en doelgroep
Deze richtlijn doet aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering en is gericht op het vaststellen van goed medisch handelen.
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad.
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met geografische spreiding van de werkgroepleden en met evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden. Naast de afgevaardigden van de verschillende beroepsgroepen zijn er vertegenwoordigers van patiëntenverenigingen en belangenorganisaties betrokken geweest bij de ontwikkeling van de richtlijn.
Tabel 1: Overzicht werkgroepleden herziening 2022-2024.
|
Werkgroepleden |
Functie |
Vereniging of affiliatie |
|
Prof. dr. H.J.C. de Vries (voorzitter) |
Dermatoloog |
NVDV |
|
Dr. A.P. van Dam (vicevoorzitter) |
Arts-microbioloog |
NVMM |
|
Drs. E. Ab |
Huisarts |
NHG |
|
Dr. A.H. Adriaanse |
Gynaecoloog |
NVOG |
|
Drs. C.A.J. van Bokhoven |
Arts Maatschappij en Gezondheid |
NVIB/WASS |
|
Drs. H. Bos (vanaf mei 2022) |
Arts Maatschappij en Gezondheid |
Soa Aids Nederland |
|
Drs. M.D. Esajas |
Gynaecoloog |
NVOG |
|
Drs. M.A.M. van den Elshout |
Arts seksuele gezondheid |
GGD regio Utrecht |
|
Dr. H.M. Götz |
Arts Maatschappij en Gezondheid, epidemioloog |
NVIB/WASS |
|
Drs. M.O. Hoogeveen (vanaf april 2023) |
Arts-onderzoeker |
NVDV |
|
Dr. E. Hoornenborg |
Internist-infectioloog |
NVHB (NIV) |
|
Drs. A.G.W van Hulzen |
Verpleegkundig specialist |
V&VN |
|
Drs. R. Joosten |
Arts Maatschappij en Gezondheid |
RIVM |
|
Drs. D.M. van Loon (sept 2022-mei 2023) |
Arts-onderzoeker |
NVDV |
|
Dr. G. Losonczy |
Oogarts |
NOG |
|
Drs. B. Meijer |
Uroloog |
NVU |
|
Dr. J.M. Oldhoff |
Dermatoloog |
NVDV |
|
Prof. Dr. M.F. Schim van der Loeff |
Arts Maatschappij en Gezondheid, epidemioloog |
GGD Amsterdam |
|
Drs. F.W. Sintenie |
Belangenvertegenwoordiger |
Treat it Queer |
|
Drs. M. Stolting (tot december 2022) |
Arts-onderzoeker |
NVDV |
|
E.N.J. Stronck (vanaf april 2022) |
Patiëntvertegenwoordiger |
Poz&Proud (Hiv Vereniging) |
|
Dr. A.H. Teeuw |
Kinderarts |
NVK |
|
Dr. S.O. Verboeket |
Belangenvertegenwoordiger |
PrEPnu |
|
Dr. C.E. Vergunst |
Dermatoloog |
NVDV |
|
Dr. S.M.E. Vrouenraets |
Internist-infectioloog |
NVHB (NIV) |
|
Drs. M.I.L.S. Werner |
Arts Maatschappij en Gezondheid |
NVIB/WASS |
|
Dr. M. van Westreenen |
Arts-microbioloog |
NVMM |
|
Dr. C. Zemouri |
Gezondheidswetenschapper |
Zemouri Public Health Research & Consultancy |
|
Klankbordleden |
|
|
|
Dr. J. Schouten |
Neuroloog |
NVN |
Tabel 2: Overzicht betrokken partijen herziening 2022-2024.
|
Overzicht betrokken partijen* |
Zitting nemend in werkgroep |
Knelpuntenanalyse |
Commentaarfase |
Autorisatie |
Opmerkingen |
|
Wetenschappelijke verenigingen |
|||||
|
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Medische Microbiologie (NVMM) |
X |
X |
X |
X |
|
|
Nederlands Huisartsen Genootschap (NHG) |
X |
X |
X |
|
Voor huisartsen gelden de NHG-standaarden. |
|
Nederlandse Vereniging voor Urologie (NVU) |
X |
X |
X |
X |
Geen extern commentaar geleverd. |
|
Nederlandse Internisten Vereniging (NIV) namens de Nederlandse Vereniging van Hiv-Behandelaren (NVHB) en de Nederlandse Vereniging voor Internist-infectiologen (NVII) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging Infectieziektebestrijding (NVIB) namens de Werkgroep Artsen Seksuele gezondheid en Soa (WASS) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) |
X |
|
X |
X |
Zijn later (na knelpuntanalyse) aangeschoven. |
|
Nederlandse Vereniging voor Kindergeneeskunde (NVK) |
X |
|
X |
X |
Zijn later (na knelpuntanalyse) aangeschoven. |
|
Nederlandse Vereniging voor Neurologie (NVN) |
|
|
X |
|
Gemandateerd klankbordgroep lid. |
|
Nederlands Oogheelkundig Genootschap (NOG) |
X |
|
X |
X |
Zijn later (na knelpuntanalyse) aangeschoven. |
|
Overige organisaties |
|||||
|
Rijksinstituut voor Volksgezondheid en het Milieu-Centrum voor Infectieziektebestrijding (RIVM-Cib) |
X |
X |
X |
|
|
|
Soa Aids Nederland |
X |
X |
X |
|
|
|
Verpleegkundigen & Verzorgenden Nederland (V&VN) |
X |
X |
X |
X |
Geen extern commentaar geleverd. |
|
Nederlandse Vereniging voor Ziekenhuis Apothekers (NVZA) |
|
|
X |
|
|
|
Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) |
|
|
X |
|
Per abuis niet uitgenodigd voor knelpuntanalyse. Er is afgesproken dit in de toekomst wel te doen. |
|
Nederlandse Associatie Physician Assistants (NAPA) |
|
|
X |
|
Geen extern commentaar geleverd. |
|
Patiëntenverenigingen |
|||||
|
Poz&Proud |
X |
X |
X |
X |
Geautoriseerd via Patiëntfederatie Nederland |
|
Treat it Queer |
X |
X |
X |
X |
Geautoriseerd via Patiëntfederatie Nederland |
|
PrEPnu |
X |
X |
X |
|
Geen extern commentaar geleverd. |
|
Huid Nederland |
|
|
X |
|
Geen extern commentaar geleverd. |
|
Stakeholders |
|||||
|
Zorginstituut Nederland (ZiN) |
|
|
X |
|
Uitgenodigd. Geen commentaar ontvangen. |
|
Nederlandse Vereniging Ziekenhuizen (NVZ) |
|
|
X |
|
|
|
Nederlandse Federatie van Universitair Medische Centra (NFU) |
|
|
X |
|
Uitgenodigd. Geen commentaar ontvangen. |
|
Zorgverzekeraars Nederland (ZN) |
|
|
X |
|
Uitgenodigd. Geen commentaar ontvangen. |
|
Inspectie Gezondheidszorg en Jeugd (IGJ) |
|
|
X |
|
Uitgenodigd. Geeft geen commentaar. |
* Alle partijen werden uitgenodigd voor de knelpuntenanalyse (invitational conference) en de commentaarfase.
Deelname aan de werkgroep en autorisatie wordt enkel aan de wetenschappelijke verenigingen, patiëntenverenigingen en overige organisaties voorgelegd.
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling (2021) is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen, persoonlijke relaties, reputatiemanagement |
Extern gefinancierd onderzoek |
Overige belangen |
Getekend op |
Acties |
|
Prof. dr. H.J.C. de Vries |
Dermatoloog, CSG GGD Amsterdam & afdeling dermatologie, Amsterdam UMC |
Chair of CBK Zuidoost foundation, onbetaald |
- |
- |
- |
07-12-2022 |
- |
|
Drs. E. Ab |
Huisarts UMCG |
- Kaderarts urogynaecologie (onbetaald) - Expertgroep seksuele gezondheid (onbetaald) |
- |
- |
- |
10-02-2022 |
- |
|
Dr. A.H. Adriaanse |
Gynaecoloog, Noordwest Ziekenhuisgroep, locatie Alkmaar |
- Medisch manager OK-organisatie Noordwest Ziekenhuisgroep - Lid Calamiteiten commissie Noordwest Ziekenhuisgroep - Opleider Internationale Gezondheidszorg en Tropengeneeskunde, Noordwest Ziekenhuisgroep (deze functies zijn onderdeel van het dienstverband binnen de Noordwest Ziekenhuisgroep) |
- |
- |
- |
27-08-2023 |
- |
|
Drs. C.A.J. van Bokhoven |
Arts maatschappij en gezondheid, infectieziektebestrijding, GGD Gelderland-Zuid |
- Lid visitatiecommissie Seksuele gezondheid GGD’en (vergoeding valt onder reguliere financiering) - Lid werkgroep kwaliteitsprofiel ASG (betaald door VWS) |
- |
- |
- |
23-02-2022 |
- |
|
Dr. H. Bos |
Arts M+G infectieziektebestrijding, strategisch adviseur Soa Aids Nederland (0,8) |
- |
- |
- |
- |
24-02-2022 |
- |
|
Dr. A.P. van Dam |
Arts-microbioloog Amsterdam UMC (0,9 FTE) met detachering naar - GGD Amsterdam (0,2 FTE) - RIVM (COMmer) (0,2 FTE) |
- Vanuit Amsterdam UMC: lid redactieraad Tijdschrift voor Infectieziekten (onbetaald) - Vanuit GGD: labvertegenwoordiger NL voor SOA-ECDC (onbetaald) |
Geen specifieke intellectuele belangen of reputatie. In het algemeen is het zo dat het definiëren van een bepaalde conditie als een ziektebeeld, waarop diagnostiek en behandeling moet volgen door een professional, leidt tot een groter belang van deze professional en zijn/haar werkgever. Dit geldt ook voor mij als arts-microbioloog, en mijn werkgevers. |
Onderzoek naar effectiviteit van zolidoflacin voor behandeling voor gonorroe (iov GARDP) Onderzoek naar M. genitalium bij PID, financier OLVG research fonds -Onderzoek naar diagnostische waarde geautomatiseerde moleculaire test voor T. pallidum (Hologic financiert kits, geen honoraria) |
- |
16-01-2023 |
- |
|
Drs. M.A.M. van den Elshout |
- Medisch coördinator afd. seksuele gezondheid, GGD regio Utrecht (36u) - Arts-onderzoeker AMPrEP, AMR / Amsterdam UMC /GGD Amsterdam (8u) -Arts seksuele gezondheid, GGD Amsterdam, Gemeente Amsterdam (0,77u) |
Registratiecommissie SOAP, lid namens ASG-stuurgroep, leden geven advies aan de directeur RIVM/CIb over de gegevens die aangeleverd moeten worden t.b.v. de in het SOAP gebruikersreglement genoemde doelen (onbetaald). |
- |
- |
- |
14-11-2022 |
- |
|
Drs. M.D. Esajas |
Gynaecoloog UMCG |
Docent BVO Nederland, onbetaald |
- |
- |
- |
24-11-2022 |
- |
|
Dr. H.M. Götz |
Arts M+G IZB GGD Rotterdam- Rijnmond |
- |
- |
- |
- |
09-02-2022 |
- |
|
Drs. M.O. Hoogeveen |
Arts-onderzoeker, NVDV |
Klinisch onderzoek pediatrie Virtual Reality Hypnosis |
- |
- |
- |
25-01-2022 |
- |
|
Dr. E. Hoornenborg |
- Hoofd Centrum voor Seksuele Gezondheid GGD Amsterdam (1,0 fte) - Internist-infectioloog, DC Lairesse, Amsterdam (0,1 fte) |
- |
- |
GGD Amsterdam ontvangt in 2023 een grant van Gilead Sciences voor outreach HIV en STI testing. Geen belang bij uitkomst met betrekking tot de MDR. |
- |
23-08-2023 |
- |
|
Drs. A.G.W. van Hulzen |
Verpleegkundig Specialist AGZ (hiv- en hepatitis behandelcentrum) Isala Zwolle (24u) |
- |
- |
- |
- |
29-11-2022 |
- |
|
Drs. D.M. van Loon |
Arts-onderzoeker NVDV |
- |
- |
- |
- |
01-02-2023 |
- |
|
Drs. R. Joosten |
Arts Maatschappij en Gezondheid, profiel Infectieziektebestrijding RIVM |
- |
- |
- |
- |
24-11-2022 |
- |
|
Dr. G. Losonczy |
Oogarts, corneachirurg, Radboud UMC Nijmegen |
- |
- |
- |
- |
19-07-2023 |
- |
|
Drs. B. Meijer |
Uroloog, ACIBADEM, Amsterdam |
Lid werkgroep bekwaamheidseisen (beperkte) genitale chirurgie (onbetaald) |
- |
- |
- |
11-2-2022 |
- |
|
Dr. J.M. Oldhoff |
Dermatoloog, UMCG |
- Voorzitter domeingroep SOA en huidinfecties, NVDV - Hoofd SOA GGD Groningen (betaald via samenwerkingsverband met de afd. dermatologie UMCG) |
- |
- |
- |
10-02-2022 |
- |
|
Prof. Dr. M.F. Schim van der Loeff |
- Senior epidemioloog bij afdeling infectieziekten, GGD Amsterdam (fulltime) - Bijzonder hoogleraar van epidemiologie van Seksueel Overdraagbare Infecties, Amsterdam UMC (1 dag per week) |
Bestuurslid Stichting Virus Actiefonds (onbetaald) tot november 2022 |
- |
Mijn werkgever, GGD Amsterdam, stimuleert medewerkers om deel te nemen aan adviescommissies en richtlijncommissies, zoals deze. Alle betalingen uit bovenstaande functies gaan naar werkgever. - Hoofdonderzoeker op onderzoek CONTROL, gefinancierd door ZonMw (juli 2020-heden) - Projectleider op onderzoek NABOGO, gefinancierd door ZonMw (2016-2022) - Co-PI op onderzoek EZI-PrEP, gefinancierd door AidsFonds (2019-heden) - Deelnemer van Advisory board MSD (november 2020 en juni 2021) - Lid van Advisory Board Novosanis (oktober 2022-heden) - Hoofdonderzoeker van Ivestigator-Initiated Research grant bij GSK (oktober 2022-nu) |
23-2-2022 |
- |
|
|
Dr. J. Schouten |
- Neuroloog, Rijnstate Ziekenhuis Arnhem |
Forensisch neuroloog, Pieter Baan Centrum (betaald) |
- |
- |
- |
24-07-2023 |
- |
|
Drs. F. W. Sintenie |
- Penningmeester bij Treat it Queer (i.p. onbetaald) - ANIOS verslavingsgeneeskunde bij Jellinek (betaald) |
- |
- |
- |
Treat it Queer zet zich in voor betere zorg voor de LHBTI+ gemeenschap middels onderwijs, onderzoek en advies. Alle oprichters zijn zelf onderdeel van de gemeenschap, maar hebben ook alleen een achtergrond in de geneeskunde en/of global health. Derhalve zou het theoretisch kunnen dat de stichting Treat it Queer meer bekendheid krijgt door de richtlijn, en hierdoor sneller of makkelijker gevraagd wordt om projecten te organiseren of hieraan deel te nemen. Er spelen geen directe financiële belangen. (zie verder uitleg de belangenverklaring) |
18-2-2022 |
- |
|
Drs. M. Stolting |
Arts-onderzoeker NVDV |
- |
- |
- |
- |
05-06-2022 |
- |
|
E.N.J. Stronck |
Coördinator Poz&Proud, onderdeel van de hiv vereniging |
- |
- |
- |
- |
24-11-2022 |
- |
|
Dr. A.H. Teeuw |
Kinderarts sociale pediatrie, Emma Kinderziekenhuis-Amsterdam UMC |
- LECK kinderarts (onbetaald) - CSG kinderarts (onbetaald) |
- |
- |
- |
22-01-2023 |
- |
|
Dr. S.O. Verboeket |
Arts in opleiding tot verslavingsarts, SBOH / Stichting Arkin |
Lid actiegroep PrEPnu (voorheen voorzitterschap; vrijwilligerswerk) |
- |
- |
Als lid van actiegroep PrEPnu ben ik er bij gebaat dat PrEP beter en breder toegankelijk wordt dan op dit moment sprake van is. Met deze visie, en mede daardoor, ben ik betrokken bij de totstandkoming van deze richtlijn |
11-12-2022 |
- |
|
Dr. C.E. Vergunst |
- Dermatoloog GGD Amsterdam (18u per week - Dermatoloog Centrum Oosterwal, gedetacheerd NoordWestZiekenhuisgroep (18u per week) |
-Lid domeingroep SOA en huidinfecties (onbetaald) - Docent NSPOH (betaald) |
Recent gepubliceerd wetenschappelijk onderzoek mede van mijn hand zal in de nieuwe richtlijn verwerkt worden |
Betrokkenheid bij onderzoek naar klinische relevantie Mg infecties, momenteel intern gefinancierd door GGD Amsterdam, in verleden is studie deels gesponsord door Hologic (levering test-kits) |
-Bevestiging reputatie als expert op het gebied van SOA. -De richtlijn wordt ook doorgevoerd, voor zover van toepassing, in de door mij en mijn collega’s beheerde lokale protocollen van de GGD Amsterdam. |
14-02-2022 én |
- |
|
Dr. S.M.E. Vrouenraets |
Internist-infectioloog, OLVG. Tevens gedetacheerd vanuit OLVG naar AvL voor het uitvoeren HRA (hoog risico anoscopieën) en A-team werkzaamheden |
- |
- |
- |
- |
22-11-2022 |
- |
|
Drs. M.I.L.S. Werner |
Arts Maatschappij en Gezondheid, GGD Zuid Limburg |
- |
- |
- |
- |
23-11-2022 |
- |
|
Dr. M. van Westreenen |
Arts-microbioloog, Erasmus MC en STAR-SHL |
- GRAS werkgroep (onbetaald) - ECDC SOHO network focal point organs (onbetaald) |
- |
- |
- |
21-11-2022 |
- |
|
Dr. C. Zemouri |
- Onderzoeker COVID-19 aanbevelingen, Amsterdam Medisch Centrum - Zelfstandig onderzoeker en consultant, Zemouri Public Health Research & Consultancy |
- |
- |
- |
- |
06-04-2022 |
- |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door deelname van een aantal patiënten/sleutelpopulatie organisaties zoals Poz&Proud, PrEP.nu, en Treat it Queer. Afgevaardigden van deze organisaties waren aanwezig bij alle vergaderingen en hebben als auteurs en commentators een directe en actieve bijdrage geleverd aan het tot stand komen van de richtlijn.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt via het internet verspreid onder alle relevante beroepsgroepen en ziekenhuizen en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Tevens is er een samenvatting gemaakt inzake de belangrijkste wijzigingen en is de ‘MDR Soa App’ geüpdatet aan de hand van de wijzigingen voortvloeiende uit deze herziening; deze is voor iedereen beschikbaar die daar kennis van wil nemen. Het volledige implementatieplan is opgenomen in bijlage implementatieplan.
Werkwijze
Aanleiding
Op initiatief van de Nederlandse Vereniging voor Dermatologie en Venereologie en de Nederlandse Vereniging voor Medische Microbiologie is de richtlijn Seksueel Overdraagbare Aandoeningen (SOA) in 2022-2024 herzien. De laatste grote herziening dateert uit 2018. In 2019 heeft er een kleine modulaire herziening plaatsgevonden. Voor deze huidige herziening kwamen meerdere modules in aanmerking, omdat er relevante ontwikkelingen hebben plaatsgevonden omtrent epidemiologie (mpox en scabiës), therapie (chlamydia), testbeleid (chlamydia en Mycoplasma genitalium-infectie) en biomedische interventies (PrEP).
Knelpuntenanalyse
In de voorbereidingsfase heeft een bijeenkomst plaatsgevonden waarvoor alle belanghebbenden zijn uitgenodigd. Zie bijlage 2, tabel 2 voor de aanwezigheid van de verschillende partijen bij deze eerste bijeenkomst.
Samenstelling van de werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met geografische spreiding van de werkgroepleden en met evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden. Naast de afgevaardigden van de verschillende beroepsgroepen zijn er vertegenwoordigers van patiëntenverenigingen en belangenorganisaties betrokken geweest bij de ontwikkeling van de richtlijn. Zie bijlage 2, tabel 1 voor een volledig overzicht van de betrokken partijen.
Wetenschappelijke bewijsvoering
De voorlaatste update van de richtlijn dateert uit 2019, welke tot stand is gekomen op basis van commentaar op de vorige versie (2018), en evaluatie door de werkgroep. Er zijn toen geen substantiële wijzigingen aangebracht, maar storende fouten zoals in doseringen zijn gecorrigeerd en verduidelijkingen zijn waar nodig aangebracht. De richtlijnwerkgroep werkte in de periode 2021-2023 aan een nieuwe conceptrichtlijntekst. De werkgroepleden werden verdeeld in subgroepen die zich elk bogen over een module. Als basistekst is uitgegaan van de 2019 MDR Soa die eerder door de in Nederland aanwezige deelexperts zijn samengesteld.
De aanbevelingen uit deze richtlijn zijn, voor zover mogelijk, gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Voor een groot deel van de adviezen die in de richtlijn worden gegeven is onvoldoende bewijs voorhanden dat vandaag de dag noodzakelijk wordt geacht voor opname in een richtlijn. Zo is de huidige behandeling van syfilis terug te voeren op kennis en ervaring stammend uit het midden van de 20e eeuw, ver voor de implementatie van de ”evidence based medicine”-criteria die nu als standaard worden vereist als onderbouwing van medisch beleid. Er bestaat echter geen twijfel aan de keuze voor benzathinebenzylpenicilline als eerstekeuzebehandeling voor syfilis. Dit geldt overigens niet alleen voor seksueel overdraagbare aandoeningen; het overgrote deel van de 3000 dermatologische diagnoses kent geen behandeling die op stevig bewijs rust; toch bestaat ook daar behoefte aan therapeutische adviezen.
Er is in 2002 een Soa-richtlijn verschenen die geheel volgens de toen geldende standaard van wetenschappelijke bewijsvoering is opgesteld. Op basis van vooraf opgestelde vragen werden zoekopdrachten uitgevoerd en een poging tot beantwoording van de vragen gedaan. Helaas bleek voor de meest klinisch relevante ‘uitgangsvragen’ geen systematische onderbouwing vanuit de literatuur voorhanden (er kwamen geen adviezen met een bewijskracht boven niveau 4 uit). De meest prangende vragen omtrent diagnostiek en behandeling konden zodoende niet worden beantwoord en kwamen ook niet aan bod. Vanwege het teleurstellende resultaat en de kritiek op deze richtlijn is bij de volgende versie afgestapt van het model van vooraf opgestelde vragen en is weer gekozen voor de voorheen gehanteerde werkwijze zoals bij de 1997 richtlijn die bestond uit vaste paragrafen per syndroom en infectie (zoals epidemiologie, diagnostiek en behandeling). Vanaf 2012 is de richtlijn daarom hoofdzakelijk gebaseerd op een combinatie van de mening van de werkgroep (expert opinie) na uitvoerige discussie, aanvullend gericht literatuuronderzoek (niet systematisch beoordeeld) en recent gepubliceerde internationale en nationale richtlijnen, waarin naast standaarden van het Nederlands Huisartsen Genootschap (NHG), de Amerikaanse CDC, de Britse BASHH, de Europese IUSTI en de WHO-richtlijnen het meest leidend zijn geweest. De internationale richtlijnen volgen ook het door ons gekozen stramien van vaste paragrafen per syndroom/infectie die al dan niet is onderbouwd met wetenschappelijk onderzoek dan wel met expert opinie. Per hoofdstuk of passage wordt duidelijk gerefereerd naar nationale of internationale richtlijnen waaruit zaken overgenomen zijn. Daarnaast heeft er voor alle modules/hoofdstukken gedurende het gehele herzieningsproces, intensieve samenwerking met het RIVM/LCI plaatsgevonden. Daar waar geen gepubliceerd bewijs voorhanden was, is per definitie gebruik gemaakt van expert opinies zoals deze tijdens de verschillende overlegmomenten werden geformuleerd.
Voor de onderbouwing van de diagnostiek en behandel adviezen van chlamydiasis is wel meer bewijs voorhanden. Voor het hoofdstuk C1. Chlamydiasis (inclusief lymphogranuloma venereum) hebben we dankbaar gebruikgemaakt van de NHG-Standaard: Het soa-consult (NHG, 2022). Deze NHG-Standaard is recent (2022) voor wat betreft de non-LGV-chlamydia-infecties herzien door het Nederlands Huisartsen Genootschap, waarbij er gebruik is gemaakt van de GRADE-methodiek om meerdere uitgangsvragen te beantwoorden. Deze methodiek is terug te vinden in het document ‘totstandkoming en methoden’ van deze NHG-Standaard. Daar waar is afgeweken van het advies in deze standaard staat dat nadrukkelijk vermeld in de tekst. De hoofdstukken B1. Urethritis, B2. Fluor vaginalis en vaginitis, B3. Acute epididymitis (bij volwassenen) zijn eveneens grotendeels afkomstig uit de NHG-Standaarden en NHG-Behandelrichtlijnen (‘Het soa-consult’, ‘Fluor vaginalis’ en ‘Acute epididymitis bij volwassenen’’) met enkele aanpassingen en toevoegingen uit recentere literatuur. Voor achtergrondinformatie bij de tekst van dit hoofdstuk (inclusief een uitvoerige onderbouwing) verwijzen we naar de volledige NHG-Standaard en diens ‘totstandkoming en methoden’.
De conceptteksten werden tijdens verschillende subgroepvergaderingen en een eendaagse plenaire bijeenkomst besproken. De conceptteksten zijn vervolgens, na verwerking van de commentaren van verschillende betrokken wetenschappelijke en beroepsverenigingen en instanties, eind 2023 aangeboden ter autorisatie (zie: initiatief en autorisatie). De richtlijn biedt de mogelijkheid om per gezondheidechelon (0e lijn, GGD; 1e lijn, huisarts; 2e lijn, ziekenhuis) de meest geëigende keuzes te maken in het te voeren beleid. Dit houdt bijvoorbeeld in dat er verschillen kunnen bestaan in testbeleid voor urogenitale chlamydia-infecties tussen de verschillende echelons.
Belangrijkste wijzigingen
Zie de ‘Algemene inleiding’ van de MDR Soa.
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is gezocht naar en gebruik gemaakt van onderzoek waarvan de resultaten bijdragen aan een antwoord op relevante vraagstukken uit de klinische praktijk. Voor deze herziening is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om vraagstukken te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is te raadplegen in bijlage 4.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar, voor zover mogelijk, wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen, (patiënt)organisaties en stakeholders voorgelegd ter commentaar (zie ook tabel 2). De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter autorisatie.