Palliatie van dysfagie
Uitgangsvraag
Wat is de optimale behandeling voor palliatie van dysfagie bij het niet curabel oesofaguscarcinoom?
Aanbeveling
Geef kortdurend External Beam Radio Therapy (EBRT) (5x4 Gy) bij patiënten met dysfagie veroorzaakt door een incurabel oesofaguscarcinoom en een beperkte levensverwachting. Overweeg bij patiënten met een langere levensverwachting een hogere dosis.
Plaats een stent indien de levensverwachting korter is dan drie maanden, gezien het snelle effect op de verbetering van passageklachten.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Wanneer gekeken wordt naar de geïncludeerde studies, komt geen duidelijk beeld naar voren van een voorkeur voor external beam radiotherapie of brachytherapie voor de behandeling van patiënten met palliatie van dysfagie bij een niet curabel oesofaguscarcinoom. In de geïncludeerde studies is er geen directe vergelijking gemaakt tussen brachytherapie en external beam radiotherapie. Er is in de studies ook niet gekeken naar kwaliteit van leven. Wel lijkt er een voorkeur te zijn voor een combinatie van beide therapieën vergeleken met monotherapie wanneer wordt gekeken naar verbetering van dysfagieklachten; in de systematic review werd geen verschil gevonden in aantal complicaties. De twee therapievormen zijn wel directer met elkaar vergeleken in een onderzoek met een prospectief observationeel design, namelijk de POLDER-studie (Jeene, 2020). Uit deze studie blijkt dat kortdurende external beam radiotherapie (5 fracties van 4Gy) minstens zo effectief is als brachytherapie op het verminderen van dysfagieklachten en dat dysfagieklachten sneller minder werden bij external beam radiotherapie dan bij brachytherapie. Ook is er in dezelfde POLDER-studie gekeken naar patient reported outcomes zoals kwaliteit van leven, waarbij er een voorkeur bleek voor EBRT op basis van scores op misselijkheid, overgeven, pijn en eetlustvermindering (van Rossum, 2021).
In het onderzoek uitgevoerd door Vermeulen in 2020 werden 292 patiënten retrospectief geanalyseerd, waarbij een vergelijking werd gemaakt tussen lage dosis externe radiotherapie (5x4 Gy) en hoge dosis radiotherapie (10x3 Gy EBRT gevolgd door 1x12 Gy brachytherapie). Het onderzoek vond plaats in Nederland, bij het Radboud Universitair Medisch Centrum Nijmegen en Radiotherapiegroep. Het primaire resultaat was verbetering van dysfagie zes weken na het begin van de stralingstherapie. Bijkomende resultaten waren aanhoudende en terugkerende dysfagie gedurende het resterende leven van de patiënten, ernstige bijwerkingen en overleving. Uit deze studie bleek dat een hogere dosis EBRT gevolgd door een brachyboost na 6 weken termijn vergelijkbare verbetering gaf van dysfagie als een lage dosis EBRT. Wel trad er na een hogere dosis radiotherapie minder vaak terugkeer op van dysfagieklachten. Dit werd bevestigd in de studie van Walterbos in 2019, echter waren dit kleine en heterogene groepen. Er was geen verschil in toxiciteit.
Overige behandelopties bij dysfagie
In twee gerandomiseerde onderzoeken (Adam, 1997 en Dallal, 2001) werden laserbehandeling en stentplaatsing met elkaar vergeleken. In het onderzoek van Adam et al. werd alleen wat betreft het aantal behandelingen voor hernieuwde passageklachten een verschil gevonden, namelijk 12% voor laser en 33% voor stentplaatsing (27). Patiënten die met de laser werden behandeld, ondergingen echter elke vier weken een vervolgbehandeling, zodat laserbehandelde patiënten waarschijnlijk toch vaker een behandeling ondergingen. In het onderzoek van Dallal et al. was het enige verschil dat laserbehandelde patiënten, die met intervallen van vier tot zes weken werden behandeld, significant langer leefden dan patiënten die een stent kregen (28). Dit verschil is echter, gezien het biologisch gedrag van een inoperabel oesofaguscarcinoom, moeilijk te begrijpen. Verder werd in dit onderzoek gevonden dat de kwaliteit van leven sneller achteruitging in de stentgroep, wat wellicht uit het verschil in overleving te verklaren valt, terwijl de behandelingskosten van laser hoger waren. Concluderend lijken stentplaatsing en laserbehandeling even effectief wat betreft de verbetering van passageklachten op korte termijn, maar heeft laserbehandeling het nadeel dat patiënten elke vier tot zes weken dienen terug te komen voor een vervolgbehandeling.
In de SIREC-trial werden patiënten gerandomiseerd tussen brachytherapie en stentplaatsing. Beide interventies gaven goede verlichting van dysfagie, waarbij het effect van een stent sneller optrad maar het effect van brachytherapie langer aanhield. De auteurs concludeerden dat een stent de eerste keus heeft bij patiënten met een prognose van minder dan 3 maanden en dat bij een betere prognose brachytherapie de voorkeur heeft.
Voor wat betreft de radiotherapie-dosis lijkt een dosis van 5x4 Gy voor kortdurende palliatie bij patiënten met gemetastaseerde ziekte vergelijkbaar met brachytherapie. Er zijn aanwijzingen dat een hogere bestralingsdosis een langduriger effect heeft op de dysfagie. Of een hogere dosis te prefereren is boven een eventuele herbestraling is onbekend.
Het valt te overwegen om bij patiënten met beperkte dysfagie die gaan starten met systemische therapie eerst het effect van systeemtherapie af te wachten.
Kosten, aanvaardbaarheid, haalbaarheid en implementatie
EBRT is beter beschikbaar, minder invasief en heeft lagere kosten en een eenvoudiger logistiek. Daarmee gaat de voorkeur uit naar EBRT.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Plaats een stent indien de levensverwachting korter is dan drie maanden, gezien het snelle effect op de verbetering van passageklachten.
Bij een geschatte levensverwachting van meer dan drie maanden gaat de voorkeur uit naar radiotherapie gezien het langer aanhoudende effect. Aangezien er geen voordeel lijkt te zijn voor brachytherapie ten opzichte van EBRT spelen andere argumenten een rol in de keuze tussen EBRT en brachytherapie. Gelet op de betere beschikbaarheid van EBRT, het non-invasieve karakter, de lagere kosten en de eenvoudigere logistiek rondom EBRT gaat de voorkeur uit naar EBRT.
Onderbouwing
Achtergrond
Dysphagia is common in esophageal cancer. Managing dysphagia in patients with incurable esophageal carcinoma is crucial to enhance their quality of life and promote well-being. In the Netherlands, various treatments are employed to alleviate dysphagia in cases of incurable esophageal carcinoma, namely brachytherapy, stent placement, and external beam radiotherapy.
Conclusies
Improvement of Dysphagia
|
Very low GRADE |
The evidence is very uncertain on the effect of brachytherapy versus external beam radiotherapy on reducing dysphagia in patients with palliation of dysphagia in incurable esophageal cancer.
Source: Sur, 2004; Rosenblatt, 2010; Yadav, 2007 |
Quality of Life
|
No GRADE |
No evidence from randomised studies was found regarding the effect of brachytherapy and/or external beam radiotherapy on quality of life for patients with palliation of dysphagia in incurable esophageal cancer.
Source: - |
Adverse events
|
Very low GRADE |
The evidence is very uncertain on the number of adverse events occurring in patients treated with brachytherapy versus external beam radiotherapy in patients with palliation of dysphagia in incurable esophageal cancer.
Source: Sur, 2004; Rosenblatt, 2010 |
Samenvatting literatuur
Description of studies
Three studies were found that compared the two treatment modalities in combination in a randomized setting; two studies compared brachytherapy monotherapy with brachytherapy plus external beam radiotherapy (sur, 2004 and Rosenblatt, 2010), and one study compared external beam radiotherapy (EBRT) with or without brachytherapy (Yadav 2007). No randomized studies were found that compared the two modalities directly. One Cochrane review was included where one comparison was relevant for the current topic (Yang, 2014). In the relevant comparison of this review, no other studies were included then two of the three described original studies (Sur, 2004 and Rosenblatt, 2010).
Sur (2004)
In the study executed by Sur in 2004, in the Johannesburg Hospital in South-Africa, two methods of palliation of dysphagia are compared in combination: high-dose-rate intraluminal brachytherapy (2x8 Gy HDR) alone versus high-dose-rate intraluminal brachytherapy with external beam therapy (10x3 Gy EBRT). A total of 60 non-metastatic squamous cell carcinoma patients were randomized to one of these two arms. The participants were followed for a year, and dyspgahia-free survival, and overall survival were measured, as well as adverse effects.
Rosenblatt (2010)
In the study executed by Rosenblatt in 2010, 219 squamous cell carcinoma patients were randomized in a multi-center study in six countries (Brazil, Croatia, China, India. South-Africa and Sudan) to either high-dose-rate intraluminal brachytherapy alone (2x8 Gy HDR), or high-dose-rate intraluminal brachytherapy with external beam therapy (10x3 Gy EBRT). The median follow-up rate was 197 days, and primary outcome was dysphagia relief experience. Other outcomes were performance status, weight and adverse events.
Yadav (2007)
In the study executed by Yadav in 2007, 116 squamous cell carcinoma patients were randomized to either external beam radiotherapy (EBRT) with two sessions of brachytherapy (ILBT), or EBRT alone in two different doses (high and low). The study took place in the Chandigarh Postgraduate Institute of Medical Education and Research, India. The median follow-up was 9 months, and the included outcomes were Improvement in Mean Dysphagia Grade, barium/endoscopy response and toxicity score.
Results
Improvement of dysphagia
In the study by Sur (2004), dysphagia was measured with a scoring system that defined dysphagia as 1: no dysphagia, 2: dysphagia to solids, 3: dysphagia to semisolids, 4: dysphagia to liquids and 5: total dysphagia. These scores were not analyzed, only dysphagia free survival was used as an outcome. This did not differ between the two groups after 12 months.
In the study by Rosenblatt (2010), dysphagia was defined as Dysphagia-relief experience (DRE) and measured similarly as in the study by Sur (2004). A log-rank test was performed on the proportion of participants without a dysphagia event between the study arms, and the estimated differences in absolute percent chance of not having experienced a dysphagia-event when high-dose-rate intraluminal brachytherapy was added were +16.0% after 100 days, +17.8% after 200 days and +19.0% after 300 days. Cox regression analyses were conducted hierarchically. For the addition of EBRT the p-value was 0.022, ignoring other variables. Then, during stepwise addition of covariates, p-values were always <0.02, and the final p-value was 0.014 in favor of a combined therapy, stratified by country. No other variable was significantly associated with DRE once the addition of EBRT was taken into account.
In the study by Yadav (2007), dysphagia relief was measured according to the WHO grading. The study reports that the study arm of EBRT plus ILBT had a maximum improvement of 36.7%, followed by the study arm of EBRT alone in high dose with a maximum improvement of 28.6% in dysphagia. After 1 month there was no further improvement in dysphagia in all the three arms. At 6 months, improvement in mean dysphagia grade in the EBRT plus ILBT arm was 21%, in the EBRT in high dose arm it was 15.6%; while in the EBRT in low dose arm it was only 14.2%.
Quality of life
No included study used quality of life as an outcome in their trials.
Complications/adverse events
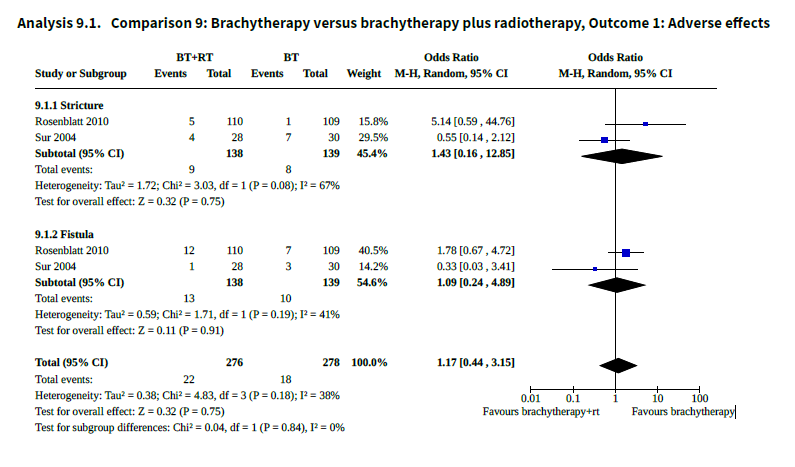
In the Cochrane review done by Yang (2014), the outcome of adverse events was evaluated (among other outcomes and comparisons). The studies of Sur (2004) and Rosenblatt (2010) were included in this systematic review on the outcome of adverse events. The meta-analysis is summarized in Figure 1. The number of adverse events did not differ significantly between the groups of brachytherapy versus brachytherapy plus radiotherapy.
In the study by Yadav (2007), radiation toxicity was reported, but not analyzed.
Figure 1. Meta-analysis of adverse events within brachytherapy versus brachytherapy plus radiotherapy (Yang 2014)
Level of evidence of the literature
The level of evidence regarding the outcome measure Improvement of Dysphagia was downgraded by three levels: one level because of study limitations (risk of bias) due to the unblinded study design of the included studies; one level because of applicability since the compared arms in the study were not similar to those defined in the PICO (bias due to indirectness); and one level because of the limited number of included patients (imprecision).
The level of evidence regarding the outcome measure Adverse events was downgraded by three levels: one level because of study limitations (risk of bias) due to the unblinded study design of the included studies; one level because of applicability since the compared arms in the study were not similar to those defined in the PICO (bias due to indirectness); and one level because of the limited number of included patients (imprecision).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
P: Patients with palliation of dysphagia in incurable esophageal cancer
I: Brachytherapy
C: External beam radiotherapy
O: Improvement of dysphagia (validated scale), quality of life (validated scale), complications/adverse events
Relevant outcome measures
The guideline development group considered improvement of dysphagia, quality of life, complications/adverse events as a critical outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined a difference on 10 points on the Quality of Life scale and a difference of 1 point on the Mellow & Inkas scale as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until May 22nd, 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 102 hits. Studies were selected based on the following criteria: following the right PICO, methodology of SR or RCT. Twelve studies were initially selected based on title and abstract screening. After reading the full text, eight studies were excluded (see the table with reasons for exclusion under the tab Methods), and four studies were included (of which one Cochrane review).
Results
Three randomised studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- 1 - Adam A, Ellul J, Watkinson AF, Tan BS, Morgan RA, Saunders MP, Mason RC. Palliation of inoperable esophageal carcinoma: a prospective randomized trial of laser therapy and stent placement. Radiology. 1997 Feb;202(2):344-8. Doi: 10.1148/radiology.202.2.9015054. PMID: 9015054.
- 2 - Dallal HJ, Smith GD, Grieve DC, Ghosh S, Penman ID, Palmer KR. A randomized trial of thermal ablative therapy versus expandable metal stents in the palliative treatment of patients with esophageal carcinoma. Gastrointest Endosc. 2001 Nov;54(5):549-57. Doi: 10.1067/mge.2001.118947. PMID: 11677469.
- 3 - Jeene PM, Vermeulen BD, Rozema T, Braam PM, Lips I, Muller K, van Kampen D, Homs MYV, Oppedijk V, Berbée M, van Rossum PSN, El Sharouni S, Siersema PD, Hulshof MCCM; POLDER Study Group. Short-Course External Beam Radiotherapy Versus Brachytherapy for Palliation of Dysphagia in Esophageal Cancer: A Matched Comparison of Two Prospective Trials. J Thorac Oncol. 2020 Aug;15(8):1361-1368. Doi: 10.1016/j.jtho.2020.04.032. Epub 2020 May 11. PMID: 32407795.
- 4 - Rosenblatt E, Jones G, Sur RK, Donde B, Salvajoli JV, Ghosh-Laskar S, Frobe A, Suleiman A, Xiao Z, Nag S. Adding external beam to intra-luminal brachytherapy improves palliation in obstructive squamous cell oesophageal cancer: a prospective multi-centre randomized trial of the International Atomic Energy Agency. Radiother Oncol. 2010 Dec;97(3):488-94. Doi: 10.1016/j.radonc.2010.09.001. Epub 2010 Oct 13. PMID: 20950882.
- 5 - Sur R, Donde B, Falkson C, Ahmed SN, Levin V, Nag S, Wong R, Jones G. Randomized prospective study comparing high-dose-rate intraluminal brachytherapy (HDRILBT) alone with HDRILBT and external beam radiotherapy in the palliation of advanced esophageal cancer. Brachytherapy. 2004;3(4):191-5. Doi: 10.1016/j.brachy.2004.09.004. PMID: 15607150.
- 6 - Van Rossum PSN, Jeene PM, Rozema T, Braam PM, Lips IM, Muller K, van Kampen D, Vermeulen BD, Homs MYV, Oppedijk V, Berbée M, Hulshof MCCM, Siersema PD, El Sharouni SY. Patient-reported outcomes after external beam radiotherapy versus brachytherapy for palliation of dysphagia in esophageal cancer: A matched comparison of two prospective trials. Radiother Oncol. 2021 Feb;155:73-79. Doi: 10.1016/j.radonc.2020.10.009. Epub 2020 Oct 14. PMID: 33065190.
- 7 - Vermeulen BD, Jeene PM, Sijben J, Krol R, Rütten H, Bogers JA, Braam PM, Siersema PD. Low-Dose Versus High-Dose Radiation Therapy for the Palliation of Dysphagia From Esophageal Cancer: A Multicenter Retrospective Cohort Study. Pract Radiat Oncol. 2020 Jul-Aug;10(4):e255-e263. Doi: 10.1016/j.prro.2019.10.010. Epub 2019 Oct 24. PMID: 31669401.
- 8 - Walterbos NR, Fiocco M, Neelis KJ, van der Linden YM, Langers AMJ, Slingerland M, de Steur WO, Peters FP, Lips IM. Effectiveness of several external beam radiotherapy schedules for palliation of esophageal cancer. Clin Transl Radiat Oncol. 2019 Apr 24;17:24-31. doi: 10.1016/j.ctro.2019.04.017. PMID: 31193091; PMCID: PMC6517531.
- 9 - Yadav BS, Kapoor R, Sharma SC, Kochhar R, Patel FD. Radiation schedules for palliation in carcinoma esophagus. JK Science: Journal of Medical Education & Research. 2007 9.3: 127.
- 10 - Yang C, Li J, Fu W, Xu W, Yang S. Interventions for dysphagia in oesophageal cancer. Cochrane Database of Systematic Reviews 2014, Issue 10. Art. No.: CD005048. DOI: 10.1002/14651858.CD005048.pub4. Accessed 10 October 2023.
Evidence tabellen
Evidence tables
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control I 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Sur, 2004 |
Type of study: One-centred randomized controlled trial
Setting and country: Johannesburg Hospital, University of Witwatersrand, Johannesburg, South-Africa
Funding and conflicts of interest: The study was supported by technical contract no. 302-E3- SAF-10800 of the International Atomic Energy Agency, Vienna, Austria. There is no conflicts of interest statement. |
Inclusion criteria: lesion in the thoracic esophagus; Inoperable advanced disease; histologically proven squamous cell carcinoma; and an ECOG performance score of 0–2
Exclusion criteria: evidence of distant metastasis; involvement of tncogenheo-bronchial tree on bronchoscopy and/or barium swallow
N total at baseline: Intervention: 30 Control: 30
Important prognostic factors2: age ± SD: I: 52.8 (38-69) C: 54.0 (33-70)
Sex: I: 63% M C: 70% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Treatment with high-dose-rate intraluminal brachytherapy (HDRILBT) with a Microselectron HDR unit followed by external beam radiotherapy (named Group B in the study)
|
Describe control (treatment/procedure/test):
Treatment with high-dose-rate intraluminal brachytherapy (HDRILBT) with a Microselectron HDR unit alone (named Group A in the study) |
Length of follow-up: 1 year
Loss-to-follow-up: Intervention: N=2 (7%) Reasons: these two participants refused treatment with EBRT because they had no dysphagia at the time of randomization. These participants were excluded from the analysis and subsequently lost to follow-up
Control: No loss to follow-up
Incomplete outcome data: No incomplete outcome data
|
Outcome measures and effect size (include 95%CI and p-value if available):
There was no statistically significant difference (p>0.05) in DFS between the two groups at the end of 12 months. The overall survival of the two groups was also similar (p>0.05). The median survival for Group A was 7.2 months, whereas for Group B it was 7.5 months. The addition of EBRT did not appear to improve DFS or OS in this analysis.
In terms of adverse effects potentially attributable to radiotherapy, 11 patients developed strictures (7 patients in Group A and 4 in Group B, p>0.05). Furthermore, 4 patients had progressive luminal disease that progressed to fistula (3 in Group A and 1 in Group B, p>0.05). |
Pilot study, therefore underpowered |
|
Rosenblatt, 2010 |
Type of study: Multi-centred, international randomized controlled trial
Setting and country: The study was executed in Brazil, Croatia, China, India. South-Africa and Sudan
Funding and conflicts of interest: sponsorship of this trial has been the International Atomic Energy Agency (IAEA) under Coordinated Research Project E3.30.21. Authors declare no conflicts of interest. |
Inclusion criteria: dysphagia prior to treatment; performance status Eastern Cooperative Oncology Group (ECOG) 1 to 2 (19); squamous cell carcinoma of the oesophagus; Successful completion of one HDRBT insertion; and signed informed consent
Exclusion criteria: fistulae at baseline; perforation during the first HDRBT; prior therapy (e.g. chemotherapy, laser, surgery, stent) except one prior dilatation; disease beyond the mediastinum, or being eligible and agreeing to potentially curative therapies
N total at baseline: Intervention: 110 Control: 109
Important prognostic factors2: age: I: 60.7 C: 61.9
Sex: I: 64% M C: 54 % M
Groups comparable at baseline? Yes, no significant differences between the two groups
|
Describe intervention (treatment/procedure/test):
HDRBT plus EBRT |
Describe control (treatment/procedure/test):
HDRBT alone |
Length of follow-up: Median: 197 days
Loss-to-follow-up: Intervention: None reported
Control: None reported
Incomplete outcome data: None reported |
Outcome measures and effect size (include 95%CI and p-value if available):
Overall survival: There was no effect of the intervention on overall survival: ‘Overall survival was significantly influenced by both age and ECOG on a univariate log-rank analysis. Step-wise regression led to a model with only older age (p = 0.002) and lower ECOG (p = 0.038) as significant predictors of better survival. Thus, randomization to EBRT was clearly not associated with improved overall survival.’
Important clinical events See table 1
Dysphagia-relief experience (DRE) At 100 days, the DRE was 66.7% with HDRBT alone, but it was 82.7% with combined therapy. At 200 days, the respective values were 51.8 and 69.6%; at 300 days these were 36.9 and 55.9%, indicating a continued benefit. Therefore the estimated differences in absolute percent chance of not having experienced a dysphagia-event, and in favor of the addition of EBRT to HDRBT were +16.0%, +17.8% and +19.0%, respectively.
Cox regression analyses were conducted hierarchically. For the addition of EBRT the p-value was 0.022, ignoring other variables.
|
|
|
Yadav, 2007 |
Type of study: RCT
Setting and country: Department of radiotherapy and gastroenterology, PGIMER, Chandigarh, India
Funding and conflicts of interest: None disclosed in the article, funding also not disclosed |
Inclusion criteria: biopsy proven squamous cell carcinoma, tumor more than or equal to 5 cm in length on endoscopy and/or barium swallow, surgically inoperable disease, age; 17 to 70 years, Karnofsky performance score > 50 and no prior malignancy in the past 5 years.
N total at baseline: Intervention: 38 Control: Arm B 40, arm C 38
Important prognostic factors2: No analyses done. Groups comparable at baseline? Endoscopic status may differ significantly between groups.
|
Describe intervention (treatment/procedure/test):
Arm A: external beam radiation (EBRT) to a dose of 30Gy/10 #/2 weeks along with two sessions of intraluminal brachytherapy (ILBT), 600cGy each, one week apart, after a gap of two weeks from EBRT
|
Describe control (treatment/procedure/test):
Arm B: only EBRT to a dose of 30Gy/10 #/2 weeks
Arm C: EBRT to a dose of 20Gy/5#/1week without brachytherapy |
Length of follow-up: Median 9 months (range 3-34 months)
Loss-to-follow-up: Intervention: N= 2(6%) Reasons (describe) Reasons not described
Control: Arm B: N=2 (5.7%) Arm C: N=5 (14%) Reasons not described
Incomplete outcome data: None reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Improvement in Mean Dysphagia Grade Arm-A had maximum improvement of 36.7%, followed by Arm-B 28.6%. After 1 month there was no further improvement in dysphagia in all the three arms. At 6 months, improvement in mean dysphagia grade in Arm-A was 21%, in Arm-B it was 15.6%; while in Arm- C it was only 14.2%.
Barium/endoscopy Response On barium swallow / endoscopic assessment; at 3 months of interval in Arm-A 68.8% of patients had shown improvement while 32.2% had stable disease. In Arm-B 61.2% had improvement and 39.8% were with stable disease. In Arm-C, only 45.6% patients had improvement. At six months, 53.8% of patients in Arm-A had improvement and 26.6% had stable disease. In Arm-B results were 33.6%and 24.6% respectively. In Arm-C only 22.6% of patients had improvement, while 16.9% had stable disease.
Toxicity score See table 2 |
No conflicts of interest disclosed |
Risk of bias table
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Sur, 2004 |
Definitely yes
Reason: A random number table was used |
No information
|
Definitely no
Reason: Patients and health care providers were not blinded, no information on blinding of data collectors and analysts |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes;
Reason: All relevant outcomes were reported |
Probably no
Reason: Pilot study and therefore underpowered |
HIGH
Unblinded and underpowered study |
|
Rosenblatt, 2010 |
Definitely yes;
Reason: Central randomization by Data Management Centre, stratified by centres with 1-to-1 allocation |
No information |
Definitely no
Reason: Patients and health care providers were not blinded, no information on blinding of data collectors and analysts |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
Some concerns |
|
Yadav, 2007 |
Definitely yes
Reason: Tippet’s random number table was used |
No information |
Definitely no
Reason: Patients and health care providers were not blinded, no information on blinding of data collectors and analysts |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
Some concerns |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Chakarova A, Karanov S, Petkova E, Bakardjiev S, Bogdanov G. Brachytherapy after laser recanalization versus external beam radiotherapy after laser recanalization versus laser alone in inoperable oesophagocardial cancer: a controlled pilot study. J BUON. 2005 Oct-Dec;10(4):511-6. PMID: 17357209. |
Not the pre-defined treatment modalities of interest |
|
Eldeeb H, Reza S, Shmueli U, Logsdail G, Hinks P, Mukherjee S. External beam radiotherapy versus brachytherapy in the management of malignant oesophageal dysphagia: a retrospective study. J BUON. 2012 Jul-Sep;17(3):508-11. PMID: 23033290. |
Observational study |
|
Hanna WC, Sudarshan M, Roberge D, David M, Waschke KA, Mayrand S, Alcindor T, Ferri LE. What is the optimal management of dysphagia in metastatic esophageal cancer? Curr Oncol. 2012 Apr;19(2):e60-6. doi: 10.3747/co.19.892. PMID: 22514498; PMCID: PMC3320233. |
Observational study |
|
Jeene PM, Vermeulen BD, Rozema T, Braam PM, Lips I, Muller K, van Kampen D, Homs MYV, Oppedijk V, Berbée M, van Rossum PSN, El Sharouni S, Siersema PD, Hulshof MCCM; POLDER Study Group. Short-Course External Beam Radiotherapy Versus Brachytherapy for Palliation of Dysphagia in Esophageal Cancer: A Matched Comparison of Two Prospective Trials. J Thorac Oncol. 2020 Aug;15(8):1361-1368. doi: 10.1016/j.jtho.2020.04.032. Epub 2020 May 11. PMID: 32407795. |
Observational study |
|
Lancellotta V, Cellini F, Fionda B, De Sanctis V, Vidali C, Fusco V, Barbera F, Gambacorta MA, Corvò R, Magrini SM, Tagliaferri L. The role of palliative interventional radiotherapy (brachytherapy) in esophageal cancer: An AIRO (Italian Association of Radiotherapy and Clinical Oncology) systematic review focused on dysphagia-free survival. Brachytherapy. 2020 Jan-Feb;19(1):104-110. doi: 10.1016/j.brachy.2019.09.005. Epub 2019 Oct 18. PMID: 31636025. |
Not the pre-defined treatment modalities of interest |
|
Opstelten JL, de Wijkerslooth LR, Leenders M, Bac DJ, Brink MA, Loffeld BC, Meijnen-Bult MJ, Minderhoud IM, Verhagen MA, van Oijen MG, Siersema PD. Variation in palliative care of esophageal cancer in clinical practice: factors associated with treatment decisions. Dis Esophagus. 2017 Feb 1;30(2):1-7. doi: 10.1111/dote.12478. PMID: 26919349. |
Observational study |
|
Pichel RC, Araújo A, Domingues VDS, Santos JN, Freire E, Mendes AS, Romão R, Araújo A. Best Supportive Care of the Patient with Oesophageal Cancer. Cancers (Basel). 2022 Dec 19;14(24):6268. doi: 10.3390/cancers14246268. PMID: 36551753; PMCID: PMC9776873. |
Narrative review (although systematic search is in place) |
|
van Rossum PSN, Jeene PM, Rozema T, Braam PM, Lips IM, Muller K, van Kampen D, Vermeulen BD, Homs MYV, Oppedijk V, Berbée M, Hulshof MCCM, Siersema PD, El Sharouni SY. Patient-reported outcomes after external beam radiotherapy versus brachytherapy for palliation of dysphagia in esophageal cancer: A matched comparison of two prospective trials. Radiother Oncol. 2021 Feb;155:73-79. doi: 10.1016/j.radonc.2020.10.009. Epub 2020 Oct 14. PMID: 33065190. |
Observational study |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-09-2024
Laatst geautoriseerd : 01-09-2024
Geplande herbeoordeling : 01-09-2029
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van het cluster) die betrokken zijn bij de zorg voor patiënten met oesofagus- en maagcarcinoom.
Het cluster oesofagus- en maagcarcinoom bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule. Het cluster oesofagus- en maagcarcinoom bestaat uit de volgende personen:
Clusterstuurgroep
- Dhr. Prof. Dr. P.D. (Peter) Siersema (voorzitter), maag-darm-leverarts, Erasmus MC, Rotterdam; NVMDL
- Mevr. Dr. R.E. (Roos) Pouw, maag-darm-leverarts, Amsterdam UMC, Amsterdam; NVMDL
- Mevr. Dr. A. (Annemarieke) Bartels – Rutten, radioloog, NKI-AVL, Amsterdam; NVvR
- Dhr. Prof. Dr. M.I. (Mark) van Berge Henegouwen, chirurg, Amsterdam UMC, Amsterdam; NVvH
- Dhr. Prof. Dr. R. (Richard) van Hillegersberg, chirurg, UMC Utrecht, Utrecht; NVvH
- Dhr. M.C.C.M. (Maarten) Hulshof MD PhD, Radiotherapeut, Amsterdam UMC, Amsterdam; NVRO (neemt geen deel meer)
- Mevr. Dr. H.W.M. (Hanneke) van Laarhoven, internist, Amsterdam UMC, Amsterdam; NIV
- Mevr. Dr. E.M. (Liesbeth) Timmermans, bestuurslid Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal; SPKS (tot 1 december 2023)
- Dhr. Dr. E. (Erik) Vegt, nucleair geneeskundige, Erasmus MC, Rotterdam; NVNG
Clusterexpertisegroep
- Dhr. Drs. W.W. (Weibel) Braunius, keel-neus-oorarts, UMC Utrecht, Utrecht; NVKNO
- Mevr. Dr. M.J. (Marc) van Det, chirurg, Ziekenhuisgroep Twente; NVvH
- Mevr. Dr. S.S. (Suzanne) Gisbertz, chirurg, Amsterdam UMC, Amsterdam; NVvH
- Mevr. Dr. N.C.T. (Nicole) van Grieken, patholoog, Amsterdam UMC, Amsterdam; NVVP
- Dhr. R. (Ronald) Hoekstra, internist, Ziekenhuisgroep Twente; NIV
- Dhr. R. (Remco) Huiszoon MBA, ervaringsdeskundige en bestuurslid Stichting voor Patiënten met kanker aan het Spijsverteringskanaal excl. darmkanker; SPKS
- Dhr. P.M. (Paul) Jeene MD, radiotherapeut, Radiotherapiegroep; NVRO
- Dhr. Dr. S.M. (Sjoerd) Lagarde, chirurg, Erasmus MC, Rotterdam; NVvH
- Dhr. Dr. R.W.F. (Roelof) van Leeuwen, ziekenhuisapotheker, Erasmus MC, Rotterdam; NVZA
- Dhr. Dr. S.L. (Sybren) Meijer, patholoog, Amsterdam UMC, Amsterdam; NVVP
- Mevr. B. (Bianca) Mostert, internist, Erasmus MC, Rotterdam; NIV
- Mevr. C.T. (Kristel) Muijs MD PhD, radiotherapeut, UMCG, Groningen; NVRO
- Mevr. L. (Luidmila) Peppelenbosch – Kodach, patholoog, NKI-AVL, Amsterdam; NVVP
- Mevr. Drs. H. (Heidi) Rütten, radiotherapeut, Radboud UMC, Nijmegen; NVRO
- Mevr. M. (Marije) Slingerland, internist, LUMC, Leiden; NIV
- Mevr. Prof. Dr. V.M.C.W. (Manon) Spaander, maag-darm-leverarts, Erasmus MC, Rotterdam; NVMDL
- Mevr. M.E. (Manon) Dik, verpleegkundig specialist, Ziekenhuisgroep Twente; V&VN
- Dhr. C.C.G. (Carlo) Schippers, verpleegkundig specialist, UMC Utrecht, Utrecht; V&VN
Met ondersteuning van:
- Mevr. S.N. (Sarah) van Duijn MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. M. (Miriam) te Lintel Hekkert MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. Dr. C.M.W. (Charlotte) Gaasterland, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Siersema (Voorzitter) |
MDL-arts en Hoofd Endoscopisch Centrum, Radboud University Medical Center
|
Editor in Chief, Endoscopy |
Research funding/advisory board zonder invloed op deze richtlijn |
Geen restrictie |
|
Pouw (tijdelijke voorzitter) |
MDL-arts Amsterdam UMC |
Bestuurslid DUCG - onbetaald. Bestuurslid young ISDE - onbetaald. Bestuurslid Barrett Expertise Centra - onbetaald. Lid beoordelingscommissie ontwikkeling en implementatie KWF - onbetaald. Nationaal afgevaardigde NVMDL voor UEG - onbetaald. Projectleider KWF (PREFER studie). Studie protocol (inclusief inclusie criteria) PREFER studie staat vast. Publicatie resultaten worden pas over vijf jaar verwacht, ruim na datum publicatie richtlijnmodule endoscopische behandeling vroegcarcinoom maag. |
Betaalde deelname aan onderwijscursus georganiseerd door Medtronic Betaald adviseurschap voor Medtronic BV. (scholing en webminar endoscopische behandeling vroege afwijking in slokdarm, geen belang bij gebruik producten) Betaald adviseurschap voor MicroTech Europe (webminar, symposium, m.n. behandeling van lekkages na slokdarmoperaties) |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module;
|
|
Timmermans |
- Bestuurslid SPKS (Stichting voor Patiënten met kanker aan het Spijsverteringskanaal) 5 uur per week - Gedragswetenschappelijk docent huisartsenopleiding Eerstelijnsgeneeskunde Radboudumc |
Onbetaald vrijwilligerswerk Bestuurslid SPKS (15 uur per week) |
Geen |
Neemt geen deel meer aan cluster - Geen restrictie
|
|
Van Laarhoven |
Hoofd afdeling medische oncologie, Amsterdam UMC |
- Wetenschappelijke raad KWF (onbetaald) - Voorzitter ESMO upper GI faculty (onbetaald) - Lid ESMO Leadership Generation programme (onbetaald) - Lid EORTC upper GI strategy commiittee (onbetaald) |
- Consultant or advisory role: Amphera, AstraZeneca, Beigene, BMS, Daiichy-Sankyo, Dragonfly, Eli Lilly, MSD, Nordic Pharma, Servier - Research funding and/or medication supply: Bayer, BMS, Celgene, Janssen, Incyte, Eli Lilly, MSD, Nordic Pharma, Philips, Roche, Servier - Speaker role: Astellas, Benecke, Daiichy-Sankyo, JAAP, Medtalks, Novartis, Travel Congress Management B.V Employment and leadership: Amsterdam UMC, the Netherlands (head of the department of medical oncology) Honorary: ESMO (chair upper GI faculty) |
Geen restrictie |
|
Bartels |
Radioloog, Antoni van Leeuwenhoek |
Geen |
Geen |
Geen restrictie |
|
Van Berge Henegouwen |
Chirurg slokdarm en maagchirurgie Amsterdam UMC Hoogleraar slokdarm en maagchirurgie Universiteit van Amsterdam |
- bestuur DUCA, DICA en voorzitter werkgroep Upper GI (allen onbetaald). |
- Olympus financiering studie (researcher initiated grant) Stryker financiering studie (researcher initiated grant) uitkomsten richtlijn geen invloed op deze bedrijven of studies - Consultancy voor meerdere bedrijven (B. Braun en Viatris) (uitbetaling aan Amsterdam UMC), niet gerelateerd aan richtlijn. |
Geen restrictie |
|
Hulshof |
Radiotherapeut oncoloog Amsterdam UMC |
Geen |
Geen |
Neemt geen deel meer aan cluster - Geen restrictie |
|
Van Hillegersberg |
Chirurg, UMC Utrecht |
Proctor Intuitive Surgical Consultant Medtronic |
- Bestuur DUCA, DICA |
Geen restrictie |
|
Vegt |
Nucleair geneeskundige, Afdeling Radiologie en Nucleaire Geneeskunde, Erasmus MC, Rotterdam |
Geen |
- ZonMW-subsidie voor de PLASTIC-studie, programma doelmatigheid van zorg, naar de kosten-effectiviteit van FDG-PET/CT en laparoscopie bij maagcarcinoom. |
Geen restrictie |
|
Van Rossum |
[volgt] |
[volgt] |
[volgt] |
[volgt] |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Huiszoon |
ING Bank N.V. Agile coach expert, full-time |
Buddy voor slokdarmkanker patiënten bij het SPKS, onbetaald. Vanuit persoonlijke ervaring 'klankbord' zijn voor patiënten die nu dezelfde ziekte hebben als ik in 2017 heb gehad |
Neemt deel namens SPKS en hoopt vanuit dat perspectief als ervaringsdeskundige bij te kunnen dragen. Geen boegbeeldfunctie of ander belang |
Geen restrictie |
|
Braunius |
Oncologisch Hoofd-Halschirurg UMC Utrecht Cancer Center |
Geen |
Geen |
Geen restrictie |
|
Van Leeuwen |
Ziekenhuisapotheker - Erasmus MC Afdelingen Apotheek (80%) en Interne Oncologie (20%) |
SIG Oncologie NVZA - onbetaald Werkgroep Geneesmiddel Interacties NVZA/KNMP (betaald "onkosten") Onderwijs PAO Farmacie (betaald "onkosten") |
Industrie: Geneesmiddelen onderzoek i.s.m. Roche, Astellas, BMS, Servier, Boehringer (unrestricted research grants) Fondsen: Stichting Coolsingel, Stichting de Merel, Stichting Mitialto Geen conflict of interest |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; b) Werkgroeplid werkt tenminste samen met een ander werkgroeplid met vergelijkbare expertise in alle fasen (studieselectie, data-extractie, evidence synthese, evidence-to-decision, aanbevelingen formuleren) van het ontwikkelproces; c) In alle fasen van het ontwikkelproces is een onafhankelijk methodoloog betrokken; d) Overwegingen en aanbevelingen worden besproken en vastgesteld tijdens een werkgroepvergadering onder leiding van een onafhankelijk voorzitter (zonder gemelde belangen) |
|
Jeene |
Radiotherapeut - Oncoloog bij Radiotherapiegroep PhD candidate - AmsterdamUMC ( 0 uren aanstelling) |
Bestuurslid DUCG - onbetaald |
Studie coördinator en eerste auteur POLDER trail (effectiviteit kortdurende uitwendige radiotherapie, geen externe financiering). PICO is anders dan studie |
Geen restrictie |
|
Gisbertz |
Slokdarmkanker en maagkanker chirurg - Amsterdam UMC |
Bestuur ESDE, NVGIC, ISDE, research commitee EAES, de Groene OK: allen onbetaald |
Extern gefinancierd onderzoek: KWF: SQA n observational studies (projectleider) CCA: USPIO enhanced MRI in esophageal cancer (projectleider) |
Geen restrictie |
|
Lagarde |
Chirug, Erasmus MC, Rotterdam |
- lid wetenschappelijke commissie DKCA - bestuurslid werkgroep Upper Gi beiden onbetaald |
Geen |
Geen restrictie |
|
Hoekstra |
Internist-oncoloog, Ziekenhuisgroep Twente (ZGT) |
Lid Concillium Medicinae Internae (onbetaald) |
- Als internist-oncoloog betrokken bij inclusie van patiënten in klinische studies bij oesofagus- en maagcarcinoom. Op dit moment Critics-2 studie en Lyrics studie |
Geen restrictie |
|
Van Det |
Gastro-intestinaal chirurg Ziekenhuis groep Twente (ZGT) |
- Proctor/Instructor voor Intuitive Surgical betreffende Robot-Assisted operaties in de upper-GI zoals: - Slokdarm resecties - Maagresecties - Hernia diafragmatica. |
Geen |
Geen restrictie |
|
Rütten |
Radiotherapeut, Radboud UMC |
Geen |
Geen |
Geen restrictie |
|
Van Grieken |
Patholoog, Amsterdam UMC (locatie Vumc), Amsterdam |
Detachering Expertisepanel poliepen BVO-DK, Screeningsorganisatie BVO darmkanker (3 uur/week) |
- KWF - Identificatie van markers voor response op immunotherapie - projectleider - KWF - CRITICS-II klinische trial voor resectabel maagcarcinoom - ZonMW - Effect van chemotherapie bij patienten met microsatelliet instabiel resectabel maagcarcinoom. – projectleider - advisory boards van BMS, MSD |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; |
|
Mostert |
Internist-oncoloog, Erasmus MC |
Consultancy voor: BMS, Lilly, Servier |
- BMS: fase 2 studie: nivolumab tijdens actieve surveillance slokdarmcarcinoom Sanofi: cabazitaxel bij AR-v7 positieve prostaatcarcinoom patiënten Pfizer: DLA bij mammacarcinoompatiënten behandeld met CDK4/6 De f1/2 studie betreft research support`; investigator initiated studie waarvoor BMS de medicatie “schenkt” Astra zeneca betreft advisory board. |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; |
|
Slingerland |
Internist-oncoloog LUMC |
Geen |
- Advisory board Lilly, Astra Zeneca en BMS |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; |
|
Spaander |
MDL-arts 1.0 Fte in Erasmus Universiteit MC (betaald) Voor 6 uur per week gedetacheerd aan de screeningorganisatie voor het BVO darmkanker (betaald) |
Voorzitter NVMDL en NVGE oncologie commissie (onbetaald) |
ZonMW: Gender differencees in Barrett Surveillance, projectleidersrol. Capsulomics: Biomarkers in Barrett slokdarm, projectleidersrol. Lucid: Non-ionvasive tool for Barrett surveillance. Microtech: New Esophageal stent. CELTIC: Blood test bij FIT +patiënten
|
Geen restrictie |
|
Meijer |
Patholoog, Amsterdam UMC |
Geen |
Geen |
Geen restrictie |
|
Peppelenbosch - Kodach |
Patholoog, NKI/AVL |
Geen |
Deelname studie inter-observer variabiliteit voor PD-L1 CPS in maagcarcinomen, gefinancierd door BMS, fee naar de werkgever AVL/NKI |
Geen restrictie |
|
Muijs |
Radiotherapeut-Oncoloog Universitaire Medisch Centrum Groningen |
Lid wetenschapscommissie DUCA (Gemandateerde NVRO) Lid werkgroep indicatie protocol protonen radiotherapie (NVRO) |
Project Leider Models Project (KWf funded): ontwikkelen en valideren predictiemodellen voor complicaties na CRT en resectie Principle investigator CLARIFY studie (KWF funded): Observationeel onderzoek naar pulmonale hupertensie als complicatie na thoracale RT Participatie in PROTECT studie (EU funded): RCT fase 3: fotonen vs protonen bij nCRT voor oesofaguscarcinoom Voortrekker protonen RT bij het oesofaguscarcinoom |
Geen restrictie |
|
Dik |
[volgt] |
[volgt] |
[volgt] |
[volgt] |
|
Schippers |
[volgt] |
[volgt] |
[volgt] |
[volgt] |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afvaardiging van de Stichting voor Patiënten met kanker aan het Spijsverteringskanaal (SPKS). De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan SPKS en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
‘Palliatie van dysfagie’ (oesofaguscarcinoom) |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de betrokken wetenschappelijke verenigingen en patiëntenorganisaties zijn hier ook andere stakeholders voor benaderd in juni 2021.
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze module is geprioriteerd door het cluster.
Voor de geprioriteerde modules zijn door het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Het cluster definieerde klinisch (patiënt) relevante verschillen, tenminste voor de cruciale uitkomstmaten.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen.
De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID).
Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en deze worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.