Melanoom - BRAF gen mutatie
Uitgangsvraag
Wat is het juiste moment en wijze waarop mutatieanalyse ten behoeve van gerichte systeemtherapie bij patiënten met inoperabel stadium III melanoom en melanoom stadium IV dient te worden verricht?
Aanbeveling
De werkgroep adviseert dat BRAF-mutatieanalyse (hierna te noemen: BRAF-test) alleen wordt uitgevoerd wanneer op basis van de klinische situatie BRAF-remmers een behandeloptie zijn.
De BRAF-test dient bij voorkeur op een recente dan wel nog aanwezige melanoommetastase te worden bepaald.
(In verband met tumorheterogeniteit; er kan een discrepantie in mutatiestatus tussen het primaire melanoom en de metastasen zijn. Tevens is de diagnose melanoommetastase op die manier ook altijd histologisch of cytologisch bevestigd).
Het verrichten van een BRAF-test wordt alleen aanbevolen bij metastasen van primaire melanomen van de huid en in beperkte mate bij metastasen van primaire slijmvliesmelanomen. Indien geen mutatie wordt gevonden op grond van locatie van het primaire melanoom en de vooraf -kans op een BRAF mutatie op grond van locatie van het primaire melanoom wel hoog is, kan overwogen worden een ander extra melanoom sample van dezelfde patiënt te testen. BRAF-testen bij metastasen van primair uvea-of centraal zenuwstelselmelanoom zijn niet zinvol en worden niet aanbevolen.
De BRAF-test die gebruikt wordt, dient alle nu bekende en BRAF-remmer responderende BRAFV600 mutaties en ook niet-responderende BRAFD594 mutaties te detecteren, en dient daarnaast het specifieke type mutatie te identificeren. (BRAF-mutaties andere dan BRAFV600E komen tot in circa 30% van melanomen met BRAF-mutaties voor).
Het verrichten van aanvullende bepalingen waaronder de NRAS- en KIT -mutatie status wordt aanbevolen bij melanomen van de huid zonder BRAF-mutatie, en bij acrolentigineuze – en slijmvliesmelanomen, indien er een behandelconsequentie is.
De gebruikte BRAF-test dient gevalideerd te zijn en uitgevoerd te worden door een moleculair diagnostisch laboratorium dat hiertoe is uitgerust, deelneemt aan kwaliteitsrondzendingen en daarbij goed scoort, en bij voorkeur verbonden is aan een melanoomcentrum.
Ten behoeve van de nationale registratie dient de uitslag van de moleculaire test de aangetoonde BRAF mutatie te specificeren volgens de vigerende HGVS (Human Genome Variation Society) nomenclatuur.
Het is wenselijk dat de uitslag van de BRAF-test binnen vijf dagen na binnenkomst van het tumormateriaal bij het uitvoerend lab bekend is.
Onderbouwing
Achtergrond
Ongeveer de helft van de huidmelanomen heeft een BRAF-mutatie. Specifieke remmers van het kinase, gecodeerd door het gemuteerde V600-BRAF, worden gebruikt in de behandeling van volwassen melanoompatiënten met een BRAF-V600 mutatie die inoperabel zijn of metastasen hebben. Deze BRAF remmers verlengen significant de mediane overleving in melanoompatiënten met BRAF-V600 mutaties [McArthur 2014(71), Luke 2012(70), Chapman 2011(56)]. Circa 50% van de BRAF V600 mutante melanomen reageren, vaak snel, op therapie met BRAF remmers [Sosman 2012(75), Flaherty 2014(60)]. Een mutatie in het BRAF-gen leidt tot een overactief BRAF-eiwit met constitutieve activering van de MAP-kinase signaaltransductieroute, die een belangrijke rol speelt bij het ontstaan van melanocytaire tumoren waaronder melanoom.
Naast BRAF komen bij melanomen ook andere mutaties voor in genen van de MAP-kinase signaaltransductieroute zoals NRAS, GNAQ, GNA11 en KIT. Ook voor deze genen worden steeds vaker -nu deels nog in preklinische trials - remmers toegepast bij chirurgisch incurabele melanoompatiënten.
Op dit moment ontbreken richtlijnen over het moment en de wijze waarop moleculaire testen voor specifieke mutaties ten behoeve van gerichte therapie, ook BRAF-testen, bij melanoom dienen te gebeuren. Deze richtlijn voorziet in dit hiaat.
Conclusies
Concluderend kunnen we stellen dat een test op de aanwezigheid van een BRAF-mutatie in gemetastaseerd melanoom met verstand van zaken op het juiste moment en op het meest ge-eigende materiaal moet worden ingezet, om patiënten optimaal te kunnen selecteren voor behandeling met BRAF-remmers. In deze ‘consensus-based’ –module geeft de werkgroep aan, dat er melanomen zijn waarin BRAF-mutaties niet voorkomen en waarin derhalve het testen van BRAF genmutaties niet zinvol is, dat er meer dan één type BRAF mutatie relevant is voor therapie met
BRAF remmers, dat er heterogeniteit is met betrekking tot de mutatiestatus in diverse melanoomsamples van een patiënt, dat er meerdere BRAF-remmers zijn, en dat er een scala aan BRAF-testen is, elk met specifieke voor- en nadelen. Het is van belang dat alle spelers
betrokken in de melanoomzorg goed op de hoogte zijn van de mogelijkheden en beperkingen van de diverse testen. In het kader van centralisatie en registratie van zorg voor gemetastaseerde melanoompatiënten zoals die nu plaats vindt in Nederland, is het van belang, dat de voor BRAF-remmers relevante BRAF-mutaties getest worden en goed geregistreerd worden, zodat in de toekomst therapie-effecten het best kunnen worden geëvalueerd en behandelingen kunnen worden geoptimaliseerd.
Samenvatting literatuur
Gen-mutaties in melanoom
Melanomen hebben vaak hot-spot mutaties in genen die coderen voor eiwitten van de MAP-kinase signaaltransductieroute. De meest voorkomende mutatie in melanoom van de huid is een mutatie in het BRAF-gen.
Diverse subtypen van melanoom hebben, mede afhankelijk van de lokalisatie van het primaire melanoom, een bepaalde mutatiefrequentie in verschillende genen uit deze MAP-kinase signaaltransductieroute [Whiteman 2011(77)]. De meeste afwijkende eiwitten die het gevolg zijn van deze gen-mutaties, kunnen inmiddels gericht geremd worden. BRAF-mutaties zien we vooral in primaire melanomen van intermitterend aan zonlicht blootgestelde huid. Daarentegen komen bij melanomen van het oog en het centraal zenuwstelsel juist GNAQ- en GNA11-mutaties frequent voor. In lentigo maligna melanoom, acrolentigineus melanoom en slijmvliesmelanoom zijn BRAF-mutaties zeldzaam en zijn KIT en NRAS mutaties frequenter aanwezig [Whiteman 2011(77), Greaves 2013(62), Lovly 2012(69), Bastian 2014(55)].
Typen BRAF-mutaties in melanoom en gevoeligheid voor BRAF-remmers
De meest frequente mutatie in het BRAF gen in melanoom is de mono nucleotide puntmutatie in exon 15 ter plaatse van codon 600 (CTG), c.1799T>A, die er toe leidt dat valine (V) wordt vervangen door glutaminezuur (Glu, E), de zogenaamde c.1799T>A (p.Val600Glu) mutatie, die vaak als de V600E mutatie wordt beschreven. Tot voor kort werd aangenomen dat deze V600E mutatie in circa 85% van de melanomen met BRAF-mutaties aanwezig is. Een aantal recente (anno 2014) studies laat echter zien, dat andere mutaties van codon 600 van het BRAF gen meer voorkomen dan aanvankelijk gedacht en dat ook deze melanomen gevoelig zijn voor vemurafenib of andere BRAF-remmers [McArthur 2014(71), Chapman 2011(56), Greaves 2013(62), Rubinstein 2010(73), Ascierto 2012(54)].
Naast deze gevoeligheid van andere BRAF-mutaties voor BRAF-remmers zijn er ook BRAF-mutaties gerapporteerd die ongevoelig blijken voor behandeling met BRAF-remmers, bijvoorbeeld het zogenaamde kinase dead mutatie BRAFD594 [Stones 2013(76), Heidom 2010(64)].
In 2012 verscheen een onderzoeksrapport, uitgevoerd door de European Medicines Agency, over de effectiviteit van vemurafenib in volwassen melanoompatiënten. Op basis van de bevindingen van deze studie wordt geadviseerd om alle melanoompatiënten met een V600-mutatie te behandelen met vemurafenib en behandeling niet te beperken tot de patiënten met een BRAFV600E –mutatie [Ascierto 2012(54), da Rocha 2013(59)].
Ontwikkelingen in behandeling van melanoom gaan snel. Er zijn inmiddels ook trials met combinaties van BRAF remmers en MEK remmers gaande, welke minder toxiciteit vertonen [Kwong 2013(67), Kudchadkar 2013(66)].
Concluderend komt in tot circa 30% van de BRAF gemuteerde melanomen een niet-V600E mutatie voor, dit betreft ca. 10-15% van alle melanoompatiënten. Detectie van deze andere subtypen is relevant omdat ook hier in het merendeel gevoeligheid voor BRAF remmers is aangetoond. In de komende jaren zal moeten blijken hoe de gevoeligheid van de diverse andere BRAF mutaties is voor diverse BRAF remmers.
Centralisatie van melanoomzorg in Nederland
Er is een multidisciplinair normeringsdocument opgesteld door de Stichting Oncologische Samenwerking (SONCOS), waarin kwaliteitsnormen zijn opgesteld voor de behandeling van diverse tumortypen, waaronder het melanoom (www.soncos.org). Voor het melanoom geldt onder andere, dat systeemtherapie voor patiënten met op afstand gemetastaseerd melanoom gecentreerd wordt in een van de daarvoor specifiek aangewezen melanoomcentra en partners daarvan. Een voorwaarde is, dat de melanoomcentra een register bijhouden van alle patiënten met gemetastaseerd melanoom, waarbij gegevens over kliniek, pathologie, moleculaire afwijkingen en therapie systematisch worden geregistreerd. Naar verwachting zal dit een belangrijke bijdrage leveren aan een beter inzicht, welke BRAF-mutatie predictief is voor een respons op welke BRAF remmende therapie. De recent opgerichte DICA (Dutch Institute for Clinical Auditing) uitkomstregistratie melanomen (www.clinicalaudit.nl) vervult hier een belangrijke functie. Voorwaarde is wel, dat het pathologieonderzoek, waarvan de BRAF-mutatieanalyse deel kan uitmaken, gedegen en volledig gebeurt. In het normeringsdocument wordt dan ook gesteld dat de afdeling pathologie van een centrum beschikt over specifieke expertise op het gebied van melanoom en over alle benodigde diagnostische technieken.
Technologieën voor detectie van BRAF mutaties
Er zijn diverse testen beschikbaar voor het aantonen van BRAF mutaties. Tot op heden is er wereldwijd en ook in Nederland geen standaardprocedure. In de Verenigde Staten heeft de FDA de cobas ® 4800 BRAF V600 mutatietest goedgekeurd om BRAF-mutaties te detecteren. Grofweg zijn een drietal verschillende strategieën voor mutatiedetectie te onderscheiden.
A. Technologieën waarbij volledige genen of exonen van genen worden geanalyseerd en waarbij identificatie van de exacte mutatie mogelijk is: voorbeelden hiervan zijn Sanger of Next Generation Sequencing technieken (NGS). Klassieke Sanger sequentie-analyse is voor een laboratorium een universele technologie die toepasbaar is voor mutatiedetectie van meerdere genen, niet alleen het BRAF gen. Met behulp van Sanger sequencing kunnen zowel hot-spot mutaties, als ook andere mutaties (substituties, deleties, inserties) buiten de mutatie hot-spot worden gedetecteerd. Het nadeel van Sanger sequencing is de beperkte sensitiviteit (allel-detectie van ongeveer 20%) en dat er voor elke sequentieanalyse een verhoudingsgewijs grote hoeveelheid DNA nodig is. Pyrosequencing is sensitiever, kan ook mutante allelen kwantificeren en kan alle mutaties in een interessegebied detecteren. Ook de Next Generation Sequencing technologie wordt toegepast binnen de moleculaire diagnostiek. Vooral de “relatief simpele” NGS instrumenten, zijn bij uitstek geschikt voor sequentieanalyse van panels van genen, waardoor dus niet alleen de sequentie analyse van BRAF kan worden bepaald maar tegelijkertijd, en met gebruik van dezelfde hoeveelheid uitgangsmateriaal, kunnen ook regio’s van andere genen die van belang zijn voor de diagnostiek van melanomen, worden geanalyseerd. De twee belangrijkste ‘NGS-tafelmodellen’ zijn de Illumina MiSeq en de Ion Torrent-Personalised Genome Machine (IT-PGM). Met de IT-PGM kan met een minimale hoeveelheid DNA (10 ng per test, wat ook nodig is voor de analyse van een bepaald exon met behulp van Sanger sequencing) van een groot aantal genen tegelijkertijd de sequentie worden bepaald, waarbij er een hogere detectie-gevoeligheid dan traditionele Sanger sequencing wordt bereikt, namelijk ca. 5%. De technologie werkt uitstekend, ook voor DNA geëxtraheerd uit formaline-gefixeerd en in paraffine-ingebed weefsel. Voorts kunnen korte doorlooptijden worden gerealiseerd.
B. Technologieën die specifieke hot-spotmutaties detecteren en een exacte identificatie van de mutatie geven. Voorbeelden van een dergelijke technologie zijn de BRAF Taqman® Mutation Detection Assays en de OncoCarta panels Sequenom.
De technologie van de BRAF TaqMan®Mutation Detection kan specifiek en gevoelig een bepaalde mutatie zoals de V600E detecteren. Additionele Taqman assays zijn nodig voor de detectie van niet-V600E-mutaties. Elke assay gebruikt een minimale hoeveelheid DNA (circa 100 pg per assay), wat een nadeel is wanneer alleen kleine biopten met slechts geringe DNA-opbrengst beschikbaar zijn.
Met de eerste OncoCarta Panel versie 1.0 kunnen 238 verschillende mutaties van 19 genen worden geïdentificeerd, waaronder meer dan 20 verschillende BRAF mutaties: zowel de BRAF V600E en de V600K, V600R en V600D mutaties, als ook BRAF exon 11 mutaties. Inmiddels is er ook een OncoCarta versie 1.0, MelaCarta beschikbaar waarbij 15 verschillende BRAF mutaties gelegen in exon 15 en 11 kunnen worden gedetecteerd. De detectiegevoeligheid ligt rondom de 10% en de technologie werkt op formaline gefixeerd en in paraffine ingebed weefsel. Het nadeel, vooral in vergelijk met de Ion-Torrent PGM technologie, is dat er relatief veel DNA nodig is voor een complete analyse (ca. 500 ng).
C. Technologieën die geen exacte identificatie van de mutatie geven: voorbeelden hiervan zijn High-Resolution Melting Analysis (HRMA) en de COBAS 4800 BRAF V600 ® test. HRMA detecteert kleine verschillen in smelttemperaturen van amplificatieprodukten, hetgeen een indicatie is voor de aanwezigheid van een mutatie. HRM is een gevoelige techniek, echter het identificeren van een mutatie vraagt een aanvullende analyse, door bijvoorbeeld -Sanger sequencing, wat alleen mogelijk is bij een voldoende hoog percentage van tumorcellen (40%). De COBAS 4800 BRAF V600 ® test detecteert BRAFV600E mutaties zeer gevoelig, namelijk bij aanwezigheid van 5% gemuteerde allelen in het weefsel [Gonzalez 2013(61)]. Belangrijke beperkingen van de test zijn de hoeveelheid benodigd DNA (125 ng) en de beperkte detectie mogelijkheid van de V600K en V600D mutaties, waardoor potentieel behandelbare BRAF V600-gemuteerde melanoom patiënten gemist zullen worden bij uitsluitend gebruik van deze test [Halait 2012(63)]. Bovendien geeft deze test geen informatie betreffende de specifieke mutatie die is gedetecteerd.
Analyse van de BRAF mutatiestatus in de juiste context
Bij het analyseren van de BRAF mutatiestatus is een goede interactie tussen aanvrager, patholoog, en klinisch moleculair bioloog noodzakelijk. Daarnaast is belangrijk dat de test wordt uitgevoerd binnen een CCKL-geaccrediteerd laboratorium voor moleculaire pathologie dat voldoet aan de kwaliteitseisen van de beroepsvereniging. Uiteraard dient het moleculair diagnostisch laboratorium te participeren in externe kwaliteitsrondzendingen en daarbij goede resultaten te behalen.
Enkele specifieke zaken worden hierbij nog nader uitgewerkt:
- De moleculaire test vindt plaats binnen een setting waarbij de betrokken patholoog ervaren is in melanoomdiagnostiek en voldoende zicht heeft op de mogelijkheden en valkuilen van de moleculaire diagnostiek. De patholoog bevestigt door de weefselcontrole vooraf aan de moleculaire test de diagnose melanoommetastase, tekent het tumorweefsel af voor de analist ten behoeve van tumordissectie, en bepaalt het tumorcelpercentage. Daarnaast kan de patholoog op basis van de voorgeschiedenis en primaire lokalisatie van het melanoom mede bepalen welke genen zinvol zijn om te testen.
- In het moleculaire- pathologie-laboratorium zijn klinisch moleculair biologen in de pathologie (KMBP-er) en goed opgeleide moleculair diagnostisch analisten verantwoordelijk voor de uitvoering, analyse, interpretatie en vastlegging van de moleculaire testresultaten. Een goede interactie tussen patholoog en KMBP-er is noodzakelijk.
- Een moleculair verslag voldoet aan de aanbevelingen zoals gedaan in Groot-Brittannië en aan de richtlijnen opgesteld door de Nederlandse werkgroep voor moleculaire pathologie [Gonzalez 2013(61), richtlijnen moleculaire pathologie]. De volgende items worden vastgelegd in het verslag: het weefsel-blokje dat is getest, het percentage tumorcellen en de beoordelaar daarvan, de gebruikte moleculaire testmethode en de detectiegevoeligheid van de test, de genen welke zijn getest en welke exonen of mutaties zijn getest, de beschrijving van de eventueel aanwezige mutatie volgens de Human Genome Variation Society nomenclatuur (HGVS), en de interpretatie van de moleculaire data.
- Een BRAF-test wordt uitgevoerd wanneer op basis van de klinische situatie BRAF-remmers een therapeutische optie zijn. Dit betreft momenteel de groep van patiënten met niet-operabele, gemetastaseerde en snel progressieve melanomen. De internist-oncoloog is in het algemeen degene die de BRAF-test aanvraagt, omdat deze de klinische situatie kent.
- De moleculaire analyse wordt bij voorkeur gedaan op een op dat moment aanwezige en te behandelen metastase. Hiervoor zijn er twee belangrijke argumenten. Ten eerste wordt zo de diagnose melanoommetastase histologisch bevestigd. Ten tweede is er aanzienlijke tumorheterogeniteit, met een gerapporteerde discrepantie van 7,5-29% in de BRAF en NRAS mutatiestatus van de melanoommetastase in vergelijking tot de primaire tumor [Colombino 2012(57), 2013(58), Yancovitz 2012(78)]. Concordantie blijkt het hoogst voor viscerale metastasen (92,5%) en kliermetastasen (91%), maar is laag voor brein- (79%) en huidmetastasen (71%). Vooral bij de laatste twee is verkrijgen van metastatisch tumorweefsel voor de moleculaire test extra belangrijk. Hierbij kan het zijn dat er geen BRAF of NRAS mutatie in het primaire melanoom wordt gedetecteerd, terwijl deze wel aanwezig is in de metastase; ook kan de primaire tumor een mutatie bevatten, maar de metastase niet, of heeft het primaire melanoom een andere mutatie dan de metastase. Het testen van meerdere samples van een patiënt verdient aanbeveling als in de eerste test geen BRAF-mutatie wordt aangetoond en de a priori kans op een BRAF mutatie wel hoog is [Saint-Jean 2014(74)].
- De moleculaire diagnostische test is gevalideerd. Gedegen validatie dient vooraf te gaan aan implementatie in het moleculair diagnostisch pathologielaboratorium. Tot aan de succesvolle afronding van de validatie dient de test uitbesteed te worden aan een laboratorium dat de test wel heeft gevalideerd. Tevens dient de mutatie analyse te worden uitgevoerd in een moleculair diagnostisch laboratorium dat hiertoe is uitgerust en dat aantoonbaar deelneemt aan kwaliteitsrondzendingen voor de bepaalde mutatie analyse.
- De moleculaire test dient alle relevante BRAF exon 15 mutaties te identificeren. Aanbevolen wordt om in de moleculaire uitslag te benoemen of de mutatie aan- of afwezig is, of gedetecteerd dan wel niet-gedetecteerd is (in plaats van mutatie positief of negatief).
Bepaalde moleculaire testen voldoen om deze reden niet, aangezien deze niet alle relevante behandelbare BRAF mutaties kunnen detecteren. Immuunhistochemie heeft soortgelijke beperkingen: ook middels immuunhistochemie worden alleen patiënten met een V600E mutatie gedetecteerd [Long 2013(68)].
Een korte doorlooptijd van de moleculaire test is essentieel. Gezien de vaak snelle progressie van de tumor is een doorlooptijd van maximaal 5 werkdagen vanaf het moment van ontvangst van het materiaal tot aan het autoriseren en versturen van de uitslag, een gewenst en haalbaar tijdspad. Het verslag van de mutatieanalyse wordt in Nederland opgenomen in het pathologie verslag, zodat de testuitslag landelijk inzichtelijk is via het Uniforme Decentrale PALGA Systeem (UDPS), de verslag- en communicatiemodule voor pathologie laboratoria van de Stichting PALGA in Nederland.
Referenties
- 1 - Cordova A et al., 18 Fluoro-2-deoxy-D-glucose-positron emission tomography (FDG-PET) imaging versus sentinel lymph node biopsy (SLNB) in the staging of cutaneous melanoma in AJCC stage I and II. Chirurgia. 2006 (of Publication: Jun 2006): p. 19 (3) (pp 189-191).
- 2 - Kell M.R et al. PET CT imaging in patients undergoing sentinel node biopsy for melanoma. European Journal of Surgical Oncology, 2007(of Publication: Sep 2007): p. 33 (7) (pp 911-913), 2007.
- 3 - Klode J et al. Sentinel lymph node excision and PET-CT in the initial stage of malignant melanoma: A retrospective analysis of 61 patients with malignant melanoma in American joint committee on cancer stages i and II. Dermatologic Surgery, 2010(of Publication: April 2010): p. 36 (4) (pp 439-45), 2010.
- 4 - Singh B et al., Preoperative 18F-FDG-PET/CT imaging and sentinel node biopsy in the detection of regional lymph node metastases in malignant melanoma. Melanoma Research, 2008(of Publication: October 2008): p. 18 (5) (pp 346-352), 2008.
- 5 - Kahle B, Hoffend J, Wacker J, Hartschuh W. Preoperative ultrasonographic identification of the sentinel lymph node in patients with malignant melanoma. Cancer. 2003 Apr 15;97(8):1947-54.
- 6 - Hocevar M et al. The role of preoperative ultrasonography in reducing the number of sentinel lymph node procedures in melanoma. Melanoma Research. 2004(of Publication: Dec 2004): p. 14 (6) (pp 533-6), 2004
- 7 - Sanki A et al., Targeted high-resolution ultrasound is not an effective substitute for sentinel lymph node biopsy in patients with primary cutaneous melanoma. J Clin Oncol 2009(Nov) 27(33):5614-9.
- 8 - Van Rijk MC et al., Ultrasonography and fine-needle aspiration cytology in the preoperative evaluation of melanoma patients eligible for sentinel node biopsy. Ann Surg Oncol, 2006 Nov13;(11):1511-6.
- 9 - Voit C et al. Ultrasound morphology criteria predict metastatic disease of the sentinel nodes in patients with melanoma. Journal of clinical oncology. J Clin Oncol. 2010 Feb 10;28(5):847-52. Epub 2010 Jan 11.
- 10 - Xing Y et al. Contemporary diagnostic imaging modalities for the staging and surveillance of melanoma patients: a meta-analysis. J Natnl Canc Inst 2011;103(2):129-42.
- 11 - Fogarty GB, TartagliaC. The Utility of Magnetic Resonance Imaging in the Detection of Brain Metastases in the Staging of Cutaneous Melanoma. Clinical Oncology, 2006(of Publication: May 2006): p. 18 (4) (pp 360-362), 2006.
- 12 - Facey K., Bradbury I, Laking G, Payne E. Overview of het clinical effecttiveness of positron emissoin tomography imaging in selected cancers. Health Technology Assessment. 2007;11(44).
- 13 - Gulec SA, Faries MB, Lee CC, Kirgan D et al. The role of fluorine-18 deoxyglucose positron emission tomography in the management of patients with metastatic melanoma: impact on surgical decision making. Clin Nucl Med. 2003;28(12):961-5.
- 14 - Swetter S, Carroll LA., Johnson DL et al. Positron Emission Tomography is luperior to Computd Tomography for metastatic detection in melanoma patientsl. Annals of Surgical Oncology. 2002;9 (7): 646-53.
- 15 - Finkelstein SE, Carrasquillo JA, Hoffman JM et al. A prospective analysis of positron emission tomography and conventional imaging for detection of stage IV metastatic melanoma in patients undergoing metastasectomy. Ann Surg Oncol. 2004;11(8):731-8.
- 16 - Brady MS, Akhurst T, Spankneber K, et al.Utility of preoperative [18F]Fluorodeoxyglucose Positron Emission Tomography scanning in high-riks melanoma patients. Annals of Surgical Oncology. 2006;13 (4): 525-532.
- 17 - Reinhardt MJ, Joe AY, Jaeger U et al. Diagnostic performance of whole body dual modality 18F-FDG PET/CT imaging for N- and M-staging of malignant melanoma: experience with 250 consectutive patients. Journal of Clinical Onology. 2006; 24 (7): 1178-86.
- 18 - Römer W, Nörmayr A, Fiedler E et al . Retrospective interactive rigid fusion of 18F-FDG PET and CT. Nuklearmedzin. 2006;45: 88-95.
- 19 - Iagaru A, Quon A, Johnson D et al. 2-Deoxy -2-[18F]Fluorodeoxyglucose Positron Emission Tomography / Computd Tomography in the management of melanoma. Molecular Imaging and Biology. 2006;9: 50-7.
- 20 - Pfannenberg C, Aschoff P, Schanz S et al. Prospective comparison of [18F]Fluorode-oxyglucose Positron Emission Tomography. Computed Tomography and whole-body magnetic resonance imaging in staging of advanced malignant melanoma. European Journal of Cancer 2007;43: 557-64.
- 21 - Veit-Haibach P, Vogt FM, Jablonka R et al. Diagnostic accuracy op contraxt-enhanced FDG-ET/CT in primary staging of cutaneous malignant melanoma." Eur J Nucl Med Mol. 2009; Imaging 36: 1910-8.
- 22 - Bastiaannet E, Wobbes, T., Hoekstra, O.S., et al. Prospective Comparison of [18F]Fluorodeoxyglucose Positron Emission Tomography and Computed Tomography in patients with palpable lymph node metastases: Diangnostic accuracy and impact on treatment. Jounal of Clinical Oncology. 2009:27(28): 4774-80.
- 23 - Krug B et al. Role of PET in the initial staging of cutaneous malignant melanoma: systematic review. Radiology, 2008(of Publication: Dec 2008): p. 249 (3) (pp 836-844), 2008.
- 55 - Bastian BC. The molecular pathology of melanoma: an integrated taxonomy of melanocytic neoplasia. Annu Rev Pathol. 2014;9:239-71.
- 56 - Chapman PB, Hauschild A, Robert C, et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med. 2011;364:2507-16.
- 57 - Colombino M, Capone M, Lissia A, et al. BRAF/NRAS mutation frequencies among primary tumors and metastases in patients with melanoma. J Clin Oncol. 2012;30:2522-9.
- 58 - Colombino M, Lissia A, Capone M, et al. Heterogeneous distribution of BRAF/NRAS mutations among Italian patients with advanced melanoma. Journal of translational medicine. J Transl Med. 2013;11:202.
- 59 - da Rocha Dias S, Salmonson T, van Zwieten-Boot B, et al. The European Medicines Agency review of vemurafenib (Zelboraf(R)) for the treatment of adult patients with BRAF V600 mutation-positive unresectable or metastatic melanoma: Summary of the scientific assessment of the Committee for Medicinal Products for Human Use. Eur J Cancer. 2013;49:1654-61.
- 60 - Flaherty L, Hamid O, Linette G, et al. A single-arm, open-label, expanded access study of vemurafenib in patients with metastatic melanoma in the United States. Cancer Journal. 2014;20:18-24.
- 61 - Gonzalez D, Fearfield L, Nathan P, et al. BRAF mutation testing algorithm for vemurafenib treatment in melanoma: recommendations from an expert panel. Br J Dermatol. 2013;168:700-7
- 62 - Greaves WO, Verma S, Patel KP, et al. Frequency and Spectrum of BRAF Mutations in a Retrospective, Single-Institution Study of 1112 Cases of Melanoma. J Mol Diagn. 2013;15:220-6.
- 63 - Halait H, Demartin K, Shah S, et al. Analytical performance of a real-time PCR-based assay for V600 mutations in the BRAF gene, used as the companion diagnostic test for the novel BRAF inhibitor vemurafenib in metastatic melanoma. Diagn Mol Pathol. 2012;21:1-8.
- 64 - Heidorn SJ, Milagre C, Whittaker S, et al. Kinase-dead BRAF and oncogenic RAS cooperate to drive tumor progression through CRAF. Cell. 2010;140:209-21.
- 65 - Klein O, Clements A, Menzies AM, et al. BRAF inhibitor activity in V600R metastatic melanoma. Eur J Cancer. 2013;49:1073-9
- 66 - Kudchadkar RR, Smalley KS, Glass LF, et al. Targeted therapy in melanoma. Clin Dermatol. 2013;31:200-8.
- 67 - Kwong LN, Davies MA. Targeted therapy for melanoma: rational combinatorial approaches. Oncogene. 2014 2;33:1-9
- 68 - Long GV, Wilmott JS, Capper D, et al. Immunohistochemistry is highly sensitive and specific for the detection of V600E BRAF mutation in melanoma. Am J Surg Pathol. 2013;37:61-5.
- 69 - Lovly CM, Dahlman KB, Fohn LE, et al. Routine multiplex mutational profiling of melanomas enables enrollment in genotype-driven therapeutic trials. PLoS One. 2012;7:e35309.
- 70 - Luke JJ, Hodi FS. Vemurafenib and BRAF inhibition: a new class of treatment for metastatic melanoma. Clin Cancer Res. 2012;18:9-14.
- 71 - McArthur GA, Chapman PB, Robert C, et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014;15:323-32.
- 72 - Menzies AM, Long GV, Murali R. Dabrafenib and its potential for the treatment of metastatic melanoma. Drug Design, Development and Therapy. 2012;6:391-405.
- 73 - Rubinstein JC, Sznol M, Pavlick AC, et al. Incidence of the V600K mutation among melanoma patients with BRAF mutations, and potential therapeutic response to the specific BRAF inhibitor PLX4032. Journal Transl Med. 2010;8:67.
- 74 - Saint-Jean M, Quereux G, Nguyen JM, et al. Is a single BRAF wild-type test sufficient to exclude melanoma patients from vemurafenib therapy? J Invest Dermatol. 2014;134:1468-70.
- 75 - Sosman JA, Kim KB, Schuchter L, et al. Survival in BRAF V600-mutant advanced melanoma treated with vemurafenib. N Engl J Med. 2012;366:707-14.
- 76 - Stones CJ, Kim JE, Joseph WR, et al. Comparison of responses of human melanoma cell lines to MEK and BRAF inhibitors. Frontiers in Genetics. 2013;4:66.
- 77 - Whiteman DC, Pavan WJ, Bastian BC. The melanomas: a synthesis of epidemiological, clinical, histopathological, genetic, and biological aspects, supporting distinct subtypes, causal pathways, and cells of origin. Pigment Cell Melanoma Res. 2011;24:879-97.
- 78 - Yancovitz M, Litterman A, Yoon J, et al. Intra- and inter-tumor heterogeneity of BRAF(V600E))mutations in primary and metastatic melanoma. PLoS One. 2012;7:e29336.
- 79 - Yang H, Higgins B, Kolinsky K, et al. RG7204 (PLX4032), a selective BRAFV600E inhibitor, displays potent antitumor activity in preclinical melanoma models. Cancer Res. 2010;70:5518-27.
Evidence tabellen
Richtlijn 2012
Revisie 2016
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-10-2024
Laatst geautoriseerd : 01-03-2016
Geplande herbeoordeling : 01-10-2028
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal vijf jaar na vaststelling) wordt vanuit het IKNL bewaakt. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld.
Algemene gegevens
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg. IKNL draagt bij aan het verbeteren van de zorg rond kanker door het verzamelen van gegevens, het opstellen van richtlijnen, het bewaken van kwaliteit en het faciliteren van samenwerkingsverbanden. Ons doel is de beste zorg voor iedere patiënt.
IKNL werkt aan multidisciplinaire richtlijnontwikkeling voor de oncologische en palliatieve zorg. Naast het reviseren van richtlijnen faciliteert IKNL ook het onderhoud, het beheer, de implementatie en de evaluatie van deze richtlijnen. Een implementatie- en evaluatieplan wordt gepubliceerd indien de richtlijn geautoriseerd beschikbaar is.
De kwaliteit van ontwikkelen, implementeren en evalueren van evidence en consensus based richtlijnen waarborgt IKNL door aan te sluiten bij de criteria opgesteld in de Richtlijn voor Richtlijnen (maart 2012), AGREE II en de Medisch specialistische richtlijnen 2.0.
Initiatief
Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG)
Nederlandse Vereniging voor Pathologie (NVVP)
Organisatie
Integraal Kankercentrum Nederland (IKNL)
Betrokken verenigingen
Nederlandse Internisten Vereeniging (NIV)
Nederlandse Melanoom Werkgroep (NMW)
Nederlandse Vereniging voor Dermatologie en Venerologie (NVDV)
Nederlandse Vereniging voor Heelkunde (NVvH)
Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG)
Nederlandse Vereniging voor Pathologie (NVVP)
Nederlandse Vereniging voor Radiologie (NVvR)
Leven met Kanker beweging - Stichting Melanoom
Financiering
Deze module is gefinancierd door de:
Kwaliteitskoepel Medisch Specialisten (SKMS)
Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG)
Nederlandse Vereniging voor Pathologie (NVVP)
De inhoud van de modules is niet beïnvloed door de financierende instanties.
Juridische verantwoordelijkheid
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Houderschap richtlijn
De houder van de richtlijn moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen. Onder houder wordt verstaan de verenigingen van beroepsbeoefenaren die de richtlijn autoriseren.
Integraal Kankercentrum Nederland draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Doel en doelgroep
Doel
Een richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. Deze richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het expliciteren van goed medisch handelen. De richtlijn beoogt een leidraad te zijn voor de dagelijkse praktijk van de preventie, diagnostiek, behandeling en follow-up van patiënten met een melanoom van de huid. Melanomen op andere plaatsen in het lichaam zijn in deze richtlijn buiten beschouwing gelaten. De richtlijn omvat alle stadia van de ziekte.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een melanoom van de huid, zoals dermatologen, pathologen, chirurgen, radiotherapeuten, internist-oncologen, huisartsen, oncologieverpleegkundigen, IKNL-consulenten, maatschappelijk werkers en psychologen.
Samenstelling werkgroep
Werkgroep:
- Dr. A.C.J. van Akkooi, chirurgisch oncoloog, werkzaam in het Antoni van Leeuwenhoek, NVvH, voorzitter
- Prof. dr. C. Verhoef, chirurgisch oncoloog, werkzaam in het Erasmus Medisch Centrum, NVvH
- Dr. L.B. Been, chirurgisch oncoloog, werkzaam in het Universitair Medisch Centrum Groningen, NVvH
- Prof. dr. A.J.M. van den Eertwegh, internist-oncoloog, werkzaam in het Amsterdam Universitair Medisch Centrum, NIV
- Dr. M.J.B. Aarts, internist-oncoloog, werkzaam in het Maastricht Universitair Medisch Centrum, NIV
- Mr. Dr. E.R.M. de Haas, dermatoloog, werkzaam in het Erasmus Medisch Centrum, NVDV
- Drs. B. van der Hiel, nucleair geneeskundige, werkzaam in het Antoni van Leeuwenhoek, NVNG
- Ir. K.J.A. van Elst, patiëntvertegenwoordiger, Stichting Melanoom
Met ondersteuning van:
- Dr. W.J. Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. Tra, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De werkgroepleden zijn afgevaardigd namens wetenschappelijke en hebben daarmee het mandaat voor hun inbreng.
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van de werkgroep gemandateerd door de wetenschappelijke verenigingen.
Inbreng patiëntenperspectief
Bij de ontwikkeling van de module in 2015-2016 is tijdens alle fasen gebruik gemaakt van de input van patiënten. Door de Leven met Kanker Beweging is stichting Melanoom gevraagd een patiënten vertegenwoordiger voor de richtlijn werkgroep af te vaardigen. Stichting Melanoom heet hierop mw. dr. N.A. Gruis afgevaardigd. Zij heeft gedurende het gehele traject van de revisie 2016 geparticipeerd in de richtijn werkgroep.
De input van patiënt vertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Methode ontwikkeling
Consensus based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de oncologische en palliatieve zorgpraktijk, inclusief borging daarvan. Als onderdeel van elke richtlijn stelt IKNL een implementatieplan op.
Activiteiten en interventies voor verspreiding en implementatie vinden zowel op landelijk als regionaal niveau plaats. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Werkwijze
Modulaire update 2016
De werkgroep heeft specifiek een aantal modules uit de richtlijn onder de loep genomen en aangepast aan de huidige stand van zaken. Het initiatief voor deze revisie is genomen door de Nederlandse Vereniging voor Nucleair Geneeskundigen (NVNG) en de Nederlandse Vereniging voor Pathologie (NVVP). Voor een drietal uitgansvragen, (1. De rol van de FDG-PET/CT scan in de diagnostiek, 2. De rol van de FDG-PET/CT scan in de follow-up en 3. de schildwachtklierprocedure) zijn systematisch literatuuronderzoeken verricht. Voor uitwerking van de uitgansvraag over de procedure rondom de BRAF-genmutatietest is gekozen voor een consensus based aanpak. Deze module beschrijft met name de organisatie van zorg omtrent deze test. Er zijn ook modules opgesteld voor de onderwerpen “systemische therapie (ipilimumab)” en “kosteneffectiviteit van de FDG-PET/CT scan bij inoperabel stadium 3 en stadium 4 patiënten”, echter door de snelle ontwikkelingen op het gebied van de systemische therapie heeft de werkgroep besloten deze modules (vooralsnog) niet te publiceren. Voor een overzicht van de uitgangsvragen zie bijlage X.
Voor iedere uitgangsvraag werd een subgroep geformeerd met vertegenwoordigers van relevante disciplines. De werkgroepleden schreven tekst, conclusies, overwegingen en aanbevelingen die tijdens plenaire vergaderingen werden besproken en na verwerking van de commentaren werden geaccordeerd.
De concept modules werden naar alle binnen deze werkgroep vertegenwoordigde verenigingen en organisaties gestuurd voor commentaar. Na verwerking van het commentaar zijn de nieuwe modules door de voltallige werkgroep vastgesteld en ter autorisatie naar de relevante beroepsverenigingen voorgelegd. De voorzitter van de werkgroep en de procesbegeleider van het IKNL zorgden voor de coördinatie en onderlinge afstemming van de subgroepen.
De EBRO-methodiek
Opbouw
Elke module van de richtlijn is volgens een vast stramien opgebouwd: de uitgangsvraag en aanbevelingen, de onderbouwing (samenvatting literatuur, referentielijst, conclusies en evidence tabellen), de overwegingen en de verantwoording. Voor het evidence based uitwerken van vragen rondom diagnostische interventie hanteren we de EBRO-methodiek, voor therapeutische interventies de GRADE methodiek.
De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
Selectie
Aanbevelingen werden gebaseerd op ‘beste evidence' en daarom werd naast selectie op relevantie tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
1. Meta-analyses en systematische reviews;
2. Gerandomiseerde gecontroleerde studies (RCT's);
3. Niet gerandomiseerde gecontroleerde studies (CCT's).
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De geselecteerde artikelen zijn vervolgens beoordeeld op de kwaliteit van het onderzoek door middel van het invullen van de checklist critical appraisal. Hierbij is het wetenschappelijk bewijs beoordeeld op vertekening (bias) en gegradeerd naar mate van bewijs. In de laatste kolom van de evidence tabellen wordt een samenvatting gegeven van de critical appraisal. De mate van bewijskracht en het niveau van bewijs zijn in de conclusies van de verschillende hoofdstukken of paragrafen weergegeven. De belangrijkste literatuur waarop de conclusies zijn gebaseerd, is daarbij vermeld.
Tabel 1. Diagnostische tests
Indeling van onderzoeksresultaten naar mate van bewijskracht
|
A1 |
Onderzoek naar de effecten van diagnostiek op klinische uitkomsten bij een prospectief gevolgde goed gedefinieerde patiëntengroep met een tevoren gedefinieerd beleid op grond van de te onderzoeken testuitslagen, of besliskundig onderzoek naar de effecten van diagnostiek op klinische uitkomsten, waarbij resultaten van onderzoek van A2-niveau als basis worden gebruikt en voldoende rekening wordt gehouden met onderlinge afhankelijkheid van diagnostische test. |
|
A2 |
Onderzoek ten opzichte van een referentietest, waarbij van tevoren criteria zijn gedefinieerd voor de te onderzoeken test en voor een referentietest, met een goede beschrijving van de test en de onderzochte klinische populatie; het moet een voldoende grote serie van opeenvolgende patiënten betreffen, er moet gebruik gemaakt zijn van tevoren gedefinieerde afkapwaarden en de resultaten van de test, en de ‘gouden standaard' moeten onafhankelijk zijn beoordeeld. Bij situaties waarbij multiple, diagnostische test een rol spelen, is er in principe een onderlinge afhankelijkheid en dient de analyse hierop te zijn aangepast, bijvoorbeeld met logistische regressie. |
|
B |
Vergelijking met een referentietest, beschrijving van de onderzochte test en van de onderzochte populatie, maar niet de kenmerken die verder onder niveau A1 en A2 staan genoemd. |
|
C |
Niet-vergelijkend onderzoek |
|
D |
Mening van deskundigen (bijvoorbeeld werkgroepleden) |
Tabel 2. Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggend bewijs
|
Niveau van bewijs |
Conclusie gebaseerd op |
Formulering |
|
1 |
Eén systematische review (A1) of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A1 of A2 |
Het is aangetoond dat... |
|
2 |
Ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
Het is aannemelijk dat... |
|
3 |
Eén onderzoek van niveau A2, B of C |
Er zijn aanwijzingen dat... |
|
4 |
Mening van deskundigen (bijvoorbeeld de werkgroepleden) |
De werkgroep is van mening dat... |
Methode voor het formuleren van ‘Overwegingen'
Naast de evidence uit de literatuur (conclusie) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden beschreven onder het kopje ‘Overwegingen' in de richtlijntekst. Bij de Overwegingen wordt de conclusie (op basis van de literatuur) door de werkgroep leden geplaatst in de context van de dagelijkse praktijk en maken zij een afweging van de voor- en nadelen van de verschillende beleidsopties. Vervolgens stellen werkgroepleden door middel van discussie (consensusmethode) gezamenlijk de aanbevelingen op. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.
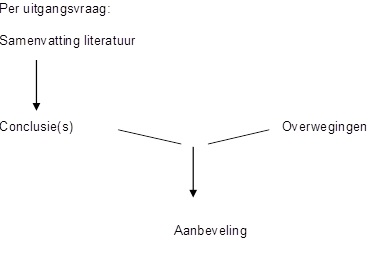
Voor het gestructureerd en transparant beschrijven van de overwegingen en aanbevelingen is een checklist ‘overwegingen' en een checklist ‘formuleren van aanbevelingen' opgesteld.
Checklist ‘overwegingen'
Eén of meerdere conclusies leidt c.q. leiden tot één aanbeveling. Vul per aanbeveling één checklist ‘overwegingen' in. Maak een link naar de ingevulde checklist in het tabblad ‘overwegingen' van het betreffende onderwerp.
Als een bepaald diagnostisch instrument of bepaalde behandeling niet werkzaam is dient geen gebruik gemaakt te worden van dit diagnostisch instrument of deze behandeling. Overwegingen zijn dan niet bijdragend en worden niet beschreven.
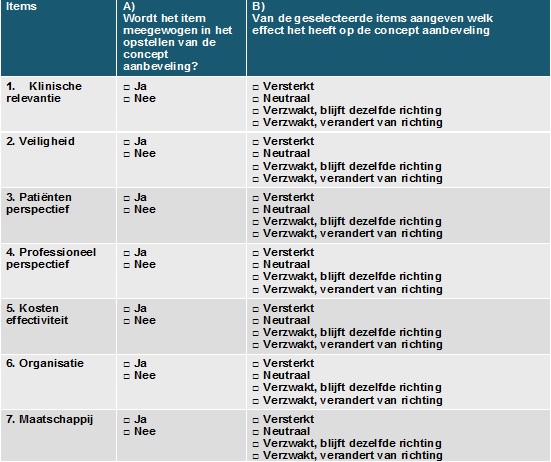

Uitleg items checlist 'overwegingen'
1. Klinische relevantie: bepalen door professionals en evt. literatuuronderzoek
- Sterkte van het effect vergeleken met geen interventie
- Consistentie van het beschikbare bewijs uit de verschillende studies
- Generaliseerbaarheid
- Voorbeeld: een bepaalde behandeling kan een significante verbetering van symptomen geven die patiënten echter niet als zodanig ervaren, dus klinisch niet relevant.
2. Veiligheidsissues: bepalen door professionals en evt. literatuuronderzoek
- Bijwerkingen, risico's of complicaties op korte en lange termijn
- Gebruik bij co-morbiditeit / gelijktijdig gebruik medicatie en/of interventie
- Voorbeeld: fysieke comorbiditeit kan bepaalde behandelingen uitsluiten.
3. Patiënten perspectief: bepalen door professionals, patiënten en eventueel literatuuronderzoek
- Voorkeuren / te verwachten compliance / te verwachten tevredenheid / kwaliteit van leven
- Voorbeeld: diagnostiek of behandeling waarvoor minder ziekenhuisbezoek nodig is; behandeling die makkelijker toe te dienen is; behandeling die sneller effect laat zien.
4. Professioneel perspectief: bepalen door professionals
- Kennis en ervaring met technieken/therapie
- Risico's die professional loopt bij het toepassen van de interventie / tijdbesparing of het verlies aan tijd door het invoeren van de interventie
- Houding, normen en waarden van de professional
- Voorbeeld: een nieuwe techniek die nog niet alle professionals beheersen.
5. Kosteneffectiviteit: bepalen door professionals, indien gewenst en mogelijk kosteneffectiviteitsanalyse door expert
- Kosteneffectiviteit in verhouding tot bestaande ingrepen/behandelingen voor deze ziekte
6. Organisatorische factoren: bepalen door professionals
- De beschikbaarheid/aanwezigheid van faciliteiten & medicijnen
- De wijze waarop de organisatie van de zorg aangeboden dient te worden / grootte van de verandering in het organisatie-zorgproces / infrastructuur voor implementatie
- Voorbeeld: een bepaalde diagnostiek of behandeling kan alleen in bepaalde centra worden uitgevoerd in verband met de aanwezigheid van faciliteiten zoals een PET scan.
7. Maatschappelijke factoren: bepalen door professionals
- Vergoeding door verzekeraars / Industriële belangen / Ethische overwegingen / Juridische overwegingen / Politieke en strategische consequenties
- Voorbeeld: indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling worden aanbevolen.
Checklist formuleren van aanbevelingen

Methode voor het formuleren van aanbevelingen
In de praktijk kunnen er per uitgangsvraag meerdere conclusies zijn, met verschillend niveau van bewijs. Indien er meerdere conclusies bij de uitgangsvraag zijn geformuleerd is het van belang de conclusies te prioriteren. Het niveau van bewijs van de conclusie die het meest van belang is voor het formuleren van de aanbeveling wordt meegenomen in de checklist ‘formuleren van aanbevelingen'.
De GRADE-methodiek
Opbouw
Elke module van de richtlijn is volgens een vast stramien opgebouwd: de uitgangsvraag en aanbevelingen, de onderbouwing (samenvatting literatuur, referentielijst, conclusies en evidence tabellen), de overwegingen en de verantwoording. Voor het evidence based uitwerken van vragen rondom therapeutische interventies hanteren we de GRADE methodiek, voor alle overige uitgangsvragen de EBRO methodiek.
De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn, voor zover mogelijk, gebaseerd op gepubliceerd wetenschappelijk onderzoek.
Selectie
Naast de selectie op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
· 1. Gerandomiseerde gecontroleerde studies (RCT's)
· 2. Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
a. De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
b. De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen'
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.

Tabel 3. Van bewijs naar aanbeveling
|
Algehele kwaliteit van bewijs hoog / matig / laag / zeer laag |
|
|
Beslissing1 |
Toelichting |
|
1. Kwaliteit van het bewijs Is de algehele kwaliteit van bewijs hoog? |
☐ ja ☐ nee of onduidelijk
|
...
|
|
2. Balans tussen gewenste en ongewenste effecten Overtreffen de gunstige effecten de ongunstige effecten, of de ongunstige effecten de gunstige effecten aanzienlijk en is de werkgroep hier zeker van?
|
☐ ja ☐ nee of onduidelijk
|
...
|
|
3. Patiëntenperspectief Hanteren vrijwel alle patiënten hetzelfde perspectief op de wenselijkheid of de onwenselijkheid van de aan te bieden interventie?
|
☐ ja ☐ nee of onduidelijk
|
...
|
|
4. Professioneel perspectief Hanteren vrijwel alle zorgverleners hetzelfde perspectief op de wenselijkheid of de onwenselijkheid van de aan te bieden interventie?
|
☐ ja ☐ nee of onduidelijk
|
...
|
|
Onderstaande factoren alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen
|
||
|
5. Middelenbeslag Zijn de netto-gunstige effecten de (extra) middelen waard? |
☐ ja ☐ nee of onduidelijk ... |
...
|
|
6. Organisatie van zorg Zijn voldoende condities van zorg-organisatorische aard aanwezig om de interventie toe te passen? |
☐ ja ☐ nee of onduidelijk
|
...
|
|
7. Maatschappelijk perspectief Zijn voldoende condities van maatschappelijke aard aanwezig om de interventie toe te passen? |
☐ ja ☐ nee of onduidelijk
|
...
|
|
1. Indien een of meerdere factoren worden geëvalueerd met ‘ja' neemt de waarschijnlijkheid van een sterke aanbeveling toe. |
||
|
Sterkte van de aanbeveling sterk / zwak (conditioneel) |
Toelichting bij Tabel 3
1. Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
2. Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- Bespreken effectiviteit in relatie tot bijwerkingen en complicaties in het licht van de kwaliteit van bewijs, de precisie van de effectgrootte en minimaal klinisch relevant geacht voordeel.
- Sterkte van het effect vergeleken met geen interventie.
- Aanwezigheid van comorbiditeit.
- Klinisch niet relevantie van het effect.
3. Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
4. Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico's die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient' plaats te vinden (sterk) of wel ‘kan worden overwogen' (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
5. Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling.
6. Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- De beschikbaarheid/aanwezigheid van faciliteiten & medicijnen.
- De wijze waarop de organisatie van de zorg aangeboden dient te worden/grootte van de verandering in de organisatie-zorgproces/infrastructuur voor implementatie.
- Voorbeeld: een bepaalde diagnostiek of behandeling kan alleen in bepaalde centra worden uitgevoerd in verband met de aanwezigheid van faciliteiten zoals een PET scan.
7. Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin - voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Er dient.... te worden gegeven/gedaan.
- Zwakke/conditionele aanbevelingen: Overweeg..... te geven/te doen.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
