Corticosteroïden bij longaanval astma
Uitgangsvraag
De uitgangsvraag omvat de volgende deelvragen:
Wat is de optimale dosering prednisolon bij patiënten met een longaanval astma die zich presenteren in het ziekenhuis?
Welke groep patiënten heeft mogelijk baat bij een afwijkende dosering prednisolon?
Aanbeveling
1. Schrijf bij een longaanval astma standaard prednisolon 40mg/dag voor gedurende minimaal 5 dagen, zo mogelijk oraal. Bij uitblijven van klinisch herstel kan overwogen worden de stootkuur te verlengen tot maximaal 14 dagen.
2. Gebruik een afbouwschema bij:
- een bekende bijnierschorsinsufficiëntie
OF
- gebruik van een onderhoudsdosering prednisolon.
3. Ga bij uitblijven van klinisch herstel na 14 dagen na of er sprake is van een persisterende longaanval astma of andere beïnvloedbare factoren (“treatable traits”).
Wees ook beducht op mogelijke bijwerkingen van prednisolon waaronder diabetes mellitus, osteoporose en glaucoom wanneer meerdere twee of meer stootkuren per jaar worden voorgeschreven. Bij meer stootkuren worden bijwerkingen waarschijnlijker en/of ernstiger.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de geïncludeerde studie is het onduidelijk of een hogere dosering prednisolon als behandeling van volwassen patiënten met een longaanval astma tot een lager risico op een herhaalde aanval, een betere longfunctie (FEV1/PEFR), of een hoger risico op bijwerkingen leidt dan een lagere dosering. In de geïncludeerde studies werd een hogere dosering gedefinieerd als een totale dosis over de gehele kuur van 320 tot 1575 mg: 40 mg/dag voor 8 dagen of een afbouwschema van 45-0 mg/dag over 7 weken, vergeleken met een lagere dosering: een afbouwschema van 45-0 mg/dag over 7 dagen tot een startdosering van 40 mg/dag met verschillende afbouwschema’s. De onduidelijkheid van de resultaten is te wijten aan de zeer ruime onzekerheidsmarges in de resultaten, die het gevolg zijn van een klein aantal deelnemers aan de geïncludeerde studie, en daarbinnen het beperkte risico op een herhaalde aanval. Voor het overige is de geïncludeerde studie wel kwalitatief goed uitgevoerd. Dit zorgt ervoor dat de alleen de imprecisie van de resultaten leidde tot afwaardering binnen de GRADE-methodiek, met twee niveaus tot een lage bewijskracht.
De totale bewijskracht voor het effect van de hoogte van de dosering op alle uitkomstmaten is uitgekomen op laag. Het is mogelijk dat goed uitgevoerd onderzoek in grotere onderzoekspopulaties de precisie van de resultaten sterk zou vergroten.
Er zijn onvoldoende gegevens in de beschikbare literatuur om een uitspraak te doen over het eventuele voordeel van een langere duur van een corticosteroïdenkuur ten aanzien van het risico op een recidief longaanval astma dan wel opname hiervoor. Het bewijs ten aanzien van het verschil in longfunctie is laag, het is onduidelijk of een kuur van 5 dagen verschilt van een kuur van 10 dagen. Er zijn geen studies die rapporteren over bijwerkingen/negatieve uitkomsten bij een langere of kortere duur van een kuur corticosteroïden. De totale bewijskracht is laag vanwege de zeer grote imprecisie van de resultaten.
Prednisolon heeft al decennia zijn effectiviteit bewezen ter voorkoming van mortaliteit en morbiditeit bij longaanvallen astma. Op basis van de huidige literatuur is de optimale dosering en duur van deze behandeling niet aan te geven. Prednisolon kent vele bijwerkingen op korte en langere termijn die naast morbiditeit voor de patiënt ook tot toegenomen zorgkosten kan leiden. In dat kader is het verstandig prednisolon niet hoger of langer te doseren dan nodig is. IC-opname, (duur van) ziekenhuisopname, heropname en/of recidief longaanval zijn volgens de werkgroep de belangrijkste uitkomstmaten. Juist deze punten zijn helaas onvoldoende onderzocht. Anderszins, kijkend naar longfunctie en recidief longaanval is er ook geen duidelijk voordeel aangetoond van een hogere dosis en/of langere kuur prednisolon. Het NHG adviseert 40mg prednisolon/dag gedurende 5-14 dagen en GINA (2022) adviseert 40-50mg prednisolon gedurende 5-7 dagen.
Prednisolon wordt bij voorkeur oraal ingenomen. Het wordt goed en snel geabsorbeerd vanuit het maagdarmkanaal. In z’n algemeenheid is toediening van geneesmiddelen per intraveneus infuus geassocieerd met o.a. hogere kosten en meer infectieuze complicaties. Bij patiënten bij wie orale inname van medicatie niet goed mogelijk is, bv. bij slik– of passagestoornissen of patiënten op de intensive care, dient intraveneuze toediening te worden overwogen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het is voorstelbaar dat patiënten onder andere op basis van ervaringen in het verleden een voorkeur hebben t.a.v. dosis en duur van prednisolon. De wens van de patiënt kan worden meegewogen mits de professional dat verantwoord acht.
Kosten (middelenbeslag)
De kosten van prednisolon zijn verwaarloosbaar.
Aanvaardbaarheid, haalbaarheid en implementatie
Gezien de lage kosten van prednisolon en de huidige praktijk worden er geen problemen verwacht t.a.v. implementatie of aanvaardbaarheid.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Om zoveel mogelijk uniformiteit in beleid in de Nederlandse astmazorg te bewerkstelligen, is het advies van de werkgroep om aan te sluiten bij de NHG-Standaard. Daarnaast is het belangrijk om bijwerkingen van prednisolon te minimaliseren.
Onderbouwing
Achtergrond
Ten aanzien van de dosis en de duur van een prednisolonkuur bestaat aanzienlijke praktijkvariatie. Dit geldt ook voor het al dan niet inzetten van afbouwschema’s na het gebruik van prednisolon bij een longaanval astma. Het doel is om tot een aanbeveling te komen die eenduidigheid geeft voor deze behandeling. In deze module is gekozen voor het gebruik van prednisolon omdat met dit glucocorticoïd in Nederland de meeste ervaring bestaat bij behandeling van een longaanval astma.
Conclusies
|
No GRADE |
No studies reported on duration of hospitalisation |
|
No GRADE |
Due to the lack of data, it is not possible to draw a conclusion about the effect of a shorter course of prednisolone compared to a longer course of prednisolone to treat patients with an acute asthma exacerbation on the reduction of the risk of a recurrent asthma exacerbation at any point in time.
Source: Normansell (2016) |
|
Low GRADE |
The evidence suggests that a shorter course (5 days) of prednisolone to treat patients with an acute asthma exacerbation results in little to no difference in lung function measured by peak flow compared to a longer course (10 days) of prednisolone.
Source: Normansell (2016) |
|
Low GRADE |
The evidence is unclear about the effect of a lower total dose (180-225 mg) during a course of prednisolone compared to a higher total dose (320-1575 mg) of prednisolone to treat patients with an acute asthma exacerbation on the reduction of the risk of a recurrent asthma exacerbation.
Source: Normansell (2016) |
|
Low GRADE |
The evidence suggests that a lower total dose (e.g. 180 mg) during a course of prednisolone to treat patients with an acute asthma exacerbation results in little to no difference in lung function measured by forced expiratory volume in 1 second compared to a higher total dose (e.g. 320 mg) of prednisolone.
Source: Normansell (2016) |
|
Low GRADE |
The evidence suggests that a lower total dose during a course of prednisolone to treat patients with an acute asthma exacerbation results in little to no difference in lung function measured by peak flow compared to a higher total dose of prednisolone.
Source: Normansell (2016) |
|
Low GRADE |
The evidence suggests that a lower total dose (e.g. 225 mg) during a course of prednisolone to treat patients with an acute asthma exacerbation results in little to no difference in adverse events compared to a higher total dose (e.g. 1575 mg) of prednisolone.
Source: Normansell (2016) |
Samenvatting literatuur
Description of studies
Normansell (2016) performed a systematic review of randomized controlled trials to compare the effects of various corticosteroid treatment schemes to treat an acute asthma exacerbation on the primary outcomes admission/readmission, asthma symptoms at the end of the steroid course, and serious adverse events. Secondary outcomes relevant to this guideline were recurrent exacerbation, lung function tests at end of steroid course, and adverse events. The review reported comparisons that were not strictly defined, such as longer vs shorter course duration, or higher vs lower dose to be able to pool results. For this guideline, we analysed the studies according to the PICO. The study planned to perform subgroup analyses for severity of asthma exacerbation, and other subgroups. The review included 18 studies in 2,438 participants, of which 7 studies included adults. Five of these studies, including 170 patients, were relevant to this guideline, as one study reported no quantitative data, and one study compared two different medications. Recurrence rate of exacerbations and lung function measurements FEV1 (% of predicted value) and PEF were reported. The included studies reported on patients who visited the emergency department or outpatient clinic, however, the severity of the asthma exacerbations was not reported.
No studies were found that addressed the second search question and PICO.
Results
1. Longer versus shorter duration of prednisolone treatment
1.1. Duration of hospitalisation
No studies reported on the crucial outcome measure hospitalisation duration.
1.2. PEFR
Normansell (2016) reported a mean difference to compare the effect of longer versus shorter prednisolone treatment on PEFR. One study (Jones, 2002) reported that the PEFR was 15 l/min lower (95% CI: -42.04 to 72.04) after a prednisolone course of 5 days 40mg, compared to 10 days of the same dosage. This difference was not considered clinically relevant, and the confidence interval included the null effect.
1.3. Recurrent exacerbations
Normansell (2016) reported an odds ratio to estimate the effect of longer (10 days) versus shorter (5 days) prednisolone treatment to prevent recurrent asthma exacerbations. One study in this systematic review (Jones, 2002) reported an odds ratio of 2.62 (95% CI: 0.1 to 67.83) in favour of prednisolone course of 5 days 40mg, compared to 10 days of the same dosage. The odds ratio is considered clinically relevant, but the confidence interval includes the minimal clinical important difference, as well as the null effect.
2. Higher versus lower total dosage over course of prednisolone treatment (including tapering strategies with different total doses)
2.1. Duration of hospitalisation
No studies reported on the crucial outcome measure hospitalisation duration as all patients were discharged home.
2.2. Recurrent exacerbations
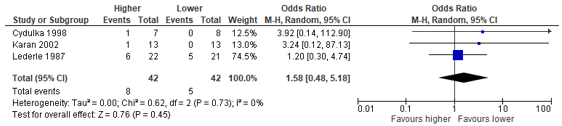
Normansell (2016) reported odds ratios and risk differences to estimate the effect of a higher (320-1575 mg) versus a lower (180-225 mg) total dosage of prednisolone treatment to prevent recurrent asthma exacerbations (follow-up durations: Cydulka, 1998: 21 days; Karan, 2002: 21 days; Lederle, 1987: 12 weeks). These three studies reported recurrence incidences, and we calculated a pooled odds ratio over these three studies (see Figure 1). The pooled odds ratio was 1.58 (95% CI: 0.48 to 5.18) in favour of the lower total dosage. The odds ratio is considered clinically relevant, but the confidence interval includes the minimal clinical important difference, as well as the null effect.
Figure 1 - Forest plot to compare the effect higher versus lower total dosage of prednisolone to treat an acute asthma exacerbation on recurrent exacerbation.
CI, confidence interval; I2, heterogeneity; M-H, Mantel-Haenszel
FEV1
Normansell (2016) reported a mean difference to compare the effect of a higher versus a lower total dosage of prednisolone treatment on FEV1. Two studies reported the FEV1 at the end of the prednisolone course (Cydulka, 1998; Karan, 2002). Cydulka (1998) reported a 2.5 %pred (95% CI: -10.82 to 15.82) higher FEV1 after a course of 40 mg/d prednisolone for 8d (total 320 mg prednisolone) compared to a course of 40 mg/d prednisolone tapering by -5 mg/d/d for 8d (total 180 mg prednisolone). Karan (2002) reported a -1.3 % (95% CI: -5.04 to 2.44) lower FEV1-predicted after a course of 40 mg/d prednisolone for 8d (total 320 mg prednisolone) compared to a course of 40 mg/d prednisolone reducing the dose by 5 mg per day for 8d (total 180 mg prednisolone). Both differences were not considered clinically relevant, and the confidence intervals include the minimal clinical important difference, as well as the null effect.
PEFR
Normansell (2016) reported a mean difference to compare the effect of a higher versus a lower total dosage of prednisolone treatment on PEFR. One study (O’Driscoll, 1993) reported that the PEFR was -26 l/min lower (95% CI: -85 to 33) after a prednisolone course of 40 mg/d prednisolone for 10d, followed by reducing the dose by 5 mg per day for 7d (total 540 mg prednisolone), compared to a course of 40 mg/d prednisolone for 10d, followed by placebo tapering for 7d (total 400 mg prednisolone). This difference was considered clinically relevant, but the confidence interval includes the minimal clinical important difference, as well as the null effect.
Adverse events
Normansell reported a mean difference to compare the effect of a higher versus a lower total dosage of prednisolone treatment on adverse events. Two studies (Lederle, 1987; Cydulka, 1998) reported on adverse events.
Lederle (1987) reported 9 cases of adverse events in the patients in the study arm who received a total dose of 1575 mg prednisolone (n=22), and 3 cases in the patients in the study arm who received a total dose of 225 mg of prednisolone (n=21). In this study, adverse events were defined as: weight gain, oedema, acne and easy bruising. This translates to a risk ratio of 2.9 (95% CI: 0.9 to 9.2). This risk ratio was considered clinically relevant, but the confidence interval includes the minimal clinically important difference and the null.
Cydulka reported no cases of adrenal suppression in any arm. No comparative measure could be calculated.
Level of evidence of the literature
Longer versus shorter duration of prednisolone treatment
The level of evidence regarding the outcome measure recurrent exacerbation was ungraded due to lack of data.
The level of evidence regarding the outcome measure lung function (PEFR) started as High (systematic review of clinical trials) and was downgraded by two levels to Low because of imprecision (confidence interval crosses clinically important difference on detrimental as well as beneficial effect directions).
Higher versus lower total dosage over course of prednisolone treatment (including tapering strategies with different total doses)
The level of evidence regarding the outcome measure recurrent exacerbation started as High (systematic review of clinical trials) and was downgraded by two levels to Low because of the imprecision (confidence interval crosses clinically important difference on detrimental as well as beneficial effect directions).
The level of evidence regarding the outcome measure lung function (FEV1) started as High (systematic review of clinical trials) and was downgraded by two levels to Low because of the imprecision (confidence intervals crossed clinically important difference on detrimental as well as beneficial effect directions).
The level of evidence regarding the outcome measure lung function (PEFR) started as High (randomised clinical trial) and was downgraded by two levels to Low because of indirectness (treatment initiated two days after exacerbation), and imprecision (low number of patients).
The level of evidence regarding the outcome measure adverse events started as High (systematic review of clinical trials) and was downgraded by two levels to Low because of the imprecision (confidence intervals crossed clinically important difference on detrimental as well as beneficial effect directions).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
1a. Is there a benefit in using a higher dose of prednisolone than 40 mg per day in the treatment of an acute asthma exacerbation?
1b. Is there a benefit in using a longer period of a prednisolone course, i.e. 10 days, versus a shorter period of 5 days in the treatment of an acute asthma exacerbation?
2. Which subgroup of patients (e.g. regarding severity of the exacerbation, use of biologicals, previous or recent use of steroids) would benefit from a different dosage?
P (Patients) = adult patients who present in a hospital (emergency department or outpatient clinic) with a suspected asthma exacerbation
I (Intervention) = treatment with high-dose prednisolone (>40 mg per day)
After the literature search and selection, in addition longer treatment duration and tapering strategies that lead to a higher total dose of prednisolone were considered as interventions
C (Comparison) = treatment with low-dose prednisolone (≤40 mg per day)
O (Outcomes) = (crucial) duration of hospitalisation, recurrent hospitalization, ICU-hospitalization, recurrent exacerbation
(important) FEV1, PEFR, SABA, (serious) adverse events
Relevant outcome measures
The guideline development group considered duration of hospitalization, recurrent hospitalization, ICU-hospitalization, recurrent exacerbation as crucial outcome measures for decision making; and FEV1, PEFR, SABA, (serious) adverse events as important outcome measures for decision making.
The working group used the following minimal clinically important differences (MCID) for the relevant outcome measures:
(Richtlijn ernstig astma; Santanello, 1999; Bonini, 2019)
Crucial:
- Duration of hospitalization: ≥ 1 day difference
- Recurrent hospitalization related to an exacerbation: 50% risk difference
- Recurrent exacerbation within the follow-up duration of the study: 50% risk difference
- ICU-hospitalization: ≥0.5d difference
Important:
- FEV1: 20%
- PEF: definition as used in literature
- SABA: definition as used in literature
- Adverse events as used in literature
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until December 13, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 392 hits. Studies were selected based on the following criteria: systematic review of randomised controlled trials, randomised controlled trial, relevant to PICO, article in English or Dutch, no conference abstract. Eight studies were initially selected based on title and abstract screening. After reading the full text, 7 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 1 study was included.
Results
One study was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Bonini M, Di Paolo M, Bagnasco D, Baiardini I, Braido F, Caminati M, Carpagnano E, Contoli M, Corsico A, Del Giacco S, Heffler E, Lombardi C, Menichini I, Milanese M, Scichilone N, Senna G, Canonica GW. Minimal clinically important difference for asthma endpoints: an expert consensus report. Eur Respir Rev. 2020 Jun 3;29(156):190137. doi: 10.1183/16000617.0137-2019. PMID: 32499305; PMCID: PMC9488652.
- Santanello NC, Zhang J, Seidenberg B, Reiss TF, Barber BL. What are minimal important changes for asthma measures in a clinical trial? Eur Respir J. 1999 Jul;14(1):23-7. doi: 10.1034/j.1399-3003.1999.14a06.x. PMID: 10489824.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question:
1. Is there a benefit in using a higher dose of prednisolone than 30/40 mg per day in the treatment of an acute asthma exacerbation?
2. Which subgroup of patients (e.g. regarding severity of the exacerbation, use of biologicals, previous or recent use of steroids) would benefit from a different dosage?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Normansell, 2016
individual study characteristics deduced from Normansell, 2016
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to April 2016
A: Cydulka, 1998 B: Jones, 2002 C: Karan, 2002
E: Lederle, 1987 F: O'Driscoll, 1993
Study design: RCT
Setting and Country: A: ED, USA B: inpatient, UK C: outpatient, India E: inpatient, not reported F: inpatient, UK
Source of funding and conflicts of interest: A: not reported B: not reported C: not reported E: placebo tablets provided by Rowell Laboratories Inc., Baudette, Minnesota, USA F: placebo tablets provided by Pfizer UK Ltd |
Inclusion criteria SR: RCTs (blinded and unblinded) comparing any dose of any type of oral corticosteroids in patients with an acute asthma exacerbation
Exclusion criteria SR: Crossover trials
16 studies included, of which 7 in adults
Important patient characteristics at baseline:
N, mean age A: 15; I 24.1 C 32.0 (I 5.0 C 8.5) B: 47; I 29.8 C 32.0 (I 11.3 C 11.0) C: 26; I 43.9 C 49.2 (I 12.4 C 12.1) E: 43; I 62.6 C 63 (not reported) F: 39; I 28 C 37 (I 18-55 (range) C 20-53 (range)) Sex: A: I: not reported%; C: not reported% B: I: not reported%; C: not reported% C: I: not reported%; C: not reported% E: I: 100%; C: 100% F: I: not reported%; C: not reported%
Groups comparable at baseline? A: probably yes B: probably yes D: probably yes E: probably yes F: probably yes |
Describe intervention:
A: 40 mg/d prednisolone for 8d (total 320 mg prednisolone eq) B: 40 mg/d prednisolone for 10d (total 400 mg prednisolone eq) C: 40 mg/d prednisolone for 8d (total 320 mg prednisolone eq) E: 40 mg/d prednisolone tapering by -5 mg/d/w for 7w (total 1575 mg prednisolone eq) F: 40 mg/d prednisolone for 10d, followed by tapering by -5 mg/d/d for 7d (total 540 mg prednisolone eq) |
Describe control:
A: 40 mg/d prednisolone tapering by -5 mg/d/d for 8d (total 180 mg prednisolone eq) B: 40 mg/d prednisolone for 5d (total 200 mg prednisolone eq) C: 40 mg/d prednisolone tapering by -5 mg/d/d for 8d (total 180 mg prednisolone eq) E: 45 mg/d prednisolone tapering by -5 mg/d/d for 7d (total 225 mg prednisolone eq) F: 40 mg/d prednisolone for 10d, followed by placebo tapering for 7d (total 400 mg prednisolone eq) |
End-point of follow-up:
A: 21d B: 21d C: 21d E: 12w F: 28d
For how many participants were no complete outcome data available? A: I: -; C: - B: overall 3 C: overall 2 E: I: -; C: - F: overall 4
|
Comparison 1: Longer vs Shorter duration Outcome measure-1 Exacerbation recurrence (higher favours shorter duration)
B: OR: 2.62 (95% CI: 0.1 to 67.83)
Outcome measure-2 PEFR (higher favours longer duration)
B: MD: 15 l/min (95% CI: -42.04 to 72.04)
Comparison 2: Taper vs No taper
Outcome measure-1 Exacerbation recurrence (higher favours lower total dosage) A: RD: 0.14 (95% CI: -0.17 to 0.45) C: RD: 0.08 (95% CI: -0.11 to 0.27) E: OR: 1.2 (95% CI: 0.3 to 4.74)
Outcome measure-2 Lung function (FEV1% pred) (higher favours non-tapered course) A: MD: 2.5 (95% CI: -10.82 to 15.82) C: MD: -1.3 (95% CI: -5.04 to 2.44)
Outcome measure-3 Lung function (PEFR) (lower favours lower total dosage) F: MD: -26 (95% CI: -85 to 33)
|
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
Risk of bias tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Normansell, 2016 |
No
Reason: The research question leaves the possibility to compare treatment strategies that may be substantially different as being similar |
Yes
Reason: Well described and comprehensive search |
Yes
Reason: Well reported populations, interventions, comparisons, and outcomes |
Yes
Reason: Well reported populations, interventions, comparisons, and outcomes |
Not applicable
Reason: only RCTs were included in this review |
Yes
Reason: GRADE methodology was used to assess scientific quality |
Yes
Reason: Sufficient sub-comparisons have been made to assess differences between interventions |
Yes
Reason: risk taken into account, but number of studies was insufficient to address in funnel plot |
Yes
Reason: Addressed, but not all underlying studies reported potential CoIs |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Webb, 1986 |
Wrong setting |
|
O’Driscoll 1993 |
Included in SR |
|
Jones 2002 |
Included in SR |
|
Krishnan 2009 |
Wrong comparison, no quantitative results |
|
Hatton 1995 |
Inhaled corticosteroids |
|
Manser 2001 |
Wrong comparison |
|
Klaustermeyer 2016 |
Background article |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 19-02-2024
Laatst geautoriseerd : 19-02-2024
Geplande herbeoordeling : 19-02-2027
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom de longaanval astma.
Samenstelling werkgroep
- Dr. E.J.M. (Els) Weersink, longarts, Amsterdam UMC te Amsterdam, NVALT (voorzitter)
- Drs. A. (Annelies) Beukert, longarts, Martini Ziekenhuis te Groningen, NVALT
- Dr. G.J. (Gert-Jan) Braunstahl, longarts, Franciscus Gasthuis & Vlietland te Rotterdam, NVALT
- Drs. R.C. (Rachel) Numan, AIOS longgeneeskunde, HagaZiekenhuis te ’s Gravenhage, NVALT
- Drs. L.C. (Louise) Urlings-Strop, intensivist, Reinier de Graaf Ziekenhuis, Delft, NVIC
- Drs. F.E.C. Geijsel, SEH-artsKNMG, OLVG te Amsterdam, NVSHA
- Dr. E.C. (Erwin) Vasbinder, ziekenhuisapotheker, Franciscus Gasthuis & Vlietland te Rotterdam, NVZA
- Prof. Dr. J.W.M. (Jean) Muris, huisarts en hoogleraar huisartsgeneeskunde, Maastricht UMC+ te Maastricht, NHG
- M.H.A. (Mariëtte) Scholma MSc, verpleegkundig specialist longziekten, Wilhelmina Ziekenhuis Assen te Assen, V&VN
- L.A.M. (Betty) Frankemölle, patiëntvertegenwoordiger, Longfonds
- M.A.P. (Marjo) Poulissen, patiëntvertegenwoordiger, Longfonds
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Weersink* |
Longarts, afdeling longziekten Academisch Medisch Centrum, Amsterdam |
voorzitter RL ernstig astma (afgerond) |
In 2017 voor meerdere farmaceutische bedrijven een betaald adviseurschap. (GSK, Novartis, TEVA, Chiesi Boehringer). In 2019-2020 nog wel adviseurschap niet meer tegen betaling. 2019: dienstverlening, bijdrage aan sympsoium van Astra Zeneca, Novartis, Genzyme BV 2019: vergoeding gastvrijheid Genzyme BV.
Bestuurslid stichting RAPSODI, de stichting die de database voor ernstig astma beheerd en mede gefinancierd wordt door ZONMW, Novartis, GSK, TEVA, Astra Zeneca en Sanofi. Hier is inmiddels een governance vastgelegd welke rol de farmaceuten hierbij hebben. |
Geen actie |
|
Urlings |
Intensivist (longarts) – Reinier de Graaf Gasthuis |
Waarneming diverse ziekenhuizen Intensive Care – betaald |
Geen |
Geen actie |
|
Vasbinder |
ziekenhuisapotheker |
Redacteur van medisch-farmaceutisch handboek “Praktische Farmacotherapie bij Longaandoeningen”, betaald door uitgever Lannoo Campus |
Betrokken bij meerdere onderzoeken bij patiënten met moeilijk behandelbaar/ernstig astma dat financieel wordt ondersteund door: * diverse zorgverzekeraars * TEVA (farmaceutische industrie) * Astra Zeneca (hoofdonderzoeker)
Geneesmiddeleninkoop voor het ziekenhuis, waaronder biologicals, verwachting dat deze binnen het kader van deze RL niet relevant zijn |
Geen actie |
|
Muris |
Universiteit Maastricht 1.0 fte Huisartspraktijk Geulle 17 werkdagen spreekuur / jaar |
Geen |
Webinar over orale corticosteroïden bij astma (GSK) |
Geen actie |
|
Geijsel |
SEH arts KNMG bij OLVG, tevens plaatsvervangend opleider en fellow opleider (95%) SEH arts bij MyEmergencyDoctor, Australische werkgever, telehealth (5%) |
EM-masterclass ontwikkelaar en faculty (betaald) |
Geen |
Geen actie |
|
Poulissen |
Projectleider zorg Longfonds full time (met detachering voor 12 uur naar astmaVereniging Nederland en Davos). |
Geen |
Geen |
Geen actie |
|
Beukert |
longarts te Martini Ziekenhuis Groningen tot 1-8-2021 Longarts te Deventer Ziekenhuis, Deventer, vanaf 23-8-2021 |
Secretaris Sectie Astma en Allergie (SAA) van de NVALT, onbetaald Lid werkgroep binnen SAA over biologicals, onbetaald |
Enkele keer deelname aan een betaalde adviesraadbijeenkomst (laatste in 2021, over biologicals) bij farmaceut maar dat houdt m.i. geen relatie met de inhoud van deze richtlijn |
Geen actie |
|
Numan |
AIOS longgeneeskunde HAGA ziekenhuis |
Geen |
Geen |
Geen actie |
|
Frankemölle |
Vrijwilligster bij het Longfonds, lid van de Longfonds Ervaringsdeskundigengroep. astmaVereniging Nederland en Davos Vrijwilligster European Lung Foundation, lid van SHARP |
Ik neem deel aan diverse werkgroepen maar geen van allen heeft als hoofdthema astma-aanval. |
Geen |
Geen actie |
|
Braunstahl |
Longarts, Franciscus Gasthuis & Vlietland Rotterdam |
Null-aanstelling ErasmusMC voor onderzoek: onbetaald. Deelname RL ernstig astma en KNO-RL, obesitas |
Vergoeding: Presentaties en incidenteel advieswerk voor Boehringer Ingelheim, Sanofi, Novartis, GSK, AstraZeneca, ALK, MEDA en Chiesi. (wrsch speelt deze longmedicatie geen rol in deze richtlijn)
Deelname richtlijn ernstig astma Deelname klankbordgroep van het project ‘Obesitas volwassenen’
Webinar over orale corticosteroïden bij astma (GSK)
Geen vergoeding: Redactie NTvAAKI Bestuur RoLeX astma/COPD nascholingen Bestuur Rapsodi, ernstig astma database NL Voorzitter astmasectie NVALT Wetenschappelijke adviescommissie Longfonds |
Geen actie |
|
Scholma |
Verpleegkundig specialist longziekten Wilhelmina Ziekenhuis Assen |
vrijwilliger longfonds, expertgroep zorgaanpak COPD (chiesi). Geen relatie met longaanval astma voorzitter kwaliteitsteam Assen van de HZD |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door afgevaardigde patiëntenvereniging Longfonds in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan het Longfonds en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Corticosteroïden bij longaanval astma |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een longaanval astma.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodi
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. Doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. Doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. Doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. Doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. Doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. Doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.