Nervus vagus stimulatie bij epilepsie
Uitgangsvraag
Welke patiënten komen in aanmerking voor behandeling met nervus vagus stimulatie (NVS)?
Aanbeveling
Overweeg nervus vagus stimulatie bij patiënten (kinderen en volwassenen) met therapieresistente epilepsie, bij wie epilepsiechirurgie geen optie is. Daarbij moet rekening gehouden worden met de kans op complicaties en bijwerkingen.
De belangrijkste (zeldzame) complicaties van de implantatie zijn postoperatieve infectie, stembandparese en tijdelijke unilaterale zwakte van de gezichtsspieren. Overige bijwerkingen als gevolg van de implantatie zijn heesheid, hoesten en paresthesieën. De belangrijkste bijwerkingen ten gevolge van stimulatie zijn heesheid en dyspneuklachten. De belangrijkste bijwerkingen van implantatie in combinatie met stimulatie zijn heesheid, dyspneuklachten, paresthesieën en pijn.
Houd bij MRI en diathermie rekening met speciale voorzorgsmaatregelen, wanneer iemand met nervus vagus stimulatie wordt behandeld of is behandeld.
Voer geen MRI uit van de cervicale wervelkolom of schouderregio wanneer iemand wordt behandeld of is behandeld met nervus vagus stimulatie.
Verwijs mensen bij wie nervus vagus stimulatie overwogen wordt, naar de gespecialiseerde epilepsiezorg (zie hiervoor ook het Handboek Nervus Vagus Stimulatie van de landelijke werkgroep NVS).
Overwegingen
Uit de literatuur volgt dat het aannemelijk is dat nervus vagus stimulatie met hoge stimulatieparameters voor een afname in aanvalsfrequentie zorgt bij patiënten met epilepsie (Handforth, et al., 1998; The Vagus Nerve Stimulation Study Group, 1995). De studie van Klinkenberg et al. (2012), die op zichzelf geen effect op de aanvalsfrequentie liet zien, laat daarnaast zien dat vermindering van de ernst van de aanvallen en verbetering van het welzijn op kunnen treden. Dit maakt deze behandeling de moeite waard om te overwegen bij kinderen en volwassenen met therapieresistente epilepsie.
Deze conclusie is in lijn met de recent verschenen evidence based richtlijn update van de American Academy of Neurolgy (AAN) (Morris et al., 2013). Hierin wordt aangegeven dat NVS overwogen kan worden bij kinderen of bij patiënten met het Lennox Gastaut syndroom. Ook kan NVS overwogen worden bij volwassenen met epilepsie ter verbetering van de stemming. Bij kinderen wordt geadviseerd alert te zijn op een wondinfectie post-operatief. Duncan en Devinsky geven een kritische beschouwing van deze richtlijn (Dugan and Devinsky, 2013). De auteurs geven aan dat zij als clinici het positieve effect van NVS onderkennen en NVS een waardevolle aanvulling vinden bij de behandeling van patiënten met therapieresistente epilepsie maar dat de wetenschappelijke onderbouwing onvoldoende is.
De lange termijn effecten van NVS werden beschreven door Chrastina, et al.(Chrastina, et al., 2018). Patiënten waarbij meer dan 10 jaar gelden een NVS behandeling werd gestart werden jaarlijks geëvalueerd. In totaal werden 74 patiënten geïncludeerd. De NVS behandeling varieerde van 10-17 jaar. Volgend op een initiële toename van het aantal patiënten met goede behandelresultaten ( gedefinieerd als >50% of >90% aanvalsfrequentie reductie) ontstond er na 6 jaar een stabiele fase. Bij de meeste patiënten met en vertraagde respons op NVS ging deze vooraf door een medicatie wijziging in het voorafgaande jaar. Leeftijd van de patiënt, epilepsieduur, debuut leeftijd, MRI bevindingen en type aanval bleken geen significante voorspeller van de lange termijn uitkomsten.
Bijwerkingen en complicaties
Complicaties kunnen samenhangen met de implantatie of met de stimulatie (of beide). In de Cochrane review van Privitera (Privitera,et al., 2010) zijn deze bijwerkingen onderscheiden door het vergelijken van de baseline met de lage stimulatie (relatie met implantatie), de lage met de hoge stimulatie (relatie met stimulatie) en de baseline met de hoge stimulatie (relatie met beide).
In de twee geïncludeerde RCTs zijn de belangrijkste (zeldzame) complicaties van de implantatie postoperatieve infectie, stembandparese en tijdelijke unilaterale zwakte van de gezichtsspieren. De overige gerapporteerde bijwerkingen als gevolg van de implantatie die significant vaker voorkwamen zijn heesheid, hoesten en paresthesieën.
De belangrijkste gerapporteerde bijwerkingen ten gevolge van stimulatie die significant vaker voor kwamen zijn heesheid en dyspneuklachten. De belangrijkste bijwerkingen van implantatie in combinatie met stimulatie zijn heesheid, dyspneuklachten, paresthesieën en pijn.
Bij de volgende patiëntencategorieën moet extra zorg zijn voor eventuele bijwerkingen:
- patiënten met pre-existente slaapapneuproblematiek;
- patiënten met pre-existente slikproblemen;
- patiënten met pre-existente psychiatrische problematiek.
SUDEP
Er is slechts een beperkt aantal gegevens bekend over het SUDEP-risico bij patiënten met een therapieresistente epilepsie die behandeld worden met NVS. Mogelijk is sprake van een afgenomen risico op SUDEP bij langdurige behandeling met NVS (Ryvlin et.al., 2017). Deze informatie is gebaseerd op registeronderzoek waarbij de gegevens van in totaal 40.443 NVS-patiënten over een follow-upperiode van 10 jaar geanalyseerd zijn. 3689 patiënten kwamen in die periode te overlijden waarvan 632 als gevolg van SUDEP. Er bleek een meer dan 30% afname van het aantal SUDEP-gevallen tussen 1-2 jaar en 3-10 jaar follow-up. Het merendeel van de gevallen betrof een mogelijke SUDEP. Deze getallen komen niet overeen met resultaten uit een eerdere studie (Granbichler et al., 2015). Bij de studie van Granblicher et al. is echter uitgegaan van een bewezen SUDEP. De incidentie van SUDEP bleek in genoemde studie vergelijkbaar met de incidentie in andere cohorten van patiënten met therapieresistente epilepsie. Vooralsnog kan worden geconcludeerd dat bij behandeling met NVS de kans op SUDEP onveranderd blijft of mogelijk zelfs vermindert.
Magnetic Resonance Imaging(MRI)-onderzoek
Hoge elektromagnetische veldsterkten kunnen de pulsgenerator beschadigen. Bovendien kan een hoge veldsterkte een temperatuurstijging veroorzaken rondom de stimulator en/of de elektroden. Hierdoor kan weefselschade ontstaan. MRI-onderzoek kan alleen onder speciale condities en bij een intact systeem worden uitgevoerd. De instructies die de fabrikant geformuleerd heeft zijn te vinden op de ‘VNS Therapy System Physician’s Manual (US)’ op https://vnstherapy.com/. In de literatuur wordt melding gemaakt van uitgebreidere toepassingsmogelijkheden. In alle gevallen is overleg met de radioloog noodzakelijk.
(Bipolaire) diathermie
Bipolaire diathermie voor chirurgische doeleinden is onder speciale condities toegestaan. Overige vormen van diathermie zijn gecontra-indiceerd. Behandeling met kortegolf diathermie, microgolf diathermie of therapeutische ultrasound diathermie (hierna ‘diathermie’ genoemd) mag niet worden toegepast. Energie die vrijkomt bij diathermie kan via het geïmplanteerde systeem omgezet worden in warmte. Hierdoor kan weefselschade ontstaan. Letsel of schade is altijd mogelijk bij een diathermiebehandeling. Het maakt niet uit of de pulsgenerator is INgeschakeld of UITgeschakeld. Bovendien kan diathermie onderdelen van het neurostimulatiesysteem beschadigen.
Bipolaire diathermie voor chirurgische doeleinden is toegestaan mits de nervus vagus stimulator is UITgeschakeld (0 mA zowel normale als magneetstimulatie). De vector energie, of stroom, moet van de stimulator weggeleid worden door middel van een kleefplaat.
Economische evaluaties
De economische evaluatie van Helmers et al. (Helmers et al., 2012) is bruikbaar en laat zien dat nervus vagus stimulatie een kosteneffectieve behandeling is bij kinderen met therapieresistente epilepsie. Voor de beoordeling van de studies wordt verwezen naar de evidence tabel onder ‘economisch evaluatieonderzoek’ in de bijlagen.
Onderbouwing
Achtergrond
Nervus vagus stimulatie (NVS) is een niet-medicamenteuze behandeling van epilepsie. De nervus vagus stimulator bestaat uit een programmeerbare pulsgenerator die onderhuids wordt geïmplanteerd. De stimulatie-elektroden worden onderhuids getunneld naar de linker nervus vagus en hieromheen gelegd. De stimulatieparameters worden telemetrisch ingesteld.
Om de vraag te beantwoorden wanneer NVS geïndiceerd is, is in de literatuur gezocht naar studies naar het effect van NVS op de aanvalsfrequentie. Als er een gunstig effect aangetoond wordt, kan uit de inclusiecriteria voor deze studies worden afgeleid welke patiënten in aanmerking komen voor NVS.
Conclusies
|
Matig |
Het is aannemelijk dat nervus vagus stimulatie met hoge stimulatieparameters bij patiënten van 4 jaar of ouder met therapieresistente epilepsie op de korte termijn een gunstig effect heeft op de aanvalsfrequentie.
(Handforth, et al., 1998; The Vagus Nerve Stimulation Study Group, 1995; Klinkenberg et al., 2012) |
Samenvatting literatuur
In de systematische review zijn twee randomized controlled trials (RCTs) opgenomen van de VNS study group (The Vagus Nerve Stimulation Study Group, 1995) en Handforth (Handforth et al., 1998). Deze RCTs met betrekking tot patiënten van 12 jaar en ouder, gaan over patiënten met therapieresistente focale epilepsie met focale en bilateraal spreidende tonisch clonische aanvallen (Handforth et al., 1998;The Vagus Nerve Stimulation Study Group, 1995). De behandelgroep, waar patiënten voor 12 tot 16 weken werden behandeld met hoge stimulatieparameters, werd vergeleken met de controlegroep, waar patiënten voor dezelfde periode werden behandeld met lage stimulatieparameters. Intention-to-treat analyse vond plaats. Er zijn geen studies gevonden over de langere termijn.
De RCT met betrekking tot kinderen van 4 tot 18 jaar gaat eveneens over patiënten met therapieresistente focale epilepsie met focale en bilateraal spreidende tonisch clonische aanvallen (Klinkenberg et al., 2012). Deze patiënten werden 20 weken lang behandeld met hoge (behandelgroep) of lage (controlegroep) stimulatieparameters.
Afname van de aanvalsfrequentie van 50% of meer
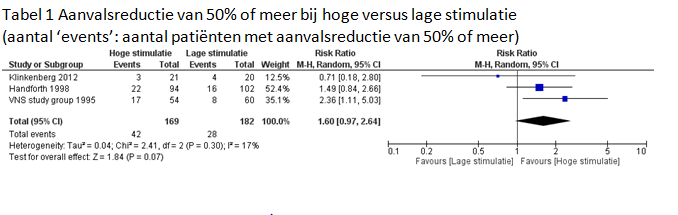
Alle drie de geïncludeerde RCTs bekeken het effect van hoge versus lage nervus stimulatie op een afname in aanvalsfrequentie van 50% of meer. Twee RCTs onderzochten dit bij een patiëntenpopulatie van 12 jaar en ouder en een RCT onderzocht dit bij kinderen van 4-18 jaar. In dit hoofdstuk wordt echter geen onderscheid gemaakt tussen kinderen en volwassenen. Omdat de behandelingen die toegepast zijn in de studies ongeveer gelijk zijn, was het mogelijk om een meta-analyse van de drie studies uit te voeren. De resultaten van de meta-analyse voor de uitkomstmaat aanvalsreductie van 50% of meer zijn te zien in tabel 1. Het gepoolde relatieve risico op aanvalsreductie van 50% of meer is 1.6. Dit betekent dat de kans op een aanvalsreductie van 50% of meer in de groep behandeld met hoge stimulatie ongeveer 1.6 keer zo groot is ten opzichte van de groep behandeld met lage stimulatie. Door hoge stimulatie wordt de kans op aanvalsreductie dus met 60% vergroot. Dit resultaat is niet significant, wat duidt op imprecisie. De bewijskracht van de meta-analyse gaat daarom met een niveau omlaag. Daarnaast kan er van het resultaat dat hoge stimulatie tot meer aanvalsafname leidt dan lage stimulatie alleen indirect afgeleid worden dat nervus vagus stimulatie effectief is. De werkgroep trekt hiervoor echter geen punten van de bewijskracht af.
Zoeken en selecteren
Er is gezocht naar literatuur over het effect van nervus vagus stimulatie bij volwassenen en kinderen vanaf 1 januari 2004 in de databases Medline, Embase en the Cochrane Library. Uiteindelijk werd er één systematische review en één randomized controlled trial (RCT) geïncludeerd op basis van de volgende criteria:
- Onderzoek is van voldoende kwaliteit (systematische reviews, randomized controlled trials (RCTs)).
- Onderzoek hanteert als uitkomstmaat een 50% afname van de aanvalsfrequentie.
Vanwege het kleine aantal RCTs is ervoor gekozen om de originele studies te gebruiken voor het beantwoorden van de vraag en niet de systematische review. In 2015 werden deze studies opgenomen in een Cochrane review (Panebianco et al., 2015).
Referenties
- Chrastina, J., Z. Novak, T. Zeman, J. Kocvarova, M. Pail, I. Dolezalova, . . . M. Brazdil. (2018). Single-center long-term results of vagus nerve stimulation for epilepsy: A 10-17 year follow-up study. Seizure, 59, 41-47. DOI: 10.1016/j.seizure.2018.04.022.
- Dugan P., Devinsky O. 2013. Epilepsy: Guidelines on vagus nerve stimulation for epilepsy. Nat Rev Neurol. 2013 Nov;9(11):611-2. doi: 10.1038/nrneurol.2013.211. Epub 2013 Oct 15. No abstract available. PMID: 24126624.
- Granbichler, C. A., Nashef, L., Selway, R., & Polkey, C. E. (2015). Mortality and SUDEP in epilepsy patients treated with vagus nerve stimulation. Epilepsia, 56(2), 291-296. doi: 10.1111/epi.12888
- Handboek Nervus Vagus Stimulatie van de landelijke werkgroep NVS. Versie: april 2019. Link: https://www.epilepsieliga.nl/nvshandboek/105/117/0/0/Aanvraag-implantatie--keuze-implantatiecentrum/
- Handforth, A., DeGiorgio, C.M., Schachter, S.C., Uthman, B.M., Naritoku, D.K., Tecoma, E.S., Hnery, T.R., Collins, S.D., Vaughn, B.V., Gilmartin, R.C., Labar, D.R., Morris, G.L., Salinsky, M.C., Osorio, I., Ristanovic, R.K., Labiner, D.M., Jones, J.C., Murphy, J.V., Ney, G.C., Wheless, J.W. (1998). Vagus nerve stimulation therapy for partial-onzet seizures: a randomized active-controle trial. Neurology 51, 48-55.
- Helmers, S. L., Duh, M. S., Guerin, A., Sarda, S. P., Samuelson, T. M., Bunker, M. T., . . . Faught, E. (2012). Clinical outcomes, quality of life, and costs associated with implantation of vagus nerve stimulation therapy in pediatric patients with drug-resistant epilepsy. Eur J Paediatr Neurol, 16(5), 449-458. doi: 10.1016/j.ejpn.2012.01.001.
- Klinkenberg, S., Aalbers, M. W., Vles, J. S., Cornips, E. M., Rijkers, K., Leenen, L., et al. (2012). Vagus nerve stimulation in children with intractable epilepsy: a randomized controlled trial. Dev Med Child Neurol, 54(9), 855-861.
- Morris, G. L. 3rd., Gloss, D., Buchhalter, J., Mack, K. J., Nickels, K., Harden, C. 2013. Evidence-based guideline update: Vagus nerve stimulation for the treatment of epilepsy: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology 2013 Aug 28
- Panebianco, M., Rigby, A., Weston, J., & Marson, A. G. (2015). Vagus nerve stimulation for partial seizures. Cochrane Database Syst Rev, 4, CD002896. doi: 10.1002/14651858.CD002896.pub2
- Privitera, M.D., Welty, T.T.E. Ficker, D.D.M., Welge, J. (2010). Vagus nerve stimulation for partial seizures (review). The Cochrane Library 7.
- Ryvlin, P., So, E. L., Gordon, C. M., Hesdorffer, D. C., Sperling, M. R., Devinsky, O., . . . Friedman, D. (2018). Long-term surveillance of SUDEP in drug-resistant epilepsy patients treated with VNS therapy. Epilepsia. doi: 10.1111/epi.14002.
- The Vagus Nerve Stimulation Group. (1995). A randomized controlled trial of chronic vagus nerve stimulation for treatment of medically intractable seizures. Neurology 45, 224-230.
Evidence tabellen
| Interventieonderzoek (trials en cohort) | |||||||||||
| Study reference | Study characteristics | Patient characteristics | Intervention (I) | Comparison / control (C) | Follow-up | Outcome measures and effect size | Comments | ||||
|
Handforth, 1998 |
Type of study: RCT
Setting: 20 U.S. centers
Country: USA
Source of funding: Not reported |
Inclusion criteria: -six partial-onset seizures involving alteration of consciousness (focal seizures with impaired awareness with or without bilateral tonic clonic seizures) over 30 days, with not more than 21 days between seizures -Age: 12-65 years -Use acceptable contraception if female and fertile -take one to three marketed antiepileptic drugs on a stable regimen for at least 1 month of five half-lives plus 2 weeks before study entry
Exclusion criteria: -deteriorating neurologic or medical conditions -pregnancy -cardiac or pulmonary disease -active peptic ulcer -history of nonepileptic seizures -more than one episode of status epilepticus in the previous 12 months -prior cervical vagotomy -inability to give proper consent -prior cervical vagotomy -inability to give proper consent -prior vagus nerve stimulation -prior brain stimulation -resective epilepsy surgery or inability to perform function test or comply with clinic visits
N=198
Intervention group: N=95
Mean age ± SD: 32.1 ±10.8
Sex:51.6 % M /48.4 % F
Control group: N=103
Mean age ± SD: 34.2 ±10.1
Sex: 42.7% M /57.3 % F
Groups comparable at baseline? yes, in demographic and pretreatment seizure characteristics |
High vagus nerve stimulation: on/off cycles of 30 seconds every 5 minutes, each “on” period consisting of 500-µs duration pulses at 30-Hz frequency (3.5 mA) |
Low vagus nerve stimulation: on/off cycles of 30 seconds every 3 hours, with each “on” cycle consisting of 130-µs duration pulses at 1-Hz frequency (3.5mA) |
Endpoint of follow-up: 12-16 weeks
For how many participants were no complete outcome data available? 2 patients
Intervention group: N (%):1/95 (1.05%)
Control group: N (%):1/103 (0.97%)
Reasons for incomplete outcome data described? -postical Cheyne-Stokes respiration (1 in intervention) -variety of symptoms during ramp-up (1 in control)
Significant differences between groups? no |
Reduction of 50% or more (%): I: 22 (23.4%) C: 16 (15.7%) p=0.172 |
|||||
|
Klinkenberg, 2011 |
Type of study: Double-blinded RCT
Setting: Maastricht University Medical center
Country: the Netherlands
Source of funding: NR |
Inclusion criteria: Children (age 4-18) with medically refractory epilepsy despite adequate and stable use of Aed concentrations and not eligible for surgery
Exclusion criteria: non-epileptic seizures; a documented history of generalized status epilepticus in the previous 3 months; evidence of a progressive cerebral lesion, degenerative disorder, or malignancy in the previous 5 years; the presence of unstable medical disease in the previous 2 years; schizophrenia or any psychotic symptomatology; a high risk of complications; a history of alcohol or drug abuse, or of psychiatric disorder requiring electroconvulsive therapy or chronic use of major tranquillizers in the previous 6 months; regular treatment with antihistamines, metoclopramide, or central nervous system- active compounds; and treatment with an experimental drug during previous 30 days
N=41
Intervention group: N=21
Mean age (range): 10yr, 11 months (3 yr, 10 months – 17 yr, 8 months)
Sex: 52% M (n=11) / 48% F (n=10)
Control group: N=20
Mean age (range): 11yr, 6 months (4 yr, 2 months – 17 yr, 2 months)
Sex: 60% M (n=12)/ 40% F (n=8)
Groups comparable at baseline? yes, in sex, age at implantation, age at onset, seizure frequency, ILAE classification, number of AEDs used before |
High vagus nerve stimulation
Treatment was initiated at output current 0.25mA, pulse 0.5, frequency 30 Hz, duty cycle on(s)/off(min): 30/5
After 2 weeks current was increased stepwise to maximum 1.75mA until there was a reduction of 50% or more in seizure frequency or the highest tolerable current was reached in the case of adverse events occuring
After treatment period the maximum current was 2.25mA |
Low vagus nerve stimulation
Treatment was initiated at output current 0.25mA, pulse 0.1, frequency 1 Hz, duty cycle on(s)/off(min): 14/60
Current was temporarily increased during clinical visits and switched back at the end of the visit
After treatment period, during add-on period, the control group was adjusted according to the schedule of the treatment group with a max current of 2.25 mA |
Endpoint of follow-up: 51 wks (12 wks baseline, 20 wks treatment, 19 wks add-on without control group)
For how many participants were no complete outcome data available?
Intervention group: N (%): 2/21 (10%)
Control group: N (%): 1/20 (5%)
Reasons for incomplete outcome data described? Unreliable/inclomplete seizure diaries
(additionally, information for four participants regarding the last 30 days of the add-on phase was missing (at that time there was no control group anymore))
Significant differences between groups? No |
50% reduction in seizure frequency during treatment period: I: 3/21 (14%) C: 4/20 (20%) P=1.000 |
- small study population (n=41)
- only children included (children may have different threshold values and conduction velocity)
- adverse events per group NR |
||||
|
The Vagus Nerve Stimulation study group, 1995 |
Type of study: RCT
Setting: 17 centers in North America and Europe
Country: USA, Germany, Canada, Sweden, the Netherlands
Source of funding: Sponsored by Cyberonics Inc., Houston, TX |
Inclusion criteria: -medically seizures defined as a frequency of ≥6 per month -predominately focal seizures types (with or without impaired awareness or focal to bilateral tonic clonic) according to the classification system of the international league against epilepsy -Age ≥12 years
Exclusion criteria: progressive or unstable neurologic illness other than epilepsy, any unstable medical condition, pregnancy, use of more than three AEDs at the time of study entry, use of an investigational AED at the time of study entry, seizure frequency <6 per month or any seizure-free interval >14 days, -≥20% variation in any AED level
N=114
Intervention group: N=54
Mean age ± SD: 33.1
Sex: 61% M / 39% F
Control group: N=60
Mean age ± SD: 33.5
Sex: 63% M / 37% F
Groups comparable at baseline? yes, in age, seizure frequency, duration of epilepsy, percent of male patients, seizure types and number of AEDs in use |
High vagus nerve stimulation for 14 weeks:
On/off cycles of 30-90 seconds every 5-10 minutes, each “on” period consisting of 500-µs duration pulses at 20-50-Hz frequency (0.25-3.0 mA) |
Low vagus nerve stimulation for 14 weeks:
On/off cycles of 30 seconds every 60-180 minutes, each “on” period consisting of 130-µs duration pulses at 1-2-Hz frequency (0.25-2.75 mA) |
Endpoint of follow-up: 14 weeks
For how many participants were no complete outcome data available?
Intervention group: N (%): 0
Control group: N (%): 0 |
50% reduction in seizure frequency: I: 31% C: 13% p=0.02 |
|||||
Risk of bias tabellen
| Methodology checklist - intervention studies | |||||||||||
| Study reference | There was adequate concealment of allocation | Participants receiving care were kept 'blind' to treatment allocation | Care providers were kept 'blind' to treatment allocation | Outcome assessors were kept 'blind' to participants’ exposure to the intervention | Use of unvalidated or intermediate | Selective outcome reporting on basis of the results | Loss to follow-up/incomplete outcome data described and acceptable | Analysis by intention to treat | Other limitations | Comments | |
| Handforth, 1998 | yes | yes | yes | yes | no | no | yes | yes | |||
| Klinkenberg, 2011 | yes | yes | yes | yes | no | no | yes | unclear | yes |
- small study population (n=41)
- only children included (children may have different threshold values and conduction velocity)
- adverse events per group NR |
|
| The Vagus Nerve Stimulation study group, 1995 | yes | yes | yes | yes | no | no | unclear | yes | |||
Economisch evaluatieonderzoek
| Economic evaluations (summary) | |||||||||||
| Study reference | Study characteristics | Patient characteristics | Is the new intervention cost-effective? | Are the outcomes of the economic evaluation uncertain and/or variable? | Balance between health benefits, side effects, and risk | Overall conclusion Transferability (see table transferability) | Generalizability of the study results | Implementation problems | |||
|
Helmers et al., 2012 |
Type of study Trial based Country United Stated of America Perspective Public payer
|
Epilepsy |
yes |
no |
QALY gain Clinical events reported Yes ( in general a decrease of clinical events (see table 2)
|
Transferable |
Generazible |
No implementation problems |
|||
| Economic evaluations (transferability) | |||||||||||
| Study reference | Study characteristics | Patient characteristics | The relevant technology is comparable to the one that shall be used in the decision country? | Intervention | The comparator is relevant to the one that is relevant in the decision country? | Comparator(s) | Based on the quality appraisal, what is quality of the economic evaluation? | Acceptable quality? | Overall conclusion Transferability | ||
|
Helmers et al., 2012 |
Type of study Trial based Country United Stated of America Perspective Public payer
|
Epilepsy |
VNS |
yes |
Each persons is his own comparator |
yes |
16, high |
yes |
Transferable |
||
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 30-05-2023
Laatst geautoriseerd : 17-06-2020
Geplande herbeoordeling :
Sinds 2014 wordt eenmaal per jaar een literatuursearch per module uitgevoerd. De clusterleden beoordelen of er in de resultaten van de search artikelen zijn die aanleiding geven om de (aanbevelingen van) de module aan te passen. Tot 2020 werden de geselecteerde artikelen opgenomen in een evidence tabel, en indien door de werkgroep voldoende relevant bevonden, werden de aanbevelingen inhoudelijk aangepast. Sinds 2020 is overgegaan tot modulair onderhoud van richtlijnen binnen clusters (zie: https://richtlijnendatabase.nl/werkwijze.html). Na de literatuurselectie wordt tijdens een vergadering met alle clusterleden de prioritering gemaakt voor de vijf te herziene modules van dat jaar. De herziene modules worden ter commentaar en autorisatie aangeboden aan de betrokken wetenschappelijke verenigingen. Dit is een zich jaarlijks herhalende cyclus.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS) en vanuit EpilepsieNL
De volgende verenigingen en organisaties hebben medewerking verleend aan de totstandkoming van de richtlijn (in alfabetische volgorde):
- EpilepsieNL
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Nederlands Instituut van Psychologen, sectie neuropsychologie (NIP)
- Nederlandse Liga tegen Epilepsie
Doel en doelgroep
Doel
De epilepsiepatiënt in Nederland op eenduidige en wetenschappelijk onderbouwde wijze diagnosticeren en behandelen. Ter ondersteuning van de richtlijngebruiker wordt - daar waar relevant - verwezen naar de module Informatie voor patiënten. De inhoud van de patiënteninformatie valt buiten verantwoordelijkheid van de werkgroep.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Samenstelling werkgroep
Voor het ontwikkelen van de webbased richtlijn is in 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met epilepsie. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de webbased richtlijn die in november 2013 vastgesteld en geautoriseerd werd. De richtlijn wordt vanaf 2013 jaarlijks geactualiseerd. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. Eventuele mutaties in de werkgroepsamenstelling vinden plaats in overleg met de Nederlandse Vereniging voor Neurologie, de werkgroep en de betreffende beroepsvereniging. Nieuwe leden dienen te allen tijden gemandateerd te worden door de betreffende beroepsvereniging. De werkgroep wordt ondersteund door adviseurs van het Kennisinstituut van Medisch Specialisten en door een voorlichter van het EpilepsieNL.
Werkgroep
- Prof. dr. H.J.M. Majoie (voorzitter), neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze en Maastricht
- Dr. C.M. (Carin) Delsman-van Gelder, Kinderarts/kinderneuroloog, Maxima Medisch Centrum, Veldhoven (vanaf 2022)
- Drs. M.H.G. (Marjolein) Dremmen, Radioloog (subspecialisatie kinderneuroradiologie), Erasmus MC, Rotterdam (vanaf 2020)
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Dr. J. Nicolai, kinderneuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Maastricht
- Dr. P. van Vliet, neuroloog/intensivist, Haaglanden Medisch Centrum, Den Haag
- Drs. R. (Roel) van Vugt, Anesthesioloog, Sint Maartenskliniek, Nijmegen (vanaf 2020)
- Dr. A. Altinbas, neuroloog-kinderneuroloog, SEIN /LUMC, Heemstede en Leiden (vanaf 2020)
- Drs. T. Balvers, neuroloog, SEIN/LUMC, Heemstede en Leiden (vanaf 2020)
- Dr. M.A.A.M. de Bruijn, AIOS neurologie, Elisabeth-Tweesteden Ziekenhuis, Tilburg (vanaf 2020)
- Prof. Dr. E.F.I. Comans, nucleair geneeskundige, Amsterdam UMC, Amsterdam (vanaf 2020)
- Dr. T.H.P. Draak, kinderneuroloog/neuroloog, Zuyderland Medisch Centrum, Heerlen en Sittard-Geleen (vanaf 2021)
- Drs. F.M.S. Eshuis, AIOS spoedeisende geneeskunde, Catharina ziekenhuis, Eindhoven (vanaf 2020)
- Dr. F.N.G. Van ’t Hof, neuroloog, SEIN, Heemstede en Amsterdam (vanaf 2020)
- Dr. P.A.M. Hofman, (neuro)radioloog, Maastricht UMC+ en Kempenhaeghe, Heeze en Maastricht
- Dr. D. Ijff, GZ psycholoog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze
- Ir. D. Jenniskens, Community Manager EpilepsieNL, Houten (vanaf 2020)
- Dr. J.A.F. Koekkoek, neuroloog, LUMC, Leiden, en Haaglanden Medisch Centrum, Den Haag
- Dr. R.H.C. Lazeron, neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Heeze
- Dr. M. Mantione, klinisch neuropsycholoog, UMC Utrecht (vanaf 2022)
- Drs. J.B. Masselink, Ziekenhuisapotheker, Medisch Spectrum Twente, Enschede (vanaf 2020)
- G.A.P.G. van Mastrigt, HTA onderzoeker/epidemioloog B, Universiteit Maastricht
- Dr. L. M’Rabet, MT-lid Kennis en Innovatie EpilepsieNL, Houten(vanaf 2022)
- Dr. J.C. Reijneveld, neuroloog en universitair hoofddocent neurologie, SEIN en Amsterdam UMC, Heemstede en Amsterdam (vanaf 2020)
- Drs. H.E. Ronner, neuroloog, AmsterdamUMC loctie VUmc, Amsterdam
- Dr. M.K.M. van Schie, AIOS neurologie, LUMC, Leiden (vanaf 2022)
- Dr. O. Schijns, neurochirurg, Maastricht UMC+, Maastricht (vanaf 2020)
- Dr. F.M. Snoeijen-Schouwenaars, AVG, Centrum voor Epilepsiewoonzorg Kempenhaeghe, Heeze
- Dr. R.D. Thijs, neuroloog, SEIN, Heemstede en LUMC, Leiden
- Dr. N. Tolboom, nucleair geneeskundige, UMC Utrecht, Utrecht (vanaf 2020)
- Dr. S.O. Tousseyn, neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Heeze
- Drs. J. H. van Tuijl, neuroloog, Elisabeth-TweeSteden ziekenhuis, Tilburg
- Dr. A. Uiterwijk, neuroloog, Academisch Centrum voor Epileptologie, Kempenhaeghe/Maastricht UMC+, Heeze
- Dr. N.E. Verbeek, klinisch geneticus, UMC Utrecht, Utrecht
- Dr. M. Vlooswijk, neuroloog, Maastricht UMC+, Maastricht (vanaf 2020)
- Dr. I. Wegner, neuroloog, SEIN, Zwolle en Leeuwarden
Werkgroepleden tot 2020/2021:
- P.B. Augustijn, kinderneuroloog, SEIN, Heemstede (tot 2020)
- Dr. C.A. van Donselaar, neuroloog, Maasstad Ziekenhuis, Rotterdam en Kempenhaeghe, Heeze (tot 2020)
- Dr. G.J. de Haan, neuroloog, SEIN, Heemstede (plaatsvervangend voorzitter, tot 2020)
- M.C. Hoeberigs, neuroradioloog, Maastricht UMC+ en Kempenhaeghe, Heeze (tot 2020)
- Dr. F. Leijten, neuroloog, UMC Utrecht, Utrecht (tot 2021)
- Em. prof. dr. D. Lindhout, klinisch geneticus, kinderarts niet praktiserend, UMC Utrecht en SEIN, Heemstede (tot 2020)
- Dr. W. van der Meij, neuroloog, Haaglanden Medisch Centrum, Den Haag (tot 2020)
- Dr. B. Panis, kinderneuroloog, Maastricht UMC+, Maastricht (tot 2021)
Met ondersteuning van
- I. Gijselhart, bibliothecaresse, Kempenhaeghe Heeze
- L. Linssen, secretaresse opleidingen medisch specialisten, Kempenhaeghe Heeze
- Dr. J. Buddeke, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf 2020)
- Dr. M.M.J. van Rooijen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf 2022)
Belangenverklaringen
Werkgroepleden verklaren schriftelijk of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn.
|
Werkgroeplid |
Belangen |
Zo ja, welke |
Jaar ingevuld |
|
Aldenkamp, dhr. |
Ja |
Deelname aan Wetenschappelijke |
2015 |
|
Augustijn, dhr. |
Ja |
Bestuurslid en regelmatig docent |
2015, herzien 2017 |
|
Beumer, mw. D. |
Nee |
|
2017 |
|
Bruijn, mw. M. de |
|
Coördinator van de ACES studie (antibodies causing epilepsy syndromes): nationale multicenterstudie waarvoor een beurs ontvangen van het Nationaal epilepsie Fonds (principal investigator: dr. M.J. Titulaer, euroloog, Erasmus MC). |
2017 |
|
Donselaar, dhr. dr. |
Ja |
Bestuurslid Stichting Epilepsie Onderwijs Nederland, onbetaald Lid Richtlijnen Commissie Diagnostiek en behandeling van Epilepsie (NVN, vergoeding) Lid Commissie Wetenschap Beter Keten (samenwerkingsverband Erasmus MC, Fransciscus Vlietland Groep, Maasstad Ziekenhuis, onbetaald) Aandelen UCB |
2015 |
|
Gijselhart, mw. I. |
|
|
|
|
Haan, dhr. dr. |
Ja |
Staflid neurologie Erasmus MC Rotterdam Begeleiden aios-en Cursorisch onderwijs (onbetaald) Eindredacteur vakblad Epilepsie Ex- voorzitter Liga tegen Epilepsie Adviseur EVN, EpilepsieNL |
2015, herzien 2017 |
|
Hofman, dhr. Dr. |
Nee |
|
2015, herzien 2017 |
|
Kolk, mw. N. van |
|
Gastdocent Radboud Health Academy (neurologie verpleegkunde), betaald |
2017 |
|
Kolsteren, mw. E. |
Nee |
|
2015, herzien 2017 |
|
Lazeron, dr. R.H.C. |
Ja |
Ontwikkeling nachtelijk aanvalsdetectie en - alarmeringssysteem, gefinancierd door ZonMW, Nuts-Ohra fonds, EpilepsieNL, met deelname van een hiertoe opgerichte onderneming LivAssured, met hulp van de firma ImplementationIQ en met participatie van investeringsfondsen in de gezondheidszorg. Geen direct of persoonlijk financieel belang in LivAssured, ImplementationIQ of de investeringsfondsen. |
2017 |
|
Leijten, dr. F.S.S. |
Ja |
Aandelen ProLira, een start-up bedrijf dat een deliriummonitor ontwikkelt. Ontwikkeling nachtelijk aanvalsdetectie en - alarmeringssysteem, gefinancierd door ZonMW, Nuts-Ohra fonds, EpilepsieNL, met deelname van hiertoe opgerichte onderneming LivAssured met hulp van de firma ImplementationIQ en met participatie van investeringsfondsen in de gezondheidszorg. Geen direct of persoonlijk financieel belang in LivAssured, ImplementationIQ of investeringsfondsen. |
2017 |
|
Lindhout, dhr. |
Ja |
Lid Gezondheidsraad (onbetaald) Lid vaste commissie Reproductie toxische stoffen van de Gezondheidsraad (vacatiegeld) Lid ad hoc commissies Gezondheidsraad (vacatiegeld) Lid Wetenschappelijke adviesraad Lareb (vacatiegeld) Lid Wetenschappelijk adviesraad Stichting Michelle (onbetaald) Lid Medische adviesraad STSN (onbetaald) |
2015 |
|
Majoie, mw. |
Ja |
Relevante commissies: |
2017 |
|
Mastrigt, mw. G. |
|
Onderzoeker/docent Universiteit Maastricht (0,1 fte) |
2017 |
|
Nicolai, dr. J. |
Ja |
Vanuit MUMC+ gedetacheerd in St. Jansgasthuis Weert, Elkerklierk Helmond en Kempenhaeghe Heeze (in dienst MUMC+) |
2017 |
|
Panis, mw. dr. P. |
Nee |
|
2017 |
|
Pols, mw. dr. M. |
|
|
|
|
Roelfsema, dr. V |
Nee |
|
2015, herzien 2017 |
|
Tuijl, mw. J.H. van |
Ja |
Lid werkgroep richtlijn Epilepsie (onbetaald) |
2015, herzien 2017 |
|
Uiterwijk, mw. A. |
Nee |
|
2017 |
|
Veendrick, mw. |
Nee |
|
2015 |
|
Venhorst, mw. K. |
|
|
|
|
Vliet, dhr. P. van |
Nee |
|
2015, herzien 2017 |
|
Wardt, dhr. J. van |
Nee |
|
2017 |
|
Wegner, mw. dr. I |
Ja |
Houden van wetenschappelijke voordrachten, voor een deel onbetaald, maar er zijn ook enkele voordrachten waarvoor de werkgever (SEIN) een financiële bijdrage heeft ontvangen van de firma UCB als vergoeding voor gemaakte uren. Dit alles volgens de officieel hiervoor geldende wet- en regelgeving. |
? |
|
Wijnen, dhr. B. |
|
|
|
|
Zijlmans, mw. |
Ja |
Commissielid communications committee international league against epilepsy (onbetaald) |
2015, herzien 2017 |
Inbreng patiëntenperspectief
Er wordt aandacht besteed aan het patiëntenperspectief door het betrekken van de Epilepsievereniging Nederland in commentaarfases. Bij de richtlijn is een module met patiëntinformatie ontwikkeld. Deze is geautoriseerd door de Epilepsie Vereniging Nederland en de Nederlandse Vereniging voor Neurologie.
Methode ontwikkeling
Evidence based
Werkwijze
Algemeen
AGREE
Deze richtlijn is opgesteld en wordt bijgehouden conform de eisen in het rapport ‘Richtlijnen 2.0’ van de adviescommissie Richtlijnen van de Raad WOK. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/). Dit is een internationaal breed geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Uitgangsvragen en uitkomstmaten
Op basis van de lijst met onderwerpen stellen de werkgroepleden en de adviseur concept-uitgangsvragen op. Deze worden met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen vaststelt. Vervolgens inventariseert de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn. Hierbij wordt zowel naar gewenste als ongewenste effecten gekeken. De werkgroep waardeert deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieert de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vindt, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er wordt eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews in PubMed en voor specifieke onderwerpen in the Cochrane Library, Embase en Psychinfo. Vervolgens wordt voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens wordt aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie wordt gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteren de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen worden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden onder ‘zoekstrategie’ van de desbetreffende uitgangsvraag.
Voor een aantal vragen is de recente Engelse evidence based richtlijn ‘The epilepsies’ van het NICE (National Institute of Clinical Excellence) als basis gebruikt.
Kwaliteitsbeoordeling individuele studies
Individuele studies worden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de evidence tabel.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen worden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur worden beschreven in de samenvatting van de literatuur. Bij een aantal interventievragen worden bij voldoende overeenkomsten tussen de studies de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen
De kracht van het wetenschappelijke bewijs wordt bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/) (Atkins et al, 2004) (zie tabel 1).
Tabel 1. GRADE-indeling van kwaliteit van studies per uitkomstmaat
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
1. Studiebeperkingen 2. Inconsistentie 3.Indirectheid 4. Imprecisie 5. Publicatiebias |
1. Groot effect 2. Dosis-respons relatie 3. Plausibele confounding |
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkende studie (bijvoorbeeld: patëntencontrole onderzoek, cohortonderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (bijvoorbeeld: case series of case reports) |
||
|
RCTs beginnen 'hoog'(4), observationele studies beginnen 'laag'(2) |
|||
Formuleren van conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose wordt het wetenschappelijke bewijs samengevat in één of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt de conclusie getrokken op basis van alle studies samen (body of evidence). Hierbij maken de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans worden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Voor een conclusie die gebaseerd is op (een) studie(s) die niet uit een systematisch literatuuronderzoek naar voren is/zijn gekomen, wordt geen niveau van bewijskracht bepaald. In een dergelijk geval staat bij de conclusie "geen beoordeling" vermeld.
Tabel 2. Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggend bewijs
|
Niveau |
Conclusie gebaseerd op |
|
Hoog |
Onderzoek van niveau A1 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken |
|
Matig |
één onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
Laag |
één onderzoek van niveau B of C |
|
Zeer laag |
Mening van deskundigen |
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn wordt expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn zijn er interne en externe kwaliteitsindicatoren ontwikkeld. Het doel van de indicatoren is om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroepleden is gevraagd om bestaande indicatoren en indicatoren gebaseerd op aanbevelingen uit de richtlijn te scoren op relevantie en registreerbaarheid. De indicatoren die het hoogst scoorden, zijn in de (concept)richtlijn opgenomen. Een overzicht treft u aan in de bijlage Indicatoren. De indicatoren zijn ook terug te vinden bij de betreffende uitgangsvraag.
Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Lacunes in kennis
De zorg voor patiënten met epilepsie kent nog veel aspecten waarover onzekerheid bestaat wat als optimaal kan worden aangewezen. In vrijwel alle modules van de richtlijn ‘Epilepsie’ zijn lacunes in kennis te onderkennen. Het is daarom zeer gewenst dat er verder wetenschappelijk onderzoek plaatsvindt naar de zorg voor patiënten met epilepsie. De werkgroep inventariseert de lacunes in kennis breed en heeft een aantal onderwerpen benoemd waarvan zij van mening is dat onderzoek hiernaar prioriteit verdient. Een overzicht treft u aan in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De richtlijn is in 2013 aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Vanaf 2013 wordt de richtlijn jaarlijks geactualiseerd (zie onder Herziening). De werkgroep doet aan het einde van het jaar een voorstel met welke modules zij denkt dat een commentaarronde nodig is aan de commissie Kwaliteit/subcommissie Richtlijnen van de Nederlandse Vereniging voor Neurologie (NVN). Hierbij is het uitgangspunt dat alleen die wijzigingen die eventueel tot discussie binnen de diverse beroepsgroepen kunnen leiden ter commentaar en tevens ter autorisatie voorgelegd worden. Alle andere wijzigingen worden doorgevoerd onder eigen verantwoordelijkheid van de werkgroep. De subcommissie Richtlijnen van de NVN beslist uiteindelijk welke modules aan de betrokken beroepsverenigingen worden voorgelegd. Voor die modules wordt eerst een commentaarfase gestart. Al het commentaar dat digitaal binnenkomt wordt gebundeld en in de werkgroep besproken en eventueel verwerkt in de richtlijnmodule. Vervolgens worden de aangepaste modules van de richtlijn voor autorisatie aangeboden. Bij akkoord van de beroepsverenigingen worden de geactualiseerde teksten definitief gepubliceerd op de website. De beroepsverenigingen worden hiervan op de hoogte gebracht.
Nieuwe uitgangsvragen
Als gebruikers van de richtlijn een belangrijk onderwerpen missen, kunnen zij een suggestie voor een nieuwe uitgangsvraag aanleveren bij de werkgroep (met motivering). De werkgroep zal jaarlijks de ontvangen suggesties bespreken en besluiten welke vragen opgenomen worden in de richtlijn.
Economische evaluaties
Doelmatigheid van behandeling
Sinds mei 2016 wordt aan de richtlijn ook kennis over de doelmatigheid (kosteneffectiviteit) van de epilepsiebehandeling meegenomen, ook wel economische evaluatie genoemd. Om deze kennis te verkrijgen is een systematische literatuur studie uitgevoerd (Wijnen et al., 2017, Wijnen et al., 2015). De gebruikte methodologie om de economische evaluaties in te bouwen in klinische richtlijnen is beschreven in een drietal papers (Wijnen et al., 2016, Mastrigt van et al., 2016, Thielen et al., 2016).
Databases
In MEDLINE (via PubMed), EMBASE en NHS economische evaluatie Database (NHS EED) is gezocht op kosteneffectiviteitsstudies. Voor bestaande systematische reviews, werden Cochrane Reviews, Cochrane DARE en Cochrane Health Technology Assessment Databases gebruikt.
Zoekstrategieën
Voor de identificatie van relevante studies zijn vooraf gedefinieerde klinische zoekstrategieën gecombineerd met een gevalideerd zoekfilter van McMaster University om economische evaluaties te identificeren (McMaster). Bij de zoekstrategieën hebben we ons beperkt tot therapeutische interventies.
Beoordeling van de studies
Om te beoordelen of de economische evaluaties kunnen worden opgenomen in de richtlijn is iedere gevonden studie beoordeeld aan de hand van zeven vragen. In deze pdf is de uitwerking van de verschillende vragen te vinden. Deze vragen zijn gebaseerd op de Consensus on Health Economics Criteria checklist (Evers et al., 2005) en de Welte transferability checklist (Welte et al., 2004).
Referenties
- Atkins, D., Best, D., Briss, P.A., Eccles, M., Falck-Ytter, Y., Flottorp, S., Guyatt, G.H., Harbour, R.T., Haugh, M.C., Henry, D., Hill, S., Jaeschke, R., Leng, G., Liberati, A., Magrini, N., Mason, J., Middleton, P., Mrukowicz, J., O’Connell, D., Oxman, A.D., Phillips, B., Schünemann, H.J., Edejer, T.T., Varonen, H., Vist, G.E., Williams, J.W. Jr, Zaza, S. GRADE Working Group. (2004). Grading quality of evidence and strength of recommendations. BMJ Jun; 19, 328(7454):1490.
- van Everdingen, J.J.E., Burgers, J.S., Assendelft, W.J.J., Swinkels, J.A., van Barneveld, T.A., van de Klundert, J.L.M. (2004). Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum.
- Evers, S., Goossens, M., De Vet, H., Van Tulder, M., Ament, A. (2005). Criteria list for assessment of methodological quality of economic evaluations: Consensus on Health Economic Criteria. International journal of technology assessment in health care. 21(02):240-245.
- van Mastrigt, G. A., Hiligsmann, M., Arts, J. J., Broos, P. H., Kleijnen, J., Evers, S. M., & Majoie, M. H. (2016). How to prepare a systematic review of economic evaluations for informing evidence-based healthcare decisions: a five-step approach (part 1/3). Expert Rev Pharmacoecon Outcomes Res (Nov 2), 1-16. doi: 10.1080/14737167.2016.1246960.
- McMaster University. (2016, Feb 09). Search Strategies for EMBASE in Ovid Syntax, from http://hiru.mcmaster.ca/hiru/HIRU_Hedges_EMBASE_Strategies.aspx.
- Thielen, F. W., Van Mastrigt, G., Burgers, L. T., Bramer, W. M., Majoie, H., Evers, S., & Kleijnen, J. (2016). How to prepare a systematic review of economic evaluations for clinical practice guidelines: database selection and search strategy development (part 2/3). Expert Rev Pharmacoecon Outcomes Res (Nov 2), 1-17. doi: 10.1080/14737167.2016.1246962.
- Welte, R., Feenstra, T., Jager, H., & Leidl, R. (2004). A decision chart for assessing and improving the transferability of economic evaluation results between countries. Pharmacoeconomics, 22(13), 857-876.
- Wijnen, B., van Mastrigt, G., Evers, G., Gershuni, O., Lambrechts, D., Majoie, H., & De Kinderen, R. (2015). Review of economic evaluations of treatments for patients with epilepsy. Prospero: International prospective register of systematic reviews. Retrieved from http://www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD42015019278.
- Wijnen, B., van Mastrigt, G., Redekop, W. K., Majoie, H., de Kinderen, R., & Evers, S. (2016). How to prepare a systematic review of economic evaluations for informing evidence-based healthcare decisions: data extraction, risk of bias, and transferability (Part 3/3). Expert Rev Pharmacoecon Outcomes Res (Oct 21). doi: 10.1080/14737167.2016.1246961.
- Wijnen, B. F., van Mastrigt, G. A., Evers, S. M., Gershuni, O., Lambrechts, D. A., Majoie, M. H., . . . de Kinderen, R. J. (2017). A systematic review of economic evaluations of treatments for patients with epilepsy. Epilepsia. doi: 10.1111/epi.13655.

