Behandeling van diabetisch macula oedeem
Uitgangsvraag
Wat is de optimale behandeling van diabetisch macula oedeem bij volwassen personen met diabetes?
Aanbeveling
Raadpleeg (als oogarts of PA/optometrist) de behandelaar (huisarts of internist) voor een optimale instelling van glucose en cardiovasculaire risicofactoren.
Overweeg bij mild centraal diabetisch macula oedeem en een nog goede visus (≥ 0,8), een expectatief beleid met regelmatige controles (bijv. elke 3 maanden).
Begin bij visusdaling op basis van centraal diabetisch macula oedeem te behandelen met anti-VEGF. Start met bevacizumab, maar overweeg aflibercept (2 mg) bij een visus ≤ 0,4.
Bij een langere behandeling (2 jaar of langer) lijken de verschillen in effectiviteit tussen aflibercept (2 mg), ranibizumab en bevacizumab kleiner te worden.
Overweeg lasercoagulatie bij visusbedreigend extrafoveaal oedeem en/of veel harde exsudaten.
Maak een FAG bij non-respons op de therapie om (maculaire) ischemie en perifere lekkage op te sporen.
Switch naar ofwel een ander anti-VEGF of naar corticosteroïden bij non-respons na 3-6 injecties.
Overweeg corticosteroïden bij contra-indicatie voor anti-VEGF of non-compliance bij multipele injecties.
Stop met behandelen bij een langer bestaande droge macula en/of non-respons op verschillende therapieën.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit de systematische literatuuranalyse komt naar voren dat:
- Behandeling van diabetisch macula oedeem met anti-VEGF (met name bevacizumab, ranibizumab, aflibercept (2 mg); herhaalde intravitreale injecties) een duidelijke meerwaarde heeft in vergelijking met behandeling met alleen laser.
- Aflibercept (2 mg) bij een behandelduur van 1 jaar waarschijnlijk een hogere effectiviteit heeft dan ranibizumab en bevacizumab, terwijl ranibizumab en bevacizumab waarschijnlijk een vergelijkbare effectiviteit hebben.
- Aflibercept (2 mg), bevacizumab en ranibizumab mogelijk een vergelijkbare effectiviteit hebben bij behandeling van de subgroep patiënten met een relatief hoge BCVA (78-69 letters).
- Aflibercept (2 mg) mogelijk voordelen biedt ten opzichte van ranibizumab en bevacizumab in de subgroep patiënten met een relatief lage BCVA (< 69 letters) bij start van de behandeling, met name als er ook sprake is van een relatief grote retinadikte.
- Bij een behandeling gedurende twee jaar de verschillen in effectiviteit tussen aflibercept (2 mg), ranibizumab en bevacizumab in het verbeteren van de visus geringer en mogelijk niet klinisch relevant zijn.
- Faricimab en ranibizumab mogelijk een vergelijkbare effectiviteit hebben bij behandeling van diabetisch macula oedeem.
- Door gebrek aan bewijs van voldoende kwaliteit het onduidelijk is wat de effectiviteit van conbercept is in vergelijking met ranibizumab.
- Ranibizumab waarschijnlijk een hogere effectiviteit heeft dan triamcinolon.
- Triamcinolon in pseudofake ogen mogelijk een met ranibizumab vergelijkbare effectiviteit heeft.
- Dexamethason (implantaat) mogelijk een met bevacizumab vergelijkbare effectiviteit heeft.
- Anti-VEGF middelen waarschijnlijk geen grote veiligheidsrisico’s met zich meebrengen, terwijl intravitreale injectie van corticosteroïden waarschijnlijk leidt tot een verhoogd risico op oculaire adverse events (verhoogde oogdruk, cataract progressie.
De werkgroep is zich bewust van het feit dat de studies die onderzoek doen naar het middel ranibizumab verschillende doseringen (0.3 mg vs. 0.5 mg) gebruiken. De Cochrane review van Virgili (2018) heeft geen onderscheid gemaakt tussen de verschillende doseringen. Zij beschrijven in de review dat er geen aanwijzingen zijn dat er verschillen zijn in de effectiviteit van het middel bij maandelijks gebruik (Virgili, 2018; Heier, 2016). In de Nederlandse praktijk wordt de dosering van 0.5 mg gehanteerd. Om deze reden heeft de werkgroep afgewaardeerd voor indirectheid bij het beoordelen van de literatuur.
Aanvullende argumenten met betrekking tot de voor- en nadelen van de interventie
Over een langere follow-up zijn er weinig data over de verschillen tussen de anti-VEGFs. In de protocol T extension study werden deelnemers van de vergelijkende trial (Wells 2016a) na 5 jaar uitgenodigd voor een visite. Tussen de 2 en 5 jaar was er geen gestandaardiseerde behandeling en werden deelnemers behandeld door hun eigen behandelaar. Na 2 tot 5 jaar follow-up, bleef de gemiddelde centrale retinale dikte gelijk, maar verslechterde de gemiddelde visus. Er werd geen verschil gezien tussen de groepen van anti-VEGF medicijnen die de deelnemers in de eerste 2 jaar gehad hadden (Glassman, 2020). In de Fight Retinal Blindness registry waren ranibizumab en aflibercept (2 mg) beiden effectief in de behandeling van DME na 1 jaar follow-up. Met aflibercept (2 mg) werd een betere visus (+3 letters) behaald ten opzichte van ranibizumab in de groep met baseline visus £ 0,4 en aflibercept (2 mg) gaf een lagere centrale retinale dikte in zowel de groep met een lage als een hoge baseline visus (Bhandari 2020). Beide studies komen overeen met de 2-jaars data van de RCT van Wells. In het Standpunt Diabetisch Macula Oedeem (NOG, 2017) wordt bij lage baseline visus (<0,5) aanbevolen om aflibercept (2 mg) of ranibizumab in te zetten. De huidige update van de richtlijnmodule levert echter aanvullend bewijs voor een klinisch relevant voordeel van aflibercept (2 mg) t.o.v. ranibizumab (en bevacizumab) bij een behandelduur van een jaar.
Ook nieuwe anti-VEGF medicijnen zullen op korte termijn geïntroduceerd worden op de markt voor de behandeling van diabetisch macula oedeem. Hoewel op dit moment de registratie RCT’s nog niet afgerond zijn, willen we ze hier wel kort benoemen.
Brolucizumab is een gehumaniseerd enkelstrengs antilichaam dat alle vormen van VEGF-A remt. Voor diabetisch macula oedeem (DME) zijn er twee fase 3 studies: de KITE en KESTREL studie, waarbij brolucizumab met aflibercept (2 mg) wordt vergeleken. Een-jaars data van deze studies laten zien dat brolucizumab niet-inferior is tot aflibercept (2 mg) op basis van visusverbetering. Meer dan de helft van de patiënten met brolucizumab 6 mg zaten na de oplaadfase op een interval van 12 weken. Ook was er een gelijke mate van verbetering van de ernst van diabetische retinopathie in beide groepen. Echter werd in de KESTREL studie een verhoogd risico op intra-oculaire inflammatie gevonden, inclusief retinale vasculitis. In de KITE studie werd er geen verhoogd risico op intra-oculaire inflammatie gevonden (Brown et al, 2022). Brolucizumab is in mei 2022 goedgekeurd voor de behandeling van DME door de EMA.
Faricimab is een bispecifiek antilichaam dat aangrijpt op VEGF-A en angiopoïetine-2. De BOULEVARD trial is een fase 2 RCT die mogelijk een vergelijkbare effectiviteit laat zien tussen faricimab en ranibizumab in de behandeling van DME gedurende 36 weken (Sahni 2019). Op dit moment zijn de een-jaars resultaten beschikbaar van twee fase 3 registratie RCT’s (RHINE en YOSIMITE) waarbij faricimab vergeleken wordt met aflibercept (2 mg). Faricimab is hier niet inferior aan de behandeling met aflibercept (2 mg) met betrekking tot visusverbetering (Wykoff, 2022). Tevens lijkt Faricimab ook een mogelijke langere werkingsduur te hebben. Het is begin 2022 goedgekeurd voor de behandeling van DME door de FDA.
Conbercept is een recombinant fusie eiwit, gericht op VEGF-A, VEGF-B en PLGF (placental growth factor). Conbercept is in China geregistreerd voor de behandeling van AMD in 2013 en voor DME in 2019. De PANDA-1 en PANDA-2 trials zijn wereldwijde fase 3 studies naar effectiviteit en veiligheid van conbercept in patienten met AMD. Deze studies zijn vroegtijdig gestopt wegens bijwerkingen.
Ziv-aflibercept (ZaltrapÒ) is een chemotherapeuticum geregistreerd voor de behandeling van colorectaal carcinoom en werkt als goedkoop alternatief voor aflibercept (2 mg). Ziv-aflibercept heeft een hogere osmolariteit dan aflibercept (1000 mOsm/kg tov 300 mOsm/kg). Hoewel dit eerder wel werd gesuggereerd, laten studies tot nu toe geen verhoogd risico zien op schade aan het retinale pigment epitheel of aan de retina. Daardoor lijkt het met name geschikt voor behandeling van retinale aandoeningen in ontwikkelingslanden vanwege gelijke effectiviteit en lagere kosten. Er zijn nog weinig vergelijkende studies met ziv-aflibercept voor DME. Een dubbel blinde RCT (123 ogen) met patiënten met DME liet een hogere visus winst zien in ogen behandeld met ziv-aflibercept ten opzichte van bevacizumab na 1 jaar follow-up. Het grootste verschil werd gezien in de groep met een lagere baseline visus (0,4; Jabbarpoor Bonyadi 2018).
Het Port Delivery System (PDS) is een oogimplantaat, waarbij er een continue afgifte is van een formule van Ranibizumab en dit om de 6 maanden bijgevuld moet worden. De Archway studie is een fase 3 studie voor patiënten met AMD waarbij het PDS systeem niet inferior was aan maandelijkse injecties met Ranibizumab (Holekamp et al, Ophthalmology 2021). De fase 3 studie voor DME is onderweg. (PAGODA) KSI-301 in een langwerkend anti-VEGF, waarbij de fase 3 studies (GLEAM en GLIMMER) nog onderweg zijn. Ook met aflibercept 8 mg loopt een fase 3 studie voor patiënten met DME (PHOTON studie).
Er is geen eenduidig bewijs naar het voorkomen van systemische bijwerkingen na intravitreale injectie met anti-VEGF. Vanwege de lage incidentie van cardiovasculaire events, zijn er geen studies naar verricht, maar worden resultaten uit subanalyses van verschillende studies beschreven, waarbij er een lagere statistische power is. De resultaten hiervan zijn verschillend en er volgt geen duidelijk verhoogde associatie met anti-VEGF en cardiovasculaire events.
Off-label use Bevacizumab
De patiënt dient geïnformeerd te worden over de off-label status van intravitreale toepassing van bevacizumab. Bevacizumab is geregistreerd voor systemische behandelingen in de oncologie (farmacotherapeutisch kompas). Sinds > 10 jaar wordt bevacizumab zeer frequent gebruikt in de Nederlandse oogheelkundige praktijk. Op basis van de beschikbare wetenschappelijke literatuur staat bevacizumab als eerste keus van behandeling in verschillende richtlijnen en standpunten vermeld (richtlijn maculadegeneratie 2014, 2017; standpunt DME 2017; richtlijn DR 2017; critical appraisal RVO; www.oogheelkunde.org). Registratie van het product door de registratiehouder zal waarschijnlijk niet gebeuren, omdat er commercieel weinig interesse voor is.
Kosten (middelenbeslag)
De kosten voor 1 intravitreale injectie met bevacizumab bedragen ongeveer 40,00 euro per injectie. Ranibizumab en aflibercept (2 mg) komen uit op ongeveer 670,00 euro en 788,00 euro, respectievelijk (farmacotherapeutisch kompas). Op grond van gelijke effectiviteit en veiligheid en het grote verschil in kosten is bevacizumab kosten-effectiever dan ranibizumab en aflibercept (2 mg) (Elshout 2014; Dakin 2014; Stein 2014). In 2018 is een kosten-effectiviteits analyse verschenen naar bevacizumab, ranibizumab en aflibercept (2 mg) bij de behandeling voor leeftijdsgebonden maculadegeneratie (van Asten, 2018). Hieruit bleek duidelijk dat bevacizumab kosten-effectiever is dan ranibizumab of aflibercept (2 mg). Ook voor de behandeling van diabetisch macula oedeem is bevacizumab kosten-effectiever dan aflibercept (2 mg) of ranibizumab (Ross, 2016)
Aanvaardbaarheid, haalbaarheid en implementatie
De kosten van de intravitreale medicijnen en injectie worden vergoed door de zorgverzekeraar. Bevacizumab, Ranibizumab en aflibercept (2 mg) zijn add-on geneesmiddelen en vallen vaak in het budget dure geneesmiddelen van een ziekenhuis. Naar aanleiding van afspraken met zorgverzekeraars, kan het zijn dat er streng gekeken wordt of de behandelrichtlijnen worden opgevolgd en niet te veel ‘dure’ geneesmiddelen worden gebruikt. Dit kan leiden tot belemmeringen van vrijheid van productkeuze door behandelaars. Onder andere door de toename van het aantal mensen met diabetes mellitus, zijn er steeds meer mensen met oculaire complicaties ten gevolge van de diabetes. Het Nederlands oogheelkundig gezelschap ziet ieder jaar een stijging van het aantal intravitreale injecties (zie ook www.oogheelkunde.org). Ook voor alleen DME stijgen het aantal injecties jaarlijks. Daarmee stijgen ook het aantal injecties met dure medicijnen, wat leidt tot een toenemende druk op het budget dure geneesmiddelen.
Rationale van de aanbeveling en praktische kanttekeningen
Waarmee wordt de behandeling van DME gestart?
Bij symptomatisch centraal macula oedeem bij diabetes mellitus is er een indicatie om te starten met behandelen. Vanwege de hoge mate van effectiviteit is de start met een anti-VEGF medicament de behandeling van eerste keus. Gezien gelijke mate van effectiviteit en veiligheid tussen de anti-VEGF middelen en het kostenbesparende effect van bevacizumab, kan men in eerste instantie beginnen met dit laatste middel. Voor patiënten met een visus ≤ 0,4 zou aflibercept (2 mg) mogelijk een positiever effect kunnen hebben dan bevacizumab. Het starten met maandelijkse injecties gedurende drie tot zes maanden met anti-VEGF verdient de voorkeur. Hierna lijkt een treat- en extend (TE) schema (steeds langere tussenpauzen tussen injecties op basis van goede respons, OCT gecontroleerd) betere resultaten te geven dan een maandelijks injectie schema (Payne 2019, Volkmann 2020). Voor maculadegeneratie lijkt een treat- en extend schema ook superieur ten opzichte van pro-re-nata (PRN, behandel als nodig; Aurell 2019). In diabetisch macula oedeem, heeft de RETAIN studie laten zien dat TE leidt tot 40% minder bezoeken, en een licht verhoogd aantal injecties, waarbij er geen verschil in visuswinst is aangetoond tussen TE en PRN gedurende 24 maanden (Prünte 2016). Een treat- en extend schema kan leiden tot een beter begrip bij de patiënt dat er bij ieder bezoek een injectie gepland staat, en daardoor een betere compliance (Volkmann 2020).
Bij mild centraal diabetisch macula oedeem en nog een goede visus (³0,8), kan volstaan worden met een expectatief beleid volgens de DRCRN protocol V studie (Baker 2019). In deze studie met 702 deelnemers was er geen significant verschil in visusverlies na 2 jaar follow-up tussen behandelingen met aflibercept (2 mg), laser of observatie. Uiteraard worden regelmatige controles dan wel aanbevolen. In de observatie groep was de kans op anti-VEGF injecties verhoogd bij ernstige vormen van diabetische retinopathie, toename centrale retinale dikte en de noodzaak van behandeling van het andere oog (post-hoc analyses protocol V).
Bij visusbedreigend extrafoveaal macula oedeem kan een laserbehandeling overwogen worden. Voordelig hierbij zou kunnen zijn dat je het aantal injecties reduceert (Elman et al, Ophthalmology 2010, Mitchell P et al, Ophthalmology 2011, Zur and Loewenstein, Eye 2022). Gezien toename van atrofie van de laserlittekens in de tijd, dient men >1000-1500 micrometer van de fovea te blijven.
Bij de behandeling van DME dienen ook glucose, bloeddruk, lipidenstatus en andere cardiovasculaire risicofactoren zo goed mogelijk behandeld te worden.
Wat zijn de criteria om te switchen van therapie?
Een substantieel deel van de patiënten met DME reageert niet op de eerste 3-6 injecties met bevacizumab. Voor bevacizumab zijn hier weinig data over, maar een studie laat zien dat ongeveer 40% van patiënten die initieel met ranibizumab werden behandeld persisterend DME heeft na 24 weken (Bressler, 2016). De definitie voor non-respons is niet eenduidig beschreven, maar wordt over het algemeen gesteld als er geen afname van de retinale dikte en/of persisterend vocht na en tijdens de behandeling wordt gezien.
Als er nog geen FAG verricht is, dient men een FAG te maken om te kijken of er non-perfusie van de macula is en/of lekkage in de macula is, waarvoor laserbehandeling mogelijk is. Ook met ICG (indocyanine groen) angiografie kunnen soms grote microvasculaire veranderingen worden aangetoond in de late fase, die behandeld kunnen worden met focale laser (Farias, 2020).
Bij non-respons dient het de voorkeur om te switchen naar een ander therapeutisch middel. Bij phake patiënten kan er in eerste instantie gekozen worden voor een ander anti-VEGF middel. Bij pseudofakie lijkt de effectiviteit van een corticosteroïden gelijk te zijn aan anti-VEGF. De kanttekening hierbij is dat er verschillen zijn in effectiviteit tussen de verschillende anti-VEGF. Daarnaast dient rekening gehouden te worden met eventuele toename van de intra-oculaire druk. Tevens kan een corticosteroïd ook overwogen worden bij patiënten die nog de eigen lens bezitten, maar dan kan een cataractextractie bij nog persisterend macula oedeem nodig zijn (Hussain 2016).
In eerste instantie wordt geadviseerd te starten met bijvoorbeeld triamcinolon acetonide (off-label) of de biologisch afbreekbare dexamethason implant met vertraagde afgifte intravitreaal in verband met de werkingsduur van een aantal maanden. Bij chronisch oedeem dat onvoldoende effectief behandeld kan worden met laser of anti-VEGF en regelmatig corticosteroiden intravitreaal nodig heeft, kan men ook kiezen voor een intravitreale implant met vertraagde afgifte van fluocinolone acetonide gedurende 36 maanden (Campochiaro 2011, 2012). Let wel op dat een steroidrespons hierbij uitgesloten moet zijn.
Switchen naar een ander anti-VEGF of een andere behandelstrategie wordt ook geadviseerd bij overgevoeligheid voor een van de componenten van een anti-VEGF en/of bij een doorgemaakte heftige uveïtis na anti-VEGF. Ondanks dat er geen evidence is voor associatie met thrombo-embolische processen, blijft het wel onder de aandacht en kan eventueel een switch naar een niet VEGF-gemedieerde behandeling worden gekozen na een recent doorgemaakt thrombo-embolisch event.
Wat zijn de criteria om te stoppen met de behandeling van DME?
Redenen om (tijdelijk) te stoppen van de behandeling van DME kunnen zijn:
- gedurende langere tijd droge macula
- ondanks meerdere behandelentiteiten (anti-VEGF, corticosteroïden, aanvullend laser) geen effect op de anatomie van de retina.
- Logistiek voor patiënt niet haalbaar/ wens patiënt
Na stoppen van de behandeling is goede follow-up noodzakelijk gezien de kans op een recidief.
Onderbouwing
Achtergrond
Gedurende bijna 30 jaar was focale en/of grid lasercoagulatie de belangrijkste behandeling voor klinisch significant diabetisch macula oedeem (DME), gebaseerd op de eerste resultaten van de ETDRS studie die in 1985 zijn gepubliceerd (ETDRS, 1985). Sinds ongeveer 15 jaar vindt er een verschuiving van de behandeling plaats en komt er steeds meer bewijs dat anti–vascular endothelial growth factor (-VEGF) medicatie superieur is ten opzichte van lasertherapie. Ook het positieve effect van steroïden in de behandeling van DME komt steeds meer naar voren, hoewel er op de lange duur bijwerkingen kunnen ontstaan zoals cataract en glaucoom. Doordat er steeds meer behandelmogelijkheden bijkomen, ontstaan er ook veel vragen (welk middel, welke indicatie, wanneer switchen, naar welke therapie) over de beste behandeling van diabetisch macula oedeem. Omdat er sinds de vorige richtlijn diabetische retinopathie (autorisatiedatum: 14-11-2017) veel studies bijgekomen zijn met betrekking tot anti-VEGF en DME, is er in het jaar 2020 voor gekozen de module ‘behandeling van diabetisch macula oedeem’ gedeeltelijk te herzien.
Conclusies
Anti-VEGF versus laser
|
Hoog
GRADE |
Behandeling van diabetisch macula oedeem met anti-VEGF (bevacizumab, ranibizumab, aflibercept (2 mg); herhaalde intravitreale injecties) verhoogt de kans op een klinisch relevante verbetering van de visus (≥15 letters), en verlaagt de kans op een klinisch relevante verslechtering van de visus, in vergelijking tot behandeling met alleen laser.
Ranibizumab, bevacizumab en aflibercept (2 mg) zijn allen effectief in visusverbetering en vertragen van visusverslechtering bij de behandeling van centraal diabetisch macula oedeem.
Met name gebaseerd op resultaten bij een jaar follow-up. Langetermijneffecten (>2 jaar), en effecten in hoog (cardiovasculair-)risico populaties zijn onvoldoende onderzocht.
Bronnen: Virgili 2014; Virgili 2018 |
|
Hoog
GRADE |
Behandeling van diabetisch macula oedeem met anti-VEGF (bevacizumab, ranibizumab, aflibercept (2 mg)) leidt tot een grotere daling van de centrale retinadikte dan behandeling met alleen laser.
Bronnen: Virgili 2014; Virgili 2018 |
Anti-VEGF: middelen onderling
Vergelijking tussen aflibercept (2 mg), bevacizumab, en ranibizumab
|
Redelijk
GRADE |
Aflibercept (2 mg) heeft waarschijnlijk een hogere effectiviteit in het verbeteren van de visus bij behandeling van diabetisch macula oedeem gedurende een jaar dan ranibizumab en bevacizumab.
Bronnen: Virgili 2014, Virgili 2018; Fouda 2017 |
|
Redelijk
GRADE |
Ranibizumab en bevacizumab hebben waarschijnlijk een vergelijkbare effectiviteit in het verbeteren van de visus bij behandeling van diabetisch macula oedeem.
Bronnen: Virgili 2014; Virgili 2018; Vader 2020; Schauwvlieghe 2015 |
|
Laag
GRADE |
Er zijn aanwijzingen dat bij patiënten met diabetisch macula oedeem en een BCVA van 78-69 letters, bevacizumab, ranibizumab en aflibercept (2 mg) een vergelijkbare effectiviteit hebben in het verbeteren van de visus bij behandeling gedurende een of twee jaar.
Deze conclusie lijkt onafhankelijk van de centrale retinadikte bij start van behandeling.
Bronnen: Wells 2016a; Wells 2016b |
|
Laag
GRADE |
Er zijn aanwijzingen dat bij patiënten met diabetisch macula oedeem en een BCVA lager dan 69 letters, aflibercept (2 mg) een hogere effectiviteit heeft in het verbeteren van de visus bij behandeling gedurende een jaar dan ranibizumab en bevacizumab. Ranibizumab en bevacizumab lijken dan een vergelijkbare effectiviteit te hebben.
Deze hogere effectiviteit van aflibercept (2 mg) bij behandeling gedurende een jaar lijkt vooral te gelden voor patiënten met een relatief grote centrale retinadikte bij start van de behandeling.
Bij een behandeling gedurende twee jaar zijn de verschillen in effectiviteit tussen aflibercept (2 mg), ranibizumab en bevacizumab in het verbeteren van de visus geringer en mogelijk niet klinisch relevant.
|
|
Redelijk/Laag
Laag
Laag
GRADE |
Aflibercept (2 mg) heeft mogelijk een hogere effectiviteit dan bevacizumab en een enigszins hogere effectiviteit dan ranibizumab, in het verlagen van de centrale retinadikte bij behandeling gedurende een jaar.
Ranibizumab heeft mogelijk een gering hogere effectiviteit dan bevacizumab in het verlagen van de centrale retinadikte bij behandeling gedurende een jaar.
Bronnen: Virgili 2014, Virgili 2018; Fouda 2017; Vader 2020; Schauwvlieghe 2015 |
|
Laag
GRADE |
Er zijn aanwijzingen dat bij patiënten met diabetisch macula oedeem en een BCVA van 78-69 letters in combinatie met een relatief grote centrale retinadikte, aflibercept (2 mg) en ranibizumab een hogere effectiviteit hebben dan bevacizumab in het in het verlagen van de centrale retinadikte bij behandeling gedurende een jaar. Aflibercept (2 mg) en ranibizumab lijken een vergelijkbare effectiviteit te hebben.
Bij patiënten met een BCVA van 78-69 letters in combinatie met een relatief geringe centrale retinadikte bestaat er mogelijk geen verschil in effectiviteit tussen aflibercept (2 mg), ranibizumab en bevacizumab in het verlagen van de centrale retinadikte bij behandeling gedurende een jaar.
Bij patiënten met een BCVA van 78-69 letters, ongeacht centrale retinadikte, heeft aflibercept (2 mg) na 2 jaar follow-up mogelijk een hogere effectiviteit dan bevacizumab in het verlagen van de centrale retinadikte. Er bestaat mogelijk geen verschil in effectiviteit tussen ranibizumab en bevacizumab. Bronnen: Wells 2016a; Wells 2016b |
|
Laag
GRADE |
Er zijn aanwijzingen dat bij patiënten met diabetisch macula oedeem en een BCVA lager dan 69 letters in combinatie met een relatief grote centrale retinadikte, aflibercept (2 mg) en ranibizumab een hogere effectiviteit hebben dan bevacizumab in het in het verlagen van de centrale retinadikte bij behandeling gedurende een jaar. Aflibercept (2 mg) en ranibizumab lijken een vergelijkbare effectiviteit te hebben.
Bij patiënten met een BCVA lager dan 69 letters in combinatie met een relatief geringe centrale retinadikte bestaat er mogelijk geen verschil in effectiviteit tussen aflibercept (2 mg), ranibizumab en bevacizumab in het verlagen van de centrale retinadikte bij behandeling gedurende een jaar.
De verschillen in effectiviteit tussen aflibercept (2 mg), ranibizumab en bevacizumab in het verlagen van de centrale retinadikte lijken na een follow-up van twee jaar geringer te worden.
Bronnen: Wells 2016a; Wells 2016b |
Vergelijking tussen conbercept en ranibizumab
|
Zeer Laag
GRADE |
We zijn onzeker over de effectiviteit van conbercept in het verbeteren van de visus, en in het verlagen van de centrale retinadikte, bij behandeling van diabetisch macula oedeem, in vergelijking met ranibizumab.
Bronnen: Sun 2020 |
Vergelijking tussen faricimab en ranibizumab
|
Laag
GRADE |
Ranibizumab en faricimab hebben mogelijk een vergelijkbare effectiviteit in het verbeteren van de visus, en in het verlagen van de centrale retinadikte, bij behandeling van diabetisch macula oedeem.
Bronnen: Sahni 2019 |
Anti-VEGF versus corticosteroïden
|
Redelijk
GRADE |
Behandeling van diabetisch macula oedeem met ranibizumab verhoogt de kans op een klinisch relevante verbetering van de visus, en verlaagt de kans op een klinisch relevante verslechtering van de visus, in vergelijking tot behandeling met triamcinolon (herhaalde intravitreale injecties).
Met name gebaseerd op resultaten bij een jaar follow-up. Langetermijneffecten (>2 jaar), en effecten in hoog (cardiovasculair-)risico populaties zijn onvoldoende onderzocht
Bronnen: DRCRN 2010, 2011 |
|
Laag
GRADE |
Er zijn aanwijzingen dat bij diabetisch macula oedeem in pseudofake ogen, ranibizumab en triamcinolon een vergelijkbare effectiviteit hebben in het verbeteren van de visus.
Bronnen: DRCRN 2010, 2011 |
|
Laag
GRADE |
Er zijn aanwijzingen dat bij patiënten met eigen lens en diabetisch macula oedeem, ranibizumab een hogere effectiviteit heeft dan triamcinolon in het verbeteren van de visus.
Bronnen: DRCRN 2010, 2011 |
|
Redelijk
GRADE |
Ranibizumab en triamcinolon hebben een vergelijkbare effectiviteit in het verlagen van de centrale retinadikte bij patiënten met diabetisch macula oedeem.
Bronnen: DRCRN 2010, 2011 |
|
Laag
GRADE |
Er zijn aanwijzingen dat bevacizumab en dexamethason (implantaat) een vergelijkbare effectiviteit hebben in het verbeteren van de visus bij patiënten met diabetisch macula oedeem. Dexamethason lijkt een grotere effectiviteit te hebben in het verlagen van de centrale retinadikte.
Bronnen: Gillies 2014 |
Bijwerkingen en complicaties
|
Redelijk
GRADE |
Anti-VEGF middelen leiden waarschijnlijk niet tot een verhoogd risico op ernstige oculaire complicaties, ernstige systemische adverse events, arterieel trombo-embolische events, of totale mortaliteit, in vergelijking tot alleen laserbehandeling of controlebehandeling.
Met name gebaseerd op resultaten bij een jaar follow-up. Langetermijneffecten (>2 jaar), en effecten in hoog (cardiovasculair-)risico populaties zijn onvoldoende onderzocht.
Bronnen: : Virgili 2014; Virgili 2018; Reibaldi 2020; Thulliez 2018 |
|
Laag
GRADE |
Er lijken geen klinisch relevante verschillen in veiligheid te bestaan tussen individuele anti-VEGF middelen (bevacizumab, ranibizumab, aflibercept (2 mg)).
Met name gebaseerd op resultaten bij een jaar follow-up. Langetermijneffecten (>2 jaar), en effecten in hoog (cardiovasculair-)risico populaties zijn onvoldoende onderzocht.
Bronnen: Virgili 2014; Virgili 2018; Reibaldi 2020; Thulliez 2018 |
|
Redelijk
GRADE |
Er zijn geen aanwijzingen dat het risico op ernstige oculaire of systemische adverse events is verhoogd na laserbehandeling.
Bronnen: Virgili 2014; Ford 2013; Virgili 2018 |
|
Redelijk
GRADE |
Intravitreale injecties van corticosteroïden ter behandeling van diabetisch macula oedeem leiden tot een verhoogd risico op oculaire adverse events, in het bijzonder verhoogde oogdruk en cataract (progressie), in vergelijking met controlebehandeling, anti-VEGF of laserbehandeling.
Met name gebaseerd op resultaten bij een jaar follow-up. Langetermijneffecten (>2 jaar), en effecten in hoog (cardiovasculair-)risico populaties zijn onvoldoende onderzocht.
Bronnen: Ford 2013 |
|
Laag
GRADE |
Er zijn geen aanwijzingen dat intravitreale injecties met corticosteroïden het risico op systemische adverse events verhogen.
Met name gebaseerd op resultaten bij een jaar follow up. Langetermijneffecten (>2 jaar), en effecten in hoog (cardiovasculair-)risico populaties zijn onvoldoende onderzocht.
Bronnen: Ford 2013 |
Samenvatting literatuur
Voor de vergelijking van anti-VEGF versus laser is de systematische literatuuranalyse gebaseerd op Virgili (2014), voor de vergelijking van anti-VEGF middelen onderling is de literatuuranalyse gebaseerd op Virgili (2014) en de aanvullende studie (DRCRN 2015). Voor de vergelijking van anti-VEGF versus corticosteroïden is de literatuuranalyse gebaseerd op Ford (2013) met de aanvullende studie (Gillies 2014).
De update richt zich primair op de onderlinge vergelijking tussen anti-VEGF middelen, waarbij de systematische literatuuranalyse gebaseerd op de recent herziene SR van Virgili (Virgili 2018), de SR van Sun (2020) en 4 aanvullende RCT’s (Vader 2020; Schauwvlieghe 2015; Fouda 2017; Wells 2016a, 2016b; Sahni 2019). Daarnaast is de evidence voor de vergelijking tussen laser en anti-VEGF middelen herbeoordeeld aan de hand van de recente herziening van de Cochrane review (Virgili 2018).
Anti-VEGF versus laser
Voor de vergelijking van anti-VEGF versus laser is de systematische literatuuranalyse gebaseerd op Virgili (2014), een aanvullende zoekactie leverde geen recentere studies op die aan de inclusiecriteria voldoen en relevant zijn voor de vergelijking anti-VEGF versus laser.
De systematische review van Virgili (2014) is van zeer goede kwaliteit (zie Table of quality assessment). Virgili (2014) vergelijkt anti-VEGF middelen met laser- of controlebehandeling en dekt de literatuur tot april 2014.
Virgili (2014) includeert 18 RCT’s waarin anti-VEGF behandeling wordt vergeleken met laserbehandeling (11 studies, 1333 deelnemers), of placebo (sham treatment; 3 studies, 497 deelnemers), of waarin een combinatiebehandeling met anti-VEGF en laser wordt vergeleken met alleen laserbehandeling (4 studies, 919 deelnemers). De studiegrootte varieert tussen 37 en 852 deelnemers. Vergelijkingen met intravitreale corticosteroïden werden van de analyse uitgesloten. De primaire uitkomstmaat is verandering van visus (BCVA, best-corrected visual acuity) bij een jaar follow-up, gedefinieerd als een verbetering of verslechtering met tenminste 15 ETDRS letters, 3 ETDRS lijnen of 0,3 logMAR. Als secundaire uitkomstmaten worden o.a. centrale retinadikte en veiligheid (oculaire en systemische adverse events) geanalyseerd. Patiënten in de geïncludeerde studies hadden de klinische diagnose DME, in veel gevallen bevestigd met OCT. De BCVA op baseline lag tussen 20/200 en 20/40.
Er is enige variatie in de inclusiecriteria die worden gehanteerd in de RCT’s, met name met betrekking tot patiënten die eerder met laser zijn behandeld. In een meerderheid van de studies worden alleen patiënten die in de laatste drie tot zes maanden zijn gelaserd uitgesloten. In drie RCT’s worden alleen patiënten die niet reageerden op een laserbehandeling geïncludeerd (zie Virgili 2014 [Ahmadieh 2008; BOLT 2010; Ekinci 2014]), en in een RCT (zie Virgili 2014 [Soheilian 2007]) worden juist patiënten geïncludeerd die geen eerdere laserbehandeling hebben ondergaan.
De individuele studieopzet (risk of bias) van de geïncludeerde studies werd beoordeeld in overeenstemming met het Cochrane Handbook (Higgins 2011), en de kwaliteit van de studies is overwegend hoog (zie de risk of bias beoordeling in Fig. 1-6; Virgili 2014). Twaalf van de achttien RCT’s zijn Europese of Noord-Amerikaanse RCT’s gesponsord door de anti-VEGF fabrikant (zie Virgili 2014 [BOLT 2010; DA VINCI 2011; DRCRnet 2010; Korobelnik 2014; Macugen 2005; Macugen 2011; READ2 2009; NCT01131585 (RELATION); RESOLVE 2010; RESPOND 2013; RESTORE 2011; RISE-RIDE]). Vijf van de zes niet-commerciële studies betreft off-label gebruik van bevacizumab.
Elf RCT’s vergeleken laserbehandeling met anti-VEGF, overwegend bij een jaar follow-up: bevacizumab (3 studies, 249 deelnemers), ranibizumab (5 studies, 1529 deelnemers), aflibercept (3 studies, 1120 deelnemers). Anti-VEGF behandeling betrof 7-9 injecties in het eerste en 3-4 injecties in het tweede jaar, pro re nata (injecties als nodig) of volgens een vast regime.
De evidence voor de vergelijking tussen laser en anti-VEGF middelen is herbeoordeeld aan de hand van de herziene Cochrane reviews van Virgili (Virgili 2018). Zie ‘vergelijking tussen anti-VEGF middelen onderling’ voor details met betrekking tot de systematische review van Virgili (2018).
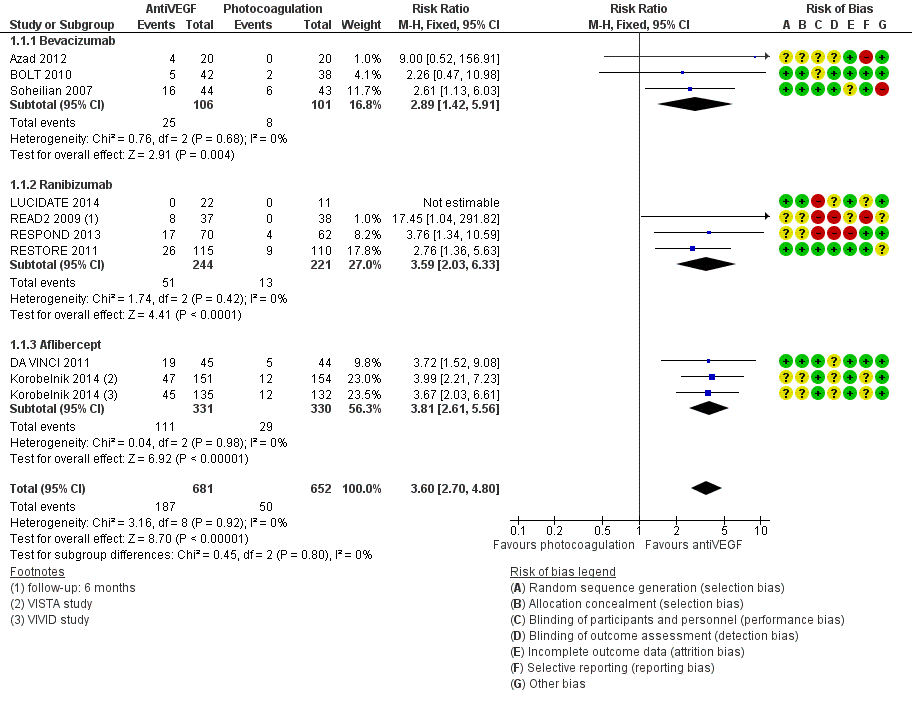
Visus (BCVA) – cruciale uitkomstmaat
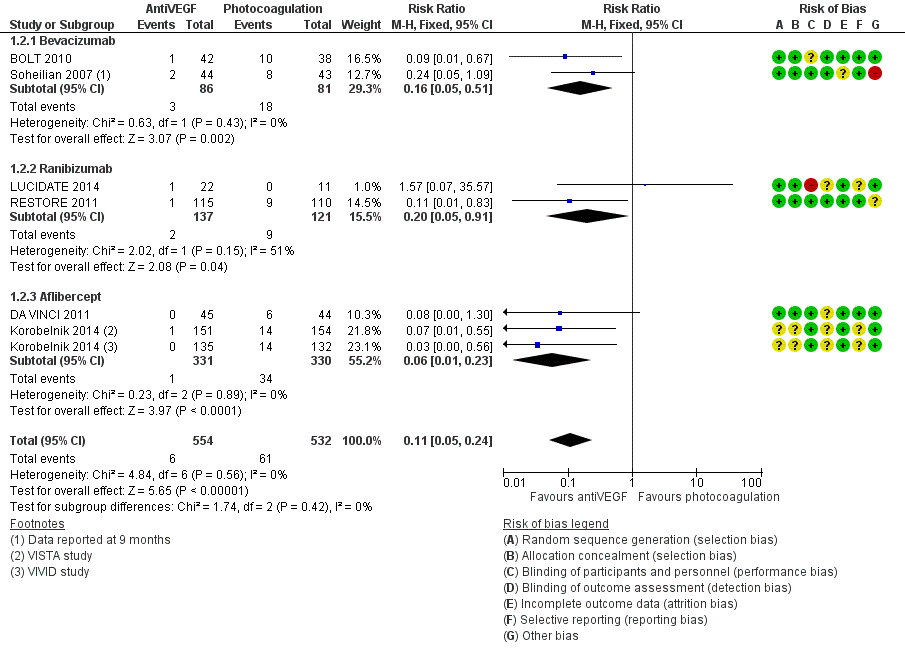
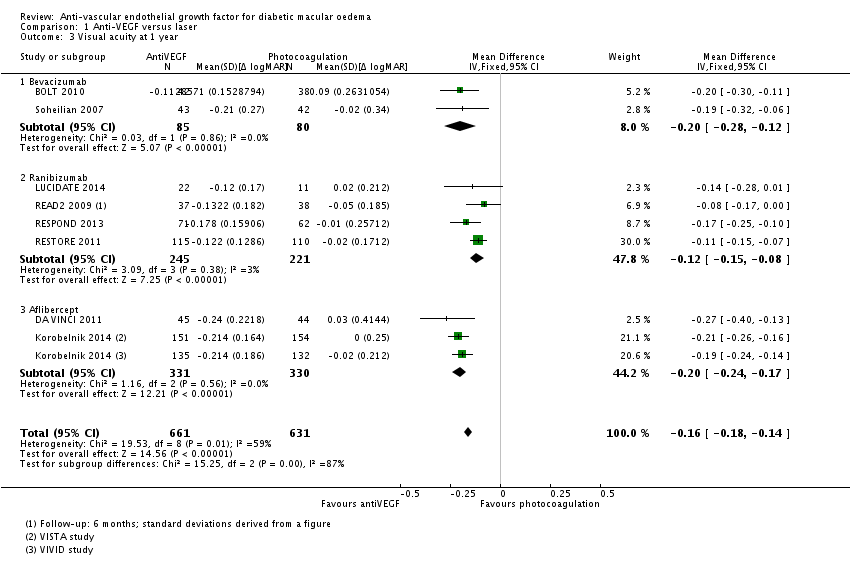
Meta-analyse van de proportie patiënten waarin de visus klinisch relevant, dat wil zeggen met ( 3 of meer lijnen; 15 of meer letters), is toegenomen na een jaar follow-up (Fig. 1) laat zien dat behandeling met anti-VEGF de kans op een klinisch relevante verbetering van de visus vergroot ten opzichte van laserbehandeling: relatief risico, RR=3,6 (95% betrouwbaarheidsinterval, 95%BI= [2,7; 4,8]; 10 studies, 1333 deelnemers, heterogeniteit I2=0%). In absolute termen neemt het aantal patiënten met klinisch relevante verbetering van de visus naar schatting toe van 8 op de 100 bij laserbehandeling naar 28 op de 100 bij anti-VEGF behandeling: number needed to treat, NNT=5 (95%BI=[3; 8]). Tegelijkertijd verlaagt behandeling met anti-VEGF de kans op een klinisch relevante verslechtering van de visus ten opzichte van laserbehandeling (Fig. 2): relatief risico, RR=0,11 (95%BI=[0,05; 0,24]; 7 studies, 1086 deelnemers, heterogeniteit I2=0%). Het aantal patiënten met een klinisch relevante verslechtering van de visus bij een jaar follow-up neemt naar schatting af van 12 op de 100 bij laserbehandeling naar minder dan 2 op de 100 bij anti-VEGF behandeling: NNT=10 (95%BI=[9; 12]). Het verschil in visus tussen behandeling met anti-VEGF en laserbehandeling bij een jaar follow-up bedraagt (Fig. 3): gemiddeld verschil, MD=1,6 lijnen (95%BI=[1,4; 1,8]; 9 studies, 1292 deelnemers, heterogeniteit I2=59%) in het voordeel van de anti-VEGF behandeling. Deze gemiddelde verbetering in visus op groepsniveau bij behandeling met anti-VEGF in plaats van laser is weliswaar statistisch significant maar bereikt niet de grens voor klinische relevantie (3 of meer lijnen). Een klinisch relevante verbetering van de visus wordt slechts bereikt bij een betrekkelijk klein deel van de patiënten.
Data verkregen bij langere follow-up geven een vergelijkbaar beeld, maar zijn schaars en daarmee minder betrouwbaar. Eén RCT (zie Virgili 2014 [BOLT 2010]) rapporteert de primaire uitkomstmaat: bij 2 jaar follow-up blijkt anti-VEGF (bevacizumab) de kans op een klinisch relevante verbetering van de visus te vergroten en de kans op een verslechtering van de visus te verkleinen ten opzichte van laserbehandeling; respectievelijk RR=9,1 (95%BI= [1,2; 65,8]) en RR=0,08 (95%BI= [0,00; 1,51]). Twee RCT’s (zie Virgili 2014 [BOLT 2010; Soheilian 2007]) rapporteren het gemiddelde verschil in visus tussen behandeling met anti-VEGF en laserbehandeling bij 2 jaar follow-up: MD=-0,14 logMAR (95%BI=[-0,24; -0,05]; 2 studies, 142 deelnemers, heterogeniteit I2=29%), ongeveer 1,5 lijnen in het voordeel van anti-VEGF.
Figuur 2.1. Forest plot van de vergelijking tussen anti-VEGF en laser: relatief risico op toename visus met tenminste 3 lijnen bij ongeveer een jaar follow-up. Subgroepen: bevacizumab, ranibizumab, aflibercept. Fixed effects model. Cochrane Risk of bias beoordeling (Virgili 2014).
Figuur 2.2. Forest plot van de vergelijking tussen anti-VEGF en laser: relatief risico op afname visus met tenminste 3 lijnen bij ongeveer een jaar follow-up. Fixed effects model. Cochrane Risk of bias beoordeling (Virgili 2014).
Figuur 2.3. Forest plot van de vergelijking tussen anti-VEGF en laser: verschil (MD, mean difference) in visus (BCVA) bij een jaar follow-up. Fixed effects model (Virgili 2014).
Bovenstaande resultaten worden bevestigd in de herziene Cochrane review (Virgili 2018). Netwerk meta-analyse van de proportie patiënten waarin de visus klinisch relevant (met 3 of meer lijnen; 15 of meer letters), is toegenomen na een jaar follow-up laat zien dat behandeling met aflibercept (RR=3,66; 95%BI=[2,79; 4.79]), bevacizumab (RR=2,47; 95%BI=[1,81; 3,37]) en ranibizumab (RR=2,76; 95%BI=[2,12; 3,59]) de kans op een klinisch relevante verbetering van de visus vergroot ten opzichte van laserbehandeling. In absolute termen neemt het aantal patiënten met klinisch relevante verbetering van de visus naar schatting toe van 10 op de 100 bij laserbehandeling naar 37 op de 100, 25 op de 100, en 28 op de 100 bij behandeling met respectievelijk aflibercept, bevacizumab en ranibizumab: number needed to treat, NNT= 3,8 (aflibercept), NNT= 6,8 (bevacizumab) en NNT= 5,7 (ranibizumab).
Centrale retinale dikte – belangrijke uitkomstmaat
Meta-analyse van de centrale retinale dikte bepaald met OCT bij een jaar follow-up (Fig. 4) laat zien dat behandeling met anti-VEGF de centrale retinadikte statistisch significant en klinisch relevant verlaagt ten opzichte van laserbehandeling: MD=-78,8 µm (95%BI= [-94,5; -63,1]; 8 studies, 1215 deelnemers, heterogeniteit I2=68%).
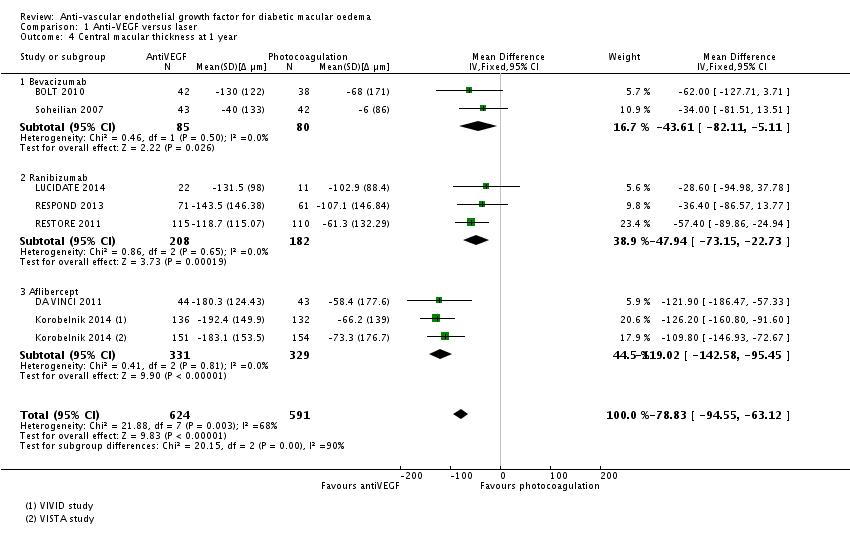
Figuur 2.4. Forest plot van de vergelijking tussen anti-VEGF en laser: verschil (MD, mean difference) in retinale dikte. Random effects model (Virgili 2014).
Bovenstaande resultaten worden bevestigd in de herziene Cochrane review (Virgili 2018). Netwerk meta-analyse van de centrale retinale dikte bepaald met OCT bij een jaar follow-up laat zien dat behandeling met aflibercept (MD=-114 µm; 95%BI=[−147; −81]), bevacizumab (MD=-46 µm; 95%BI=[−78; −14]) en ranibizumab (MD=-75 µm; 95%BI=[−100; −50]) de centrale retinadikte statistisch significant en, met uitzondering van bevacizumab, klinisch relevant verlaagt ten opzichte van laserbehandeling. Behandeling met bevacizumab resulteert in een gemiddelde afname in retinale dikte die kleiner is dan het door de werkgroep gedefinieerde minimaal klinisch relevante verschil van 50 µm, maar de effectschatting (95%BI) overlapt wel met deze grens voor klinisch relevantie.
Ernstige bijwerkingen en complicaties – belangrijke uitkomstmaat
Zie Bijwerkingen en complicaties (alle vergelijkingen).
Overige uitkomstmaten
Virgili (2014) rapporteert geen uitkomsten met betrekking tot belasting voor de patiënt, en kosten (inclusief tijdsinvestering behandelaar) of kosteneffectiviteit.
Vergelijking anti-VEGF middelen onderling
Bij de herziening is de systematische literatuuranalyse voor de vergelijking tussen aflibercept, bevacizumab, en ranibizumab gebaseerd op de SR van Virgili (2018) en 3 aanvullende RCT’s (Vader 2020; Schauwvlieghe 2015; Fouda 2017; Wells 2016a, 2016b). Voor de vergelijking tussen conbercept en ranibizumab is deze gebaseerd op de SR van Sun (2020), en voor de vergelijking tussen farcimab en ranibizumab is deze gebaseerd op een RCT van Sahni (2019).
Vergelijking tussen aflibercept, bevacizumab, en ranibizumab
De systematische review van Virgili (2018) is van zeer goede kwaliteit (zie Table of quality assessment). Virgili (2018) vergelijkt anti-VEGF middelen onderling ((in)directe vergelijkingen) en dekt de literatuur tot 26 april 2017. Virgili (2018) includeert 24 RCT’s waarin aflibercept (3 studies; 975 ogen), bevacizumab (8 studies; 515 ogen) en ranibizumab (11 studies; 1518 ogen) behandeling onderling wordt vergeleken. De individuele studiegrootte varieert tussen de 32 en 859 deelnemers. De uitkomstmaat is verandering van visus (BCVA, best-corrected visual acuity) bij een jaar follow-up, gedefinieerd als een verbetering of verslechtering met tenminste 15 ETDRS letters, 3 ETDRS lijnen of 0,3 logMAR. Als secundaire uitkomstmaten worden o.a. centrale retinadikte en veiligheid (oculaire en systemische adverse events) geanalyseerd. Patiënten in de geïncludeerde studies hadden de klinische diagnose DME, in veel gevallen bevestigd met OCT. De BCVA op baseline lag tussen 20/200 en 20/40. De individuele studieopzet (risk of bias) van de geïncludeerde studies werd beoordeeld in overeenstemming met het Cochrane Handbook (Higgins 2011), en de kwaliteit van de studies is overwegend hoog (zie de risk of bias beoordeling in Virgili 2018 [Fig. 2]). Zeventien van de vierentwintig RCT’s zijn gesponsord door een anti-VEGF fabrikant (zie Virgili 2018 [DA VINCI 2011; DRCRnet 2010; DRCRnet 2015; Korobelnik 2014; Ishibashi 2014; Lopez-Galvez 2014; LUCIDATE 2014; Macugen 2005; Macugen 2011; Nupomuceno 2013; READ2 2009; RELATION 2012; RESOLVE 2010; RESPOND 2013; RESTORE 2011; REVEAL 2016; RISE-RIDE]).
De studies van Wells (2016a) is een verkennende post-hoc analyse van de DRCRnet RCT (Wells 2015) en Wells (2016b) is een extensie van genoemde RCT. De RCT betreft volwassen patiënten met diabetisch macula oedeem die zijn behandeld met herhaalde intravitreale injecties met aflibercept (2 mg; n=224), bevacizumab (1.25 mg; n=218), of ranibizumab (0,3 mg; n=218). De oorspronkelijke DRCRnet RCT is gesubsidieerd door de National Institute of Health (NIH; USA) en wordt afgezien van het gratis beschikbaar stellen van aflibercept en ranibizumab niet gesponsord door fabrikanten. De uitkomstmaat is verandering van visus (BCVA, best-corrected visual acuity; letter score) en verandering van de centrale retinadikte (Centrale Subfield Thickness; CST) bij jaar follow-up (Wells 2016a) en 2 jaar follow-up (Wells 2016b). Inclusie beperkt zich tot patiënten met de klinische diagnose DME (bevestigd met OCT) en tenminste een oog met een BCVA van 78-24 letters (Snellen visus 20/32 tot 20/320). Vooraf zijn subgroepen gedefinieerd op basis van patiëntkarakteristieken op baseline: een lage BVCA score (<69 letters), een hoge BCVA score (> 70 letters), een lage retinadikte (CST <400µm), en een hoge retinadikte (CST >400µm). Voor een overzicht van de studiekarakteristieken en resultaten wordt verwezen naar de evidencetabel.
Vergelijking tussen bevacizumab en ranibizumab
De BRDME studie (Vader 2020; Schauwvlieghe 2015) is een Nederlandse multicenter RCT van goede kwaliteit (zie Table of quality assessment), waarin volwassen patiënten met diabetisch macula oedeem worden gerandomiseerd naar behandeling met 6 maandelijks herhaalde intravitreale injecties met bevacizumab (1,25 mg; n=86), of ranibizumab (0,5 mg; n=84). De studie is gesubsidieerd door de Nederlandse organisatie voor gezondheidsonderzoek en zorginnovatie (ZonMw). De primaire uitkomstmaat is verandering van visus (BCVA, best-corrected visual acuity; letter score) bij 6 maanden follow-up. Als secundaire uitkomstmaten worden centrale retinadikte en veiligheid (adverse events) geanalyseerd. Inclusie beperkt zich tot patiënten met de klinische diagnose DME (bevestigd met OCT) en tenminste één oog met een BCVA van 78-24 letters. Er is een subgroepanalyse uitgevoerd op basis van lage (BCVA ≤ 69 letters) en hoge visus (BCVA > 70 letters).De gemiddelde BCVA op baseline is 69,0 letters in de bevacizumab groep en 68,5 letters in de ranibizumab groep, de gemiddelde leeftijd bedraagt 63,9 jaar in de bevacizumab groep en 64,9 jaar in de ranibizumab groep, en het merendeel van de patiënten (88.1 versus 85.5%) heeft type 2 diabetes mellitus. Voor een overzicht van de studiekarakteristieken en resultaten wordt verwezen naar de evidencetabel.
Vergelijking tussen aflibercept en ranibizumab
De studie van Fouda (2017) is een Noord-Afrikaanse RCT van goede kwaliteit (zie Table of quality assessment), waarin volwassen patiënten met diabetisch macula oedeem worden gerandomiseerd naar behandeling met herhaalde intravitreale injecties met aflibercept (2mg; n=35), en ranibizumab (0,5 mg; n=35). Het is onbekend hoe de studie is gefinancierd. De primaire uitkomstmaat is verandering van visus (BCVA, best-corrected visual acuity; letter score) en verandering van de gemiddelde centrale retinadikte bij een jaar follow-up. Inclusie beperkt zich tot patiënten met de klinische diagnose DME (bevestigd met OCT) en tenminste een oog met een BCVA van 0,1 tot 1,25 snellen decimaal. De gemiddelde BCVA op baseline is 0,17 snellen decimaal in de aflibercept groep en 0,18 snellen decimaal in de ranibizumab groep, en de gemiddelde leeftijd bedraagt 55,1 jaar in de aflibercept groep en 56,6 jaar in de ranibizumab groep. Voor een overzicht van de studiekarakteristieken en resultaten wordt verwezen naar de evidencetabel.
Vergelijking tussen conbercept en ranibizumab
Voor de vergelijking van intravitreale conbercept met intravitreal ranibizumab is de systematische literatuuranalyse gebaseerd op Sun (2020). De systematische review van Sun (2020) is van lage kwaliteit met name vanwege het ontbreken van een risk of bias beoordeling (wel uitgevoerd maar niet gerapporteerd) en het poolen van resultaten uit observationeel en gerandomiseerd onderzoek (zie Table of quality assessment). De individuele studiekwaliteit kan niet worden beoordeeld omdat het uitsluitend Chinese studies betreft gepubliceerd in de eigen taal. Sun (2020) dekt de literatuur tot februari 2019. Sun (2020) includeert één RCT’s en zeven observationele studies waarin intravitreale conbercept (300 patiënten) met intravitreale ranibizumab (288 patiënten) worden vergeleken. Het is onbekend hoe de studie is gefinancierd. De studiegrootte varieert tussen de 50 en 110 deelnemers. De uitkomstmaat is verandering van BCVA (geconverteerd naar logMAR) bij 1, 3 en 6 maanden na behandeling, centrale retinadikte (gemeten middels OCT) en veiligheid (adverse events). Patiënten in de geïncludeerde studies hadden de klinische diagnose DME, bevestigd met OCT.
Vergelijking tussen faricimab en ranibizumab
De studie van Sahni (2019) is een Noord-Amerikaanse multicenter RCT van goede kwaliteit (zie Table of quality assessment), waarin volwassen patiënten met diabetisch macula oedeem worden gerandomiseerd naar behandeling met herhaalde intravitreale injecties met ranibizumab (0,3 mg; n=59), farcimab (1,5 mg; n=54), of farcimab (6,0 mg; n=53). De studie is gesubsidieerd door Roche, en Roche heeft ook inspraak gehad in het design, de uitvoering, analyse, en rapportage van de studie. De primaire uitkomstmaat is verandering van visus (BCVA, best-corrected visual acuity; letter score) en verandering van de gemiddelde centrale retinadikte bij 24 weken follow-up. Inclusie beperkt zich tot patiënten met de klinische diagnose DME (bevestigd met OCT) en tenminste een oog met een BCVA van 73-24 letters (Snellen visus 20/40 tot 20/320). De gemiddelde BCVA op baseline is 64,8 letters (Snellen 20/50), de gemiddelde leeftijd bedraagt 62,6 jaar, en 63,6% is man. Voor een overzicht van de studiekarakteristieken en resultaten wordt verwezen naar de evidence tabel.
Ranibizumab 0,3 mg en 0,5 mg
In 2006 werd 0,5 mg ranibizumab goedgekeurd voor de behandeling van AMD (age-related macular degeneration). In de RISE & RIDE study werd er geen verschil in effectiviteit gevonden tussen maandelijks 0,3 mg en 0,5 mg ranibizumab bij de behandeling van DME gedurende 36 maanden (Brown DM et al, Ophthalmology 2013). In verband met gelijke effectiviteit, werd in 2012 0,3 mg ranibizumab goedgekeurd voor de behandeling van DME in de Verenigde Staten, omdat het mogelijk verminderd risico zou geven op systemische VEGF suppressie. In 2011 werd 0,5 mg ranibizumab goedgekeurd door de EMA voor de behandeling van DME op basis van de RESOLVE, RETAIN, RESTORE en RISE&RIDE studies. Voor DME zijn er geen aanwijzingen dat er een dose-respons relatie zou zijn. Voor de volledigheid staan in tabel 2.1 nogmaals de gebruikte doseringen per studie.
Tabel 2.1. Gebruikte dosering van ranibizumab per studie
|
Studie |
Dosering ranibizumab |
|
DRCRN, 2017 |
0.3 mg |
|
DRCRN, 2010,2011 |
0.5 mg |
|
Vader, 2020 (Schauwvlie, 2015) |
0.5 mg |
|
Sahnhi, 2019 |
0.3 mg |
|
Fouda, 2017 |
0.5 mg |
|
Wells, 2016a |
0.3 mg |
|
Wells, 2016b |
0.3 mg |
|
Virgili (2018) - DRCRnet 2010 - Lopez-Galvez 2014 - LUCIDATE 2014 - READ2 2009 - RELATION 2012 - RESOLVE 2010 - RESPOND 2013 - RESTORE 2011 - REVEAL 2015 - RISE-RIDE - Turkoglu 2015 - DRCRnet 2015 - Wiley 2016 |
0.5 mg 0.5 mg 0.5 mg 0.5 mg 0.5 mg dose adjustment was allowed for ranibizumab 0.5 mg 0.5 mg 0.5 mg 0.3 mg en 0,5 mg 0.5 mg 0.3 mg 0.3 mg |
|
Sun (2020): - Xu and Rong - Full-teksten van de andere studies niet gevonden |
0.5 mg |
Visus (BCVA) – cruciale uitkomstmaat
Vergelijking tussen aflibercept, bevacizumab, en ranibizumab
In de meta-analyses van Virgili (2018) worden voor de uitkomstmaat op basis van een klinisch relevante verbetering van de visus (een verbetering met tenminste 15 ETDRS letters, 3 ETDRS lijnen of 0,3 logMAR) en 1 jaar follow-up statisch significante verschillen gevonden waarbij aflibercept zich positief onderscheidt ten opzichte van ranibizumab en bevacizumab: relatief risico ten opzichte van aflibercept, respectievelijk RR= 0,75 (95% BI=[0,60; 0,94]) en RR= 0,68 (95% BI=[0,53; 0,86]). Tussen behandeling met ranibizumab en bevacizumab wordt een klein en niet statistisch significant verschil gevonden: RR= 1,11 (95%BI=[ 0,87; 1,43]). In absolute termen neemt het aantal patiënten met klinisch relevante verbetering van de visus na 1 jaar behandeling naar schatting af van 37 op de 100 bij behandeling met aflibercept, naar 28 op de 100, en 25 op de 100 bij behandeling met respectievelijk ranibizumab en bevacizumab: number needed to treat, NNT= 10,9 (aflibercept in vergelijking met ranibizumab), NNT= 8,5 (aflibercept in vergelijking met bevacizumab). Het bijbehorende groepsverschil (mean difference, MD) bij vergelijking van aflibercept met ranibizumab, en van aflibercept met bevacizumab bedraagt respectievelijk MD=0,08 (95% BI [0,05; 0,11]) logMAR en MD=0,08 (95% BI=[0,05; 0,11]) logMAR. Tussen behandeling met ranibizumab en bevacizumab wordt geen verschil gevonden: MD=0,00 (95%BI=[−0,02; 0,03]) logMAR. In alle gevallen is het groepsverschil kleiner dan 0,3 logMAR en derhalve niet klinisch relevant.
Wells (2016a) vergelijkt aflibercept, bevacizumab an ranibizumab in een post-hoc subgroepanalyse van de DRCN2015 RCT (Wells 2015) en Wells (2016b) is een extensie van genoemde RCT. Subgroepen worden onderscheiden op basis van lage baseline visus (Snellen visus 20/50 of slechter; BCVA Letter score <69) versus hogere baseline visus (Snellen visus 20/32-20/40; BCVA letter score 78-69), en verder onderverdeeld in patiënten met lage centrale retinadikte op baseline (CST<400µm) versus hogere centrale retinadikte (CST >400µm). De uitkomstmaat is verandering in visus (BCVA gecorrigeerd voor baseline; letter score op een schaal van 0-100) bij 1 jaar follow-up (Wells 2016a) en 2 jaar follow-up (Wells 2016b). De belangrijkste resultaten zijn samengevat in Tabel 1 en 2. Bij de post-hoc subgroepanalyse van Wells (2016a) moet wel worden aangetekend dat het verkennende analyses betreft met een groot aantal vergelijkingen (zonder correctie voor multiple testing), kleine subgroep grootte en een geringe statistische power.
|
Hoge BCVA 20/32-20/40 (letter score 78-69) op baseline |
Verandering in BCVA t.o.v. baseline (MD letter score; 95%BI) Interventie versus controle A = aflibercept, B = bevacizumab, R = ranibizumab |
||
|
1 jaar follow-up (Wells 2016a) |
|||
|
N=313 |
A versus B
|
A versus R |
R versus B
|
|
CST≥400µm op baseline (N=107)
|
3.7 [−0.8; 8.1] |
0.2 [−3.8; 4.3] |
3.4 [−0.8; 7.6] |
|
CST<400µm op baseline (N=206)
|
−1.0 [−3.9; 1.9] |
−0.4 [−3.5; 2.7] |
−0.6 [−3.7; 2.4] |
|
2 jaar follow-up (Wells 2016b) |
|||
|
Overall (N=289) |
1,1 [-1,1; 3,4] |
-0,7 [-2,9; 1,5] |
1,9 [-0,9; 4,7] |
|
Lage BCVA 20/50 or worse (letter score <69) op baseline |
Verandering in BCVA t.o.v. baseline (MD letter score; 95%BI) Interventie versus controle A = aflibercept, B = bevacizumab, R = ranibizumab |
||
|
1 jaar follow-up (Wells 2016a) |
|||
|
N=300 |
A versus B
|
A versus R |
R versus B
|
|
CST≥400µm op baseline (N=172)
|
8.1 [4.9; 11.3] |
4.5 [1.2; 7.8] |
3.6 [0.3; 7.0] |
|
CST<400µm op baseline (N=128)
|
5.7 [1.8; 9.7] |
4.7 [0.9; 8.4] |
1.1 [−2.7; 4.8] |
|
2 jaar follow-up (Wells 2016b) |
|||
|
Overall (N=277) |
4,7 [0,5; 8,8] |
2,3 [-1,1; 5,6] |
-2,4 [-5,8; 1,0] |
Tabel 2.2. Subgroepanalyse van het effect van intraoculair anti-VEGF op de visus (BCVA): vergelijking tussen aflibercept, bevacizumab, en ranibizumab bij patiënten met een relatief hoge BCVA (bovenste panel) en een relatief lage BCVA (onderste panel). Resultaten na 1 jaar (Wells 2016a) met onderscheid tussen patiënten met een hoge of lage centrale retinadikte op baseline (CST≥400 µm, CST<400 µm), en na 2 jaar (Wells 2016b). Uitkomstmaat: verandering in BCVA t.o.v. baseline (MD letter score; 95%BI). Een positief verschil is in het voordeel van de interventie, statistisch significante effectschattingen zijn vetgedrukt, een groepsverschil van ≥15 letters wordt als klinisch relevant beschouwd.
|
Hoge BCVA 20/32-20/40 (letter score 78-69) op baseline |
% patiënten met ≥15 letters verbetering in BCVA (verschil; 95%BI) Interventie versus controle A = aflibercept, B = bevacizumab, R = ranibizumab |
||
|
1 jaar follow-up (Wells 2016a) |
|||
|
N=313 |
A versus B
|
A versus R |
R versus B
|
|
CST≥400 µm op baseline (N=107)
|
11 [−7; 29]
|
6 [−14; 25]
|
6 [−10; 22]
|
|
CST<400 µm op baseline (N=206)
|
−1 [−12; 10]
|
3 [−6; 13]
|
−4 [−15; 6]
|
|
2 jaar follow-up (Wells 2016b) |
|||
|
Overall (N=289) |
1 (-10; 11) |
2 (-8; 11) |
-1 (-11; 10) |
|
Lage BCVA 20/50 or worse (letter score <69) op baseline |
% patiënten met ≥15 letters verbetering in BCVA (verschil; 95%BI) Interventie versus controle A = aflibercept, B = bevacizumab, R = ranibizumab |
||
|
1 jaar follow-up (Wells 2016a) |
|||
|
N=300 |
A versus B
|
A versus R |
R versus B
|
|
CST≥400 µm op baseline (N=172)
|
30 [14; 45] |
20 [3; 37] |
10 [-8; 27] |
|
CST<400 µm op baseline (N=128)
|
20 [−1; 41]
|
13 [−7; 33]
|
7 [−13; 27]
|
|
2 jaar follow-up (Wells 2016b) |
|||
|
Overall (N=277) |
8 [-9 ; 25] |
2 [-11; 15] |
6 [-8 ; 20] |
Tabel 2.3. Subgroepanalyse van het effect van intraoculair anti-VEGF op de visus (zie toelichting bij Tabel 1). Uitkomstmaat: proportie patiënten met klinisch relevante verbetering in BCVA (≥15 letters t.o.v. baseline. Een positief verschil is in het voordeel van de interventie, statistisch significante effectschattingen zijn vetgedrukt.
Bij patiënten met een relatief hoge BCVA op baseline zijn er op basis van gemiddelde verandering in visus op groepsniveau na 1 jaar follow-up (Tabel 1), nauwelijks verschillen in effectiviteit tussen aflibercept, bevacizumab en ranibizumab: de groepsverschillen zijn statistisch niet significant en klinisch niet relevant, en vrijwel onafhankelijk van de centrale retinadikte op baseline. Bij patiënten met een relatief lage BCVA op baseline is er sprake van een klein voordeel voor behandeling met aflibercept in vergelijking met bevacizumab en ranibizumab: de groepsverschillen zijn (overwegend) statistisch significant maar opnieuw niet klinisch relevant, en vrijwel onafhankelijk van de centrale retinadikte op baseline. Ook na 2 jaar follow-up zijn er geen klinisch relevante verschillen in effectiviteit tussen aflibercept, bevacizumab en ranibizumab, en dit geldt voor alle subgroepen. Bij patiënten met een relatief hoge BCVA op baseline en een analyse van responders, patiënten waarbij de visus klinisch relevant verbetert ten opzichte van baseline (Tabel 2), zijn er kleine, statistisch niet significante, verschillen in effectiviteit tussen aflibercept, bevacizumab en ranibizumab. Bij patiënten met een relatief lage BCVA op baseline zijn er aanwijzingen voor een aanzienlijk (klinisch relevant) hoger percentage responders bij behandeling met aflibercept, met name bij patiënten met een relatief hoge centrale retinadikte: 30% en 20% meer responders na behandeling met aflibercept in vergelijking met respectievelijk bevacizumab en ranibizumab. Na 2 jaar follow-up is er echter geen sprake meer van een duidelijk voordeel van aflibercept ten opzichte van bevacizumab of ranibizumab. Samenvattend zijn er aanwijzingen dat aflibercept voordelen biedt in de subgroep patiënten met een relatief lage BCVA op baseline, met name als er ook sprake is van een relatief grote retinadikte, maar na 2 jaar follow-up lijkt er nauwelijks verschil in de effectiviteit van behandeling te bestaan tussen aflibercept, bevacizumab en ranibizumab.
Vergelijking tussen bevacizumab en ranibizumab
De RCT van Vader (2020; Schauwvlieghe 2015) is een non-inferioriteit studie waar een directe vergelijking van bevacizumab en ranibizumab is uitgevoerd om na te gaan of behandeling met bevacizumab niet minder werkzaam is dan behandeling met ranibizumab. Op basis van een verandering van de visus met een non-inferioriteit marge van 3,5 letters blijkt bij 6 maanden follow-up dat non-inferioriteit van bevacizumab aan ranibizumab net niet kan worden vastgesteld (ondergrens tweezijdig 90% BI -3,63 letters). Het bijbehorende groepsverschil is niet statistisch significant en niet klinisch relevant MD=-1,80 letters (95%BI=[-4,17; 0,57]). Voor de uitkomstmaat op basis van een klinisch relevante verandering van de visus met tenminste 15 letters is er sprake van minder behandelsucces in de bevacizumab groep (5.8%) dan in de ranibizumab groep (13.1%), maar het groepsverschil is niet statistisch significant (P = 0,105). In een subgroepanalyse kon eveneens geen non-inferioriteit worden aangetoond tussen bevacizumab en ranibizumab in de subgroep patiënten met een baseline BCVA <69 letters (ondergrens tweezijdig 90%BI= -6,43 letters). Het bijbehorende groepsverschil na 6 maanden follow-up is niet statistisch significant en niet klinisch relevant MD=-3,70 letters (95%BI=[-7,53; 0,13]). In de subgroep met baseline BCVA >70 is wel sprake van non-inferioriteit (ondergrens tweezijdig 90%BI= -2,57). Het bijbehorende groepsverschil is niet statistisch significant en niet klinisch relevant MD=-0.50 (95%BI=[-2,94; 1,94]). Overigens moet wel worden aangetekend dat de subgroepanalyse niet over voldoende power beschikte om non-inferioriteit betrouwbaar aan te tonen.
Vergelijking tussen aflibercept en ranibizumab
De RCT van Fouda (2017) biedt eveneens een directe vergelijking van aflibercept en ranibizumab. Voor de uitkomstmaat verandering in visus (snellen decimaal notatie), bij een jaar follow-up bedraagt het groepsverschil bij vergelijking van aflibercept met ranibizumab: MD = -0,06 (95%BI=[-0,18; 0,06]). Wanneer verbetering of verslechtering wordt gedefinieerd als een 0,1 snellen decimaal verandering van de BCVA score, liet in de aflibercept groep 63% (22/35) van de ogen verbetering zien, 20% (7/35) verslechtering zien, en was er bij 17% (6/35) geen verschil waarneembaar. In de ranizumab groep liet 57,1% (20/35) ogen verbetering zien, 20% (7/35) verslechtering zien, en was er bij 23% (8/35) geen verschil waarneembaar. Samenvattend suggereert de RCT van Fouda (2017) een vergelijkbare effectiviteit van aflibercept en ranibizumab na een jaar behandeling. Dit resultaat komt niet overeen met het resultaat van de netwerk meta-analyse in Virgili (2018) die een grotere effectiviteit laat zien voor aflibercept. Door de geringe studieomvang zou inclusie van Fouda (2017) in de netwerk meta-analyse van Virgili (2018) echter niet tot een ander resultaat van de netwerk meta-analyse leiden.
Vergelijking tussen conbercept en ranibizumab
De systematische review van Sun (2020) biedt een vergelijk van conbercept met ranibizumab na 1, 3 en 6 maanden follow-up. Voor de uitkomstmaat verandering in visus (geconverteerd naar logMAR), blijkt bij 6 maanden follow-up dat conbercept een klinisch relevante verbetering van de visus oplevert in vergelijking met ranibizumab (SMD−0.74; 95%BI=[−1,28; −0,2]). Deze effectschatting is echter geheel gebaseerd op resultaten uit observationeel onderzoek. De enige RCT laat geen verschil zien tussen conbercept en ranibizumab na 1 en 3 maanden follow-up, resultaten bij 6 maanden follow-up worden niet gerapporteerd. Mede door de lage kwaliteit van de SR (zie eerder in de tekst) kan geen betrouwbare conclusie worden getrokken over de effectiviteit van conbercept in vergelijking met ranibizumab.
Vergelijking tussen faricimab en ranibizumab
De RCT van Sahni (2019) biedt een directe vergelijking van 6.0 mg faricimab, 1.5 mg faricimab, en 0.3 mg ranibizumab. Voor de uitkomstmaat verandering in visus (BCVA gecorrigeerd voor baseline; letter score op een schaal van 0-100), bij 24 weken follow-up wordt bij patiënten die niet eerder met anti-VEGF zijn behandeld (n=168) een toename in BCVA waargenomen ten opzichte van baseline met respectievelijk 10,3 letters (95%BI, [7,9; 12,7]), 11,7 letters (95%BI, [9.2; 14.2]) en 13,9 letters (95%BI=[11.2; 16,6]) voor de 0.3 mg ranibizumab, 1.5 mg faricimab, 6.0 mg faricimab groep.
Bij patiënten behandeld met 6.0 mg faricimab is daarmee sprake van een statistisch significant voordeel in vergelijking met ranibizumab (MD= 3,6; 95%BI, [0,08; 7,1]), dit groepsverschil is echter niet klinisch relevant. Het percentage patiënten met een klinisch relevante verandering van de visus (tenminste 15 letters) bedraagt 36,0% en 42,5% in de faricimab groepen (respectievelijk 1,5 mg en 6,0 mg faricimab) en 35,3% in de ranibizumab groep: bij de hoogste dosering faricimab is het groepsverschil (MD= 7,2%; 95%BI=[-10,6; 24,5]) klinisch relevant maar niet statistisch significant.
Retinale dikte – belangrijke uitkomstmaat
Vergelijking tussen aflibercept, bevacizumab, en ranibizumab
Meta-analyse van de gemiddelde verandering in centrale retinadikte (Virgili 2018) laat statistisch significante verschillen zien, waarbij aflibercept zich positief onderscheidt (sterkere afname retinadikte) ten opzichte van bevacizumab (MD=68 µm; 95%BI=[29; 108]) en ranibizumab (MD=39 µm; 95%BI=[2; 76]). Het verschil met bevacizumab is tevens klinisch relevant. Wanneer ranibizumab wordt vergeleken met bevacizumab is er sprake van een statistisch significant voordeel voor ranibizumab maar dit verschil is niet klinisch relevant (MD=29 µm; 95%BI=[1; 58]).
Wells (2016a) vergelijkt aflibercept, bevacizumab en ranibizumab. Bij patiënten met een relatief hoge BCVA en relatief grote centrale retinadikte op baseline is er sprake van een statistisch significant en klinisch relevant voordeel voor behandeling met aflibercept en ranibizumab in vergelijking met bevacizumab (1 jaar follow-up): respectievelijk MD= -112 μm (95%BI=[-157; -68]) en MD= -90 μm (95%BI=[-132; -48]). Het verschil in effectiviteit tussen aflibercept en ranibizumab is daarentegen statistisch niet significant en klinisch niet relevant. Bij patiënten met een relatief hoge BCVA en relatief lage centrale retinadikte worden geen klinisch relevante verschillen in effectiviteit waargenomen tussen aflibercept, ranibizumab en bevacizumab. Een vergelijkbaar beeld ontstaat bij behandeling van patienten met een relatief lage BCVA: alleen bij de patienten met een relatief grote centrale retinadikte op baseline is er sprake van een statistisch significant en klinisch relevant voordeel voor behandeling met aflibercept en ranibizumab in vergelijking met bevacizumab: respectievelijk MD= -123 μm (95%BI=[-155; -91]) en MD= -99 μm (95%BI=[-133; -66]).
Wells (2016b) rapporteert resultaten na een follow-up van 2 jaar. Bij patiënten met een relatief hoge BCVA op baseline (ongeacht centrale retinadikte) is er na 2 jaar follow-up sprake van een statistisch significant en klinisch relevant voordeel van aflibercept ten opzichte van bevacizumab, terwijl behandeling met ranibizumab net geen klinisch relevant voordeel bereikt in vergelijking met bevacizumab: respectievelijk MD= -57 μm (95%BI=[-83; -32]) en MD= -45 μm (95%BI=[-70; -21]). Bij patienten met een relatief lage BCVA op baseline (ongeacht centrale retinadikte) en 2 jaar follow-up is er alleen bij behandeling met aflibercept sprake van een statistisch significant voordeel ten opzichte van bevacizumab, het verschil in effectiviteit is echter niet klinisch relevant: MD= -42 μm (95%BI=[-77; -7]).
|
Hoge BCVA 20/32-20/40 (letter score 78-69) op baseline |
Verandering in centrale retinadikte (MD in µm; 95%BI) Interventie versus controle A = aflibercept, B = bevacizumab, R = ranibizumab |
||
|
1 jaar follow-up (Wells 2016a) |
|||
|
N=313 |
A versus B
|
A versus R |
R versus B
|
|
CST≥400 µm op baseline (N=107)
|
-112 [-157; -68] |
-22 [-63; 19] |
-90 [-132; -48] |
|
CST<400 µm op baseline (N=206)
|
-32 [-61; -3] |
-20 [-51; 11] |
-12 [-43; 19] |
|
2 jaar follow-up (Wells 2016b) |
|||
|
Overall (N=289) |
-57 [-83; -32] |
-12 [-32; 8.8] |
-45 [-70; -21] |
|
Lage BCVA 20/50 or worse (letter score <69) op baseline |
Verandering in centrale retinadikte (MD in µm; 95%BI) Interventie versus controle A = aflibercept, B = bevacizumab, R = ranibizumab |
||
|
1 jaar follow-up (Wells 2016a) |
|||
|
N=300 |
A versus B
|
A versus R |
R versus B
|
|
CST≥400 µm op baseline (N-172)
|
-123 [-155; -91] |
-24 [-57; 10] |
-99 [-133; -66] |
|
CST<400 µm op baseline (N=128)
|
-31 [-70; 8] |
-7 [-45; 30] |
-24 [-61; 14] |
|
2 jaar follow-up (Wells 2016b) |
|||
|
Overall (N=277) |
-42 [-77; -7] |
-19 [-48; 9] |
-23 [-52; 7] |
Tabel 2.4. Subgroepanalyse van het effect van intraoculair anti-VEGF op de centrale retinadikte (CST): vergelijking tussen aflibercept, bevacizumab, en ranibizumab bij patiënten met een relatief hoge BCVA (bovenste panel) en een relatief lage BCVA (onderste panel). Resultaten na 1 jaar (Wells 2016) met onderscheid tussen patiënten met een hoge of lage centrale retinadikte op baseline (CST≥400 µm, CST<400 µm), en na 2 jaar (Wells 2016b). Uitkomstmaat: verandering in centrale retinadikte t.o.v. baseline (µm; 95%BI). Een negatief verschil is in het voordeel van de interventie, statistisch significante effectschattingen zijn vetgedrukt, een groepsverschil van ≥50 µm wordt als klinisch relevant beschouwd.
Vergelijking tussen bevacizumab en ranibizumab
De RCT van Vader (2020; Schauwvlieghe 2015) biedt een vergelijking van bevacizumab en ranibizumab. Bij 6 maanden follow-up wordt een statistisch significant en klinisch relevant verschil waargenomen in het voordeel van ranibizumab: MD= 74 µm (95%BI=[41; 107]). Dit resultaat sluit aan bij de netwerk meta-analyse (Virgili 2018), alhoewel het voordeel van ranibizumab in vergelijking met bevacizumab groter uitvalt dan in de netwerk meta-analyse.
In een post-hoc subgroepanalyse wordt bij patiënten met BCVA ≤69 letters op baseline (gemiddelde centrale retinadikte 60,8-62,1 µm) eveneens een statistisch significant en klinisch relevant verschil waargenomen in het voordeel van ranibizumab: MD=131 µm (95%BI=[74; 188]). In de subgroep patiënten met BCVA ≥70 letters op baseline (gemiddelde centrale retinadikte 64,7-75,0 µm) is er ook sprake van een statistische significant voordeel voor ranibizumab maar het verschil is niet klinisch relevant (MD=26 µm (95%BI=[9; 61]).
Vergelijking tussen aflibercept en ranibizumab
Fouda (2017) biedt een directe vergelijking van aflibercept en ranibizumab. Bij een jaar follow-up wordt een statistisch niet significant en klinisch niet relevant verschil waargenomen in het voordeel van aflibercept: MD=26,5 μm (95%BI=[-14,1; 67,1]). Dit resultaat sluit aan bij de resultaten van de netwerk meta-analyse (Virgili 2018).
Vergelijking tussen conbercept en ranibizumab
De systematische review van Sun (2020) biedt een vergelijk van conbercept met ranibizumab na 1, 3 en 6 maanden follow-up. Voor de uitkomstmaat verandering in centrale retinadikte, blijkt bij 6 maanden follow-up dat conbercept een klinisch relevante verbetering (afname) in centrale retinadikte oplevert in vergelijking met ranibizumab (SMD = −1,27; 95% BI[−2,33; −0,21]). Deze effectschatting is echter geheel gebaseerd op resultaten uit observationeel onderzoek. De enige RCT laat slechts een gering (klinisch niet relevant) en statistisch niet significant verschil zien tussen conbercept en ranibizumab na 1 en 3 maanden follow-up, resultaten bij 6 maanden follow-up worden niet gerapporteerd. Mede door de lage kwaliteit van de SR (zie eerder in de tekst) kan geen betrouwbare conclusie worden getrokken over de effectiviteit van conbercept in vergelijking met ranibizumab.
Vergelijking tussen faricimab en ranibizumab
Sahni 2019 biedt een directe vergelijking van 1,5 mg faricimab, 6,0 mg faricimab, en 0,3 mg ranibizumab. Bij patiënten die niet eerder met anti-VEGF zijn behandeld (n=168) wordt na 24 weken een afname van de centrale retinadikte waargenomen ten opzichte van baseline van respectievelijk: MD=-205 µm (95%BI=[-228; -181]), MD=-217 µm (95%BI=[-242; -192]), en MD=-226 µm (95%BI=[-252; -200]). De verschillen in effectiviteit zijn daarmee gering, statistisch niet significant en klinisch niet relevant.
Ernstige bijwerkingen en complicaties – belangrijke uitkomstmaat
zie Bijwerkingen en complicaties (alle vergelijkingen).
Overige uitkomstmaten – belangrijke uitkomstmaten
Virgili (2014, 2018) rapporteert geen uitkomsten met betrekking tot belasting voor de patiënt, en kosten (inclusief tijdsinvestering behandelaar) of kosteneffectiviteit. Het aantal intravitreale injecties varieert nauwelijks tussen de anti-VEGF middelen (mediaan tussen 9 en 10). Wel is vaker sprake van een indicatie voor (aanvullende) laserbehandeling bij gebruik van bevacizumab of ranibizumab in vergelijking tot aflibercept (DRCRN 2015): het percentage patiënten dat een aanvullende laserbehandeling ondergaat bedraagt respectievelijk 56%, 46%, en 37% (DRCRN 2015).
Nog grotere verschillen worden waargenomen als de analyse wordt beperkt tot de patiënten met lagere visus (BCVA<69): aanvullende laserbehandeling bij respectievelijk 65% (bevacizumab), 50% (ranibizumab), en 37% (aflibercept) van de patiënten.
Anti-VEGF versus corticosteroïden
Voor de vergelijking van anti-VEGF versus corticosteroïden is de systematische literatuuranalyse gebaseerd op Ford (2013), en de aanvullende studie (Gillies 2014). De systematische review van Ford (2013) is van goede kwaliteit (zie Table of quality assessment). Ford (2013) vergelijkt anti-VEGF middelen met corticosteroïd-, laser- of controlebehandeling. Ford (2013) dekt de literatuur tot juli 2012 en includeert zowel RCT’s als observationeel onderzoek (voor de evaluatie van bijwerkingen en complicaties). Studies met een follow-up van minder dan zes maanden, minder dan 25 ogen per interventie, of studies waarin sprake was van een eenmalige injectie met anti-VEGF of corticosteroïden werden uitgesloten.
Ford (2013) includeert 3 RCT’s voor de vergelijking van anti-VEGF met corticosteroïden (Oliveira Neto 2011; DRCRN 2010, 2011; Lim 2012). Vanwege te grote klinische heterogeniteit (verschillen in studiepopulatie, interventies, en uitkomstmaten) is een meta-analyse van de resultaten niet mogelijk, en worden de resultaten van de individuele studies hieronder besproken. De RCT van Oliveira Neto (2011) wordt in deze analyse niet meegenomen omdat alleen een samenvatting beschikbaar is en door het ontbreken van een officiële publicatie de kwaliteit van de resultaten niet kan worden beoordeeld. Op basis van de inclusiecriteria van Ford (2013) werd voor de vergelijking van anti-VEGF met corticosteroïden in een aanvullende zoekactie de RCT van Gillies (2014) geïdentificeerd. De literatuuranalyse is derhalve gebaseerd op drie RCT’s (DRCRN 2010, 2011; Lim 2012; Gillies 2014). De belangrijkste studiekarakteristieken, resultaten, en beoordeling van de individuele studieopzet zijn opgenomen in de evidencetabellen.
De studiegrootte varieert tussen 61 en 691 deelnemers. Patiënten in de geïncludeerde studies hadden de klinische diagnose DME, bevestigd met OCT. Er is variatie in de inclusiecriteria die worden gehanteerd in de RCT’s. In DRCRN (2010, 2011) worden patiënten die in de laatste vier maanden zijn gelaserd uitgesloten, en ook patiënten zonder eerdere laserbehandeling geïncludeerd. Gillies (2014) beperkt zich juist tot patiënten die niet reageren op een laserbehandeling, terwijl Lim (2012) alle patiënten uitsluit die eerder zijn behandeld voor DME. Er is eveneens variatie in de gebruikte medicatie en dosering. De RCT’s vergelijken ranibizumab met triamcinolone (DRCRN 2010, 2011; in combinatie met laser binnen 3-10 dagen), bevacizumab met triamcinolon (Lim 2012), of bevacizumab met dexamethason (Gillies 2014). In Lim (2012) is het aantal injecties beduidend lager dan in DRCRN (2010, 2011) en Gillies (2014). De kwaliteit van de studies is overwegend hoog (zie beoordeling van de individuele studieopzet in de evidencetabellen). Lim (2012) is een Zuid-Koreaanse studie, DRCRN (2010, 2011) en Gillies (2014) zijn respectievelijk uitgevoerd in de Verenigde Staten en Australië. DRCRN (2010, 2011) en Gillies (2014) zijn gesponsord door de fabrikant van anti-VEGF of corticosteroïd implantaat.
Visus (BCVA) – cruciale uitkomstmaat
De DRCRN (2010, 2011) kent vier armen (totaal aantal deelnemers 691; 854 ogen): ranibizumab (0,5 mg) in combinatie met prompte laserbehandeling (binnen 3-10 dagen na ranibizumab; RPL), ranibizumab in combinatie met uitgestelde (‘deferred’) laserbehandeling (≥24 weken; RDL), triamcinolon (4 mg) in combinatie met prompte laserbehandeling (TPL), en placebo in combinatie met prompte laserbehandeling (controlegroep; CPL). In alle gevallen beperkt de statistische analyse zich tot een vergelijking met de controlegroep met alleen laserbehandeling.
Bij een jaar follow-up (DRCRN 2010) is er in beide ranibizumab groepen (RPL en RDL; 8-9 injecties) sprake van een statistisch significant grotere verbetering van de visus (BCVA) dan in de controlegroep (CPL), terwijl er maar een klein en statistisch niet significant verschil bestaat tussen de triamcinolon (3 injecties) en controlegroep: gemiddeld groepsverschil (letters), MD=5,8 (95% BI=[3,2;8,5]) en 6,0 (95% BI=[3,4;8,6]) voor RPL en RDL, versus MD= 1,1 (95% BI=[-1,5;3,7]) voor TPL. In de ranibizumab groepen is er bij 28-30% van de behandelde ogen sprake van een verbetering in visus met tenminste 15 letters tegen 21% in de triamcinolon groep, en 15% in de controlegroep: MD=16% (95% BI=[6;26]) en 13% (95% BI=[4;22]) voor RPL en RDL, versus MD= 6% (95% BI=[-2;15]; statistisch niet significant) voor TPL. Ook worden in de ranibizumab groepen minder mensen geconfronteerd met een afname in visus met tenminste 15 letters: MD= -6% (95% BI=[-11;-2]) en -6% (95% BI=[-10;-1]) voor RPL en RDL, versus MD= 0% (95% BI=[-6;6]; statistisch niet significant) voor TPL. Deze resultaten laten een grotere effectiviteit zien van ranibizumab (in combinatie met prompte of uitgestelde laserbehandeling) dan van triamcinolon (in combinatie met prompte laserbehandeling). De effectiviteit van triamcinolon in combinatie met prompte laserbehandeling verschilt niet significant van behandeling met alleen laser.
Uit een vooraf gedefinieerde subgroep analyse blijkt dat er aanzienlijk verschil bestaat in effectiviteit van de behandeling tussen pseudofake en fake ogen (respectievelijk N=273 en 581 ogen). Bij ogen met eigen lens, is er sprake van een verbetering in visus met tenminste 10 letters bij 54% (RPL), 54% (RDL), 26% (TPL), en 27% (controle; CPL). Bij pseudofake ogen bedragen deze percentages, 43% (RPL), 30% (RDL), 47% (TPL), en 30% (CPL). Een vergelijkbaar beeld ontstaat bij analyse op basis van verslechtering van de visus met tenminste 10 letters: 2% (RPL), 3% (RDL), 20% (TPL), en 15% (CPL) bij fake ogen, en 5% (RPL), 4% (RDL), 3% (TPL), en 10% bij pseudofake ogen. Resultaten gebaseerd op een verbetering of verslechtering met tenminste 15 letters worden niet gerapporteerd. Deze resultaten suggereren een vergelijkbaar effect op de visus (BCVA) van ranibizumab en triamcinolon bij pseudofake ogen. Bij ogen met eigen lens lijkt de effectiviteit van triamcinolon in combinatie met prompte laserbehandeling lager dan die van ranibizumab in combinatie met laser, en vergelijkbaar met de effectiviteit van behandeling met alleen laser, waarschijnlijk ten gevolge van cataractontwikkeling. Hierbij moet wel worden aangetekend dat de studiegrootte (sample size) is afgestemd op de continue uitkomstmaat (BCVA) en zonder rekening te houden met de subgroep analyse.
Bij twee jaar follow-up (DRCRN 2011) zijn de resultaten in grote lijnen vergelijkbaar al wordt in veel gevallen geen statistische significantie meer bereikt. Er wordt een grotere verbetering van de visus (BCVA) waargenomen in de ranibizumab groepen (RPL en RDL) dan in de controlegroep (CPL), en een klein en statistisch niet significant verschil tussen de triamcinolon en controlegroep: gemiddeld groepsverschil (letters), MD=3,8 (95% BI=[-0,4;7,7]) en 5,8 (95% BI=[1,9;9,8]) voor RPL en RDL, versus MD= -1,5 (95% BI=[-5,5;2,4]) voor TPL. Als de analyse wordt beperkt tot de pseudofake ogen bedragen de gemiddelde groepsverschillen: MD= 0.5 (95%BI=[-5,5;6,6]) en 3,5 ([-2,3;9,3]) voor RPL en RDL, versus MD=1,6 ([-4,5;7,6]) voor TPL (alle groepsverschillen zijn statistisch niet significant).
Lim (2012) randomiseert naar drie behandelarmen (totaal aantal deelnemers 105; 111 ogen): bevacizumab (1,25 mg) in combinatie met triamcinolon (2 mg), alleen bevacizumab (tweemaal 1,25 mg), of alleen triamcinolon (2 mg). Bij een jaar follow-up worden geen statistisch significante verschillen waargenomen in visus tussen de behandelgroepen (BCVA; logMAR schaal): respectievelijk BCVA=0,49 (standaard deviatie, SD=0,32), 0,46 (SD=0,28), en 0,49 (SD=0,19). Resultaten gebaseerd op een verbetering of verslechtering in visus met 15 of meer letters worden niet gerapporteerd. Hierbij moet wel worden aangetekend dat Lim (2012) een geringe studieomvang heeft (36-38 ogen per behandelarm), uitsluitend patiënten includeert die niet eerder voor DME zijn behandeld, en de injectiefrequentie ongebruikelijk laag is (gemiddelde injectiefrequentie van 3,5 en 2,0 voor respectievelijk bevacizumab en triamcinolon).
Gillies (2014) randomiseert naar twee behandelarmen (totaal aantal deelnemers 61; 88 ogen): bevacizumab (1,25 mg) of een slow-release dexamethason implantaat (0,7 mg; Ozurdex, Allergan Inc, CA). Bij een jaar follow-up bedraagt het gemiddelde aantal injecties 8,6 (bevacizumab) en 2,7 (dexamethason). Er wordt geen statistisch significant verschil waargenomen in verbetering van de visus ten opzichte van baseline tussen de behandelgroepen (BCVA; ETDRS letters): respectievelijk MD= 8,9 (95%BI=[6,27;11,6]) en 5,6 (95%BI=[0,90;10,3]; p=0,24 voor vergelijking van de groepen).
In 31% van de behandelde ogen in de bevacizumab groep en 22% in de dexamethason groep verbetert de visus met tenminste 15 letters (p=0,46). Bij geen van de ogen behandeld met bevacizumab en vier van de ogen (9%) behandeld met dexamethason is sprake van een verslechtering van de visus met 15 of meer letters, bij drie patiënten als gevolg van een toename in de densiteit van cataract.
Retinale dikte – belangrijke uitkomstmaat
In DRCRN (2010) bedraagt het verschil in afname in centrale retinadikte in vergelijking tot de controlegroep met alleen laserbehandeling bij een jaar follow-up: MD= -55 µm (95%BI=[-78;-32]) en -49 µm (95%BI= [-72;-26]]) in de ranibizumab groepen RPL en RDL, en MD= -52 µm (95%BI=[-75;-29]) in de triamcinolon groep (TPL). Als behandelsucces wordt gedefinieerd het bereiken van een centrale retinadikte lager dan 250 µm, is het behandelsucces afhankelijk van de behandeling, 53% en 42% in de ranibizumab groepen, 47% in de triamcinolon groep, en 27% in de controlegroep (CPL): relatief risico ten opzichte van de controlegroep, RR= 2,00 [1,52;2,64] en 1,55 [1,13;2,13] in de ranibizumab groepen en RR= 1,76 [1,31;2,36] in de triamcinolon groep. Deze resultaten laten een vergelijkbare effectiviteit zien van ranibizumab (in combinatie met prompte of uitgestelde laserbehandeling) en triamcinolon (in combinatie met prompte laserbehandeling), en een significant lagere effectiviteit van alleen laserbehandeling. Bij twee jaar follow-up (DRCRN 2011) worden kleinere verschillen in effectiviteit waargenomen tussen de behandelgroepen, en is het verschil in effectiviteit tussen triamcinolon- en controlegroep statistisch niet significant: relatief risico op het bereiken van een centrale retinadikte lager dan 250 µm, ten opzichte van de controlegroep, RR= 1,34 (95%BI=[1,03;1,76]) en 1,35 (95%BI=[1,03;1,78]) in de ranibizumab groepen en RR= 1,16 (95%BI=[0,88;1,52]) in de triamcinolon groep
Lim (2012) vergelijkt bevacizumab met triamcinolon en vindt bij een jaar follow-up geen statistisch significant verschil in centrale retinadikte: respectievelijk 268 µm (SD=74) en 249 µm (SD=78). Gillies (2014) vergelijkt bevacizumab met dexamethason en vindt bij een jaar follow-up wel een statistisch significant grotere afname in centrale retinadikte na dexamethasonbehandeling: respectievelijk MD= -122 µm en -187 µm (p=0,015 voor vergelijking van de groepen).
Ernstige bijwerkingen en complicaties – cruciale uitkomstmaat
zie Bijwerkingen en complicaties (alle vergelijkingen).
Overige uitkomstmaten – belangrijke uitkomstmaten
Ford (2013) en Gillies (2014) rapporteren geen uitkomsten met betrekking tot belasting voor de patiënt, en kosten (inclusief tijdsinvestering behandelaar) of kosteneffectiviteit. Wel geven de studies inzicht in een aantal bepalende factoren: verschillen in effectiviteit tussen de behandelmodaliteiten, de hogere frequentie van intravitreale injecties (en ziekenhuisbezoek) bij gebruik van anti-VEGF middelen in vergelijking tot corticosteroïden, en de hogere incidentie van verhoogde oogdruk en cataract (en daaruit voortvloeiende behandeling) bij gebruik van corticosteroïden.
Bijwerkingen en complicaties (alle vergelijkingen)
Voor bijwerkingen en complicaties is de systematische literatuuranalyse gebaseerd op de systematische reviews van Virgili (2014) en Ford (2013), en de aanvullende studies (DRCRN (2015; Gillies 2014). Voor een overzicht van de bijwerkingen zoals deze worden vermeld in de officiële productinformatie (SmPC) van de diverse geneesmiddelen, verwijzen wij u naar de website van het College ter Beoordeling van Geneesmiddelen (www.cbg-meb.nl) en voor meldingen van mogelijke bijwerkingen naar de website van Bijwerkingencentrum Lareb (www.lareb.nl).
Update (september 2020): Voor een update van deze richtlijnmodule is voor bijwerkingen en complicaties de systematische literatuuranalyse mede gebaseerd op de systematische reviews van Virgili (2018), Sun (2020), Reibaldi (2020), en Thulliez (2018), en aanvullende studies (Wells 2016a, 2016b; Fouda 2017 Vader 2020; Sahni 2019).
Anti-VEGF
Ernstige oculaire complicaties zoals endophthalmitis komen nauwelijks voor in de geïncludeerde RCT’s. Als alle anti-VEGF middelen gezamenlijk worden vergeleken met laser- of controlebehandeling (Fig. 5-7; Virgili 2014), blijkt er geen statistisch significant verschil in de incidentie van ernstige systemische adverse events (RR=0,98; 95%BI=[0,83; 1,17]; 15 studies, 441 events in 2985 deelnemers), arterieel trombo-embolische events (RR=0,89; 95%BI=[0,63; 1,25]; 14 studies, 129 events in 3034 deelnemers), of totale mortaliteit (RR=0,88; 95%BI=[0,52; 1,47]; 63 events in 3562 deelnemers). Hierbij moet wel worden opgemerkt dat er niet altijd sprake is van volledige rapportage van veiligheidsdata, en in enkele studies patiënten met een cardiovasculaire voorgeschiedenis zijn uitgesloten. Met betrekking tot eventuele verschillen in de veiligheid (ernstige bijwerkingen en complicaties) tussen de anti-VEGF middelen laat Virgili (2014) geen conclusies toe, aangezien het hier indirecte vergelijkingen betreft en bovendien met een lage statistische power om verschillen in veiligheid tussen anti-VEGF middelen te kunnen detecteren. In de recente RCT van de DRCRN (2015) worden de effectiviteit en veiligheid van aflibercept, bevacizumab en ranibizumab wel rechtstreeks vergeleken (218-224 patiënten per studiearm), en geen statistisch significante verschillen in oculaire of systemische adverse events worden geconstateerd (primaire analyse). In een post-hoc analyse naar de frequentie van cardiale en vasculaire adverse events (gecombineerde MedDRA systeem orgaanklassen voor cardiale en vasculaire aandoeningen) is er wel sprake van een statistisch significant hogere frequentie van adverse events in de ranibizumab groep (17% van de patiënten met tenminste één event bij een jaar follow-up; cardiovasculaire events m.u.v. hypertensie) ten opzichte van de overige armen (9% bij zowel aflibercept als bevacizumab; p-waarde 0,01). Hierbij moet wel worden aangetekend dat de studiegrootte (statistische power) is afgestemd op de primaire uitkomstmaat (BCVA) en onvoldoende is voor een betrouwbare analyse van eventuele verschillen in veiligheid tussen de anti-VEGF middelen.
Figuur 2.5. Forest plot van de vergelijking tussen anti-VEGF en laser: relatief risico op ernstige systemische adverse events bij een tot twee jaar follow-up. Random effects model. Cochrane Risk of bias beoordeling (Virgili 2014).
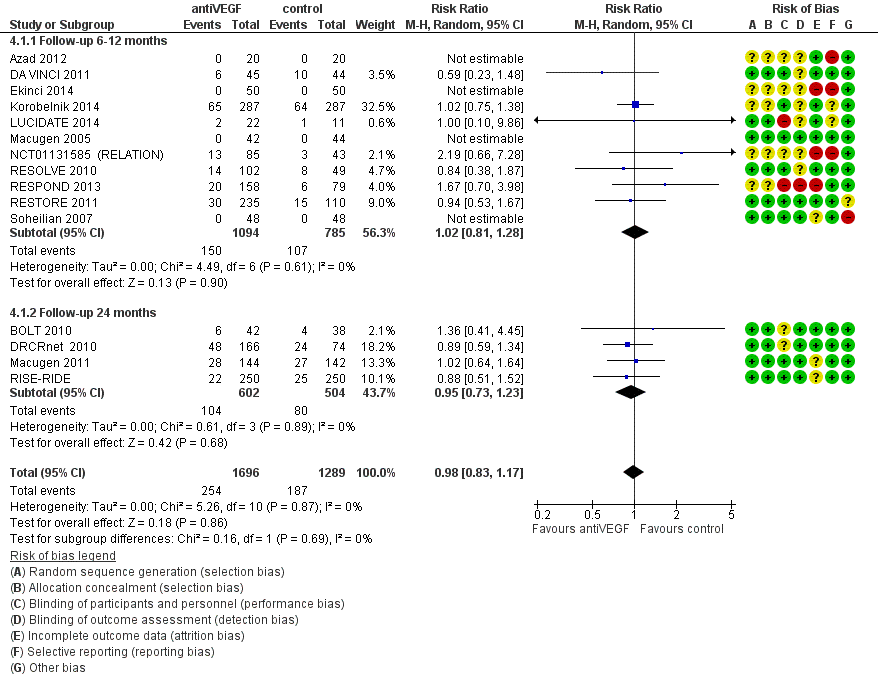
Figuur 2.6. Forest plot van de vergelijking tussen anti-VEGF en laser: relatief risico op trombo-embolische events bij een tot twee jaar follow-up. Random effects model. Cochrane Risk of bias beoordeling (Virgili 2014).

Figuur 2.7. Forest plot van de vergelijking tussen anti-VEGF en laser: relatief risico op mortaliteit. Random effects model (Virgili 2014).
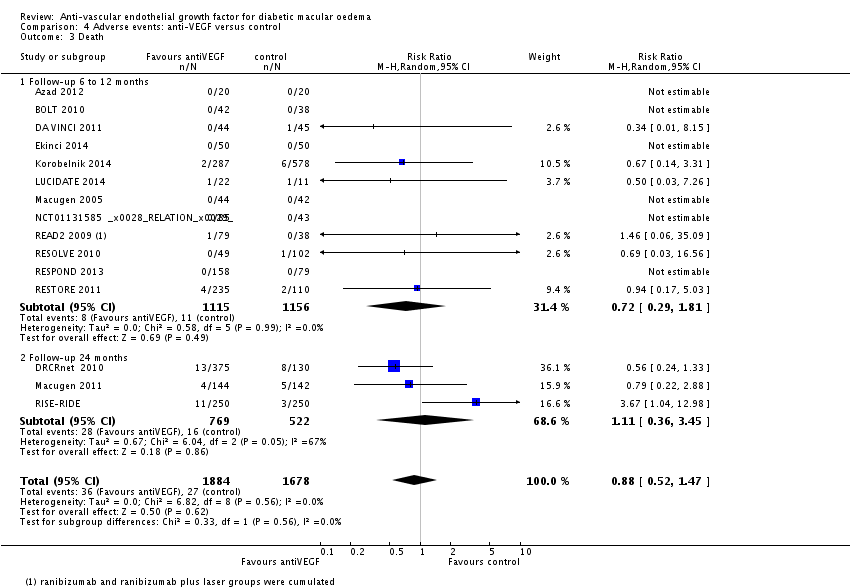
Deze update bevestigt eerdere bevindingen. Ernstige oculaire complicaties zoals endophthalmitis komen nauwelijks voor in de geïncludeerde RCT’s. Virgili (2018) vergelijkt aflibercept, bevacizumab en ranibizumab met een controlebehandeling (lasercoagulatie), en hieruit blijken geen statistisch significante verschillen in de incidentie van ernstige systemische adverse events (respectievelijk: RR=0,98; 95%BI=[0,83; 1,16], RR=0,93; 95%BI=[0,73; 1,19], en RR=0,97; 95%BI=[0,80; 1,17]), arterieel trombo-embolische events (respectievelijk: RR=0,88; 95%BI=[0,37; 2,13], RR=0,94; 95%BI=[0,33; 2,66], en RR=1,09; 95%BI=[0,52; 2,29]), of totale mortaliteit (respectievelijk: RR=1,01; 95%BI=[0,34; 3,03], RR=1,61; 95%BI=[0,45; 5,69], en RR=0,90; 95%BI=[0,40; 2,01]). Virgili (2018) vergelijkt ook ranibizumab met aflibercept, en ranibizumab met bevacizumab, en hieruit blijkt eveneens dat er geen statistisch significante verschillen kunnen worden waargenomen in de incidentie van ernstige systemische adverse events (respectievelijk: RR=0,98; 95%BI=[0,82; 1,19], RR=1,04; 95%BI=[0,84; 1,28]), arterieel trombo-embolische events (respectievelijk: RR=1,24; 95%BI=[0,48; 3,19], RR=1,17; 95%BI=[0,43; 3,13]), of totale mortaliteit (respectievelijk: RR=1,16; 95%BI=[0,38; 3,58], RR=0,73; 95%BI=[0,22; 2,37]). Hierbij moet wel vermeld worden dat het hier grotendeels indirecte vergelijkingen betreft en bovendien met een lage statistische power om verschillen in veiligheid tussen anti-VEGF middelen te kunnen detecteren.
Thulliez (2018) vergelijk 21 systematische reviews gepubliceerd tussen januari 2011 en juni 2016, die een totaal van 57 RCTs includeerden. Van deze systematische reviews rapporteerde 11 reviews adverse events als primaire uitkomst. Op basis van alle geïncludeerde studies wordt geconcludeerd dat behandeling met aflibercept, ranibizumab en bevacizumab niet leidt tot een verhoogd risico op systemische adverse events.
Sun (2020) vergelijkt conbercept met ranibizumab, en vindt geen statistisch significant verschil in het risico op verhoogde intra-oculaire oogdruk (OR=1.71; 95%BI=[0,55; 5,25]) en conjunctivale bloeding (OR=0.89; 95%BI=[0,34; 2,34]). Sahni 2019 vergelijkt faricimab met ranibizumab en aan het einde van de studieperiode (36 weken) zijn er geen nieuwe of onverwachte oculaire of systemische events waargenomen. Van alle deelnemers in deze studie ervaarden 1.8% (4/224) glasvlochtbloeding en 1.8% (4/224) een arterieel trombo-embolisch event.
Reibaldi (2020) heeft een meta-analyse uitgevoerd naar de relatie tussen sterftecijfer en anti-VEGF behandeling bij patiënten met diabetisch macula-oedeem, leeftijd gerelateerde maculadegeneratie of retinale vaatocclusie (34 studies; 8887 patiënten). Hierbij werden geen statistisch significant verschillen waargenomen tussen de anti-VEGF groep en controle groep. Hierbij moet wel worden vermeld dat er sprake is van lage statistische power en dat een eventueel verhoogd sterfterisico bij intravitreale anti-VEGF behandeling, met name bij een groot aantal injecties, niet volledig kan worden uitgesloten. Samenvattend, zijn er bij behandeling met anti-VEGF middelen geen aanwijzingen voor een verhoogd risico op ernstige oculaire complicaties, ernstige systemische adverse events, arterieel trombo-embolische events, of totale mortaliteit. Daarnaast lijken er geen klinisch relevante verschillen in veiligheid te bestaan tussen individuele anti-VEGF middelen. Vanwege de lage statistische power kan echter een klinisch relevant verschil in veiligheid tussen anti-VEGF middelen ook niet formeel worden uitgesloten.
Corticosteroïden
Ford (2013) includeert twee studies naar dexamethason en rapporteert hogere incidenties van ontstekingen in de voorste oogkamer (21-27% in vergelijking met 9% in de controlegroep zonder behandeling), van glasvochtbloedingen (20-23% versus 5% in controlegroep zonder behandeling), en van verhoogde oogdruk (9-20% versus 0-2% in controlegroep zonder behandeling of behandeling met alleen laser). Gillies (2014) vergelijkt dexamethason met bevacizumab en constateert hogere incidenties van verhoogde oogdruk (toename met 5 mmHg: 46% versus 19%), van cataract progressie (toename met twee 'Age-Related Eye Disease Study grades': 13% versus 5%), en van cataractoperaties (6,5% versus 2,4%). Ford (2013) includeert tien studies naar gebruik van triamcinolon, en constateert een duidelijk toename in de incidentie van verhoogde oogdruk (68% versus 10% in placebo) en cataractoperaties (56% versus 8% in placebo, bij drie jaar follow-up). In DRCRN (2010, 2011) is de incidentie van cataractoperaties ook substantieel verhoogd in de triamcinolon-groep ten opzichte van de ranibizumab-groep en controlegroep (respectievelijk 59% versus 14% en 14%; p<0.001 voor beide vergelijkingen; twee jaar follow-up). Een vergelijkbaar beeld ontstaat voor het optreden van een verhoogde oogdruk (toename met 10 mmHg of meer, of gebruik van oogdrukverlagende medicatie: 50% in de triamcinolon-groep versus 9% en 11% in de ranibizumab en controlegroep; p<0,001 voor beide vergelijkingen; twee jaar follow-up). Systemische bijwerkingen (adverse events) zijn zeldzaam. Bij de interpretatie van deze resultaten moet rekening worden gehouden met de relatief geringe studieomvang en studieduur, die geen eenduidige uitspraak toelaten over zeldzame bijwerkingen of complicaties, of bijwerkingen en complicaties die relatief laat of na langdurige behandeling optreden.
Laser
Er zijn geen aanwijzingen dat het risico op oculaire of systemische adverse events verhoogd is na laserbehandeling (zie bovenstaande vergelijkingen met anti-VEGF en corticosteroïd behandeling en Fig. 5-7).
Bewijskracht van de literatuur
In alle gevallen is de bewijskracht gebaseerd op gerandomiseerd onderzoek en is het uitgangspunt bij het bepalen van de bewijskracht hoog. Voor de vergelijking tussen anti-VEGF en laser is de bewijskracht voor de uitkomstmaten visus (BCVA) en centrale retinadikte hoog, de effecten zijn groot en robuust en de heterogeniteit is laag. Voor de vergelijking tussen anti-VEGF middelen onderling is de bewijskracht voor de uitkomstmaat visus (BCVA) redelijk, de bewijskracht is met een niveau verlaagd vanwege imprecisie (effectschatting overlapt met grens voor klinische relevantie). Voor conclusies gebaseerd op subgroepanalyses is de bewijskracht voor alle uitkomstmaten laag, er is met twee niveau’s verlaagd vanwege risk of bias (post-hoc subgroepanalyse) en imprecisie (enkele studie; onvoldoende statistische power). Voor de vergelijking tussen anti-VEGF middelen onderling is de bewijskracht voor de uitkomstmaat centrale retinadikte: redelijk (vergelijking tussen aflibercept en bevacizumab; een niveau verlaagd vanwege imprecisie) of laag (vergelijking tussen aflibercept en ranibizumab; twee niveau’s verlaagd vanwege risk of bias, indirectheid en imprecisie). Voor de vergelijking tussen conbercept en ranibizumab is de bewijskracht voor alle uitkomstmaten zeer laag vanwege ernstige risk of bias, indirectheid en imprecisie. Voor de vergelijking farcimab en ranibizumab is de bewijskracht voor de uitkomstmaten visus en centrale retinadikte laag, de bewijskracht is met twee niveaus verlaagt vanwege indirectheid en ernstige imprecisie. Voor de vergelijking tussen anti-VEGF met corticosteroïden, ranibizumab versus triamcinolon, is de bewijskracht voor de uitkomstmaten visus en centrale retinadikte redelijk, er is met een niveau verlaagd vanwege indirectheid en imprecisie (slechts een RCT). Voor de subgroepen (pseudofakie, fakie) is de bewijskracht laag, er is met een tweede niveau verlaagd vanwege imprecisie (onvoldoende statistische power). Voor de vergelijking tussen bevacizumab en triamcinolon is de bewijskracht zeer laag, vanwege ernstige imprecisie (slechts een RCT van geringe omvang; effect overlapt de grens voor klinische relevantie) en indirectheid (ongebruikelijk lage injectiefrequentie). Voor de vergelijking tussen bevacizumab en dexamethason is de bewijskracht laag, er is twee niveau’s verlaagd vanwege ernstige imprecisie (slechts een RCT; onvoldoende statische power). Voor vergelijking van bijwerkingen en complicaties tussen anti-VEGF en controle- of laserbehandeling is de bewijskracht redelijk, er is een niveau verlaagd vanwege indirectheid (langetermijneffecten onvoldoende onderzocht; exclusie van patiënten met hoog cardiovasculair risico). Voor de vergelijking van bijwerkingen en complicaties tussen anti-VEGFmiddelen onderling is de bewijskracht laag, er is met een tweede niveau verlaagd vanwege imprecisie (een enkele RCT met directe vergelijking). Voor de vergelijking van bijwerkingen en complicaties tussen laserbehandeling en controle- of alternatieve behandeling is de bewijskracht redelijk, er is een niveau verlaagd vanwege indirectheid (langetermijneffecten onvoldoende onderzocht; exclusie van patiënten met hoog cardiovasculair risico). Voor de vergelijking van bijwerkingen en complicaties (oculaire adverse events) tussen corticosteroïdbehandeling en controlebehandeling, anti-VEGF of laserbehandeling is de bewijskracht redelijk, er is een niveau verlaagd vanwege indirectheid (langetermijneffecten onvoldoende onderzocht; exclusie van patiënten met hoog cardiovasculair risico). Voor systemische adverse events is de bewijskracht laag, er is een tweede niveau verlaagd vanwege imprecisie (lage statistische power).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: wat zijn de gunstige en ongunstige effecten van de relevante behandelopties (anti-VEGF, laser, corticosteroïden, vitrectomie) bij behandeling van (klinisch significant) macula oedeem bij volwassen personen met diabetes? De klinisch relevante vergelijkingen zijn die van anti-VEGF versus laser, anti-VEGF middelen onderling, en anti-VEGF versus corticosteroïden.
De 2022-update richt zich primair op behandeling met anti-VEGF middelen, en de onderlinge vergelijking tussen anti-VEGF middelen. In deze update is geen verdere search gedaan naar de behandeling met corticosteroiden of laser bij diabetisch macula oedeem.
Relevante uitkomstmaten
De werkgroep achtte verschil in best-gecorrigeerde visus (best corrected visual acuity, BCVA), een cruciale uitkomstmaat; verandering in centrale retinale dikte op de OCT (Optical Coherence Tomography) en ernstige bijwerkingen of complicaties (systemische bijwerkingen zoals cardiovasculaire events, trombo-embolische processen en/of totale mortaliteit en oculaire bijwerkingen zoals endophthalmitis, glasvochtbloeding, ablatio retinae, hoge oogdruk, cataract), zijn belangrijke uitkomstmaten (maar niet cruciaal voor de besluitvorming). Milde bijwerkingen, belasting voor de patiënt, en kosten (inclusief tijdsinvestering behandelaar), worden gezien als overige uitkomstmaten.
De werkgroep definieerde een verandering (verbetering of verslechtering) van de visus (BCVA) met tenminste 15 letters (3 lijnen; 0,3 logMAR; dichotome uitkomstmaat) als een klinisch (patiënt) relevant verschil. Voor de uitkomstmaat centrale retinale dikte werd een verandering van tenminste 50 µm, of het bereiken van een retinadikte lager dan 250 µm als klinisch relevant beschouwd.
In responder analyses werd een number-needed-to-treat (NNT) van kleiner of gelijk aan 20 aangehouden als klinisch relevant. Voor ernstige bijwerkingen en complicaties werd niet bij voorbaat een klinisch relevant verschil vastgesteld.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase en de Cochrane Library is met relevante zoektermen gezocht naar systematische reviews, richtlijnen en RCT’s die behandelopties voor diabetisch macula oedeem vergelijken. In eerste instantie is gezocht vanaf 2006 en de zoekactie beperkt tot systematische reviews in Medline en Embase. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Deze initiële literatuurzoekactie leverde 62 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review, vergelijking van relevante behandelopties (anti-VEGF, laser, corticosteroïden) voor diabetisch macula oedeem, bij volwassenen met diabetes mellitus type 1 of 2, met door de werkgroep als relevant benoemde uitkomstmaten (zie eerder in de tekst). Op basis van titel en abstract werden 28 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 26 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 2 studies definitief geselecteerd (Virgili 2014; Ford 2013).
De systematische review van Virgili (2014) vergelijkt anti-VEGF middelen met laser- of controlebehandeling en dekt de literatuur tot april 2014. De systematische review van Ford (2013) vergelijkt ook anti-VEGF middelen met corticosteroïden, en corticosteroïden met laser- of controlebehandeling, en bestrijkt de literatuur tot juli 2012. In aanvullende zoekacties is vervolgens gezocht naar recentere studies die voldoen aan de inclusiecriteria van genoemde systematische reviews (zie zoekverantwoording) en een relevante klinische vergelijking betreffen. Deze zoekacties leverden respectievelijk 154 en 131 treffers op voor de update van Virgili (2014) en Ford (2013), 43 en 35 studies werden voorgeselecteerd, en 43 en 34 studies geëxcludeerd na raadpleging van de volledige tekst (zie exclusietabel). De RCT van Gillies (2014) werd als aanvullende studie voor Ford (2013) geïdentificeerd. Aan de update van Virgili werd een zeer recente RCT verschenen net na de zoekdatum toegevoegd (DRCRN 2015).
Vier onderzoeken (twee SR’s, twee RCT’s) zijn opgenomen in de literatuuranalyse. Voor de belangrijkste studiekarakteristieken en resultaten van de systematische (Cochrane) review van Virgili (2014) en beoordeling van de individuele studieopzet (risk of bias) van de geïncludeerde studies wordt verwezen naar de bewuste publicatie.
De belangrijkste studiekarakteristieken, resultaten, en beoordeling van de individuele studieopzet van de relevante geïncludeerde studies in Ford (2013), en de aanvullende studies (DRCRN 2015; Gillies 2014) zijn opgenomen in de evidence tabellen.
De update richt zich primair op behandeling met anti-VEGF middelen, en de onderlinge vergelijking tussen anti-VEGF middelen. In de databases Medline (OVID), Embase en de Cochrane Library is op 13 juli 2020 met relevante zoektermen gezocht naar systematische reviews, richtlijnen en RCT’s die behandeling voor diabetisch macula oedeem met anti-VEGF middelen vergelijken. In eerste instantie is gezocht vanaf 2015 en de zoekactie beperkt tot systematische reviews in Medline en Embase. De zoekverantwoording is weergegeven onder het tabblad verantwoording.
Deze initiële literatuurzoekactie leverde 713 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review of RCT, vergelijking van behandeling met anti-VEGF middelen voor diabetisch macula oedeem, bij volwassenen met diabetes mellitus type 1 of 2, met door de werkgroep als relevant benoemde uitkomstmaten (zie eerder in de tekst). Op basis van titel en abstract werden 48 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 37 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 9 studies definitief geselecteerd, waaronder twee systematische reviews (Virgili 2018; Sun 2020). De update richt zich primair op de onderlinge vergelijking tussen anti-VEGF middelen, daarnaast is de evidence voor de vergelijking tussen laser en anti-VEGF middelen’ herbeoordeeld aan de hand van de recente Cochrane review (Virgili 2018).
Referenties
- Aurell S, Sjövall K, Paul A, Morén Å, Granstam E. Better visual outcome at 1 year with antivascular
endothelial growth factor treatment according to treat-and-extend compared with pro re
nata in eyes with neovascular age-related macular degeneration. Acta Ophthalmol. 2019
Aug;97(5):519-524. doi: 10.1111/aos.13989. Epub 2018 Dec 3. PMID: 30511374; PMCID:
PMC6767032. - Baker CW, Glassman AR, Beaulieu WT, et al. Effect of Initial Management With Aflibercept vs Laser
Photocoagulation vs Observation on Vision Loss Among Patients With Diabetic Macular
Edema Involving the Center of the Macula and Good Visual Acuity: A Randomized Clinical
Trial. JAMA. 2019;321(19):1880–1894. doi:10.1001/jama.2019.5790 - Bhandari S, Nguyen V, Fraser-Bell S, Mehta H, Viola F, Baudin F, Gabrielle PH, Creuzot-
Garcher C, Gillies M, Barthelmes D. Ranibizumab or Aflibercept for Diabetic Macular
Edema: Comparison of 1-Year Outcomes from the Fight Retinal Blindness! Registry.
Ophthalmology. 2020 May;127(5):608-615. doi: 10.1016/j.ophtha.2019.11.018. Epub
2019 Nov 26. PMID: 31932092. - Brown, D. M., Wolf, S., Garweg, J., Bandello, F., Emanuelli, A., Barranco, J. J. E., ... & Souied, E.
(2021). Brolucizumab for the treatment of visual impairment due to diabetic macular
edema: 52-week results from the KITE and KESTREL studies. Investigative Ophthalmology & Visual Science, 62(8), 1045-1045. - Brown, D. M., Emanuelli, A., Bandello, F., Barranco, J., Figueira, J., Souied, E., Wolf, S., Gupta, V.,
Ngah, N. F., Liew, G., Tuli, R., Tadayoni, R., Dhoot, D., Wang, L., Bouillaud, E., Wang, Y.,
Kovacic, L., Guerard, N., & Garweg, J. G. (2022). KESTREL and KITE: 52-week results from two
Phase III pivotal trials of brolucizumab for diabetic macular edema. American journal of
ophthalmology, S0002-9394(22)00006-X.
Castro Farías, D., Matsui Serrano, R., Bianchi Gancharov, J., de Dios Cuadras, U., Sahel, J.,
Graue Wiechers, F., Dupas, B., & Paques, M. (2020). Indocyanine green angiography for
identifying telangiectatic capillaries in diabetic macular oedema. The British journal of
ophthalmology, 104(4), 509–513. Dugel PU, Koh A, Ogura Y, Jaffe GJ, Schmidt-Erfurth U, Brown DM, - Gomes AV, Warburton J, Weichselberger A, Holz FG; HAWK and HARRIER Study
Investigators. HAWK and HARRIER: phase 3, multicenter, randomized, double-masked trials of brolucizumab for neovascular age-related macular degeneration Ophthalmology. 2020 Jan;127(1):72-84. - Bressler, S. B., Ayala, A. R., Bressler, N. M., Melia, M., Qin, H., Ferris, F. L., 3rd, Flaxel, C. J., Friedman,
S. M., Glassman, A. R., Jampol, L. M., Rauser, M. E., & Diabetic Retinopathy Clinical Research
Network (2016). Persistent Macular Thickening After Ranibizumab Treatment for Diabetic Macular Edema With Vision Impairment. JAMA ophthalmology, 134(3), 278–285. https://doi.org/10.1001/jamaophthalmol.2015.5346 - Campochiaro, P. A., Brown, D. M., Pearson, A., Ciulla, T., Boyer, D., Holz, F. G., Tolentino, M., Gupta,
A., Duarte, L., Madreperla, S., Gonder, J., Kapik, B., Billman, K., Kane, F. E., & FAME Study
Group (2011). Long-term benefit of sustained-delivery fluocinolone acetonide vitreous inserts for diabetic macular edema. Ophthalmology, 118(4), 626–635.e2. https://doi.org/10.1016/j.ophtha.2010.12.028 - Campochiaro, P. A., Brown, D. M., Pearson, A., Chen, S., Boyer, D., Ruiz-Moreno, J., Garretson, B.,
Gupta, A., Hariprasad, S. M., Bailey, C., Reichel, E., Soubrane, G., Kapik, B., Billman, K., Kane,
F. E., Green, K., & FAME Study Group (2012). Sustained delivery fluocinolone acetonide vitreous inserts provide benefit for at least 3 years in patients with diabetic macular edema. Ophthalmology, 119(10), 2125–2132. https://doi.org/10.1016/j.ophtha.2012.04.030 - Dakin, H. A., Wordsworth, S., Rogers, C. A., Abangma, G., Raftery, J., Harding, S. P., Lotery, A. J.,
Downes, S. M., Chakravarthy, U., Reeves, B. C., & IVAN Study Investigators (2014). Cost-
effectiveness of ranibizumab and bevacizumab for age-related macular degeneration: 2-year
findings from the IVAN randomised trial. BMJ open, 4(7), e005094.
https://doi.org/10.1136/bmjopen-2014-005094 - DRCRN, Diabetic Retinopathy Clinical Research Network, Elman, M. J., Aiello, L. P., Beck, R. W.,
Bressler, N. M., Bressler, S. B., Edwards, A. R., Ferris, F. L., 3rd, Friedman, S. M., Glassman, A. R., Miller, K. M., Scott, I. U., Stockdale, C. R., & Sun, J. K. (2010). Randomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology, 117(6), 1064–1077.e35. https://doi.org/10.1016/j.ophtha.2010.02.031 - DRCRN, Diabetic Retinopathy Clinical Research Network, Elman, M. J., Bressler, N. M., Qin, H., Beck,
R. W., Ferris, F. L., 3rd, Friedman, S. M., Glassman, A. R., Scott, I. U., Stockdale, C. R., & Sun, J.
K. (2011). Expanded 2-year follow-up of ranibizumab plus prompt or deferred laser or
triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology, 118(4), 609–
614. https://doi.org/10.1016/j.ophtha.2010.12.033 - DRCRN, Diabetic Retinopathy Clinical Research Network, Wells, J. A., Glassman, A. R., Ayala, A. R.,
Jampol, L. M., Aiello, L. P., Antoszyk, A. N., Arnold-Bush, B., Baker, C. W., Bressler, N. M., Browning, D. J., Elman, M. J., Ferris, F. L., Friedman, S. M., Melia, M., Pieramici, D. J., Sun, J. K., & Beck, R. W. (2015). Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. The New England journal of medicine, 372(13), 1193–1203. https://doi.org/10.1056/NEJMoa1414264 - Dugel PU, Singh RP, Koh A, Ogura Y, Weissgerber G, Gedif K, Jaffe GJ, Tadayoni R, Schmidt-Erfurth U,
Holz FG. HAWK and HARRIER: Ninety-Six-Week Outcomes from the Phase 3 Trials of
Brolucizumab for Neovascular Age-Related Macular Degeneration. Ophthalmology. 2021
Jan;128(1):89-99. - Elshout, M., van der Reis, M. I., Webers, C. A., & Schouten, J. S. (2014). The cost-utility of aflibercept
for the treatment of age-related macular degeneration compared to bevacizumab and
ranibizumab and the influence of model parameters. Graefe's archive for clinical and
experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle
Ophthalmologie, 252(12), 1911–1920. https://doi.org/10.1007/s00417-014-2641-3 - ETDRS. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study
report number 1. Early Treatment Diabetic Retinopathy Study research group. (1985).
Archives of ophthalmology (Chicago, Ill. : 1960), 103(12), 1796–1806. - Fouda, S. M., & Bahgat, A. M. (2017). Intravitreal aflibercept versus intravitreal ranibizumab for the
treatment of diabetic macular edema. Clinical ophthalmology (Auckland, N.Z.), 11, 567–571. https://doi.org/10.2147/OPTH.S131381 - Gillies, M. C., Lim, L. L., Campain, A., Quin, G. J., Salem, W., Li, J., Goodwin, S., Aroney, C., McAllister,
I. L., & Fraser-Bell, S. (2014). A randomized clinical trial of intravitreal bevacizumab versus intravitreal dexamethasone for diabetic macular edema: the BEVORDEX study. Ophthalmology, 121(12), 2473–2481. https://doi.org/10.1016/j.ophtha.2014.07.002 - Glassman AR, Wells JA 3rd, Josic K, Maguire MG, Antoszyk AN, Baker C, Beaulieu WT, Elman
MJ, Jampol LM, Sun JK. Five-Year Outcomes after Initial Aflibercept, Bevacizumab, or
Ranibizumab Treatment for Diabetic Macular Edema (Protocol T Extension Study).
Ophthalmology. 2020 Sep;127(9):1201-1210. doi: 10.1016/j.ophtha.2020.03.021. Epub
2020 Mar 29. PMID: 32402554; PMCID: PMC7483366. - Hussain, R. M., & Ciulla, T. A. (2016). Treatment strategies for refractory diabetic macular edema:
switching anti-VEGF treatments, adopting corticosteroid-based treatments, and combination
therapy. Expert opinion on biological therapy, 16(3), 365–374. https://doi.org/10.1517/14712598.2016.1131265 - Liu WS, Li YJ. Comparison of conbercept and ranibizumab for the treatment efficacy of diabetic
macular edema: a Meta-analysis and systematic review. Int J Ophthalmol. 2019;12(9):1479-
1486. Published 2019 Sep 18. doi:10.18240/ijo.2019.09.17 - Moja, L., Lucenteforte, E., Kwag, K. H., Bertele, V., Campomori, A., Chakravarthy, U., D'Amico, R.,
Dickersin, K., Kodjikian, L., Lindsley, K., Loke, Y., Maguire, M., Martin, D. F., Mugelli, A., Mühlbauer, B., Püntmann, I., Reeves, B., Rogers, C., Schmucker, C., Subramanian, M. L., … Virgili, G. (2014). Systemic safety of bevacizumab versus ranibizumab for neovascular age-related macular degeneration. The Cochrane database of systematic reviews, 9(9), CD011230. https://doi.org/10.1002/14651858.CD011230.pub2 - Payne JF, Wykoff CC, Clark WL, Bruce BB, Boyer DS, Brown DM; TREX-DME Study Group. Randomized
Trial of Treat and Extend Ranibizumab With and Without Navigated Laser Versus Monthly
Dosing for Diabetic Macular Edema: TREX-DME 2-Year Outcomes. Am J Ophthalmol. 2019
Jun;202:91-99. doi: 10.1016/j.ajo.2019.02.005. Epub 2019 Feb 14. PMID: 30771333. - Pham B, Thomas SM, Lillie E, Lee T, Hamid J, Richter T, Janoudi G, Agarwal A, Sharpe JP, Scott A,
Warren R, Brahmbhatt R, Macdonald E, Straus SE, Tricco AC. Anti-vascular endothelial growth
factor treatment for retinal conditions: a systematic review and meta-analysis. BMJ Open. 2019 May 28;9(5):e022031. - Prünte, C., Fajnkuchen, F., Mahmood, S., Ricci, F., Hatz, K., Studnička, J., Bezlyak, V., Parikh, S.,
Stubbings, W. J., Wenzel, A., Figueira, J., & RETAIN Study Group (2016). Ranibizumab 0.5 mg treat-and-extend regimen for diabetic macular oedema: the RETAIN study. The British journal of ophthalmology, 100(6), 787–795. https://doi.org/10.1136/bjophthalmol-2015-307249
doi: 10.1136/bmjopen-2018-022031. PMID: 31142516; PMCID: PMC6549720. - Reibaldi, M., Fallico, M., Avitabile, T., Bonfiglio, V., Russo, A., Castellino, N., Parisi, G., Longo, A.,
Pulvirenti, A., Boscia, F., & Virgili, G. (2020). Risk of Death Associated With Intravitreal Anti-Vascular Endothelial Growth Factor Therapy: A Systematic Review and Meta-analysis. JAMA ophthalmology, 138(1), 50–57. https://doi.org/10.1001/jamaophthalmol.2019.4636 - Ross EL, Hutton DW, Stein JD, Bressler NM, Jampol LM, Glassman AR; Diabetic Retinopathy Clinical
Research Network. Cost-effectiveness of Aflibercept, Bevacizumab, and Ranibizumab for
Diabetic Macular Edema Treatment: Analysis From the Diabetic Retinopathy Clinical Research Network Comparative Effectiveness Trial. JAMA Ophthalmol. 2016 Aug 1;134(8):888-96. doi:
10.1001/jamaophthalmol.2016.1669. PMID: 27280850; PMCID: PMC6648661. - Sahni, J., Patel, S. S., Dugel, P. U., Khanani, A. M., Jhaveri, C. D., Wykoff, C. C., Hershberger, V. S.,
Pauly-Evers, M., Sadikhov, S., Szczesny, P., Schwab, D., Nogoceke, E., Osborne, A., Weikert, R., & Fauser, S. (2019). Simultaneous Inhibition of Angiopoietin-2 and Vascular Endothelial Growth Factor-A with Faricimab in Diabetic Macular Edema: BOULEVARD Phase 2 Randomized Trial. Ophthalmology, 126(8), 1155–1170. https://doi.org/10.1016/j.ophtha.2019.03.023 - Schauwvlieghe, A. M., Dijkman, G., Hooymans, J. M., Verbraak, F. D., Hoyng, C. B., Dijkgraaf, M. G.,
Van Leeuwen, R., Vingerling, J. R., Moll, A. C., & Schlingemann, R. O. (2015). Comparing the effectiveness and costs of Bevacizumab to Ranibizumab in patients with Diabetic Macular Edema: a randomized clinical trial (the BRDME study). BMC ophthalmology, 15, 71. https://doi.org/10.1186/s12886-015-0043-x - Stein, J. D., Newman-Casey, P. A., Mrinalini, T., Lee, P. P., & Hutton, D. W. (2014). Cost-effectiveness
of bevacizumab and ranibizumab for newly diagnosed neovascular macular degeneration.
Ophthalmology, 121(4), 936–945. https://doi.org/10.1016/j.ophtha.2013.10.037 - Sun, X., Zhang, J., Tian, J., Chen, S., Zeng, F., & Yuan, G. (2020). Comparison of the Efficacy and Safety
of Intravitreal Conbercept with Intravitreal Ranibizumab for Treatment of Diabetic Macular Edema: A Meta-Analysis. Journal of ophthalmology, 2020, 5809081. https://doi.org/10.1155/2020/5809081 - Thulliez, M., Angoulvant, D., Pisella, P. J., & Bejan-Angoulvant, T. (2018). Overview of Systematic
Reviews and Meta-analyses on Systemic Adverse Events Associated With Intravitreal Anti-Vascular Endothelial Growth Factor Medication Use. JAMA ophthalmology, 136(5), 557–566. https://doi.org/10.1001/jamaophthalmol.2018.0002 - Vader, M., Schauwvlieghe, A., Verbraak, F. D., Dijkman, G., Hooymans, J., Los, L. I., Zwinderman, A.
H., Peto, T., Hoyng, C. B., van Leeuwen, R., Vingerling, J. R., Moll, A. C., van Lith-Verhoeven, J.,
Dijkgraaf, M., Schlingemann, R. O., & Bevacizumab and Ranibizumab in Diabetic Macular
Edema Study Group (2020). Comparing the Efficacy of Bevacizumab and Ranibizumab in Patients with Diabetic Macular Edema (BRDME): The BRDME Study, a Randomized Trial. Ophthalmology. Retina, 4(8), 777–788. https://doi.org/10.1016/j.oret.2020.02.008 - van Asten F, Michels CTJ, Hoyng CB, et al. The cost-effectiveness of bevacizumab, ranibizumab and
aflibercept for the treatment of age-related macular degeneration-A cost-effectiveness
analysis from a societal perspective. PLoS One. 2018;13(5):e0197670. Published 2018 May
17. doi:10.1371/journal.pone.0197670 - Virgili, G., Parravano, M., Menchini, F., & Evans, J. R. (2014). Anti-vascular endothelial growth factor
for diabetic macular oedema. The Cochrane database of systematic reviews, (10), CD007419.
https://doi.org/10.1002/14651858.CD007419.pub4 - Virgili, G., Parravano, M., Evans, J. R., Gordon, I., & Lucenteforte, E. (2018). Anti-vascular endothelial
growth factor for diabetic macular oedema: a network meta-analysis. The Cochrane database
of systematic reviews, 10(10), CD007419. https://doi.org/10.1002/14651858.CD007419.pub6 - Volkmann I, Knoll K, Wiezorrek M, Greb O, Framme C. Individualized treat-and-extend regime for
optimization of real-world vision outcome and improved patients' persistence. BMC
Ophthalmol. 2020;20(1):122. Published 2020 Mar 30. doi:10.1186/s12886-020-01397-x - Wells, J. A., Glassman, A. R., Jampol, L. M., Aiello, L. P., Antoszyk, A. N., Baker, C. W., Bressler, N. M.,
Browning, D. J., Connor, C. G., Elman, M. J., Ferris, F. L., Friedman, S. M., Melia, M., Pieramici,
D. J., Sun, J. K., Beck, R. W., & Diabetic Retinopathy Clinical Research Network (2016).
Association of Baseline Visual Acuity and Retinal Thickness With 1-Year Efficacy of
Aflibercept, Bevacizumab, and Ranibizumab for Diabetic Macular Edema. JAMA ophthalmology, 134(2), 127–134. https://doi.org/10.1001/jamaophthalmol.2015.4599 - Wells, J. A., Glassman, A. R., Ayala, A. R., Jampol, L. M., Bressler, N. M., Bressler, S. B., Brucker, A. J.,
Ferris, F. L., Hampton, G. R., Jhaveri, C., Melia, M., Beck, R. W., & Diabetic Retinopathy
Clinical Research Network (2016). Aflibercept, Bevacizumab, or Ranibizumab for Diabetic
Macular Edema: Two-Year Results from a Comparative Effectiveness Randomized Clinical
Trial. Ophthalmology, 123(6), 1351–1359. https://doi.org/10.1016/j.ophtha.2016.02.022 - Wykoff, C. C., Abreu, F., Adamis, A. P., Basu, K., Eichenbaum, D. A., Haskova, Z., Lin, H., Loewenstein,
A., Mohan, S., Pearce, I. A., Sakamoto, T., Schlottmann, P. G., Silverman, D., Sun, J. K., Wells, J. A., Willis, J. R., Tadayoni, R., & YOSEMITE and RHINE Investigators (2022). Efficacy, durability, and safety of intravitreal faricimab with extended dosing up to every 16 weeks in patients with diabetic macular oedema (YOSEMITE and RHINE): two randomised, double-masked, phase 3 trials. Lancet (London, England), S0140-6736(22)00018-6.
Evidence tabellen
- Evidence table for (systematic reviews of) RCTs and observational studies (intervention studies)
Research question: What is the optimal treatment for diabetic macular edema?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Update of the systematic review of Virgili (2014) – comparisons: anti-VEGF versus laser, and anti-VEGF versus alternative anti-VEGF |
|||||||
|
DRCRN 2015
|
RCT; parallel design
NCT01627249
Setting: multicentre, 89 clinical sites in USA
Source of funding: Non-commercial (NIH); manufacturers provided aflibercept and ranibizumab, DRCR.net purchased bevacizumab
|
Inclusion criteria: >=18 years; diab type 1 or 2; >=1 eye with BCVA of 78 (Snellen 20/32) to 24 (20/320); center-involved DME on clin exam and OCT (protocol-defined Thresholds); no anti-VEGF treatment within previous 12 months
Aug 2012-Aug 2013
Important patient characteristics at baseline:
N=660 aflibercept (224) bevacizumab (218) ranibizumab (218)
Mean age 61±10 47% women 65% white 90% t2 diab Mean dur diab 17±11 years Mean VA letter 64.8±11.3 (Snellen 20/50) Mean central subfield thickness 412±130 μm
Groups comparable at baseline? Yes |
Describe intervention:
Aflibercept 2.0 mg (224) Bevacizumab 1.25 mg 218 Ranibizumab 0.3 mg (218)
Injection volume 0.05 ml
baseline and every 4 weeks unless visual acuity >= 20/20 with central subfield thickness below eligibility threshold and no improvement or worsening in response to past two injections.
Improvement = increase in VA >= 5 letters or decrease in central subfield thickness of >= 10% Worsening = decrease in VA >= 5 letters or increase in central subfield thickness of >= 10%
Starting at 24-week visit, irrespective of VA and central subfield thickness, injection was withheld if no improvement or worsening after two consecutive injections
Laser photocoagulation therapy (focal, grid, or both) was initiated at or after the 24-week visit for persistent diabetic macular edema, defined on the basis of protocol-specified criteria.
Treatment for diabetic macular edema other than the randomly assigned anti-VEGF agent or laser therapy was permitted if a study eye met the criteria for treatment failure. |
Describe control:
Alternative intervention: A vs B; A vs R; R vs B
A=Aflibercept B=Bevacizumab R=Ranibizumab
Number injections median (IQR) aflibercept: 9 (8-11) bevacizumab: 10 (8-12) ranibizumab: 10 (8-11)
Laser (focal and/or grid) >=1 between 24-48 weeks Aflibercept: 37% Bevacizumab: 56% Ranibizumab: 46%
Subgroup-1 (severe) VA >= 20/50 Letter score <=69 median 10-11 injections Aflibercept: 37% laser Bevacizumab: 65%laser Ranibizumab: 50% laser
Subgroup-2 (less severe) VA 20/32-20/40 Letter score 78-69 median 9 injections/group Aflibercept: 36% laser Bevacizumab: 47% laser Ranibizumab: 43% laser |
End-point of follow-up: 1 year (follow-up visits every 4 weeks)
For how many participants were no complete outcome data available?
Overall 6-7% Death/Dropped/Missed Aflibercept: 3/12/1 Bevacizumab: 5/6/1 Ranibizumab: 3/9/0
ITT analysis with multiple imputation (mITT) |
BCVA improvement (cont; dich at >=10 and >=15 letters); decrease in macular thickness (cont; % with CST<250 μm); adverse events (ocular; systemic); mean difference [95% CI]
Predefined subgroup analysis: Subgroup-1 VA >= 20/50 Subgroup-2 VA 20/32-20/40
BCVA (prim outcome) using Electronic Early Treatment of Diabetic Retinopathy Study Visual Acuity Test
Macular thickness (CST) Dilated ocular examination and spectral or time-domain OCT (97% and 3% of scans, resp). OCT values were converted to time-domain–equivalent values for analysis and reporting.
Adverse events Any untoward medical occurrence, regardless of whether the event was considered to be related to treatment; coded (MedDRA)
Results: at 1 year followup
BCVA (change from baseline) Overall, continuous A-B: 3.5 [1.4;5.7] A-R: 2.1 [0.1;4.2] R-B: 1.4 [-0.4;3.2] Overall, >=15 letters (%) Improvement A-B: 11 [1;21] NNT=9.1[4.8;100] A-R: 8 [0;17] R-B: 3 [-5;11] Worsening A-B: 0 [-2;2] A-R: 0 [-2;2] R-B: 0 [-2;2]
Subgroup-1, continuous A-B: 6.5 [2.9;10.1] A-R: 4.7 [1.4;8.0] R-B: 1.8 [-1.1;4.8] Subgroup-1, >=15 letters Improvement A/B/R=67/41/50% A-B: 24 [9;39] NNT=4.2[2.6;11.1] A-R: 18 [4;32] NNT=5.6[3.1;25] R-B: 6 [-7;19] Worsening A/B/R=1/2/2% A-B: 0 [-3;3] A-R: -1 [-4;2] R-B: 1 [-3;4] Subgroup-1, >=10 letters Improvement A/B/R=77/60/69% A-B: 17 [2;31] A-R: 10 [-4;23] R-B: 7 [-6;20] Worsening A/B/R=1/4/2% A-B: -3 [-7;2] A-R: -1 [-5;3] R-B: -1 [-6;3]
Subgroup-2, continuous A-B: 0.7 [-1.3;2.7] A-R: -0.4 [-2.3;1.5] R-B: 1.1 [-0.9;3.1] Subgroup-2, >=15 letters Improvement A/B/R=18/16/15% A-B: 2 [-7;11] A-R: 4 [-5;12] R-B: -2 [-10;7] Worsening A/B/R=2/1/1% A-B: 1 [-2;4] A-R: 1 [-2;4] R-B: 0 [-3;3] Subgroup-2, >=10 letters Improvement A/B/R=50/45/50% A-B: 6 [-9;21] A-R: 0 [-13;14] R-B: 6 [-10;21] Worsening A/B/R=4/2/1% A-B: 2 [-3;6] A-R: 3 [-1;7] R-B: -1 [-4;2]
Macular thickness (CST) Change from baseline Subgroup-1, continuous (um) A-B: -86 [-122;-50] A-R: -19 [-48;11] R-B: -67 [-101;33] Subgroup-1, <250 μm (%) A/B/R=70/39/56 A-B: 32 [16;48] NNT=3.1[2.1;6.3] A-R: 16 [3;30] NNT=6.3[3.3;33.3] R-B: 16 [2;29] NNT=6.3[3.4;50]
Subgroup-2, continuous (um) A-B: -56 [-78;-33] A-R: -18 [-37;1] R-B: -38 [-59;-16] Subgroup-2, <250 μm (%) A/B/R=62/34/60 A-B: 31 [16;45] NNT=3.2[2.2;6.3] A-R: -2 [-16;12] R-B: 33 [17;48] NNT=3.0[2.1;5.9]
Adverse events Events occurring at least once A/B/R Ocular no. of eyes (%) Endophthalmitis 0(0)/0(0)/0(0) Inflammation 2(1)/2(1)/2(1) Ret detach or tear 0(0)/1(<0.5)/1(<0.5) Vitr hemorr 4(2)/9(4)/7(3) Cataract 2(1)/2(1)/0(0) Elev IOP 32(14)/19(9)/23(11) all p-values non-sign
Systemic No. of participants (%) Nonfatal MI 4(2)/1(<0.5)/3(1) Nonfatal stroke 0(0)/4(2)/4(2) Death any cause 3(1)/5(2)/4(2) Hospital 49(22)/40(18)/49(22) Serious AE 59(26)/46(21)/55(25) Gastroint event 44(20)/40(18)/38(17) Renal event 28(12)/23(11)/24(11) Hypert 26(12)/16(7)/26(12) all p-values non-sign |
Authors conclude that aflibercept, bevacizumab, and ranibizumab were effective and relatively safe treatments for DME causing vision impairment. When initial visual acuity loss was mild, there was, on average, little difference in visual acuity at 1 year among the three agents. However, at worse levels of initial visual acuity, aflibercept was more effective at improving vision. [subgroup-1 = worse; subgroup-2 = mild DME]
Costs: based on Medicare allowable charges, cost for a single intravitreous injection is $1,950 for aflibercept, $50 for bevacizumab and $1,200 for ranibizumab [median number of injections was 9-10]
Note: bevacizumab is used off-label, and has to be repackaged into single-use vials containing the dose that is commonly used in clinical practice
Power calculation: 220 per group based on group difference in VA of 4.0, SD 11.4, alpha 0.05, loss to fup of 7.5%, and power of 90%. Note: the subgroup analyses and most analyses on secondary outcomes do not fulfill the power calculation.
Post-hoc analyses (Aes): Frequency of events in the combined MedDRA system organ classes of cardiac disorders and vascular disorders differed among treatment groups (P = 0.01 excluding hypertension events and P = 0.04 including hypertension events), with a higher frequency in the ranibizumab group than in the other two groups
ROB: centralized randomization in permuted blocks with stratification according to study site and visual acuity in the study eye; Study participants, reading-center graders, medical monitor (AEs), VA and OCT technicians were unaware of treatment-group assignments; investigators and study coordinators were aware of the treatment group assignments |
|
Systematic review of Ford (2013) – RCTs included in Ford (2013) for comparison: anti-VEGF versus steroids |
|||||||
|
DRCRN 2010, 2011
[Elman 2010, 2011]
|
RCT; parallel design
Setting: USA Multicenter
Source of funding: Non-commercial (NIH); drugs provided freely by manufacturers (= sponsor)
|
Inclusion criteria: ≥18; type 1 or 2 DM; BCVA letter score 78–24 (20/32–20/320); definite retinal thickening due to DMO as main cause of visual loss; (3) retinal thickness measured on time domain OCT ≥250 μm in central subfield (2 study eyes per patient could be included if both were eligible at study entry)
Exclusion: (1) treatment DMO within prior 3 months, or panretinal photocoagulation within prior 4 months or anticipated need for panretinal photocoagulation within next 6 months, (3) major ocular surgery within prior 4 months, (4) history of glaucoma or steroid-induced IOP elevation, (5) IOP ≥25 mm Hg; SP >180 mm, DP>110 mm Hg; MI, other Major cardiac, CVA, TIA, cong heart failure
Mar2007–Dec2010
N: 854 eyes of 691 patients
Important patient characteristics at baseline: Age median 62–64 y Sex 41–46% fem 6–9% type 1 DM 89–92% type 2 DM HbA1c median 7.3–7.5% Baseline VA 63 SD12 Baseline CMT 405 SD134 μm Comorbidities: 60–67% prior treatment for DMO; 61–68% with NPDR, 26–36% with PDR or PDR scars
Groups comparable at baseline? Yes |
4 groups / interventions: 854 eyes of 691 patients (163 with 2 study eyes)
Group 1 (CPL, n=293 eyes): sham injection plus prompt (within 3–10 days) focal/grid photocoagulation
Group 2 (RPL, n=187 eyes): 0.5 mg IV ranibizumab plus prompt focal/grid photocoagulation
Group 3 (RDL, n=188 eyes): 0.5 mg IV ranibizumab plus deferred (≥24 weeks) focal/grid photocoagulation
Group 4 (TPL, n=186 eyes): 4 mg IV triamcinolone plus prompt focal/grid photocoagulation
All groups: study treatment every 4 weeks up to 12 weeks, then retreatment algorithm: 16 to 20 weeks, monthly retreatment unless ‘success’ criteria were met (VA ≥84 (20/20) or OCT CST<250 μm); 24–48 weeks, patients subdivided into ‘success’, ‘improvement’, ‘no improvement’ or ‘failure’; ‘improvement’ group continued treatment, other groups treated at investigator discretion
ranibizumab could be given as often as every 4 weeks, and triamcinolone every 16 weeks (with sham as often as every 4 weeks). Retreatment for focal/grid laser if there was oedema involving or threatening the center of the macula and if complete laser had not been given
Number of injections: Median number of drug injections before 1 year visit was 8–9 for ranibizumab, 3 for triamcinolone, and 5 sham injections.
Retreatment between 1 and 2 years (Elman 2011): median injections 2 in RPL group, 3 in RDL group; in TPL group 68% of eyes received at least 1 injection; at least one focal/grid laser sessions between 1 and 2 years: 51% CPL, 40% RPL, 29% RDL, 52% TPL Laser Modified ETDRS protocol as used in prior DRCR.net protocols
|
The relevant comparison is group-2 versus group-4 = Ranimizumab+laser versus triamcinolone+laser = RPL versus TPL
Note: Because correlation was possible between eyes of the same patient, generalized estimating equation (GEE) methods were used where appropriate
Note: subgroup analysis for pseudophakic eyes |
End-point of follow-up: 1–2 y; 2 y extension (Elman, 2011)
follow-up visits every 4 weeks
For how many participants were no complete outcome data available? 13 patients (2%) died in year-1 and 15 patients in year-2 (unrelated to study treatment)
Of remaining patients, 94-96% completed followup year-1 (4-6% loss to followup; with similar BCVA at baseline)
ITT analysis with LOCF (last observation carried forward)
Elman (2011): expanded 2-year followup >> see below
Results: at 2 year followup
BCVA (change from baseline) continuous CPL = reference RPL: 3.7 [-0.4;7.7] RDL: 5.8 [1.9;9.8] TPL: -1.5 [-5.5;2.4] >=15 letters (%) Improvement 18/29/28/22 CPL = reference RPL: 11 [-0.1;22] RDL: 11 [-0.5;22] TPL: 4 [-6;15] Worsening CPL = reference RPL: -6 [-12;1] RDL: -8 [-14;-2] TPL: 3 [-5;12] >=10 letters (%) Improvement 36/44/48/41 CPL = reference RPL: 8 [-4;21] RDL: 13 [0.5;26] TPL: 6 [-7;18] Worsening 13/7/3/19 CPL = reference RPL: -5 [-13;-2] RDL: -10 [-16;-3] TPL: 6 [-3;16]
Subgroups Among the eyes that were pseudophakic at baseline, the mean change in visual acuity letter score from baseline to the 2-year visit was 1.6 letters (95%CI=[-4.5;7.6]) greater in TPL compared with CPL and was similar to difference in outcomes between RPL (0.5 [-5.5;6.6]) and RDL (3.5 [-2.3;9.3]) compared with CPL
>> ‘as reported previously for 1-year followup, in an analysis limited to pseudophakic eyes, the triamcinolone prompt laser group’s outcome for visual acuity was of similar magnitude to that of the 2 ranibizumab groups’
Macular thickness (CST) continuous (µm) -138/-141/-150/-107 CPL = reference RPL: -31 [-56;-6] RDL: -28 [-53;-3] TPL: -10 [-35;16] <250 μm (%) Relative risk 39/54/56/45% CPL = reference = 1 RPL: 1.34 [1.03;1.76] RDL: 1.35 [1.03;1.78] TPL: 1.16 [0.88;1.52]
Adverse events See 1 column to the right
|
BCVA improvement (cont; dich at >=10 and >=15 letters); decrease in macular thickness (cont; % with CST<250 μm); adverse events (ocular; systemic); mean difference [95% CI]
BCVA (prim outcome) using Electronic Early Treatment of Diabetic Retinopathy Study Visual Acuity Test
Macular thickness (CST) Dilated ocular examination and spectral or time-domain OCT (97% and 3% of scans, resp). OCT values were converted to time-domain–equivalent values for analysis and reporting.
Adverse events Any untoward medical occurrence, regardless of whether the event was considered to be related to treatment; coded (MedDRA)
Results: at 1 year followup
BCVA (change from baseline) continuous CPL = reference RPL: 5.8 [3.2;8.5] RDL: 6.0 [3.4;8.6] TPL: 1.1 [-1.5;3.7] >=15 letters (%) Improvement 15/30/28/21 CPL = reference RPL: 16 [6;26] RDL: 13 [4;22] TPL: 6 [-2;15] Worsening CPL = reference RPL: -6 [-11;-2] RDL: -6 [-10;-1] TPL: 0 [-6;6] >=10 letters (%) Improvement 28/51/47/33 CPL = reference RPL: 23 [13;34] RDL: 19 [9;29] TPL: 6 [-4;16] Worsening 13/3/3/15 CPL = reference RPL: -10 [-16;-5] RDL: -10 [-16;-4] TPL: 1 [-7;9]
Subgroups Pseudophakic at baseline? No/Yes (273/581 eyes) Continuous change from baseline (SD) CPL: 2(13)/4(14) RPL: 9(10)/8(12) RDL: 10(14)/7(9) TPL: 2(14)/8(9) >=10 letters (%) Improvement CPL: 27/30% RPL: 54/43% RDL: 54/30% TPL: 26/47% >=10 letters (%) Worse CPL: 15/10% RPL: 2/5% RDL: 3/4% TPL: 20/3%
[see paper for other subgroup analyses]
Note: results for >=15 letters change in BCVA not reported for these subgroups
Macular thickness (CST) continuous (µm) -102/-131/-137/-127 CPL = reference RPL: -55 [-78;-32] RDL: -49 [-72;-26] TPL: -52 [-75;-29] <250 μm (%) Relative risk 27/53/42/47% CPL = reference = 1 RPL: 2.00 [1.52;2.64] RDL: 1.55 [1.13;2.13] TPL: 1.76 [1.31;2.36]
Adverse events Events occurring at least once CPL/RPL/RDL/TPL Ocular (1 year fup) no. of eyes (%) Endophth 1(1)/1(1)/1(1)/0 Ret detach 0/0/1(1)/0 Vitr hem 15(5)/3(2)/4(2)/2(1) Catsurg 11(6)/6(5)/8(6)/19(15) [cat surg over 2 years fup substantially greater in TPL compared with CPL or ranibizumab groups (59% vs 14% respectively; P<0.001 for both comparisons)] Intraocular pressure (IOP): Elev IOP (>=10 mm from basel) 16(5)/10(5)/5(3)/70(38) Elev IOP (>=30 mm from basel) 3(1)/2(1)/4(2)/46(25) IOP medication during fup 9(3)/5(3)/4(2)/41(22) IOP any of above: 23(8)/12(6)/7(4)/79(42) [over 2 years fup: IOP any events was more frequent in TPL than in ranibizumab groups or CPL (93 [50%] vs. 34 [9%] or 32 [11%], respectively; P<0.001 for both comparisons)}
Systemic (1 year fup) No. of participants (%) CPL/RPL+RDL/TPL Nonfatal MI 3(2)/1(1)/2(1) Nonfatal stroke 5(4)/3(1)/1(1) Vasc death 4(3)/7(2)/2(1) Any ATC cardiovasc event 10(8)/11(3)/5(3) all p-values non-sign [no difference in frequency among the 4 groups that could not be attributed to chance. No indication of increase in cardiovascular or cerebrovascular events in ranibizumab groups; mean number of systemic AEs per participant through 2 years fup was 3+/-3 in CPL, 3+/-3 in ranibizumab groups combined, and 3+/-4 in TPL] |
Authors conclude that ranibizumab with prompt or deferred laser is more effective compared with prompt laser alone for treatment of DME involving the central macula. In pseudophakic eyes, intravitreal triamcinolone prompt laser may be equally effective as ranibizumab at improving visual acuity and reducing retinal thickening but is associated with an increased risk of elevated IOP
|
|
Lim 2012
|
RCT; parallel design
Setting: South Korea; Dept Ophthalm, single center
Source of funding: Non-commercial?
|
Inclusion criteria: clinically significant DME (ETDRS criteria); CMT >= 300 μm by OCT
Exclusion: (1) unstable medical status, including glycemic control and blood pressure; any previous treatment for DME, including intravitreal, sub-Tenon injection or macular photocoagulation, history of vitreoretinal surgery, uncontrolled glaucoma; proliferative diabetic retinopathy with active neovascularization, previous panretinal photocoagulation, presence of vitreomacular traction, history of systemic corticosteroids within 6 months, contraindications for bevacizumab or triamcinolone acetonide
Mar2008–Feb2010
N: 120 eyes of 110 patients
9 eyes (5 patients) lost to followup
Study sample = 111 eyes (105 patients)
Important patient characteristics at baseline: BT/B/T Age 58/61/60 Sex (%male) 47/50/45 HbA1c 7.5/7.4/7.2 Retino severity (ETDRS scale) Mild-to-moderate Nonproliferative 89/87/92% Severe nonprolifer 8/11/8% IOP (mm Hg) 14/15/14
Groups comparable at baseline? Yes |
3 groups / interventions: 111 eyes of 105 patients (6 with 2 study eyes)
BT: 1.25 mg (0.05 ml) bevacizumab + 2 mg (0.05 ml) triamcinolone acetonide B: twice 1.25 mg (0.05 ml) bevacizumab at 6-weeks interval T: 2 mg (0.05 ml) triamcinolone acetonide
Number of injections: Based on single injection (in BT and T) and 2 injections (B); but additional injections based on CMT >> Retreatment: Repeated IVB injections were administered when the central macular thickness appeared more than 300 μm on OCT in at least 6 weeks (?) in all three groups; mean number of additional injections: 1.28 (BT), 2.54 (B), 1.04 (T)
|
Alternative intervention: BT: 36 eyes B: 38 T: 37
|
End-point of follow-up: 6 months 12 months [6 weeks and 3 months also analyzed but not included in the current evidence table]
For how many participants were no complete outcome data available? 5 (9 eyes=7.5%) lost to fup; not differentiated per group
Only patients (eyes) with complete fup analyzed (111 eyes) |
BCVA (cont); macular thickness (cont); adverse events (ocular; systemic); p-values
BCVA (prim outcome) Best-corrected visual acuity measured by Snellen chart (logMAR) scale.
Macular thickness (CMT) mean thickness on 1-mm circle centered on the fovea (central macular thickness) using a fast macular thickness map
Adverse events Cataracts graded by masked clinical observer using the Age-Related Eye Diseases Study photographic standards
Results: shown here for 6 months and 12 months followup
BCVA Continuous logMAR (SD) Baseline BT: 0.64±0.25 B: 0.62±0.23 T: 0.65±0.28 6 months BT: 0.52±0.29 B: 0.58±0.20 T: 0.44±0.29 12 months BT: 0.49±0.32 B: 0.46±0.28 T: 0.49±0.19 All p-values non-significant
CMT Continuous µm (SD) Baseline BT: 458 (92) B: 447(110) T: 449 (106) 6 months BT: 358 (89) B: 357 (98) T: 329 (109) 12 months BT: 259 (60) B: 268 (74) T: 249 (78) All p-values non-significant
Adverse events ‘No significant increase in BP, thromboembolic events or serious ocular complications (vitreous hemorrhage, endophthalmitis and retinal detachment) was encountered; IOP (>21 mm Hg) detected in 3 eyes (8.3%) in IVB/IVT group and 4 eyes (10.8%) in IVT group (controlled with topical medications); no progression of cataract by 2 or more Age-Related Eye Diseases Study grades noted’ |
Authors conclude that IVB/IVT and IVT showed more pronounced effects during the earlier postinjection period. However, levels of visual acuity or central macular thickness at 12 months were comparable in the three study groups. No beneficial effect of the combination injection was observed
Note: only treatment-naïve eyes (and without active neovascularization) are included; small sample size
Note: BCVA not analyzed in relation to clinically significant change in vision (>10 letters, or >15 letters)
Note: low number of injections
Note: only outcome assessors and statisticians were blinded (but ROB unlikely for relevant outcome measures)
Note: sample size (power calculation) unclear, MCID missing in calculation
|
|
Oliveira Neto 2011 |
EXCLUDED [so far study results have not been published; meeting abstract only] |
EXCLUDED |
EXCLUDED |
EXCLUDED |
EXCLUDED |
EXCLUDED |
EXCLUDED |
|
|
|
|
|
|
|
|
|
|
Update of the systematic review of Ford (2013) – comparison: anti-VEGF versus steroids |
|||||||
|
Gillies 2014 |
RCT; parallel design
NCT01298076
Setting: 4 retina clinics Australia
Source of funding: Non-commercial (National Health and Medical Research Council); unrestricted educational grant from Allergan Pharmaceutical (= sponsor)
|
Inclusion criteria: DME affecting central fovea >= 3 months after >= 1 laser treatment, or belief (investigator) that laser treatment would be unhelpful; BCVA 17-72 log (Snellen 20/400 - 20/40)
Exclusion: uncontrolled glaucoma or glaucoma controlled with >1 medication; loss of vision because of other causes; intercurrent severe systemic disease; any condition affecting follow-up or documentation
Oct2010-Sept 2012
Important patient characteristics at baseline:
N=88 eyes (61 patients): 27/61 patients had both eyes in study
B-bevacizum (42) D-dexameth (46)
B/D
Mean age 62.2/61.4 Women 38%/35% Mean dur diab 16.7/16.7 years Mean VA letter 56.3/55.5 CMT 503/474 μm IOP 14.5/14.8 mm Hg HbA1c 7.8/7.7%
Groups comparable at baseline? Yes |
Describe intervention:
Bevacizumab 1.25 mg (42)
baseline and every 4-weeks unless CMT <300 mm or VA >=79 (20/25)
Nr injections (12 months) Mean = 8.6 |
Describe control:
Dexam implant 0.7 mg (46)
[Ozurdex; Allergan, Inc., Irvine, CA]
baseline and every 16 weeks unless CMT <300 mm or VA >=79 (20/25)
Nr injections (12 months) Mean = 2.7
Note: Because correlation was possible between eyes of the same patient, generalized estimating equation (GEE) methods were used where appropriate |
End-point of follow-up: 48-50 weeks (’12 months’)
follow-up visits every 4 weeks
For how many participants were no complete outcome data available?
Overall 8% (eyes) = 6 patients Bevacizumab: 4 lost (eyes) Dexameth: 3 lost (eyes)
4/6 patients withdrew because of difficulty attending monthly appointments; 2 patients withdrew because of perceived lack of efficacy of bevacizumab
ITT analysis with LOCF (last observation carried forward) |
BCVA improvement (cont; dich at >=10 letters); change in macular thickness (cont); adverse events (ocular; systemic)
Participants underwent dilated fundal examination, measurement of Logarithm of the minimum angle of resolution BCVA, IOP, and blood pressure (BP); and grading of anterior and posterior chamber cells and cataract.
BCVA (prim outcome) ETDRS charts using standardized procedures by certified masked research officers; prim outcome = % with >= 10 ETDRS letter improvement to baseline (at 1 year)
Macular thickness (CMT) measured from the central 1-mm subfield from spectral-domain ocular coherence tomography image.s
Adverse events Intraocular pressure (IOPs) using Goldman applanation Tonometry; cataracts graded using Age-Related Eye Disease Study photographic standards; significant elevation of IOP = increase > 5 mmHg compared with baseline level; significant progression of cataract = > 2 Age-Related Eye Disease Study grades; Worsening of systemic hypertension = increase BP to > 150 mmHg systolic or 100 mmHg diastolic and increased by 20 mmHg on at least 2 consecutive visits or addition of new antihypertensive medication or increase in dose of antihypertensive
Results: at 1 year followup
BCVA (change from baseline) continuous B: 8.9 [6.27;11.6] D: 5.6 [0.90;10.3] P=0.24
>=10 letters (%) Improvement B: 17/42 (40%) D: 19/46 (41%) P=0.99 Sens analysis (>= 10 letters): all eyes lost = event 19/42 (45.2%) 20/46 (43.5%) P=0.78 none of eyes lost = event 15/42 (35.7%) 17/46 (37%) P=0.95
>=10 letters (%) Worsening B: 0/42 (0%) D: 5/46 (11%) [P=??] because of increase in cataract density in 4 cases and syphilitic chorioretinitis in 1 eye (infection deemed related to treatment)
Overall, >=15 letters (%) Improvement B: 13/42 (31%) D: 10/46 (22%) [P=0.46; i.e. non-significant]
>=15 letters (%) Worsening B: 0/42 (0%) D: 4/46 (9%) [P=??]
Macular thickness (CMT) Change from baseline B: -122 µm D: -187 µm P=0.015
Adverse events No treatment-related cases of retinal detachment or endophthalmitis in either group
IOP up 5 mmHg (any fup visit) 8 /42 (19%) 21/46 (46%) IOP up 10 mmHg(any fup visit) 0/42 (0%) 9/46 (20%) 12 eyes (dexameth group) demonstrated an IOP of > 25 mmHg at least once during follow-up visits. Eyes with increases in IOP were managed successfully with either observation or topical IOP-lowering medications
cataract up >2 grades(any fup) 2/42 (4.8%) 6/46 (13%) Cataract surgery 1/42 (2.4%) 3/46 (6.5%)
Systemic (B/D/B+D) worsening of hypertension [see definition above] B-only: 6.7% (1/15) D-only: 10.5% (2/19) B+D: 14.8% (4/27) of patients (B+D applies to patients with both eyes treated) Chest pain: 1/1/1 Angina: 0/1/0 MI: 0/0/1 Cong card failure: 0/0/3 Kidney failure: 0/1/0 |
Authors conclude that dexamethasone achieved similar rates of visual acuity improvement compared with bevacizumab with superior anatomic outcomes and fewer injections. However, more dexamethasone treated eyes lost vision, mainly because of cataract.
Note: 26/88 eyes (29.5%) were pseudophakic at baseline, 10 were treated with bevacizumab, 16 with dexamethasone; with similar results (mean change in BCVA for bevacizumab eyes, 7.7 letters; mean change in BCVA for dexamethasone-treated eyes, 10.4 letters; P = 0.47, t test for difference in BCVA change)
Note: only outcome assessors were blinded (but ROB unlikely for most outcome measures)
Note: sample size (power calculation) based on assuming as clinically significant an event rate in the order of 50% in one group compared with 20% in the second group >> minimum of 35 eyes per group required for 80% power at 2-sided 5% level. With loss to follow-up of 12% of eyes, we aimed to recruit a minimum of 40 eyes per group. >> a difference of 30% in event rate seem very large for a MCID
Note: it is well established that steroid-related cataract generally appears in the second year after commencing intravitreal steroid therapy; steroids may deliver better anatomic results (CMT reduction) than VEGF inhibitors, however, this did not translate to better VA outcomes; much lower treatment intensity required for dexamethasone implant (mean 2.7) was advantage over bevacizumab (mean 8.6); dexamethasone implant is not as easy to administer because it requires a 22-gauge needle; number of visits may not be much less because IOP needs to be checked; patients are likely to prefer fewer injections
Costs: both fewer injections and fewer visits with steroids must be weighed against the substantially greater cost of dexamethasone implant and cost and clinical consequences of cataract and its removal, which is more likely in eyes receiving steroids
Note: dexamethasone implant does not provide therapeutic effects for 6 months, therefore studies in which dexamethasone implant is given only 6-monthly should be avoided
Note: DME is a chronic disease that conceivably could require life-long treatment in some patients. RCT’s provide little to no information on these long-term outcomes. There is an urgent need for postmarketing observational studies and data linkage to track long-term outcomes in patients receiving treatment for DME
|
|
Update Virgil, 2018 – comparison of anti-VEGF versus alternative anti-VEGF |
|||||||
|
Vader, 2020 Schauwvlieghe, 2015
|
Noninferiority RCT
NCT01635790 NTR3247
Setting: Multicentre, 8 clinical centres in the Netherlands)
Source of funding: Non-commercial Netherlands Organisation for Health Research and Development (ZonMW) |
Inclusion criteria: >18 years; Diab type 1 or 2; Visual impairment due to DME in at least one eye, central area thickness on OCT >325 µM; ; BCVA letter score 78–24
June 2012 – February 2018
Important patient characteristics at baseline:
N=170 Bevacizumab (86) Ranibizumab (84)
B/R Mean age 63.9±11.6/64.9±11.6 47.6/30.5% women 88.1/85.5% t2 diab Mean dure diab 15.4±8.8/17.5±13.4 years
Mean VA letter 69.0±1.0/68.5±10.2
Mean central thickness 450.2 ±91.9/465.9±104.6 μm
Groups comparable at baseline? Yes, but there was a difference in gender between both treatment groups |
Describe intervention: Bevacizumab 1.25 mg Ranibizumab 0.5 mg
baseline and every month (30±7 days; up to 6 months)
Best-corrected VA was determined at every visit with OCT and clinical examination
Noninferiority margin of 3.5 letters
|
Comparison is: Bevacizumab 1.25 mg versus Ranibizumab 0.5 mg
|
End-point of follow-up: 6 month (follow-up visits every 30±7 days)
For how many participants were no complete outcome data available? Bevacizumab: 2 persons (1 withdrew consent, 1 did not meet inclusion criteria after all) Ranibizumab: 2 persons (1 withdrew consent, 1 without follow-up after baseline.
|
BCVA (cont); macular thickness (cont); adverse events (ocular; systemic); p-values; mean difference [90% CI]
BCVA (prim outcome) Best-corrected visual acuity
Change in central area thickness: Dilated ocular examination and spectral OCT. OCT values were converted to Heidelberg Spectralis for analysis and reporting.
Adverse events Any towards medication were coded (MedDRA)
Results: at 6 months follow-up
BCVA (Mean change from baseline) Overall, continuous B 1-month: 2.1±5.7 B 2-month: 3.8±5.2 B 3-month: 4.2±5.8 B 4-month: 4.6±6.7 B 5-month: 4.9±7.0 B 6-month: 4.9±6.7 R 1-month: 3.3±6.0 R 2-month: 5.1±6.6 R 3-month: 5.7±8.5 R 4-month: 5.8±8.8 R 5-month: 6.6±8.8 R 6-month: 6.7±8.7 Overall, >=15 letters (%) Stabilizers (<15 letters loss or gain (%)) B: 94.2 R: 86.9 Nonresponders (loss >= 15 letters) B: 0 R: 0 Gainers (gain >= 15 letters) B: 5.8 R: 13.1
Central area thickness Change from baseline, continuous (um) B 1-month: -49.8±76.6 B 2-month: -56.9±90.4 B 3-month: -66.2±96.7 B 4-month: -64.7±91.3 B 5-month: -67.5±97.4 B 6-month: -64.2±104.2 R 1-month: -86.0±111.5 R 2-month: -108.4±115.7 R 3-month: -107.6±116.6 R 4-month: -119.7±116.2 R 5-month: -132.0±114.7 R 6-month: -138.2±114.3
Adverse events Events occurring at least once no. of eyes (%) B/R Elevated intraocular pressure 1(1.2)/1(1.2) Anterior uveitis 1(1.2)/3(3.6) Retinal tear 0(0)/1(1.2) Hypertension 9(10.6)/15(18.1) Death from any cause 2(2.4)/0(0) Nonfatal myocardial infarction 0(0)/1(1.2) Nonfatal stroke 1(1.2)/0(0) Wound resulting from vascular problems 1(1.2)/2/(2.4) Transient ischemic attack 2(2.4)/0(0) Pneumonia 1(1.2)/1(1.2) Urosepsis 2(2.4)/1(1.2) |
Authors conclude that noninferiority of 1.25 mg bevacizumab to 0.5 mg ranibizumab was not confirmed. Only the subgroup of patients with a lower BCVA at baseline showed better visual acuity and anatomic outcomes with ranibizumab. But the study was not powered for subgroup analysis
Costs: Only ranibizumab is registered as treatment for macular edema, but bevacizumab is used off-label because its cost is 20- to 40-fold lower compared with to other drugs.
Power calculation: 123 per group based on group difference in VA 7, SD 11, alpha 0.05, and power of 80%. ROB: centralized randomization in permuted blocks with stratification according to study site and visual acuity (=<52 letters vs. =>53 letters), and central area thickness on spectral-domain OCT (=<400 mm or >400 mm). Study participants, investigator staff, and treating physicians were unaware of treatment allocation. |
|
Sahni, 2019
|
RCT; active comparator-controlled
NCT02699450
Setting: multicentre, 59 clinical sites in USA
Source of funding: Commercial. Roche participated in the study design; conducting the study; data collection, management, analysis, and interpretation;and preparation, review, and approval of the manuscript. |
Inclusion criteria: >=18 years; diab type 1 or 2; >=1 eye with BCVA of 73 (Snellen 20/40) to 24 (20/320); center-involved DME on clin exam and CST measured by OCT => 325 µm; no anti-VEGF treatment within previous 12 months, no high-risk proliferative DR, prior panretinal photocoagulation, macular laser photocoagulation within 3 months of the start of the study, any history of Iluvien or Ozurdex implants.
Patients with anti-VEGF treatment >3 months from start of the study were enrolled as a separate population.
April 2016-March 2017
Important patient characteristics at baseline:
N=166 0.3 mg Ranibizumab (59) 1.5 mg Farcimab (54) 6.0 mg Farcimab (53)
Mean age 62.6±9.0 53.6%- Male 78.3% white Mean dur diab 15.8±10.2 years Mean VA letter 60.8±10.6 Mean central subfield thickness 507.4±146.7 μm
Groups comparable at baseline? Yes |
Describe intervention:
0.3 mg Ranibizumab (59) 1.5 mg Farcimab (54) 6.0 mg Farcimab (53)
Injection volume 50 µl
baseline and every 4 weeks up to 36 weeks. Patients received injections every 4 weeks up to 24 weeks and were followed off treatment every 4 weeks from week 24 up to 36. Patients received a single dose of 0.3 mg ranibizumab and exited the study if BVCA decreased by 5 letters or CST increased by 50 µm.
Improvement = increase in VA >= 15 letters or decrease in central subfield thickness of 1 mm diameter.
|
Describe comparison: 0.3 mg Ranibizumab vs 1.5 mg Farcimab vs 6.0 mg Farcimab
|
End-point of follow-up: 36 weeks (follow-up visits every 4 weeks)
For how many participants were no complete outcome data available?
Anti- VEGF treatment naïve group:
Ranibizumab 0.3 mg: -Withdrawn 3.4% -Death 3.4% -Other 6.8% -Lost to follow-up 3.4% -Physiscian decision 3.4%
Faricimab 1.5 mg: -Withdrawn 1.9% -Death 1.9% -Other 5.6%
Faricimab 6.0 mg: -Withdrawn 3.8% -Death 1.9% -Other 5.7% -Lost to follow-up 5.7%
Previously anti-VEGF treated group:
Ranibizumab 0.3 mg: -Withdrawn 3.2% -Adverse event 3.2% -Lost to follow-up 3.2%
Faricimab 1.5 mg: -none 0%
Faricimab 6.0 mg: -Withdrawn 3.4% -Death 3.4% -Other 5.7% -Lost to follow-up 3.4%
|
BCVA improvement (cont; dich at >=10 and >=15 letters); decrease in mean CST from baseline (1-mm diameter); Diabetic Retinopathy Severity Scale (DRSS) score (improvement from baseline), durability of treatment effect, adverse events
Predefined subgroup analysis: Anti-VEGF naïve patients Previously treated anti-VEGF patients
BCVA (prim outcome) Early Treatment of Diabetic Retinopathy Study Visual Acuity Test
Central subfield thickness (CST) Measured with the Spectralis OCT device
Adverse events Safety outcome measures included incidence and severity of ocular and nonocular adverse events (AEs).
Results: at 24 weeks follow-up
BCVA (change from baseline) Overall, continuous Ranibizumab 0.3: 10.3 Farcimab 1.5: 11.7 Farcimab 6.0: 13.9 Overall, gaining >=10 letters (%) Ranibizumab 0.3: 59.2 Farcimab 1.5: 60.6 Farcimab 6.0: 72.1
Overall, gaining >=15 letters (%) Ranibizumab 0.3: 35.3 Farcimab 1.5: 36.0 Farcimab 6.0: 42.5
Subgroup previously treated with anti-VEGF Overall, continuous Ranibizumab 0.3: 8.3 Farcimab 6.0: 9.6 Overall, gaining >=10 letters (%) Ranibizumab 0.3: 43.4 Farcimab 6.0: 598
Overall, gaining >=15 letters (%) Ranibizumab 0.3: 16.8 Farcimab 6.0: 23.2
Macular thickness (CST) Change from baseline Ranibizumab 0.3: -204.7 Farcimab 1.5: -217.1 Farcimab 6.0: -225.8
Patients achieving CST =< 325 µm (%). Ranibizumab 0.3: 61.2 Farcimab 1.5: 63.3 Farcimab 6.0: 77.3
DRSS Score => 2 step improvement (%) Ranibizumab 0.3: 12.2 Farcimab 1.5: 27.7 Farcimab 6.0: 38.6
Subgroup previously treated with anti-VEGF Ranibizumab 0.3: -148 Farcimab 6.0: -186.6
Patients achieving CST =< 325 µm (%). Ranibizumab 0.3: 53.6 Farcimab 6.0: 87.0
DRSS Score => 2 step improvement (%) Ranibizumab 0.3: 23.1 Farcimab 6.0: 22.7
Adverse events Events occurring at least once Ranibizumab 0.3/Farcimab 1. 5/Farcimab 6.0 Patients (events) Study eye Cataract 2(2)/0(0)/3(3) Conjunctival hemorrhage 5(5)/2(2)/8(8) Diabetic retinal edema 2(2)/2(2)/0(0) Dry eye 1(1)/0(0)/4(4) Eye pain 2(2)/3(3)/2(2) Eye pruritus 3(3)/1(1)/1(1) Eyelid edema 0(0)/2(3)/0(0) Lacrimation increased 3(3/)0(0)/1(1) Retinal exudates 1(1)/3(3)/2(2) Vision blurred 1(1)/2(2)/1(2) Vitreous detachment 2(2)/3(3)/1(1) Vitreous floaters 2(2)/2(2)/2(2) Vitreous hemorrhage 3(4)/0(0)/0(0)
Fellow eye Cataract subcapsular 0(0)/2(2)/0(0) Conjunctival hemorrhage 3(3)/0(0)/0(0) Diabetic retinal edema 2(2)/2(2)/5(5) Dry eye 2(2)/0(0)/3(3) Retinal exudates 1(1)/2(2)/1(1) Vision blurred 1(1)/2(2)/2(3) |
Authors conclude that faricimab demonstrated statistically superior visual acuity gains versus ranibizumab at week 24 in treatment-naïve patients. Central subfield thickness results support the primary outcome.
Power calculation: Assuming a SD of 11 ETDRS letters and a dropout rate of 10%, the sample size provided approximately an 80% power to detect a true difference of 5 ETDRS letters at the 1-sided α level of 10%..
ROB: Patients were randomized through the IxRS interactive voice and web responsesystem.Randomization was stratified based on baseline BCVA (ETDRS letter score, 64 letters or better vs. 63 letters or worse), previous macular laser treatment status, and previous intravitreal anti-VEGF treatment in the study eye. |
|
Fouda, 2017 |
Randomized prospective study
Setting: 1 Centre, Egypt
Source of funding: Not mentioned |
Inclusion criteria: diab type 1 or 2; >=1 eye with BCVA ranged from 0.1 to 0.25; edema affecting the central 1 mm of the macula (measured by OCT)
Exclusion criteria: vascular retinal disorders other than diabetic retinopathy; previous intravitreal injections of any agents, previous intraocular surgery, previous laser treatment. Proliferative diabetic retinopathy. BVCA <0.1 or >0.25; Edema not affecting the central 1mm.
Important patient characteristics at baseline:
N=70 Aflibercept (35) Ranibizumab (35) A/R Mean age 55.05±4.7/56.64±5.8 Groups comparable at baseline? Yes |
Describe intervention:
2 mg/0.05 mL aflibercept 0.5 mg/0.1 mL ranibizumab
Injections were given at baseline and then every 1 month for three intravitreal injections as a loading dose. Anti-VEGF was re-injected if the macular edema was persistent or if the visual acuity or the CMT worsened.
Follow-up monthly for 12 months after the last injection of the loading dose.
Improvement or worsening of macular edema was defined as a 10% change of CMT in comparison with last visit while 0.1 change of visual acuity in comparison with last visit was considered a significant change.
|
Describe comparison 2 mg/0.05 mL aflibercept 0.5 mg/0.1 mL ranibizumab
|
End-point of follow-up: 12 months (follow-up visits every month)
For how many participants were no complete outcome data available? No mention of missing data or loss to follow-up
|
BCVA improvement (cont); mean CMT from baseline (cont); number of reinjections
BCVA (prim outcome) Early Treatment of Diabetic Retinopathy Study Visual Acuity Test
Central macular thickness (CMT) Measured with the Spectralis OCT device
Results: at 1 follow-up
BCVA (change from baseline) Overall, continuous (Snellen decimal) Aflibercept - Baseline: 0.17±0.05 Aflibercept - 1 month: 0.39±0.21 Aflibercept - 3 month: 0.35±0.2 Aflibercept - 6 month: 0.37±0.24 Aflibercept - 12 month: 0.42±0.28
Ranibizumab - Baseline: 0.18±0.04 Ranibizumab - 1 month: 0.34±0.19 Ranibizumab - 3 month: 0.33±0.19 Ranibizumab - 6 month: 0.41±0.19 Ranibizumab - 12 month: 0.37±0.23
Macular thickness (CST) Overall, continuous (µm) Aflibercept - Baseline: 465.29±33.7 Aflibercept - 1 month: 365.4±72.2 Aflibercept - 3 month: 370.54±83.6 Aflibercept - 6 month: 391.7±85.8 Aflibercept - 12 month: 360.8±85.7
Ranibizumab - Baseline: 465.29±33.7 Ranibizumab - 1 month: 388.06±77.3 Ranibizumab - 3 month: 394.3±84.8 Ranibizumab - 6 month: 360.1±74.4 Ranibizumab - 12 month: 387.3±87.8
Drug re-injection Aflibercept reinjected 2 to 5 times with an average of 2.62±0.68. Ranibizumab reinjected 2 to 6 times with an average of 3.03±0.95.
|
Authors conclude that both aflibercept and ranibizumab improve visual acuity and decrease CMT in eyes with DME and moderate visual loss with no difference between the two drugs. Power calculation: No power calculation
ROB: No description of randimization |
|
Wells, 2016a |
Post hoc exploratory analyses of randomized trial data
NCT01627249.
August 22, 2012 - August 28, 2013
Setting: multicentre, 89 clinical sites in USA
Source of funding: Non-commercial (NIH); manufacturers provided aflibercept and ranibizumab, DRCR.net purchased bevacizumab
|
Inclusion criteria: >=18 years; >=1 eye with BCVA of 78 (Snellen 20/23) to 24 (20/320); CST measured by OCT => 250 µm;
Important patient characteristics at baseline: A=aflibercept, B=bevacizumab R=ranibizumab
N=660 CST>400, Letter score 69-78; A = Mean letter score 73.2; Mean CST 499 µm B=Mean letter score 72.4; Mean CST 471 µm R=Mean letter score 72.8; Mean CST 479 µm CST<400, Letter score 69-78; n=141 A = Mean letter score 73.6; Mean CST 317 µm B=Mean letter score 73.0; Mean CST 318 µm R=Mean letter score 73.7; Mean CST 314 µm CST>400, Letter score <69; n=172 A = Mean letter score 54.9; Mean CST 543 µm B=Mean letter score 55.6; Mean CST 558 µm R=Mean letter score 55.5; Mean CST 540 µm CST<400, Letter score <69; n=118 A = Mean letter score 59.0; Mean CST 327 µm B=Mean letter score 59.4; Mean CST 323 µm R=Mean letter score 57.7; Mean CST 320 µm
Groups comparable at baseline? Yes |
Describe intervention: 0.05-mL intravitreous injections of 2.0mg of aflibercept (n = 224), 1.25 mg of bevacizumab (n = 218), or 0.3 mg of ranibizumab (n = 218)
Injections were given at baseline and 4weeks. Subsequent injections were performed every 4 weeks unless: (1) before the 24-week visit, VA letter score was 84 or more (20/20 or better) with CST <250 μm (by OCT), no improvement from the last 2 injections, referred to as treatment success, or (2) starting at the 24-week visit, no improvement and no worsening after 2 consecutive injections. Improvement = a gain of at least 5 letters or at least a 10% reduction in CST
at or after the 24-week visit, focal/grid photocoagulation was added if thickened areas to treat within the macula; if the CST => 250 μm; edema threatening the fovea and VA; CST did not improve from the last 2 consecutive injections. Retreatment with focal/grid photocoagulation was performed unless (1) < 13weeks since previous treatment . (2) complete treatment with focal/grid photocoagulation performed (3) the CST was <250 μm and no edema threatening the fovea (4) the eye had improved since the last treatment. |
Describe comparison: Alternative intervention: A vs B; A vs R; R vs B
A=Aflibercept B=Bevacizumab R=Ranibizumab
|
End-point of follow-up: 52 weeks (follow-up visits every 4 weeks)
For how many participants were no complete outcome data available? No mention of loss to follow up. 8 eyes had missing baseline CST
|
BCVA improvement (cont; dich at >=5, >=10 and >=15 letters); decrease in mean CST from baseline (con);
Predefined subgroup analysis: CST>400 µm, Letter score 69-78 CST<400 µm, Letter score 69-78 CST>400 µm, Letter score <69 CST<400 µm, Letter score <69
BCVA (prim outcome) using Electronic Early Treatment of Diabetic Retinopathy Study Visual Acuity Test
Macular thickness (CST) Dilated ocular examination and spectral or time-domain OCT (97% and 3% of scans, resp). OCT values were converted to time-domain–equivalent values for analysis and reporting.
Adverse events Any untoward medical occurrence, regardless of whether the event was considered to be related to treatment; coded (MedDRA)
Results: at 1 year follow up
A=aflibercept, B=bevacizumab R=ranibizumab
BCVA (change from baseline) Baseline visual acuity 20/50 or worse (letter score <69) CST >= 400 µm/CST < 400 µm, continuous A vs B: 8.1 (4.9 ;11.3)/5.7 (1.8;9.7) A vs R: 4.5 (1.2;7.8)/4.7 (0.9;8.4) R vs B: 3.6 (0.3;7.0)/1.1 (−2.7;4.8)
Overall, gaining >=5 letters (%) CST >= 400 µm /CST < 400 µm A vs B: 16(3;28)/9(−8;26) A vs R: 5(−7;17)/3(−11;18) R vs B: 11(−4;25)/6(−11;23) Overall, gaining >=10 letters (%) CST >= 400 µm /CST < 400 µm A vs B: 23(8;38/9(−11;30) A vs R: 10(−5;25)/2(−17;21) R vs B: 14(−3;31)/7(−13;28) Overall, gaining >=15 letters (%) CST >= 400 µm /CST < 400 µm A vs B: 30(14;45)/20(−1;41) A vs R: 20(3;37)/13(−7;33) R vs B: 10(−8;27)/7(−13;27)
Baseline visual acuity 20/32-20/40 (letter score 78-69) CST >= 400 µm/CST < 400 µm, continuous A vs B: 3.7 (−0.8;8.1)/−1.0 (−3.9;1.9) A vs R: 0.2 (−3.8 to 4.3)/−0.4 (−3.5 to 2.7) R vs B: 3.4 (−0.8 to 7.6)/−0.6 (−3.7 to 2.4)
Overall, gaining >=5 letters (%) CST >= 400 µm /CST < 400 µm A vs B: 35(15;56)/−4(−19;11) A vs R: 13(−4;29)/−8(−23;7) R vs B: 23(1;44)/4(−11 ;19) Overall, gaining >=10 letters (%) CST >= 400 µm /CST < 400 µm A vs B: 32(8;55)/−4(−20;12) A vs R: 7(−15;30)/0(−16;16) R vs B: 25(2;47)/−4(−21;12) Overall, gaining >=15 letters (%) CST >= 400 µm /CST < 400 µm A vs B: 11(−7;29)/−1(−12;10) A vs R: 6(−14 to 25)/3(−6 to 13) R vs B: 6(−10 to 22)/−4(−15;6)
Macular thickness (CST) Baseline visual acuity 20/50 or worse (letter score <69) CST >= 400 µm/CST < 400 µm, continuous A vs B: −123 (−155;−91)/−31 (−70;8) A vs R: −24 (−57;10)/−7 (−45;30) R vs B: −99 (−133;−66)/−24 (−61;14)
Baseline visual acuity 20/32-20/40 (letter score78-69) CST >= 400 µm/CST < 400 µm, continuous A vs B: −112 (−157;−68)/−32 (−61;−3) A vs R: −22 (−63;19)/−20 (−51;11) R vs B: −90 (−132 ;48)/−12(−43;19)
|
Authors conclude that that for eyes with better initial VA and thicker CST, some VA outcomes may be worse in the bevacizumab group than in the aflibercept and ranibizumab groups.
Note: caution is suggested when interpreting the data given the exploratory nature of analyses and the small sample sizes.
Power calculation: Difference in VA of 4, SD 11.4, alpha 0.05, loss to follow-up of 7.5% and power of 90%.
ROB: One eye of each participant in a 1:1:1 ratio. Randomization in permuted blocks and with stratification according to study site and visual acuity in the study eye. |
|
Wells, 2016b |
RCT; parallel design
NCT01627249
Setting: multicentre, 89 clinical sites in USA
Source of funding: Non-commercial (NIH); manufacturers provided aflibercept and ranibizumab, DRCR.net purchased bevacizumab
|
Inclusion criteria: >=18 years; diab type 1 or 2; >=1 eye with BCVA of 78 (Snellen 20/32) to 24 (20/320); center-involved DME on clin exam and OCT (protocol-defined Thresholds); no anti-VEGF treatment within previous 12 months
Aug 2012-Aug 2013
Important patient characteristics at baseline:
N=660 aflibercept (224) bevacizumab (218) ranibizumab (218)
Mean age 61±10 47% women 65% white 90% t2 diab Mean dur diab 17±11 years Mean VA letter 64.8±11.3 (Snellen 20/50) Mean central subfield thickness 412±130 μm
Groups comparable at baseline? Yes |
Describe intervention:
Aflibercept 2.0 mg (224) Bevacizumab 1.25 mg 218 Ranibizumab 0.3 mg (218)
Injection volume 0.05 ml
baseline and every 4 weeks unless visual acuity >= 20/20 with central subfield thickness below eligibility threshold and no improvement or worsening in response to past two injections.
Improvement = increase in VA >= 5 letters or decrease in central subfield thickness of >= 10% Worsening = decrease in VA >= 5 letters or increase in central subfield thickness of >= 10%
Starting at 24-week visit, irrespective of VA and central subfield thickness, injection was withheld if no improvement or worsening after two consecutive injections
Laser photocoagulation therapy (focal, grid, or both) was initiated at or after the 24-week visit for persistent diabetic macular edema, defined on the basis of protocol-specified criteria.
Treatment for diabetic macular edema other than the randomly assigned anti-VEGF agent or laser therapy was permitted if a study eye met the criteria for treatment failure. |
Describe comparison: Alternative intervention: A vs B; A vs R; R vs B
A=Aflibercept B=Bevacizumab R=Ranibizumab Number injections median (IQR) aflibercept: 15 (11-17) bevacizumab: 16 (12-20) ranibizumab: 15 (11-19)
Laser (focal and/or grid) >=1 between 24-48 weeks Aflibercept: 41% Bevacizumab: 64% Ranibizumab: 52%
|
End-point of follow-up: End-point of follow-up: 2 year (follow-up visits every 4 weeks during the first year and every 4 to 16 weeks during the second year)
For how many participants were no complete outcome data available? follow up visits were completed for
A=90% B=85% C=88%
Overall 6-7% Death/Dropped/Missed Aflibercept: 3/12/1 Bevacizumab: 5/6/1 Ranibizumab: 3/9/0
ITT analysis with multiple imputation (mITT)
|
BCVA improvement (cont; dich at >=10 and >=15 letters); decrease in macular thickness (cont; % with CST<250 μm); adverse events (ocular; systemic); mean difference [95% CI]
Predefined subgroup analysis: Subgroup-1 VA >= 20/50 Subgroup-2 VA 20/32-20/40
BCVA (prim outcome) using Electronic Early Treatment of Diabetic Retinopathy Study Visual Acuity Test
Macular thickness (CST) Dilated ocular examination and spectral or time-domain OCT (97% and 3% of scans, resp). OCT values were converted to time-domain–equivalent values for analysis and reporting.
Adverse events Any untoward medical occurrence, regardless of whether the event was considered to be related to treatment; coded (MedDRA)
Results: at 2 year follow up
BCVA (change from baseline) Overall, continuous A-B: 1.1 [-1.1;3.4] A-R: -0.7 [-2.9;1.5] R-B: 1.9 [-0.9;4.7] Overall, >=15 letters (%) Improvement A-B: 1 [-10;11] A-R: 2 [-8;11] R-B: -1 [-11;10] Worsening A-B: 1 [-3;5] A-R: 2 [-2;5] R-B: -1 [-4;3]
Subgroup-1, continuous A-B: 4.7 [0.5;8.8] A-R: 2.3 [-1.1;5.6] R-B: 2.4 [--1.0;5.8] Subgroup-1, >=15 letters Improvement A-B: 1 [-10;11] A-R: 2 [-8;11] R-B: -1 [-11;10] Worsening A-B: 1 [-3;5] A-R: 2 [-2;5] R-B: -1 [-4;3] Subgroup-1, >=10 letters Improvement A-B: 10 [-6;26] A-R: 3 [-9;15] R-B: 7 [-6;20] Worsening A-B: -3 [-10;3] A-R: 2 [-3;7] R-B: -5 [-13;3]
Subgroup-2, continuous A-B: 1.1 [-1.1;3.4] A-R: -0.7 [-2.9;1.5] R-B: 1.9 [-0.9;4.7] Subgroup-2, >=15 letters Improvement A-B: 1 [-10;11] A-R: 2 [-8;11] R-B: -1 [-11;10] Worsening A-B: 1 [-3;5] A-R: 2 [-2;5] R-B: -1 [-4;3] Subgroup-2, >=10 letters Improvement A-B: 9 [-7;25] A-R: 4 [-10;17] R-B: 5 [-8;19] Worsening A-B: 0 [-6;5] A-R: 3 [-3;8] R-B: -3 [-8;3]
Macular thickness (CST) Change from baseline Subgroup-1, continuous (um) A-B: -42.1 [-77.2;-7] A-R: -19.3 [-47;8.3] R-B: -22.8 [-52.2;6.6] Subgroup-1, <250 μm (%) A-B: 31 [14;47] A-R: 12 [-1;25] R-B: 19 [2;35]
Subgroup-2, continuous (um) A-B: -57.3 [-82.7;-31.9] A-R: -11.8 [-32.4;8.8] R-B: -45.4 [-69.6;-21.3] Subgroup-2, <250 μm (%) A-B: 33 [17;49] A-R: -2 [-12;15] R-B: 32 [16;47]
Adverse events Events occurring at least once A/B/R Ocular no. of eyes (%) Endophthalmitis 0(0)/1(<1)/0(0) Inflammation 6(3)/3(1)/4(3) Ret detach or tear 2(<1)/2(<1)/1(<1) Vitr hemorr 15(7)/17(8)/10(5) Cataract 3(1)/2(<1)/0(0) Elev IOP 39(17)/27(12)/35(16)
Systemic No. of participants (%) Nonfatal MI 7(3)/3(1)/6(3) Nonfatal stroke 2(<1)/6(3)/11(5) Death any cause 5(2)/13(6)/11(5) Hospital 77(34)/71(33)/73(33) Serious AE 88(39)/81(37)/82(38) Gastroint event 67(30)/64(29)/60(28) Renal event 50(22)/46(21)/35(16) Hypert 39(17)/27(12)/44(20)
|
Authors conclude that aflibercept, bevacizumab, and ranibizumab all had visual acuity improvement at 2 years. VA outcomes were similar among treatment groups for eyes with baseline 20/32-20/40. Among eyes with worse baseline VA, aflibercept, on average had superior 2-year VA outcomes compared with bevacizumab, but superiority of aflibercept over ranibizumab. Noted at 1 year was no longer identified.
ROB: centralized randomization in permuted blocks with stratification according to study site and visual acuity in the study eye; Study participants, reading-center graders, medical monitor (AEs), VA and OCT technicians were unaware of treatment-group assignments; investigators and study coordinators were aware of the treatment group assignments |
- Table of quality assessment for systematic reviews of RCTs and observational studies
Research question: what is the optimal treatment of diabetic macular edema?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Virgili 2014 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes*1 |
Yes*1 |
Yes*1 |
|
Ford 2013 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes*2 |
Yes*2 |
|
Virgili 2018 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Reibaldi, 2020 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Thulliez, 2018 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Sun, 2020 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Unclear*3 |
Yes*4 |
No |
Yes |
*1 for some comparisons there was considerable heterogeneity (noted in the text); reporting bias analysed, publication bias could not be assessed because of low number of studies; number of studies was too low to perform a sensitivity analysis excluding industry-funded studies
*2 reporting bias analysed, publication bias could not be assessed because of low number of studies; number of studies was too low to perform a sensitivity analysis excluding industry-funded studies
*3 Mentions use of Cochrane Collaboration’s tool, but does not report any outcome of study quality or bias.
*4 Pools 7 observational studies with on RCT.
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
- Risk of bias table for intervention studies (randomized controlled trials)
Research question: What is the optimal treatment for diabetic macular edema?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
DRCRN 2015 |
centralized randomization in permuted blocks |
Unlikely |
Unlikely*1 |
Unlikely*1 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Gillies 2014 |
centralized randomization in permuted blocks |
Unlikely |
Unlikely*2 |
Unlikely*2 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
DRCRN 2010,2011 |
centralized randomization in permuted blocks |
Unlikely |
Unlikely*3 |
Unlikely*3 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Lim 2012 |
computer-generated randomization in permuted blocks |
Unlikely |
Unlikely*4 |
Unclear*4 |
Unlikely |
Unlikely |
Unclear*4 |
Unclear*4 |
|
Vader, 2020 Schauwvlieghe, 2015
|
centralized randomization in permuted blocks |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Sahni, 2019 |
Randomized through the IxRS interactive voice and web response system stratified on baseline BCVA, previous macular laser treatment status, and previous intravitreal anti-VEGF treatment in the study eye |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Fouda, 2017 |
Randomly divided into two groups*1 |
Unclear*5 |
Unclear*5 |
Unclear*5 |
Unclear*5 |
Unlikely |
Unlikely |
Unlikely |
|
Wells 2016a |
centralized randomization in permuted blocks |
Unlikely*1 |
Unlikely*1 |
Unclear |
Unlikely |
Unlikely |
Unclear |
Unlikely |
|
Wells 2016b |
centralized randomization in permuted blocks |
Unlikely*1 |
Unlikely*1 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
*1 Study participants may become unmasked to their treatment group assignment when discussing non-study eye anti-VEGF treatment, but ROB is judged to be low for primary outcome (VA); investigators not masked to treatment group assignment, but ROB judged to be low for primary outcome (VA); all outcome assessors were blinded
*2 Patients and care providers not blinded, but ROB for primary outcome (BCVA improvement with >= 10 ETDRS letters) and secondary outcomes (except patient-reported Impact of Vision Imparement) unlikely; outcome assessors were blinded
*3 Participants were blinded in year-1, but participants may become unmasked to their treatment group assignment when discussing non-study eye anti-VEGF treatment, in year-2 participants were no longer blinded to treatment allocation (‘expanded followup’), ROB is judged to be low for primary outcome (VA); investigators not masked to treatment group assignment, but ROB judged to be low for primary outcome (VA); all outcome assessors were blinded
*4 Patients and care providers not blinded, but ROB for primary outcome (BCVA and CMT) unlikely; outcome assessors and statisticians performing data analysis were blinded; loss to followup (7.5%) not specified per intervention, no imputation of missing values
*5 Randomization process not specified, no mention of blinding of participants, care providers or outcome assessors.
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Zoekactie-1: systematische reviews - 26 exclusies |
|
|
Scottish Med Consortium 2014 |
Geen SR of origineel onderzoek |
|
Mitchell 2014 |
SR van matige kwaliteit; tot juli 2013; voegt niets toe aan Virgili 2013 of Ford 2012 |
|
Regnier 2014 |
SR van goede kwaliteit; tot feb 2014; voegt niets toe aan Virgili 2013 / DRCRN 2015 |
|
Stefanini 2014 |
Narrative review |
|
Yanagida 2014 |
SR van goede kwaliteit; tot mei 2013; safety ranibizumab; voegt weinig toe aan Virgili 2014 |
|
Abouammoh 2013 |
SR van goede kwaliteit; tot maart 2012; safety ranibizumab; voegt weinig toe aan Virgili 2014 |
|
Evoy 2013 |
SR van matige kwaliteit; tot feb 2013; voegt niets toe aan Virgili 2013 |
|
Fortin 2013 |
Verkorte versie van Fortin 2012 |
|
Fortin 2012 |
SR van zeer goede kwaliteit; tot juli 2012; voegt weinig toe aan Virgili 2014 |
|
Gupta 2013 |
Geen antw op uitgangsvraag; narrative review |
|
Jorge 2013 |
Cochrane protocol |
|
Ollendorf 2013 |
SR; tot juni 2012; voegt weinig toe aan Virgili 2014 |
|
Zhang 2013 |
SR van goede kwaliteit; tot jan 2013; voegt weinig toe aan Ford 2013 |
|
Ford 2012 |
SR van goede kwaliteit; tot sept 2011; voegt weinig toe aan Virgili 2014 |
|
Ho 2012 |
SR; geen meta-analyse; tot sept 2011; voegt niets toe aan Virgili 2014 |
|
Qi 2012 |
Verkeerde PICO |
|
Virgili 2012 |
Zie update (Virgili 2014) |
|
Wang 2012 |
SR van goede kwaliteit; tot aug 2011; voegt niets toe aan Virgili 2014 |
|
Zechmeister-Koss 2012 |
SR van goede kwaliteit; tot jan 2011; voegt niets toe aan Virgili 2014 |
|
DRCRN 2011 |
Verkeerde PICO (DRCRN studies maken deel uit van Virgili 2014) |
|
Goyal 2011 |
SR; meta-analyse; tot juli 2009; voegt niets toe aan Virgili 2014 |
|
Yilmaz 2011 |
SR; meta-analyse; tot dec 2009; voegt niets toe aan Virgili 2014 / Ford 2013 |
|
Karim 2010 |
SR; meta-analyse; tot okt 2008; voegt niets toe aan Virgili 2014 |
|
Rudnisky 2009 |
SR; meta-analyse; tot sept 2008; triamcinolone versus laser; voegt niets toe aan Ford 2013 |
|
Yilmaz 2009 |
SR; meta-analyse; tot sept 2008; voegt niets toe aan Ford 2013 |
|
Grover 2008 |
Cochrane SR; tot juni 2007; voegt niets toe aan Ford 2013 |
|
Zoekactie-2: update van Virgili 2014 (selectiecriteria Virgili 2014; relevante vergelijkingen) |
|
|
Ali 2014 |
Verkeerde PICO (uitkomstmaat); intraoculaire druk |
|
Avery 2014 |
Verkeerde PICO (uitkomstmaat); geen RCT |
|
Bandello 2014 |
Geen RCT maar narrative review |
|
Bhayana 2014 |
Verkeerde PICO |
|
Boyer 2014 |
Verkeerde PICO |
|
Bressler 2014 |
Verkeerde PICO (uitkomstmaat) |
|
Chen 2014 |
SR en meta-analyse; tot juni 2014; voegt niets toe aan Virgili 2014 |
|
Cheung 2014 |
Geen RCT maar narrative review |
|
Chew 2014 |
Verkeerde PICO |
|
Ciulla 2014 |
Geen RCT maar narrative review |
|
Comyn 2014 |
Geincludeerd in Virgili 2014 |
|
Cunha-Vaz 2014 |
Verkeerde PICO |
|
Domalpally 2015 |
Verkeerde PICO |
|
Ekinci 2014 |
Geincludeerd in Virgili 2014 |
|
Elman 2015 |
Verkeerde PICO (verkeerde vergelijking) |
|
Gillies 2014 |
Verkeerde PICO |
|
Jeon 2014 |
Verkeerde PICO (uitkomstmaat) |
|
Jampol 2014 |
Geen RCT maar narrative review |
|
Jeon 2014 |
Verkeerde PICO (niet vergelijkend); Geen RCT |
|
Korobelnik 2014 |
Geincludeerd in Virgili 2014 |
|
Kriechbaum 2014 |
Verkeerde PICO |
|
Lazic 2014 |
Verkeerde PICO (verkeerde interventie; niet vergelijkend); geen RCT |
|
Liu 2015 |
Verkeerde PICO (verkeerde vergelijking voor Virgilli 2014); geen RCT |
|
Liu 2014 |
Geen RCT maar SR (tot November 2013); verkeerde PICO |
|
Liu 2014 |
Geen RCT maar SR (tot November 2013) |
|
Massin 2014 |
Verkeerde PICO |
|
Mathew 2014 |
Verkeerde PICO (verkeerde interventie; niet vergelijkend); geen RCT |
|
Mitchell 2014 |
Geen RCT maar internationale richtlijn (SR tot Juli 2013) |
|
Othman 2014 |
Verkeerde PICO (verkeerde interventie; niet vergelijkend); geen RCT |
|
Patelli 2014 |
Geen RCT maar review |
|
Regnier 2014 |
Geen RCT maar SR (zie eerder) |
|
Romero-Aroca 2014 |
Geen RCT maar SR |
|
Schmidt-Erfurth 2014 |
Geincludeerd in Virgili 2014 |
|
Simunovic 2014 |
Verkeerde PICO; geen RCT |
|
Stewart 2014 |
Geen RCT maar narrative review |
|
Suner 2014 |
Verkeerde PICO |
|
Takamura 2014 |
Verkeerde PICO |
|
Tao 2014 |
Geen RCT maar SR; verkeerde PICO |
|
Thulliez 2014 |
Verkeerde PICO (patientenpopulatie) |
|
Virgili 2014 |
Basis SR (al geselecteerd) |
|
Virgili 2014 |
Dubbele referentie; basis SR (al geselecteerd) |
|
Xu 2014 |
Verkeerde PICO |
|
Yanagida 2014 |
Geen RCT maar SR (zie eerder) |
|
Zoekactie-3: update van Ford 2013 – 34 exclusies (selectiecriteria Ford 2013; relevante vergelijkingen) |
|
|
Arevalo 2014 |
Geen RCT maar narrative review |
|
Azad 2012 |
Single injection |
|
Bandello 2014 |
Geen RCT maar narrative review |
|
Bhayana 2014 |
Aantal ogen per studiearm lager dan 25 |
|
Boyer 2014 |
Verkeerde PICO (vergelijking) |
|
Bressler 2013 |
Verkeerde PICO (vergelijking) |
|
Callanan 2013 |
Verkeerde PICO (vergelijking) |
|
Campochiaro 2012 |
Verkeerde PICO (vergelijking) |
|
Cho 2012 |
Verkeerde PICO (vergelijking) |
|
Ciulla 2014 |
Geen RCT maar narrative review |
|
Comyn 2013 |
Geen RCT maar narrative review |
|
Cunha-Vaz 2014 |
Verkeerde PICO (vergelijking) |
|
Dempe 2012 |
Verkeerde PICO (vergelijking) |
|
Dewan 2012 |
Verkeerde PICO (uitkomstmaat en vergelijking) |
|
Doi 2012 |
Verkeerde PICO (interventie) |
|
Hooper 2012 |
Geen RCT maar internationale richtlijn |
|
Isaac 2012 |
Single injection |
|
Jeon 2014 |
Verkeerde PICO (niet vergelijkend) |
|
Kiernan 2012 |
Geen RCT maar narrative review |
|
Kriechbaum 2014 |
Aantal ogen per studiearm lager dan 25 |
|
Kriechbaum 2014 |
Dubbele referentie |
|
Lazic 2014 |
Geen RCT; niet vergelijkend |
|
Lim 2012 |
Geincludeerd in Ford 2013 |
|
Liu 2015 |
Geen RCT maar case series |
|
Liu 2014 |
Verkeerde PICO (vergelijking); geen RCT maar SR |
|
Messenger 2013 |
Geen RCT maar narrative review |
|
Othman 2014 |
Verkeerde PICO (niet vergelijkend); geen RCT |
|
Shoeibi 2013 |
Verkeerde PICO (vergelijking) |
|
Simunovic 2014 |
Verkeerde PICO (interventie); geen RCT maar SR |
|
Smiddy 2012 |
Verkeerde PICO (uitkomstmaat); geen RCT |
|
Soheilian 2012 |
Verkeerde PICO (vergelijking) |
|
Stein 2013 |
Verkeerde PICO (uitkomstmaat); geen RCT |
|
Virgili 2014 |
Verkeerde PICO (vergelijking) |
|
Xu 2012 |
Verkeerde PICO (vergelijking); geen RCT maar SR |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 20-01-2023
Laatst geautoriseerd : 20-01-2023
Geplande herbeoordeling :
Geldigheid en Onderhoud
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Behandeling van diabetisch macula oedeem |
NIV en NOG |
2017 |
2019 |
Jaarlijks |
[NIV, NOG of de werkgroep] |
lopend onderzoek, beschikbaarheid nieuwe middelen, wijzigingen in vergoeding |
|
Update (sept 2020)
Anti-VEGF |
NIV en NOG |
2021 |
2023 |
Jaarlijks |
Cluster diabetes |
lopend onderzoek, beschikbaarheid nieuwe middelen, wijzigingen in vergoeding |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Voor wie is de richtlijn bedoeld?
Deze richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de zorg voor patiënten met DR.
Voor patiënten
Een ander woord voor diabetes mellitus is suikerziekte. Als iemand diabetes mellitus heeft, kan het lichaam de bloedsuiker niet goed zelf regelen. DR is beschadiging van het netvlies van de ogen en is een veelvoorkomende oorzaak van blindheid en slechtziendheid bij volwassenen in de leeftijd tussen de 30 en de 65 jaar.
Samenstelling werkgroep
Werkgroep
- Dr. M.V. (Manon) van Hecke, oogarts, Elisabeth-Tweesteden ziekenhuis, Tilburg; Nederlands Oogheelkundig Gezelschap (NOG)
- S.M.J. (Sandra) Smeets, (kinder)oogarts, VieCuri medisch centrum, Venlo; Nederlands Oogheelkundig Gezelschap (NOG)
- Dr. Y. (Yvonne) de Jong-Hesse, oogarts, Leids Universitair Medisch Centrum (LUMC), Leiden; Nederlands Oogheelkundig Gezelschap (NOG)
- Dr. P.A. (Peter) Grootenhuis, kaderhuisarts diabetes, Huisartsenpraktijk Grootenhuis, Hoorn; Nederlands Huisartsen Genootschap (NHG, DiHAG)
- M.P. (Marianne) den Breejen, kinderarts, Diabeter, Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- G. (Gabriëlle) Janssen, optometrist, Oogklasse, Amsterdam; Optometristen Vereniging Nederland (OVN)
- H.J. (Anneke) Jansen Molenaar, adviseur oogzorg (patiëntvertegenwoordiger), Oogvereniging, Utrecht
Klankbordgroep
- P.J.H.M (Pauline) Stouthart, Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- T.M. (Ties) Obers, Diabetesvereniging Nederland (DVN)
- J.M. (Marieke) van Haren-Loezmans, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- R.M. (Richard) Posthuma, Nederlandse Vereniging van ZiekenhuisApothekers (NVZA)
- A.M. (Aisha) Salarbaks, Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
- S.C. (Sue) Holleman, Verpleegkundigen & Verzorgenden Nederland (V&VN), afdeling Diabeteszorg
- M.W.F. (Martin) van Leen, Verenso
- Dr. ir. C.H.L. (Chris) Peters, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. E.H. (Erik) Serné, Nederlandse Internisten Vereniging (NIV)
Met ondersteuning van:
- Dr. K.N.J. (Koert) Burger, epidemioloog, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.N. (Anh Nhi) Nguyen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.M.A. (Maxime) Verhoeven, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.J. (Bart) Versteeg, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar (d.w.z. voor start van het traject) directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van Hecke (voorzitter) |
Oogarts ETZ |
werkgroep geneesmiddelen FMS onbetaald; werkgroep horizonscan geneesmiddelen ZiNL onbetaald; werkgroep intramurale geneesmiddelen ETZ, onbetaald; externe adviseur oogheelkundige geneesmiddelen CBG, betaald; jan 2019: praatje medische retina symposium: laser bij DR; eenmalig betaald door Bayer; dec 2019: E-learning gemaakt naar fluids bij AMD, eenmalig betaald door Novartis |
Geen |
Geen |
|
Smeets |
Oogarts: Viecuri Venlo |
Werkgroep kinderoogheelkunde - onbetaald Werkgroep strabologie - onbetaald. |
Geen |
Geen |
|
De Jong – Hesse |
Oogarts, Amsterdam UMC, locatie VUMC |
sinds jan 2019: voorzitter adviescommissie macula van het Oogfonds (onbetaald); t/m 2019: bestuurslid maculafonds (onbetaald); bestuurslid werkgroep Medische Retina (onbetaald) |
2017/2018: tijdelijke overeenkomsten van dienstverlening met Novartis Pharma voor geven van presentaties/ redigeren van teksten
|
Geen trekker bij vragen m.b.t. antiVEGF |
|
Grootenhuis |
Huisarts, praktijkhouder Huisartsopleider VUMC Kaderhuisarts diabetes, THOON |
Lid wetenschappelijke Adviesraad Geneesmiddelen Bulletin. |
Geen |
Geen |
|
Den Breejen |
Kinderarts bij Diabeter Nederland |
Geen |
Geen |
Geen
|
|
Janssen |
Optometrist en bedrijfskundige. ’ZZP Werkzaamheden bestaan uit: Organisatie congressen en scholingen voor optometristen (0,18 fte) Optometrist (0,2 fte) Adviseur taakhetrschikking optometrie Hoofdredacteur vakblad optometrie (0,1 fte) |
Voorzitter Optometristen Vereniging Nederland – betaald (0,2 fte) |
Geen |
Geen |
|
Jansen Molenaar |
Adviseur oogzorg, Oogvereniging |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging (Oogvereniging) in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Diabetes Vereniging Nederland.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Screening bij kinderen |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Geautomatiseerde screening middels AI |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Behandeling van diabetisch macula oedeem |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
