Kwaliteit van coloscopie: algemene aspecten
Uitgangsvraag
Aan welke minimale kwaliteitseisen moet een coloscopie voldoen?
Aanbeveling
De onderstaande aanbevelingen voor post-poliepectomie surveillance zijn van toepassing op alle patiënten waarbij alle poliepen radicaal zijn verwijderd tijdens een coloscopie van voldoende kwaliteit.
Een coloscopie van voldoende kwaliteit dient aan de volgende eisen te voldoen: het coecum moet worden bereikt (en 2 van de 3 kenmerken fotografisch vastgelegd) en de kwaliteit van de darmvoorbereiding moet voldoende zijn (BBPS tenminste 2 in elk van de 3 colonsegmenten).
Daarnaast is het aan te bevelen dat de endoscopist op de hoogte is van zijn/haar eigen kwaliteitsparameters (zoals via BVO of een kwaliteitsregistratie): bijvoorbeeld een voldoende hoge coecumintubatierate van ≥ 90% en een adenoom detectie rate van ≥ 25%.
Voor de kliniek waar de endoscopist werkzaam is, is het wenselijk dat de kwaliteit van de darmvoorbereiding in tenminste 90% van de patiënten voldoende (BBPS ≥ 2 in elk colonsegment) is.
Overwegingen
Het primaire doel van de coloscopie is om het aantal nieuwe gevallen van CRC en het aantal sterfgevallen als gevolg van CRC te reduceren. Het detectiecijfer van CRC is echter een minder nauwkeurige indicatie voor de kwaliteit van de coloscopie dan het detectiecijfer van adenomen. Ook kan het detectiecijfer voor CRC sterk variëren tussen endoscopisten door het lage aantal CRC’s in de algemene populatie.
Post-coloscopie CRC’s (PCCRC’s) zijn een belangrijke kwaliteitsindicator. Deze indicator vereist echter rapportage met een zeer lange follow-up in een daarvoor uitgerust registratiesysteem, met daarnaast koppeling met de landelijke kankerregistratie van het IKNL. Daarom is dit geen goed bruikbare kwaliteitsindicator voor de dagelijkse praktijk en wordt het adenoom detectie rate hiervoor het meest geschikt geacht.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor de patient is het van belang dat de coloscopie met hoge kwaliteit wordt uitgevoerd, zowel om de kans op een PCCRC zo klein mogelijk te houden alsmede om te voorkomen dat het nodig is om voor optimale kwaliteit een extra, tweede coloscopie te ondergaan.
Kosten (middelenbeslag)
Het uitvoeren van coloscopieen van hoogwaardige kwaliteit is uiteraard ook van belang voor de kosten-effectiviteit, zowel omdat een eventueel tweede coloscopie met extra kosten gepaard gaat maar ook omdat een PCCRC extra behandeling en dus kosten met zich meebrengt (endoscopische of chirurgische behandeling, eventueel aangevuld met andere (neo-)adjuvante therapieën).
Aanvaardbaarheid, haalbaarheid en implementatie
Dat de effectiviteit van coloscopie voor de detectie en preventie van CRC afhangt van de kwaliteit van de uitvoering van deze procedure is als gegeven inmiddels door de beroepsgroep aanvaard, zowel in het buitenland (ESGE; Kaminski, 2017) als in Nederland. Meting van kwaliteitsparameters is in Nederlands als eerste geïmplementeerd binnen het bevolkingsonderzoek darmkanker. Inmiddels is ook een kwaliteitsprogramma voor alle andere endoscopieen opgezet, de DGEA. Deelname aan deze kwaliteitsregistratie wordt door de NVMDL geadviseerd maar is nog niet verplicht. Goede registratie van kwaliteitsparameters en ook deelname aan dergelijke kwaliteitsregistraties vergt gestructureerde verslaglegging van endoscopieën, iets wat de grote leveranciers faciliteren, maar sommige ziekenhuizen met eigen systemen mogelijk kunnen maken.
Onderbouwing
Achtergrond
Coloscopie is de standaardmethode voor de detectie van darmkanker en poliepen en biedt tegelijkertijd de mogelijkheid het merendeel van deze afwijkingen te verwijderen. De effectiviteit van coloscopie voor de detectie en preventie van CRC hangt af van de kwaliteit van de uitvoering van deze procedure. Helaas worden er in de periode na een coloscopie en voorafgaand aan de volgende surveillance coloscopie toch nog CRCs, zogenaamde post-coloscopie CRCs (PCCRCs), gevonden. Het merendeel van deze CRCs lijkt in theorie te kunnen worden voorkomen. Gemiste poliepen en (vroeg)carcinomen zijn hiervoor een belangrijke reden. Een andere mogelijke oorzaak is irradicale poliepectomie (voor de techniek en voor surveillance na mogelijk irradicale poliepectomie of piecemeal verwijdering verwijzen we naar de richtlijn Poliepectomie van het rectum en colon).
Mogelijke oorzaken voor gemiste afwijkingen zijn bijvoorbeeld onvolledige beoordeling van het colorectum als gevolg van onvoldoende kwaliteit van de darmvoorbereiding, niet succesvolle coecum intubatie of onvoldoende technische kwaliteiten van de endoscopist. Van een aantal kwaliteitsparameters is inmiddels aangetoond dat registratie en feedback een positief effect op het voorkomen van PCCRCs heeft. Dit is de reden dat bij de implementatie van het landelijk bevolkingsonderzoek darmkanker de voorwaarde is gesteld dat de coloscopieën die volgen na een positieve FIT uniform worden uitgevoerd en aan hoge kwaliteitseisen voldoen (RIVM, 2012). Om dit doel te verwezenlijken wordt binnen het bevolkingsonderzoek een volledige registratie en periodieke evaluatie van de kwaliteitsindicatoren van de coloscopie verricht (Bronzwaer, 2019). Inmiddels is er in samenwerking met de NVMDL ook een kwaliteitsprogramma voor alle andere coloscopieen opgezet, de zogenaamde DGEA. Dit biedt de deelnemende centra en endoscopisten de mogelijkheid om inzage in hun eigen kwaliteitsparameters te krijgen. Deelname aan deze kwaliteitsregistratie wordt geadviseerd maar is niet verplicht.
Specifiek voor de surveillance setting is inmiddels ook bekend dat de kwaliteit van de endoscopist medebepalend is voor het risico op PCCRC. Wieszczy (2021) toonde aan dat low-performing endoscopisten die (in de setting van coloscopieen als primaire screeningsmethode, dus anders dan FIT-positieven) gemiddeld in minder dan 20 van de 100 patiënten tenminste 1 adenoom vinden, dus een adenoom detectie rate (ADR) van <20 hebben) een hoger risico op PCCRC hebben dan patiënten die werden gescopieerd door een high-performing endoscopist (met ADR ≥ 20).
In deze module worden algemene aspecten samengevat betreffende de kwaliteit van een coloscopie, gebaseerd op de Europese richtlijn.
Samenvatting literatuur
Since 2013, new evidence has strengthened the idea that overutilization of endoscopic surveillance cannot compensate for an initially suboptimal colonoscopy. In a cohort of 11 944 patients with a mean follow-up of nearly 8 years, a suboptimal examination has been shown to confer a higher risk of CRC incidence and mortality after polypectomy (incomplete colonoscopy, hazard ratio [HR] 1.8, 95% confidence interval [95%CI] 1.34 – 2.41; poor bowel preparation, HR 2.09, 95%CI 1.19 – 3.67), irrespective of the baseline risk and the performance of surveillance intervention (Atkin, 2017).
Specific ESGE and World Endoscopy Organization (WEO) guidelines have already addressed the general principles of quality of colonoscopy, endoscopic resection, and bowel cleansing (Figure 1)(Hassan, 2019; Jover, 2018; Kaminski, 2017).
In the case of doubt about the completeness of endoscopic resection, such as positive or indefinite resection margins at pathology, an early repeat colonoscopy is recommended (Ferlitsch, 2017; Hassan, 2019). This is especially relevant when it is borne in mind that large polyp size, namely ≥ 20 mm, has been strictly associated with increased long-term post-polypectomy CRC incidence/mortality risk (see below) (Atkin, 2017; Wieszczy, 2020). Regarding the completeness of mucosal evaluation, an increased risk of metachronous advanced neoplasia has been reported in patients with ≥ 5 adenomas with one ≥ 10 mm (Vemulapalli, 2014). However, cohort studies based on the risk of CRC, rather than that of metachronous advanced neoplasia, have in general downgraded the role of both multiplicity and polyp size < 20 mm (Click, 2018; Vleugels, 2019; Wieszczy, 2010). Thus, it seems reasonable to recommend an early repeat colonoscopy only in those few cases where the number or complexity of multiple endoscopic resections have affected, according to endoscopist judgment, the quality of the baseline colonoscopy.
Inadequate bowel preparation
Strong recommendations for a 1-year repeat colonoscopy in the case of inadequate bowel preparation were issued by ESGE (Hassan, 2019) recently and by other associations (Lieberman, 2012), strengthened by new evidence showing how a suboptimal baseline exam independently increases CRC incidence and mortality (Atkin, 2017). Of note, this recommendation is not followed in 90% of cases according to a colonoscopy registry of 9170 average risk patients with normal findings at screening colonoscopy (Butterly, 2020).
The adenoma miss rate, but not the advanced adenoma miss rate, is independently associated with bowel preparation quality (Zhao, 2019) and therefore standard guideline recommendations for surveillance intervals apply only to patients with adequate bowel preparation. There is no agreement on the definition of adequate bowel preparation (Jover, 2018). ESGE defines adequate bowel preparation as: Boston Bowel Preparation Scale ≥ 6, Ottawa Scale ≤ 7, or Aronchick Scale excellent, good, or fair (Kaminski, 2017), while some authors have proposed that bowel preparation should be considered inadequate if the Boston Bowel Preparation Scale score is 0 or 1 in any colon segment (Clark, 206). The latter has the preference as this implicates that the quality of the bowel prep is good enough in each segment to enable appropriate mucosal inspection.
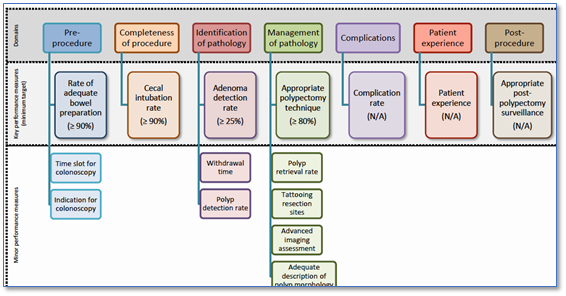
Figure 1 The domains and performance measures
Zoeken en selecteren
To answer the clinical question, the ESGE guideline Post-polypectomy colonoscopy surveillance (Hassan, 2020) and the ESGE guideline Performance measures for lower gastrointestinal endoscopy (Kaminski, 2017) were used. The summary of literature below was adopted from these guidelines.
Referenties
- Atkin W, Wooldrage K, Brenner A, Martin J, Shah U, Perera S, Lucas F, Brown JP, Kralj-Hans I,
Greliak P, Pack K, Wood J, Thomson A, Veitch A, Duffy SW, Cross AJ. Adenoma surveillance and colorectal cancer incidence: a retrospective, multicentre, cohort study. Lancet Oncol. 2017 Jun;18(6):823-834. doi: 10.1016/S1470-2045(17)30187-0. Epub 2017 Apr 28. PMID: 28457708; PMCID: PMC5461371. - Bronzwaer MES, Depla ACTM, van Lelyveld N, Spanier BWM, Oosterhout YH, van Leerdam
ME, Spaander MCW, Dekker E; Dutch Colonoscopy Quality Assurance working
group. Quality assurance of colonoscopy within the Dutch national colorectal
cancer screening program. Gastrointest Endosc. 2019 Jan;89(1):1-13. doi: 10.1016/j.gie.2018.09.011. Epub 2018 Sep 18. PMID: 30240879. - Butterly LF, Nadel MR, Anderson JC, Robinson CM, Weiss JE, Lieberman D, Shapiro JA. Impact
of Colonoscopy Bowel Preparation Quality on Follow-up Interval Recommendations for Average-risk Patients With Normal Screening Colonoscopies: Data From the New Hampshire Colonoscopy Registry. J Clin Gastroenterol. 2020 Apr;54(4):356-364. doi: 10.1097/MCG.0000000000001115. PMID: 30106836; PMCID: PMC6374206. - Clark BT, Protiva P, Nagar A, Imaeda A, Ciarleglio MM, Deng Y, Laine L. Quantification of
Adequate Bowel Preparation for Screening or Surveillance Colonoscopy in Men. Gastroenterology. 2016 Feb;150(2):396-405; quiz e14-5. doi: 10.1053/j.gastro.2015.09.041. Epub 2015 Oct 9. PMID: 26439436; PMCID: PMC4728019. - Click B, Pinsky PF, Hickey T, Doroudi M, Schoen RE. Association of Colonoscopy Adenoma
Findings With Long-term Colorectal Cancer Incidence. JAMA. 2018 May 15;319(19):2021-2031. doi: 10.1001/jama.2018.5809. PMID: 29800214; PMCID: PMC6583246. - Ferlitsch M, Moss A, Hassan C, Bhandari P, Dumonceau JM, Paspatis G, Jover R, Langner C,
Bronzwaer M, Nalankilli K, Fockens P, Hazzan R, Gralnek IM, Gschwantler M, Waldmann E, Jeschek P, Penz D, Heresbach D, Moons L, Lemmers A, Paraskeva K, Pohl J, Ponchon T, Regula J, Repici A, Rutter MD, Burgess NG, Bourke MJ. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2017 Mar;49(3):270-297. doi: 10.1055/s-0043-102569. Epub 2017 Feb 17. PMID: 28212588. - Hassan C, Antonelli G, Dumonceau JM, Regula J, Bretthauer M, Chaussade S, Dekker E,
Ferlitsch M, Gimeno-Garcia A, Jover R, Kalager M, Pellisé M, Pox C, Ricciardiello L, Rutter M, Helsingen LM, Bleijenberg A, Senore C, van Hooft JE, Dinis-Ribeiro M, Quintero E. Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2020. Endoscopy. 2020 Aug;52(8):687-700. doi: 10.1055/a-1185-3109. Epub 2020 Jun 22. PMID: 32572858. - Hassan C, East J, Radaelli F, Spada C, Benamouzig R, Bisschops R, Bretthauer M, Dekker E,
Dinis-Ribeiro M, Ferlitsch M, Fuccio L, Awadie H, Gralnek I, Jover R, Kaminski MF, Pellisé M, Triantafyllou K, Vanella G, Mangas-Sanjuan C, Frazzoni L, Van Hooft JE, Dumonceau JM. Bowel preparation for colonoscopy: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2019. Endoscopy. 2019 Aug;51(8):775-794. doi: 10.1055/a-0959-0505. Epub 2019 Jul 11. PMID: 31295746. - Jover R, Dekker E, Schoen RE, Hassan C, Pellise M, Ladabaum U; WEO Expert Working Group
of Surveillance after colonic neoplasm. Colonoscopy quality requisites for selecting surveillance intervals: A World Endoscopy Organization Delphi Recommendation. Dig Endosc. 2018 Nov;30(6):750-759. doi: 10.1111/den.13229. Epub 2018 Jul 26. PMID: 29971834. - Kaminski MF, Thomas-Gibson S, Bugajski M, Bretthauer M, Rees CJ, Dekker E, Hoff G, Jover
R, Suchanek S, Ferlitsch M, Anderson J, Roesch T, Hultcranz R, Racz I, Kuipers EJ, Garborg K, East JE, Rupinski M, Seip B, Bennett C, Senore C, Minozzi S, Bisschops R, Domagk D, Valori R, Spada C, Hassan C, Dinis-Ribeiro M, Rutter MD. Performance measures for lower gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy. 2017 Apr;49(4):378-397. doi: 10.1055/s-0043-103411. Epub 2017 Mar 7. PMID: 28268235. - Lieberman DA, Rex DK, Winawer SJ, Giardiello FM, Johnson DA, Levin TR. Guidelines for
colonoscopy surveillance after screening and polypectomy: a consens
us update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology. 2012 Sep;143(3):844-857. doi: 10.1053/j.gastro.2012.06.001. Epub 2012 Jul 3. PMID: 22763141. - Rijksinstituut voor Volksgezondheid en Milieu (RIVM). Protocol voor de toelating en auditing
van coloscopiecentra en endoscopisten bevolkingsonderzoek darmkanker. 2012 Nov versie 2.0. - Vleugels JLA, Hassan C, Senore C, Cassoni P, Baron JA, Rex DK, Ponugoti PL, Pellise M, Parejo
S, Bessa X, Arnau-Collell C, Kaminski MF, Bugajski M, Wieszczy P, Kuipers EJ, Melson J, Ma KH, Holman R, Dekker E, Pohl H. Diminutive Polyps With Advanced Histologic Features Do Not Increase Risk for Metachronous Advanced Colon Neoplasia. Gastroenterology. 2019 Feb;156(3):623-634.e3. doi: 10.1053/j.gastro.2018.10.050. Epub 2018 Nov 2. PMID: 30395813. - Wieszczy P, Kaminski MF, Franczyk R, Loberg M, Kobiela J, Rupinska M, Kocot B, Rupinski M,
Holme O, Wojciechowska U, Didkowska J, Ransohoff D, Bretthauer M, Kalager M, Regula J. Colorectal Cancer Incidence and Mortality After Removal of Adenomas During Screening Colonoscopies. Gastroenterology. 2020 Mar;158(4):875-883.e5. doi: 10.1053/j.gastro.2019.09.011. Epub 2019 Sep 26. PMID: 31563625. - Wieszczy P, Waldmann E, Løberg M, Regula J, Rupinski M, Bugajski M, Gray K, Kalager M,
Ferlitsch M, Kaminski MF, Bretthauer M. Colonoscopist Performance and
Colorectal Cancer Risk After Adenoma Removal to Stratify Surveillance: Two
Nationwide Observational Studies. Gastroenterology. 2021 Mar;160(4):1067-
1074.e6. doi: 10.1053/j.gastro.2020.10.009. Epub 2020 Oct 14. PMID: 33065063. - Zhao S, Wang S, Pan P, Xia T, Chang X, Yang X, Guo L, Meng Q, Yang F, Qian W, Xu Z, Wang Y,
Wang Z, Gu L, Wang R, Jia F, Yao J, Li Z, Bai Y. Magnitude, Risk Factors, and Factors Associated With Adenoma Miss Rate of Tandem Colonoscopy: A Systematic Review and Meta-analysis. Gastroenterology. 2019 May;156(6):1661-1674.e11. doi: 10.1053/j.gastro.2019.01.260. Epub 2019 Feb 6. PMID: 30738046.
Evidence tabellen
|
First author, year [Ref. in Guideline] |
Study design, study objective |
Intervention/comparator |
Participants |
Outcomes |
Results |
Certainty of evidence (GRADE) |
|
Atkin, 2017
|
Pooled analysis from three screening cohorts. Effect of surveillance on CRC incidence in intermediate risk patients (IR: 3-4 < 10 mm, or 1-2 >= 10 mm) |
Patients with IR adenoma after baseline colonoscopy, comparing those with vs. without follow-up colonoscopies |
N=2352 • UKFSST, age 55-64, n=796 • English bowel screening pilot (gFOBT): 60% uptake, age 50-69, n=407 • Kaiser Permanente Colon Cancer Prevention Program (sigmo: age>=50, n=625
|
Colorectal cancer incidence for no surveillance compared to 1 or 2+ visits after a median follow up of 11.2 years (hazard ratio, 95% CI) |
Overall • 1 visit: 0.27 (0.10 - 0.71) • 2+ visit: 0.33 (0.12 - 0.90)
Low IR:
• 0 visits: 1 • 1 visit: 0.15 (0.02- 1.41)
High IR:
• 0 visits: 1 • 1 visit: 0.29 (0.09 - 0.97)
|
Low (due to serious risk of selection bias) |
|
Atkin, 2017 (Hospital data) |
Multicentre cohort study. Effect of surveillance on CRC incidence in intermediate risk patients (IR: 3-4 < 10 mm, or 1-2 >= 10 mm) |
Patients with IR adenoma after baseline colonoscopy, comparing those with vs. without follow-up colonoscopies |
N=11944 Median age 66.7 years • 42% did not attend surveillance, and of these 46% died during follow-up • 58% had one or more surveillance visits, and of these 21% died during follow-up
|
CRC incidence after baseline for no surveillance compared to 1 or 2+ visits after a median follow-up of 7.9 years (hazard ratio, 95% CI) |
Overall • 1 visit: 0.57 (0.39-0.77) • 2+ visits:0.47 (0.31-0.72)
Low IR:
• 0 visits: 1 • 1 visit: 0·54 (0·20–1·43)
High IR:
• 0 visits: 1 • 1 visit: 0·52 (0·36–0·75)
|
Low (due to serious risk of selection bias) |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 10-10-2022
Laatst geautoriseerd : 10-10-2022
Geplande herbeoordeling :
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met een indicatie voor coloscopie surveillance.
Werkgroep
- Prof. dr. E. (Evelien) Dekker (voorzitter), NVMDL
- Dr. A.M. (Anne-Marie) van Berkel, NVMDL
- Prof. dr. M.E. (Monique) van Leerdam, NVMDL
- W. (Willemijn) de Klaver, NVMDL
- Dr. Y. (Yark) Hazewinkel, NVMDL
- Prof. dr. M.C.W. (Manon) Spaander, NVMDL
- Dr. M.J. (Marin) de Jong, NVMDL
- Prof. dr. I.D. (Iris) Nagtegaal, NVvP
- Dr. M.M. (Miangela) Laclé, NVvP
- Dr. I. (Iris) Lansdorp-Vogelaar, persoonlijke titel
- P.S. (Petra) Kellerhuis, Stichting Darmkanker
- M.M.B. (Tineke) Plessen, Stomavereniging
Klankbordgroep
- Dr. J.J. (Jan) Meeuse, NIV
- R. (Ruud) Blankenburgh, NIV
Met ondersteuning van:
- Dr. A.N. (Anh Nhi) Nguyen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Restricties |
|
Dekker |
Maag-Darm-Leverarts Amsterdam UMC |
Inhoudelijk expert WG toetsing en accreditatie endoscopisten bevolkingsonderzoek darmkanker, aanstelling bij screeningsorganisatie. Betaald, maar direct aan werkgever AUMC. |
Ik heb honorarium ontvangen voor medisch advies van FujiFilm, Olympus, Tillots, GI Supply, CPP-FAP
Ik ben Nlse PI van een grote prospectieve gerandomiseerde studie naar intervallen voor surcveillance coloscopie na eerdere adenomen: de EPoS-studie. Ik heb voor uitvoering in NL een KWF-subdsidie verworven |
Geen |
|
Berkel, van |
Maag-darm-leverarts, Noord West Ziekenhuisgroep |
geen |
nee |
Geen |
|
Leerdam, van |
MDL-arts Antoni van Leeuwenhoek, Amsterdam |
Medisch directeur Stichting Opsporing Erfelijke Tumoren, Leiden (onbetaald) |
Financier: KWF |
Geen |
|
Klaver, de |
Arts-onderzoeker in het Amsterdam UMC en het Antoni van Leeuwenhoek/Nederlands Kanker Instituut. |
nee |
Financier: KWF |
Geen |
|
Hazewinkel |
MDL arts, Ter gooi MC |
nee |
nee |
Geen |
|
Nagtegaal |
Patholoog Radboudumc |
Voorzitter Stichting PALGA (onbetaald) |
Financier: KWF |
Geen |
|
Laclé |
Patholoog, UMC Utrecht |
nee |
Financier |
Geen |
|
Kellerhuis |
Leraar voortgezet onderwijs, Stichting Carmelcollege |
Vrijwilliger bij Stichting Darmkanker, lid van teams Belangenbehartiging en Patientenparticipatie in Onderzoeken, onbetaald. |
nee |
Geen |
|
Plessen |
Vrijwilliger bij de stomavereniging |
vrijwilliger bomenmuseum |
nee |
Geen |
|
Lansdorp-Vogelaar |
Universiteir Hoofddocent bij afdeling Maatschappelijke Gezondheidszorg van het Erasmus MC in Rotterdam |
December 2021 en Maart 2022, expert bij twee Gezondheidsraad vergaderingen tbv de evaluatie van het bevolkingsonderzoek darmkanker (vacatiegeld) |
Financier: RIVM. Inh. Onderzoek: Evaluatie van het bevolkingsonderzoek darmkanker. PL: ja.
|
Geen |
|
Spaander |
Maag- Darm- Leverarts, Erasmus MC, hoogleraar gastrointestinaal oncologie in het bijzonder |
Editor in chief Best Practise & Research Clinical Gastroenterology (betaald) Editorial board |
Financier:
|
Geen |
|
Jong, de |
AIOS MDL, LUMC |
Bestuurslid NVMDL io, niet betaald (commissies: werkgroep kennisagenda, arbeidsmarkt, accreditatie) |
nee |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van Stichting Darmkanker en Stomavereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Darmkanker en Stomavereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een indicatie voor coloscopie surveillance. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunten analyse. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Methode literatuursamenvatting
Een beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De literatuursamenvatting in de verschillende modules zijn overgenomen van twee recente Europese richtlijnen, namelijk “Post-polypectomy colonoscopy surveillance: European Society of GI Endoscopy (ESGE) Guideline – Update 2020” (Hassan, 2020) en “Endoscopic surveillance after surgical or endoscopic resection for colorectal cancer: European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Digestive Oncology (ESDO) Guideline” (Hassan, 2019). Onder het kopje ‘Summary of literature’ zijn stukken uit de twee Europese richtlijnen integraal overgenomen. Er is geen nieuwe literatuur search gedaan.
Beoordelen van de kracht van het wetenschappelijke bewijs
In de twee ESGE-richtlijnen die geadapteerd zijn in deze richtlijn, werd de kracht van het wetenschappelijke bewijs bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
