SCIT en SLIT bij kinderen met allergische astma
Uitgangsvraag
Wat is de plaats van immunotherapie (SCIT/SLIT) ten opzichte van placebo bij kinderen met allergische astma met betrekking tot astma-controle?
Aanbeveling
Maak gezamenlijk met de patiënt/ouder/verzorger een onderbouwde afweging voor het starten van SCIT of SLIT bij kinderen/adolescenten met allergisch astma, rekening houdend met kans op bijwerkingen en belang van therapietrouw.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de literatuuranalyse werden een aantal studies geïncludeerd die het effect van SCIT/SLIT op astma controle, kwaliteit van leven en medicijngebruik onderzochten in kinderen en adolescenten met aanhoudende astma en inhalatie allergie. Doordat deze studies verschillende meeteenheden gebruikten of niet alle individuele data konden worden gereproduceerd uit de systematische review, konden niet alle data worden gepoold.
Voor de cruciale uitkomstmaat astma controle kon met een deel van de studies een meta-analyse worden uitgevoerd. In combinatie met de andere studies zijn er aanwijzingen dat SCIT/SLIT astma controle verbetert in vergelijking met behandeling met placebo. Echter is hiervan de bewijskracht laag en kan dit niet met zekerheid worden geconcludeerd. Er werd weinig en van lage kwaliteit bewijs gevonden voor de cruciale uitkomstmaat longaanvallen, waaruit bleek dat het zou kunnen dat SCIT/SLIT het aantal astma aanvallen verminderd. Er werd weinig tot geen verschil gevonden in ziekte-specifieke kwaliteit van leven en longfunctie, beide met een lage bewijskracht. Er werden geen studies gevonden die het effect van SCIT/SLIT op luchtwegontsteking rapporteerden. Wat betreft de belangrijke uitkomstmaat medicatiegebruik kon met een deel van de studies een meta-analyse worden uitgevoerd, en in combinatie met de andere studies, is het mogelijk dat SCIT/SLIT het gebruik van astmamedicatie vermindert ten opzichte van placebo of gewone zorg. De bewijskracht hiervan is echter laag.
Concluderend suggereert het gevonden bewijs dat SCIT/SLIT mogelijk een positief effect zou kunnen hebben op astma controle, longaanvallen en medicatiegebruik bij kinderen en adolescenten met aanhoudende astma en inhalatie allergie in vergelijking met placebo of gebruikelijke zorg. Daarnaast suggereert het gevonden bewijs dat SCIT/SLIT weinig tot geen effect zou kunnen hebben op kwaliteit van leven en longfunctie. De bewijskracht van deze conclusies is laag, met name door risico op bias en lage generaliseerbaarheid door kleine studiepopulaties.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Immunotherapie heeft mogelijk effect op astma controle en aantal exacerbaties. Ook resulteert immunotherapie in een mogelijk lager gebruik van onderhoudsmedicatie bij kinderen met allergisch astma. Zowel SCIT als SLIT dienen gedurende een periode van minimaal 3 jaar te worden toegepast. Hierbij wordt SCIT wekelijk tot maandelijks gegeven, normaliter in het ziekenhuis en soms in de huisartsenpraktijk. Bij SLIT worden dagelijks tabletten ingenomen in de thuissetting.
Uit een retrospectieve studie van het Erasmus MC bleek dat van 6486 patiënten die waren gestart met SCIT of SLIT slechts 18% van de patiënten na drie jaar nog medicatie afhaalde bij de apotheek. Voor SCIT was dit 23%, voor SLIT slechts 7%. De mediane duur van de behandeling bleek voor SCIT 1.7 jaar en voor SLIT 0.6 jaar te zijn. Een slechtere compliance werd verder gevonden bij patiënten van specialisten vergeleken met huisartsen, mono- allergeenbehandeling, lagere socio-economische status en jongere leeftijd (Kiel, 2013).
De kans op systemische reacties bij SCIT is relatief laag (0.1-0.2%) met gebruik van conventionele opbouw-doses. Versnelde ophoging van de subcutane doses resulteert in toename van systemische bijwerkingen. Lokale bijwerkingen, zoals jeuk en roodheid op de injectieplaats, treden op in 26-86% van de gevallen. Systemische bijwerkingen komen bij SLIT sporadisch voor. Lokale bijwerkingen zoals orale jeuk en zwelling, meestal spontaan herstellend, treden op bij 30-40% van de patiënten (James, 2017).
Een studie uit 2017 onderzocht de systemische bijwerkingen van zowel SCIT als SLIT onder 1500 Europese kinderen die gedurende 1 jaar werden gevolgd. In totaal werden 29 systemische bijwerkingen gerapporteerd; het merendeel (79.3%) werd veroorzaakt door SCIT. Slechts één systemische bijwerking werd geclassificeerd als ernstig. 10.3% van de systemische bijwerkingen werd geclassificeerd als anafylaxie, en traden allen op in de groep behandeld met SCIT (Rodriguez Del Rio, 2017).
Vanwege het niet-invasieve karakter van sublinguale versus subcutane toediening en de kleinere kans op systemische bijwerkingen heeft vanuit patiëntenperspectief behandeling met SLIT de voorkeur boven behandeling met SCIT bij kinderen met allergische aandoeningen (James, 2017).
De behandelend arts dient de voor- en nadelen van SCIT en SLIT met de patiënt en/of ouders/verzorgers te bespreken, schriftelijke informatie mee te geven en na een bedenktijd hierop terug te komen. Gezamenlijk moet een keuze met de hoogste kans van slagen, qua effectiviteit maar ook qua therapietrouw en veiligheid, worden overeengekomen.
Kosten (middelenbeslag)
Verschillende studies hebben de kosteneffectiviteit onderzocht van zowel SCIT als SLIT op de behandeling van allergische rhinitis. Door lager medicatie-behoefte voor adequate klachtencontrole, alsmede een positief effect op Quality of Life Years, is de algemene consensus dat SCIT en SLIT een kosteneffectieve behandeling van allergische aandoeningen bij kinderen is (Lockey & Hankin, 2011).
Echter, duidelijkheid over de kosteneffectiviteit van SCIT versus SLIT ontbreekt; meerdere studies hebben verschillende uitkomsten in kosteneffectiviteit van beide modaliteiten laten zien. Deze studies hebben niet specifiek het kosteneffect op astma op de kinderleeftijd geëvalueerd (Brüggenjürgen et al., 2021; Hardin et al., 2021).
Aanvaardbaarheid, haalbaarheid en implementatie
SCIT kan zowel door kinderartsen als door andere medisch specialisten toegediend worden. Van belang is hierbij dat zowel de toedienend arts als het (para)medisch personeel adequaat getraind zijn in het herkennen en behandelen van een systemische of anafylactische reactie. Er dient minimaal 30 minuten observatie plaats te vinden na toedienen van subcutane immunotherapie. Daarbij dienen geschikte medicatie en materialen voor het behandelen van een anafylactische reactie binnen handbereik aanwezig te zijn. Dit vereist dus tijd, ruimte en getraind personeel voor een veilige behandeling.
SLIT kan na een eerste toediening onder observatie, zoals hierboven beschreven, veilig in de thuissituatie worden toegediend.
Absolute contra-indicaties voor het starten met SCIT of SLIT zijn ongecontroleerd astma, actieve systemische auto-immuunziekten en maligniteiten. De EAACI spreekt in haar richtlijn Immunotherapie ook over ernstig astma als absolute contra-indicatie. Deze stelling is gebaseerd op studies die aantonen dat bij patiënten met ongecontroleerd astma of FEV1 <80% van voorspeld er een verhoogd risico is op astma-exacerbaties. Ernstig astma kenmerkt zich volgens de definitie van de richtlijn ‘Diagnostiek en behandeling van ernstig astma’ onder andere door aanhoudend astmasymptomen en/of ≥2 astma-aanvallen ondanks hoge dosis medicatie en goede therapietrouw- en techniek. Er is hierbij dus met name sprake van onvoldoende astma-controle. Derhalve is de werkgroep van mening dat ernstig astma of FEV1 <80% een contra-indicatie is voor immunotherapie. De werkgroep benadrukt dat wanneer een patiënt stabiel en onder controle is, er geen aanwijzingen zijn dat de ernst van astma een absolute contra-indicatie vormt voor immunotherapie.
Bij contra-indicaties zoals bèta-blokkergebruik, ernstige cardiovasculaire ziekten, andere auto-immuunziektes, ernstige psychiatrische ziektes, slechte compliance en immunodeficiëntie dienen de baten van immunotherapie (klinisch gunstig effect) afgewogen te worden met het eventueel optreden van bijwerkingen bij de patiënt door de contra-indicatie.
Zoals hierboven beschreven is daarnaast de mate van therapietrouw van belang. De hoeveelheid vereiste bezoeken aan het ziekenhuis bij SCIT kan een ernstige belemmerende factor zijn voor patiënten. Daartegenover staat dat betere monitoring van de therapietrouw mogelijk is bij SCIT ten opzichte van SLIT, gezien het regelmatige contact met de zorgverlener.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
De literatuuranalyse toont aan dat SCIT en SLIT een beperkt positief effect hebben bij kinderen/adolescenten met allergisch astma op het gebruik van astmamedicatie, astmacontrole en longaanvallen. Immunotherapie is een kosteneffectieve behandeling bij patiënten met allergisch astma. Gezien de zwakke aanwijzingen wordt immunotherapie dan ook hoogdrempelig geadviseerd bij allergisch astma.
Indien wordt besloten te starten met immunotherapie dient een goed onderbouwde afweging te worden gemaakt over het starten met SCIT of SLIT. Deze afweging dient te worden gemaakt op basis van invasiviteit van de behandeling (subcutane injecties vs sublinguale tabletten), risico’s op bijwerkingen en compliance.
De kans op optreden van ernstige systemische bijwerkingen of anafylaxie is klein maar relevant, met name bij SCIT. Derhalve dient SCIT te worden verricht in een gecontroleerde omgeving met getraind personeel en noodmedicatie. Lokale bijwerkingen kunnen invloed hebben op de compliance van de patiënt: regelmatige monitoring is van belang voor behoud van een goede compliance.
Onderbouwing
Achtergrond
Allergische sensibilisatie is een bekende risicofactor voor zowel het ontstaan als de ernst van astma bij kinderen en volwassenen. De huidige behandeling van astma richt zich vooral op chronische luchtwegontsteking en longaanvallen. De allergische component van de onderliggende abnormale immuunrespons wordt daarbij echter niet behandeld. Immunotherapie richt zich op deze afwijkende immuunrespons. Het is onduidelijk of behandeling met immunotherapie de astmacontrole bij kinderen met allergische astma beïnvloedt.
Conclusies
Asthma control
|
Low GRADE |
SCIT/SLIT may slightly increase asthma control when compared with control (placebo or usual care) in children and adolescents with stable asthma and inhalation allergy.
Source: Dhami (2017); Baris (2014); de Vos (2021); Karakoc-Aydiner (2015); Shao (2014); Stelmach (2011) From Dhami (2017): Hui (2013); Lue (2006); Pham-Thi (2007); Roberts (2006); Stelmach (2009) |
(Severe) exacerbations
|
Low GRADE |
SCIT/SLIT may reduce the amount of annual asthma attacks when compared with control (placebo or usual care) in children and adolescents with stable asthma and inhalation allergy.
Source: Baris (2014) |
Disease-specific) quality of life
|
Low GRADE |
SCIT/SLIT may result in little to no difference in (disease-specific) quality of life when compared with control (placebo or usual care) in children and adolescents with stable asthma and inhalation allergy.
Source: Dhami (2017); de Vos (2021) From Dhami (2017): Pham-Thi (2007) |
(Change in) lung function
|
Low GRADE |
SCIT/SLIT may result in little to no difference in (change in) lung function over time when compared with control (placebo or usual care) in children and adolescents with stable asthma and inhalation allergy.
Source: Baris (2014); Dhami (2017); Karakoc-Aydiner (2015); Shao (2014) From Dhami (2017): Hui (2014); Lue (2006); Pham-Thi (2007); Roberts (2006); Stelmach (2009) |
Airway inflammation
|
No GRADE |
No evidence was found regarding the effect of SCIT/SLIT on airway inflammation when compared with control (placebo or usual care) in children and adolescents with stable asthma and inhalation allergy. |
Medication use
|
Low GRADE |
SCIT/SLIT may result in a reduction in medication use when compared with control (placebo or usual care) in children and adolescents with stable asthma and inhalation allergy.
Source: Dhami (2017); Baris (2014); Karakoc-Aydiner (2015); Shao (2014); de Vos (2021) From Dhami (2017): Lue (2006); Roberts (2006); Kuna (2011) |
Samenvatting literatuur
Description of studies
The systematic review of Dhami (2017) was used as the basis for the literature analysis, as this was the most recent study with the highest methodological quality. Articles published after the search date (2015) of this systematic review were assessed for inclusion and this resulted in five additional randomized controlled trails (RCTs).
Dhami (2017) performed a systematic review on allergen immunotherapy in allergic asthma. Nine databases were searched for double-blind RCTs comparing SCIT or SLIT to placebo in patients with allergic asthma. The primary outcomes were short-term and long-term effectiveness as assessed by symptom and/or medication scores. Secondary outcomes were asthma control, asthma-specific quality of life (QoL), exacerbations, lung function, response to environmental exposure chamber or bronchial allergen challenge, health economic analysis from the perspective of the health system/payer, and safety as assessed by local and systemic reactions. A total of 98 studies were included, from which 89 were RCTs. Fifteen of these were included in a meta-analysis. Only the six RCTs in the subgroup meta-analyses in children were included in our literature analysis. These RCTs included the studies of Hui (2013), Kuna (2011), and Lue (2006), Roberts (2006), Pham-Thi (2007), Stelmach (2009).
The study of Hui (2013) included 90 children with mean age 9.9 years with mild to moderate asthma severity. They compared SCIT HDM with control receiving glucocorticoid management.
The study of Kuna (2011) included 50 children with 38 with mild to moderate asthma, 46 allergic rhinitis, and 34 rhinoconjunctivitis. Mean age was 11.5 years and they compared SCIT Alternaria alternata with placebo.
The study of Lue (2006) included 10 children with mildly persistent to moderate persistent asthma. Mean age in the SLIT HDM group was 7.7 years and in the placebo group 8.6 years.
The study of Roberts (2006) included 35 children with mean age 9.9 years. They compared SCIT grass pollen to placebo.
The study of Pham-Thi (2007) included 111 children with mild to moderate allergic asthma. Mean age in the SLIT HDM group was 9.6 years and 9.5 years in the placebo group.
The study of Stelmach (2009) included 50 children with mild or moderate allergic asthma. Mean age in the SLIT grass pollen group was 9.1 years and 8.5 years in the placebo group.
De Vos (2021) performed a prospective RCT to determine the effect of SCIT on asthma when started at ages younger than four years. Children with atopy aged 18 to 47 months were included in either a three-year course of SCIT with eight common environmental allergens or usual care. A total of 31 patients received the intervention and 27 usual care. Outcomes were asthma symptoms, medication score, asthma related QoL, and naso-ocular symptoms, skin symptoms, and allergy medication scores, measured during phone interviews or two-monthly study visits. A total of 8 patients were randomized but not included in the intention-to-treat (ITT) analysis and 20 patients were only included in the ITT analysis and not in the per-protocol (PP) analysis.
Karakoc-Aydiner (2015) performed a prospective RCT to compare the long-term clinical and immunological effects of SCIT and SLIT with pharmacotherapy only. Children with asthma, rhinitis, and asthma with rhinitis were included, of whom 16 received SCIT with D. pteronyssinus and D. farina, 16 received SLIT with D. pteronyssinus and D. farina, and 16 received control. After three years of follow-up, a total of 17 patients did not reach the endpoint of the study. Outcomes were total rhinitis symptom score (TRSS) and asthma symptom score (TASS), total symptom scores (TSS), total medication scores (TMS), safety profiles, skin-nasal-bronchial reactivity, and immunological parameters.
Shao (2014) performed a multicenter RCT to evaluate the efficacy and safety of SLIT in allergic rhinitis children aged 3-13 years old. 80% of the included patients also had allergic asthma, only these results are reported here. 168 children received standard pharmacotherapy as needed with SLIT with D. farina and 96 received standard pharmacotherapy as needed without SLIT. After 12 months follow-up, 27 (15%) and 19 (10%) patients were lost to follow-up in the intervention and control group respectively. Outcomes measured in patients with asthma were pulmonary function, asthma symptom, and asthma medication. Other outcomes were adverse events, rhinitis symptoms, rhinitis medication, severity of rhinitis symptoms, and immunoglobulins., but since these were also measured in patients without asthma, these outcomes were not reported here.
Baris (2014) performed a RCT to compare SCIT along with vitamin D supplementation, SCIT and pharmacotherapy, and pharmacotherapy alone in house dust mite (HDM) sensitized asthma with or without rhinitis in children between 5 and 15 years of age. Since we were only interested in the comparison between SCIT and pharmacotherapy, only these results are reported here. A total of 15 patients received SCIT with pharmacotherapy and 18 patients received pharmacotherapy, of which a total of four were lost to follow-up after 12 months. Outcomes were asthma symptoms, annual asthma attacks, lung function, medication use, immunological parameters, and adverse events.
Stelmach (2012) performed a prospective RCT to compare the efficacy and safety of SLIT given pre-coseasonally (starting before the pollen season and continuing until the end of it), SLIT given continuously (all year round, independent of the pollen season), and placebo. Since we were interested in the comparison between SLIT continuously (as this is also the method in the other included studies) and placebo, only these results are reported here. Children aged 6-18 years allergic to grass pollen with or without asthma were included. A total of 19 patients received SLIT with extract of Dactylis glomerata, Anthoxanthum odoratum, Lolium perenne, Poa pratensis, and Phleum pretense for the first 6 months and placebo for the second 6 months. A total of 18 patients received placebo for 12 months. The total study follow-up period was 2 years, in which 3 patients were lost to follow-up. Asthma symptoms was measured in patients with asthma, other outcome measures were also assessed in patients without asthma.
Results
The data were pooled wherever possible and described narratively when the data were not adequately reported in the original study.
Asthma control
For the asthma control outcome measure, we included studies that reported asthma control as well as symptom scores, because a large portion of asthma control is defined by the symptoms patients are experiencing. Asthma control was measured using the Asthma Control Questionnaire, Asthma Free days, or Asthma Symptom Score.
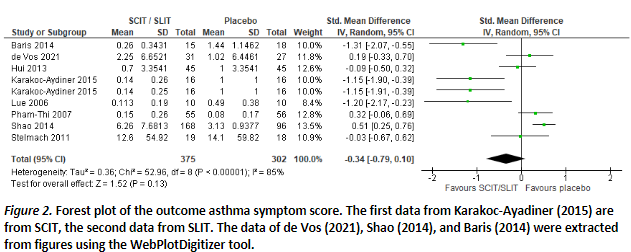
Six studies reported on asthma symptom scores, where lower scores represent less asthma symptoms.
Of the five studies included in the meta-analysis of Dhami (2017), three studies could be included in our meta-analysis. In total, eight studies provided data that allowed pooling (Figure 2). After pooling, a small effect with SMD of -0.34 (95%CI -0.79; 0.10) in favor of SCIT/SLIT was found, but this difference is not statistically significant.
Two studies could not be pooled, because other outcomes were reported.
The study of Roberts (2006), included in Dhami (2017), reported a lower symptom score after two seasons in the intervention group (intervention median 0.5 (IQR 0.1-0.8) vs control median 0.8 (IQR 0.4-2.1).
The study of Stelmach (2009), included in Dhami (2017), reported that treatment with SLIT significantly improved asthma symptoms score over 2 years of therapy, compared with placebo treatment (no data provided).
One study reported on severity of asthma symptoms, where higher scores represent higher severity.
The study of Karakoc-Aydiner (2015) reported lower mean ± SD severity of asthma symptoms in both SCIT and SLIT compared with control (1.66 ± 1.87 for SCIT, 2.5 ± 1.4 for SLIT, and 4.5 ± 2.7 for control; SCIT vs control mean difference (MD) 2.84 ± 0.82 in favor of SCIT and SLIT vs control MD 2 ± 0.96 in favor of SLIT).
One study reported on combined asthma medication and symptom score.
The study of de Vos (2021) reported no significant difference in combined asthma medication and symptom score over three years between SCIT and usual care (no data reported, p=0.22).
(Severe) exacerbations
One study reported on the number of annual asthma attacks.
Baris (2014) reported the mean ± SD number of annual asthma attacks, and found a reduction in the SCIT group compared with the control group (SCIT 2.1 ± 1.3 vs control 3.3 ± 1.6; MD 1.2 ± 0.50 in favor of SCIT). This is a reduction of 64% in annual asthma attacks in the SCIT group, compared with control, and therefore a clinically relevant difference between SCIT and control.
(Disease-specific) quality of life (QoL)
Two studies reported on asthma related QoL. De Vos (2021) used the Pediatric Asthma Caregiver Quality of Life Questionnaire during two-monthly study visit, with the higher scores indicating less impairment. Pham-Thi (2007) used the Childhood Asthma Questionnaire, in which higher scores represent less impairment.
The study of de Vos (2021) reported a significant improvement in mean ± SD asthma related QoL over time between SCIT and usual care in favor of SCIT (SCIT 68.7 ± 39.3 vs control 80.0 ± 45.8, p=0.04; MD 11.3 ± 11.3 in favor of SCIT). Data were extracted from figures using the WebPlotDigitizer tool.
One study in Dhami (2017), Pham-Thi (2007), reported a significant improvement in quality of life in children 6-11 years using SLIT compared to placebo (p=0.04) but no difference between SLIT and placebo in children aged 12-16 years (data not provided in the original study).
(Change in) lung function
One study reported the change in peak expiratory flow (PEF) and forced expiratory volume in the first second (FEV1) between three years and baseline.
Karakoc-Aydiner (2015) reported a slight, not significant, increase in PEF and FEV1 at three years compared with baseline in both the SLIT and SCIT groups (data not provided in the original study).
Five studies included in Dhami (2017) and two other studies reported the lung function between intervention and control after follow-up. These data could not be pooled due to different outcomes and time periods.
The study of Hui (2014), included in Dhami (2017), reported a significant difference in PEF between children using SCIT versus placebo after three years (SCIT 91.3 ± 5.8 vs placebo 81.6 ± 4.5, p=0.007).
The study of Roberts (2006), included in Dhami (2017), reported that FEV1 in both the SCIT and placebo group was less than 85% of predicted value a third of the time during the study duration of two years (not data provided).
The study of Lue (2006), included in Dhami (2017), reported no difference in FEV1 between the SLIT and placebo group after 24 weeks (no data provided).
The study of Pham-Thi (2007), included in Dhami (2017), reported a difference in FEV1 between children using SLIT versus placebo after 78 weeks (SLIT 88.5 ± 13.4 vs placebo 94.5 ± 14.6).
The study of Stelmach (2009), included in Dhami (2017), reported a difference in FEV1 between children using SLIT versus placebo after 104 weeks (SLIT 100.4 (95%CI 95.6-105.1) vs placebo 88.2 (95%CI 81.7-94.7). They also reported a difference in PEF between children using SLIT versus placebo after 104 weeks (SLIT 92.9 (95%CI 84.4-101.4 vs placebo 84.0 (95%CI 75.4-92.6).
The study of Shao (2014) reported a significant reduction in change in PEF between children using SLIT versus usual care after 7 and 12 months follow-up (p<0.01, no further data provided).
The study of Baris (2014) reported no significant difference in pulmonary function tests (FEV1, PEF, FEF25/75) at admission and after 12 months follow-up between SCIT and usual care (FEV1 (mean %): SCIT 90 ± 9 vs usual care mean 93 ± 11; PEF(mean %): SCIT 88 ± 18 vs usual care 98 ± 17; FEF25/75 (mean %): SCIT 112 ± 25 vs usual care 105 ± 25).
Airway inflammation
None of the included studies reported on the outcome airway inflammation.
Medication use
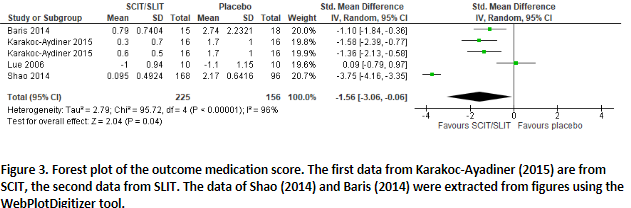
Six studies reported on medication score, calculated by types of medication, and recorded by patients and/or guardians during the study. The scoring was as follows: β-2 agonists, 1 point; inhaled/intranasal corticosteroids, 2 points; and 1 corticosteroid tablet, 3 points. The points were totaled to calculate the total medication score or asthma medication score.
Of the four studies in the meta-analysis of Dhami (2017), the study of Lue (2006) could be included in our meta-analysis. The data of Dahl (2006) in the meta-analysis of Dhami (2017) was found to be in adult patients instead of children, so therefore not included here. In total, four studies provided data that allowed pooling (Figure 3). After pooling, a SMD of -1.56 (95%CI -3.06; -0.06) in favor of SCIT/SLIT was found. This demonstrates a moderate effect size indicating that SLIT/SCIT could reduce medication use in children.
The study of Roberts (2006), included in Dhami (2017), reported a lower medication score after two seasons in the intervention group (intervention median 0.5 (IQR 0.0-1.7) vs control median 2.2 (IQR 0.0-3.2).
One study reported on use of asthma rescue inhalers.
The study of de Vos (2021) reported no significant difference in use of asthma rescue inhalers over three years follow-up between SCIT and usual care (p=0.91, no exact data provided).
One study reported on the use of controller medicines.
The study of de Vos (2021) reported no significant difference in use of controller medicines over three years follow-up between SCIT and usual care (p=0.91, no exact data provided).
One study reported on the average incidence rate of systemic corticosteroid bursts per child per year.
The study of de Vos (2021) reported no significant difference in use of systemic corticosteroid bursts between SCIT and usual care (SCIT 1.54 95%CI 1.12; 2.14 vs control 1.28 95%CI 0.85; 1.93, adjusted IRR 1.26, 95%CI 0.82; 1.96, p=0.29).
One study reported the inhaled corticosteroid discontinuation rate, measured after 12 months follow-up.
The study of Baris (2014) reported significantly higher inhaled corticosteroid discontinuation rate in the SCIT group compared with usual care (SCIT 20% vs control 0%, p=0.02).
One study reported the inhaled corticosteroid dosage, measured after 12 months follow-up.
The study of Baris (2014) reported significantly lower mean ± SD inhaled corticosteroid dosage in the SCIT group compared with usual care (SCIT 113 ± 76 mcg/day vs control 384 ± 52 mcg/day, p=0.01; MD 271 ± 23.16 in favor of SCIT). Data were extracted from figures using the WebPlotDigitizer tool.
Level of evidence of the literature
Asthma control
The level of evidence regarding the outcome measure asthma control was downgraded by two levels because of study limitations (risk of bias) and conflicting results (inconsistency) to low GRADE.
(Severe) exacerbations
The level of evidence regarding the outcome measure (severe) exacerbations was downgraded by two levels because of study limitations (risk of bias) and low number of included patients (imprecision) to low GRADE.
(Disease-specific) quality of life
The level of evidence regarding the outcome measure (disease-specific) quality of life was downgraded by two levels because of study limitations (risk of bias) and low number of included patients (imprecision) to low GRADE.
(Change in) lung function
The level of evidence regarding the outcome measure (change in) lung function was downgraded by two levels because of study limitations (risk of bias due to lack of blinding and no placebo comparison) and inconsistent results to low GRADE.
Airway inflammation
The level of evidence regarding the outcome measure airway inflammation was not assessed due to the lack of studies.
Medication use
The level of evidence regarding the outcome measure medication use was downgraded by two levels because of study limitations (risk of bias due to lack of blinding, high lost to follow-up, and no placebo comparison) to low GRADE.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of immunotherapy (SCIT/ SLIT) compared with placebo or usual care for children (6-12 yrs) and adolescents (>12 yrs) with stable asthma and inhalation allergy to pollen and/or grass and/or house dust mite on asthma control?
| P: | children (6-12yrs) and adolescents (>12 yrs) with stable asthma and inhalation allergy to pollen and/or grass and/or house dust mite; |
| I: | immunotherapy: subcutaneous immunotherapy (SCIT) or sublingual immunotherapy (SLIT); |
| C: | placebo or usual care; |
| O: | asthma control, asthma symptoms, (severe) exacerbations, (disease-specific) quality of life, change in lung function, medication use, and airway inflammation. |
Relevant outcome measures
The guideline development group considered asthma control, asthma symptoms and (severe) exacerbations as critical outcome measures for decision making; and (disease-specific) quality of life, change in lung function, medication use, and airway inflammation as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined a reduction in annual exacerbation rate or in the risk of having a severe asthma-related event ranging from 20–40% for a given asthma treatment regimen and/or intervention as a Minimal Clinical Important Difference (MCID) for exacerbations, based on Bonini 2020.
For the other dichotomic outcome measures, the working group used the GRADE default limits as limits for clinical decision making, which are defined as a risk ratio (RR) of >1.25 and <0.8 as clinically relevant.
For the outcome symptom score, the working group defined a reduction of 10% of the maximum score as MCID. For other continuous outcome measures, the working group defined a difference of 0.5 standard deviation (SD) as clinically relevant. When standardized mean difference (SMD) was used, 0.2 represented a small effect size, 0.5 a medium effect size and 0.8 a large effect size, based on Cohen, 1988.
Since the objective was to determine whether SLIT or SCIT is more effective than placebo or usual care, the results were compared only against the threshold of beneficial effect (figure 1).
Figure 1. Visual representation of the values of clinical decision making for any beneficial effect (retrieved from Batterham AM, Hopkons WG (2005). Making meaningful inferences about magnitudes. Sportscience 9, 6-13).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2012 until the 6th of April 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 600 hits. Studies were selected based on the following criteria: systematic reviews and RCTs about asthma and allergen immunotherapy in children. 32 studies were initially selected based on title and abstract screening. After reading the full text, 29 studies were excluded (see the table with reasons for exclusion under the tab Methods). Reference checking of excluded reviews resulted in inclusion of three additional studies, whereby a total of six studies were included in the analysis of the literature.
Results
Six studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Baris S, Kiykim A, Ozen A, Tulunay A, Karakoc-Aydiner E, Barlan IB. Vitamin D as an adjunct to subcutaneous allergen immunotherapy in asthmatic children sensitized to house dust mite. Allergy. 2014 Feb;69(2):246-53. doi: 10.1111/all.12278. Epub 2013 Nov 4. PMID: 24180595.
- Bonini M, Paolo MD, Bagnasco D, Baiardini I, Braido F, Caminati M, et al. Minimal clinically important difference for asthma endpoints: an expert consensus report. European Respiratory Review [Internet]. 2020 Jun 30 [cited 2023 Aug 8];29(156). Available from: https://err.ersjournals.com/content/29/156/190137
- Brüggenjürgen B, Klimek L & Reinhold T. Real world effectiveness and cost consequences of grass pollen SCIT compared with SLIT and symptomatic treatment. Allergo J Int. 2021; 30, 198206. https://doi.org/10.1007/s40629-021-00183-5
- Cohen J. Statistical Power Analysis for the Behavioral Sciences. 2nd ed. New York: Routledge; 1988. 567 p.
- de Vos G, Viswanathan S, Pichardo Y, Nazari R, Jorge Y, Ren Z, Serebrisky D, Rosenstreich D, Wiznia A. A randomized trial of subcutaneous allergy immunotherapy in inner-city children with asthma less than 4 years of age. Ann Allergy Asthma Immunol. 2021 Apr;126(4):367-377.e5. doi: 10.1016/j.anai.2020.12.016. Epub 2021 Jan 6. PMID: 33418053.
- Dhami S, Kakourou A, Asamoah F, Agache I, Lau S, Jutel M, Muraro A, Roberts G, Akdis CA, Bonini M, Cavkaytar O, Flood B, Gajdanowicz P, Izuhara K, Kalayci Ö, Mosges R, Palomares O, Pfaar O, Smolinska S, Sokolowska M, Asaria M, Netuveli G, Zaman H, Akhlaq A, Sheikh A. Allergen immunotherapy for allergic asthma: A systematic review and meta-analysis. Allergy. 2017 Dec;72(12):1825-1848. doi: 10.1111/all.13208. Epub 2017 Jul 6. PMID: 28543086.
- Hardin FM, Eskander PN, Franzese C. Cost-effective Analysis of Subcutaneous vs Sublingual Immunotherapy From the Payor's Perspective. OTO Open. 2021 Oct 25;5(4):2473974X211052955. doi: 10.1177/2473974X211052955. PMID: 34723051; PMCID: PMC8549470.
- James C, Bernstein DI. Allergen immunotherapy: an updated review of safety. Curr Opin Allergy Clin Immunol. 2017 Feb;17(1):55-59. doi: 10.1097/ACI.0000000000000335. PMID: 27906697; PMCID: PMC5644500.
- Karakoc-Aydiner E, Eifan AO, Baris S, Gunay E, Akturk E, Akkoc T, Bahceciler NN, Barlan IB. Long-Term Effect of Sublingual and Subcutaneous Immunotherapy in Dust Mite-Allergic Children With Asthma/Rhinitis: A 3-Year Prospective Randomized Controlled Trial. J Investig Allergol Clin Immunol. 2015;25(5):334-42. Erratum in: J Investig Allergol Clin Immunol. 2016;26(2):144. PMID: 26727762.
- Kiel MA, Röder E, Gerth van Wijk R, Al MJ, Hop WC, Rutten-van Mölken MP. Real-life compliance and persistence among users of subcutaneous and sublingual allergen immunotherapy. J Allergy Clin Immunol. 2013 Aug;132(2):353-60.e2. doi: 10.1016/j.jaci.2013.03.013. Epub 2013 May 4. PMID: 23651609.
- Lockey RF, Hankin CS. Health economics of allergen-specific immunotherapy in the United States. J Allergy Clin Immunol. 2011 Jan;127(1):39-43. doi: 10.1016/j.jaci.2010.09.033. PMID: 21211640.
- Rodríguez Del Río P, Vidal C, Just J, Tabar AI, Sanchez-Machin I, Eberle P, Borja J, Bubel P, Pfaar O, Demoly P, Calderón MA. The European Survey on Adverse Systemic Reactions in Allergen Immunotherapy (EASSI): A paediatric assessment. Pediatr Allergy Immunol. 2017 Feb;28(1):60-70. doi: 10.1111/pai.12660. Epub 2016 Nov 3. PMID: 27637414.
- Shao J, Cui YX, Zheng YF, Peng HF, Zheng ZL, Chen JY, Li Q, Cao LF. Efficacy and safety of sublingual immunotherapy in children aged 3-13 years with allergic rhinitis. Am J Rhinol Allergy. 2014 Mar-Apr;28(2):131-9. doi: 10.2500/ajra.2014.28.4006. PMID: 24717951.
- Stelmach I, Kaluzi?ska-Parzyszek I, Jerzynska J, Stelmach P, Stelmach W, Majak P. Comparative effect of pre-coseasonal and continuous grass sublingual immunotherapy in children. Allergy. 2012 Mar;67(3):312-20. doi: 10.1111/j.1398-9995.2011.02758.x. Epub 2011 Dec 6. PMID: 22142341.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 04-09-2024
Laatst geautoriseerd : 04-09-2024
Geplande herbeoordeling : 04-09-2029
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij tweedelijns astmazorg bij kinderen.
Werkgroep
- Dr. E.P. (Eric) de Groot, kinderlongarts, werkzaam bij Zuyderland Medisch Centrum te Heerlen, NVK (voorzitter)
- Drs. S.C. (Sanne) Hammer, kinderlongarts, werkzaam in het Amphia ziekenhuis te Breda, NVK
- Drs. E.A. (Ellen) Croonen, kinderlongarts, werkzaam in het Canisius Wilhelmina Ziekenhuis te Nijmegen, NVK
- Dr. H.T. (Martijn) den Dekker, kinderarts, werkzaam in het ErasmusMC – Sophia kinderziekenhuis te Rotterdam, NVK
- C.G.W. (Christel) Linssen-Geven, kinderlongverpleegkundige, werkzaam in het Catharina Ziekenhuis te Eindhoven, V&VN
- Dr. J.W.M. (Jean) Muris, huisarts en hoogleraar Huisartsgeneeskunde, NHG
- M.A.P. (Marjo) Poulissen-Erinkveld, senior beleidsadviseur, Longfonds & VND (tot mei 2023)
- Drs. Y. (Yvonne) Kappe, senior projectleider, Longfonds & VND (vanaf september 2023)
- E.M. (Esther) van der Roest, VND
- S.T. (Saskia) van Dorst M, ervaringsdeskundige, Longfonds
- E. (Esther) Oosterling-Vonk, Longfonds (vanaf maart 2023)
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- L.A.M. (Liza) van Mun, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Y. (Yvonne) van Kempen, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen Actie |
|
Jean Muris |
Universiteit Maastricht 1.0 fte |
Geen |
Geen |
Geen restricties |
|
Eric de Groot* |
Kinderlongarts, Zuyderland Medisch Centrum 80% Kinderlongarts Radboud UMC 0-uren (alleen diensten) |
Lid Medische commissie Villa Pardoes (onbetaald) APLS instructeur, SSHK (onbetaald) |
Geen |
Geen restricties |
|
Saskia van Dorst |
Longfonds ErvaringsDeskundige (vrijwilliger Longfonds) |
Geen |
Geen |
Geen restricties |
|
Marjo Poulissen |
Sr.Projectleider Longfonds 36 uur |
Geen |
Ik heb zelf astma, maar ben dan ook mede patientenvertegenwoordiger vanuit Longfonds en astmaVereniging nederland en Davos. |
Geen restricties |
|
Esther van der Roest |
Unitmanager CDL WKZ |
Lid astmaVereniging Nederland en Davos |
Alleen uit arbeid bij UMCU |
Geen restricties |
|
Martijn den Dekker |
Kinderarts – fellow kinderlongziekten, Sophia Kinderziekenhuis / Erasmus MC, Rotterdam. |
Geen |
Geen |
Geen restricties |
|
Sanne Hammer |
Kinderlongarts Amphia |
Geen |
Geen |
Geen restricties |
|
Christel Linssen-Geven |
Kinderlongverpleegkundige Catharina ziekenhuis Eindhoven (betaald) Lid van Taakgroep kinderlongverpleegkundigen (onbetaald) |
Gastdocent op Fontys Eindhoven en HU Utrecht (betaald) |
Geen |
Geen restricties |
|
Ellen Croonen |
Kinderlongarts, Canisius Wilhelmina Ziekenhuis Nijmegen |
Deelname aan beroepsgerelateerde initiatieven, onbetaald. |
SALSA studie; In vivo efficacy of Salbutamol (Sandoz) versus salbutamol (Ventolin GSK) (Salsa study)- Financier: Longfonds |
Geen restricties |
|
Yvonne Kappe |
Sr. Projectleider Longfonds 12 uur Vanuit Longfonds gedetacheerd naar Sr. Projectleider en Beleidsadviseur astmaVereniging Nederland en Davos 12 uur – vanaf 1 september 2023 |
Geen |
Geen |
Geen restrcities |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van meerdere personen vanuit het Longfonds en astmaVereniging Nederland en Davos in de werkgroep. Op verschillende momenten is input gevraagd tijdens een invitational conference en bij het opstellen van het raamwerk. Het verslag van de invitational conference (zie bijlagen] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module FeNO in diagnostisch traject |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module LTRA vs ICS bij recidiverend piepen |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module SCIT en SLIT bij kinderen met allergische astma |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Titreren behandeling op basis van FeNO |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Voorzetkamer of vernevelapparaat bij longaanval astma |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase heeft de NVK sectie Kinderlongziekten modules van de richtlijn Astma bij kinderen geprioriteerd voor herziening. Tevens zijn er knelpunten uitgevraagd in een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van vijf uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.