Medicatie bij aandrangincontinentie
Uitgangsvraag
Wat is de effectiviteit van medicamenteuze behandeling op aandrangincontinentie bij vrouwen?
Aanbeveling
Aanbeveling-1
Bied antimuscarinica aan als conservatieve behandeling van OAB-klachten bij vrouwen heeft gefaald.
Bied mirabegron aan als alternatief voor antimuscarinica bij gebrek aan effect of hinderlijke bijwerkingen.
Aanbeveling-2
Overweeg combinatietherapie met mirabegron boven dosisverhoging als een antimuscarinica behandeling ineffectief blijkt.
Overweeg evaluatie na 4-6 weken van patiënten die gestart zijn met antimuscarinica of mirabegron.
Aanbeveling-3
Overweeg bij ouderen afhankelijk van de al gebruikte medicatie te starten met mirabegron i.p.v. antimuscarinica.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de huidige samenvatting van de literatuur zijn uitkomsten beschreven afkomstig uit één SR (Balk, 2018). In totaal worden 11 van de 12 individuele studies beschreven, omdat één studie insufficiënte data rapporteert. Daarnaast is data gebruikt uit de studie van Yokoyama (2018). De omvang van de studiepopulatie in de samenvatting van de literatuur bestaat uitsluitend uit vrouwen. De geïncludeerde studies bestuderen allen antimuscarinica. Er zijn geen studies geïncludeerd die beta3-agonisten (bijv., mirabegron) bestuderen in een populatie van uitsluitend vrouwen. Dit punt wordt opgenomen als kennislacune. Daarnaast zijn geen studies gevonden die de combinatie van antimuscarinica met bekkenfysiotherapie en/of blaastraining vergelijken met placebo in deze populatie vrouwen. In de EAU richtlijn (Rai, 2012) wordt beschreven dat blaastraining in aanvulling op antimuscarinica de aandrangincontinentie niet verbeterde in vergelijking met medicatie alleen, maar wel de frequentie van mictie en de nycturie.
Oxybutynine vs. placebo
Zes studies bestuderen de vergelijking oxybutynine vs. placebo. De cruciale uitkomstmaten laten zien dat een behandeling met oxybutynine verbetering geeft (vermindering van frequentie en ernst van incontinentie episodes) in vergelijking met placebo. Er worden klinisch relevante effecten beschreven, met uitzondering van de sub-uitkomst ‘satisfaction’. De bewijskracht is laag. Voor de andere cruciale uitkomstmaat ‘quality of life’ wordt ook een klinisch relevant effect gevonden in het voordeel van oxybutynine. De bewijskracht hiervoor is redelijk. Voor de belangrijke uitkomstmaat ‘bijwerkingen’ wordt beschreven dat een behandeling met oxybutynine mogelijk gepaard gaat met een verhoogd risico op bewerkingen. Dit effect met een redelijke bewijskracht is niet klinische relevant. De meeste voorkomende bijwerking ‘droge mond’ wordt ook vaker gerapporteerd in de oxybutynine groep. Dit effect met een lage bewijskracht is klinisch relevant.
Tolterodine vs. placebo
Vier studies bestuderen de vergelijking tolterodine vs. placebo. De cruciale uitkomstmaten laten zien dat een behandeling met tolterodine verbetering geeft (vermindering van frequentie en ernst van incontinentie episodes) in vergelijking met placebo. Er worden klinisch relevante effecten beschreven, echter is de bewijskracht laag. De andere cruciale uitkomstmaat ‘quality of life’ is niet beschreven voor deze vergelijking. Een behandeling met tolterodine gaat mogelijk gepaard gaat met een verhoogd risico op bewerkingen. Dit effect met een lage bewijskracht is klinisch relevant.
Fesoterodine vs. placebo
Twee studies bestudeerden de vergelijking fesoterodine vs. placebo. De cruciale uitkomstmaten laten zien dat een behandeling met fesoterodine verbetering geeft (vermindering van frequentie en ernst van incontinentie episodes) in vergelijking met placebo. Er worden klinisch relevante effecten beschreven. De bewijskracht is redelijk. Voor de andere cruciale uitkomstmaat ‘quality of life’ wordt een effect gevonden in het voordeel van fesoterodine, echter is dit effect niet klinische relevant. De bewijskracht hiervoor is redelijk. Voor de belangrijke uitkomstmaat ‘bijwerkingen’ wordt beschreven dat een behandeling met fesoterodine mogelijk gepaard gaat met een verhoogd risico op bewerkingen. Dit effect met een redelijke bewijskracht is klinisch relevant.
Solifenacine vs. placebo
Eén studie bestudeert de vergelijking solifenacine vs. placebo. De follow-up periode van deze studie is 4 weken. De cruciale uitkomstmaten laten zien dat een behandeling met solifenacine verbetering geeft (vermindering van frequentie en ernst van incontinentie episodes) in vergelijking met placebo. Er worden klinisch relevante effecten beschreven. Echter is de bewijskracht hiervoor zeer laag. Voor de andere cruciale uitkomstmaat ‘quality of life’ wordt ook een klinisch relevant effect gevonden in het voordeel van solifenacine. De bewijskracht hiervoor is laag. De belangrijke uitkomstmaat “bijwerkingen” is niet beschreven voor deze vergelijking.
Aanvullende literatuur
Het literatuuronderzoek heeft zich beperkt tot studies waarbij uitsluitend vrouwen geïncludeerd werden.
Er zijn echter ook grote trials naar voren gekomen in de zoekvraag die niet geselecteerd werden in de samenvatting van de literatuur, omdat het een gemengde populatie (mannen en vrouwen) met een idiopathische overactieve blaas (OAB) betrof. In deze alinea wil de werkgroep enkele van deze trials onder de aandacht brengen. Deze studies worden momenteel ook geanalyseerd binnen een andere richtlijn, namelijk de richtlijn ‘urine-incontinentie (UI) 2e- en 3e-lijnszorg’, module ‘Medicamenteuze behandeling bij UI’.
De EMPOWUR-trial bestudeert het nog niet in Nederland beschikbare vibegron (Staskin, 2020). In deze internationale dubbel geblindeerde RCT werden 1518 patiënten (85% vrouw) geïncludeerd die 12 weken vibegron 75mg, tolterodine 4mg of placebo kregen. In de vibegron groep had 52.4% een ≥75% reductie van urge incontinentie episodes vs. 47.6% van de patiënten die tolterodine kregen en 36.38% in de placebogroep (p<0.05).
Een ander artikel beschrijft de veiligheid en effectiviteit van alle door de producent gesponsorde fase 2-4 studies met mirabegron met antimuscarinica (solifenacine en tolterodine) en placebo in mannen en vrouwen (65-76% is vrouw in deze studies) met OAB wereldwijd (Chapple, 2020). Medicatie gerelateerde bijwerkingen komen meer voor bij antimuscarinica, dan bij mirabegron en de placebogroep. Het vóórkomen van hypertensie was gelijk in de antimuscarinica, mirabegron en in de placebogroep. Mirabegron zou een gunstiger bijwerkingenprofiel hebben bij ouderen en patiënten met bekende obstipatie. Hierbij moet opgewerkt worden dat dit onderzoek gefinancierd is door de producent.
In de SYNERGY II dubbel geblindeerde multicenter RCT werden 1829 patiënten (80% vrouw) geïncludeerd met urge urine-incontinentie. Zij kregen solifenacine 5mg, mirabegron50mg of een combinatie van beiden gedurende 1 jaar (Mueller, 2019). Combinatietherapie gaf minder incontinentie episodes vergelijken met mirabegron of solifenacine monotherapie (vs mirabegron: adjusted mean difference (AMD) −0.5, 95%CI −0.7 to −0.2, p < 0.001; vs solifenacine: AMD −0.1, 95% CI −0.4 to 0.1, p = 0.002) en mictiefrequentie (vs mirabegron: AMD −0.5, 95% CI −0.8 to −0.2, p < 0.001; vs solifenacine: AMD −0.4, 95% CI −0.7 to −0.1, p = 0.004). Een andere publicatie van de SYNERGY-trial laat de PROs (patient reported outcomes) zien waarbij de combinatietherapie verbetering geeft op HRQOL-parameters zoals de OAB-q symptom bother score (Robinson, 2018).
Met behulp van de uitgangsvraag werd literatuur gezocht die uitsluitend vrouwen met urge incontinentie beschreef. Subgroepen binnen deze populatie zijn niet aangetroffen in de samenvatting van de literatuur. In de Europese richtlijn (EAU) wordt wel een subgroep beschreven t.a.v. oudere patiënten. De EAU vat de literatuur over de oudere patiënt als volgt samen:
- Antimuscarinica zijn even effectief bij ouderen, vergeleken met jongere patiënten met een overactieve blaas (OAB).
- Oxybutynine kan cognitieve functie verslechteren bij oudere mensen met OAB.
- Solifenacine, darifenacine en fesoterodine veroorzaken geen cognitieve dysfunctie in ouderen in korte termijn studies.
- De impact van medicatie met anticholinergische effecten is cumulatief en vergroot bij langduriger exposure bij ouderen.
- Mirabegron is effectief en veilig bij ouderen.
In de richtlijn urine-incontinentie (UI) 2e- en 3e-lijnszorg wordt ook aandacht besteed aan medicatie gebruik bij kwetsbare ouderen. Momenteel wordt deze module herzien.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De tolerantie (balans tussen effectiviteit en bijwerkingen) van antimuscarinica en mirabegron is onderzocht in o.a. de PREFER-studie (Staskin, 2018), waarbij patiënten (73% vrouw) met OAB mirabegron met tolterodine in een cross-over design als monotherapie gedurende 3 maanden gebruikten. De ‘medication tolerability score’ en klinische verbetering was meer uitgesproken in de mirabegron groep dan bij tolterodine groep, en meer uitgesproken bij vrouwen, patiënten ouder ≥65 jaar en patiënten zonder incontinentie bij start van de studie.
In de richtlijn van de EAU wordt het volgende beschreven over waarden en voorkeur van patiënten; (1) naleving aan antimuscarinische behandeling is laag en verminderd over tijd door gebrek aan effect, bijwerkingen en kosten, (2) de meeste patiënten stoppen de antimuscarinische medicijnen in de 1e 3 maanden.
Kosten (middelenbeslag)
Ten aanzien van de kosten varieert de prijs van antimuscarinica per dag tussen de 0,24 cent (solifenacine 10mg/oxybutynine 5mg) en de 0,90 cent (fesoterodine 4mg/mirabegron 50mg). Op jaarbasis kan dit een behoorlijke impact geven op het eigen risico (zie onderstaande tabel (d.d. 8-3-22). Voor deze geneesmiddelen hoeft naast het eigen risico niet te worden bijbetaald. Bij gelijke effectiviteit zou o.b.v. kosten solifenacine 10mg de eerste keuze moeten zijn.
Tabel prijs per geneesmiddel.
|
Naam geneesmiddel |
Prijs per dag |
Prijs per jaar |
|
Darifenacine (emselex) 7.5mg |
€ 0.88 |
€ 321.20 |
|
Darifenacine (emselex) 15mg |
€ 0.54 |
€ 197.10 |
|
Fesoterodine (toviaz) 4mg |
€ 0.90 |
€ 328.50 |
|
Fesoterodine (toviaz) 8mg |
€ 0.58 |
€ 211.70 |
|
Oxybutynine (generiek) 2.5mg |
€ 0.59 |
€ 215.35 |
|
Oxybutynine (generiek) 5mg |
€ 0.24 |
€ 87.50 |
|
Solifenacine (generiek) 5mg |
€ 0.43 |
€ 156.95 |
|
Solifenacine (generiek) 10mg |
€ 0.24 |
€ 87.50 |
|
Tolterodine (generiek) 1mg |
€ 0.74 |
€ 270.10 |
|
Tolterodine (generiek) 2mg |
€ 0.46 |
€ 167.90 |
|
Tolterodine (generiek) 4mg |
€ 0.30 |
€ 109.50 |
|
Mirabegron (betmiga) 50mg |
€ 0.90 |
€ 328.50 |
Aanvaardbaarheid, haalbaarheid en implementatie
Er is geen consistent bewijs dat aantoont dat medicatie superieur is over conservatieve therapie. In een systematische review van 7 RCTs waarbij antimuscarinica werd vergeleken met blaastraining en medicatie met blaastraining vergeleken werd met blaastraining gaf alleen voor oxybutinine een voordeel in verbetering of genezing van de aandrangincontinentie (Rai, 2012). Echter de geïncludeerde studies hebben kleine aantallen, heterogeniteit en een beperkt aantal onderzochte antimuscarinica. Conservatieve therapie in de vorm van blaastraining en bekkenfysiotherapie kent echter geen bijwerkingen en zou een eerste stap kunnen zijn in de behandeling van aandrangincontinentie bij vrouwen, echter valt dat buiten de onderzoeksvraag voor deze module.
Geen van de antimuscarinica is superieur ten opzichte van een ander ten aanzien van het genezen of verbeteren van OAB-klachten. Hogere dosis antimuscarinica zijn meer effectief in het verbeteren van OAB-symptomen, maar genereren wel meer bijwerkingen.
De meeste patiënten stoppen het gebruik van antimuscarinica in de eerste 3 maanden. Deze lage therapietrouw wordt verklaard door een ervaren gebrek aan effectiviteit, bijwerkingen en kosten van het geneesmiddel. De werking van antimuscarinica is maximaal na 4 weken (farmacotherapeutisch kompas). Bij mirabegron is de tijd tot maximaal effect langer, namelijk rond de 6 weken. Raadzaam is het recept voor maximaal 6 weken uit te schrijven met het oog op duurzaamheid en na 6 weken telefonisch de behandeling te evalueren t.a.v. effect en bijwerkingen. Patiënten kunnen geïnstrueerd worden bij hinderlijke bijwerkingen de medicatie te staken en eerder met de behandelaar contact op te nemen. Frequent gerapporteerde bijwerkingen van mirabegron zijn tachycardie (1-10%) en palpitaties (0,1-1%). Daarbij is bloeddrukcontrole noodzakelijk bij patiënten die antihypertensiva gebruiken.
Rationale van de aanbeveling
Aanbeveling-1
Geen antimuscarinicum is duidelijk superieur ten opzichte van de ander in het verbeteren of genezen van urge incontinentie bij vrouwen. Hogere dosis van een antimuscarinica zijn effectiever in het verbeteren van OAB-symptomen, maar generen een hoger risico op bijwerkingen. Mirabegron is mogelijk effectiever dan placebo en even effectief als antimuscarinica voor de verbetering van OAB/urge incontinentie symptomen. Dit is echter niet naar voren gekomen uit de samenvatting van de literatuur, omdat de PICO-vraag zich heeft gelimiteerd tot literatuur met uitsluitend vrouwen, maar wordt wel beschreven in de EAU richtlijn urine-incontinentie.
Aanbeveling-2
De meeste patiënten stoppen antimuscarinica tijdens de eerste 3 maanden, vanwege gebrek aan effectiviteit of bijwerkingen. Patiënten die onvoldoende behandeld worden met solifenacine 5 mg hebben lijken meer te hebben aan de toevoeging van mirabegron dan aan dosis verhoging van solifenacine.
Aanbeveling-3
Aanbeveling-subgroep ouderen
Hoewel de verschillende antimuscarinica mogelijk even effectief zijn bij ouderen, is de impact van medicatie met anticholinerge effecten cumulatief en neemt de impact mogelijk toe bij langdurig gebruik. Mirabegron is mogelijk veiliger bij ouderen.
Onderbouwing
Achtergrond
Vrouwen met aandrangincontinentie starten vaak met bekkenfysiotherapie in de eerste lijn. Hierbij wordt naast uitleg en oefentherapie ook vaak blaastraining toegepast. Als er onvoldoende verbetering van klachten bereikt wordt, is medicamenteuze behandeling de eerste behandelkeuze. Er zijn verschillende medicament beschikbaar, waarbij de meeste keuze is in antimuscarinica. Deze preparaten verschillen in farmacokinetische eigenschappen zoals vetoplosbaarheid en halfwaardetijd, maar hebben vergelijkbare bijwerkingen zoals droge mond, wazig zien, vermoeidheid of veranderde cognitieve functie. Daarnaast is er sinds een aantal jaar een beta3adrenoreceptor agonist beschikbaar, mirabegron, die een gunstiger bijwerkingen profiel lijkt te hebben. Met behulp van onderstaande PICO wordt een antwoord gezocht op bovenstaande vraag.
Conclusies / Summary of Findings
1. Oxybutynin vs. placebo
Conclusions
|
Low GRADE |
Oxybutynin may reduce urge incontinence symptoms (i.e., cure, improvement) when compared with placebo in women with urge incontinence.
Sources: Burgio, 1998; Moore, 1990; Szonyi, 1995; Thuroff, 1991 |
|
Low GRADE |
Oxybutynin may result in little to no difference in urge incontinence symptoms (i.e., satisfaction) when compared with placebo in women with urge incontinence.
Sources: Gittelman, 2014; Sand, 2012. |
|
Moderate GRADE |
Oxybutynin likely increases quality of life when compared with placebo in women with urge incontinence.
Sources: Sand, 2012. |
|
Low GRADE |
Oxybutynin may result in little to no difference in the occurrence of any adverse events when compared with placebo in women with urge incontinence.
Sources: Gittelman, 2014; Sand, 2012. |
|
Low GRADE |
Oxybutynin may increase adverse events (i.e., dry mouth) when compared with placebo in women with urge incontinence.
Sources: Khallur, 2004; Rogers, 2008. |
2. Tolterodine vs. placebo
Conclusions
|
Low GRADE |
Tolterodine may reduce urge incontinence symptoms (i.e., cure and improvement) when compared with placebo in women with urge incontinence.
Sources: Rogers, 2008;2009. |
|
Low GRADE |
Tolterodine may increase any adverse events when compared with placebo in women with urge incontinence.
Sources: Khallur, 2004; Rogers, 2008. |
3. Fesoterodine vs. placebo
Conclusions
|
Moderate GRADE |
Fesoterodine probably reduces urge incontinence symptoms (i.e., improvement) when compared with placebo in women with urge incontinence.
Sources: Huang, 2014; Yokoyama, 2018. |
|
Low GRADE |
Fesoterodine probably results in little to no difference in quality of life when compared with placebo in women with urge incontinence.
Sources: Huang, 2014; Yokoyama, 2018 |
4. Solifenacin vs. placebo
Conclusions
|
Very Low GRADE |
It is uncertain what the effect of treatment with solifenacin is on urge incontinence symptoms (i.e., improvement), when compared to placebo treatment, in women with urge incontinence.
Sources: Oreskovic, 2013. |
|
Low GRADE |
Solifenacin may increase quality of life when compared with placebo in women with urge incontinence.
Sources: Oreskovic, 2013. |
Samenvatting literatuur
Description of studies
Balk (2018) performed an update of a previous systematic review from 2012 (Shamliyan, 2012), which evaluated comparisons of nonsurgical treatments for urinary incontinence (UI) in (adult) women. Several comparisons were updated by Balk (2018), of which we here report the comparison ‘What are the benefits and harms of pharmacological treatments of UI in women, and how do they compare with each other?’. All studies that were included in the review of by Shamliyan (2012) were eligible for inclusion. Balk (2018) extended the literature search from 01-01-2011 to 04-12-2017 to identify relevant new studies. The search was conducted in MEDLINE, the Cochrane Central Trials Registry, the Cochrane Database of Systematic Reviews, and Embase databases. Data was selected based on the predefined PICO, a follow-up period of minimal weeks, and only RCTs for effectiveness outcomes (i.e., urge incontinence and quality of life). All relevant data was extracted for the individual studies. The Cochrane risk of bias tool was used to assess the individual risk of bias in the included studies. The total body of evidence was assessed per comparison, per outcome measure with the AHRQ Methods Guide. The primary outcomes of interest were UI outcomes (i.e., cure, improvement, and satisfaction). Other outcomes of interest were quality of life and adverse events. In total, 12 studies (with n=3845, mean age of 52 years) were included in the comparison of interest (i.e., anticholinergics (a 2nd line treatment used primarily for urgency UI) vs. placebo treatment). Of them, 6 studied a comparison with oxybutynin, 4 with tolterodine, 1 with fesoterodine, and 1 with solifenacin. A limitation of the current SR was that outcomes were not described per individual study, only per comparison.
Yokoyama (2018) performed a pooled analysis of individual patient data from 10 identically designed RCTs. These RCTs were double-blind, placebo-controlled, parallel-group studies over a period of 12 weeks. Patients were randomized to receive fesoterodine or placebo treatment. Women aged above 65 years were included if they met the other inclusion criteria; overactive bladder (OAB) symptoms for a minimum of 6 months with >0 UUI episodes/24 h at baseline in a bladder diary. The primary aim was the change from baseline to week 12 in the number of UUI episodes/24 h. Other outcomes of interest were changes (baseline to 12 weeks) in OAB-q scores for symptom bother and HRQOL scales, and treatment related adverse events. In total data of 1004 patients (i.e., without hypertension) were used in the current summary of literature. Of them, 623 patients received fesoterodine and 381 placebo treatment. A limitation of the current study is that it was designed to identify difference between females with hypertension and without. However, the current summary of literature used only data of women without hypertension. Furthermore, no data was reported about the number of patients who were lost to follow and/or dropped out during the study period.
Results
The outcomes are described below per comparison and per outcome, based on the SR of Balk (2018).
The crucial outcome urge incontinence symptoms was described as cure, improvement, and/or satisfaction. This was defined as follows.
- The outcome ‘cure’ was defined as absence of incontinence episodes in bladder diaries, negative pad stress, or no abnormalities noted on urodynamics.
- The outcome ‘improvement’ was defined as improvement in reduction of frequency and severity of incontinence episodes by >50%; reduction in pad stress test by >50%; reduction in restrictions of daily activities due to incontinence; women’s perception of improvement in their bladder condition.
- The outcome ‘satisfaction’ was not defined. However, it was mentioned that it was assessed with several validated tools, including the Overactive Bladder Symptom Score, the Benefit, Satisfaction with Treatment, and Willingness, the Estimated Percent Improvement, or the Global Perception of Improvement.
The other crucial outcome quality of life was defined as subject’s reports about emotional, physical, and social wellbeing. The important outcome adverse events was defined as any harmful and undesired effect in treated subjects.
Outcomes (i.e., changes in UUI episodes/24h, QoL, AE) of the study of Yokoyama (2018) were added in the comparison ‘fesoterodine vs. placebo’.
1. Oxybutynin vs. placebo
This comparison was of interest in six studies of the SR (Burgio, 1998; Gittelman, 2014; Moore, 1990; Sand, 2012 Szonyi, 1995; Thuroff, 1991).
1.1 Cure
The outcome ‘cure’ was reported in one of the included studies (Moore, 1990). Only patients in the intervention group (5/28 (18%)) achieved this outcome after 4 weeks. This resulted in an RR of 9.90 (95%CI 0.60 to 169.90), with risk difference of 0.15 (95%CI 0.07 to 0.23).
1.2 Improvement
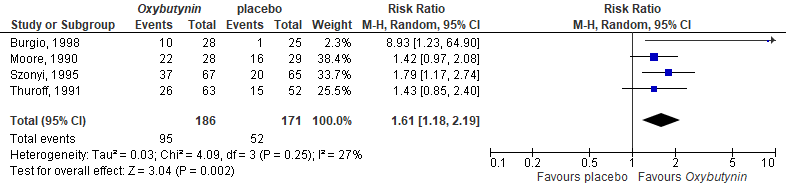
Improvement in UI was reported in four of the included studies (Moore, 1990; Szonyi, 1995; Burgio, 1998; Thuroff, 1991). Overall, 95/186 (51%) patients treated in the intervention group achieved this outcome, compared with 52/171 (30%) in the placebo group. This resulted in a pooled RR of 1.61 (95%CI 1.18 to 2.19), favoring the oxybutynin group, see Figure 1. The risk difference was 0.22 (95%CI 0.13 to 0.32).
Figure 1. Forest plot for improvement; oxybutynin vs. placebo.
1.3 Satisfaction
The study of Gittelman (2014) reported weekly incontinence episodes. More improvement in total (stress and urge) weekly incontinence episodes were shown for the intervention group (n=115) compared with the control group (n=112; mean changes -16.8 vs. -13.8). This resulted in a standardized mean difference of -0.19 (95%CI -0.45 to 0.07), in favor of the intervention group.
The study of Sand (2012) reported daily urinary incontinence episodes. More improvement in total (stress and urge) weekly incontinence episodes were shown for the intervention group (n=352) compared with the control group (n=352; mean changes -3.0 vs. -2.5). This resulted in a standardized mean difference of -0.17 (95%CI -0.32 to -0.02), in favor of the intervention group.
1.4 Quality of life
This was assessed with 2 questionnaires: Impact Questionnaire (IIQ) and the King’s Health Questionnaire (KHQ) in one of the included studies (Sand, 2012). Scores improved more in the intervention group (n=352) after 12 weeks, compared with the control group (n=352). However, as only scores of subscales were reported for the KHQ, it was not possible to calculate the overall mean difference. This was possible for the IIQ, resulting in a standardized mean difference of -8.32 (95%CI -8.78 to -7.86), favoring the intervention group.
1.5 Adverse events
The occurrence of any AE was reported in Gittelman (2014) and Sand (2012).
Gittelman (2014) reported that an AE occurred in 89/143 (62%) patients in the intervention group, compared with 75/155 (48%) in the control group. Urinary tract infection and dry mouth were most common in the intervention group vs. placebo, respectively (13 vs. 7 and 7 vs. 4).
Sand (2012) reported that an AE occurred in 203/352 (58%) patients in the intervention group, compared with 171/352 (49%) in the control group. Dry mouth was most common in the intervention group vs. placebo, respectively (26 vs. 10).
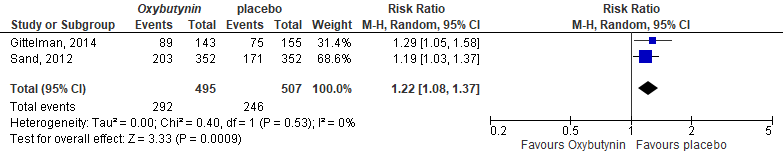
The pooled RR was 1.22 (95%CI 1.08 to 1.37), meaning higher risk on AE in the intervention group, see Figure 2. The risk difference was 0.11 (95%CI 0.04 to 0.17).
Figure 2. Forest plot for any adverse events; oxybutynin vs. placebo
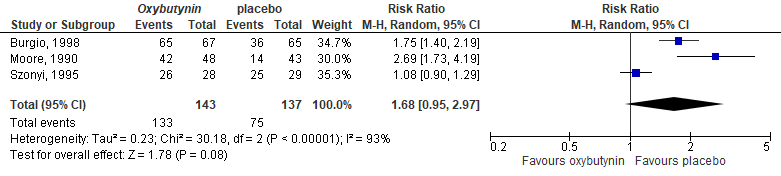
Three other studies reported only outcomes per AE. The AE ‘dry mouth’ was the most common AE, see Figure 3. The pooled RR was 1.68 (95%CI 0.95 to 2.97), meaning higher risk on dry mouth in the intervention group. The risk difference was 0.34 (95%CI 0.07 to 0.62).
Figure 3. Forest plot for dry mouth; oxybutynin vs. placebo
Level of evidence of the literature
The level of evidence (GRADE method) is determined per comparison and outcome measure and is based on results from RCTs and therefore starts at level “high”. Subsequently, the level of evidence was downgraded if there were relevant shortcomings in one of the several GRADE domains: risk of bias, inconsistency, indirectness, imprecision, and publication bias.
The level of evidence regarding the outcome measures urge incontinence symptoms (i.e., cure), was downgraded by 2 levels because imprecision (95%CI of the mean difference includes no significant effect (RR=1), no clinically relevant effect (RR 0.75-1.25), and not meeting the optimal information size).
The level of evidence regarding the outcome measures urge incontinence symptoms (i.e., improvement), was downgraded by 2 levels because imprecision (95%CI of the mean difference includes no clinically relevant effect (RR 0.75-1.25), and not meeting the optimal information size).
The level of evidence regarding the outcome measures urge incontinence symptoms (i.e., satisfaction (weekly)), was downgraded by 2 levels because imprecision (95%CI of the mean difference includes no significant effect, no clinically relevant effect (SMD<0.5), and not meeting the optimal information size).
The level of evidence regarding the outcome measures urge incontinence symptoms (i.e., satisfaction (daily)), was downgraded by 2 levels because imprecision (95%CI of the mean difference includes no clinically relevant effect (SMD<0.5), and not meeting the optimal information size).
The level of evidence regarding the outcome measures quality of life was downgraded by 1 level because of imprecision (not meeting the optimal information size).
The level of evidence regarding the outcome measures adverse events (i.e., any AE), was downgraded by 2 levels because of imprecision (95%CI of the mean difference includes no clinically relevant effect (RR 0.75-1.25), and not meeting the optimal information size)
The level of evidence regarding the outcome measures adverse events (i.e., dry mouth), was downgraded by 2 levels because of imprecision (95%CI of the mean difference includes no significant effect (RR=1), no clinically relevant effect (RR 0.75-1.25) and not meeting the optimal information size).
|
Low GRADE |
Oxybutynin may reduce urge incontinence symptoms (i.e., cure, improvement) when compared with placebo in women with urge incontinence.
Sources: Burgio, 1998; Moore, 1990; Szonyi, 1995; Thuroff, 1991 |
|
Low GRADE |
Oxybutynin may result in little to no difference in urge incontinence symptoms (i.e., satisfaction) when compared with placebo in women with urge incontinence.
Sources: Gittelman, 2014; Sand, 2012. |
|
Moderate GRADE |
Oxybutynin likely increases quality of life when compared with placebo in women with urge incontinence.
Sources: Sand, 2012. |
|
Low GRADE |
Oxybutynin may result in little to no difference in the occurrence of any adverse events when compared with placebo in women with urge incontinence.
Sources: Gittelman, 2014; Sand, 2012. |
|
Low GRADE |
Oxybutynin may increase adverse events (i.e., dry mouth) when compared with placebo in women with urge incontinence.
Sources: Khallur, 2004; Rogers, 2008. |
2. Tolterodine vs. placebo
This comparison was of interest in four studies (Khullar, 2004; McMicheal, 2013; Rogers, 2008;2009) of the SR. However, insufficient data was reported in the study of McMicheal (2013), and therefore this study was removed from the analysis.
2.1 Cure
The outcome ‘cure’ was reported in one of the included studies (Rogers, 2008). More patients in the intervention group (115/202 (57%)) achieved this outcome after 12 weeks, compared with the placebo group (89/211 (42%)). This resulted in an RR of 1.40 (95%CI 0.90 to 1.60), with risk difference of 0.06 (95%CI 0.02 to 0.10).
2.2 Improvement
The outcome ‘improvement’ was reported in one of the included studies (Rogers, 2009). More patients in the intervention group (79/202 (39%)) achieved this outcome after 12 weeks, compared with the placebo group (58/211 (27%)). This resulted in an RR of 1.40 (95%CI 1.10 to 1.90), with risk difference of 0.08 (95%CI 0.03 to 0.13).
2.3 Satisfaction
This outcome was not reported in the studies for the current comparison.
2.4 Quality of life
This outcome was described in two of the included studies (Khullar, 2004; Rogers, 2009). However, only outcomes of subscales were reported by both studies, and therefore, no effect estimate could be obtained. In the individual trial of Khullar (2004) it is mentioned that quality of life improved more in all subscales in the intervention group compared with the control group. This was also shown in the study of Rogers (2009).
2.5 Adverse events
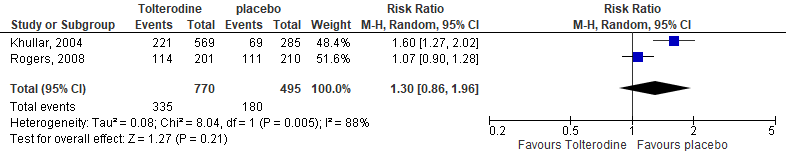
The occurrence of any AE was reported in two of the included studies (Khullar, 2004; Rogers, 2008). Khullar (2004) reported 221/569 (39%) AEs in the intervention group, compared with 69/285 (34%) in the placebo group. Rogers (2008) reported 114/201 (57%) AEs in the intervention group, compared with 111/210 (53%) in the placebo group. The pooled estimate resulted in a RR of 1.30 (95%CI 0.86 to 1.96), meaning a higher risk on any AE in the intervention groups. The risk difference was 0.10 (95%CI -0.01 to 0.20), see Figure 4.
Figure 4. Forest plot for adverse events; tolterodine vs. placebo
Level of evidence of the literature
The level of evidence regarding the outcome measures quality of life could not be assessed with GRADE. Since no effect estimate could be provided.
The level of evidence regarding the outcome measures urge incontinence symptoms (i.e., cure) was downgraded by 2 levels because imprecision (95%CI of the mean difference includes no significant effect (RR=1), no clinically relevant effect (RR 0.75-1.25), and not meeting the optimal information size).
The level of evidence regarding the outcome measures urge incontinence symptoms (i.e., improvement) was downgraded by 2 levels because imprecision (95%CI of the mean difference includes no clinically relevant effect (RR 0.75-1.25), and not meeting the optimal information size).
The level of evidence regarding the outcome measure adverse events was downgraded by 2 levels because imprecision (95%CI of the mean difference includes no significant effect (RR=1), no clinically relevant effect (RR 0.75-1.25), and not meeting the optimal information size).
Conclusions
|
Low GRADE |
Tolterodine may reduce urge incontinence symptoms (i.e., cure and improvement) when compared with placebo in women with urge incontinence.
Sources: Rogers, 2008;2009. |
|
Low GRADE |
Tolterodine may increase any adverse events when compared with placebo in women with urge incontinence.
Sources: Khallur, 2004; Rogers, 2008. |
3. Fesoterodine vs. placebo
This comparison was of interest in one study (Huang, 2014) of the SR and in the study of Yokoyama (2018).
3.1 Cure
This outcome was not reported in the study of Huang (2014) nor in the study of Yokoyama (2018).
3.2 Improvement
The study of Huang (2014) reported that after the intervention period of 12 weeks, symptoms were improved in 181/303 (60%) patients in the intervention group. This was shown in 140/303 (46%) patients in the control group. This resulted in a RR of 1.29 (95% CI 1.11 to 1.51), with a risk difference of 0.14 (95%CI 0.06 to 0.21).
The study of Yokoyama (2018) reported that the change in UUI episodes per 24h at week 12 was -0.84 in the intervention group (n=623) and +0.03 in the placebo group (n=381). This resulted in a mean difference of -0.83 in favor of the intervention group. As de SD was not reported, it is not possible to calculate a 95%CI.
3.3 Satisfaction
This outcome was not reported in the study of Huang (2014) nor in the study of Yokoyama (2018).
3.4 Quality of life
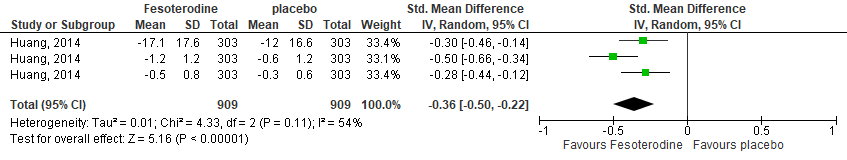
The study of Huang (2014) assessed this outcome with 3 questionnaires: Overactive Bladder Questionnaire, Patient perception of bladder condition, and patient perception of urgency scale. Scores improved more in the intervention group after 12 weeks, compared with the control group. This resulted in a standardized mean difference of -0.36 (95%CI -0.50 to -0.22), favoring the intervention group, see Figure 5.
Figure 5. Forest plot for quality of life; fesoterodine vs. placebo
The study of Yokoyama (2018) assessed this outcome with the Overactive Bladder Questionnaire scores for ‘symptom bother’ and ‘HRQOL’.
The mean change score for ‘symptom bother’ from baseline to week 12 was -27.25 (SD 1.03) in the intervention group, and -14.43 (1.24) in the placebo group. This resulted in a mean difference of -12.77 (95%CI -12.92 to 12.62) in favor of the intervention group.
The mean change in ‘total HRQOL scores’ from baseline to week 12 was 21.51 (0.88) in the intervention group, compared with 11.1 (1.07) in the control group. This resulted in a mean difference of 10.41 (95%CI -23.90 to 21.54), also in favor of the intervention group.
3.5 Adverse events
In the study of Huang (2014), any AEs were of interest. In the intervention group 187/303 (62%) patients reported the occurrence of any AE, compared with 149/303 (50%) in the placebo group. This resulted in a RR of 1.26 (95%CI 1.09 to 1.45).
Yokoyama (2018) reported any treatment-related AEs. In the intervention group 278/623 (45%) patients reported the occurrence of any AE, compared with 86/381 (23%) in the placebo group. This resulted in a RR of 1.98 (95%CI 1.61 to 2.43).
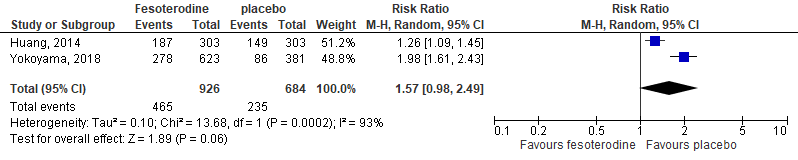
The pooled RR in a RR of 1.57 (95%CI 0.98 to 2.49), with a risk difference of 0.18 (0.08 to 0.27), see Figure 6.
Figure 6. Forest plot for adverse events; fesoterodine vs. placebo.
Level of evidence of the literature
The level of evidence regarding the outcome measure urge incontinence symptoms (i.e., improvement) was downgraded by one level because of imprecision (95%CI of the mean difference includes no clinically relevant effect (RR 0.75-1.25)).
The level of evidence regarding the outcome measure quality of life was downgraded by one level because of imprecision (95%CI of the mean difference includes no clinically relevant effect (SMD<0.5)).
The level of evidence regarding the outcome measure adverse events was downgraded by one level because of imprecision (95%CI of the mean difference includes no clinically relevant effect (RR 0.75-1.25)).
Conclusions
|
Moderate GRADE |
Fesoterodine probably reduces urge incontinence symptoms (i.e., improvement) when compared with placebo in women with urge incontinence.
Sources: Huang, 2014; Yokoyama, 2018. |
|
Low GRADE |
Fesoterodine probably results in little to no difference in quality of life when compared with placebo in women with urge incontinence.
Sources: Huang, 2014; Yokoyama, 2018 |
4. Solifenacin vs. placebo
This comparison was of interest in one study (Oreskovic, 2013) of the SR.
4.1 Cure
This outcome was not reported in the study for the current comparison.
4.2 Improvement
After the intervention period of 4 weeks, 71/76 (93%) patients in the intervention group improved symptoms. This was shown in 0/73 (0%) patients in the control group. This resulted in a RR of 137.43 (95% CI 8.67 to 217.14), with a risk difference of 0.83 (95%CI 0.87 to 0.99).
4.3 Satisfaction
This outcome was not reported in the study for the current comparison.
4.4 Quality of life
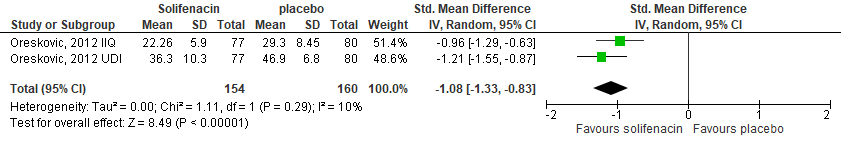
Daily activity was measured with Incontinence Impact Questionnaire (IIQ), and distress with Urinary Distress Inventory (UDI). After 4 weeks intervention IIQ and UDI scores improved more in the intervention group compared to the control group. This resulted in a standardized mean difference of -1.08 (95%CI -1.33 to -0.83), favoring the intervention group, see Figure 7.
Figure 7. Forest plot for quality of life; solifenacin vs. placebo
4.5 Adverse events
In the study of Oreskovic (2013), AEs were only reported in the intervention group, and therefore, it was not possible to calculate an effect estimate. The most common AEs were dry mouth and constipation.
Level of evidence of the literature
The level of evidence regarding the outcome measures adverse events could not be assessed with GRADE. Since no effect estimate could be provided.
The level of evidence regarding the outcome measures urge incontinence symptoms (i.e., improvement) was downgraded by 3 levels because of imprecision (2 levels, wide 95%CI, and not meeting the optimal information size), and risk of bias (1 level, relative short follow-up of 4 weeks).
The level of evidence regarding the outcome measures quality of life was downgraded by 2 level because of imprecision (1 level, not meeting the optimal information size), and risk of bias (1 level, relative short follow-up of 4 weeks).
Conclusions
|
Very Low GRADE |
It is uncertain what the effect of treatment with solifenacin is on urge incontinence symptoms (i.e., improvement), when compared to placebo treatment, in women with urge incontinence.
Sources: Oreskovic, 2013. |
|
Low GRADE |
Solifenacin may increase quality of life when compared with placebo in women with urge incontinence.
Sources: Oreskovic, 2013. |
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness of treatment with anticholinergic medication or beta3-agonist, compared with placebo or no treatment in women with urge urinary incontinence on the outcome measures urge incontinence symptoms, adverse events, and quality of life?
P: Women with urge urinary incontinence.
I: Anticholinergic medication (i.e., darifenacine, fesoterodine, tolterodine, solifenacine, oxybutinine) or beta3-agonist (i.e., mirabregon) with or without bladder training.
C: Placebo / no treatment.
O: Effect on incontinence (i.e. urge incontinence episodes), adverse events, quality of life (measured as patient related outcome measure).
Relevant outcome measures
The guideline development group considered urge incontinence episodes and quality of life as a critical outcome measure for decision making; and adverse events as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
If urge incontinence symptoms were measured with Urinary Distress Inventory (UDI), the working group defined a difference of 8 points as a minimal clinically (patient) important difference. In all other cases, a difference of 25% in the relative risk for dichotomous outcomes or a 0.5 standard deviation (reported as SMD) for continuous outcomes was taken as a minimal clinically important difference for other outcome measures.
Search and select (Methods)
Search strategy in 2011
The 2011 version of this guideline was an adaptation of the NICE guideline from 2006. Hence, the literature search was based on the search from the NICE Urinary incontinence guideline from 2006 (NICE, 2006) and the updated version of the ICS guideline from 2009 (Abrams, 2009), that was published during the project. In total, 44 RCTs were selected. These studies included both males and females, and other comparisons were of interest. Therefore, these studies were not included in the summary of literature below.
Search strategy in 2021
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from January 1st, 2006 to April 2nd, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 210 hits for SRs.
Studies were selected based on the following criteria:
- Women with urge incontinence.
- Pharmacological intervention with anticholinergic medication (i.e., darifenacine, fesoterodine, tolterodine, solifenacine, oxybutinine) or beta3-agonist (i.e., mirabregon) with or without bladder training.
- Comparison with placebo or no treatment.
- Investigated at least one of the outcomes as reported in the PICO.
In total nineteen studies were initially selected based on title and abstract screening. After reading the full text, eighteen studies were excluded (see Table of excluded studies), and one SR was included. After selecting the most relevant SR, an updated version of the literature search was performed to select relevant RCTs that were published since the included SRs (i.e., searched from 01-01-2018 until 02-04-2021). In total, a title abstract selection of 110 RCTs was performed. Initially, 4 RCTs were selected based on title and abstract screening. After reading the full text, 3 RCTs were excluded (see the table with reasons for exclusion under the tab Methods), and 1 RCT was included. The detailed search strategy is depicted under the tab Methods.
Results
One systematic review (including twelve studies of interest) was included in the analysis of the literature, and one study which used individual patient data of 10 RCTs. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Balk E, Adam GP, Kimmel H, Rofeberg V, Saeed I, Jeppson P, Trikalinos T. Nonsurgical Treatments for Urinary Incontinence in Women: A Systematic Review Update [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2018 Aug.
- Chapple CR, Cruz F, Cardozo L, Staskin D, Herschorn S, Choudhury N, Stoelzel M, Heesakkers J, Siddiqui E. Safety and Efficacy of Mirabegron: Analysis of a Large Integrated Clinical Trial Database of Patients with Overactive Bladder Receiving Mirabegron, Antimuscarinics, or Placebo. Eur Urol. 2020 Jan;77(1):119-128.
- EAU Guidelines. Edn. presented at the EAU Annual Congress Milan 2021. ISBN 978-94-92671-13-4
- Mueller ER, van Maanen R, Chapple C, Abrams P, Herschorn S, Robinson D, Stoelzel M, Yoon SJ, Al-Shukri S, Rechberger T, Gratzke C. Long-term treatment of older patients with overactive bladder using a combination of mirabegron and solifenacin: a prespecified analysis from the randomized, phase III SYNERGY II study. Neurourol Urodyn. 2019 Feb;38(2):779-792.
- Rai BP, Cody JD, Alhasso A, Stewart L. Anticholinergic drugs versus non-drug active therapies for non-neurogenic overactive bladder syndrome in adults. Cochrane Database Syst Rev. 2012 Dec 12;12(12):CD003193.
- Robinson D, Kelleher C, Staskin D, Mueller ER, Falconer C, Wang J, Ridder A, Stoelzel M, Paireddy A, van Maanen R, Hakimi Z, Herschorn S. Patient-reported outcomes from SYNERGY, a randomized, double-blind, multicenter study evaluating combinations of mirabegron and solifenacin compared with monotherapy and placebo in OAB patients. Neurourol Urodyn. 2018 Jan;37(1):394-406. d
- Shamliyan T, Wyman J, Kane RL. Nonsurgical Treatments for Urinary Incontinence in Adult Women: Diagnosis and Comparative Effectiveness [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2012 Apr. Report No.: 11(12)-EHC074-EF.
- Staskin D, Frankel J, Varano S, Shortino D, Jankowich R, Mudd PN Jr. International Phase III, Randomized, Double-Blind, Placebo and Active Controlled Study to Evaluate the Safety and Efficacy of Vibegron in Patients with Symptoms of Overactive Bladder: EMPOWUR. J Urol. 2020 Aug;204(2):316-324.
- Staskin D, Herschorn S, Fialkov J, Tu LM, Walsh T, Schermer CR. A prospective, double-blind, randomized, two-period crossover, multicenter study to evaluate tolerability and patient preference between mirabegron and tolterodine in patients with overactive bladder (PREFER study). Int Urogynecol J. 2018 Feb;29(2):273-283.
- Yokoyama O, Yamagami H, Hiro S, Hotta S, Yoshida M. Efficacy and safety of fesoterodine treatment for overactive bladder symptoms in elderly women with and without hypertension. Int J Urol. 2018 Mar;25(3):251-257.
Evidence tabellen
Research question: What are the benefits and harms of treatment with anticholinergic medication or beta3-agonist, compared with placebo or no treatment in women with urge incontinence on the outcome measures urge incontinence symptoms, adverse events, quality of life?
Systematic review
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Balk, 2018 |
SR and meta-analysis of RCTs
Literature search up to December 2017
A: Burgio, 1998 B: Sand, 2013 C: Gittelman, 2014 D: Huang, 2014 E: Khullar, 2004 F: mc Micheal, 2013 G: Moore, 1990 H: Oreskovic, 2013 I: Rogers, 2008 J: Rogers, 2009 K: Szonyi, 1995 L: Thuroff, 1991
Study design: RCTs
Setting and Country:* A: USA B: USA C: Canada D: USA E: UK F: USA G: - H: Croatia I: USA J: USA K: - L:
Source of funding and conflicts of interest:* A: Supported by grant AG RO1 08010 from the National Institute on Aging, National Institutes of Health, Bethesda, MD B: - C: Industry funded/industry provided materials D: Industry funded/industry provided materials E: F: Industry funded/industry provided materials G: Tillots Laboratories provided oxybutynin and placebo tablets H: not reported I: Funded by Pfizer Inc. J: Funded by Pfizer Inc. K: Funded by Smith and Nephew Pharmaceuticals L: Pharmacia Leo Therapeutics, Helsingborg, Sweden provided the pharmaceutical preparations used in this study
* only reported for the new studies since the current SR was an update.
|
Inclusion criteria SR: P= Non-pregnant community-dwelling adult women with symptoms of UI I= Anticholinergics, Beta agonists C= placebo control O=Categorical measures of UI: Cure*, improvement, satisfaction with the treatment outcome, quality of life, adverse events.
Exclusion criteria SR: P= If >10% of study participants are from ineligible groups (children or adolescents, men, pregnant women, institutionalized or hospitalized participants, or have surgically-treated UI) I= Interventions not available in the United States and surgical treatments C= x O= Measurements used for diagnostic purposes or that do not measure UI specifically (see full report)
12 studies of interest included
Important patient characteristics at baseline:
N, mean age A: 197 patients, 67.5 (7.7) yrs B: 704 patients, 59 (12.3) yrs. C: 323 patients, 57 (11.5) yrs. D: 604 patients, 56 (14) yrs. E: 854 patients, 58.2 (13.3) yrs. F: 67 patients, 54.4 years G: 53 patients, 46 yrs. H: 157 patients, 56.9 (10.1) yrs. I: 413 patients, 48 yrs. J:372 patients, 48 (12) yrs. K: 60 patients, 82 (6.0) yrs. L: 154 patients, 50 yrs.
Sex: all females
Groups comparable at baseline? All RCTs. |
Describe intervention:
B: Oxybutynin C: Oxybutynin (4 mg) E: Tolterodine (4mg) G: Oxybutynin (3 mg) I: Tolterodine (4mg) J: Tolterodine K: Oxybutynin (5mg) L: Oxybutynin (15 mg)
|
Describe control:
A: control (placebo) B: control (placebo) C: control (placebo) D: control (no treatment) E: control (placebo) F: control (placebo) G: control (placebo) H: control (placebo) I: control (placebo) J: control (placebo) K: control (placebo) L: control (placebo)
|
End-point of follow-up:
A: 8 weeks B: 12 weeks C: x D: x E: 8 weeks F: x G: x H: x I: 12 weeks J: x K: 6 weeks L: 4 weeks
For how many participants were no complete outcome data available? * (intervention/control) C: 54 D: 41 F: 0 H: 14
* only reported for the new studies since the current SR was an update.
|
Outcome measure-1 Defined as cure
Effect measure: RR, RD, mean difference [95% CI]:
Pooled effect (random effects model): 1.95 [95% CI 1.32 to 2.88] favoring the intervention group
Outcome measure-2 Defined as improvement
Effect measure: RR, RD, mean difference [95% CI]: Pooled effect (random effects model): 2.95 [95% CI 1.81 to 4.79] favoring the intervention group
Outcome measure-3 Defined as satisfaction
Effect measure: RR, RD, mean difference [95% CI]:
Pooled effect (random effects model): 2.60 [95% CI 2.05 to 3.28] favoring the intervention group
|
Facultative:
Brief description of author’s conclusion - Anticholinergics more effective than placebo for cure, improvement, and satisfaction (moderate SoE for satisfaction due to imprecision in urgency UI studies). - QoL: Anticholinergics better than placebo or no treatment.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question *odds ratios were reported instant of RR, this was because of data transformation.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading Reported in table K
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question Sensitivity analyses were performed for specific subgroups. Although this was not of interest of the current question.
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroup analysis) Could be present since no dose-response meta-analysis was conducted (different dosages were used in the interventions). |
Intervention study
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Yokoyama, 2018 |
Type of study: RCT, pooling data of 10 RCTs
Setting and country: Japan
Funding and conflicts of interest: This study was sponsored by Pfizer Japan, and Pfize employees participated in the analysis plan, data analysis and manuscript preparation. Medical writing assistance was provided by Patricia B Leinen, PhD, of Complete Healthcare Communications, LLC, and was funded by Pfizer Japan. |
Inclusion criteria: The eligible study population consisted of women who were aged ≥65 years. Enrolled participants had to have OAB symptoms for a minimum of 6 months with >0 UUI episodes/24 h at baseline in a bladder diary completed by each participant. Urgency episodes were defined as those with a USS rating of ≥3.
Exclusion criteria: -
N total at baseline: *without hypertension Intervention: 623 Control: 381
Important prognostic factors2: For example age ± SD: I: 72.8 (5.5) C: 73.0 (5.4)
Groups comparable at baseline? Yes, no differences between groups. |
Describe intervention (treatment/procedure/test): Fesoterodine (8mg or 4mg)
|
Describe control (treatment/procedure/test): Placebo treatment
|
Length of follow-up: 12 weeks
Loss-to-follow-up: N.a.
Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: N.a.
Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Change in UUI episodes per 24h at week 12: I: -0.80 C: +0.03 Mean difference of -0.83, statistical significant.
OAB-q Symptom bother, change baseline to week 12; I: -27.25 (1.03) C: -14.43 (1.24)
HRQOL, change baseline to week 12; I: 21.51 (0.88) C: 11.10 (1.07)
Treatment related adverse events; I: 278/623 (45%) C: 86/381 (23%) |
Study designed to investigate difference between patients with or without hypertension. For the current summary of literature only data of patients without hypertension are used.
|
Table of quality assessment
Based on AMSTAR checklist and PRISMA checklist
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Balk, 2018 |
Yes, PICO and inclusion criteria are described. |
Yes, search period and strategy are described. |
Yes, are described for new studies. |
Yes, are described for new studies. |
Not applicable |
Yes, risk of Bias tables are provided per study. |
Yes, but not for dosage of medication. |
Unclear, not mentioned |
Yes, described per study. |
Risk of bias table
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
Low Some concerns High
|
|
Yokoma, 2018 |
Definitely yes;
Reason: Central randomization with computer generated random numbers |
Definitely yes;
Reason: Central randomization with computer generated random numbers |
Probably yes;
Reason: Patients, health care providers and outcome assessors blinded (blinding of data collectors and analysts not reported) |
Probably no
Reason: this was not mentioned in the study. Probably as data was pooled. |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
Low |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Athanasiou, 2020 |
Included males and females |
|
Ayeleke, 2013 |
Included males and females |
|
Ayeleke, 2015 |
Included males and females |
|
Chapple, 1007 |
Included males and females |
|
Chapple, 2014 |
Included males and females |
|
Chapple, 2016 |
Included males and females |
|
Dell’Utri, 2012 |
Included males and females |
|
Geoffrion, 2018 |
Included males and females |
|
Herbison, 2019 |
Included males and females |
|
Hsu, 2019 |
Included males and females |
|
Kelleher, 2008 |
Included males and females |
|
Luo, 2012 |
Included males and females |
|
Mandpe, 2020 |
Included males and females |
|
Pavesi, 2013 |
Included males and females |
|
Rebecca, 2014 |
Included males and females |
|
Robinson, 2018 |
Included males and females |
|
Rossanese, 2015 |
Included males and females |
|
Sebastianelli, 208 |
Included males and females |
|
Shamliyan, 2012 |
Included males and females |
|
Staskin, 2020 |
Included males and females. |
|
Warsi, 2018 |
Post-hoc analysis, primary paper included in SR of Balk |
|
Wu, 2014 |
Included males and females |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 13-11-2023
Beoordeeld op geldigheid : 07-11-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules zijn in 2020 per module schrijvers en meelezers benoemd. Deze personen werden aangewezen als vertegenwoordigers door de relevante beroepsgroepen die betrokken zijn bij de in de module beschreven zorg (zie hiervoor de Samenstelling van de werkgroep). Alle schrijvers van modules vallend onder één richtlijn vormden samen een schrijfgroep. Alle meelezers van modules vallend onder één richtlijn vormden samen een clusterwerkgroep. In totaal resulteerde dit dus in zes werkgroep en zes clusterwerkgroepen.
Voorzitter project (technisch voorzitter)
Timmermans A. (Anne), gynaecoloog, AmsterdamUMC, NVOG
Werkgroep Urine-incontinentie bij vrouwen
Engberts M.K. (Marian), urogynaecoloog, Isala Ziekenhuis te Zwolle, NVOG
Klerkx W.M. (Wenche), urogynaecoloog, St. Antonius Ziekenhuis te Utrecht, NVOG
Koldewijn E.L. (Evert), uroloog, Catharina Ziekenhuis te Eindhoven, NVU
Labrie J. (Julien), gynaecoloog, Spaarne Gasthuis te Haarlem, NVOG
Martens F. (Frank), uroloog, Radboudumc te Nijmegen, NVU
Steures P. (Pieternel), urogynaecoloog, Jeroen Bosch Ziekenhuis te Den Bosch, NVOG
Clusterwerkgroep Urine-incontinentie bij vrouwen
Adamse C. (Corine), geregistreerd bekkenfysiotherapeut en klinisch epidemioloog, Antonius Ziekenhuis Sneek, docent Master opleiding Bekkenfysiotherapie, SOMT Amersfoort, NVFB/KNGF
Bosch M. (Marlies), patiëntvertegenwoordiger, Bekkenbodem4all
Dos Santos A. (Ana), bekkenfysiotherapeut MSc, PelviCentrum te Leiden, NVFB/KNGF
Lagro-Janssen A.L.M. (Toine), prof, huisarts n.p., RadboudUMC Nijmegen, NHG
Teunissen T.A.M. (Doreth), huisarts, RadboudUMC te Nijmegen, NHG
Ondersteuning project
Abdollahi M. (Mohammadreza), adviseur Kennisinstituut van de Federatie van Medisch Specialisten
Labeur Y.J. (Yvonne), adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Sussenbach A.E. (Annelotte), junior adviseur Kennisinstituut van de Federatie van Medisch Specialisten
Verhoeven M. (Maxime), adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Projectleiding
Augustus 2022- nu Mostovaya I.M. (Irina) (projectleider), senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
April 2020 tot augustus 2021: Bijlsma-Rutte A. (Anne), adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
September 2021 tot januari 2022: Venhorst K. (Kristie), adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Februari 2022 tot juni 2022: Göthlin M. (Mattias), adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Timmermans (technisch voorzitter van het project) |
Gynaecoloog, Amsterdam UMC (0.5 fte) |
Commissie kwaliteitsdocumenten NVOG (onbetaald); projectgroep Gynae Goes Green NVOG (onbetaald) |
Geen |
Geen actie |
|
Urine-incontinentie bij vrouwen - werkgroep |
||||
|
Engberts |
Urogynaecoloog ISALA |
Trainer Altis ® Sling voor Coloplast, betaald |
Geen |
Niet betrokken bij de besluitvorming rondom (fasci)slings. |
|
Klerkx |
Urogynaecoloog, St. Antonius Ziekenhuis |
Geen |
Geen |
Geen actie |
|
Koldewijn |
Uroloog 100% Catharina ziekenhuis Eindhoven |
Voorzitter Stichting Opleidingen Medici (SOM). Stichting acquireert gelden voor promotieonderzoek: onbetaald |
Geen |
Geen actie |
|
Labrie |
Gynaecoloog Spaarne Gasthuis |
Medisch Manager vakgroep gynaecologie gevaceerd |
Geen |
Geen actie |
|
Martens |
Uroloog, radboudumc |
Geen |
OASIS trial, implantaat PTNS, BlueWind, multicenter, PI Nijmegen. |
Geen trekker van module over PTNS/TENS. |
|
Steures |
Urogynaecoloog Jeroen Bosch Ziekenhuis, Den Bosch |
Geen |
Geen |
Geen actie |
|
Urine-incontinentie bij vrouwen - clusterwerkgroep |
||||
|
Adamse |
Geregistreerd bekkenfysiotherapeut en klinisch epidemioloog, Antonius Ziekenhuis Sneek. |
Commissielid Wetenschapscommissie NVFB Commissielid Richtlijn chronische bekkenpijn FMS Docent Master opleiding Bekkenfysiotherapie, SOMT Amersfoort |
Geen |
Geen actie |
|
Bosch |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
|
Dos Santos |
Geregistreerd bekkenfysiotherapeut MSc bij PelviCentrum - Centrum voor Bekkenfysiotherapie Leiden |
Lid van NVFB Wetenschappelijke Commissie. Vergoeding van de reiskosten en bijwonen van vergaderingen. |
Deelname aan het ontwikkelen van de richtlijn kan ervoor zorgen dat collega vaker gaan verwijzen naar mijn praktijk vanwege meer bekendheid. Mogelijk belangen bij bescherming positie bekkenfysiotherapie. |
Geen actie |
|
Lagro-Janssen |
Geen werkgever |
Adviseur centrum Seksueel Geweld Gelderland-Zuid en Midden (onbetaald) |
Geen |
Geen actie |
|
Teunissen |
Huisarts, zelfstandig 0,6 fte Docent, senior onderzoeker Radboudumc afdeling eerstelijnsgeneeskunde 0,4 fte |
Huisarts -> huisartswerkzaamheden (betaald) Radboudumc -> docent senior onderzoeker (betaald) |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Patiëntenfederatie Nederland en Stichting Bekkenbodem4All voor de schriftelijke knelpunteninventarisatie en voor deelname aan de clusterwerkgroepen. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De richtlijn is voor commentaar voorgelegd aan Patiëntenfederatie Nederland en Stichting Bekkenbodem4All en de eventueel aangeleverde commentaren worden bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld volgens de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg en de actualiteit van de aanbevelingen beschreven in de te reviseren modules. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG), de Nederlandse Vereniging van Maag-Darm-Leverartsen (NVMDL), Vereniging Klinische Genetica Nederland (VKGN), Inspectie Gezondheidszorg en Jeugd (IGJ), Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV), Nederlands Huisartsen Genootschap (NHG), Nederlandse Vereniging voor Bekkenfysiotherapie (NVFB) / Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF), Nederlandse Vereniging van Ziekenhuizen (NVZ), Patiëntenfederatie Nederland (PFN), Zorginstituut Nederland (ZiNL), Zelfstandige Klinieken Nederland (ZKN) en Zorgverzekeraars Nederland (ZN) via een schriftelijke knelpunteninventarisatie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Ook definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Hultcrantz, 2017; Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Volgens de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en akkoord.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. Erratum in: BMJ. 2008 May 24;336(7654).
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324.
Zoekverantwoording
Literatuur zoekstrategie
Algemene informatie
|
Richtlijn Urine Incontinentie >> herziening 4 modules in het ’24 modules project’ |
|
|
Uitgangsvraag: Wat is de effectiviteit van medicamenteuze behandeling op aandrangincontinentie? |
|
|
Database(s): Medline (OVID), Embase |
Datum: 02-04-2021 |
|
Periode: >2006 |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Laura Boerboom |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
→ Voor deze vraag is gezocht op de elementen aandrangincontinentie (in het blauw) en medicamenteuze behandeling (in het groen).
→ De werkgroep had drie sleutelpublicaties, en deze opgegeven artikelen van Kelleher (2018), Chen (2018) en Shamliyan (2012) komen allemaal uit onderstaande search.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (via embase.com) en Medline (via OVID) is op 02-04-2021 met relevante zoektermen gezocht naar systematische reviews, RCT’s en observationele studies over de effectiviteit van medicamenteuze behandeling bij vrouwen met aandrangincontinentie. De literatuurzoekactie leverde … unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
186 |
160 |
210 |
|
RCTs |
835 |
694 |
|
|
Observationele studies |
187 |
200 |
|
|
Totaal |
1208 |
1054 |
|
Zoekstrategie
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Urinary Bladder, Overactive/ or exp Urinary Incontinence, Urge/ or 'bladder overactivity'.ti,ab,kf. or 'overactive bladder'.ti,ab,kf. or 'detrusor overactivity'.ti,ab,kf. or 'overactive detrusor'.ti,ab,kf. or 'overactive urinary bladder'.ti,ab,kf. or 'urge incontinence'.ti,ab,kf. or 'urinary incontinence'.ti,ab,kf. or 'urine incontinence'.ti,ab,kf. (34395) 2 exp Adrenergic beta-Agonists/ or (darifenacin or fesoterodine or tolterodine or solifenacin or oxybutynin or mirabegron).ti,ab,kf. (118987) 3 1 and 2 (2173) 4 limit 3 to ((english or dutch) and yr="2006 -Current") (1620) 5 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (487531) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2100295) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3679067) 8 4 and 5 (160) – SR’s 9 (4 and 6) not 8 (694) – RCT’s 10 (4 and 7) not 8 not 9 (200) – Observationele studies 11 8 or 9 or 10 (1054) |