Pre-analytische aspecten bij lipidendiagnostiek
Uitgangsvraag
Met welke patiënt-afhankelijke factoren dient rekening te worden gehouden bij bloedafname voor diagnostiek ten behoeve van het cardiovasculair risicoprofiel?
De uitgangsvraag omvat de volgende deelvragen:
1. Wat is de definitie van een nuchtere afname?
2. Wanneer kan men volstaan met een niet-nuchtere afname voor diagnostiek ten behoeve van het cardiovasculair risicoprofiel?
3. Zijn er alternatieven indien er interferentie wordt ondervonden bij een niet-nuchtere afname door verhoogde triglyceriden?
4. Welke andere relevante factoren kunnen op individueel niveau significant de concentraties van de verschillende lipiden (totaal cholesterol, LDL-C, HDL-C, non-HDL-cholesterol en triglyceriden) beïnvloeden?
Aanbeveling
- Houd voor een nuchtere bloedafname een nuchtere periode van ten minste 12 uur (overnacht) aan, waarbij alleen water ad lib. gedronken mag worden tot 1 uur voor de bloedafname.
- Bepaal bij een inschatting van het cardiovasculair risicoprofiel de verschillende parameters (lipidenprofiel, glucose, kreatinine + eGFR) uit een niet-nuchtere bloedafname.
- Bepaal nuchter het lipidenprofiel wanneer de niet-nuchtere triglyceridenconcentratie > 5 mmol/L is.
Overweeg een nuchtere afname van het lipidenprofiel bij patiënten met een verhoogd risico op hypertriglyceridemie (o.a. obesitas, diabetes mellitus, leveraandoeningen) of vanwege patiënt-gerelateerde overwegingen.
NB. om praktische redenen kan gekozen worden om een grens van 4,5 mmol/L aan te houden, vanwege de beperkingen in het gebruik van de Friedewald formule voor berekening van LDL-C.
-
Houd bij patiënten met een verhoogd risico op (tijdelijke) dyslipidemie zo veel mogelijk dezelfde wijze van bloedafname aan (nuchter of niet-nuchter) wanneer de gemeten waarde rond een klinische beslisgrens valt.
Overwegingen
Wat is de definitie van een nuchtere afname?
In de geconsulteerde literatuur is geen eenduidige definitie gevonden voor het begrip ‘nuchter’ (Grankvist, 2018). Een algemeen gangbare beschrijving voor een nuchtere conditie is dat “de persoon zich geheel onthoudt van het consumeren van voedsel gedurende een periode van ten minste twaalf uur en alleen water drinkt (waaraan geen beperking is gesteld) tot een uur voor afname” (Simundic, 2018). Dit geeft de meest gangbare werkwijze voor een nuchtere afname weer, met een beperkte belasting voor de patiënt.
Wanneer kan men volstaan met een niet-nuchtere afname voor diagnostiek ten behoeve van het cardiovasculair risicoprofiel?
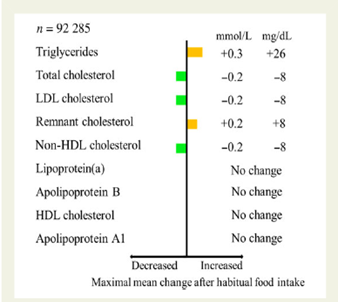
Van oudsher wordt aan patiënten gevraagd nuchter bloed af te laten nemen voor de bepaling van lipidenspectra. Er zijn meerdere wetenschappelijke studies gevonden waarin de relatie tussen voedselinname vóór bloedafname en plasmawaarden van lipidenfracties binnen individuen is beschreven (Krug, 2012; Cohn, 1988; Mihan, 2011). Met name bij de triglyceriden en LDL-C bepalingen wordt een verschil gevonden in tegenstelling tot HDL-cholesterol, non-HDL-cholesterol en ApoB. Op populatieniveau is vastgesteld (Nordestgaard, 2016) dat de invloed van een normale voedselinname op de meeste lipidenparameters beperkt is en klinisch niet relevant (zie Figuur 1, maximale verandering 1-6 uur na voedselinname). Bovendien is een niet-nuchtere afname patiëntvriendelijker, minder belastend voor de bloedafnamedienst en meer representatief voor de cholesterolwaarde gedurende de dag.
De invloed op de voorspelling van het risico op hart- en vaatziekten zal op populatieniveau niet significant worden beïnvloed door niet-nuchtere bloedafname. Niet-nuchtere waarden laten daarbij een goede voorspellende waarde zien op het optreden van hart- en vaatziekten en myocardinfarct (Nordestgaard, 2016; Nordestgaard, 2014). Echter, men dient wel rekening te houden bij de overgang van nuchtere naar niet-nuchtere LDL-C-monitoring met een verlaging in LDL-C en totaal cholesterol van gemiddeld 0,2 mmol/L. Eenzelfde daling van 0,2 mmol/L gemiddeld wordt ook gezien voor non-HDL cholesterol (Langsted, 2019).
Figuur 1. Maximale gemiddelde verandering 1-6 uur na voedselinname (Nordestgaard, 2016). Meting van totaal cholesterol, triglyceriden, LDL-C (bij triglyceriden < 4 mmol/L met de Friedewald formule), HDL-C, apolipoproteïne A1, apolipoproteïne B, (Konelab, Helsinki, Finland of Boehringer Mannheim, Mannheim, Germany), lipoproteïne (a) gemeten met DiaSys (DiaSys, Diagnostic Systems, Holzheim, Germany) of Denka Seiken methode (Denka Seiken, Tokyo, Japan).
Bij een triglyceride van > 4,5 mmol/L is er een significante invloed van een niet-nuchtere bloedafname beschreven op de bepaling van de berekende LDL-C (Friedewald formule) (zie submodule Analytische aspecten bij lipidendiagnostiek). Aangezien een triglyceride > 4,5 mmol/L bij minder dan 2% van de patiëntenresultaten voorkomt (eerstelijnsdiagnostiek aanvragen in Zuidoost-Brabant in 2022) is de kans beperkt dat alsnog een nuchtere waarde moet worden bepaald.
Voor de glucosebepaling binnen de risico-inschatting is het niet nodig om nuchter bloed af te nemen. Alleen wanneer de glucose afwijkend blijkt te zijn, dient deze nuchter herhaald te worden.
Lp(a) is een onafhankelijke cardiovasculaire risicofactor, die voor circa 90 % genetisch wordt bepaald door polymorfisme in het LPA-gen (Rhainds, 2021). Voor het overige deel wordt de Lp(a) concentratie beïnvloed door de samenstelling van de voeding (Enkhmaa, 2022). Er kan worden volstaan met een eenmalige afname en er is geen indicatie voor een nuchtere afname (Langsted, 2014). Bij de evaluatie van de Lp(a) waarde moet met enkele (patho) fysiologische condities rekening gehouden worden, zoals nierfalen (Enkhmaa, 2022). Omdat Lp(a) een variabel molecuulgewicht heeft, afhankelijk van de grootte van de apo(a)-isovorm, wordt rapportage in een molaire eenheid (nmol/L) geadviseerd (Kronenberg, 2022; statement SKML). Voorzichtigheid is geboden bij het omrekenen van een concentratie in nmol/L naar mg/L, vanwege variatie in de Lp(a) bepaling tussen verschillende assay types en een al dan niet aanwezige correcte omrekenfactor die bekend moet zijn bij de leverancier van de assay. In de Richtlijn Erfelijke dyslipidemie in de 2e en 3e lijn wordt ingegaan op de indicatie voor bepaling van Lp(a).
Bij welke patiënten is wel een nuchtere afname gewenst?
In het algemeen kan gesteld worden dat bij groepen patiënten met een dyslipidemie grotere verschillen aanwezig zijn tussen nuchtere en niet-nuchtere waarden. Voor mensen met diabetes is het te overwegen nuchter af te nemen voor de LDL-C-bepaling; in deze groep zijn grotere verschillen beschreven (Langsted, 2011) en heerst nog onduidelijkheid of niet-nuchtere afnames gehanteerd kunnen worden (Lund, 2011). Bij patiënten met diabetes kan er een daling van max. 0,6 mmol/L voor LDL-C optreden ten opzichte van de niet-nuchtere waarde. Een alternatief is om bij patiënten met diabetes non-HDL-C of ApoB te gebruiken als streefwaarde in plaats van LDL-C. Daarnaast kan er vaker sprake zijn van verhoogde triglyceridewaarden, zelfs in de nuchtere toestand. Dit kan op zowel de berekende als de direct gemeten LDL-C bepaling een verlagende invloed hebben (zie submodule Analytische aspecten bij lipidendiagnostiek).
Een nuchtere afname kan nodig zijn in de volgende situaties:
- niet-nuchtere triglyceriden van > 5mmol/L;
- bekende hypertriglyceridemie;
- herstellend van hypertriglyceridemische pancreatitis;
- het starten met medicatie die ernstige hypertriglyceridemie kan veroorzaken;
- additionele aangevraagde laboratoriumtesten die nuchter bloedprikken vereisen, zoals bijvoorbeeld bij een afwijkend niet-nuchtere glucose;
- bepaalde genetische of verworven dyslipidemieën, waarbij er sprake is van (sterk) verhoogde triglyceriden.
Indien in het kader van CVRM-diagnostiek een nuchtere afname bij bovenstaande situaties niet mogelijk of niet wenselijk is (bijvoorbeeld bij verminderde mobiliteit), kan er gekozen worden voor het gebruik van non-HDL-C voor vaststellen risico en het monitoren bij interventie en ApoB voor het monitoren bij interventie.
Gebruik van non-HDL-C
In de door de European Society of Cardiology (ESC) ontwikkelde richtlijn over preventie van hart- en vaatziekten wordt non-HDL-C (= totaal cholesterol – HDL-C) gebruikt bij de SCORE2 berekening voor het inschatten van het cardiovasculair risico, in plaats van LDL-C (Visseren, 2021). Non-HDL-C is minstens net zo goed als LDL-C om het risico in te schatten en het effect van lipidenverlagende therapie te beoordelen. Het gebruik van non-HDL-C is eenvoudig, als berekening kosteloos en kan door laboratoria automatisch gerapporteerd worden. Tevens zijn er praktische voordelen, bijvoorbeeld dat het ook bruikbaar is bij een hoog triglyceridegehalte (Arsenault, 2009; Van den Berg, 2016).
Gebruik van ApoB
ApoB is een goed alternatief voor LDL-C en non-HDL-C in het kader van monitoring bij interventie; het kan nauwkeuriger bepaald worden dan LDL-C en wordt, voor zover bekend, niet beïnvloed door een hoge concentratie triglyceriden. Daarnaast kan ApoB bij een deel van de patiënten, onder meer bij (een verdenking op) erfelijke dyslipidemieën, aanvullende informatie geven (De Graaf, 2008). Hiervoor kan gebruik gemaakt worden van het diagnostische ApoB algoritme op basis van de ApoB, totaal cholesterol en triglyceriden (https://apob.app/). Dit algoritme is gebaseerd op een nuchtere afname en afkapwaarden die bij een nuchtere toestand horen.
Zie verder in detail de submodule Analytische aspecten bij lipidendiagnostiek en Richtlijn erfelijke dyslipidemie in de 2e en 3e lijn.
Welke andere relevante factoren kunnen op individueel niveau significant de verschillende lipiden (totaal cholesterol, LDL-C, HDL-C, non-HDL-C en triglyceriden) beïnvloeden?
Hypertriglyceridemie/gecombineerde dyslipidemie
Triglyceridewaarden worden beïnvloed door de inname en samenstelling van voedsel en door erfelijke factoren. Een normale voedselinname heeft tussen de twee en tien uur invloed op de concentratie triglyceriden. De tijdsduur van normalisatie en de mate van afwijking als gevolg van voedselinname is afhankelijk van meerdere factoren, zoals aard en hoeveelheid van de ingenomen voedselcomponenten, de vertering en het metabolisme. Onder andere leeftijd, geslacht, BMI en genetische factoren beïnvloeden het metabolisme (Keirns, 2021). Hierdoor is sprake van een aanzienlijke interindividuele variatie.
Hypertriglyceridemie (vaak in combinatie met een andere dyslipidemie) wordt daarnaast veelvuldig gezien bij (Heidemann, 2022):
- alcoholgebruik, -misbruik;
- chronische nierinsufficiëntie met proteïnurie, nefrotisch syndroom;
- glucose-intolerantie/type 2 diabetes;
- metabool syndroom/insuline resistentie;
- (abdominale) obesitas;
- medicatie, o.a. thiazide diuretica, glucocorticoïden, antipsychotica (2e generatie), bètablokkers, orale oestrogenen en oestrogeenagonisten, immunosuppressiva, retinolzuurderivaten, antiretrovirale medicijnen (m.n. protease remmers);
- zwangerschap, met name in het derde trimester;
- gebruik van anabole steroïden;
- polycysteus ovariumsyndroom;
- hypothyreoïdie.
De cholesterolconcentraties in het bloed zijn binnen een kort tijdsinterval veel minder afhankelijk van de voedselinname en samenstelling. Enkele (minder voor de hand liggende) secundaire oorzaken van een afwijkend cholesterol profiel worden hieronder kort samengevat.
Hypercholesterolemie
Verhoogde totaal cholesterol en LDL-C waarden worden, behalve bij diabetes mellitus en obesitas, ook gezien bij hypothyreoïdie, cholestatische leverziekten en nefrotisch syndroom (Vaziri, 2016; Stuijver, 2012).
Studies hebben aangetoond dat gebruik van anabole steroïden kan leiden tot een toename in LDL-C van zo’n 20% en een afname van het HDL-C van 20-70% (Achar, 2010; Geutjes, 2020).
Hypoalfalipoproteïnemie
Een verlaagde HDL-C (en totaal cholesterol en LDL-C) concentratie kan genetisch worden veroorzaakt, maar ook door andere condities zoals chronische en acute inflammatie. Bij acute inflammatie zijn er casussen beschreven van tijdelijk zeer sterk verlaagde HDL-C waarden, maar hier is sprake van grote interindividuele verschillen (Kwakernaak, 2018).
Hypolipidemie
Verlaagde niveaus van totaal cholesterol en LDL-C kunnen gezien worden bij hyperthyreoïdie, malabsorptie of ernstige ondervoeding, en chronische leverziekte (Malloy, 1982).
Aanvaardbaarheid, haalbaarheid en implementatie
In de praktijk is een niet-nuchtere bloedafname voor lipidenonderzoek steeds meer de standaard geworden. Omdat het voor de patiënten, maar ook voor de bloedafnamedienst, minder belastend is, worden er geen grote barrières verwacht wat betreft de implementatie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De invloed van een normale voedselinname op de meeste lipidenparameters lijkt beperkt en klinisch niet relevant. Bovendien is een niet-nuchtere afname meer representatief voor de cholesterolwaarde gedurende de dag. Daarbij kan in tweede instantie tot een nuchtere afname worden overgegaan indien dat noodzakelijk blijkt te zijn.
Onderbouwing
Achtergrond
De huidige (internationale) richtlijnen voor het vaststellen van cardiovasculaire risico’s zijn grotendeels gebaseerd op epidemiologisch onderzoek (Mach, 2020). Zo is vastgesteld dat de risicoprofilering niet op grond van nuchter afgenomen parameters hoeft te worden uitgevoerd, maar dat een even goede evaluatie kan worden gedaan met behulp van niet-nuchtere waarden. De reden hiervoor is dat de voedingsstatus een beperkte en klinisch niet-relevante invloed heeft op de gemeten waarden van het cardiovasculair risicoprofiel. De uitvoering van een niet-nuchtere bloedafname is bovendien veel patiëntvriendelijker en in de praktijk minder belastend voor de bloedafnamedienst, met name als deze thuis moet worden uitgevoerd.
Hoewel een niet-nuchtere evaluatie onder normale omstandigheden op populatieniveau volstaat, moet bij de interpretatie op individueel niveau rekening gehouden worden met een aantal niet-fysiologische en pathologische factoren, die invloed kunnen hebben op de laboratoriumparameters uit het cardiovasculair risicoprofiel en daarom in ogenschouw moeten worden genomen bij een individuele risicoprofilering.
In deze submodule wordt een aantal van de meest voorkomende patiënt-afhankelijke invloeden beschreven op de gemeten waarden van de lipidendiagnostiek, met een nadruk op de invloed van voedselinname. Een handreiking wordt gegeven voor de facetten waarmee in de praktijk rekening gehouden moet worden bij de interpretatie op individueel niveau.
Conclusies
| Definitie nuchter |
|
De nuchtere periode duurt ten minste 12 uur (overnacht), waarbij alleen water ad lib. gedronken mag worden tot 1 uur voor de bloedafname.
Bronnen: Simundic, 2018; Grankvist, 2018. |
| Niet-nuchtere afname |
Bronnen: Nordestgaard, 2016; Nordestgaard, 2014; Langsted, 2011; Lund, 2011; Arsenault, 2009; Van den Berg, 2016; Mook-Kanamori, 2019; Geutjes, 2020. |
Zoeken en selecteren
Er is voor deze submodule geen systematische literatuuranalyse verricht. De aanbevelingen zijn tot stand gekomen op basis van het perspectief van zorgverleners en een niet-systematische literatuuranalyse.
Referenties
- Achar S, Rostamian A, Narayan SM. Cardiac and metabolic effects of anabolic-androgenic steroid abuse on lipids, blood pressure, left ventricular dimensions, and rhythm. Am J Cardiol. 2010 Sep 15;106(6):893-901. doi: 10.1016/j.amjcard.2010.05.013. PMID: 20816133; PMCID: PMC4111565.
- Arsenault BJ, Rana JS, Stroes ES, Després JP, Shah PK, Kastelein JJ, Wareham NJ, Boekholdt SM, Khaw KT. Beyond low-density lipoprotein cholesterol: respective contributions of non-high-density lipoprotein cholesterol levels, triglycerides, and the total cholesterol/high-density lipoprotein cholesterol ratio to coronary heart disease risk in apparently healthy men and women. J Am Coll Cardiol. 2009 Dec 29;55(1):35-41. doi: 10.1016/j.jacc.2009.07.057. PMID: 20117361.
- Cohn JS, McNamara JR, Schaefer EJ. Lipoprotein cholesterol concentrations in the plasma of human subjects as measured in the fed and fasted states. Clin Chem 1988;34:2456 9.
- Grankvist K, Sigthorsson G, Kristensen GB, Pelanti J, Nybo M. Status on fasting definition for blood sampling in the Nordic countries - time for a harmonized definition. Scand J Clin Lab Invest. 2018 Nov-Dec;78(7-8):591-594. doi: 10.1080/00365513.2018.1528503. Epub 2018 Oct 19. PMID: 30338721.
- de Graaf J, Couture P, Sniderman A. A diagnostic algorithm for the atherogenic apolipoprotein B dyslipoproteinemias. Nat Clin Pract Endocrinol Metab. 2008 Nov;4(11):608-18. doi: 10.1038/ncpendmet0982. Epub 2008 Oct 7. PMID: 18838971 Review.
- Enkhmaa B, Berglund L. Non-genetic influences on lipoprotein(a) concentrations. Atherosclerosis. 2022 May;349:53-62. doi: 10.1016/j.atherosclerosis.2022.04.006. PMID: 35606076
- Geutjes PJ, Bosma M, Gorgels WJ. Anabole steroïden en cardiovasculair risico. Huisarts Wet 2020;63:DOI:10.1007/s12445-020-0813-4.
- Heidemann BE, Prinssen M, Marais AD, Visseren FLJ, Koopal C. Een afwijkend lipidenprofiel Wanneer verricht je diagnostiek naar een erfelijke oorzaak? Ned Tijdschr Geneeskd. 2022;166:D6532.
- Keirns BH, Sciarrillo CM, Koemel NA, Emerson SR. Fasting, non-fasting and postprandial triglycerides for screening cardiometabolic risk. J Nutr Sci. 2021 Sep 14;10:e75. doi: 10.1017/jns.2021.73. PMID: 34589207; PMCID: PMC8453457.
- Kronenberg F, Mora S, Stroes ESG, Ference BA, Arsenault BJ, Berglund L, Dweck MR, Koschinsky M, Lambert G, Mach F, McNeal CJ, Moriarty PM, Natarajan P, Nordestgaard BG, Parhofer KG, Virani SS, von Eckardstein A, Watts GF, Stock JK, Ray KK, Tokgözo?lu LS, Catapano AL. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement. Eur Heart J. 2022 Oct 14;43(39):3925-3946. doi:10.1093/eurheartj/ehac361. PMID: 36036785
- Kwakernaak AJ, Post MC, Pijlman AH, Bosma M. Extremely low high-density-lipoprotein cholesterol due to an unusual non-inherited cause: a case report. Clin Chem Lab Med. 2018 Dec 19;57(2):e15-e18. doi: 10.1515/cclm-2018-0501. PMID: 30091948.
- Krug S, Kastenmüller G, Stückler F, Rist MJ, Skurk T, Sailer M, Raffler J, Römisch-Margl W, Adamski J, Prehn C, Frank T, Engel KH, Hofmann T, Luy B, Zimmermann R, Moritz F, Schmitt-Kopplin P, Krumsiek J, Kremer W, Huber F, Oeh U, Theis FJ, Szymczak W, Hauner H, Suhre K, Daniel H. The dynamic range of the human metabolome revealed by challenges. FASEB J. 2012 Jun;26(6):2607-19. doi: 10.1096/fj.11-198093. Epub 2012 Mar 16. PMID: 22426117
- Langsted A, Kamstrup PR, Nordestgaard BG. Lipoprotein(a): fasting and nonfasting levels, inflammation, and cardiovascular risk. Atherosclerosis. 2014 May;234(1):95-101. doi: 10.1016/j.atherosclerosis.2014.01.049. Epub 2014 Feb 12. PMID: 24632508
- Langsted A, Nordestgaard BG. Nonfasting lipids, lipoproteins, and apolipoproteins in individuals with and without diabetes: 58 434 individuals from the Copenhagen General Population Study. Clin Chem. 2011 Mar;57(3):482-9. doi: 10.1373/clinchem.2010.157164. Epub 2010 Dec 28. PMID: 21189274.
- Lund SS, Jensen T. Using nonfasting lipids--hemodilution or convenience? Clin Chem. 2011 Sep;57(9):1336-8; author reply 1338-40. doi: 10.1373/clinchem.2011.168104. Epub 2011 Jun 30. PMID: 21719687.
- Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, Chapman MJ, De Backer GG, Delgado V, Ference BA, Graham IM, Halliday A, Landmesser U, Mihaylova B, Pedersen TR, Riccardi G, Richter DJ, Sabatine MS, Taskinen MR, Tokgozoglu L, Wiklund O; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020 Jan 1;41(1):111-188. doi: 10.1093/eurheartj/ehz455. Erratum in: Eur Heart J. 2020 Nov 21;41(44):4255. PMID: 31504418.
- Malloy MJ, Kane JP. Hypolipidemia. Med Clin North Am. 1982 Mar;66(2):469-84. doi: 10.1016/s0025-7125(16)31431-6. PMID: 7040848.
- Mihas C, Kolovou GD, Mikhailidis DP, Kovar J, Lairon D, Nordestgaard BG, Ooi TC, Perez-Martinez P, Bilianou H, Anagnostopoulou K, Panotopoulos G. Diagnostic value of postprandial triglyceride testing in healthy subjects: a meta-analysis. Curr Vasc Pharmacol. 2011 May;9(3):271-80. doi: 10.2174/157016111795495530. PMID: 21314631
- Mook-Kanamori M, Mook-Kanamori D, Bonten T. Nuchter of niet nuchter lipidenprofiel voor CVRM. Huisarts Wet 2019;62:DOI:10.1007/s12445-019-0394-2.
- Nordestgaard BG, Langsted A, Mora S, Kolovou G, Baum H, Bruckert E, Watts GF, Sypniewska G, Wiklund O, Borén J, Chapman MJ, Cobbaert C, Descamps OS, von Eckardstein A, Kamstrup PR, Pulkki K, Kronenberg F, Remaley AT, Rifai N, Ros E, Langlois M; European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) Joint Consensus Initiative. Fasting Is Not Routinely Required for Determination of a Lipid Profile: Clinical and Laboratory Implications Including Flagging at Desirable Concentration Cutpoints-A Joint Consensus Statement from the European Atherosclerosis Society and European Federation of Clinical Chemistry and Laboratory Medicine. Clin Chem. 2016 Jul;62(7):930-46. doi: 10.1373/clinchem.2016.258897. Epub 2016 May 27. PMID: 27235445.
- Nordestgaard BG, Varbo A. Triglycerides and cardiovascular disease. Lancet. 2014 Aug 16;384(9943):626-635. doi: 10.1016/S0140-6736(14)61177-6. PMID: 25131982.Rhainds D, Brodeur MR, Tardif JC. Lipoprotein (a): When to Measure and How to Treat? Curr Atheroscler Rep. 2021 Jul 8;23(9):51. doi: 10.1007/s11883-021-00951-2. PMID: 34235598
- Simundic AM, Bölenius K, Cadamuro J, Church S, Cornes MP, van Dongen-Lases EC, Eker P, Erdeljanovic T, Grankvist K, Guimaraes JT, Hoke R, Ibarz M, Ivanov H, Kovalevskaya S, Kristensen GBB, Lima-Oliveira G, Lippi G, von Meyer A, Nybo M, De la Salle B, Seipelt C, Sumarac Z, Vermeersch P; Working Group for Preanalytical Phase (WG-PRE), of the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) and Latin American Working Group for Preanalytical Phase (WG-PRE-LATAM) of the Latin America Confederation of Clinical Biochemistry (COLABIOCLI). Joint EFLM-COLABIOCLI Recommendation for venous blood sampling. Clin Chem Lab Med. 2018 Nov 27;56(12):2015-2038. doi: 10.1515/cclm-2018-0602. PMID: 30004902.
- Stuijver DJ, van Zaane B, Gerdes VE, Stroes ES. Schildklierdiagnostiek bij dyslipidemie [Screening for thyroid dysfunction in dyslipidaemia patients]. Ned Tijdschr Geneeskd. 2012;156(2):A4301. Dutch. PMID: 22236619.
- Vaziri ND. Disorders of lipid metabolism in nephrotic syndrome: mechanisms and consequences. Kidney Int. 2016 Jul;90(1):41-52. doi: 10.1016/j.kint.2016.02.026. Epub 2016 Apr 26. PMID: 27165836; PMCID: PMC5812444.
- Van den Berg MJ, van der Graaf Y, de Borst GJ, Kappelle LJ, Nathoe HM, Visseren FLJ; SMART Study Group. Low-Density Lipoprotein Cholesterol, Non-High-Density Lipoprotein Cholesterol, Triglycerides, and Apolipoprotein B and Cardiovascular Risk in Patients With Manifest Arterial Disease. Am J Cardiol. 2016 Sep 15;118(6):804-810. doi: 10.1016/j.amjcard.2016.06.048. Epub 2016 Jun 28. PMID: 27471056.
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, Benetos A, Biffi A, Boavida JM, Capodanno D, Cosyns B, Crawford C, Davos CH, Desormais I, Di Angelantonio E, Franco OH, Halvorsen S, Hobbs FDR, Hollander M, Jankowska EA, Michal M, Sacco S, Sattar N, Tokgozoglu L, Tonstad S, Tsioufis KP, van Dis I, van Gelder IC, Wanner C, Williams B; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227-3337. doi: 10.1093/eurheartj
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 10-11-2023
Laatst geautoriseerd : 10-11-2023
Geplande herbeoordeling :
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit Kwaliteitsgelden Medisch Specialisten (SKMS, projectnummer 61245588). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
De Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC) is regiehouder van deze richtlijnmodule en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De module valt binnen het cluster Cardiovasculair risicomanagement (CVRM).
Aanleiding voor het maken van de richtlijnmodule
In de richtlijnen Cardiovasculair risicomanagement (CVRM) en Erfelijke dyslipidemie in de 2e en 3e lijn werd op meerdere plekken beschrijvingen gedaan over lipidendiagnostiek. Om versnippering te voorkomen en een eenduidig beeld te geven over de keuze voor diagnostiek, de gebruikte methoden en inzicht in interpretatie van laboratoriumresultaten, is gekomen tot een integrale module Laboratoriumtechnische aspecten van lipidendiagnostiek. Keuze en interpretatie van diagnostiek wordt beïnvloed door laboratoriumtechnische facetten die de pre-analyse (voorbereiding patiënt, afname tijdstip en andere aspecten met betrekking tot de bloedafname), analyse (keuze analysemethodiek en mogelijke interferenties) en post-analyse (interpretatie, streefwaarden, normaalwaarden, eenheden) betreffen (Aakre, 2013).
Doel van de richtlijnmodule
Deze module, met drie submodules, is gericht op de meest relevante aspecten van laboratoriumdiagnostiek van lipiden en beoogt algemeen toepasbaar te zijn, ook voor andere richtlijnen waar deze aspecten van laboratoriumdiagnostiek aan de orde zijn.
Afbakening van de richtlijnmodule
De module beschrijft lipidendiagnostiek ten behoeve van risicoschatting en behandeling in het kader van cardiovasculair risicomanagement. Dit zijn primair de analyses van totaal cholesterol, HDL-cholesterol, triglyceriden, LDL-cholesterol (gemeten met de directe assay of berekend met de Friedewald formule) en non-HDL cholesterol. Voor de tweede en derde lijn is analyse van apolipoproteïne B (ApoB) en lipoproteïne(a) (Lp(a)) voor specifieke gevallen van toegevoegde waarde; voor verdere toelichting verwijzen we naar de Richtlijn Erfelijke dyslipidemie in de 2e en 3e lijn.
In de drie submodules wordt ingegaan op de volgende onderwerpen:
- Pre-analytische fase, waarin onder andere de niet-nuchtere bloedafname staat beschreven;
- Analytische fase, waarin onder andere de verschillende LDL-C analyses staan beschreven;
- Post-analytische fase, waarin onder andere aandacht is voor het verschil tussen referentie intervallen en streefwaarden van lipidendiagnostiek.
Doel en doelgroep
Doel van de richtlijnmodule
Deze module, met drie submodules, is gericht op de meest relevante aspecten van laboratoriumdiagnostiek van lipiden en beoogt algemeen toepasbaar te zijn, ook voor andere richtlijnen waar deze aspecten van laboratoriumdiagnostiek aan de orde zijn.
Beoogde gebruikers van de richtlijn
De richtlijnmodule is bedoeld voor 2e lijns zorgprofessionals die betrokken zijn bij lipidendiagnostiek in het kader van cardiovasculair risicomanagement.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is medio 2020 een NVKC-werkgroep ingesteld. Deze is – na afstemming met Cluster Cardiovasculair risicomanagement (CVRM) – gestart met de uitwerking.
- Dr. W.P.H.G. (Wilhelmine) Verboeket-van de Venne (voorzitter), wetenschappelijk onderzoeker klinische chemie, Zuyderland Medisch Centrum, Heerlen / Sittard-Geleen; beleidsadviseur kwaliteit NVKC, Utrecht
- Dr. ir. A.J. (Arjan) van Adrichem (secretaris), klinisch chemicus, Accureon, Bravis Ziekenhuis, ZorgSaam
- Dr. A. (Angela) Bikker, klinisch chemicus, Sint Antonius Ziekenhuis, Nieuwegein; Saltro Unilabs B.V., Utrecht
- Dr. J. (Joyce) Curvers, klinisch chemicus, Catharina Ziekenhuis, Eindhoven
- Dr. F.A.L. (Frans) van der Horst, klinisch chemicus, Reinier de Graaf Groep, Delft
- Dr. ir. M.L.P. (Marloes) Langelaan, klinisch chemicus, Result laboratorium, Amphia Ziekenhuis, Breda
- Dr. drs. W.P. (Wytze) Oosterhuis, arts klinische chemie, epidemioloog, Reinier de Graaf Groep Delft
Met ondersteuning van
- Dr. N.L. (Nikita) van der Zwaluw, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. W.P.H.G. Verboeket-van de Venne (voorzitter) |
Wetenschappelijk onderzoeker klinische chemie, Zuyderland Medisch Centrum, Heerlen / Sittard-Geleen; beleidsadviseur kwaliteit NVKC, Utrecht |
Geen |
Deelname aan onderzoek CoLab-score and viability PCR for SARS-CoV-2: routine blood test algorithm proven by elimination of viable SARS-CoV-2 to identify patients in order to facilitate discharge and/or de-isolation (geen projectleider), financier: ZonMw |
Geen restricties |
|
Dr. ir. A.J. van Adrichem (secretaris) |
Klinisch chemicus, Accureon, Bravis Ziekenhuis, ZorgSaam |
Geen |
Geen |
Geen restricties |
|
Dr. A. Bikker |
Klinisch chemicus, Sint Antonius Ziekenhuis, Nieuwegein; Saltro Unilabs B.V., Utrecht |
- Lid NVKC Commissie Zelftesten (onbetaald) - Lid NVKC Commissie Publieksvragen (onbetaald) |
Geen |
Geen restricties |
|
Dr. J. Curvers |
Klinisch chemicus, Catharina Ziekenhuis, Eindhoven |
Geen |
Projectleider van onderzoek Sepsis biomarkers on the VTLi, financier: Siemens Healthineers |
Geen restricties |
|
Dr. F.A.L. van der Horst, |
Klinisch chemicus, Reinier de Graaf Groep, Delft |
- Voorzitter Wetenschapsraad Reinier de Graaf Gasthuis (onbetaald) - Auditor Raad voor Accreditatie (betaald) |
Geen |
Geen restricties |
|
Dr. ir. M.L.P. Langelaan |
Klinisch chemicus, Result laboratorium, Amphia Ziekenhuis, Breda |
Lid SKML sectie Algemene chemie (onbetaald) |
Deelname aan Big Promise: onderzoek naar biomarkers om het operatierisico te voorspellen, zie www.bigpromise.nl (geen projectleider), financier: Roche |
Geen restricties |
|
Dr. drs. W.P. Oosterhuis |
Arts klinische chemie, epidemioloog, Reinier de Graaf Groep Delft |
- Morgagni BV: uitvoeren van gesubsidieerde projecten in de gezondheidszorg (betaald, niet BTW-plichtig) - Oosterhuis Medisch Advies: uitvoeren van medisch-inhoudelijke werkzaamheden (betaald); werk voor commissies en werkgroepen binnen de klinische chemie, peer-reviews (onbetaald); onderzoek m.b.t. software ontwikkeling kennissystemen |
De uitkomsten van dit project kunnen bijdragen aan versterking van de wetenschappelijke positie c.q. aanzien. |
Geen restricties |
Inbreng patiëntenperspectief
De conceptmodule is ter commentaar voorgelegd aan Patiëntenfederatie Nederland en Harteraad.
Werkwijze
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de huidige richtlijn Cardiovasculair risicomanagement en Erfelijke dyslipidemie in de 2e en 3e lijn. Op basis van de uitkomsten van de knelpuntenanalyse zijn – in samenspraak met Cluster Cardiovasculair risicomanagement – concept uitgangsvragen opgesteld, die betrekking hebben op de pre-analyse, analyse, en post-analyse. De uitgangsvragen zijn in de schrijffase definitief vastgesteld.
Methode literatuursamenvatting
Een beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de individuele studies is te vinden onder het kopje ‘Methoden – zoeken en selecteren’.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. Gedurende het proces is er regelmatig afstemming geweest met leden van het cluster CVRM.
Commentaar- en autorisatiefase
De concept richtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de concept richtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan relevante wetenschappelijke verenigingen voorgelegd voor autorisatie.
Literatuur
Aakre KM, Langlois MR, Watine J, Barth JH, Baum H, Collinson P, Laitinen P, Oosterhuis WP. Critical review of laboratory investigations in clinical practice guidelines: proposals for the description of investigation. Clin Chem Lab Med 2013; 51(6): 1217–1226. doi: 10.1515/cclm-2012-0574