Analytische aspecten bij lipidendiagnostiek
Uitgangsvraag
- Zijn de resultaten van lipidendiagnostiek tussen verschillende laboratoria uitwisselbaar?
- Welke beperkingen kennen de diverse methoden voor analyse van LDL-C?
- Hoe vergelijkbaar zijn de uitkomsten van de LDL-C met de non-HDL-C bepaling?
Aanbeveling
Gezien de uitwisselbaarheid van de resultaten van lipidendiagnostiek is er geen reden om een patiënt te vervolgen in hetzelfde laboratorium.
Gebruik geen directe LDL-C bepaling bij patiënten met een triglyceridenconcentratie < 2,3 mmol/L. Maak in dergelijke gevallen gebruik van de berekende non-HDL-C.
Eventueel kan bepaling van ApoB, als maat voor de concentratie atherogene deeltjes, overwogen worden.
Gebruik geen LDL-C berekend met de Friedewald formule bij patiënten met een triglyceridenconcentratie > 4,5 mmol/L. Maak in dergelijke gevallen gebruik van de berekende non-HDL-C.
Overwegingen
Ondanks de ontwikkelingen van directe LDL-C bepalingsmethoden, die mogelijke nadelen van het gebruik van de Friedewald formule voor de berekening van LDL-C omzeilen, kent ook de directe LDL-C analyse nadelen.
Uit de bestudeerde literatuur en recente gegevens van rondzendmonsters uit de Nederlandse laboratoria, kan worden afgeleid dat de non-HDL-C een kostenbewust alternatief is voor de follow-up van patiënten met extremere resultaten, zowel in het lage als hogere concentratiegebied.
ApoB is ook een goed alternatief. Uit de SKML rondzendingen blijkt dat ApoB waarden sterk correleren met non-HDL-C. De nadelen van de ApoB bepaling zijn de meerkosten en het niet routinematig beschikbaar zijn in alle laboratoria.
Kosten
De kosten voor lipidenbepalingen (totaal cholesterol, HDL-C, triglyceriden, directe LDL-C) zijn laag (NZa tarief tussen de 1 en 3 euro). Het missen van informatie (wanneer bijvoorbeeld alleen non-HDL-C of directe LDL-C zou worden aangevraagd en gerapporteerd) kunnen leiden tot onderdiagnostiek (gemiste hypertriglyceridemie) of het onterecht (niet) intensiveren van therapie.
Aanvaardbaarheid, haalbaarheid en implementatie
Rapporteren van non-HDL-C is voor elk laboratorium eenvoudig te implementeren, aangezien dit alleen een berekening betreft.
Verdere studies naar het restrisico op hart en vaatziekten en diverse lipidenparameters (zoals remnant cholesterol, ApoB) kunnen mogelijk in de toekomst leiden tot een aanpassing van gewenste diagnostiek of diagnostische strategieën.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Door de heterogeniteit van de lipidendeeltjes is standaardisatie van de cholesterolbepaling in deze fracties een grote opgave. Laboratoria streven naar het standaardiseren van de resultaten van de bepalingen, maar de uitdaging is om de huidige (en toekomstige) lage streefwaarden op een juiste manier te analyseren. Dit geeft beperkingen in de toepassing van testen, zoals de met de Friedewald formule berekende LDL-C en de directe LDL-C. Dit geldt vooral bij sterk afwijkende triglyceridenconcentraties. De non-HDL-C is op dit moment het beste alternatief, gelet op implementeerbaarheid, kosten en gemak voor de patiënt.
Onderbouwing
Achtergrond
Hoewel non-HDL-C wordt toegepast bij de SCORE2 voor de inschatting van het cardiovasculair risico, neemt in de praktijk de LDL-C bepaling nog steeds een centrale positie in bij de behandeling van hypercholesterolemie. Er zijn echter vragen wat betreft de standaardisatie en doelmatigheid van de bepaling van LDL-C. De steeds lager wordende streefwaarden van LDL stellen extra eisen aan de gebruikte analyse.
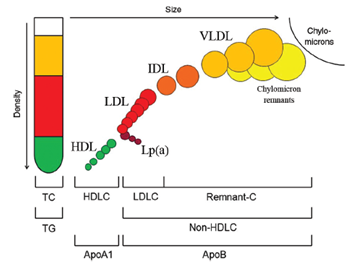
LDL bestaat uit een verzameling van heterogene deeltjes met ApoB als structureel eiwit waarbij de hoeveelheid cholesterol varieert, zie Figuur 1 (Langlois, 2018). Dit bemoeilijkt de standaardisatie van verschillende LDL-bepalingen. De referentiemethode volgens het Amerikaanse Centers of Disease Control (CDC) en Joint Committee for Traceability in Laboratory Medicine (JCTLM) is gebaseerd op de combinatie van ultracentrifugatie en een selectieve precipitatie van cholesterolhoudende fracties (de beta-quantificatie methode) waarmee deeltjes met een dichtheid van 1,006-1,063 g/mL toegekend worden aan de LDL-fractie.
Omdat deze methode zeer bewerkelijk is, wordt sinds de jaren ’70 van de vorige eeuw de Friedewald formule gebruikt voor een berekening van LDL-C (Friedewald, 1972). Deze formule (LDL-C = totaal cholesterol – HDL-C – (triglyceriden/2,2)) is ontwikkeld om klassen hyperlipidemie te kunnen onderscheiden (de “oude” Frederikson-klassen) en is lange tijd de meest gebruikte formule voor analyse van LDL-C geweest. Er zijn echter nadelen aan deze berekening. Mede daarom is de directe LDL-C methode ontwikkeld.
In deze submodule beschrijven we aandachtspunten en beperkingen bij lipidendiagnostiek, bedoeld voor zowel de klinische praktijk als het laboratorium.
Figuur 1. Verschillende cholesterolbevattende deeltjes gescheiden op basis van dichtheid (y-as), met de bijbehorende laboratoriumbepalingen die de verschillende cholesteroldeeltjes kunnen classificeren op basis van hun lipoproteïnen ApoA1, ApoB, Lp(a) (x-as). Overgenomen uit Langlois, 2018.
Conclusies / Summary of Findings
|
Zijn de resultaten van lipidendiagnostiek tussen verschillende laboratoria uitwisselbaar? |
|
De resultaten voor cholesteroldiagnostiek in Nederlandse laboratoria zijn zeer vergelijkbaar en uitwisselbaar bij normotriglyceridemie, met een lage variatie van 2-6%. Dit is lager dan op basis van de internationale literatuur werd aangenomen.
Bronnen: Langlois, 2020; Langlois, 2014; data SKML 2022. |
|
Welke beperkingen kennen de diverse methoden voor analyse van LDL-C? |
|
Bij een triglycerideconcentratie > 4,5 mmol/L is er een relevant verschil tussen de directe LDL-C bepaling en de berekende LDL-C (m.b.v. de Friedewald formule).
Bronnen: Langlois, 2020; Langlois, 2014, Martin 2013; data SKML 2022.
Het gebruik van de Friedewald formule voor berekening van LDL-C volstaat bij risico-inschatting en als uitgangswaarde voor start therapie. Echter bij hypertriglyceridemie (> 4,5 mmol/L) kent deze berekening beperkingen.
Bron: SKML 2022.
Het gebruik van de directe LDL-C volstaat bij risico-inschatting en als uitgangswaarde voor start therapie. Echter bij (intensieve) therapie en triglyceridenconcentratie < 2,3 mmol/L kent deze bepaling beperkingen.
Bronnen: Van Deventer, 2011; Martin, 2013; Balder, 2017; Reiber, 2020; Cemin, 2023. |
Samenvatting literatuur
Zijn de resultaten van lipidendiagnostiek tussen verschillende laboratoria uitwisselbaar?
In de literatuur wordt een aanzienlijk verschil tussen de resultaten van de LDL-C bepalingsmethoden beschreven. Dat verschil kan 20% of meer zijn (Langlois, 2020). De oorzaak hiervan ligt mogelijk bij verschillen in de subfracties die met de methoden worden bepaald. Een nadeel van de studie van Langlois (2020) is dat de beschreven methoden slechts deels gebruikt worden in Nederlandse laboratoria. De resultaten van de rondzendmonsters van de SKML geven meer inzicht in de Nederlandse situatie. Om vast te stellen of verschillen tussen bepalingsmethoden klinisch relevant zijn, moeten deze gezien worden in relatie tot de intra-individuele biologische variatie (CVi) van de afzonderlijke componenten in het lipidenprofiel. Een analytische variatie die lager is dan de biologische variatie zal weinig invloed hebben op de bepalingsuitkomst.
In Tabel 1 is de biologische variatie op basis van de EFLM Biological Variation Database (Aarsand) weergegeven, samen met de analytische variatie gebaseerd op 5 rondzendmonsters gemeten in ruim 170 Nederlandse laboratoria. Vastgesteld kan worden dat de biologische variatie aanzienlijk groter is dan de totale analytische variatie van alle klinisch chemische laboratoria in Nederland.
Daarnaast kan uit de data van de SKML rondzendmonsters worden afgeleid dat de variatie van lipidendiagnostiek tussen de methoden niet groter is dan binnen een methode (bij normotriglyceridemie). Daarmee worden de verschillen zoals gevonden door van Langlois (2014) niet bevestigd.
Tabel 1. Biologische variatie en totale analytische variatie bij resultaten rondom de streefwaarden (gebaseerd op de EFLM Biological Variation Database, geraadpleegd op 17 juli 2023) en analytische variatie zoals berekend op 5 rondzendmonsters van de SKML in 2022 met verschillende concentraties totaal cholesterol, HDL-C en triglyceriden.
|
Analyse |
Biologische variatie (intra-individueel) (%) |
Analytische variatie o.b.v. rondzend-monsters (%) |
Waarde van fictieve patiënt (mmol/L) |
Analytische variatie (min-max)* |
|
Totaal cholesterol |
5,3 |
2,1 |
5,0 |
4,7 – 5,3 |
|
Triglyceriden |
19,9 |
2,4 |
2,0 |
1,8 – 2,2 |
|
HDL-C |
5,7 |
3,7 |
1,0 |
0,9 – 1,1 |
|
Non-HDL-C (n=52) |
|
4,3 |
3,6 |
3,2 – 4,0 |
|
LDL-C (alle methoden) Friedewald (n=50) Directe methode (n=90) |
8,3 |
6,0 4,0 3,0 |
3,0 |
2,6 – 3,4 2,7 – 3,3 |
|
ApoB |
7,4 |
6,3 |
|
|
*Analytische variatie berekend door de standaarddeviatie (SD) te delen door de gemiddelden gerapporteerd door Nederlandse laboratoria in 5 rondzendmonsters van de SKML lipiden uit 2022. De analytische variatie is berekend voor de waarden van de fictieve patiënt ± 3SD.
Welke beperkingen kennen de diverse methoden voor analyse van LDL-C?
Beperkingen van gebruik van de Friedewald formule bij hypertriglyceridemie
Van de Nederlandse laboratoria gebruikt 40% de Friedewald formule voor berekening van LDL-C; 60% gebruikt een directe LDL-C methode (SKML, 2022). Het gebruik van de Friedewald formule voor het berekenen van LDL-C kent een aantal beperkingen. De formule gaat uit van een constante verhouding triglyceriden : totaal cholesterol om de VLDL-concentratie te schatten. Het veronderstelt een verwaarloosbaar aandeel van chylomicronen, die meer triglyceridenrijk zijn dan VLDL, en meer voorkomen in niet-nuchtere toestand (Nauck, 2002). Omdat de verhouding triglyceriden : totaal cholesterol in triglyceridenrijke lipoproteïnen progressief toeneemt naarmate hypertriglyceridemie ernstiger wordt, overschat de Friedewald formule de concentratie VLDLC en onderschat daarom LDL-C bij hoge triglyceridenconcentraties (Nauck, 2002). Deze fout wordt volgens de NCEP- en EAS-richtlijnen als onaanvaardbaar groot beschouwd bij triglyceriden ≥ 4,5 mmol/L (Bachorik, 1995; Visseren, 2021). In dat geval worden nuchtere bloedmonsters geadviseerd, ervan uitgaande dat hiermee de waarde tot beneden 4,5 mmol/L daalt (Nordestgaard, 2016).
De meeste verschillen tussen LDL-C bepalingsmethoden – met duidelijke afwijkingen tussen de resultaten van de methoden met de CDC-referentiemethoden – worden waargenomen in monsters van patiënten met triglyceridemie > 2 mmol/L, gemengde dyslipidemie of andere aandoeningen waarbij sprake is van veranderde lipoproteïnesamenstelling, zoals diabetes en chronische nierziekte (Contois, 2011).
Er zijn ook publicaties verschenen die het gebruik van de originele Friedewald formule bij TG tussen 4,5 – 8 mmol/L steunen (Demacker, 1996; Wilson, 1985; Tremblay, 2004). In deze literatuur wordt als bewijs hiervoor aangedragen dat de verhouding VLDL-TG gemiddeld niet verschillend is bij triglyceridenconcentraties onder de 4,5 mmol/L en tussen 4,5 – 8 mmol/L. Dit is juist, er treedt geen grote bias op. Wel neemt de fout rondom het gemiddelde onacceptabel toe (Tremblay, 2004). Dit leidt voor een onacceptabel groot deel van de patiënten tot onder en/of overschatting van de berekende LDL.
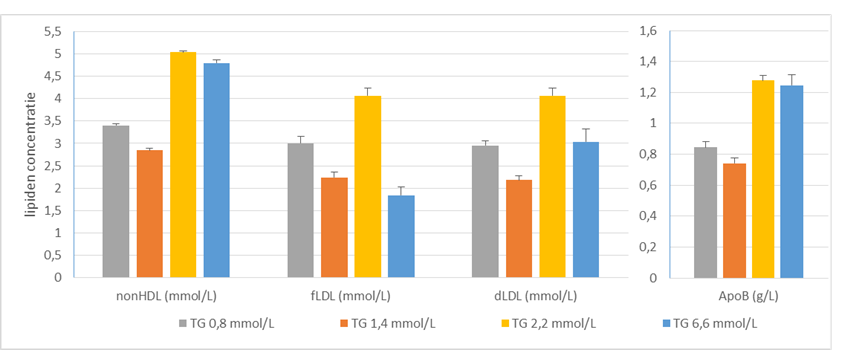
Daarnaast blijkt uit gegevens van de Nederlandse laboratoria, dat in SKML rondzendmonsters met een triglycerideconcentratie van 6,6 mmol/L een significante onderschatting van de LDL concentratie waargenomen wordt, wanneer berekend met de Friedewald formule (Figuur 2).
Tot slot maken grote internationale studies op het gebied van risicoschatting en het effect van lipidenverlagende medicatie (o.a. IMPROVE-IT (Cannon, 2015)), steeds gebruik van een berekende LDL (Friedewald) bij een TG lager dan 4,5 mmol/L (400mg/dL).
Bovenstaande argumentatie heeft er bij de werkgroep toe geleid om berekening van de LDL-C met behulp van de Friedewald formule bij een TG concentratie > 4,5 mmol/L af te raden.
Figuur 2. Waarden van vier rondzendmonsters met verschillende triglyceridenconcentraties van de SKML lipiden rondzending in 2022. De aanname hierbij is dat de ApoB concentratie geldt als gouden standaard voor atherogene deeltjes, omdat ieder LDL-molecuul hiervan één lipoproteïne heeft. LDL-C = non-HDL-C – 0,8 mmol/L.
Op grond van de gegevens van de SKML rondzending is vastgesteld dat de verhouding tussen non-HDL-C en ApoB constant is bij alle triglyceridenconcentraties, met een CV = 4,2% (Figuur 2). Dit onderbouwt dat non-HDL-C een goede maat is voor de ApoB concentratie.
Samenvattend nemen bij verhoogde triglyceriden de verschillen tussen LDL-C methoden toe. Dit betekent een beperking wat betreft het gebruik van deze bepalingen met verschillende meetmethoden bij het vervolgen van een individuele patiënt. Bij hypertriglyceridemie > 4,5 mmol/L wordt het gebruik van de Friedewald formule niet meer betrouwbaar geacht voor de berekening van de LDL-C concentratie.
Naast de Friedewald formule bestaan er andere berekeningen voor de concentratie LDL-C. De Martin-Hopkins formule gaat uit van een variabele verhouding van TG in de VLDL-fractie, maar kent dezelfde beperking als de Friedewald formule bij een triglyceridenconcentratie > 4,5 mmol/L. Deze formule is nauwkeuriger bij lagere LDL-C concentraties, maar lastig implementeerbaar in het laboratorium-informatiesysteem, vanwege de uitgebreide tabel die achter de berekening TG:VLDL zit (Martin, 2013). De Sampson-formule (Sampson, 2020) heeft het voordeel dat bij een triglyceridenconcentratie > 4,5 mmol/L een betrouwbare LDL-C berekend kan worden, maar heeft ongeveer dezelfde afwijking (aantal niet juist geclassificeerden) als de Martin-Hopkins of Friedewald formule. De Martin-Hopkins en Sampson formules zijn vrij recent geïntroduceerd en daarom buiten beschouwing gelaten in deze richtlijnmodule.
Beperkingen van directe LDL-C methoden bij lage lipidenconcentraties
De verschillen in selectiviteit voor LDL- en HDL-subfracties (Ramasamy, 2018; Contois, 2011) zijn van groot belang bij de huidige behandelingen waarin zeer lage LDL-C concentraties < 1,8 mmol/L steeds vaker met zeer effectieve LDL-C verlagende therapieën worden nagestreefd. De meeste afwijkingen in dyslipidemische monsters worden waargenomen bij lagere concentraties van LDL-C (< 1,8 mmol/L) en HDL-C (< 1,0 mmol/L) (Miller, 2010). Deze zouden kunnen resulteren in misclassificaties met betrekking tot atherosclerotische cardiovasculaire risicobeoordeling.
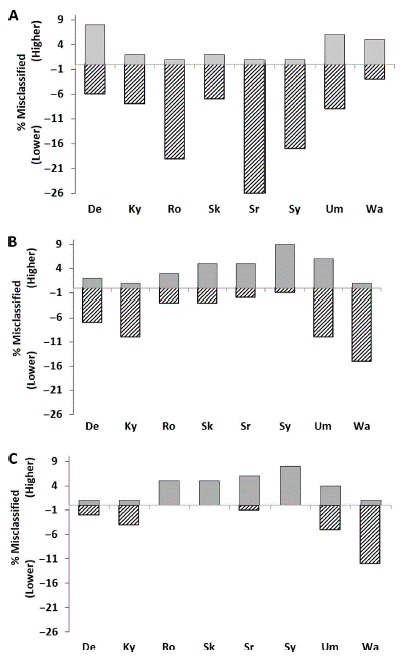
De overeenkomst tussen de ultracentrifugatiemethode en LDL-C methoden (berekend op basis van de Friedewald formule, directe LDL-C en non-HDL-C) is ook beschreven door Van Deventer (2011). Bij lagere triglyceriden concentraties (< 2,3 mmol/L) is de overeenkomst van de met de Friedewald formule berekende LDL-C beter dan de directe LDL-C methode, omdat het percentage misclassificatie lager is (zie Figuur 3, overgenomen uit Van Deventer, 2011). De directe LDL-C onderschat het risico op hart- en vaatziekte bij een lagere triglyceridenconcentratie. Nadeel van deze studie is dat de beschreven methoden beperkt gebruikt worden in Nederland, met uitzondering van de methode van Roche (Ro).
Andere studies vergelijken de met de Friedewald formule berekende LDL-C met de directe LDL-C zonder de referentiemethode te gebruiken (Martin, 2013; Balder, 2017; Reiber, 2020; Cemin, 2023), waarbij juist hogere waarden voor de directe LDL-C worden gevonden dan de LDL-C berekend met de Friedewald formule. Dit bevestigt de beperkingen van de directe LDL-C bepaling bij een triglyceriden concentratie < 2,3 mmol/L.
Figuur 3. Percentage misclassificatie voor het risico op hart- en vaatziekten bij patiënten met een triglyceridenconcentratie < 2,3 mmol/L. Percentage misclassificatie in 145 patiënten van de directe LDL-C (A), de met de Friedewald formule berekende LDL-C (B) en non-HDL-C (C) ten opzichte van de referentiemethode (ultracentrifugatie). Afkortingen representeren de verschillende methoden. Overgenomen uit Van Deventer, 2011.
Hoe vergelijkbaar zijn de uitkomsten van de LDL-C met de non-HDL-C bepaling?
De overeenkomst tussen de ultracentrifugatiemethode en non-HDL-C is beschreven door Van Deventer (2011). De auteurs beschrijven dat de non-HDL fractie de beste overeenkomst vertoont met de ultracentrifugatiemethode, onafhankelijk van de concentratie triglyceriden. Bij lagere triglyceridenconcentraties (< 2,3 mmol/L) is de overeenkomst van non-HDL-C beter dan de directe LDL-C methode, omdat het percentage misclassificatie lager is (zie Figuur 3, overgenomen uit Van Deventer, 2011).
Risico-inschatting en follow-up
LDL-C werd in studies meestal berekend met behulp van de Friedewald formule, alhoewel in recentere studies ook gebruik gemaakt wordt van directe LDL-C methoden. Groot nadeel bij bekende studies (zoals bijv. IMPROVE) is het ontbreken van de vermelding van de methodiek waarmee LDL-C is geanalyseerd. Ondanks de verschillen (bias en precisie) tussen LDL-C metingen en berekeningen, wordt er op populatieniveau steevast een verband gevonden tussen LDL-C en (rest)risico op hartvaatziekten (Silverman, 2016).
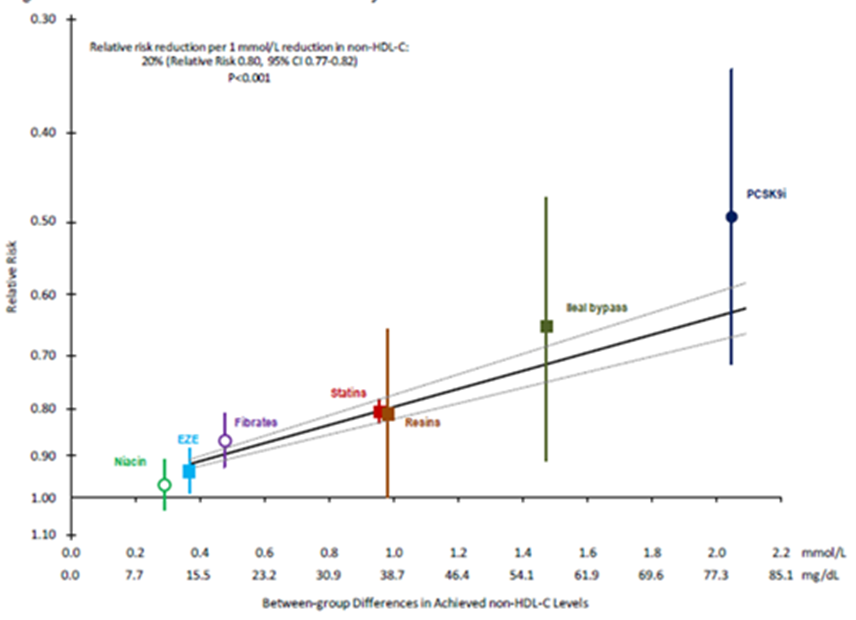
Ook de daling van LDL-C bij behandeling correleert met de reductie op cardiovasculaire events, onafhankelijk van de gebruikte LDL-C methode. De uitgevoerde studies laten (vaak in supplemental data) eenzelfde verband zien tussen daling in non-HDL-C en een reductie van cardiovasculaire events. Daarmee wordt non-HDL als een goede vervanger van LDL-C gezien, en is te verkiezen boven alternatieven die meer kosten met zich meebrengen.
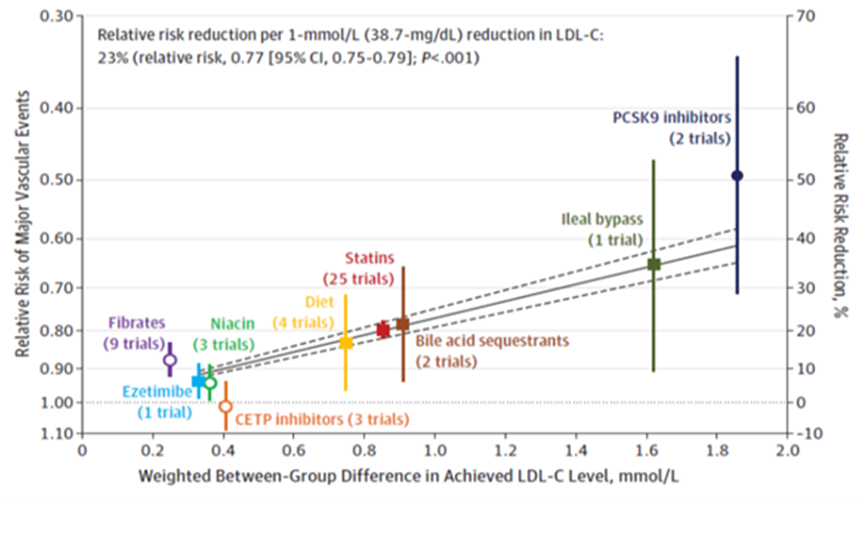
In Figuur 4 worden voorbeelden gegeven uit grote studies waarin het effect van therapie op LDL-C en non-HDL-C wordt weergegeven (Silverman, 2016; Schwartz, 2018). Hieruit blijkt dat tijdens follow-up bij (intensieve) lipidenverlagende therapie non-HDL-C dezelfde informatie geeft als LDL-C.
Figuur 4. Gewogen tussen-groep verschil in bereikt LDL (boven) of non-HDL (onder) en relatief risico voor “Major Vascular Events” per klasse interventie. Overgenomen uit Silverman, 2016.
Zoeken en selecteren
Er is voor deze submodule geen systematisch literatuuronderzoek uitgevoerd. De inhoud kon voldoende gebaseerd worden op internationale literatuur, met name consensus aanbevelingen. Daarnaast is er gebruik gemaakt van informatie van de Stichting Kwaliteitsbewaking Medische Laboratoriumdiagnostiek (SKML), verkregen uit plasmamonsters met verschillende concentraties in het lipidenprofiel, die routinematig naar alle Nederlandse klinisch chemische laboratoria worden gestuurd om de mate van onderlinge overeenkomst van de resultaten vast te stellen.
Referenties
- Aarsand AK, Fernandez-Calle P, Webster C, Coskun A, Gonzales-Lao E, Diaz-Garzon J, Jonker N, Simon M, Braga F, Perich C, Boned B, Marques-Garcia F, Carobene A, Aslan B, Sezer E, Bartlett WA, Sandberg S. The EFLM Biological Variation Database. https://biologicalvariation.eu/ [geraadpleegd op 17 juli 2023]
- Bachorik PS, Ross JW, for the NCEP Working Group on Lipoprotein Measurement. National Cholesterol Education Program recommendations for measurement of low-density lipoprotein cholesterol: executive summary. Clin Chem 1995;41:1414 20.
- Balder JW, de Vries JK, Nolte IM, Lansberg PJ, Kuivenhoven JA, Kamphuisen PW. Lipid and lipoprotein reference values from 133,450 Dutch Lifelines participants: Age- and gender-specific baseline lipid values and percentiles. J Clin Lipidol. 2017 Jul-Aug;11(4):1055-1064.e6.
- Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, Darius H, Lewis BS, Ophuis TO, Jukema JW, De Ferrari GM, Ruzyllo W, De Lucca P, Im K, Bohula EA, Reist C, Wiviott SD, Tershakovec AM, Musliner TA, Braunwald E, Califf RM; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015 Jun 18;372(25):2387-97. doi: 10.1056/NEJMoa1410489. Epub 2015 Jun 3.
- Cemin R, Casablanca S, Ermacora D, Daves M. The Importance of Being Aware of Intrinsic Methods' Limitation in Low-Density Lipoprotein Cholesterol Determination to Correctly Identify Cardiovascular Risk: Is Direct Determination Obtained with the Roche System Systematically Overestimating LDL in Very High-Risk Patients with Triglycerides Concentration of Less than 2.25 mmol/L? J Clin Med. 2023 Jun 30;12(13):4422.
- Contois JH, Warnick GR, Sniderman AD. Reliability of lowdensity lipoprotein cholesterol, non-high density lipoprotein cholesterol, and apolipoprotein B measurement. J Clin Lipidol 2011;5:264-72.
- Demacker PN, Toenhake-Dijkstra H, de Rijke YB, Stalenhoef AF, Stuyt PM, Willems HL. On the presumed inaccuracy of the Friedewald formula in hypertriglyceridemic plasma: a role for imprecise analysis? Clin Chem. 1996 Sep;42(9):1491-4.
- Friedewald WT, Levy RI, Fredrickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem. 1972 Jun;18(6):499-502.JCTLM database: Database of higher-order reference materials, measurement methods/procedures and services (www.bipm.org)
- Langlois MR, Chapman MJ, Cobbaert C, Mora S, Remaley AT, Ros E, Watts GF, Borén J, Baum H, Bruckert E, Catapano A, Descamps OS, von Eckardstein A, Kamstrup PR, Kolovou G, Kronenberg F, Langsted A, Pulkki K, Rifai N, Sypniewska G, Wiklund O, Nordestgaard BG; European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) Joint Consensus Initiative. Quantifying Atherogenic Lipoproteins: Current and Future Challenges in the Era of Personalized Medicine and Very Low Concentrations of LDL Cholesterol. A Consensus Statement from EAS and EFLM. Clin Chem. 2018 Jul;64(7):1006-1033. doi: 10.1373/clinchem.2018.287037. Epub 2018 May 14.
- Langlois MR, Descamps OS, van der Laarse A, Weykamp C, Baum H, Pulkki K, von Eckardstein A, De Bacquer D, Borén J, Wiklund O, Laitinen P, Oosterhuis WP, Cobbaert C; EAS-EFLM Collaborative Project. Clinical impact of direct HDLc and LDLc method bias in hypertriglyceridemia. A simulation study of the EAS-EFLM Collaborative Project Group. Atherosclerosis. 2014 Mar;233(1):83-90. doi: 10.1016/j.atherosclerosis.2013.12.016. Epub 2014 Jan 4.
- Langlois MR, Nordestgaard BG, Langsted A, Chapman MJ, Aakre KM, Baum H, Borén J, Bruckert E, Catapano A, Cobbaert C, Collinson P, Descamps OS, Duff CJ, von Eckardstein A, Hammerer-Lercher A, Kamstrup PR, Kolovou G, Kronenberg F, Mora S, Pulkki K, Remaley AT, Rifai N, Ros E, Stankovic S, Stavljenic-Rukavina A, Sypniewska G, Watts GF, Wiklund O, Laitinen P; European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) Joint Consensus Initiative. Quantifying atherogenic lipoproteins for lipid-lowering strategies: consensus-based recommendations from EAS and EFLM. Clin Chem Lab Med. 2020 Mar 26;58(4):496-517. doi: 10.1515/cclm-2019-1253.
- Martin SS, Blaha MJ, Elshazly MB, Brinton EA, Toth PP, McEvoy JW, Joshi PH, Kulkarni KR, Mize PD, Kwiterovich PO, Defilippis AP, Blumenthal RS, Jones SR. Friedewald-estimated versus directly measured low-density lipoprotein cholesterol and treatment implications. J Am Coll Cardiol. 2013 Aug 20;62(8):732-9.
- Miller WG, Myers GL, Sakurabayashi I, Bachmann LM, Caudill SP, Dziekonski A, Edwards S, Kimberly MM, Korzun WJ, Leary ET, Nakajima K, Nakamura M, Nilsson G, Shamburek RD, Vetrovec GW, Warnick GR, Remaley AT. Seven direct methods for measuring HDL and LDL cholesterol compared with ultracentrifugation reference measurement procedures. Clin Chem. 2010 Jun;56(6):977-86. doi: 10.1373/clinchem.2009.142810. Epub 2010 Apr 8.
- Nauck M, Warnick GR, Rifai N. Methods for measurement of LDL-cholesterol: a critical assessment of direct measurement by homogeneous assays versus calculation. Clin Chem. 2002 Feb;48(2):236-54.
- Nordestgaard BG, Langsted A, Mora S, Kolovou G, Baum H, Bruckert E, Watts GF, Sypniewska G, Wiklund O, Borén J, Chapman MJ, Cobbaert C, Descamps OS, von Eckardstein A, Kamstrup PR, Pulkki K, Kronenberg F, Remaley AT, Rifai N, Ros E, Langlois M; European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) joint consensus initiative. Fasting is not routinely required for determination of a lipid profile: clinical and laboratory implications including flagging at desirable concentration cut-points-a joint consensus statement from the European Atherosclerosis Society and European Federation of Clinical Chemistry and Laboratory Medicine. Eur Heart J. 2016 Jul 1;37(25):1944-58. doi: 10.1093/eurheartj/ehw152. Epub 2016 Apr 26.
- Ramasamy I. Update on the laboratory investigation of dyslipidemias. Clin Chim Acta. 2018 Apr;479:103-125. doi: 10.1016/j.cca.2018.01.015. Epub 2018 Jan 11.
- Reiber I, Mark L, Paragh G, Toth PP. Comparison of low-density lipoprotein cholesterol level calculated using the modified Martin/Hopkins estimation or the Friedewald formula with direct homogeneous assay measured low-density lipoprotein cholesterol. Arch Med Sci. 2020 Aug 3;18(3):577-586.
- Sampson M, Ling C, Sun Q, Harb R, Ashmaig M, Warnick R, Sethi A, Fleming JK, Otvos JD, Meeusen JW, Delaney SR, Jaffe AS, Shamburek R, Amar M, Remaley AT. A New Equation for Calculation of Low-Density Lipoprotein Cholesterol in Patients With Normolipidemia and/or Hypertriglyceridemia. JAMA Cardiol. 2020 May 1;5(5):540-548. doi: 10.1001/jamacardio.2020.0013.
- Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, Diaz R, Edelberg JM, Goodman SG, Hanotin C, Harrington RA, Jukema JW, Lecorps G, Mahaffey KW, Moryusef A, Pordy R, Quintero K, Roe MT, Sasiela WJ, Tamby JF, Tricoci P, White HD, Zeiher AM; ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018 Nov 29;379(22):2097-2107. doi: 10.1056/NEJMoa1801174. Epub 2018 Nov 7.
- Silverman MG, Ference BA, Im K, Wiviott SD, Giugliano RP, Grundy SM, Braunwald E, Sabatine MS. Association Between Lowering LDL-C and Cardiovascular Risk Reduction Among Different Therapeutic Interventions: A Systematic Review and Meta-analysis. JAMA. 2016 Sep 27;316(12):1289-97. doi: 10.1001/jama.2016.13985. PMID: 27673306.
- Stichting Kwaliteitsbewaking Medische Laboratoriumdiagnostiek (SKML). https://www.skml.nl/rondzendingen/rapportages/skml-tolerantiegebieden
- Tremblay AJ, Morrissette H, Gagné JM, Bergeron J, Gagné C, Couture P. Validation of the Friedewald formula for the determination of low-density lipoprotein cholesterol compared with beta-quantification in a large population. Clin Biochem. 2004 Sep;37(9):785-90. doi: 10.1016/j.clinbiochem.2004.03.008.
- Van Deventer HE, Miller WG, Myers GL, Sakurabayashi I, Bachmann LM, Caudill SP, Dziekonski A, Edwards S, Kimberly MM, Korzun WJ, Leary ET, Nakajima K, Nakamura M, Shamburek RD, Vetrovec GW, Warnick GR, Remaley AT. Non-HDL cholesterol shows improved accuracy for cardiovascular risk score classification compared to direct or calculated LDL cholesterol in a dyslipidemic population. Clin Chem. 2011 Mar;57(3):490-501. doi: 10.1373/clinchem.2010.154773. Epub 2011 Jan 12.
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, Benetos A, Biffi A, Boavida JM, Capodanno D, Cosyns B, Crawford C, Davos CH, Desormais I, Di Angelantonio E, Franco OH, Halvorsen S, Hobbs FDR, Hollander M, Jankowska EA, Michal M, Sacco S, Sattar N, Tokgozoglu L, Tonstad S, Tsioufis KP, van Dis I, van Gelder IC, Wanner C, Williams B; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227-3337. doi: 10.1093/eurheartj
- Wilson PW, Zech LA, Gregg RE, Schaefer EJ, Hoeg JM, Sprecher DL, Brewer HB Jr. Estimation of VLDL cholesterol in hyperlipidemia. Clin Chim Acta. 1985 Oct 15;151(3):285-91. doi: 10.1016/0009-8981(85)90091-9.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-01-2024
Beoordeeld op geldigheid : 10-11-2023
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit Kwaliteitsgelden Medisch Specialisten (SKMS, projectnummer 61245588). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
De Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC) is regiehouder van deze richtlijnmodule en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De module valt binnen het cluster Cardiovasculair risicomanagement (CVRM).
Aanleiding voor het maken van de richtlijnmodule
In de richtlijnen Cardiovasculair risicomanagement (CVRM) en Erfelijke dyslipidemie in de 2e en 3e lijn werd op meerdere plekken beschrijvingen gedaan over lipidendiagnostiek. Om versnippering te voorkomen en een eenduidig beeld te geven over de keuze voor diagnostiek, de gebruikte methoden en inzicht in interpretatie van laboratoriumresultaten, is gekomen tot een integrale module Laboratoriumtechnische aspecten van lipidendiagnostiek. Keuze en interpretatie van diagnostiek wordt beïnvloed door laboratoriumtechnische facetten die de pre-analyse (voorbereiding patiënt, afname tijdstip en andere aspecten met betrekking tot de bloedafname), analyse (keuze analysemethodiek en mogelijke interferenties) en post-analyse (interpretatie, streefwaarden, normaalwaarden, eenheden) betreffen (Aakre, 2013).
Doel van de richtlijnmodule
Deze module, met drie submodules, is gericht op de meest relevante aspecten van laboratoriumdiagnostiek van lipiden en beoogt algemeen toepasbaar te zijn, ook voor andere richtlijnen waar deze aspecten van laboratoriumdiagnostiek aan de orde zijn.
Afbakening van de richtlijnmodule
De module beschrijft lipidendiagnostiek ten behoeve van risicoschatting en behandeling in het kader van cardiovasculair risicomanagement. Dit zijn primair de analyses van totaal cholesterol, HDL-cholesterol, triglyceriden, LDL-cholesterol (gemeten met de directe assay of berekend met de Friedewald formule) en non-HDL cholesterol. Voor de tweede en derde lijn is analyse van apolipoproteïne B (ApoB) en lipoproteïne(a) (Lp(a)) voor specifieke gevallen van toegevoegde waarde; voor verdere toelichting verwijzen we naar de Richtlijn Erfelijke dyslipidemie in de 2e en 3e lijn.
In de drie submodules wordt ingegaan op de volgende onderwerpen:
- Pre-analytische fase, waarin onder andere de niet-nuchtere bloedafname staat beschreven;
- Analytische fase, waarin onder andere de verschillende LDL-C analyses staan beschreven;
- Post-analytische fase, waarin onder andere aandacht is voor het verschil tussen referentie intervallen en streefwaarden van lipidendiagnostiek.
Doel en doelgroep
Doel van de richtlijnmodule
Deze module, met drie submodules, is gericht op de meest relevante aspecten van laboratoriumdiagnostiek van lipiden en beoogt algemeen toepasbaar te zijn, ook voor andere richtlijnen waar deze aspecten van laboratoriumdiagnostiek aan de orde zijn.
Beoogde gebruikers van de richtlijn
De richtlijnmodule is bedoeld voor 2e lijns zorgprofessionals die betrokken zijn bij lipidendiagnostiek in het kader van cardiovasculair risicomanagement.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is medio 2020 een NVKC-werkgroep ingesteld. Deze is – na afstemming met Cluster Cardiovasculair risicomanagement (CVRM) – gestart met de uitwerking.
- Dr. W.P.H.G. (Wilhelmine) Verboeket-van de Venne (voorzitter), wetenschappelijk onderzoeker klinische chemie, Zuyderland Medisch Centrum, Heerlen / Sittard-Geleen; beleidsadviseur kwaliteit NVKC, Utrecht
- Dr. ir. A.J. (Arjan) van Adrichem (secretaris), klinisch chemicus, Accureon, Bravis Ziekenhuis, ZorgSaam
- Dr. A. (Angela) Bikker, klinisch chemicus, Sint Antonius Ziekenhuis, Nieuwegein; Saltro Unilabs B.V., Utrecht
- Dr. J. (Joyce) Curvers, klinisch chemicus, Catharina Ziekenhuis, Eindhoven
- Dr. F.A.L. (Frans) van der Horst, klinisch chemicus, Reinier de Graaf Groep, Delft
- Dr. ir. M.L.P. (Marloes) Langelaan, klinisch chemicus, Result laboratorium, Amphia Ziekenhuis, Breda
- Dr. drs. W.P. (Wytze) Oosterhuis, arts klinische chemie, epidemioloog, Reinier de Graaf Groep Delft
Met ondersteuning van
- Dr. N.L. (Nikita) van der Zwaluw, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. W.P.H.G. Verboeket-van de Venne (voorzitter) |
Wetenschappelijk onderzoeker klinische chemie, Zuyderland Medisch Centrum, Heerlen / Sittard-Geleen; beleidsadviseur kwaliteit NVKC, Utrecht |
Geen |
Deelname aan onderzoek CoLab-score and viability PCR for SARS-CoV-2: routine blood test algorithm proven by elimination of viable SARS-CoV-2 to identify patients in order to facilitate discharge and/or de-isolation (geen projectleider), financier: ZonMw |
Geen restricties |
|
Dr. ir. A.J. van Adrichem (secretaris) |
Klinisch chemicus, Accureon, Bravis Ziekenhuis, ZorgSaam |
Geen |
Geen |
Geen restricties |
|
Dr. A. Bikker |
Klinisch chemicus, Sint Antonius Ziekenhuis, Nieuwegein; Saltro Unilabs B.V., Utrecht |
- Lid NVKC Commissie Zelftesten (onbetaald) - Lid NVKC Commissie Publieksvragen (onbetaald) |
Geen |
Geen restricties |
|
Dr. J. Curvers |
Klinisch chemicus, Catharina Ziekenhuis, Eindhoven |
Geen |
Projectleider van onderzoek Sepsis biomarkers on the VTLi, financier: Siemens Healthineers |
Geen restricties |
|
Dr. F.A.L. van der Horst, |
Klinisch chemicus, Reinier de Graaf Groep, Delft |
- Voorzitter Wetenschapsraad Reinier de Graaf Gasthuis (onbetaald) - Auditor Raad voor Accreditatie (betaald) |
Geen |
Geen restricties |
|
Dr. ir. M.L.P. Langelaan |
Klinisch chemicus, Result laboratorium, Amphia Ziekenhuis, Breda |
Lid SKML sectie Algemene chemie (onbetaald) |
Deelname aan Big Promise: onderzoek naar biomarkers om het operatierisico te voorspellen, zie www.bigpromise.nl (geen projectleider), financier: Roche |
Geen restricties |
|
Dr. drs. W.P. Oosterhuis |
Arts klinische chemie, epidemioloog, Reinier de Graaf Groep Delft |
- Morgagni BV: uitvoeren van gesubsidieerde projecten in de gezondheidszorg (betaald, niet BTW-plichtig) - Oosterhuis Medisch Advies: uitvoeren van medisch-inhoudelijke werkzaamheden (betaald); werk voor commissies en werkgroepen binnen de klinische chemie, peer-reviews (onbetaald); onderzoek m.b.t. software ontwikkeling kennissystemen |
De uitkomsten van dit project kunnen bijdragen aan versterking van de wetenschappelijke positie c.q. aanzien. |
Geen restricties |
Inbreng patiëntenperspectief
De conceptmodule is ter commentaar voorgelegd aan Patiëntenfederatie Nederland en Harteraad.
Werkwijze
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de huidige richtlijn Cardiovasculair risicomanagement en Erfelijke dyslipidemie in de 2e en 3e lijn. Op basis van de uitkomsten van de knelpuntenanalyse zijn – in samenspraak met Cluster Cardiovasculair risicomanagement – concept uitgangsvragen opgesteld, die betrekking hebben op de pre-analyse, analyse, en post-analyse. De uitgangsvragen zijn in de schrijffase definitief vastgesteld.
Methode literatuursamenvatting
Een beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de individuele studies is te vinden onder het kopje ‘Methoden – zoeken en selecteren’.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. Gedurende het proces is er regelmatig afstemming geweest met leden van het cluster CVRM.
Commentaar- en autorisatiefase
De concept richtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de concept richtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan relevante wetenschappelijke verenigingen voorgelegd voor autorisatie.
Literatuur
Aakre KM, Langlois MR, Watine J, Barth JH, Baum H, Collinson P, Laitinen P, Oosterhuis WP. Critical review of laboratory investigations in clinical practice guidelines: proposals for the description of investigation. Clin Chem Lab Med 2013; 51(6): 1217–1226. doi: 10.1515/cclm-2012-0574