Plaatsing van een subcutane drain tijdens een sectio bij vrouwen met obesitas
Uitgangsvraag
Helpt het achterlaten van een drain tijdens een sectio om postoperatieve wondinfecties te voorkomen bij vrouwen met obesitas?
Aanbeveling
Plaats niet routinematig een subcutis drain ter preventie van wondcomplicaties bij vrouwen met obesitas die een sectio ondergaan.
Overwegingen
Vrouwen met obesitas hebben een verhoogd risico op complicaties tijdens/na de zwangerschap en het bevallen via een keizerssnede (Machado, 2012). Vaak wordt aangeraden om bij vrouwen met obesitas tijdens een keizerssnede de huid subcutaan te hechten, en/of een subcutane drain te plaatsen (Machado, 2012). Het plaatsen van de subcutis drain blijft echter controversieel (Machado, 2012): enerzijds zijn sommige auteurs van mening dat de drain kan helpen bij het voorkomen van wondinfecties en wondcomplicaties (Allaire, 2000). Het afvoeren van overtollig vloeistof in de subcutane ruimte zou helpen infecties te voorkomen. Andere auteurs zijn van mening dat, omdat de drain een extra incisie vereist, deze juist kan resulteren in extra weefselschade. Daarnaast kan de drain een port d’entree kans zijn voor infecties, of kan het als corpus alienum infecties bevorderen (Alanis, 2010).
Hoewel de puntschatter in de richting wijst in de richting van positief effect van een drain voor het verminderen van wondinfecties, febriele morbiditeit en wondinfecties, is de heterogeniteit in het bewijs tussen studies zo groot, en de kwaliteit van de individuele studies zo laag, dat er geen uitspraak kan worden gedaan over het effect van een drain (niveau van bewijskracht is zeer laag).
Ook voor postoperatieve pijn en de duur van de ziekenhuisopname konden geen uitspraken worden gedaan in verband met de kwaliteit en de hoeveelheid bewijs. De drain lijkt niet of nauwelijks effect te hebben op proceduretijd en de kans op heropname (Gates & Anderson, 2005).
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Gelet op het ontbreken van effecten van subcutis drain plaatsing op de cruciale uitkomstmaten, is de werkgroep van mening dat een subcutis drain niet dient te worden geplaatst om wondcomplicaties te voorkómen bij vrouwen met obesitas die een sectio ondergaan.
Het bestaande bewijs is echter van lage tot zeer lage kwaliteit, en gebaseerd op een relatief klein aantal geïncludeerde patiënten. Dit zou geresulteerd kunnen hebben in onvoldoende power om een (gunstig) effect van subcutis drainplaatsing waar te nemen. Dit geldt met name voor uitkomsten die relatief zeldzaam zijn, zoals bijvoorbeeld voor trombose, heropname en noodzaak tot chirurgische re-interventie. Bovendien zijn kleine effecten op meer frequent optredende uitkomstmaten niet te detecteren. Bijvoorbeeld geldt voor de primaire uitkomst wondcomplicatie (incidentie in deze populatie 10%), of voor continue maten (bijvoorbeeld opnameduur), dat alleen grote effecten bij kleine aantallen geïncludeerde patiënten detecteerbaar zullen zijn. Aangezien een vermindering van het aantal wondcomplicaties met 50% zeker als klinisch relevant zou worden bestempeld, en deze wel in het betrouwbaarheidsinterval van de punt schatters van de effecten zit, zouden grotere studies waardevol kunnen zijn om deze onderzoeksvraag te beantwoorden.
Waarden en voorkeuren van patiënten
Patiënt gerapporteerde uitkomsten werden in geen van de geïncludeerde studies gerapporteerd.
Kosten (middelenbeslag)
Geen van de studies rapporteerden over kosten. Ook op basis van het ontbreken van verschil in opnameduur, operatietijd, en infecties, is het niet aannemelijk dat het plaatsen van een subcutis drain een grote gunstige invloed heeft op kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is geen onderzoek gevonden naar de aanvaardbaarheid (onder vrouwen of onder zorgverleners) van subcutis drain plaatsing na een sectio bij vrouwen met obesitas. Er lijken geen barrières te zijn voor implementatie van het advies zoals hier geformuleerd (om geen drain te plaatsen), omdat de drainplaatsing voor deze indicatie nimmer brede implementatie heeft gekend.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het plaatsen van een postoperatieve subcutis drain beoogt met name preventie van seroom vorming en infectieuze complicaties, die beide een hogere incidentie kennen bij obesitas. In de weinige beschikbare literatuur over het onderwerp drainplaatsing post sectio bij vrouwen met obesitas, werden geen aanwijzingen gevonden van een gunstig effect op cruciale of secundaire uitkomsten.
Een Cochrane review onder 5248 vrouwen (Gates, 2013), die zich niet beperkte tot vrouwen met obesitas, vond geen bewijs voor een verschil in wondinfecties, wondcomplicaties of febriele morbiditeit bij vrouwen die een wond drain kregen, vergeleken met vrouwen die geen wonddrain kregen. Binnen een subgroepanalyse bij vrouwen met obesitas vergeleken met ongeselecteerde populaties werd geen verschil gezien in wondinfecties, wondcomplicaties of febriele morbiditeit.
Gelet op het ontbreken van effecten van subcutis drain plaatsing op de cruciale uitkomstmaten, is de werkgroep van mening dat een subcutis drain niet dient te worden geplaatst om wondcomplicates te voorkómen bij vrouwen met obesitas die een sectio ondergaan.
Onderbouwing
Achtergrond
Vrouwen met obesitas die per sectio bevallen hebben een grotere kans op postoperatieve wondcomplicaties dan vrouwen met een gezond BMI (Conner, 2014; NVOG, 2009). Een subcutane drain wordt met name bij vrouwen met obesitas vaak gebruikt om wondcomplicaties tegen te gaan (Gates, 2013; Hellums, 2007). Het is echter onduidelijk in de huidige richtlijn of een subcutane drain helpt om wondcomplicaties te voorkomen, of zelfs leidt tot méér wondcomplicaties (NVOG, 2009). In deze literatuuranalyse wordt onderzocht of een subcutane drain bij vrouwen met obesitas wondcomplicaties na de sectio kan voorkomen.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is uncertain about the effect of placement of a subcutaneous drain versus no placement of a subcutaneous drain on wound infection incidence in obese women after a caesarean section.
Sources: Gates, 2013 |
|
Very low GRADE |
The evidence is uncertain about the effect of placement of a subcutaneous drain versus no placement of a subcutaneous drain on febrile morbidity incidence in obese women after a caesarean section.
Sources: Gates, 2013 |
|
The evidence is uncertain about the effect of placement of a subcutaneous drain versus no placement of a subcutaneous drain on wound complication incidence in obese women after caesarean section.
Sources: Gates, 2013 |
|
Very low GRADE |
The evidence is uncertain about the effect of placement of a subcutaneous drain versus no placement of a subcutaneous drain on postoperative pain in obese women after a caesarean section.
Sources: Kumar, 2004 |
|
Low GRADE |
The placement of a subcutaneous drain may result in little to no difference in procedure time, compared to no placement of a subcutaneous drain in obese women after a caesarean section.
Sources: Kumar, 2004, Ramsey, 2005 and Magann, 2002 |
|
Very low GRADE |
The evidence about the effect of placement of a subcutaneous drain versus no placement of a subcutaneous drain on the duration of hospital stay in obese women after a caesarean section is uncertain.
Sources: Kumar, 2004 |
|
No GRADE |
No studies reported outcomes on risk on thrombosis and the effect of placement of a subcutaneous drain.
|
|
No GRADE |
No studies reported outcomes on patient satisfaction after placement of a subcutis drain in obese women after a caesarean section.
|
|
Low GRADE |
The placement of a subcutaneous drain may result in little to no difference in hospital readmission, compared to no placement of a subcutaneous drain in obese women during a caesarean section.
Sources: Ramsey, 2005 |
Samenvatting literatuur
Description of studies
The systematic review by Gates e.a. (2013) compared the effect of placement of a subcutaneous wound drain versus no placement of a subcutaneous wound drain during a caesarean section. The effect of placement of a subcutaneous drain in obese women was investigated using 5 RCTs (5 trials, 1214 women). Obesity was defined as either more than 2cm (Al-Inany, 2002; Allaire, 2000; Kumar, 2004; Magann, 2002) or 4cm (Ramsey, 2005) subcutaneous fat thickness in the individual studies. One study randomized to a drain and no drain group (Al-Inany, 2002), three studies randomized women into three groups: subcutaneous drain, suturing of subcuteneous fat and no intervention (Allaire 2000, Magann 2002) and one study randomized into a subcutaneous suture + drain versus subcutaneous suture without drain (Ramsey, 2002). In this case, Gates e.a. combined the suturing and no intervention group to a ‘no drain’ group (Gates, 2013). The duration of the wound drainage differed among studies from 6-36 hours to 72 hours in one study (Allaire, 2000). The outcome assessment was most often done at skin staple removal (maximum of 10 days), but with 3 studies performing an additional comprehensive follow up measurement up to a few weeks after discharge (Al-Inany, 2002; Magann, 2002; Ramsey, 2005). The evidence table with individual study characteristics and results can be found in the attachment.
Results
The data for the critical outcomes (1. wound infections, 2. febrile morbidity and 3. wound complications) were derived from the systematic review by Gates e.a. 2013. The pooled analyses were repeated, excluding the studies that included women regardless of obesity.
1. Wound infections
Figure 1. Subcutaneous drain vs. no drain. Outcome: Wound infection
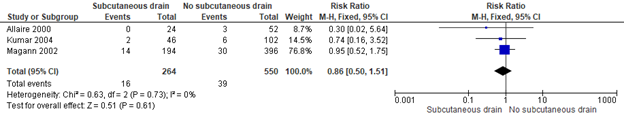
Source: Gates (2013)
Gates (2013) included 3 trials (814 women) that assessed the effect of placement of a subcutaneous drain versus no placement of a subcutaneous drain on wound infection in obese women during a caesarean section. All three studies defined obesity as more than 2cm thickness of subcutaneous fat (Gates 2013). Allaire (2000) and Kumar (2004) defined wound infections as “diagnosing two of the following characteristics: drainage of purulent material, erythema, tenderness, induration of fever and if it required opening and drainage or antibiotics”. Magann (2002) defined wound infections as any wound with induration and erythema that contained purulent material.
The placement of a subcutaneous drain did not appear to reduce wound infection incidence compared to no placement of a subcutaneous drain during a caesarean section (3 trials, 814 women, RR 0.86, 95% CI 0.50 to 1.51). The confidence interval exceeds both the upper and lower limit of clinical relevance, indicating imprecision of effect estimate.
2. Febrile morbidity
Figure 2. Subcutaneous drain vs. no drain. Outcome: Febrile morbidity
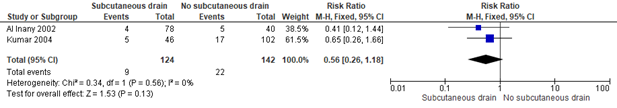
Source: Gates (2013)
Gates (2013) included 2 trials (266 women) that examined the effect of placement of a subcutaneous drain versus no placement of a subcutaneous drain on febrile morbidity in obese women during a caesarean section. Kumar (2004) defined febrile morbidity as “maternal fever measured by a temperature of more than 38.0 °C on two occasions 12 hours apart. Al Inany (2002) defined febrile morbidity as “maternal fever with a measured by a temperature elevation more than 37.8 °C on two occasions 4 hours apart.
The placement of a subcutaneous drain did not appear to reduce febrile morbidity compared to no placement of a subcutaneous drain in both trials during a caesarean section (2 trials, 266 women, RR 0.56, 95%CI 0.26 to 1.18). The confidence interval exceeds the lower limit of clinical relevance, indicating (large) imprecision.
3. Wound complications
Figure 3. Subcutaneous drain vs. no drain, outcome: Wound complications
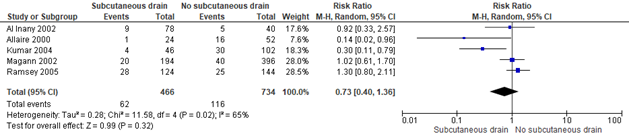
Source: Gates (2013)
Gates (2013) included 5 trials (1200 women that examined the effect of the placement of a subcutaneous drain versus no placement of a subcutaneous drain on wound complications in obese women. Wound complications were defined as diagnosing wound infection, wound separation or disruption, seroma and hematoma (Al Inany, 2002; Allaire, 2000; Kumar, 2004; Magann, 2002 and Ramsey, 2005). Al Inany (2002) defined wound complications as the detection of wound infection, wound breakdown (including separation of the incision above the fascia), hematoma and fever. Allaire (2000) defined wound complications as the detection of wound infection, wound separation, seroma or hematoma. Kumar (2004) defined wound complications as the detection of wound disruption, wound infection, seroma and hematoma. Magann (2002) defined wound complications as seromas, hematomas or infections that required that the incision be opened, evacuated and/or irrigated and debribed. Ramsey (2005) defined wound complications as subcutaneous dehiscence (> 1cm), seroma, hematoma, abscess or fascial dehiscence.
The placement of a subcutaneous drain did not appear to reduce wound complication incidence compared to no placement of a subcutaneous drain in obese women (5 trials, 1200 women, RR 0.73, 95%CI 0.40 to 1.36). The individual trials showed a widely differing effects indicating heterogeneity (I2=65%), which may be partly explained by differing definitions of wound complications among studies (Gates 2013). The confidence interval exceeds both the upper and lower limit of clinical relevance, indicating imprecision of effect estimate.
The important outcomes (4. postoperative pain, 5. procedure time, 6. duration of hospital stay, 7. thrombosis, 8. hospital readmission and 9. patient satisfaction) were not reported by Gates (2013) are thus deriving from the individual RCTs.
4. Postoperative pain
One trial in 96 women (Kumar, 2004) compared postoperative pain in obese women who received a subcutaneous drain (N=46) with women who did not receive a subcutaneous drain during a caesarean section (N=50). Besides the subcutaneous drain, Kumar (2004) assigned one intervention group to a subcutaneous stitch, which were excluded for the purpose of this module (see module 5a for comparison subcutaneous drain with subcutaneous stitch). Postoperative pain was measured once with a 10 cm visual analogue scale (VAS) approximately 24 hours after the surgery, with no pain=0 and worst pain ever=10.
Kumar (2004) reported no significant difference in postoperative pain (measured with VAS score) between obese women who received a subcutaneous drain during a caesarean section versus obese women who did not receive a subcutaneous drain during a caesarean section (subcutaneous drain (N=46), VAS (mean ± SD)= 2.7± 0.6 versus no subcutaneous drain (N=50), VAS (mean ± SD)= 2.9 ± 0.6).
5. Procedure time
Three trials in 775 women (96, 399 and 280 respectively) (Kumar, 2004; Magann, 2002 and Ramsey, 2005) reported the procedure time (min) in obese women who received a subcutaneous drain during a caesarean section versus women who did not receive a subcutaneous drain during a caesarean section. Besides the subcutaneous drain, Kumar (2004) and Magann (2002) assigned one intervention group to a subcutaneous stitch closure, which were be excluded for the purpose of this module (see module 5a for comparison subcutaneous drain with subcutaneous stitch). Ramsey (2005) compared a subcutaneous closure + drain in one group with a subcutaneous closure without drain in the control group.
Kumar (2004), Magann (2002) and Ramsey (2005) reported no significant difference in procedure time (min) between obese women who received a subcutaneous drain versus obese women who received no subcutaneous drain during caesarean section. The results are summarized in Table 1.
Table 1. Subcutaneous drain versus no subcutaneous drain. Outcome: Procedure time (min).
|
|
Procedure time (min) (Mean±SD): subcutaneous drain |
Procedure time (min) (Mean±SD): no subcutaneous drain |
Significance (P-value) |
|
Kumar (2004) |
28.9 ± 3.2 (N=46) |
28.5 ± 5.9 (N=50) |
0.17 |
|
Magann (2002) |
46.8 ± 19 (N=194) |
45.1 ± 18.2 (N=205) |
0.60 |
|
Ramsey (2005) |
70.0 ± 26.3 (N=131) |
64.4 ± 25.3 (N=149) |
0.08 |
Sources: Kumar, 2004; Magann, 2002; Ramsey, 2005
6. Duration of hospital stay
One trial in 96 women (Kumar, 2004) compared the duration of hospital stay in obese women who received a subcutaneous drain (N=46) with women who did not receive a subcutaneous drain during a caesarean section (N=50). Besides the subcutaneous drain, Kumar (2004) assigned one intervention group to a subcutaneous stitch, which were excluded for the purpose of this module (see module 5a for comparison subcutaneous drain with subcutaneous stitch).
Kumar (2004) reported no significant difference in the duration of hospital stay (days) between obese women who received a subcutaneous drain during caesarean section versus obese women who did not receive a subcutaneous drain during caesarean section (subcutaneous drain (N=46) (mean ± SD)=6.6±0.8, no subcutaneous drain (N=50) (mean ± SD)=6.8±0.5).
7. Thrombosis
No studies reported on thrombosis related outcomes.
8. Hospital readmission
One trial (Ramsey, 2005) in 268 women compared obese women who received a subcutaneous closure and drain (N=124) versus women who did not receive a subcutaneous drain (n=144) on hospital readmission percentage.
Ramsey (2005) reported no significant difference in hospital readmission for wound complications (1 trial, 268 women, subcutaneous drain (N=124)= 6.6%, no subcutaneous drain (N=144)=3.5%, adjusted OR 1.62, 95% CI 0.50 to 5.21).
9. Patient satisfaction
No studies reported patient satisfaction outcomes.
Level of evidence of the literature
Because Gates (2013) did not perform a separate quality assessment for the evidence on obese women, the working group decided to assess the evidence according to the GRADE method, using the risk of bias assessment of the individual studies as assessed by Gates (2013). According to GRADE, randomized controlled trials (RCTs) start at a high level of evidence.
The level of evidence regarding the outcome measure wound infections was downgraded by three levels to ‘very low’: one level because of study limitations (risk of bias: allocation concealment unclear, blinding for outcome assessment unclear, selective reporting unclear) and two levels because of large imprecision (confidence intervals overlap both the upper and lower limits of clinical relevance).
The level of evidence regarding the outcome measure febrile morbidity was downgraded by three levels to ‘very low’: one level because of study limitations (risk of bias: randomization unclear, allocation concealment unclear, blinding for outcome assessment unclear, selective reporting unclear) and two levels because of large imprecision (confidence intervals overlap widely the lower limits of clinical relevance and the 0-line of effectiveness).
The level of evidence regarding the outcome measure wound complications was downgraded by three levels to ‘very low’: one level because of study limitations (risk of bias: randomization unclear, allocation concealment unclear, blinding for outcome assessment unclear, selective reporting unclear); one level because of conflicting results (inconsistency); applicability (indirectness: different definitions for wound complications) and large imprecision (confidence intervals overlap both the upper and lower limits of clinical relevance).
The level of evidence regarding the outcome measure postoperative pain was downgraded by three levels to ‘very low’: one level because of study limitations (risk of bias: allocation concealment unclear, blinding for outcome assessment unclear, selective reporting unclear) and two levels because of large imprecision (number of included patients: 96).
The level of evidence regarding the outcome measure procedure time was downgraded by two levels to ‘low’: one level because of study limitations (for risk of bias: allocation of treatment procedure unclear) and one level because of imprecision (number of included patients 775).
The level of evidence regarding the outcome measure duration of hospital stay was downgraded by three levels to ‘very low’: one level because of study limitations (risk of bias: allocation concealment unclear, blinding for outcome assessment unclear, selective reporting unclear); and two levels because of large imprecision (number of included patients 96).
The outcome measure thrombosis could not be graded because no literature reporting on this outcome was found.
The level of evidence regarding the outcome measure hospital readmission was downgraded by two levels to ‘low’: one level because of study limitations (risk of bias: allocation concealment unclear, blinding for outcome assessment unclear, selective reporting unclear); and two levels because of imprecision (number of included patients 268).
The outcome measure patient satisfaction could not be graded because no literature reporting on this outcome was found.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: “What are the beneficial and unfavorable effects of placement of a subcutaneous drain versus no placement of a subcutaneous drain in pregnant women with obesity that undergo a caesarean section?”
P: Women with obesity undergoing a caesarean section
I: Subcutaneous drain
C: No subcutaneous drain
O: Wound infection (abscess and cellulitis; febrile morbidity), wound complications (seroma, hematoma, wound dehiscence), postoperative pain, procedure time, duration of hospital stay, thrombosis, hospital readmission and patient satisfaction
Relevant outcome measures
The guideline development group considered wound infection (e.g. abscess and cellulitis) and wound complications (e.g. seroma, hematoma and wound edge separation) as critical outcome measures for decision making; and postoperative pain, procedure time, duration of hospital stay, thrombosis, hospital readmission and patient satisfaction as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. Obesity was defined as having a BMI ≥30 before pregnancy or subcutaneous thickness of more than 2cm.
The working group defined the GRADE-default minimal clinically important differences for all outcomes: 0.75 and 1.25.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until December 5th, 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 46 hits. Studies were selected based on the following criteria:
- The population meets the criteria of the PICO
- The intervention meets the criteria of the PICO
- The outcome meets the criteria of the PICO
- It involves the original study or systematic review
11 studies were initially selected based on title and abstract screening. After reading the full text, 7 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 4 studies were included (one systematic review, 3 randomized controlled trials). The systematic review included all three intended trials and two new trials (meeting the inclusion criteria). A total of 5 RCTs were included. The study characteristics, quality assessment (including risk of bias) and primary results (crucial outcome measures) were extracted from the systematic review. For the secondary outcome measures, individual RCTs were studied.
Results
One systematic review, investigating five randomized controlled trials (RCTs), was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Al-Inany H, Youssef G, Abd ElMaguid A, Abdel Hamid M, Naguib A. Value of
subcutaneous drainage system in obese females undergoing cesarean section using
pfannenstiel incision. Gynecol Obstet Invest. 2002;53(2):75-8 - Alanis MC, Villers MS, Law TL, Steadman EM, Robinson CJ. Complications of
cesarean delivery in the massively obese parturient. Am J Obstet Gynecol. 2010
Sep;203(3):271.e1-7. - Allaire AD, Fisch J, McMahon MJ. Subcutaneous drain vs. suture in obese women
undergoing cesarean delivery. A prospective, randomized trial. J Reprod Med. 2000
Apr;45(4):327-31. - Ayres-de-Campos D. Obesity and the challenges of caesarean delivery:
prevention and management of wound complications. Best Pract Res Clin Obstet
Gynaecol. 2015 Apr;29(3):406-14. doi: 10.1016/j.bpobgyn.2014.08.009. Epub 2014
Oct 16. Review. . - Conner, S. N., Verticchio, J. C., Tuuli, M. G., Odibo, A. O., Macones, G. A., & Cahill, A. G. (2014). Maternal obesity and risk of postcesarean wound complications. American journal of perinatology, 31(04), 299-304.
- Dempsey A, Diamond KA, Bonney EA, Myers JE. Caesarean section: techniques and complications. Obstetrics, Gynaecology and Reproductive Medicine. 2017;27(2):37-43.
- Gates S, Anderson ER. Wound drainage for caesarean section. Cochrane Database
Syst Rev. 2013 Dec 13;(12):CD004549. - Gök, M. A., Kafadar, M. T., & Yeğen, S. F. (2019). Comparison of negative-pressure incision management system in wound dehiscence: A prospective, randomized, observational study. Journal of medicine and life, 12(3), 276.
- Hellums EK, Lin MG, Ramsey PS. Prophylactic subcutaneous drainage for prevention of wound complications after cesarean delivery--a metaanalysis. Am J Obstet Gynecol. 2007;197(3):229-35
- Kajiwara K, Kimura E, Nakano M, Takano H, Okamoto A. Clinical experience of
J-VAC drain for skin closure in the laparotomy of obstetrics and gynecology. J
Obstet Gynaecol Res. 2014 Apr;40(4):1089-97. - Kosins AM, Scholz T, Cetinkaya M, Evans GR. Evidence-based value of
subcutaneous surgical wound drainage: the largest systematic review and
meta-analysis. Plast Reconstr Surg. 2013 Aug;132(2):443-50. - Machado LS. Cesarean section in morbidly obese parturients: practical
implications and complications. N Am J Med Sci. 2012 Jan;4(1):13-8. - NVOG. Zwangerschap bij Obesitas. Nederlandse Vereniging voor Obstetrie en Gynaecologie; 2009 14-1-2020.
- Ramsey PS, White AM, Guinn DA, Lu GC, Ramin SM, Davies JK, Neely CL, Newby C,
Fonseca L, Case AS, Kaslow RA, Kirby RS, Rouse DJ, Hauth JC. Subcutaneous tissue
reapproximation, alone or in combination with drain, in obese women undergoing
cesarean delivery. Obstet Gynecol. 2005 May;105(5 Pt 1):967-73. - Swanson, E. W., Cheng, H. T., Susarla, S. M., Lough, D. M., & Kumar, A. R. (2016). Does negative pressure wound therapy applied to closed incisions following ventral hernia repair prevent wound complications and hernia recurrence? A systematic review and meta-analysis. Plastic Surgery, 24(2), 113-118.
- Thornburg LL, Linder MA, Durie DE, Walker B, Pressman EK, Glantz JC. Risk
factors for wound complications in morbidly obese women undergoing primary
cesarean delivery. J Matern Fetal Neonatal Med. 2012 Sep;25(9):1544-8.
Evidence tabellen
Research question: “What are the beneficial and unfavorable effects of placement of a subcutaneous drain versus no placement of a subcutaneous drain in obese pregnant women that undergo a caesarean section?”
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Gates 2013
|
SR of RCT’s Literature search up to November 2013
A: Al-Inany, 2002 B: Allaire, 2000 C: Kumar, 2004 D: Magann, 2002 E: Ramsey, 2005
Study design: RCT
Setting and Country: Egypt 1999-2000, USA 1995-1997, India 2000-2001, USA 1998-2001,USA 2001-2004
Source of funding and conflicts of interest: - |
Inclusion criteria SR: all published, unpublished and ongoing randomised controlled trials comparing wound drainage with no drainage, or comparing different types of drains in women undergoing a caesarean section.
Exclusion criteria SR: quasi-randomised trials (for example those randomised by date of birth or hospital number) were excluded from the analysis.
In total 10 studies included (5 for obese females subanalysis)
Important patient characteristics at baseline: A: 120 obese patients, BMI >32 B: 76 obese patients, >2cm subcutaneous fat C: 148 obese women, >cm subcutaneous fat D: 590 obese women, >2cm subcutaneous fat E: 280 obese women, BMI>30 and >4cm subcutaneous fat. |
A: subcutaneous suction drain B: subcutaneous suction drain C: subcutaneous suction drain D: subcutaneous suction drain E: Subcutaneous suture plus drain
|
A: no drain B: no drain (with or without closure subcutaneous tissue) C: no drain (with or without closure subcutaneous tissue) D: no drain (with or without closure subcutaneous tissue) E: subcutaneous suture only
|
End-point of follow-up:
A: 5-7 days / 3 weeks B: 7-10 days / retrospective chart review (timing not stated) C: 2 weeks / 6 weeks D: 7-10 days/ follow up not clear E: 7-14 days / 4-6 weeks
For how many participants were no complete outcome data available? (intervention/control) A: 2 women excluded after randomization B: no losses documented C: no missing D: no missing E: 12 follow up missing (intervention group?)
|
Wound infections Defined as two of following characteristics: “drainage of purulent material, erythema, tenderness, induration of fever and if it required opening and drainage or antibiotics” (B+C), or as “any wound with induration and erythema that contained purulent material” (D).
Effect measure: RR [95% CI]: A: - C: 0.74[0.16,3.52] D: 0.95[0.52,1.75] E: -
Pooled effect (fixed effects model): 0.86 [95% CI 0.50 to 1.51] Heterogeneity (I2): 0%
Febrile morbidity Defined as maternal fever measured by a temperature ≥38.0°C on two occasions 12 hours apart (C) and a temperature ≥37.8 8 °C on two occasions 4 hours apart (A).
Effect measure: RR [95% CI]: A: 0.41 [0.14-1.44] B: - C: 0.65 [0.26,1.66] D: -
Pooled effect not given for (only) obese women. However outcomes were not different than in total population women: Pooled effect (fixed effects model): RR 0.87[0.66,1.15] Heterogeneity (I2): 0%
Wound complications Defined as the detection of wound infection, wound separation, seroma or hematoma (A+B+C+D+E), wound disruption/subcutaneous dehiscence (A, C, E) and complications that required the wound to be reopened, evacuated, and/or irrigated and described (D). Effect measure: RR [95% CI]: A: 0.92[0.33,2.57] B: 0.14[0.02,0.96] C: 0.3[0.11,0.79] D: 1.02[0.61,1.7]
Pooled effect not given for (only) obese women. However outcomes were not different than in total population women: Pooled effect (random effects model): RR 0.85[0.55,1.32] Heterogeneity (I2): 57.38% 95% pred. interval: 0.25 to 2.94.
|
Facultative:
“Wound drainage did not appear to reduce the incidence of wound infections, or febrile morbidity when specified for obese women. The results for wound complications were heterogeneous, possibly due to different definitions of “wound complications” in different trials. Outcomes, analysed with a random effects model, showed no effect of wound drainage.
The with of the intervals show the low number of studies and the inconsistency between them. Also due to the low number of studies, the sub analysis among obese women lacked power. Besides this, different surgical techniques among different countries may have increased heterogeneity.
The methodological quality of the studies was moderate or unclear. One study had a large number of post-randomisation exclusions, others gave no information on the randomisation process. Blinding of patients and surgeons/midwives for outcomes was not achieved. The overall quality of the included trials was moderate or unclear.
In conclusion: the existing evidence does not show benefit from wound drainage at a caesarean section in obese women.” |
Table of quality assessment
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Gates, 2013 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
*The risk of bias of Al-Inany (2002), Allaire (2000), Kumar (2004), Magann (2002) and Ramsey) can be found in Gates (2013)
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Alanis 2010 |
Study design: retrospective associative study design |
|
Ayres 2015 |
Study design: narrative review |
|
Dempsey 2017 |
Study design: narrative review |
|
Kajiwara 2014 |
Exclusion criteria PICO: no obese patients |
|
Kosins 2013 |
Exclusion criteria PICO: no caesarean section |
|
Machado 2012 |
Study design: narrative review |
|
Thornburg 2012 |
Study design: retrospective associative study design |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-12-2022
Beoordeeld op geldigheid : 27-12-2022
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Subcutis drain tijdens sectio bij vrouwen met obesitas |
NVOG |
2022 |
2027 |
5 jaar |
NVOG |
Nieuw wetenschappelijk onderzoek, veranderingen in organisatie van zorg |
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor vrouwen met hypertensieve aandoeningen in de zwangerschap.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG, voorzitter stuurgroep
- Dr. S.V. (Steven) Koenen, gynaecoloog, werkzaam in het ETZ, Tilburg, NVOG, lid stuurgroep
- Dr. J.J. (Hans) Duvekot, gynaecoloog, werkzaam in het Erasmus MC, NVOG, lid stuurgroep
- Dr. H.C.J. (Liesbeth), Scheepers, gynaecoloog, werkzaam in het Maastricht Universitair Medisch Centrum +, NVOG
- Msc. D.H. (Robert) Strigter, gynaecoloog, werkzaam in het Deventer Ziekenhuis, NVOG
- Dr. M.D. (Mallory) Woiski, gynaecoloog, werkzaam in het Radboud UMC, NVOG
- Dr. I.M. (Inge) Evers, gynaecoloog-perinatoloog, werkzaam in het Meander Medisch Centrum Amersfoort, NVOG
- Dr. L. (Lia) Wijnberger, gynaecoloog, werkzaam in het Rijnstate Ziekenhuis Arnhem, NVOG
- Dr. I.H. (Ingeborg) Linskens, gynaecoloog, werkzaam in het Amsterdam UMC, locatie AMC, NVOG
- Dr. S. (Sander) Galjaard, gynaecoloog, werkzaam in het Erasmus MC, NVOG
- Dr. R.C. (Rebecca) Painter, gynaecoloog, werkzaam in het Amsterdam Universitair Medisch Centrum, NVOG
- Drs. I.C.M. (Ingrid) Beenakkers, anesthesioloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVA
- Drs. M.L. (Mark) van Zuylen, anesthesioloog in opleiding in het Amsterdam UMC, NVA
- Dr. S. (Sabine) Logtenberg, klinisch verloskundige, werkzaam in OLVG Oost Amsterdam en Academie Verloskunde Amsterdam Groningen, KNOV
- Msc. J. (José) Hollander-Boer, verloskundige (np), werkzaam bij Academie Verloskunde Amsterdam Groningen, KNOV.
- Dr. V.C. (Vera-Christina) Mertens, secretaris Stichting Zelfbewustzwanger
- Msc. J. (Jacobien) Wagemaker, Care4Neo
- I. (Ilse) van Ee, adviseur patiëntenbelang, Patiëntenfederatie Nederland.
- MSc. J.C. (Anne) Mooij, adviseur, Patiëntenfederatie Nederland.
Meelezers
- Leden van de Otterlo- werkgroep (2020-2021)
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.A.C. (Marleen) van Son, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- MSc. Y.J. (Yvonne) Labeur, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bax (voorzitter stuurgroep) |
Gynaecoloog-perinatoloog Amsterdam UMC 0,8 fte |
Gastvrouw Hospice Xenia Leiden (onbetaald), Lid commissie kwaliteitsdocumenten NVOG, Voorzitter 50 modulenproject NVOG, Voorzitter commissie Otterlo NVOG, Penningmeester werkgroep infectieziekten NVOG, Lid kernteam NIPT consortium, Lid werkgroep voorlichting en deskundigheidsbevordering RIVM, Lid werkgroep implementatie scholing RIVM, Lid werkgroep nevenbevindingen NIPT RIVM |
Geen |
Geen |
|
Beenakkers |
Anesthesioloog UMCU/WKZ |
Geen |
Geen |
Geen |
|
Duvekot (lid stuurgroep) |
Gynaecoloog, Erasmus MC (full time) |
Directeur 'medisch advies en expertise bureau Duvekot', Ridderkerk, ZZP'er |
Geen |
Geen |
|
Evers |
Gynaecoloog, Meander Medisch Centrum |
Lid van Ciekwal, Werkgroep multidisciplinaire richtlijn extreme vroeggeboorte, NVOG |
Geen |
Geen |
|
Galjaard |
Gynaecoloog ErasmusMC, Rotterdam |
Associate member Diabetes in Pregnancy Study Group (DPSG, onbezoldigd) |
Geen |
Geen |
|
Hollander-Boer |
Docent verloskunde -> Academie Verloskunde Amsterdam Groningen (AVAG) 0.8 Fte, (Verloskundige -> oproepcontract Verloskundige stadspraktijk Groningen (zelden)), Wijziging oktober 2021: oproepcontract laten beëindigen. |
Geen |
Geen |
Geen |
|
Koenen (lid stuurgroep) |
Gynaecoloog, ETZ , Tilburg |
Incidenteel juridische expertise (betaald) |
Geen |
Geen |
|
Linskens |
Gynaecoloog-perinatoloog Amsterdam UMC |
Geen |
Geen |
Geen |
|
Logtenberg |
Academie Verloskunde Amsterdam Groningen: 3 dagen docent, OLVG Oost Amsterdam 1 dag in de week klinisch verloskundige |
Geen |
Geen |
Geen |
|
Mertens |
Patiëntvertegenwoordiger namens Stichting Zelfbewust zwanger (onbezoldigd) |
Geen |
Geen |
Geen |
|
Mooij |
Adviseur Patiëntenbelang, Patiëntenfederatie Nederland |
Geen |
Geen |
Geen |
|
Painter |
Gynaecoloog, aandachtsgebied maternale ziekte 0,8FTE, Associate Professor (voor de grootte van de aanstelling als gynaecoloog) Amsterdam UMC locatie AMC |
Voorzitter Special Invest group NVOG Zwangerschap en diabetes en obesitas onbetaald, Lid gezondheidsraad commissie Voeding en Zwangerschap vacatiegelden gaan naar mijn werkgever, lid richtlijncommissie Chirurgische behandeling van obesitas (NVVH) onbetaald, lid namens NVOG bij RIVM commissie Hielprikscreening onbetaald, Voorzitter organiserend comité congres ICHG 2019 onbetaald, cluster coördinator regio Noord-Holland NVOG Consortium 2, lid Wetenschapscommissie Pijler Obstetrie NVOG onbetaald, Lid koepel wetenschap namens Pijler Obstetrie |
Principal lnvestigator Leading the Change gefinancierd onderzoek TANGO DM. naar de afkapwaarde voor diabetes gravidarum, Project team lid Zon MW gefinancierd onderzoek SUGARDIP, naar diabetes gravidarum behandeling met orale medicatie versus insuline, Project team Nederlandse Hartstichting WOMB project naar de lange termijn uitkomsten van vrouwen die subfertiel waren en obesitas, Van geen van deze projecten wordt een belang van de financier/sponsor vermoed, Gepubliceerd op het gebied van obesitas en zwangerschap. Deze artikelen zouden genoemd kunnen worden in de richtlijn, Wetenschappelijk adviseur bij patiëntenvereniging stichting ZEHG (hyperemesis gravidarum) |
Geen betrokkenheid als schrijver of meelezer bij modules waarin de eigen artikelen van de werkgroeplid terug zouden kunnen komen in de systematische literatuuranalyse |
|
Scheepers |
Gynaecoloog/perinatoloog, MUMC |
Vicevoorzitter perinatale audit, onbetaald, Wetenschappelijk coördinator regioconsortium Limburg, onbetaald |
Projectleider SIMPLE studies, ontwikkeling keuzehulp vaginaal bevallen na eerdere keizersnede, geen huidige financiële belangen. |
Geen |
|
Stigter |
Waarnemend gynaecoloog vakgroep verloskunde & gynaecologie Deventer Ziekenhuis (0.2 FTE), waarnemend gynaecoloog vakgroep verloskunde & gynaecologie Gelre Ziekenhuizen locatie Apeldoorn (0.7 FTE) |
Lid werkgroep Otterlo tot 01-09-2020, onbetaald |
Geen |
Geen |
|
Van Ee |
Adviseur Patiëntenbelang, Patientenfederatie |
Vrijwilliger Psoriasispatiënten Nederland, - coördinator patiëntenparticipatie en onderzoek en redactie lid centrale redactie, - onbetaalde werkzaamheden (soms vacatiegelden) |
Geen |
Geen |
|
Van Zuylen |
Anesthesioloog i.o. Amsterdam UMC |
Geen |
Geen |
Geen |
|
Wagemaker |
Projectleider PATH in het Maasstad Ziekenhuis Rotterdam 0,55 fte, ZZP Adviseur, trainer, onderzoeker op Family Centered en Single Room Care wisselend aantal uren 0,25 - 0,50 fte |
Vrijwilliger Vereniging van Ouders van Couveusekinderen - ervaringsexpert richtlijnontwikkeling, promotie Kwaliteitskader Kwaliteitscriteria VOC - soms vacatiegelden, Vrijwilliger V&VN kinderverpleegkunde - ondersteuning in projecten, projectadvies op opleiding en bijscholing - soms vacatiegelden |
Geen |
Geen |
|
Wijnberger |
Gynaecoloog, perinatoloog, Rijnstate ziekenhuis Arnhem |
VSV werkgroepen, medisch coördinator, NVOG: Otterlo werkgroep, commissie wetenschap (alles onbetaald) |
Geen |
Geen |
|
Woiski |
Gynaecoloog |
Lid werkgroep Otterlo |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van patiëntvertegenwoordigers van verschillende patiëntverenigingen voor de Invitational conference en afvaardigen van patiëntenverenigingen in de clusterwerkgroep. Het verslag hiervan is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie per module ook ‘Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)’. De conceptrichtlijn wordt tevens ter commentaar voorgelegd aan de betrokken patiëntenverenigingen.
Implementatie
|
Aanbeveling |
Tijdspad voor implementatie: 1-3 jaar of >3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
Alle aanbevelingen van deze module |
<1 jaar |
Geen |
Kennis van richtlijn |
Geen kennis van richtlijn |
Kennis nemen van richtlijn |
NVOG |
|
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor vrouwen met een sectio in de voorgeschiedenis en obesitas in de zwangerschap. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen tijdens de Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaarden zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
|
Database |
Zoektermen |
||||||||||||||||||
|
Embase
|
|
||||||||||||||||||
|
Medline (OVID)
|
1 exp Adipose Tissue/ or exp Subcutaneous Tissue/ or 'subcutaneous space'.ti,ab,kf. or 'subcutaneous dead space'.ti,ab,kf. or 'subcutaneous thickness'.ti,ab,kf. or 'fat thickness'.ti,ab,kf. or 'incision depth*'.ti,ab,kf. or 'wound thickness'.ti,ab,kf. (102469) 2 exp Obesity/ or exp Overweight/ or obesity.ti,ab,kw. or obese.ti,ab,kw. or obesitas.ti,ab,kw. or overweigth.ti,ab,kw. (359429) 3 exp Cesarean Section/ or cesarea*.ti,ab,kw. or caesarea*.ti,ab,kw. or caesarian.ti,ab,kw. or cesarian.ti,ab,kw. or 'c section*'.ti,ab,kw. or cesarotom*.ti,ab,kw. or (abdominal adj3 (deliver* or birth*)).ti,ab,kw. (75954) 4 exp Drainage/ or drain.ti,ab,kw. or drainage.ti,ab,kw. (136122) 5 (1 or 2) and 3 and 4 (39) |

