Ketamine bij (adeno)tonsillectomie
Uitgangsvraag
Wat is de plaats van ketamine bij (adeno)tonsillectomie? (gereviseerd in 2014)
Aanbeveling
Geef een opiaat of ketamine als alternatief of ter aanvulling op de combinatie paracetamol en NSAID.
Overwegingen
De bewijskracht voor het toedienen van zwakwerkende opiaten aan kinderen die een ATE ondergaan is laag. De ervaring is dat opiaten goede pijnstillers zijn die echter als bijwerking ademdepressie en misselijkheid kunnen geven. Een case-report uit Australië vermeldt overlijden als gevolg van ademdepressie door codeïne na ATE (Whittaker et al., 2013). Beiden zijn niet wenselijk na een ATE. Dit is een reden waarom het toedienen van deze medicijnen voorzichtig moet geschieden. De werkgroep is van mening dat opiaten, zeker bij niet geïntubeerde patiënten, geen eerste keus zijn. Als toch opiaten worden gebruikt, dienen dit (zeer) kortwerkende opiaten te zijn. Bij niet geïntubeerde patiënten is ketamine, in lage dosering, een veiliger keus als NSAIDs gecontra-indiceerd zijn.
Onderbouwing
Conclusies / Summary of Findings
|
Heel lage bewijs-kracht (GRADE) |
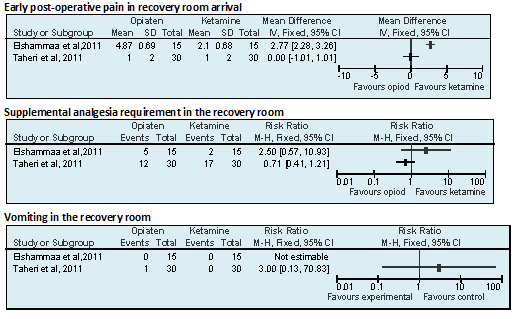
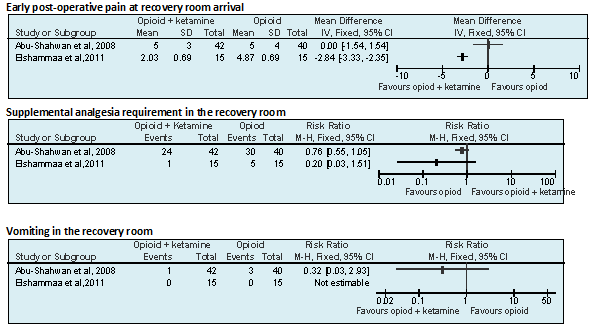
Pijnklachten bij aankomst op de recovery Kinderen die voor een ATE ketamine en opiaten IV toegediend krijgen lijken bij aankomst op de recovery minder pijnklachten te hebben vergeleken met kinderen die vlak voor een ATE alleen opiaten IV toegediend krijgen.
Bron Elshammaa et al, 2011; Abu-Shahwan et al, 2008 |
|
Heel lage bewijs-kracht (GRADE) |
Pijnklachten tijdens verblijf op de recovery Kinderen die voor een ATE ketamine en opiaten IV toegediend krijgen lijken tijdens het verblijf op de recovery minder behoefte aan supplementaire pijnstillers te hebben vergeleken met kinderen die vlak voor een ATE alleen opiaten IV toegediend krijgen.
Bron Elshammaa et al, 2011; Abu-Shahwan et al, 2008 |
|
Heel lage bewijs-kracht (GRADE) |
Braken Er lijkt geen verschil in braken te zijn tussen kinderen die vlak voor een ATE ketamine en opiaten IV toegediend krijgen en kinderen die alleen opiaten toegediend krijgen.
Bron Elshammaa et al, 2011; Abu-Shahwan et al, 2008 |
Samenvatting literatuur
Conclusie richtlijn 2007
Er zijn aanwijzingen dat ketamine effectief is als pijnstilling bij ATE (Aspinall et al, 2001; Da Conceicao et al, 2006).
Nieuwe studies
A. Ketamine versus geen ketamine
Twee recente RCT’s vergeleken het effect van opiaten en ketamine met dat van alleen opiaten (Elshammaa et al, 2011; Abu-Shahwan et al, 2008) bij kinderen van 3 tot 12 jaar, die een tonsillectomie ondergingen. De pijnstillers werden vlak voor de incisie intraveneus toegediend. De twee studies vonden tegenstrijdige resultaten voor de uitkomstmaat pijnklachten bij aankomst op de recovery: MD 0.00; 95% BI -1.54 tot 1.54 (Abu-Shahwan et al, 2008) respectievelijk MD 2.84; 95% BI -3.33 tot -2.35 in het voordeel van de groep opiaten en ketamine (Elshammaa et al, 2011) (zie module “Het beleid rond NSAID bij (adeno)tonsillectomie volgens Sluder” voor forest plot 2). In beide studies was er een trend dat patiënten, die opiaten en ketamine kregen, minder behoefte hadden aan supplementaire pijnstillers tijdens het verblijf op de recovery (zie zojuist genoemde module voor forest plot 2). Patiënten in de groep opiaten en ketamine hadden niet meer last van braken dan patiënten die alleen opiaten kregen (zie module “Het beleid rond NSAID bij (adeno)tonsillectomie volgens Sluder” voor forest plot 2).
Bewijskracht van de literatuur
Voor de uitkomstmaat ‘pijnklachten bij aankomst op de recovery’ is de bewijskracht heel laag gezien de resultaten tegenstrijdig zijn (heterogeniteit) en de studies van geringe omvang zijn (imprecisie). Tevens zijn er grote twijfels over de extrapoleerbaarheid van de resultaten naar de vergelijking ketamine versus geen ketamine (indirectheid).
Voor de uitkomstmaat ‘behoefte aan supplementaire pijnstillers tijdens het verblijf op de recovery’ is de bewijskracht laag omdat de studies van geringe omvang zijn (imprecisie). Tevens zijn er grote twijfels over de extrapoleerbaarheid van de resultaten naar de vergelijking ketamine versus geen ketamine (indirectheid).
Voor de uitkomstmaat ‘braken tijdens het verblijf op de recovery’ is de bewijskracht laag omdat de studies van geringe omvang zijn (imprecisie). Tevens zijn er grote twijfels over de extrapoleerbaarheid van de resultaten naar de vergelijking ketamine versus geen ketamine (indirectheid).
B. Ketamine versus opiaten versus NSAID
Zie module “De plaats van opiaten bij (adeno)tonsillectomie” voor uitgangsvraag over opiaten.
Bewijskracht van de literatuur
Zie module “De plaats van opiaten bij (adeno)tonsillectomie” voor uitgangsvraag over opiaten.
Zoeken en selecteren
Methode literatuuranalyse
Om de uitgangsvraag te kunnen beantwoorden zijn er twee systematische literatuuranalyses verricht naar de volgende vraagstellingen:
A. Wat is het effect van ketamine in de perioperatieve fase op de pijnbeleving (liefst VAS), postoperatieve bloeding, en braken of nausea in de eerste uren na de ingreep in vergelijking tot geen ketamine bij kinderen die een (A)TE ondergaan en voorafgaande aan de ingreep paracetamol krijgen?
B. Wat is het effect van ketamine in de perioperatieve fase op de pijnbeleving (liefst VAS), postoperatieve bloeding, en braken of nausea in de eerste uren na de ingreep in vergelijking tot een ander analgeticum (opiaten, NSAID) bij kinderen die een (A)TE ondergaan en voorafgaande aan de ingreep paracetamol krijgen?
Relevante uitkomstmaten
De werkgroep achtte VAS (visual analoge scale) de eerste 24 uur postoperatief een voor de besluitvorming kritieke uitkomstmaat en nabloedingen een voor de besluitvorming belangrijke uitkomsmaat. Postoperatieve nausea werd als minder belangrijk uitkomstmaat meegenomen.
Zoeken en selecteren van literatuur
Zie voor zoeken en selecteren module "Postoperatve pijnbestrijding".
Referenties
- Abu-Shahwan I. Ketamine does not reduce postoperative morphine consumption after tonsillectomy in children. Clin J Pain 2008;24(5):395-8
- Antilla H, Manner T, Kuurila K, et al. Ketoprofen and tramadol for analgesia during early recovery after tonsillectomy in children. Paediatr Anaesth 2006;16:548-53.
- Aspinall RL, Major A. A prospective randomised controlled study of the efficacy of ketamine for postoperative pain relief. Paediatr Anaesth 2001;11:333-6.
- Cardwell M, Siviter G, Smith A. Non-steroidal anti-inflammatory drugs and perioperative bleeding in paediatric tonsillectomy (review). Cochrane Database Syst Rev 2005;CD003591.
- Cardwell M, Siviter G, Smith A. Non-steroidal anti-inflammatory drugs and perioperative bleeding in paediatric tonsillectomy. Clin J Pain 2008;24(5):395-8.
- Da Conceicao MJ, Bruggeman Da Conceicao D, Carneiro Leao C. Effect of intravenous single dose of ketamine on postoperative pain in tonsillectomy patients. Paediatr Anaesth 2006;16:962-7.
- Elshammaa N, Chidambaran V, Housny W, et al. Ketamine as an adjunct to fentanyl improves postoperative analgesia and hastens discharge in children following tonsillectomy - A prospective, double-blinded, randomized study. Paediatr Anaesth 2011;21(10):1009-14.
- Isik B, Arslan M, Ozsoylar O, et al. Effects of preoperative lornoxicam versus tramadol on postoperative pain and adverse effects in adult tonsillectomy patients. Agri Dergisi 2009;21(3):113-20.
- Kokki H. Ketoprofen pharmacokinetics, efficacy, and tolerability in pediatric patients. [Review]. Paediatr Drugs 2010;12(5):313-29.
- Krishna S, Hughes LF, Lin SY. Postoperative hemorrhage with nonsteroidal anti-inflammatory drug use after tonsillectomy: a meta-analysis. Arch Otolaryngol Head Neck Surg 2003;129:1086-9.
- Marret E, Flahault A, Samama CM, et al. Effect of postoperative nonsteroidal anti-inflammatory drugs on bleeding risk after tonsillectomy. Meta-analysis of randomised controlled trials. Anesthesiology 2003;98:1497-1502.
- Moiniche S, Romsing J, Dahl JB, et al. Nonsteroidal anti-inflammatory drugs and the risk of operative site bleeding after tonsillectomy: a quantative systematic review. Anesth Analg 2003;96:68-77.
- Mowafi HA, Ismail SA. Preoperative peritonsillar lornoxicam infiltration is not superior to intravenous lornoxicam for pain relief following tonsillectomy in adults. Eur J Anaesthesiol 2010;27(9):807-11.
- Oksuz H, Seneglu N, Dogan Z. Comparison of the efficacies of ketamine and fentanyl on prevention of early post-operative pain after tonsillectomy. Erciyes Tip Derg 2009;31(1):027-30.
- Ozalevli M, Unlugenc H, Tuncer U, et al. Comparison of morphine and tramadol by patientcontrolled analgesia after tonsillectomy in children. Paediatr Anaesth 2005;15:979-84.
- Romsing J, Ostergaard D, Drozdziewicz D, et al. Diclofenac or acetaminophen for analgesia in paediatric tonsillectomy outpatients. Acta Anaesthesiol Scand 2000;44:291295.
- Taheri R, Seyedhejazi M, Ghojazadeh M, et al. Comparison of ketamine and fentanyl for postoperative pain relief in children following adenotonsillectomy. Pak J Biol Sci 2011;14(10):572-7.
- White MC, Nolan JA. An evaluation of pain and postoperative nausea and vomiting following introduction of guidelines for tonsillectomy. Paediatr Anaesth 2005;15:683-8.
- Whittaker MR. Opioid use and the risk of respiratory depression and death in the pediatric population. J Pediatr Pharmacol Ther. 2013;18(4):269-76.
Evidence tabellen
Evidencetabellen
Table Assessment of trial quality
|
Study |
Concealment of allocation |
Blinding patients |
Blinding care provider |
Blinding outcome assessor |
Drop-out rate described and acceptable |
Analysis by intention-to-treat |
|
Abu-Shahwan et al, 2008 |
unclear (computer-generated random number table) |
unclear (authors state that the study is double blind) |
unclear (authors state that the study is double blind) |
adequate (independent observer) |
2%
No arguments for selective loss to follow-up |
no
No arguments for bias |
|
Elshammaa et al, 2011 |
adequate |
adequate |
adequate |
adequate |
It seems that no child was lost, but not explicitly stated |
yes |
|
Oksuz et al, 2009 |
unclear (method of randomization was not reported) |
unclear |
adequate? (another anesthesiologist who was not involved in the study) |
adequate? (another anesthesiologist who was not involved in the study) |
It seems that no child was lost, but not explicitly stated |
yes |
|
Taheri et al, 2011 |
Unclear (computer-generated random number table) |
unclear (authors state that the study is double blind) |
adequate? (another anesthesiologist who was not involved in the study) |
adequate? (another anesthesiologist who was not involved in the study) |
No dropouts |
yes |
Table Study populations, interventions and outcome definitions (controlled trial)
|
Study |
Design |
Setting |
Treatment (T) and control group (C) |
Outcomes |
Remarks |
|
Abu-Shahwan et al, 2008 |
RCT |
84 children between 2 and 12 years old undergoing elective outpatient tonsillectomy |
T*: morphine (0.1 mg/kg; IV) and ketamine (0.25 mg/kg; IV) C*: morphine (0.1 mg/kg; IV)
* at induction |
Post-operative pain on PACU arrival Measured by modified Children’s Hospital of Eastern Ontario Pain Score (mCHEOPS) (1-10; 1 minimal pain, 10 maximal pain). T (42): 5 ± 3 C (40): 5 ± 4 P >0.05
Supplemental analgesia requirement at PACU Children with a pain score >6 were treated with morphine. T: 24 / 42 C: 30 / 40
Incidence of vomiting at PACU T: 1 / 42 C: 3 / 40
Supplemental analgesia requirement at day care surgical unit (DSCU) Children with a pain score >6 were treated with acetaminophen or oral codeine. T: 19 / 42 C: 32 / 40 p <0.05
Incidence of vomiting at DSCU T: 7 / 42 C: 9 / 40 |
All patients received oral acetaminophen (30 mg/kg) 30 minutes before the start of surgery.
All patients were intubated endotracheal.
Tonsillectomy was performed by dissection and diathermy.
All children received anti-emetica (dexamethasone and ondansetron).
Authors conclusion: Ketamine at induction of anesthesia did not decrease postoperative morphine consumption in children undergoing tonsillectomy. |
|
Elshammaa et al, 2011 |
RCT |
Children between 2 and 7 years old undergoing tonsillectomy; ASA I and II
|
T1 (15)*: fentanyl 1 mcg/kg (F1 group) (IV?)
T2 (15)*: ketamine 0.5 mg/kg (K-group) (IV?)
T3 (15)*: fentanyl 1 mcg/kg plus ketamine 0.5 mg/kg (FK-group) (IV?)
*pre-incision
|
Post-operative pain on PACU arrival (early-postoperative pain) Measured by pediatric behavioral FLACC pain scale on arrival at PACU and at 30, 60 and 90 min thereafter. T1: 4.87 ± 0.69 T2: 2.10 ± 0.68 T3: 2.03 ± 0.69 p (T1 vs T2; adjusted for surgical time) = 0.02; p (T1 vs T3; adjusted for surgical time) = 0.0048
Supplemental analgesia at PACU Any child with a pain score >5 received supplemental analgesia and that child was excluded from further analysis of pain scores T1: 5/15 T2: 2/15 T3: 1/15 p>0.05 (not significant)
Incidence of vomiting at PACU T1: 0/15 T2: 0/15 T3: 0/15 |
No patient was premedicated.
All patients were intubated endotracheal.
Method of tonsillectomy was not reported.
All children received anti-emetica (dexamethasone and ondansetron).
|
|
Oksuz et al, 2009 |
RCT |
40 children between 3 and 10 years old undergoing elective tonsillectomy; ASA I and II |
T*: fentanyl 1 mcg/kg intramuscular (I.M.) C*: ketamine 0.5 mg/kg I.M.
* before the surgical procedure began |
Early post-operative pain Measured by the Wong-Baker FACES Pain Rating Scala (1-5; 0 no pain, 5 maximal pain)
a) after 30 minutes T: 1.80 ± 0.62 C: 2.00 ± 0.65 P = 0.461
b) after 60 minutes T: 2.05 ± 0.69 C: 2.35 ± 0.59 P = 0.211
c) after 120 minutes T: 3.25 ± 0.72 C: 3.20 ± 0.69
d) after 240 minutes T: 3.95 ± 0.83 C: 4.05 ± 0.76 |
No patient was premedicated.
All patients were intubated endotracheal.
Method of tonsillectomy was not reported.
Authors concluded that ketamine IM and fentanyl IM had similar analgesic potency whilst ketamine caused prolonged sedation and side effects (hallucination 6/20; agitation 8/20; increased secretion 11/20). |
|
Taheri et al, 2011 |
RCT |
Children between 3 and 12 years old undergoing adenotonsillectomy; ASA I and II
|
T1 (30)*: fentanyl 1 mcg/kg (IV)
T2 (30)*: ketamine 0.5 mg/kg (IV)
*before induction |
Early post-operative pain Measured by modified Hannallah pain scale or Observational Pain Scores (OPS). Any child with a OPS >4 or continuous crying for a 5 min period received supplemental analgesia a) Mean (SD) OPS in the recovery room on arrival T1: 1 (2) P= 0.96
b) Mean (SD) OPS in the recovery room after 15 min T1: 3.53 ± 2.16 T2: 4.47 ± 2.21 P=0.21
Supplemental analgesia requirement at the recovery room T1: 12/30 T2: 17/30 P=0.47
Nausea and vomiting in the first 15 minutes T1: 1/30 T2: 0/30
Reoperation for bleeding T1: 0/30 T2: 0/30
Post-anesthesia recovery score at 15th min Measured by Aldrete score T1: 3 (0) T2: 1 (2) P=0.56 |
All patients received midazolam as premedication 5 min before induction.
All patients received dexamethasone before induction.
All patients were intubated endotracheal.
Method of tonsillectomy was the dissection and snare technique.
|
Forest plots 1
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-01-2014
Uiterlijk in 2018 bepaalt het bestuur van de NVKNO of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten.
De NVKNO is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
IN SAMENWERKING MET
in 2012 tot en met 2014
Nederlandse Vereniging voor Anesthesiologie
in 2007
Artsen Jeugdgezondheidszorg Nederland
Nederlands Huisartsen Genootschap
Nederlandse Vereniging voor Anesthesiologie
Nederlandse Vereniging voor Kindergeneeskunde
Nederlandse Vereniging voor Medische Microbiologie
Vereniging Kind en Ziekenhuis
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kims.orde.nl) en werd gefinancierd uit [de Kwaliteitsgelden Medisch Specialisten (SKMS) of andere bron].
Doel en doelgroep
Doel van de richtlijn
De herziening van de richtlijn moet heldere en eenduidige criteria opleveren voor indicatiestelling tot wel of niet operatief ingrijpen en de methode van chirurgie en anesthesie en zo een ondersteuning zijn van de dagelijkse praktijk. Tevens kan de herziene richtlijn gebruikt worden bij voorlichting aan (ouders van) patiënten en in de onderhandelingen met zorgverzekeraars.
Doelgroep
Deze richtlijn is bedoeld voor alle zorgverleners die betrokken zijn bij de behandeling van patiënten met aandoeningen van adenoïd en tonsillen die zich in de tweede lijn hebben gemeld: KNO-artsen, anesthesiologen, kinderartsen, apothekers, medisch microbiologen en verpleegkundigen. Daarnaast heeft deze richtlijn ook consequenties voor de eerste lijn; huisartsen en jeugdartsen.
Samenstelling werkgroep
Voor de beperkte revisie van de richtlijn uit 2007 is in 2012 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alleen die specialismen die inhoudelijk direct gerelateerd zijn aan de te reviseren uitgangsvragen (zie hiervoor de samenstelling van de werkgroep). De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
In 2012 tot en met 2014 hebben de volgende personen deelgenomen aan het updaten en reviseren van de richtlijn:
Werkgroep:
- Dr H.J. Rosingh (voorzitter), KNO-arts, Isala, Zwolle
- Mw Dr C.W.B. Boonacker, epidemioloog, UMC Utrecht
- Dr R.J.H. Ensink, KNO-arts, Gelre Ziekenhuizen, Zutphen
- Drs B. Pullens, KNO-arts, Erasmus MC, Rotterdam
- Mw Drs J.E.M. Samson-Vernooij, anesthesioloog, Rijnstate ziekenhuis, Arnhem
- Mw Dr J.Th. Schmidt, KNO-arts, Ziekenhuis Amstelland, Amstelveen
- Mw Dr E.H. van den Akker, KNO-arts, Meander Medisch Centrum, Amersfoort
- Mw Dr M.C.O. van den Nieuwenhuyzen, anesthesioloog, Ikazia ziekenhuis, Rotterdam
- Drs H.J.A. Visser, KNO-arts, LangeLand Ziekenhuis, Zoetermeer
Meelezers:
- Dr L. Bont, kinderarts infectioloog-immunoloog, Universitair Medisch Centrum Utrecht
- Dr N.J. Smeulers, amesthesioloog, Franciscus Ziekenhuis, Roosendaal
- Dr D.B.M. van der Werff, kinderanesthesioloog, Wilhelmina Kinderziekenhuis, Utrecht
- Mw Dr B.K. van Staaij, huisarts, Amersfoort
Met ondersteuning van:
- Mw B.S. Niël-Weise, arts-microbioloog (n.p.), senior adviseur, Kennisinstituut van Medisch Specialisten
In 2007 hebben de volgende personen deelgenomen aan de ontwikkeling van de richtlijn:
Kernredactie
- Dr H.P. Verschuur, KNO-arts, Medisch Centrum Haaglanden, Den Haag
- Mw Dr E.H. van den Akker, KNO-arts, Meander Medisch Centrum, Amersfoort
- Mw Dr C.J.I. Raats, adviseur, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
- Mw Drs C.J.G.M. Rosenbrand, senior-adviseur, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
Werkgroep:
- Dr G.J. van Asselt, arts-microbioloog, Medisch Centrum Haaglanden, Den Haag
- Mw M.E.A. van Bergen-Rodts, directeur, Vereniging Kind en Ziekenhuis, Dordrecht
- Mw Drs L.W. Boland, arts jeugdgezondheidszorg, GGD Amstelland-de Meerlanden, Amstelveen
- Dr L. Bont, kinderarts infectioloog-immunoloog, Universitair Medisch Centrum Utrecht
- Dr G.W. van Deelen, KNO-arts, Onze Lieve Vrouwe Gasthuis, Amsterdam
- Dr R.J.H. Ensink, KNO-arts, Gelre Ziekenhuizen, Zutphen
- Drs J.P.C.M. van der Hulst, kinderarts, Zaans Medisch Centrum, Zaandam
- Dr F.W. van der Meulen, KNO-arts, Academisch Medisch Centrum, Universiteit van Amsterdam
- Dr H.J. Rosingh, KNO-arts, Isala, Zwolle
- Drs J.G.H.M. Schlooz, anesthesioloog, VieCuri Medisch Centrum voor Noord-Limburg, Venlo
- Mw Dr E. Sjögren, KNO-arts, Leids Universitair Medisch Centrum, Leiden
- Mw Dr B.K. van Staaij, huisarts, Amersfoort
- Dr E.J.J.M. Theunissen, KNO-arts, VieCuri Medisch Centrum voor Noord-Limburg, Venlo
- Mw Dr M. Wagenaar, KNO-arts, Medisch Centrum Leeuwarden
- Mw Drs D.B.M. van der Werff, anesthesioloog, Universitair Medisch Centrum, Locatie Wilhelmina Kinderziekenhuis, Utrecht
Klankbordgroep:
Nederlandse Vereniging voor Anesthesiologie
- Prof. Dr H.E.M. Kerkkamp
- Mw Dr A.W.M.M. Koopman-van Gemert
- Mw Dr R. Nijholt
Artsen Jeugdgezondheidszorg Nederland
- Mw Dr E. Anten
- Mw Drs B. Carmiggelt
- Mw Drs N. Leeuwenburg
- Mw Dr C. Scheenstra
Nederlandse Vereniging voor KNO-kunde en Heelkunde van het Hoofd-Halsgebied
- Dr P.P.G. van Benthem
- Mw Drs E.M. Bolhuis
- Drs J.A.M. Engel
- Dr L.J. Hoeve
- Dr F.J.A. van den Hoogen
- Drs J.M. Kruijt
- Dr H.F. Nijdam
- Dr M.G.A.C.C. Tilanus
Nederlandse Vereniging voor Kindergeneeskunde
- Drs P.F. Eskes
- Dr N. van der Lelij
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Een overzicht van deze belangenverklaringen ligt ter inzage bij het Kennisinstituut van Medisch Specialisten (KiMS).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn is alleen beschikbaar in een digitale versie en is verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Ook is de richtlijn te downloaden vanaf de website van de Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied (www.kno.nl) en via de website van de Kwaliteitskoepel (www.kwaliteitskoepel.nl).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen in het rapport ‘Richtlijnen 2.0’ van de adviescommissie Richtlijnen van de Raad WOK. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; www.agreecollaboration.org). Dit is een internationaal breed geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter en de adviseur van de werkgroep de knelpunten en stelden zij concept uitgangsvragen op. Dit concept werd met de werkgroep besproken en vervolgens per mail aan de volgende organisaties voorgelegd met de vraag om input: Zorgverzekeraars Nederland (ZN); Nederlandse Zorgautoriteit (NZA); College voor Zorgverzekeringen (CvZ); Inspectie voor de Gezondheidszorg (IGZ); Achmea; CZ; Menzis; VGZ en de Patiëntenvereniging ‘Kind en Ziekenhuis’.
Uitgangsvragen en uitkomstmaten
De werkgroep stelde de definitieve uitgangsvragen vast. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in elektronische databases (zie paragraaf ‘zoeken en selecteren van literatuur’ van de individuele modules). Voor uitgangsvragen uit de ZATT-richtlijn 2007, die gereviseerd werden, werd de search beperkt tot de afgelopen vijf jaar, i.e. van 2007 tot 2013. Voor nieuwe uitgangsvragen werd geen beperking in publicatiedatum toegepast. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van op voorhand opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de kolom ‘Beoordeling kwaliteit studie’ van een evidencetabel.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
Bij gereviseerde interventievragen werd de kracht van het wetenschappelijke bewijs bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004). Bij niet gereviseerde interventievragen is het niveau van de bewijskracht beoordeeld met de gebruikelijke EBRO-methode.
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
Formuleren van de conclusies
Bij interventievragen verwijst de conclusie niet naar een of meer individuele artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiënten voorkeur, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
