Behandeling van depressie bij de ziekte van Parkinson
Uitgangsvraag
Hoe kan depressie het beste worden behandeld bij patiënten met de ziekte van Parkinson (ziekte van Parkinson)?
De uitgangsvraag omvat de volgende onderwerpen:
- Niet-medicamenteuze behandeling
- Medicamenteuze behandeling
Aanbeveling
Vraag altijd naar suïcidaliteit indien er sprake is van depressieve klachten.
Geef psycho-educatie over depressieve klachten aan de betreffende patiënt en diens naasten of mantelzorgers (uitleg over symptomen, oorzaken en bijdragende factoren, behandelmogelijkheden en beloop), indien er sprake is van depressieve klachten.
Onderzoek of aanpassing van de dopaminerge medicatie de responsfluctuaties kan verminderen, indien er sprake is van depressieve klachten tijdens ‘wearing off’ of tijdens ‘off’-fasen.
Overweeg de patiënt te verwijzen voor cognitieve gedragstherapie (mits cognitie redelijk intact is) door een behandelaar, bij voorkeur met expertise op het terrein van bewegingsstoornissen, indien er sprake is van een lichte tot matig ernstige depressieve stoornis.
Overweeg behandeling met een SSRI of een TCA, afhankelijk van het symptoom- en bijwerkingsprofiel, indien er sprake is van ernstige depressieve klachten, of als cognitieve gedragstherapie niet helpt.
Schrijf als behandeling van depressieve klachten bij voorkeur niet méér dopaminerge medicatie voor dan nodig om de motorische klachten te behandelen, om daarmee complicaties op korte en lange termijn te voorkomen (zoals psychoses, hallucinaties, impulscontrolestoornissen).
* Zie ook de multidisciplinaire richtlijn Depressie.
Verwijs naar een psychiater indien er sprake is van een ernstige depressie, suïcidaliteit, psychotische/katakone kenmerken, ernstige somatische klachten of indien de patiënt niet reageert op een SSRI en een TCA. De psychiater zal dan ECT of rTMS moeten overwegen.
Overwegingen
Sinds het verschijnen van de vorige richtlijn is er meer aandacht gekomen voor de behandeling van depressieve klachten bij parkinsonpatiënten. Ondanks het feit dat er een redelijk aantal onderzoeken gepubliceerd is en er een aantal systematische reviews en meta-analysen verricht is, blijft de bewijskracht van al deze onderzoeken laag tot zeer laag. Dit heeft meerdere redenen.
Onderzoek naar psychotherapeutische behandelingen is beperkt tot cognitieve gedragstherapie (CGT). CGT lijkt een positief effect op de depressieve klachten te hebben, maar de onderzoeken bevatten weinig deelnemers, de methodes verschillen sterk tussen de verschillende onderzoeken en bij patiënten is er vaak sprake van comorbide angstklachten, waardoor het onduidelijk is of de verbetering primair te maken heeft met verbetering in stemming, in angstklachten of beide. Tenslotte lijkt het aannemelijk dat er na afsluiting van de therapie boostersessies nodig zijn om het effect te behouden. Dergelijke sessies ontbreken in het huidige onderzoek en ook is er geen lange-termijn follow-up, waardoor het onduidelijk is of verbetering ook standhoudt. Om die reden is de bewijskracht van deze onderzoeken laag.
rTMS is mogelijk effectief in de behandeling van depressieve klachten bij patiënten met de ziekte van Parkinson. Langetermijnbehandelresultaten ontbreken ook hier.
Gesuperviseerde inspanningstraining was niet superieur aan individuele inspanningstraining. Beide trainingen hadden een positief effect op depressieve klachten, maar omdat er geen controleconditie werd meegenomen waarin niet werd gesport, kunnen geen conclusies worden gedaan over de effectiviteit van inspanningstraining op depressieve klachten.
Onderzoek naar elektroconvulsietherapie (ECT) als behandeling van depressieve klachten bij de ziekte van Parkinson is niet voorhanden. Een systematische review van gepubliceerde case-series en ziektegevallen concludeert dat ECT voor depressieve klachten bij parkinsonpatiënten een effectieve behandeling kan zijn met vaak tevens een positief effect op de motorische verschijnselen (Borisovskaya, 2016). Dit wordt ook gesteund door later gepubliceerde case-series (bijvoorbeeld Williams, 2017). Echter, case histories en case series zijn vaak onderhavig aan publicatiebias.
Een andere interventie die niet terugkwam uit onze literatuuranalyse is lichttherapie. Na de zoekdatum is er een dubbelblinde RCT gepubliceerd waarin lichttherapie werd vergeleken met controle licht (Rutten, 2019). Beide condities gingen gepaard met strakke dag-nachtregulatie. In zowel de groep met lichttherapie als in de groep met controle licht werden depressieve klachten significant minder, maar zonder een significant verschil tussen de twee groepen. Deze resultaten zijn onvoldoende om lichttherapie op te nemen in de richtlijnaanbevelingen.
Hoewel er in de afgelopen jaren meer onderzoek naar medicamenteuze behandeling is gedaan, is dit vaak gedaan met weinig patiënten. Een bijkomend probleem bij placebogecontroleerde medicatiestudies is de vaak hoge placeborespons, die maakt dat de uitkomstverschillen tussen de behandelcondities vaak klein zijn, ondanks de goede respons binnen de respectievelijke groepen. Ook als het verschil in uitkomst van actieve behandeling met placebo wel statistische significant is, zoals bijvoorbeeld bij de studie met pramipexol van Barone (2010) is dit verschil vaak klein en niet klinisch relevant. De hoge placeborespons heeft als gevolg dat er weinig effect wordt gemeten van de actieve medicatie.
Ondanks de tekortkomingen van gepubliceerde onderzoeken lijkt er enig bewijs te zijn voor behandeling met een TCA. Voor SSRI's is er conflicterend bewijs: in twee meta-analyses wordt geen grotere effectiviteit dan placebo beschreven, in 1 meta-analyse wel. Daarnaast laten twee andere meta-analyses en een studie geen verschil in effectiviteit zien met een TCA, een middel dat wel bewezen effect heeft. Daarnaast is er ook enig bewijs voor behandeling met de dopamine-agonist pramipexol en met de MAO-B remmer rasagiline. Het is echter de vraag of behandeling van depressieve klachten met een dopamine-agonist of MAO-B remmer wel wenselijk is bij parkinsonpatiënten die motorisch optimaal zijn ingesteld, omdat beide middelen primair gebruikt worden om de motorische klachten van de ziekte van Parkinson te behandelen. Indien patiënten motorisch goed zijn ingesteld, kan toevoegen of verder ophogen van een dopamine-agonist leiden tot agitatie, angst, impulscontrolestoornissen, slaapstoornissen, hallucinaties en dyskinesieën. Toevoegen van een MAO-B remmer aan levodopa doet ook de kans op dyskinesieën toenemen. Deze middelen hebben derhalve niet de voorkeur wat betreft de medicamenteuze behandeling van depressieve klachten in deze populatie.
In de richtlijn voor behandeling van depressieve stoornissen bij niet-parkinsonpatiënten worden lithium en klassieke (niet-specifieke en irreversibele) MAO-remmers als onderdeel van het behandelalgoritme genoemd. Met lithium is relatief weinig ervaring bij parkinsonpatiënten. Vanwege de mogelijkheid op verergering van de tremor, risico op ernstige (toxische) bijwerkingen en andere extrapiramidale symptomen is voorzichtigheid geboden. Wanneer voor een behandeling met lithium gekozen wordt is monitoring van lithiumspiegel aanbevolen. Klassieke MAO-remmers, zoals tranylcypromine en fenelzine, remmen zowel MAO-A als MAO-B op een irreversibele manier. Naast het feit dat patiënten hierbij een tyramine-beperkt dieet moeten volgen, kan de combinatie met levodopa tot een hypertensieve crisis leiden en is het valrisico vanwege de grote kans op orthostatische hypotensie verhoogd. Om deze reden zijn klassieke MAO-remmers gecontra-indiceerd als behandeling van depressieve klachten bij de ziekte van Parkinson.
Depressieve stoornissen hebben een grote impact op het dagelijks functioneren van de patiënt en de kwaliteit van leven van patiënt en omgeving. Gezien het feit dat de bewijskracht van zowel niet-medicamenteuze behandelingen als medicamenteuze behandelingen laag is, zullen de aanbeveling in deze module naast het voorhanden zijnde bewijs, ook gebaseerd zijn op de richtlijn voor de behandeling van depressieve stoornissen in de algemene bevolking, als op ervaring van de experts. Als medicamenteuze behandeling kunnen zowel een TCA of een SSRI overwogen worden. Vanwege het beperkte bewijs kan geen duidelijk advies gegeven worden over welke klasse de voorkeur heeft. Het symptoomprofiel van de klachten en het bijwerkingprofiel van het middel zal hier helpen bij de afwegingen. Een SSRI heeft vanwege de serotonerge werking mogelijk de voorkeur indien er tevens sprake is van angstklachten en minder de voorkeur indien er sprake is van gastro-intestinale klachten. Hierbij hebben langwerkende SSRIs (met name fluoxetine) niet de voorkeur, omdat in het geval van toename van extrapiramidale symptomen het langer duurt voordat deze over zijn dan bij gebruik van een korterwerkende SSRI. Een TCA zal vanwege de anticholinerge bijwerkingen (met name amitriptyline) naar verwachting geen effect op de tremor hebben, maar mogelijk wel meer cognitieve bijwerkingen dan een SSRI. Daar wordt geadviseerd om in elk geval in de tweede lijn een TCA onder spiegelcontrole in te stellen.
Onderbouwing
Achtergrond
Het klinische spectrum van de ziekte van Parkinson omvat niet alleen motorische symptomen maar ook een groot scala aan niet-motorische stoornissen. Deze niet-motorische stoornissen kunnen van grote invloed zijn op de kwaliteit van leven. Een belangrijk onderdeel van de niet-motorische stoornissen vormen de psychische stoornissen, waaronder depressie. 35% van de parkinsonpatiënten heeft klinisch relevante depressieve klachten (gemeten met een cut-off score van een depressieschaal) en 17% voldoet aan de DSM-IV criteria voor ‘depressieve stoornis’ en 13% aan de criteria voor ‘dysthymie’ ofwel ‘persisterende depressieve stoornis’ (Reijnders, 2010). Depressieve klachten kunnen daarnaast ook voorkomen bij motorische responsfluctuaties, bijvoorbeeld bij het uitwerken van de dopaminerge medicatie (‘wearing off’) of tijdens off perioden. Depressieve stoornissen hebben niet alleen een negatieve impact op motorische symptomen en ADL functies, maar ook op cognitieve prestaties en kwaliteit van leven. Daarnaast heeft het ook een negatieve invloed op de kwaliteit van leven van de partner of mantelzorger (Leentjens, 2012)
Herkenning depressie
|
De diagnose van ‘depressieve stoornis’ wordt doorgaans gesteld aan de hand van de DSM 5 criteria. Deze vereisen dat er tenminste twee weken lang vrijwel elke dag de hele dag sprake is van ofwel somberheid, ofwel van anhedonie (het onvermogen om plezier ergens aan te beleven) of interesseverlies. Daarnaast moeten nog een aantal lichamelijke en cognitieve klachten voorkomen. Lichamelijk klachten kunnen zijn: verminderde eetlust en gewichtsverlies, moeheid, energieverlies, slaapstoornissen, motorische onrust of juist (extra) remming; cognitieve klachten zijn verminderde aandacht en concentratie, piekeren en doodsgedachten. Bij de beoordeling van depressieve klachten dient altijd gevraagd te worden naar suïcidale intenties en eventuele stemmingscongruente wanen. Soms wordt ook gesproken van een ‘persisterende depressieve stoornis’ (voorheen dysthymie genoemd) die gekenmerkt wordt door lichtere, meer chronische depressieve klachten. De belangrijkste differentiaal-diagnostische overweging is ‘apathie’. Mensen met apathie voelen zich doorgaans niet somber en kunnen wel plezier aan zaken beleven, al ziet men dat niet aan hen. Differentiëren van depressie en apathie kan eenvoudig gebeuren door te vragen naar somberheid en anhedonie (bijvoorbeeld met de vraag: ‘Kunt u nog plezier beleven aan bepaalde activiteiten?’). |
Conclusies / Summary of Findings
Depressieve klachten
|
Laag GRADE |
Cognitieve gedragstherapie heeft mogelijk een positief effect op depressieve klachten bij patiënten met de ziekte van Parkinson.
Bronnen: (Calleo, 2015; Troeung, 2014; Dobkin, 2011; Veazey, 2009) |
|
Laag GRADE |
rTMS lijkt effectief te zijn in vergelijking met sham-rTMS bij depressieve klachten bij patiënten met de ziekte van Parkinson
Bronnen: (Wang, 2018) |
|
Laag GRADE |
Er is mogelijk geen verschil in effect tussen behandeling met rTMS en een SSRI op het verminderen van depressieve klachten bij patiënten met de ziekte van Parkinson.
Bronnen: (Wang, 2018) |
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil in effect is tussen gesuperviseerde- en niet-gesuperviseerde inspanningstraining op het verminderen van depressieve klachten bij patiënten met de ziekte van Parkinson.
Bronnen: (Sajatovic, 2017) |
|
Redelijk GRADE |
Behandeling met tricyclische antidepressiva (TCA’s), vergeleken met placebo, leidt waarschijnlijk tot een vermindering van depressieve symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Liu, 2013; Troeung, 2013) |
|
Laag GRADE |
Behandeling met SSRI’s, vergeleken met placebo, leidt mogelijk niet tot een vermindering van depressieve symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Liu, 2013; Troeung, 2013; Mills, 2018) |
|
Laag GRADE |
Behandeling met een SNRI, vergeleken met placebo, leidt mogelijk niet tot een vermindering van depressieve symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Liu, 2013) |
|
Zeer laag GRADE |
Het is onduidelijk of behandeling met rasagiline effect heeft op depressieve symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Barone, 2015) |
|
Laag GRADE |
Behandeling met een dopamine-agonist (pramipexol of rotigotine), vergeleken met placebo, leidt mogelijk tot een vermindering van depressieve symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Barone, 2010; Chung, 2016) |
|
Laag GRADE |
Behandeling met een SSRI verschilt mogelijk niet van een TCA in de vermindering van depressieve symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Liu, 2013; Qiu, 2014) |
|
Laag GRADE |
Behandeling met een SSRI verschilt mogelijk niet van een SNRI in de vermindering van depressieve symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Richard, 2012; Takahashi, 2018) |
Kwaliteit van leven
|
Zeer laag GRADE |
Het is onduidelijk of cognitieve gedragstherapie effect heeft op de kwaliteit van leven bij patiënten met de ziekte van Parkinson met depressieve - en/of angstklachten.
Bronnen: (Troeung, 2014; Dobkin, 2011; Veazey, 2009) |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van rTMS op de kwaliteit van leven bij patiënten met de ziekte van Parkinson met depressieve klachten.
Bronnen: (Makkos, 2016; Brys, 2016) |
|
Laag GRADE |
Behandeling met een TCA, vergeleken met placebo, leidt mogelijk niet tot een verbetering in kwaliteit van leven bij patiënten met de ziekte van Parkinson met depressieve klachten.
Bronnen: (Menza, 2009) |
|
Laag GRADE |
Behandeling met een SSRI, vergeleken met placebo, leidt mogelijk niet tot een verbetering van kwaliteit van leven bij patiënten met de ziekte van Parkinson met depressieve klachten.
Bronnen: (Menza, 2009) |
|
Zeer laag GRADE |
Het is onduidelijk of behandeling met rasagiline, vergeleken met placebo, leidt tot een verschil in kwaliteit van leven bij patiënten met de ziekte van Parkinson met depressieve klachten.
Bronnen: (Barone, 2015) |
|
Laag GRADE |
Behandeling met SSRI, vergeleken met een TCA, leidt mogelijk niet tot een verschil in kwaliteit van leven bij patiënten met de ziekte van Parkinson met depressieve klachten.
Bronnen: (Antonini, 2006; Menza, 2009) |
Samenvatting literatuur
Niet-medicamenteuze behandeling
Beschrijving studies cognitieve gedragstherapie
Vier studies onderzochten het effect van cognitieve gedragstherapie op depressieve klachten. Drie van deze studies includeerden zowel patiënten met depressie als angstklachten en worden tevens besproken in de module Angststoornissen bij Parkinson (Dobkin, 2011; Calleo, 2015; Troeung, 2014, Vaezey 2009).
Calleo (2015) verrichtte een RCT naar de effecten van cognitieve gedragstherapie (CGT) op angst- en/of depressieve klachten bij parkinsonpatiënten. In de interventiegroep startten 10 patiënten, waarvan er bij de meting na de 1 maand follow-up nog 6 overbleven (loss-to-follow-up: 40%). In de controlegroep startten 6 patiënten, waarvan er bij de meting van de 1 maand follow-up nog 5 over waren (loss-to-follow-up: 17%). De interventie bestond uit CGT (persoonlijke of telefonische sessies, afhankelijk van de keuze van de patiënt) met drie standaard sessies en een serie keuzesessies die facultatief waren. Van de deelnemers aan de studie bleek 31,3% (n=5) een depressieve stoornis te hebben; 34,5 % (n=6) een angststoornis en 31,3% (n=5) een combinatie van beide.
De RCT van Troeung (2014) onderzocht het effect van CGT gegeven als groepstherapie bij parkinsonpatiënten met ten minste één depressieve- of angststoornis volgens de DSM-IV criteria. Patiënten werden alleen geïncludeerd als ze minstens zes maanden de diagnose van de ziekte van Parkinson hadden, en hun eventuele medicatie (antiparkinsonmedicatie of antidepressiva) tenminste 3 maanden stabiel was. Door moeilijkheden met het includeren van patiënten, werden er uiteindelijk 18 patiënten geïncludeerd in de studie, in plaats van de gewenste 89. De interventie (n=11) bestond uit een achtweeks CGT-programma met elke week 2 uur groepstherapie gegeven door twee therapeuten. De controlegroep (n=7) ontving geen behandeling maar kwam op een wachtlijst en werd klinisch gemonitord. Er werd geen nieuwe behandeling gestart gedurende de 8 weken en patiënten continueerden hun bestaande medicatie voor angst en/of depressie. Er waren alleen vergelijkende resultaten beschikbaar bij de post-behandelmeting (in de follow-upmeting na één maand en zes maanden hadden alle deelnemers uit de controlegroep al de behandeling gekregen). Er is geen informatie beschikbaar over het aantal depressies en/of angststoornissen bij start van de studie.
Dobkin (2011) onderzocht in een RCT het effect van CGT op depressieve klachten bij patiënten met parkinson en een klinische diagnose van depressie volgens de DSM-IV. De interventiegroep (n=41) ontving wekelijkse sessies van 60 tot 75 minuten gedurende 10 weken, bestaande uit cognitieve gedragstherapie aangepast aan de doelgroep, caregiver support (4 educatieve sessies) en klinische monitoring. De controlegroep (n=39) ontving klinische monitoring bestaande uit twee follow-up telefoongesprekken van 30 minuten en drie evaluaties van 60 tot 90 minuten. Metingen werden gedaan op baseline, na 5, 10 (einde behandeling) en 14 weken (follow-up) door een geblindeerde testafnemer.
In de RCT van Vaezey (2009) werd het effect onderzocht van telefonisch gegeven CGT gedurende 8 weken, met voorafgaand één 'live'-CGT sessie, ten opzichte van een supportgroep (8 telefonische contacten zonder CGT). Patiënten werden geïncludeerd als er sprake was van minimaal matig-ernstige depressieve (Patient Health Questionnaire-9 (PHQ-9)-score ≥ 10) of angstklachten (Beck Anxiety Inventory (BAI)-score ≥ 16). Een score < 24 op de MMSE, evenals suïcidaliteit was een exclusiecriterium. In beide groepen participeerden vijf patiënten. Na één maand follow-up voltooiden zes patiënten de studie. De volgende patiëntkarakteristieken werden beschreven: in de interventiegroep was de gemiddelde baseline score op de Beck Anxiety Inventory 23,6 (SD= 8,3) en in de controlegroep 23,8 (SD=9,4).
Resultaten cognitieve gedragstherapie
Depressieve klachten
Calleo (2015) gebruikte een gestructureerde interviewversie van de HAM-D. In de CGT-groep scoorden patiënten gemiddeld 5,14 (SD=5,49) punten lager direct na de interventieperiode van 12 weken ten opzichte van de baselinescore. In de ‘enhanced care’-groep scoorden patiënten gemiddeld 2,25 (SD=4,79) punten hoger na de interventieperiode ten opzichte van de baselinescore. Het verschil in verschilscores tussen de groepen werd gerapporteerd door middel van de Cohen’s d=1,49 (p=0,045). Een maand na het beëindigen van de interventie werd er geen significant verschil tussen de twee groepen gevonden (verandering ten opzichte van baseline: CGT= -5 (SD=8,32); controle=0,00 (SD=6,60); p=0,52).
Troeung (2014) rapporteerde een gemiddelde afname van 3,91 punten op de depressie-subschaal van de Depression Anxiety Stress Scale (DASS-D) score in de behandelgroep en een toename van 0,29 punten in de controlegroep, hetgeen een significant verschil is (Cohen’s d=1,12; p=0,011).
Dobkin (2011) gebruikte twee depressieschalen, de HAM-D en de BDI. Op de HAM-D verbeterde de interventiegroep significant meer dan de controlegroep, na 1 maand follow-up had de interventiegroep een score van 14,52 (SD=4,75) en de placebogroep een score van 19,31 (SD=4,63) (interactie behandeling*tijd (mized between-within ANOVA): F=30,74, p<0,001, Cohen’s d=1,59). De resultaten op de BDI kwamen overeen met die van de HAM-D. De interventiegroep verbeterde meer dan de controlegroep (behandeling*tijd: F=9,77, p=0,001, Cohen’s d=0,98). Het aantal patiënten dat reageerde op de behandeling (gedefinieerd als grote verbetering op de Clinical Global Impression-Improvement Scale of een ≥50% reductie op de baseline HAM-D score) was groter in de CBT-groep dan in de controlegroep (56% versus 8%, p<0,001).
Veazey (2009) rapporteerden een gemiddelde score op de PHQ-9 na één maand follow-up van 7,7 (SD=3,7) in de cognitieve gedragstherapiegroep en 11,3 (SD=8,1) in de controlegroep. Als effectmaat werd de eta2 gerapporteerd; eta2=0,11. Dit is matig verschil tussen de groepen in het voordeel van de CGT, maar het is onbekend of het verschil statistisch significant is. Beide groepen bestonden uit data van drie van de vijf deelnemers.
Kwaliteit van leven
Troeung (2014) rapporteerden een gemiddelde afname van 3,21 punten op de totale PDQ-39 score in de behandelgroep en gemiddelde toename van 4,4 punten in de controlegroep (Cohen’s d=0,56; p=0,095).
Dobkin (2011) rapporteerde drie subschalen van de Short-Form Health Survey. De interventiegroep had een significant betere score op de subschaal sociaal functioneren vergeleken met de controlegroep (F=5,07, p=0,02, Cohen’s d=0,81). Op de subschalen fysiek disfunctioneren en physical role limitations werd geen significant effect gevonden.
Veazey (2009) rapporteerde een gemiddelde totale score op de PDQ-39 na één maand follow-up van 39,5 (SD=10,6) in de cognitieve gedragstherapiegroep en 44,7 (SD=12,8) in de controlegroep. Als effectmaat werd de eta2 gerapporteerd; eta2=0,07, een gemiddeld verschil tussen de groepen in het voordeel van de cognitieve gedragstherapie. Of het verschil statistisch significant is, is niet genoemd. Beide groepen bestonden uit data van drie van de drie deelnemers.
Bewijskracht van de literatuur
De bewijskracht voor alle beschreven vergelijkingen is afkomstig uit gerandomiseerd gecontroleerd onderzoek en startte zodoende op ‘hoog’. De bewijskracht voor de uitkomstmaat depressieve klachten na cognitieve gedragstherapie is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten (imprecisie). De bewijskracht is laag.
De bewijskracht voor de uitkomstmaat kwaliteit van leven na cognitieve gedragstherapie is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: schending randomisatie) en imprecisie (laag aantal patiënten; 95%BI omvat zowel ‘geen effect’ als de waarde van het klinisch relevante effect). De bewijskracht is zeer laag.
Beschrijving studies repetitive transcranial Magnetic Stimulation (rTMS)
Depressieve klachten
Wang (2018) onderzocht het effect van rTMS op de linker dorsolaterale prefrontale cortex (DLPFC) op depressieve klachten bij patiënten met de ziekte van Parkinson. Het review includeerde alleen dubbelblind gerandomiseerd onderzoek, dat gedaan was bij patiënten met parkinson en een klinische depressie. In totaal werden 7 studies geïncludeerd, waarvan vier studies rTMS vergeleken met shamTMS en drie studies rTMS vergeleken met een selectieve serotonine heropnameremmers (selective serotonin reuptake inhibitor, SSRI). Eén studie kon niet worden meegenomen in de meta-analyses vanwege onvolledige data. De overige zes studies includeerden 92 patiënten in totaal. Als uitkomstmaat werden depressieschalen gebruikt.
Resultaten repetitive transcranial Magnetic Stimulation (rTMS)
De meta-analyse van drie studies liet zien dat rTMS een positief effect had op depressieve klachten vergeleken met sham-TMS (standardized mean difference (SMD)= -0,86, 95%BI -1,29 tot -0.43; p<0,001) (zie figuur 1 overgenomen uit Wang, 2018).
Wanneer rTMS werd vergeleken met een behandeling met SSRI werd geen significant verschil gevonden (SMD= -0,12, 95%BI -0,86 tot 0,62; p=0,75).
Figuur 1 rTMS versus sham rTMS and versus SSRI – effect op depressieve klachten (Wang, 2018)
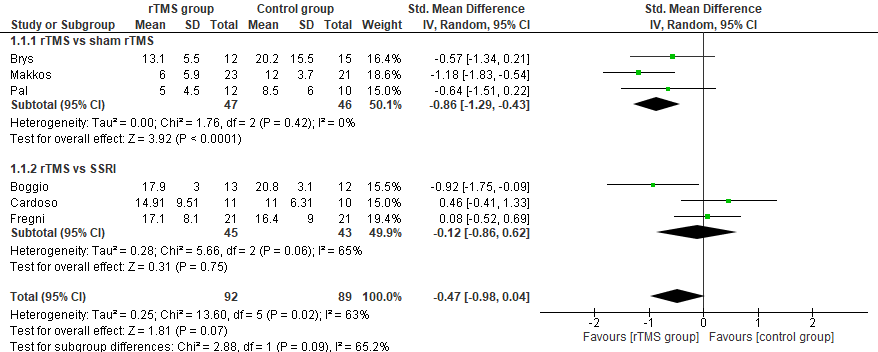
Kwaliteit van leven
In de review van Wang (2018) werd geen kwaliteit van leven als uitkomstmaat gerapporteerd. De 2 studies uit deze review die deze uitkomstmaat wel meenamen, worden hier apart besproken. Makkos (2016) zag een significante verbetering na rTMS vergeleken met shamTMS op de PDQ-39, zowel op de korte als lange termijn (TMS: mediaan 25,4 (IQR: 18,5 tot 35,4) naar 16,9 (IQR: 4,5 tot 20,0); shamTMS: 23,5 (IQR: 15,4 tot 27,7) naar 24,2 (IQR: 12,9 tot 29,9). Brys (2016) zag geen verschil tussen de groepen op de PDQ-39 (geen data).
Bewijskracht van de literatuur
De bewijskracht voor alle beschreven vergelijkingen is afkomstig uit gerandomiseerd gecontroleerd onderzoek en startte zodoende op ‘hoog’. De bewijskracht voor de uitkomstmaat depressieve klachten na TMS in vergelijking met placebo is met 1 niveau verlaagd gezien het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat depressieve klachten na TMS in vergelijking met SSRI is met 2 niveaus verlaagd gezien het geringe aantal patiënten (imprecisie) en inconsistentie.
De bewijskracht voor de uitkomstmaat kwaliteit van leven na TMS is met 3 niveaus verlaagd gezien het geringe aantal patiënten (imprecisie) en tegenstrijdige resultaten (inconsistentie).
Beschrijving studie inspanningstraining
Eén studie onderzocht het effect van inspanningstraining op depressieve klachten (Sajatovic, 2017). De interventiegroep (n=15) kreeg gesuperviseerde inspanningstraining en krachttraining, gecombineerd met chronic disease self-management (CDSM). Na 12 weken werden de deelnemers aangemoedigd om de daaropvolgende 12 weken zelfstandig te trainen. De andere groep patiënten (n=15) kreeg het advies om 3 keer per week te trainen en kreeg daarbij eenmalige instructie. Deze groep kreeg ook CDSM. Inclusiecriteria waren onder andere een Hoehn-and-Yahr stadium ≤ 3 en een depressie op basis van een MADRS-score ≥ 14 punten. De gemiddelde leeftijd was 70 (SD=7,9) jaar en 63% was man. De studie duurde in totaal 24 weken. Patiënten in beide groepen gingen gemiddeld even vaak naar de trainingssessies.
Resultaten inspanningstraining
Depressieve klachten
Sajatovic (2017) vond na 24 weken geen verschil tussen de gesuperviseerde en niet-gesuperviseerde inspanningstraining, gecombineerd met CDSM, op de MADRS. Wanneer beide groepen werden samengevoegd, werd een significante verbetering gevonden op de MADRS na 24 weken (gemiddelde afname = -6,9 punten).
Kwaliteit van leven werd niet onderzocht.
Bewijskracht van de literatuur
De bewijskracht voor alle beschreven vergelijkingen is afkomstig uit gerandomiseerd gecontroleerd onderzoek en startte zodoende op ‘hoog’. De bewijskracht voor de uitkomstmaat depressieve klachten na een gesuperviseerde inspanningsinterventie is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijke randomisatie) en het geringe aantal patiënten (imprecisie).
Medicamenteuze behandeling
Beschrijving studies
De vier meest recente systematische reviews met meta-analyse werden meegenomen in deze analyse van antidepressiva en dopamine-agonisten (Liu, 2013; Troeung, 2013; Qiu, 2014; Mills, 2018). De reviews verschilden in de medicatie die in de meta-analyses vergeleken werden: één review vergeleek selectieve serotonine reuptake inhibitors (SSRI’s) en tricyclische antidepressiva (TCA) met placebo (Troeung, 2013); één review vergeleek SSRI’s met TCA’s (Qiu, 2014) en in twee reviews werden netwerkmeta-analyses (NMA) uitgevoerd waarin naar zowel vergelijkingen tussen types antidepressiva onderling en ten opzichte van placebo werd gekeken (Liu, 2013; Mills, 2018). In een netwerkmeta-analyse worden data van vergelijkend onderzoek gepooled, om interventies te onderzoeken die niet direct met elkaar vergeleken zijn. In totaal werden in de vier reviews 30 studies beschreven, waarvan er 14 werden meegenomen in meta-analyses (aanverwante producten bij deze module). Voor de uitkomstmaat ‘kwaliteit van leven’ werden de RCT’s apart bekeken.
Uit de referentielijsten van de niet-geïncludeerde reviews (zie exclusietabel) werd een studie gevonden die voldeed aan onze inclusiecriteria (Chung, 2016). Daarnaast identificeerde de literatuursearch nog één additionele recente publicatie (Takahashi, 2018).
De meest recente review is die van Mills (2018). In deze review werd in een NMA het effect op depressieve symptomen onderzocht van verschillende types antidepressiva ten opzichte van placebo en ten opzichte van elkaar. Van de 20 beschreven studies, werden er vijf meegenomen in de NMA. De exacte inclusiecriteria voor de NMA werden niet beschreven, maar de auteurs zochten naar een zo homogeen mogelijke groep studies met betrekking tot selectiecriteria van proefpersonen, interventies en uitkomstmaten. De volgende acht vergelijkingen konden worden onderzocht met de data van de vijf studies: SSRI versus placebo; SSRI versus SNRI; SSRI versus serotonine antagonist and reuptake inhibitor (SARI); SSRI versus TCA; SNRI versus placebo; SARI versus controle; TCA versus placebo; en rasagaline versus placebo. De studies omvatten data van 347 patiënten met de ziekte van Parkinson met klinische depressie of depressieve klachten gemeten met een gestandaardiseerd instrument. Patiënten met dementie werden uitgesloten van deelname. De interventieduur varieerde van 6 tot 20 weken. Depressie werd gemeten met de BDI of de HAM-D.
In de review van Liu (2013) werden naast antidepressiva ook dopamine-agonisten onderling vergeleken en ten opzichte van placebo wat betreft hun effect op depressieve klachten bij patiënten met de ziekte van Parkinson. In de NMA werden 11 studies meegenomen. De volgende 14 vergelijkingen konden worden onderzocht met de data van de 11 studies: directe vergelijkingen: pramipexol versus placebo; pramipexol versus pergolide; pramipexol versus SSRI; SSRI versus placebo; SSRI versus TCA; SSRI versus SNRI; TCA versus placebo; SNRI versus placebo. De volgende indirecte vergelijkingen zijn gemaakt: pramipexol versus SNRI; pramipexol versus TCA; SSRI versus pergolide; TCA versus pergolide; TCA versus SNRI; SNRI versus pergolide. De 11 studies omvatten data van 801 patiënten met de ziekte van Parkinson met klinische depressie (zoals gedefinieerd door de auteurs van de originele studies). De interventieduur varieerde van 4 tot 35 weken. Verbetering in depressieve klachten werd gedefinieerd als ten minste 50% reductie in score op een gestandaardiseerd instrument (BDI, HAM-D, Inventory of Depressive Symptomatology (IDS-C), MADRS, en Zung self-rating depression scale (Zung SDS)).
In de systematische review en meta-analyse van Qiu (2014) werd de effectiviteit vergeleken van SSRI's ten opzicht ven TCA's in het verminderen van depressieve klachten bij patiënten met de ziekte van Parkinson. In deze review werden vijf studies geïncludeerd die elk een andere SSRI (sertraline, citralopram, paroxetide, fluvoxamine of fluoxetine) vergeleken met een TCA (amitriptyline, desipramine of nortriptyline). De vijf studies omvatten data van 106 proefpersonen in SSRI-groep en 116 proefpersonen in de TCA-groep, allen met de ziekte van Parkinson. De interventieduur varieerde van 4 tot 52 weken. Veranderingen in depressieve klachten werden gemeten met de HAM-D of de MADRS.
In de systematische review met meta-analyse van Troeung (2013) werden SSRI’s en TCA’s vergeleken ten opzichte van placebo in effect op depressieve en/of angst klachten bij patiënten met de ziekte van Parkinson. In de review werden 29 studies beschreven, waarvan 22 farmaceutische interventies evalueerden. Na exclusie van studies zonder placebogroep, zonder gestandaardiseerd instrument voor het meten van depressieve klachten, zonder een klinische diagnose voor depressie als inclusiecriterium, en/of onvoldoende kwantitatieve data, bleven er negen studies over voor de meta-analyse. Die negen studies omvatten data van 252 proefpersonen in de interventiegroep en 180 proefpersonen in de placebogroep, allen met de ziekte van Parkinson. De interventieduur varieerde van 10 dagen tot 12 weken. Veranderingen in depressieve en/of angst klachten werden gemeten met de HAM-D, MADRS of IDS-C.
Takahashi (2018) vergeleek in een RCT het gebruik van een SSRI (paroxetine of escitalopram) met een SNRI (duloxetine) in patiënten met de ziekte van Parkinson en depressieve symptomen zoals gemeten met de Quick Inventory Depressive Symptomatology Japanese (QIDS-J; score ≥ 6). De dosering voor paroxetine werd geleidelijk verhoogd van 10 mg/dag (2 weken) tot 20 mg/dag (8 weken) voor tabletten, en van 12,5 mg/dag tot 25 mg/dag voor controlled release tabletten. De dosering voor escitalopram werd vastgesteld op 10 mg/dag voor de gehele duur van de interventie (10 weken). De dosering voor duloxetine werd verhoogd van 20 mg/dag (2 weken) tot 40 mg/dag (8 weken). Respectievelijk 25 en 27 proefpersonen werden na randomisatie toegewezen aan de SSRI en de SNRI groepen, waarvan 19 en 20 personen de studie voltooiden en 17 personen in elke groep complete data hadden na 10 weken. Het effect van de medicatie op depressieve symptomen werd gemeten met de QIDS-J.
Chung (2016) vergeleek het gebruik van rotigotine met placebo in patiënten met de ziekte van Parkinson en depressieve symptomen zoals gemeten met de BDI (BDI-II score ≥ 16). De dosering werd wekelijks opgehoogd van 2 tot 8 mg/dag, of naar beneden bijgesteld indien nodig. Na randomisatie werden 184 proefpersonen toegewezen aan de rotigotine groep en 196 aan de placebogroep. Daarvan volbrachten respectievelijk 149 en 164 proefpersonen de studie en waren er voor 120 en 131 personen complete data beschikbaar na 8 weken. Het effect van de medicatie op depressieve symptomen werd gemeten met de HAM-D.
Resultaten medicamenteuze behandeling - depressieve klachten
TCA versus placebo
In de meta-analyses van Troeung (2013), Liu (2013) en Mills (2018) werden dezelfde twee RCT’s meegenomen (Devos, 2008; Menza, 2009). In de meta-analyse van Troeung (2013) werd gekeken naar het gestandaardiseerde verschil tussen de TCA en placebogroepen in verschilscores op de HAM-D en MADRS van baseline tot follow-up. In de meta-analyse van Liu (2013) werd gekeken naar het verschil tussen de twee groepen in aantal proefpersonen dat een afname in testscore van meer dan 50% liet zien bij follow-up. Mills (2018) deed geen meta-analyse met beide studies. Uit de twee meta-analyses bleek TCA effectief ten opzichte van placebo in het verminderen van depressieve symptomen (Troeung, 2013: gepoolde SMD=1,36, 95%BI 0,19 tot 2,52); Liu, 2013: gepoolde OR=4,85, 95%BI 1,63 tot 14,37).
SSRI versus placebo
In de meta-analyse van Troeung (2013) werden vijf RCT’s meegenomen (Wermuth, 1998; Antonini, 2006; Leentjens, 2003; Devos, 2008; Menza, 2008). In de meta-analyse van Liu (2013) werden dezelfde vijf RCT’s plus één additionele RCT (Richard, 2012) meegenomen. In de meta-analyse van Mills (2018) werden drie dezelfde RCT’s meegenomen als in de meta-analyses van Troeung (2013) en Liu (2013) plus één additionele RCT. In de meta-analyses van Troeung (2013) en Mills (2018) werd gekeken naar het gestandaardiseerde verschil tussen de SSRI- en placebogroepen in verschilscores op de HAM-D en MADRS van baseline tot follow-up. In de meta-analyse van Liu (2013) werd gekeken naar het verschil tussen de twee groepen in aantal proefpersonen dat een afname in testscore van meer dan 50% liet zien bij follow-up. In de meta-analyses van Troeung (2013) en Liu (2013) werden geen significante verschillen gevonden tussen de SSRI-groep en de placebogroep in het verminderen van depressieve symptomen (Troeung, 2013: gepoolde SMD=0,44, 95%BI -1,37 tot 2,26; Liu, 2013: gepoolde OR=1,60, 95%BI 0,87 tot 2,97), terwijl in de meta-analyse van Mills (2018) wel een significant grotere verbetering in depressieve symptomen werd gevonden in de SSRI-groep ten opzichte van de placebogroep (gepoolde SMD= -0,53, 95%BI -0,87 tot -0,20).
SNRI versus placebo
In de meta-analyse van Liu (2013) werden twee RCT’s (Weintaub, 2010; Richard, 2012) meegenomen die SNRIs vergeleken met placebo in aantal proefpersonen dat een afname in score op de IDS-C of HAM-D van meer dan 50% liet zien bij follow-up. Er werd geen significant verschil gevonden tussen de SNRI-groep en de placebogroep in het verminderen van depressieve symptomen (gepoolde OR=1,71 (95%BI 0,73 tot 4,01) (Liu, 2013).
Rasagiline (selectieve MAO-B remmer) versus placebo
De meta-analyse van Mills (2018) identificeerden één RCT die MAO-remmer vergeleek met placebo (Barone, 2015). Hierin werd rasagiline met placebo vergeleken bij patiënten met de ziekte van Parkinson en depressieve klachten. Na vier weken behandeling had rasagilinegroep (n=58) een grotere afname (-5,46, SD=0,73) in depressieve symptomen, gemeten met de BDI, zien dan de placebogroep (totale n=65; afname -3,22, SD=0,67; p=0,026. Na 12 weken (primaire uitkomstmaat) was dit verschil tussen de groepen verdwenen.
Dopamine-agonisten versus placebo
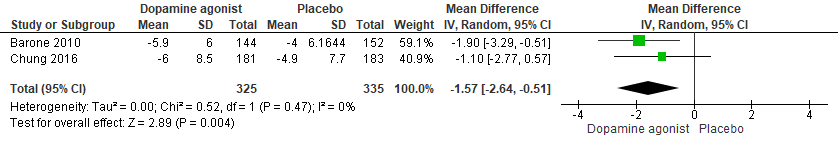
In de meta-analyses van Troeung (2013) en Liu (2013) werd één studie geïncludeerd die een dopamine-agonist vergeleek met placebo (Barone, 2010). Daarnaast werd nog één relevante studie toegevoegd (Chung, 2016). De meta-analyse waarin beide studies worden meegenomen laat zien dat behandeling met een dopamine-agonist (totale n=325) gepaard gaat met een grotere afname in depressieve symptomen dan behandeling met placebo (totale n=355) gemeten met de BDI (gemiddelde verschilscore -1,57 (95%BI -2,64 tot -0,51) (Figuur 2).
Figuur 2 Dopamine-agonisten versus placebo – uitkomst: depressieve symptomen gemeten met de BDI
Onderlinge vergelijkingen van klassen antidepressiva en dopamine-agonisten
In twee systematische reviews werd ook een meta-analyse uitgevoerd (Liu, 2013; Mills, 2018), maar verschilden in het aantal studies en in de vergelijkingen die werden meegenomen. Daarnaast werd in de meta-analyse van Qiu (2014) behandeling met een SSRI vergeleken met behandeling met een TCA. Hieronder wordt elke vergelijking kort besproken:
- SSRI versus TCA: In geen van de reviews werd een significant verschil gevonden tussen SSRI’s en TCA’s in verbetering in score op depressie schalen (Mills, 2018: 4 RCT’s: TCA versus SSRI gepoolde SMD=0,28 (95%BI −0,46 tot 1,03, Tabel 1) of percentage deelnemers dat verbetering liet zien in depressieve symptomen (Liu, 2013, 8 RCT’s: TCA versus SSRI gepoolde OR=2,77 (95%BI 0,75 tot 7,75), Tabel 2; Qiu, 2014, 5 RCT’s: SSRI versus TCA gepoolde OR=0,95 (95%BI 0,78 tot 1,16)).
- SSRI versus SNRI: In de meta-analyses van Liu (2013) werd één studie geïncludeerd die een SSRI vergeleek met een SNRI (Richard, 2012). Uit de literatuursearch kwam nog één additionele studie naar voren (Takahashi, 2018). De twee studies vergeleken allebei SSRI- en SNRI-groepen op het aantal deelnemers dat een verbetering in depressieve symptomen liet zien gemeten met de CGI. Er werd in beide studies geen significant verschil gevonden tussen de interventies en ook in de meta-analyse werd geen significant verschil gezien tussen de SSRI- (totale n=51) en SNRI-groepen (totale n=47) in het percentage deelnemers dat een verbetering liet zien in depressieve symptomen (gepoolde OR 1,77, 95%BI 0,77 tot 4,06) (Figuur 3). Ook de veranderscore op de Quick Inventory Depressive Symptomatology was niet verschillend tussen de interventies (Takahashi, 2018). Deze resultaten komen overeen met die van de twee NMAs waarin ook geen significant verschil in effect op depressieve symptomen werd gevonden tussen SSRI’s en SNRIs (Mills, 2018: gepoolde SMD=0,11 (95%BI -0,50 tot 0,73), Tabel 1; Liu, 2013: gepoolde OR=1,25 (95%BI 0,23 tot 3,73), Tabel 2).
- Voor overige vergelijkingen tussen TCA, SSRI, SNRI, SARI, MAO-remmer en dopamine-agonisten (pergolide en pramipexol) werden geen significante verschillen gevonden (Tabellen 1 en 2).
|
CONTROL |
0,15 (-1,65, 1,94) |
0,43 (-1,19, 2,06) |
0,55 (-1,19, 2,28) |
0,58 (-0,58, 1,74) |
0,92 (-0,77, 2,61) |
-0,35 (-2,15, 1,45) |
|
|
TRICYCLIC |
0,28 (-0,46, 1,03) |
0,40 (-0,52, 1,31) |
0,43 (-0,93, 1,79) |
0,77 (0,02, 1,53) |
-0,50 (-1,47, 0,47) |
|
|
|
SSRI |
0,11 (-0,50, 0,73) |
0,15 (-0,99, 1,28) |
0,49 (0,03, 0,95) |
-0,78 (-1,55, -0,01) |
|
|
|
|
SNRI |
0,03 (-1,26, 1,32) |
0,37 (-0,24, 0,99) |
-0,90 (-1,77, -0,03) |
|
|
|
|
|
SARI |
0,34 (-0,88, 1,57) |
-0,93 (-2,30, 0,44) |
|
|
|
|
|
|
PLACEBO |
-1,27 (-1,89, -0,66) |
|
|
|
|
|
|
|
MAOI |
Tabel 1 Netwerkmeta-analyse van antidepressiva getest in patiënten met de ziekte van Parkinson met depressieve klachten (Mills, 2018)
Negatieve waarden geven aan dat de therapie in kolom superieur is, positieve waarden geven aan dat de therapie in de rij superieur is. Dikgedrukte waarden zijn significant verschillend
Tabel 2 Netwerk meta-analyse van antidepressiva, dopamine-agonisten en placebo getest in patiënten met de ziekte van Parkinson met depressieve klachten (Liu, 2013)
|
SNRI |
52,54 (0,26-320,22) |
13,27 (0,51-51,67) |
4,32 (0,29-19,09) |
2,56 (0,34-9,14) |
4,29 (0,65-13,07) |
|
7,63 (0,15-42,88) |
Pergolide |
1,71 (0,04-11,03) |
1,51 (0,01-9,43) |
1,06 (0,01-5,75) |
1,71 (0,01-10,21) |
|
0,94 (0,10-3,29) |
0,50 (0,02-2,75) |
Pramipexole |
0,82 (0,03-3,56) |
0,53 (0,04-1,92) |
0,90 (0,09-2,92) |
|
0,64 (0,07-2,48) |
0,58 (0,01-4,03) |
3,17 (0,13-3,70) |
TCA |
1,00 (0,19-2,83) |
1,90 (0,32-7,51) |
|
1,25 (0,23-3,73) |
1,12 (0,02-6,73) |
3,44 (0,48-6,29) |
2,77 (0,75-7,75) |
SSRI |
1,97 (0,69-4,99) |
|
1,83 (0,36-5,66) |
1,66 (0,03-9,43) |
5,84 (0,72-9,87) |
4,18 (0,95-11,94) |
1,63 (0,66-3,32) |
Placebo |
Data zijn weergegeven als odds ratio (OR) (95%BI), gedefinieerd als een behandeling vergeleken met de onderstaande behandeling. OR’s linksonder geven de effectiviteit weer, de OR’s rechtsboven geven de acceptatie weer.
Figuur 3 SSRI versus SNRI - uitkomst: percentage deelnemers dat verbetering laat zien in depressieve symptomen

Resultaten medicamenteuze behandeling - kwaliteit van leven
TCA versus placebo
Menza (2009) vergeleek TCA (n=17) met placebo (17) op kwaliteit van leven gemeten met de SF-36 en de PDQ-8. Er waren geen statistisch significante verschillen tussen de groepen in verandering in kwaliteit van leven (geen data beschikbaar).
SSRI versus placebo
Menza (2009) vergeleek SSRI’s (n=18) met placebo (n=17) op kwaliteit van leven gemeten met de SF-36 en de PDQ-8. Er waren geen statistisch significante verschillen tussen de groepen in verandering in kwaliteit van leven (geen data beschikbaar).
MAO-remmer versus placebo
Barone (2015) vergeleek rasagiline (n=58) met placebo (n=65) op kwaliteit van leven gemeten met de PDQ-39. Er werd geen significant verschil gevonden in de rasagilinegroep ten opzichte van de placebogroep op kwaliteit van leven (MD=-5,21, 95%BI -12,31 tot 1,89).
TCA versus SSRI
In twee studies werd het effect van behandeling met een TCA met dat van een SSRI vergeleken op de kwaliteit van leven gemeten met de PDQ-39. Omdat in geen van de studies voldoende data werd gepresenteerd voor een meta-analyse, wordt elke studie apart beschreven.
- Antonini (2006) vond significante verbeteringen na 3 maanden in de met een SSRI behandelde groep (n=12) op de domeinen mobiliteit (gemiddelde op baseline: 22,3, SD=8,7; follow-up: 12,9, SD=5,8; p<0,001), ADL (baseline: 9,7, SD=7,9; follow-up: 5,4, SD=3,2; p<0,03), emotioneel (baseline: 13,4, SD=3,7; follow-up: 6,0, SD=3,1; p<0,001) en stigma (baseline: 7,4, SD=4,6; follow-up: 4,0, SD=3,4; p<0,01). In de TCA-groep (n=11) werd op geen van de domeinen een significante veranderingen gevonden. Verschillen tussen de groepen werden niet getoetst.
- Menza (2009) vond geen statistisch significante verschillen tussen de TCA-groep (n=17) en de SSRI-groep (n=18) in verandering in kwaliteit van leven gemeten met de SF-36 en de PDQ-8 (geen data beschikbaar).
SNRI versus placebo
Kwaliteit van leven werd niet onderzocht.
Dopamine agonisten versus placebo
Kwaliteit van leven werd niet onderzocht.
SSRI versus SNRI
Kwaliteit van leven werd niet onderzocht.
Bewijskracht van de literatuur
De bewijskracht voor alle beschreven vergelijkingen is afkomstig uit gerandomiseerd gecontroleerd onderzoek en startte zodoende op ‘hoog’. In de reviews van Mills (2018) en Troeung (2013) werd de risk of bias beschreven voor respectievelijk 20 en 9 studies. In beide reviews werd aangeven dat voor veel studies de risk of bias onduidelijk was door incomplete beschrijving van de methoden. Dit gold voor alle aspecten van risk of bias (randomisering, blindering, rapportage van uitkomsten en 'intention to treat' analyse). In de review van Qiu (2014) kregen alle vijf de studies een van 5 (optimaal) op de Jadad schaal. In de review van Liu (2013) werd de risk of bias van studies niet besproken. De twee studies die niet in bovenstaande reviews werden meegenomen, hadden beide te maken met behoorlijke loss-to-follow-up (Chung, 2016): 17,6%, Takahashi (2018): 23,6%), waarbij in één studie werd aangegeven dat uitval met name te wijten was aan bijwerkingen van de interventiemedicatie (Takahashi, 2018). Ook was in beide studies onduidelijk of aan de voorwaarden van 'intention to treat' analyse werd voldaan. Dit heeft mogelijk geleid tot vertekende resultaten door selectieve uitval. Vanwege de onduidelijke bias, werd de bewijskracht met 1 niveau verlaagd.
Vergelijkingen waarvoor meerdere studies beschikbaar waren, lieten over het algemeen consistente resultaten zien. Uitzondering hierop is de vergelijking van SSRI’s met placebo. In drie meta-analyses werden data van zeven studies meegenomen. De resultaten van de zeven studies varieerden sterk wanneer gekeken werd naar het aantal deelnemers met remissie van depressieve symptomen, maar niet wanneer gekeken werd naar verschilscores op depressieschalen). Ook verschilden de resultaten van de drie meta-analyses: slechts in één van de drie meta-analyses werd een significant verschil gevonden tussen SSRI en placebo. In die review werden slechts 4 van de 7 studies meegenomen. Vanwege deze inconsistente bevindingen wordt voor de vergelijking van SSRI met placebo de bewijskracht met 1 niveau verlaagd. Het is mogelijk dat inconsistentie deels wordt verklaard door verschillen in selectiecriteria voor deelnemers en daardoor variaties tussen studies in ernst van symptomen voor zowel parkinson als depressie (Liu, 2013). Er zijn echter te weinig studies per vergelijking om na te gaan of er de effectiviteit van de medicatie afhangt van de ernst van de symptomen.
De bewijskracht werd niet verlaagd voor extrapoleerbaarheid (indirectheid). Alle studies vergeleken relevante medicijnen met adequate uitkomstmaten. Alle studies includeerden patiënten met de ziekte van Parkinson met klinische depressie en/of depressieve symptomen zoals gemeten met een gestandaardiseerd instrument.
Het kleine aantal studies per vergelijking en de relatief kleine verschillen in de uitkomstmaten resulteerde in brede betrouwbaarheidsintervallen. De bewijskracht werd daarom met 1 niveau verlaagd voor imprecisie. Uitzondering hierop zijn de vergelijking TCA versus placebo en SSRI versus placebo. Hoewel er slechts twee studies zijn die TCA onderzochten, met in totaal 100 deelnemers, laten beide studies een sterk effect zien in het voordeel van TCA. De vergelijking SSRI versus placebo omvat 7 studies welke inconsistente resultaten laten zien.
Op basis van de beschreven overwegingen, wordt de bewijskracht daarom verlaagd van ‘hoog’ naar ‘laag’ voor alle vergelijkingen behalve de volgende:
- TCA versus placebo: bewijskracht wordt verlaagd naar ‘redelijk’.
- SSRI versus placebo: bewijskracht wordt verlaagd naar ‘zeer laag’.
- MAO-B remmers versus placebo: bewijskracht wordt verlaagd naar ‘zeer laag’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
P: patiënten met de ziekte van Parkinson en depressie (gedefinieerd als klinisch vastgestelde depressie of als een score boven een cutoff op een depressieschaal);
I: niet-medicamenteuze behandelmogelijkheden (bijvoorbeeld psychotherapie, repetitieve transcraniële magnetische stimulatie (rTMS), lichttherapie, elektroconvulsieve therapie (ECT)) of medicamenteuze therapie (antidepressiva, dopamine-agonisten);
C: placebo of andersoortige behandeling;
O: depressieve klachten en kwaliteit van leven.
Relevante uitkomstmaten
De werkgroep achtte vermindering van depressieve klachten en/of verbetering van kwaliteit van leven voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt:
Depressieve klachten (depressieschalen zoals gebruikt in de studies):
- Montgomery-Asberg Depression Rating Scale (MADRS).
- Hamilton Depression Rating Scale (HAM-D of ook wel HDRS).
- Beck Depression Inventory (BDI).
- Inventory of Depressive Symptomatology (IDS-C).
De werkgroep beschouwde elke statistisch significante verbetering van klachten als klinisch relevant.
Kwaliteit van leven (vragenlijsten zoals gebruikt in de studies):
- Parkinson’s Disease Quality of Life Scale (PDQ-39): de werkgroep definieerde een verbetering van -4,22 punten of een achteruitgang van +4,72 punten als een klinisch (patiënt) relevant verschil. (Horvath, 2017).
- Short Form Health Survey.
- Patient Health Questionnaire-9 (PHQ-9).
Angstklachten
- Beck Anxiety Inventory (BAI).
- Depression Anxiety Stress Scale (DASS-D).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 29 augustus 2018 met relevante zoektermen gezocht naar systematische reviews en mogelijke RCT’s die behandelmogelijkheden van depressie bij de ziekte van Parkinson onderzochten. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 496 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: (mogelijke) systematische reviews, vergelijkend onderzoek, en tenminste 10 deelnemers. Op basis van titel en abstract werden in eerste instantie 53 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 41 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 12 studies definitief geselecteerd.
Resultaten
Eén systematisch review (met 7 studies: Wang, 2018) en 5 losse RCT’s (Dobkin, 2011; Calleo, 2015; Troeung, 2014, Vaezey 2009; Sajatovic, 2017) zijn opgenomen in de literatuuranalyse voor niet-medicamenteuze behandeling. Vier systematische reviews (Liu, 2013; Troeung, 2013; Qiu, 2014; Mills, 2018; in totaal 16 RCT's) en 2 losse RCT’s (Takahashi, 2018; Chung, 2016) zijn geïncludeerd voor medicamenteuze behandeling. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidentietabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-bias tabellen.
Referenties
- Antonini A, Tesei S, Zecchinelli A, Barone P, De Gaspari D, Canesi M, Sacilotto G, Meucci N, Mariani C, Pezzoli G. Randomized study of sertraline and low-dose amitriptyline in patients with Parkinson's disease and depression: Effect on quality of life. Mov Disord. 2006;21(8):1119-22. Doi: 10.1002/mds.20895.
- Barone P, Poewe W, Albrecht S, Debieuvre C, Massey D, Rascol O, Tolosa E, Weintraub D. Pramipexol for the treatment of depressive symptoms in patients with Parkinson's disease: A randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2010;9(6):573-80. Doi: 10.1016/s1474-4422(10)70106-x.
- Barone P, Santangelo G, Morgante L, Onofrj M, Meco G, Abbruzzese G, Bonuccelli U, Cossu G, Pezzoli G, Stanzione P, Lopiano L, Antonini A, Tinazzi M. A randomized clinical trial to evaluate the effects of rasagiline on depressive symptoms in non-demented Parkinson's disease patients. Eur J Neurol. 2015;22(8):1184-91. Doi: 10.1111/ene.12724.
- Boggio PS, Fregni F, Bermpohl F, et al. Effect of repetitive TMS and fluoxetine on cognitive function in patients with Parkinson's disease and concurrent depression. Movement disorders: official journal of the Movement Disorder Society. 2005 Sep;20(9):1178-84. doi: 10.1002/mds.20508. PubMed PMID: 15895421
- Borisovskaya A, Bryson WC, Buchholz J, Samii A, Borson S. Electroconvulsive therapy for depression in Parkinson's disease: systematic review of evidence and recommendations. Neurodegener Dis Manag. 2016;6:161-76.
- Brys M, Fox MD, Agarwal S, et al. Multifocal repetitive TMS for motor and mood symptoms of Parkinson disease: A randomized trial (Randomized Controlled Trial). Neurology. 2016;87(18):1907-1915.
- Calleo JS, Amspoker AB, Sarwar AI, Kunik ME, Jankovic J, Marsh L, York M, Stanley MA. A Pilot Study of a Cognitive-Behavioral Treatment for Anxiety and Depression in Patients With Parkinson Disease. J Geriatr Psychiatry Neurol. 2015 Sep;28(3):210-7. doi: 10.1177/0891988715588831. Epub 2015 Jun 4. PubMed PMID: 26047635.
- Chung SJ, Asgharnejad M, Bauer L, Ramirez F, Jeon B. Evaluation of rotigotine transdermal patch for the treatment of depressive symptoms in patients with Parkinson's disease. Expert Opin Pharmacother. 2016;17(11):1453-61. Doi: 10.1080/14656566.2016.1202917.
- Cardoso EF, Fregni F, Martins Maia F, et al. rTMS treatment for depression in Parkinson's disease increases BOLD responses in the left prefrontal cortex. The international journal of neuropsychopharmacology. 2008 Mar;11(2):173-83. doi: 10.1017/S1461145707007961. PubMed PMID: 17708780.
- Dobkin RD, Menza M, Allen LA, Gara MA, Mark MH, Tiu J, Bienfait KL, Friedman J. Cognitive-behavioral therapy for depression in Parkinson's disease: a randomized, controlled trial. Am J Psychiatry. 2011;168(10):1066-74. doi: 10.1176/appi.ajp.2011.10111669.
- Leentjens AFG. Epidemiology of psychiatric symptoms in Parkinson’s disease. Adv Biol Psychiat 2012;27:1-12.
- Leentjens AFG. The role of dopamine agonists in the treatment of depression in patients with Parkinson's disease: A systematic review. Drugs. 2011;71(3):273-86. Doi: 10.2165/11585380-000000000-00000.
- Liu J, Dong J, Wang L, Su Y, Yan P, Sun S. Comparative efficacy and acceptability of antidepressants in parkinson's disease: A network meta-analysis. PLoS One. 2013;8(10):e76651. Doi: 10.1371/journal.pone.0076651.
- Makkos A, Pal E, Aschermann Z, et al. High-frequency repetitive transcranial magnetic stimulation can improve quality of life and depression in Parkinson's disease. European journal of neurology. 2015 June;22:515
- Menza M, Dobkin RD, Marin H, Mark MH, Gara M, Buyske S, Bienfait K, Dicke A. A controlled trial of antidepressants in patients with Parkinson disease and depression. Neurology. 2009;72(10):886-92. Doi: 10.1212/01.wnl.0000336340.89821.b3.
- Mills KA, Greene MC, Dezube R, Goodson C, Karmarkar T, Pontone GM. Efficacy and tolerability of antidepressants in Parkinson's disease: A systematic review and network meta-analysis. Int J Geriatr Psychiatry. 2018;33(4):642-51. Doi: 10.1002/gps.4834.
- Pal E, Nagy F, Aschermann Z, et al. The impact of left prefrontal repetitive transcranial magnetic stimulation on depression in Parkinson's disease: a randomized, double-blind, placebo-controlled study. Movement disorders : official journal of the Movement Disorder Society. 2010 30;25(14):2311-7. doi: 10.1002/mds.23270
- Qiu BY, Qiao JX, Yong J. Meta-analysis of selective serotonin reuptake inhibitors (SSRI’s) compared to tricyclic antidepressants (TCA’s) in the efficacy and safety of anti-depression therapy in Parkinson's disease(pd) patients. Iran J Pharm Res. 2014;13(4):1213-9. Doi.
- Richard IH, McDermott MP, Kurlan R, Lyness JM, Como PG, Pearson N, Factor SA, Juncos J, Serrano Ramos C, Brodsky M, Manning C, Marsh L, Shulman L, Fernandez HH, Black KJ, Panisset M, Christine CW, Jiang W, Singer C, Horn S, Pfeiffer R, Rottenberg D, Slevin J, Elmer L, Press D, Hyson HC, McDonald W. A randomized, double-blind, placebo-controlled trial of antidepressants in Parkinson disease. Neurology. 2012;78(16):1229-36. Doi: 10.1212/WNL.0b013e3182516244.
- Reijnders J, Ehrt U, Weber W, Aarsland D, Leentjens AFG. A systematic review of prevalence studies of depression in Parkinson’s disease. Mov Disord 2008;23:183-189
- Rocha FL, Murad MG, Stumpf BP, Hara C, Fuzikawa C. Antidepressants for depression in Parkinson's disease: Systematic review and meta-analysis. J Psychopharmacol. 2013;27(5):417-23. Doi: 10.1177/0269881113478282.
- Sandoval-Rincon M, Saenz-Farret M, Miguel-Puga A, Micheli F, Arias-Carrion O. Rational pharmacological approaches for cognitive dysfunction and depression in Parkinson's disease. Front Neurol. 2015;6:71. Doi: 10.3389/fneur.2015.00071.
- Sajatovic M, Ridgel AL, Walter EM, Tatsuoka CM, Colón-Zimmermann K, Ramsey RK, et al. A randomized trial of individual versus group-format exercise and self-management in individuals with Parkinson’s disease and comorbid depression. Patient Preference and Adherence. 2017; 11:965-73.
- Shin HW, Youn YC, Chung SJ, et al. Effect of high-frequency repetitive transcranial magnetic stimulation on major depressive disorder in patients with Parkinson's disease. J Neurol. 2016 Jul;263(7):1442-8. doi: 10.1007/s00415-016-8160-x. PubMed PMID: 27178002
- Skapinakis P, Bakola E, Salanti G, Lewis G, Kyritsis AP, Mavreas V. Efficacy and acceptability of selective serotonin reuptake inhibitors for the treatment of depression in Parkinson's disease: A systematic review and meta-analysis of randomized controlled trials. BMC Neurol. 2010;10:49. Doi: 10.1186/1471-2377-10-49.
- Starkstein SE, Brockman S. Management of depression in Parkinson's disease: A systematic review. Mov Disord Clin Pract. 2017;4(4):470-7. Doi: 10.1002/mdc3.12507.
- Takahashi M, Tabu H, Ozaki A, Hamano T, Takeshima T. Antidepressants for depression, apathy, and gait instability in Parkinson's disease: A multicenter randomized study. Intern Med. 2018. Doi: 10.2169/internalmedicine.1359-18.
- Troeung L, Egan SJ, Gasson N. A meta-analysis of randomised placebo-controlled treatment trials for depression and anxiety in Parkinson's disease. PLoS One. 2013;8(11):e79510. Doi: 10.1371/journal.pone.0079510.
- Troeung L, Egan SJ, Gasson N. A waitlist-controlled trial of group cognitive behavioural therapy for depression and anxiety in Parkinson's disease. BMC Psychiatry. 2014 Jan 27;14:19. doi: 10.1186/1471-244X-14-19. PubMed PMID: 24467781; PubMed Central PMCID: PMC3907935.
- Veazey C, Cook KF, Stanley M, Lai EC, Kunik ME. Telephone-administered cognitive behavioral therapy: a case study of anxiety and depression in Parkinson's disease. J Clin Psychol Med Settings. 2009 Sep;16(3):243-53. doi: 10.1007/s10880-009-9167-6. Epub 2009 Apr 29. PubMed PMID: 19404724.
- Wang HJ, Tan G, Zhu LN, Chen D, Xu D, Chu SS, et al. The efficacy of repetitive transcranial magnetic stimulation for Parkinson disease patients with depression. International Journal of Neuroscience.2018;1-24.
- Williams NR, Bentzley BS, Sahlem GL, Pannu J, Korte JE, Revuelta G, Short EB, George MS. Unilateral ultra-brief pulse electroconvulsive therapy for depression in Parkinson's disease. Acta Neurol Scand. 2017;135:407-411.
Evidence tabellen
Beschrijving van de systematische reviews en de daarin beschreven studies
|
Reviews → |
Troeung 2013 |
Qui 2014 |
Mills 2018 |
Liu 2013 |
Interventie |
Controle |
Uitkomstmaat depressie |
Uitkomstmaat kwaliteit van leven |
|
Studies ↓ |
||||||||
|
Anderson, 1980 |
x |
|
x |
|
nortriptyline |
placebo |
IDS-C, CGI-I |
- |
|
Antonini, 2006 |
x |
x* |
x |
x* |
amytriptyline |
sertraline |
HAM-D |
PDQ |
|
Avila, 2003 |
x |
|
x |
|
nefazodon |
fluoxetine |
BDI |
- |
|
Barone, 2006 |
x |
|
x |
x* |
sertraline |
pramipexol |
HAM-D, Zung SDS |
- |
|
Barone, 2010 |
x |
|
|
x* |
pramipexol |
placebo |
BDI |
Euroqol, PDQ |
|
Barone, 2015 |
|
|
x* |
|
rasagiline |
placebo |
BDI-IA |
PDQ |
|
Chung, 2016 |
|
|
|
|
rotigotine |
placebo |
HAM-D, BDI-II |
- |
|
Devos, 2008 |
x* |
x* |
x |
x* |
citalopram, desipramine |
placebo |
MADRS |
- |
|
Leentjens, 2003 |
x* |
|
x |
x* |
sertaline |
placebo |
MADRS |
- |
|
Menza, 2009 |
x* |
x* |
x* |
x* |
paroxetine, nortriptyline |
placebo |
HAM-D |
SF-36, PDQ |
|
Richard, 2012 |
x* |
|
x* |
x* |
paroxetine, venlafaxine |
placebo |
BDI-II, HAM-D |
- |
|
Rektorova, 2003 |
x |
|
|
x* |
pramipexol, pergolide nefazodon |
- |
MADRS, Zung SDS |
- |
|
Weintraub, 2010 |
x |
|
x |
x* |
atomoxetine |
placebo |
IDS-C, CGI |
- |
|
Wermuth, 1998 |
x* |
|
x* |
x* |
citalopram |
placebo |
HAM-D, MES, CGI |
- |
|
Werneck, 2009 |
x |
|
x* |
|
trazadon |
control |
HAM-D |
- |
|
Vergelijking meta-analyse of NMA |
SSRI en TCA versus. placebo |
SSRI versus. TCA |
NMA |
NMA |
|
|
|
|
BDI Beck Depression Index; CGI-I Clinical Global Impression Scale – Improvement; GDS Geriatric Depression Scale; HAM-D Hamilton Depression Scale; IDS-C Inventory of Depressive Symptomatology; MADRS Montgomery and Asberg Depression Rating Scale; MES melancholia scale; NHP Nothingham Health Profile; NMA netwerk meta-analyse; PDQ Parkinson’s Disease Questionnaire; Zung SDS Zung self-rating depression scale; X studie beschreven in de systematische review; X* studie meegenomen in meta-analyse
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 14-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk vijf jaar na de autorisatiedatum besluit het bestuur van de NVN om de richtlijn te updaten. In principe zullen de modules jaarlijks beoordeeld worden of deze nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Naast de ontwikkelde modules, is een aantal onderwerpen niet uitgewerkt in de huidige richtlijn. De werkgroep adviseert om deze op korte termijn alsnog te ontwikkelen omdat hier in de praktijk vraag naar is, te weten:
- urogenitale stoornissen;
- seksuele gezondheid;
- interacties tussen medicijnen ;
- visusstoornissen;
- orthostatische hypotensie;
- mond- en keelklachten;
- obstipatie.
Tabel 1 Geldigheid en onderhoud richtlijnmodules
|
Module |
Regiehou-der(s) |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Diagnostiek |
NVN |
NVN |
Nieuwe inzichten, veranderingen in zorg |
|
Medicamenteuze behandeling de Novo patiënt |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Medicamenteuze behandeling van motorische klachten en responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Geavanceerde therapieën voor responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN, NVvN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling houdingsproblematiek bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling valrisico bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Impulscontrolestoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Dopamine dysregulatie-stoornis bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Angststoornissen bij de ziekte van Parkinson |
NVN |
NVvP, NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Apathie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Depressie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Wanen en hallucinaties bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVKG |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Cognitieve stoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vermoeidheid bij de ziekte van Parkinson |
NVN |
NVN, NIP, NVKG |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Slaapstoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Pijnklachten bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Coping met de ziekte van Parkinson |
NVN |
NVN, V&VN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Werk en arbeidsongeschiktheid |
NVN |
NVAB |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Rijgeschiktheid |
NVN, VRA |
NVN, VRA |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Mantelzorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medicinale cannabis bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Mucuna Pruriens bij de ziekte van Parkinson |
NVN |
NVN, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vitamine B12 of D-suppletie bij de ziekte van Parkinson |
NVN |
NVN, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Multidisciplinaire revalidatieprogramma’s bij de ziekte van Parkinson |
VRA |
VRA, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Palliatieve zorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Advance care planning |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medische symptoombehandeling in de stervensfase |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
eHealth bij de ziekte van Parkinson |
NVN |
NVN |
Veranderingen in zorg |
|
Netwerkzorg, casemanagement en verwijscriteria |
NVN, VRA |
NVN, ParkinsonNet |
Veranderingen in zorg |
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlands Huisartsen Genootschap (NHG)
- Parkinson Vereniging (PV)
- Vereniging van Specialisten Ouderengeneeskunde (Verenso)
- Verpleegkundigen & Verzorgenden Nederland (V&VN)
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- Ergotherapie Nederland (EN)
- Nederlands Instituut van Psychologen (NIP)
- Nederlandse Vereniging van Diëtisten (NVD)
- ParkinsonNet, beroepsvereniging van professionals in sociaal werk (BPSW)
- Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB)
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVvS)
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
- Nederlandse Associatie Physician Assistants (NAPA)
- ParkinsonNet
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om een richtlijn te verkrijgen waarin de meeste recente (para)medische kennis omtrent de zorg voor patiënten met ziekte van Parkinson wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson te maken hebben.
Werkgroep
- Prof. dr. T. (Teus) van Laar (voorzitter), neuroloog, NVN
- Dr. A.J.W. (Agnita) Boon, neuroloog, NVN
- Dr. J.I. (Jorrit) Hoff, neuroloog, NVN
- Dr. M.L. (Mark) Kuijf, neuroloog, NVN
- Dr. A.G. (Alexander) Munts, neuroloog, NVN
- Dr. B. (Bart) Post, neuroloog, NVN
- Dr. G. (Gerrit) Tissingh, neuroloog, NVN (tot ..)
- Dr. F.J. (Erik) Slim, vicevoorzitter, revalidatiearts, VRA
- Drs. W.J. (Willem) Oudegeest, , revalidatiearts, VRA
- Drs. S.P. (Susan) Meuleman, revalidatiearts, VRA
- Prof. dr. O.A. (Odile) van den Heuvel, psychiater, NVvP
- Prof. dr. A.F.G. (Albert) Leentjens, psychiater, NVvP
- Dr. G. (Bert) Ziere, klinisch geriater, NVKG
- Drs. H.J. (Hannie) Scheper, specialist Ouderengeneeskunde, Verenso
- Dr. A.L. (Abram) Rutgers, huisarts, NHG
- Dr. A.A. (Annelien) Duits, klinisch neuropsycholoog, NIP
- H.H. (Herma) Lennaerts – Kats MSc, Parkinsonverpleegkundige, V&VN, ParkinsonNet
- T. (Tiny) van Wieren-Beerda MSc, verpleegkundig specialist parkinson, V&VN
- Drs. M.M. (Masja) van het Hoofd, beleidsmedewerker, Parkinson Vereniging
- Drs. K.C. (Kaie) Klaassen, patiënt-onderzoeker, Parkinson Vereniging
- Drs. M. (Marianne) Luinstra, ziekenhuisapotheker, NVZA
- Dr. M. (Marlies) van Nimwegen, fysiotherapeut (niet praktiserend), KNGF, ParkinsonNet
- Dr. I.H.W.M. (Ingrid) Sturkenboom, ergotherapeut, EN, ParkinsonNet
- K. (Karin) Overbeek-Dekker, diëtist, NVD, ParkinsonNet
- Dr. M. (Marten) Munneke, ParkinsonNet
Klankbordgroep
- Dr. J.G. (Hanneke) Kalf, logopedist, NVLF, ParkinsonNet
- K. (Klaas) Kooistra MSc, apotheker, KNMP
- P.R.I. (Paul) Rabsztyn, verpleegkundig seksuoloog SH (seksuologische hulpverlening) &VPO (voorlichting preventie en onderwijs), NVvS
- Dr. F.J.A. (Anton) Meijer, Neuro- en hoofd-hals radioloog, NVvR
- Prof. Dr. Y. (Yasin) Temel, neurochirurg, NVvN
- Drs. J.P. (Jacqueline) Janssen, Bedrijfsarts, klinisch arbeidsgeneeskundige, NVAB
- M. (Marlinda) Bakker, Geriatrisch maatschappelijk werker, BPSW
- Drs. A.L.A.J. (Danny) Hommel, specialist ouderengeneeskunde, Verenso
- Drs. H. (Hajo) Jongepier, huisarts, NHG
Met ondersteuning van
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. ir. N.L. (Nikita) van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Linda) Niesink-Boerboom, literatuurspecialist, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Guiterrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- S. (Sonja) Wouters, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Parkinson Vereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door stakeholderpartijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn ziekte van Parkinson (NVN, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens de invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). De zekerheid van het bewijs wordt beïnvloed door beperkingen in studieopzet- of uitvoering (risk of bias), imprecisie, inconsistentie, indirectheid en publicatiebias.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De formulering van de conclusies hangt af van de bewijskracht. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Netwerkzorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten in de bijlagen).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
