Behandeling van cognitieve stoornissen bij de ziekte van Parkinson
Uitgangsvraag
Hoe kunnen cognitieve stoornissen bij patiënten met de ziekte van Parkinson het beste worden behandeld?
De uitgangsvraag omvat de volgende deelvragen:
- Welke niet-medicamenteuze behandelingen zijn effectief in de behandeling van cognitieve stoornissen bij patiënten met de ziekte van Parkinson?
- Welke medicamenteuze behandelingen zijn effectief in de behandeling van cognitieve stoornissen bij patiënten met de ziekte van Parkinson?
Aanbeveling
Evalueer ten minste eenmaal per jaar, of eerder op indicatie, de ernst van de cognitieve klachten en beperkingen.
Sluit (andere) onderliggende pathologie uit en breng de cognitieve functies in kaart middels een cognitieve screeningstest (bij voorkeur de MOCA), dan wel uitgebreid neuropsychologisch onderzoek.
Staak waar mogelijk de anticholinerge medicatie en benzodiazepinen in verband met de ongunstige effecten op cognitie.
Faciliteer neuropsychologisch onderzoek indien er evidente cognitieve klachten aanwezig zijn en/of de cognitieve screening geen duidelijke afwijkingen laat zien, en/of diagnostische twijfel bestaat over de diagnose dementie.
Overweeg om compensatiestrategieën aan te leren bij patiënten met de ziekte van Parkinson middels ergotherapeuten of neuropsychologen, om de gevolgen in het dagelijks functioneren te beperken.
Overweeg een cognitieve functietraining bij patiënten met de ziekte van Parkinson die graag hun cognitieve prestaties willen verbeteren (ongeacht of er stoornissen zijn).
Start alleen bij de diagnose dementie met een cholinesteraseremmer. Biedt dit aan als er een licht tot matig ernstig dementie is, en heroverweeg deze medicatie bij ernstige dementie.
Betrek mantelzorgers en partners in de behandeling van patiënten met de ziekte van Parkinson en zorg ook voor ondersteuning van deze partner middels educatie en/of zelf-management training en/of case-management (zie module Mantelzorg).
Overweeg verwijzing voor multidisciplinaire revalidatie indien de patiënt meerdere hulpvragen heeft (zie module multidisciplinaire revalidatie).
Overwegingen
In de literatuursamenvatting worden alleen niet-medicamenteuze interventies beschreven die zich richten op het behandelen van cognitieve stoornissen bij patiënten met de ziekte van Parkinson. De effectiviteit van medicamenteuze behandelingen van een dementie bij de ziekte van Parkinson komt uitgebreid aan bod in de NICE guideline en alleen de belangrijkste bevindingen worden hier meegenomen.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Niet-medicamenteuze behandeling
In de drie geselecteerde en hierboven besproken studies zijn cognitieve stoornissen op 1 of meerdere domeinen als primaire uitkomst meegenomen in de analyse, om het effect van de interventie te toetsen. Hoewel diverse interventies in relatie tot verschillende uitkomstmaten (cognitieve domeinen en globale cognitie) zijn beschreven hebben deze allemaal een lage bewijskracht. Dit heeft voornamelijk te maken met het feit dat de studiegroepen erg klein zijn met daarbij een risico op bias omdat de metingen rondom de interventie niet geblindeerd werden uitgevoerd. Met deze lage bewijskracht is het moeilijk om een specifieke behandeling voor cognitieve stoornissen aan te bevelen. Daarbij gelden de gevonden effecten slechts voor de korte termijn en zijn geen langere termijn effecten onderzocht. In deze sectie worden in afweging van de literatuur, inclusief de niet-geselecteerde studies, meer generieke principes besproken die kunnen worden gevolgd wanneer een patiënt met de ziekte van Parkinson zich presenteert met cognitieve klachten en/of cognitieve stoornissen. Hierbij kunnen we ook denken aan preventieve interventies om een cognitieve achteruitgang voor te blijven dan wel uit te stellen.
Bij patiënten met de ziekte van Parkinson die zich met cognitieve klachten presenteren is het van belang om de cognitieve functies in kaart te brengen. Bij verdenking dementie kan eerst een Level 1 procedure (cognitieve screening of verkort standaard neuropsychologisch onderzoek) worden overwogen en alleen bij twijfel uitbreiding onderzoek middels de Level 2 procedure. De Level 2 procedure met minimaal 2 tests per cognitief domein voor de domeinen executieve functies, aandacht/tempo, geheugen, taal en visueel-ruimtelijke orientatie/visuo-spatiele functie biedt een goed uitgangspunt voor een eventuele behandeling. Zowel op stoornisniveau en op basis van het sterkte en zwakte profiel kan in overleg met de patiënt besproken worden of en welk type behandeling is geindiceerd en al dan niet wordt gewenst. In alle gevallen en voorafgaand aan alle behandelingen zullen de resultaten van het onderzoek inclusief de observaties uitgebreid worden nabesproken evenals de implicaties voor het dagelijks functioneren en advies hoe hier mee om te gaan (psychoeducatie). Niet medicamenteuze mogelijkheden voor behandeling betreffen naast psycho-educatie, cognitieve functietraining, strategie training en fysieke training. Cognitieve functie trainingen (Leung, 2015) en fysieke trainingen vooral die met een ‘aerobic’ component (Da Silva, 2018) zijn veelbelovend ten aanzien van het potentiele effect op de cognitie, werkgeheugen en de executieve functies in het bijzonder. Verder kunnen trainingen de ‘self-efficacy’ bevorderen: het gevoel te werken aan het verbeteren van de cognitie dan wel deze in stand te houden. Het aanbrengen van spelelementen met online aanbod in de thuissituatie kan de cognitieve functietraining aantrekkelijker maken en daarmee eventuele effecten langer in stand houden. Recent onderzochte strategietrainingen (onder andere Giguère-Rancourt, 2018; Vlagsma, 2018) met een voor de ziekte van Parkinson aangepaste Goal Attainment Trainingscomponent bieden perspectief wanneer het gaat om de uitvoerbaarheid en het verbeteren van subjectieve maten (beperkingen en participatie), maar verder onderzoek is nodig om uitspraken te kunnen doen over de effectiviteit.
Indien er geen cognitieve stoornissen worden gevonden, kunnen vermoeidheid en stemmingsproblemen ten grondslag liggen aan de cognitieve klachten die vervolgens leidend zullen zijn voor verder beleid.
Blijven bewegen is gunstig voor het motorisch functioneren maar de veronderstelling is dat voldoende bewegen ook de cognitieve achteruitgang in het algemeen kan afremmen. Hetzelfde geldt ook voor het blijven prikkelen van de nieuwsgierigheid en het actief blijven uitdagen van de cognitieve functies, variërend van lezen, kruiswoordpuzzels tot cognitieve functietrainingen die met een spelelement (game) extra aantrekkelijk kunnen zijn om structureel in te passen in het leefpatroon. Een gezonde levensstijl kan het risico op cognitieve achteruitgang (en dementie) mogelijk verminderen (Walton, 2017).
Tenslotte kan het betrekken van de partner in de behandeling van de patiënt het effect vergroten (Giguère-Rancourt, 2018). Daarbij kan het ondersteunen van de partner in het omgaan met de veranderingen die gepaard gaan met de ziekte van Parkinson ook weer bijdragen aan het welbevinden van de patiënt.
Medicamenteuze behandeling
De effectiviteit van medicamenteuze behandeling komt uitgebreid aan bod in de NICE guideline. Hiervoor is systematisch gezocht naar de effectiviteit van donepezil, galantamine, memantine, rivastigime, memantadine plus cholinesteraseremmer versus placebo of een andere behandeling. De belangrijkste conclusies hierbij waren:
Biedt een cholinesteraseremmer aan bij lichte tot matig ernstige dementie bij de ziekte van Parkinson en overweeg een cholinesteraseremmer bij een ernstige dementie bij de ziekte van Parkinson.
Waarden en voorkeuren van patiënten
Het is van belang om in samenspraak met de patiënt te komen tot een ideale behandelvorm die past bij de wensen en behoefte van de patiënt. Hoewel nog niet bewezen is het denkbaar dat vroegtijdig starten met cognitieve revalidatie zinvol zou kunnen zijn, ook wanneer er nog geen cognitieve stoornissen zijn. In het laatste geval zou de behandeling als preventieve interventie worden ingezet om cognitieve achteruitgang uit te stellen. Zodra er een diagnose dementie is gesteld kan in overleg met patiënt en partner/mantelzorger medicatie worden ingezet.
Cognitieve stoornissen gaan vaak samen met andere neuropsychiatrische stoornissen, onder andere verlies van initiatief (apathie), hallucinaties/wanen, punding, en axiale symptomen zoals spraak-balansstoornissen. De belasting voor de partners/mantelzorgers neemt in deze fase sterk toe en met name de neuropsychiatrische veranderingen zijn belastend. Patiënten veranderen en de communicatie wordt bemoeilijkt. Educatie voor patiënt maar vooral ook de omgeving, partner in bijzonder, is van belang. Casemanagement kan hierbij een belangrijke ondersteuningsvorm zijn en behulpzaam indien extra zorg is geïndiceerd, variërend van thuiszorg, respijtzorg, dagbesteding en dagbehandeling en uiteindelijk opname in een verpleeghuis.
Kosten
Fysieke training kan gecombineerd worden met de lopende fysio- en oefentherapie. Cognitieve functietrainingen in de thuissituatie al dan niet met een spelelement hebben mogelijk meer effect met een zogenaamde blended aanpak, maar vragen relatief weinig actieve inzet van zorgprofessionals (deels online en deels middels laagfrequent persoonlijk en/of tel contact). Cognitieve strategietraining binnen dagelijkse activiteiten kan geboden worden door de ergotherapie. Voor alle interventies geldt dat ze in de eerste lijn en binnen een revalidatiedagbehandeling kunnen worden aangeboden (ook in WLZ mogelijk) , zowel individueel als in groepen.
Haalbaarheid en implementatie
Het merendeel van de genoemde niet-medicamenteuze interventies is getoetst op haalbaarheid, maar het effect is vooralsnog niet bewezen en/of de bewijskracht is te laag. Implementatie met een goede voor- en nameting zou kunnen bijdragen aan de zogenaamde ‘best practice’ maar gerandomiseerde gecontroleerde studies met voldoende power zijn noodzakelijk voor het opnemen van ‘evidence based’ behandelingen in toekomstige richtlijnen.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Gelet op de literatuursamenvatting en de bovengenoemde overwegingen die naar voren komen vanuit het klinisch oogpunt, adviseert de werkgroep patiënten met de ziekte van Parkinson met cognitieve klachten allereerst goed in kaart te brengen alvorens te starten met behandelen. Sluit (andere) onderliggende pathologie en/of bijwerkingen medicatie uit alvorens over te gaan tot het neuropsychologisch traject. Verkort en/of uitgebreid neuropsychologisch onderzoek gaat vooraf aan een diagnose MCI of dementie. Alleen in geval van dementie kan medicatie worden aangeboden of overwogen. In overige gevallen, met of zonder cognitieve stoornissen, start met psycho-educatie op basis van het gevonden cognitieve profiel (wel/geen stoornissen en sterkten en zwakten) en bespreek de implicaties voor het dagelijks functioneren en adviseer hoe hier mee om te gaan. Afhankelijk van de hulpvraag kan aanvullend een niet-medicamenteuze behandeling worden aangeboden.
Onderbouwing
Achtergrond
Cognitieve stoornissen kunnen reeds vroeg aanwezig zijn in het beloop van de ziekte van Parkinson en het risico neemt toe met de leeftijd en ziekteduur. Het betreffen meestal stoornissen in aandacht, tempo en executief functioneren. Echter, het cognitieve profiel is heterogeen; zo komen ook stoornissen in het geheugen en visueel ruimtelijke oriëntatie voor. Een groot deel van de patiënten (48 tot 80%) ontwikkelt uiteindelijk een dementieel beeld. Vooralsnog zijn er nog weinig effectieve mogelijkheden om cognitieve stoornissen te behandelen. Cholinesteraseremmers zijn alleen effectief bevonden voor dementie bij de ziekte van Parkinson en niet voor lichte cognitieve stoornissen. Daarbij kunnen ze bijwerkingen sorteren en interfereren met de antiparkinsonmedicatie. Langzaam komt nu het onderzoek naar cognitieve revalidatie bij patiënten met de ziekte van Parkinson op gang. Cognitieve functietrainingen en vooral varianten met een spelelement (computergame) kunnen de cognitieve achteruitgang mogelijk afremmen mits patiënten blijven trainen, terwijl strategietrainingen zinvol zijn om te compenseren voor bestaande beperkingen. Daarnaast zien we de laatste jaren ook een trend, waarbij fysieke trainingen zoals danstherapie, spierkrachttraining en conditietraining (aerobics) worden ontwikkeld om het cognitief functioneren van patiënten met de ziekte van Parkinson te verbeteren. Cognitieve stoornissen kunnen veel invloed hebben op het dagelijks leven en het vermogen van parkinsonpatiënten om zich aan te passen aan een leven met tekorten en verlies. Daarom is het belangrijk om tot een optimale behandeling te komen om de invloed van cognitieve stoornissen te beperken en de progressie af te remmen. In deze module zal de plaats worden bepaald van verschillende behandelingen voor patiënten met de ziekte van Parkinson. Voor niet-medicamenteuze behandelingen is een systematische literatuuranalyse uitgevoerd. De medicamenteuze mogelijkheden voor het behandelen van dementie bij de ziekte van Parkinson zijn systematisch samengevat in de NICE guideline en de belangrijkste bevindingen zullen in deze module worden meegenomen.
De herkenning van cognitieve stoornissen
De variatie in cognitieve stoornissen en de mate waarin deze invloed hebben op het dagelijks functioneren behoeven eenduidigheid. Internationale initiatieven (Movement Disorders Society, MDS) hebben geleid tot criteria en richtlijnen voor de diagnostiek van Mild Cognitive Impairment (MCI) en dementie bij de ziekte van Parkinson. Uitgangspunten voor deze criteria zijn de diagnose ziekte van Parkinson en de aanwezigheid van cognitieve stoornissen waarvan in geval van MCI (zie Box 1) (Litvan, 2012) de ernst niet zodanig is, dat patiënten niet meer onafhankelijk kunnen functioneren. Zodra er wel interferentie is met zelfstandig dagelijks functioneren en activiteiten wegvallen dan wel taken moeten worden overgenomen kan gedacht worden aan een dementieel beeld (zie Box 2) (Emre, 2007). Observatieinstrumenten zoals de Assessment of Motor and Process Skills (AMPS), de Allen Cognitive Level Screen (ACLS), en/of de Perceive Recall Plan perform (PRPP) kunnen door een ergotherapeut worden gebruikt om aanvullende informatie te verkrijgen aangaande signalering van cognitieve problematiek.
In aansluiting op deze criteria hebben de internationale MDS werkgroepen ook aanbevelingen gedaan voor de diagnostische procedures op ‘Level 1 en 2’ niveau (Dubois, 2007). Level 1 procedures kunnen worden uitgevoerd door de behandelend specialist zelf en vragen geen expertise in de neuropsychologische diagnostiek. Level 2 procedures vragen daarentegen wel expertise van de (klinisch) neuropsycholoog waarbij een (uitgebreid) standaard testonderzoek wordt uitgevoerd. De testbatterij bevat minimaal twee tests binnen elk van de volgende vijf domeinen: aandacht en werkgeheugen, executieve functies, taal, geheugen en visuospatiele functies. Binnen Level 2 kunnen MCI-subtypes worden vastgesteld: ‘single versus multiple-domain’, waarbij er respectievelijk een stoornis moet zijn op twee tests in een enkel domein of een stoornis op ten minste een enkele test in twee of meerdere domeinen. Binnen deze subtypes kan dan weer het onderscheid worden gemaakt tussen wel en geen geheugenstoornissen (wel en niet amnestische MCI). In de criteria wordt de grens van een afwijkende score gesteld op 1 tot 2 SD onder het gemiddelde (de norm) en een stoornis kan ook worden vastgesteld op basis van een significante afname bij herhaald testen of een significante afname ten op zichte van het geschat premorbide functioneren. Validatie van de MCI-criteria en afwijkende scores in het bijzonder, wordt momenteel uitgevoerd door wederom een internationale werkgroep (Geurtsen, 2014). De Level 1 procedure betreft een cognitieve screening met een afkapscore, of een verkort standaard neuropsychologisch onderzoek (1 test per cognitief domein). Een veel gebruikt screeningsinstrument naast de MMSE en gevalideerd voor de ziekte van Parkinson is de Montreal Cognitive Assessment (MoCA) (Nazem, 2009).
De Level 1 procedure kan voldoende informatie opleveren om de diagnose dementie te stellen en te voorspellen (Hoogland, 2019). Een standaard neuropsychologisch onderzoek door een (klinisch) neuropsycholoog (Level 2) dient te worden aangevraagd, indien er evidente cognitieve klachten aanwezig zijn en/of de screening geen duidelijke afwijkingen laat zien, en/of indien diagnostische twijfel bestaat over de diagnose dementie.
Indien sprake is van een cognitief profiel passend bij dementie dient de behandelend specialist onderzoek in te zetten naar alle potentieel behandelbare aandoeningen die de cognitieve achteruitgang mede kunnen veroorzaken (onder andere delier). Hierbij dient hij op indicatie gebruik te maken van beeldvorming en aanvullend laboratoriumonderzoek.
Naast de genoemde Level 1 en 2 procedures zijn er ook observatiemethoden voor het signaleren van cognitieve stoornissen. Paramedici en ergotherapeuten in het bijzonder kunnen toegepaste cognitie in het handelen observeren en meten met behulp van ecologisch valide instrumenten zoals de Assessment of Motor and Process Skills en/of de Perceive Recall Plan perform- assessment (richtlijn Ergotherapie bij de ziekte van Parkinson).
Box 1 Criteria MCI (Litvanea)
|
De diagnose parkinson MCI berust op de volgende basiskenmerken:
|
UK PDS = United Kingdom Parkinson’s Disease Society
Box 2 Criteria Parkinsondementie(Emreea)
|
De diagnose parkinsondementie berust op de volgende basiskenmerken:
Een gedragsstoornis is niet obligaat voor de diagnose, maar de aanwezigheid van tenminste 1 gedragsstoornis (zoals visuele hallucinaties, wanen, agitatie, excessieve slaperigheid overdag, depressie, angst of apathie) maakt de diagnose parkinsondementie waarschijnlijker. Bij een lewy body dementie (LBD) gaan de typische kernsymptomen van een LBD (zoals wanen of hallucincaties, vallen, orthostatische hypotensie) voorafgaand aan de motorische stoornissen. |
UK PDS = United Kingdom Parkinson’s Disease Society; MMSE = Mini Mental State Examination.
Conclusies / Summary of Findings
|
Laag GRADE |
Cognitieve training verbetert mogelijk het executief functioneren bij patiënten met de ziekte van Parkinson met cognitieve stoornissen.
Bronnen: (Costa, 2014; Paris, 2013) |
|
Laag GRADE |
Cognitieve training lijkt de aandacht/ het werkgeheugen niet te verbeteren bij patiënten met de ziekte van Parkinson met cognitieve stoornissen.
Bronnen: (Costa, 2014; Nombela, 2011; Paris, 2013) |
|
Laag GRADE |
Cognitieve training lijkt in vergelijking met een controle behandeling het geheugen niet te verbeteren bij patiënten met de ziekte van Parkinson met cognitieve stoornissen.
Bronnen: (Paris, 2013) |
|
Laag GRADE |
Cognitieve training verbetert mogelijk de visuo-spatiële functies bij patiënten met Parkinson met cognitieve stoornissen.
Bronnen: (Paris, 2013) |
|
Laag GRADE |
Cognitieve training lijkt in vergelijking met een controle behandeling de globale cognitie niet te verbeteren bij patiënten met de ziekte van Parkinson met cognitieve stoornissen.
Bronnen: (Paris, 2013) |
|
Geen GRADE |
Cholinesteraseremmers verbeteren mogelijk het cognitief functioneren van patiënten met een dementie bij de ziekte van Parkinson.
Bronnen: (NICE Guideline, 2017) |
|
Geen GRADE |
Cholinesteraseremmers verbeteren mogelijk het globaal functioneren van patiënten met een dementie bij de ziekte van Parkinson.
Bronnen: (NICE Guideline, 2017) |
|
Geen GRADE |
Memantine lijkt het cognitief functioneren niet te verbeteren bij patiënten met een dementie bij de ziekte van Parkinson.
Bronnen: (NICE Guideline, 2017) |
|
Geen GRADE |
Memantine lijkt het globaal functioneren niet te verbeteren bij patiënten met een dementie bij de ziekte van Parkinson.
Bronnen: (NICE Guideline, 2017) |
Samenvatting literatuur
Niet-medicamenteuze interventies
Cognitieve training versus placebo
De systematische review van Lawrence (2017) dekt de literatuur tot en met 2014 en includeert gerandomiseerd onderzoek naar het effect van niet-medicamenteuze, cognitieve trainingen bij patiënten met de ziekte van Parkinson. Alleen de studies in Lawrence (2017) die patiënten hebben geïncludeerd met cognitieve stoornissen komen in aanmerking voor de literatuuranalyse. Drie RCT’s beschrijven het effect van cognitieve trainingen op de cognitieve vermogens van patiënten met de ziekte van Parkinson met cognitieve stoornissen (Costa, 2014; Nombela, 2011; Paris, 2011). Figuur 1 geeft een overzicht van de patiëntpopulatie en de belangrijkste cognitieve domeinen die zijn geëvalueerd. Costa (2014) maakte gebruik van een dubbelgeblindeerd onderzoeksdesign om te onderzoeken of een cognitieve training (n=9) voor een periode van vier weken, met een behandelduur van 9 uur, effect heeft op het executief functioneren en het werkgeheugen bij patiënten met de ziekte van Parkinson direct na de interventie. Patiënten in de controlegroep kregen een placebo-interventie waarin zij spraak- en ademhalingsoefeningen kregen (n=8). De studie van Nombela (2011) onderzocht het effect van cognitieve revalidatie op het cognitief functioneren van patiënten met de ziekte van Parkinson, direct na de interventie. Patiënten in de cognitieve revalidatiegroep kregen voor een periode van 6 maanden gemiddeld 46 uur cognitieve training (n=10). De controlegroep bestond uit gezonde leeftijds-gematchte controlepersonen die dezelfde training kregen aangeboden (n=10). De belangrijkste primaire uitkomst was de score op de Strooptest waarmee aandacht werd onderzocht. Paris (2011) evalueerde de effectiviteit van een cognitieve training op het cognitief functioneren in patiënten met de ziekte van Parkinson direct na de interventie. De cognitieve trainingsgroep (n=16) kreeg voor een periode van vier weken drie keer per week 45 minuten cognitieve vaardigheidstraining en de controlegroep kreeg spraaktherapie. Paris onderzocht het effect van de training op de volgende cognitieve domeinen: globale cognitie, executief functioneren, aandacht/werkgeheugen, geheugen, visuo-spatieel functioneren en taal.
Figuur 1 Overzicht van de geïncludeerde studies in de systematische review van Lawrence, 2017
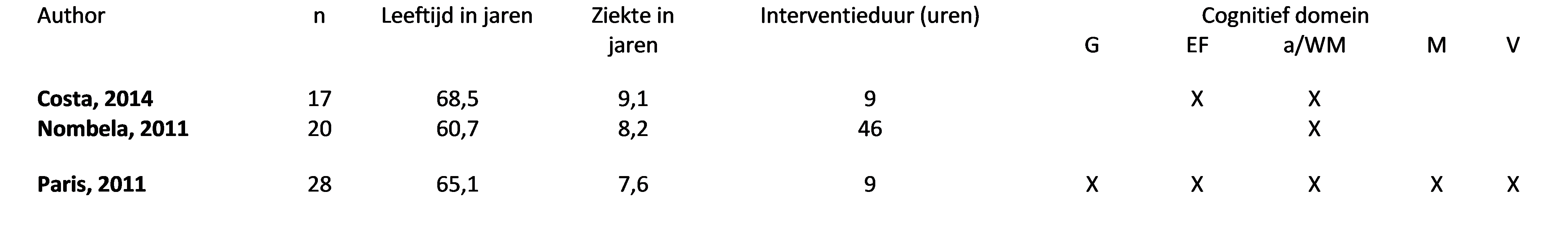
NOTE: G=globale cognitie; EF= executief functioneren; A/WM= aandacht en werkgeheugen; M= geheugen; V= visuospatiele functie; L= taal. Bron: Lawrence, 2017 (Table 4.19).
Executief functioneren
Het effect van cognitieve training op het executief functioneren is onderzocht in twee studies (Costa, 2014; Paris, 2013). Gezien de methodologische heterogeniteit is het niet mogelijk om de uitkomsten van beide studies te poolen. Costa (2014) laat middels een ANOVA analyse zien dat cognitieve training het executief functioneren verbetert, Treatment X Time interactie effect: Hedge’s g = 0,56; 95%BI -0,30 tot 1,43, maar er is geen significant verschil tussen de beide groepen. Paris (2013) laat ook middels een ANOVA analyse zien dat een cognitieve training het executief functioneren verbetert, Treatment X Time interactie effect: g=0,85; 95%BI 0,15 tot 1,56, met een statistisch significant verschil in het voordeel van de cognitieve trainingsgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat executief functioneren startte op hoog gezien de gecontroleerde studieopzet en is met één niveau verlaagd vanwege imprecisie (te geringe studieomvang) en met nog één niveau vanwege beperkingen in de onderzoeksopzet (risico op bias). De bewijskracht is laag.
Aandacht/werkgeheugen
Het effect van een cognitieve training op aandacht/ werkgeheugen is onderzocht in drie studies (Costa, 2014; Nombela, 2011; Paris, 2013). Gezien de methodologische heterogeniteit is het niet mogelijk om de uitkomsten van de studies te poolen. Costa (2014) laat middels een ANOVA analyse zien dat cognitieve training de aandacht/ werkgeheugen niet verbetert, Treatment X Time interactie effect: g=0,46 (95%BI -0,41 tot 1,33) en geen significant verschil tussen beide groepen. Paris (2013) laat middels een ANOVA analyse zien dat een cognitieve training de aandacht/ het werkgeheugen niet verbetert, Treatment X Time interactie effect: g=0,54 (95%BI -0,13 tot 1,22) en geen statistisch significant verschil tussen beide groepen. Nombela (2011) vindt ook geen verbetering, Treatment X Time interactie effect: g= -0,33 (95%BI -1,38; 0,72) en geen statistisch significant verschil tussen de cognitieve trainingsgroep en de controlegroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aandacht/werkgeheugen startte op hoog gezien de gecontroleerde studieopzet en is met één niveau verlaagd vanwege imprecisie (te geringe studieomvang) en met nog één niveau vanwege beperkingen in onderzoeksopzet (risico op bias). De bewijskracht is laag.
Geheugen
Het effect van een cognitieve training op het geheugen is onderzocht in één studie (Paris, 2013). Paris (2013) laat middels een ANOVA analyse zien dat een cognitieve training het geheugen niet verbetert, Treatment X Time interactie effect: g= 0,37 (95%BI -0,30 tot 1,04) en er is geen statistisch significant verschil tussen beide groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat geheugen startte op hoog gezien de gecontroleerde studieopzet en is met één niveau verlaagd vanwege imprecisie (te geringe studieomvang) en met nog één niveau vanwege beperkingen in onderzoeksopzet (risico op bias). De bewijskracht is laag.
Visuo-spatiele functie
Het effect van een cognitieve training op de visuo-spatiele functie is onderzocht in één studie (Paris, 2013). Paris (2013) laat middels een ANOVA analyse zien dat een cognitieve training de visuo-spatiele functie verbetert, Treatment X Time interactie effect: g= 0,89 (95%BI 0,12 tot 1,64) met een statistisch significant verschil in het voordeel van de trainingsgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat visuo-spatiele functie startte op hoog gezien de gecontroleerde studieopzet en is met één niveau verlaagd vanwege imprecisie (te geringe studieomvang) en met nog één niveau vanwege beperkingen in onderzoeksopzet (risico op bias). De bewijskracht is laag.
Globale cognitie
Het effect van een cognitieve training op de globale cognitie is onderzocht in één studie (Paris, 2013). Paris (2013) laat middels een ANOVA analyse zien dat een cognitieve training de globale cognitie niet verbetert, Treatment X Time interactie effect: g=0,39; 95%BI (-0,31 tot 1,08) en geen statistisch significant verschil tussen beide groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat visuo-spatiele functie startte op hoog gezien de gecontroleerde studieopzet en is met één niveau verlaagd vanwege imprecisie (te geringe studieomvang) en met nog één niveau vanwege beperkingen in onderzoeksopzet (risico op bias). De bewijskracht is laag.
Medicamenteuze interventies
De systematische literatuurzoekactie in deze module richtte zich alleen op (de effectiviteit van) niet-medicamenteuze behandelingen van cognitieve stoornissen bij de ziekte van Parkinson. De effectiviteit van medicamenteuze behandelingen komt uitgebreid aan bod in de NICE guideline. Hiervoor is systematisch gezocht naar de effectiviteit van donepezil, galantamine, memantine, rivastigime, memantine plus cholinesteraseremmer versus placebo of een andere behandeling bij patienten met een dementie geassocieerd met de ziekte van Parkinson. Dementie werd veelal gemeten met cognitieve screeningsinstrumenten (Level 1 procedure) onder andere de Mini Mental State Examination (MMSE) en de Alzheimers’ Disease Assessment Scale-Cog (ADAS-Cog). De belangrijkste bevindingen waren:
Cholinesteraseremmers versus placebo
Cognitief functioneren
Het effect van cholinesteraseremmers op het cognitief functioneren is onderzocht in vier studies (McKeith, 2000; Aarsland, 2002; Dubois, 2012; Leroy, 2014; Ravina, 2005). Cholinesteraseremmers verbeteren, in vergelijking met placebo, het cognitief functioneren, gemeten met de MMSE (MD=1,36; 95%BI 0,95 tot 1,77). Verder laten drie studies zien dat cholinesteraseremmers, in vergelijking met placebo, het cognitief functioneren verbeteren maar dan gemeten met de ADAS-Cog (MD= -2,28; 95%BI -3,40 tot -1,15).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat cognitief functioneren zal niet worden gegradeerd middels de GRADE-methodiek omdat deze resultaten zijn overgenomen uit de NICE-guideline (2017).
Globaal functioneren
Het effect van cholinesteraseremmers op globaal cognitief functioneren is onderzocht in vier studies (McKeith, 2000; Ravina, 2005; Aarsland, 2002; Emre , 2004). Cholinesteraseremmers verbeteren, in vergelijking met placebo, het globale functioneren, gemeten met verschillende instrumenten (SMD= -0,30; 95%BI -0,42 tot -0,17).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat globaal cognitief functioneren zal niet worden gegradeerd middels de GRADE-methodiek omdat deze resultaten zijn overgenomen uit de NICE-guideline (2017).
Memantine versus placebo
Cognitief functioneren
Het effect van memantine op het cognitief functioneren is onderzocht in één studie (Emre, 2010). Memantine verbetert, in vergelijking met placebo, niet het cognitief functioneren, gemeten met de MMSE.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat cognitief functioneren zal niet worden gegradeerd middels de GRADE-methodiek omdat deze resultaten zijn overgenomen uit de NICE-guideline (2017).
Globaal functioneren
Het effect van memantine op globaal cognitief functioneren is onderzocht in één studie Emre (2010) Memantine verbetert, in vergelijking met placebo, niet het globaal functioneren, (MD= -0,20; 95%BI= -0,69 tot 0,29).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat globaal cognitief functioneren zal niet worden gegradeerd middels de GRADE-methodiek omdat deze resultaten zijn overgenomen uit de NICE-guideline (2017).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
‘Wat zijn de effecten van niet-medicamenteuze behandelingen op het cognitief functioneren bij patiënten met de ziekte van Parkinson?’
P: patiënten met de ziekte van Parkinson met cognitieve stoornissen;
I: cognitieve training, cognitieve revalidatie, functie- en strategietraining, (partner)educatie;
C: reguliere zorg, placebo-interventie;
O: globale cognitie, cognitie op domein (executief functioneren, aandacht, verwerkingssnelheid, geheugen), psychiatrische symptomen (depressie, angst, apathie), kwaliteit van leven, functionele uitkomsten, welbevinden partner, mantelzorglast.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 01 augustus 2018 met relevante zoektermen gezocht naar studies die interventies beschrijven voor cognitieve stoornissen bij patiënten met de ziekte van Parkinson. De niet-medicamenteuze interventies werden meegenomen in deze literatuurzoekactie. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 434 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerd gecontroleerd onderzoek waarin de PICO is onderzocht, met beschrijving van minimaal één van bovengenoemde uitkomstmaten, beschreven in het Engels of in het Nederlands. Reviews werden geselecteerd op grond van de volgende selectiecriteria: zoekactie in tenminste twee databases, een objectieve en transparante selectieprocedure en een heldere synthese van de resultaten die aansluiten bij de PICO van deze uitgangsvraag. Op basis van titel en abstract werden onafhankelijk, door twee beoordelaars in eerste instantie 35 studies geselecteerd voor full-tekst selectie. Na raadpleging van de volledige tekst, werden vervolgens 32 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en drie studies definitief geselecteerd. Drie onderzoeken zijn opgenomen in de systematische literatuuranalyse (Lawrence, 2017; Da Silva, 2018; Silveira, 2018). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen. Twee recente en kwalitatief goede reviews werden als uitgangspunt gebruikt voor de uitwerking van de literatuur en aangevuld met recente studies, gepubliceerd na de searchdatum van de SR’s (Da Silva, 2018; Lawrence, 2017; Silveira, 2018). Drie onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Da Silva FC, Lop RDR, de Oliveira LC, et al. Effects of physical exercise programs on cognitive function in Parkinson's disease patients: A systematic review of randomized controlled trials of the last 10 years. PLoS One. 2018;13(2):e0193113. Published 2018 Feb 27.
- Dubois B, Burn D, Goetz C, Aarsland D, Brown RG, Broe GA, Dickson D, Duyckaerts C, Cummings J, Gauthier S, Korczyn A, Lees A, Levy R, Litvan I, Mizuno Y, McKeith IG, Olanow CW, Poewe W, Sampaio C, Tolosa E, Emre M. Diagnostic procedures for Parkinson's disease dementia: recommendations from the movement disorder society task force. Mov Disord. 2007;22(16), 2314-24.
- Emre M, Aarsland D, Brown R, Burn DJ, Duyckaerts C, Mizuno Y, Broe GA, Cummings J, Dickson DW, Gauthier S, Goldman J, Goetz C, Korczyn A, Lees A, Levy R, Litvan I, McKeith I, Olanow W, Poewe W, Quinn N, Sampaio C, Tolosa E, Dubois B. Clinical diagnostic criteria for dementia associated with Parkinson's disease. Mov Disord. 2007;22(12):1689-1707.
- Geurtsen GJ, Hoogland J, Goldman JG, et al. Parkinson’s disease mild cognitive impairment: application and validation of the criteria. J Parkinsons Dis 2014;4:131-137.
- Giguère-Rancourt A, Plourde M, Doiron M, Langlois M, Dupré N, Simard M (2018) Goal management training ® home-based approach for mild cognitive impairment in Parkinson’s disease: a multiple baseline case report, Neurocase, 24:5-6, 276-286.
- Hoogland, J. , Boel, J. A., Bie, R. M., Schmand, B. A., Geskus, R. B., Dalrymple‐Alford, J. C., Marras, C. , Adler, C. H., Weintraub, D. , Junque, C. , Pedersen, K. F., Mollenhauer, B. , Goldman, J. G., Tröster, A. I., Burn, D. J., Litvan, I. , Geurtsen, G. J. and , (2019), Risk of Parkinson's disease dementia related to level I MDS PD‐MCI. Mov Disord., 34: 430-435.
- Lawrence BJ, Gasson N, Bucks RS, Troeung L, Loftus AM. Cognitive Training and Noninvasive Brain Stimulation for Cognition in Parkinson's Disease: A Meta-analysis. Neurorehabil Neural Repair. 2017 Jul;31(7):597-608. doi: 10.1177/1545968317712468. Epub 2017 Jun 5. Review. PubMed PMID: 28583011.
- Leung IHK, Walton CC, Hallock H, Lewis SJG, Valenzuela M, Lampit A. Cognitive training in Parkinson disease: A systematic review and meta-analysis. Neurology. 2015 Oct 30.
- Litvan I, Goldman JG, Tröster AI, Schmand BA, Weintraub D, Petersen RC, Mollenhauer B, Adler CH, Marder K, Williams-Gray CH, Aarsland D, Kulisevsky J, Rodriguez-Oroz MC, Burn DJ, Barker RA, Emre M. Diagnostic Criteria for Mild Cognitive Impairment in Parkinson’s Disease: Movement Disorder Society Task Force Guidelines. Mov Disord. 2012;27(3):349-56.
- Nazem S, Siderowf AD, Duda JE et al (2009) Montreal cognitive assessment performance in patients with Parkinson’s disease with ‘normal’ global cognition according to Mini-Mental State Examination Score. J Am Geriatr Soc 57:304–308
- Reuter (2012). Group A received cognitive training only, while group B took part in a transfer training and a cognitive training. Group C conducted a cognitive training, and transfer and psychomotor trainings.
- Silveira CRA, Roy EA, Intzandt BN, Almeida QJ. Aerobic exercise is more effective than goal-based exercise for the treatment of cognition in Parkinson's disease. Brain Cogn. 2018 Apr;122:1-8. doi: 10.1016/j.bandc.2018.01.002. Epub 2018 Jan 10. PubMed PMID: 29331916.
- Sturkenboom IHWM, Thijssen MCE, Gons-van de Elsacker JJ, Jansen IJH, Maasdam, Schulten M, Vijver-Visser D, Steultjens EJM, Bloem BR, Munneke M. Ergotherapie bij de van Parkinson, een richtlijn van Ergo- therapie Nederland, Utrecht/Den Haag: Ergotherapie Nederland/Uitgeverij Lemma, 2008
- Vlagsma TT, Duits AA, Dijkstra HT, van Laar T,Spikman JM (2018): Effectiveness of ReSET; a strategic executive treatment for executive dysfunctioning in patients with Parkinson’s disease, Neuropsychological Rehabilitation,
- Walton CC, Naismith SL, Lampit A, Mowszowski L, Lewis SJ. Cognitive Training in Parkinson's Disease. Neurorehabil Neural Repair. 2017 Mar;31(3):207-216
- https://www.nice.org.uk/guidance/ng71/chapter/Recommendations#non-pharmacological-management-of-motor-and-non-motor-symptoms
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 14-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk vijf jaar na de autorisatiedatum besluit het bestuur van de NVN om de richtlijn te updaten. In principe zullen de modules jaarlijks beoordeeld worden of deze nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Naast de ontwikkelde modules, is een aantal onderwerpen niet uitgewerkt in de huidige richtlijn. De werkgroep adviseert om deze op korte termijn alsnog te ontwikkelen omdat hier in de praktijk vraag naar is, te weten:
- urogenitale stoornissen;
- seksuele gezondheid;
- interacties tussen medicijnen ;
- visusstoornissen;
- orthostatische hypotensie;
- mond- en keelklachten;
- obstipatie.
Tabel 1 Geldigheid en onderhoud richtlijnmodules
|
Module |
Regiehou-der(s) |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Diagnostiek |
NVN |
NVN |
Nieuwe inzichten, veranderingen in zorg |
|
Medicamenteuze behandeling de Novo patiënt |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Medicamenteuze behandeling van motorische klachten en responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Geavanceerde therapieën voor responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN, NVvN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling houdingsproblematiek bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling valrisico bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Impulscontrolestoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Dopamine dysregulatie-stoornis bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Angststoornissen bij de ziekte van Parkinson |
NVN |
NVvP, NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Apathie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Depressie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Wanen en hallucinaties bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVKG |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Cognitieve stoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vermoeidheid bij de ziekte van Parkinson |
NVN |
NVN, NIP, NVKG |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Slaapstoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Pijnklachten bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Coping met de ziekte van Parkinson |
NVN |
NVN, V&VN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Werk en arbeidsongeschiktheid |
NVN |
NVAB |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Rijgeschiktheid |
NVN, VRA |
NVN, VRA |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Mantelzorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medicinale cannabis bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Mucuna Pruriens bij de ziekte van Parkinson |
NVN |
NVN, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vitamine B12 of D-suppletie bij de ziekte van Parkinson |
NVN |
NVN, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Multidisciplinaire revalidatieprogramma’s bij de ziekte van Parkinson |
VRA |
VRA, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Palliatieve zorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Advance care planning |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medische symptoombehandeling in de stervensfase |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
eHealth bij de ziekte van Parkinson |
NVN |
NVN |
Veranderingen in zorg |
|
Netwerkzorg, casemanagement en verwijscriteria |
NVN, VRA |
NVN, ParkinsonNet |
Veranderingen in zorg |
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlands Huisartsen Genootschap (NHG)
- Parkinson Vereniging (PV)
- Vereniging van Specialisten Ouderengeneeskunde (Verenso)
- Verpleegkundigen & Verzorgenden Nederland (V&VN)
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- Ergotherapie Nederland (EN)
- Nederlands Instituut van Psychologen (NIP)
- Nederlandse Vereniging van Diëtisten (NVD)
- ParkinsonNet, beroepsvereniging van professionals in sociaal werk (BPSW)
- Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB)
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVvS)
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
- Nederlandse Associatie Physician Assistants (NAPA)
- ParkinsonNet
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om een richtlijn te verkrijgen waarin de meeste recente (para)medische kennis omtrent de zorg voor patiënten met ziekte van Parkinson wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson te maken hebben.
Werkgroep
- Prof. dr. T. (Teus) van Laar (voorzitter), neuroloog, NVN
- Dr. A.J.W. (Agnita) Boon, neuroloog, NVN
- Dr. J.I. (Jorrit) Hoff, neuroloog, NVN
- Dr. M.L. (Mark) Kuijf, neuroloog, NVN
- Dr. A.G. (Alexander) Munts, neuroloog, NVN
- Dr. B. (Bart) Post, neuroloog, NVN
- Dr. G. (Gerrit) Tissingh, neuroloog, NVN (tot ..)
- Dr. F.J. (Erik) Slim, vicevoorzitter, revalidatiearts, VRA
- Drs. W.J. (Willem) Oudegeest, , revalidatiearts, VRA
- Drs. S.P. (Susan) Meuleman, revalidatiearts, VRA
- Prof. dr. O.A. (Odile) van den Heuvel, psychiater, NVvP
- Prof. dr. A.F.G. (Albert) Leentjens, psychiater, NVvP
- Dr. G. (Bert) Ziere, klinisch geriater, NVKG
- Drs. H.J. (Hannie) Scheper, specialist Ouderengeneeskunde, Verenso
- Dr. A.L. (Abram) Rutgers, huisarts, NHG
- Dr. A.A. (Annelien) Duits, klinisch neuropsycholoog, NIP
- H.H. (Herma) Lennaerts – Kats MSc, Parkinsonverpleegkundige, V&VN, ParkinsonNet
- T. (Tiny) van Wieren-Beerda MSc, verpleegkundig specialist parkinson, V&VN
- Drs. M.M. (Masja) van het Hoofd, beleidsmedewerker, Parkinson Vereniging
- Drs. K.C. (Kaie) Klaassen, patiënt-onderzoeker, Parkinson Vereniging
- Drs. M. (Marianne) Luinstra, ziekenhuisapotheker, NVZA
- Dr. M. (Marlies) van Nimwegen, fysiotherapeut (niet praktiserend), KNGF, ParkinsonNet
- Dr. I.H.W.M. (Ingrid) Sturkenboom, ergotherapeut, EN, ParkinsonNet
- K. (Karin) Overbeek-Dekker, diëtist, NVD, ParkinsonNet
- Dr. M. (Marten) Munneke, ParkinsonNet
Klankbordgroep
- Dr. J.G. (Hanneke) Kalf, logopedist, NVLF, ParkinsonNet
- K. (Klaas) Kooistra MSc, apotheker, KNMP
- P.R.I. (Paul) Rabsztyn, verpleegkundig seksuoloog SH (seksuologische hulpverlening) &VPO (voorlichting preventie en onderwijs), NVvS
- Dr. F.J.A. (Anton) Meijer, Neuro- en hoofd-hals radioloog, NVvR
- Prof. Dr. Y. (Yasin) Temel, neurochirurg, NVvN
- Drs. J.P. (Jacqueline) Janssen, Bedrijfsarts, klinisch arbeidsgeneeskundige, NVAB
- M. (Marlinda) Bakker, Geriatrisch maatschappelijk werker, BPSW
- Drs. A.L.A.J. (Danny) Hommel, specialist ouderengeneeskunde, Verenso
- Drs. H. (Hajo) Jongepier, huisarts, NHG
Met ondersteuning van
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. ir. N.L. (Nikita) van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Linda) Niesink-Boerboom, literatuurspecialist, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Guiterrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- S. (Sonja) Wouters, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Parkinson Vereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door stakeholderpartijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn ziekte van Parkinson (NVN, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens de invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). De zekerheid van het bewijs wordt beïnvloed door beperkingen in studieopzet- of uitvoering (risk of bias), imprecisie, inconsistentie, indirectheid en publicatiebias.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De formulering van de conclusies hangt af van de bewijskracht. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Netwerkzorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten in de bijlagen).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.

