Multidisciplinaire revalidatieprogramma’s bij de ziekte van Parkinson
Uitgangsvraag
Wat is de effectiviteit van multidisciplinaire revalidatieprogramma’s in de behandeling van patiënten met de ziekte van Parkinson?
Aanbeveling
Overweeg een (poli)klinisch multidisciplinair revalidatieprogramma bij patiënten met de ziekte van Parkinson indien sprake is van:
- Complexe problematiek mogelijk veroorzaakt door co-morbide aandoeningen (zoals CVA, diabetische voetproblemen, status na totale heupprothese, rugklachten, chronische pijnklachten, degeneratieve afwijkingen, cognitieve stoornissen).
- een meervoudige hulpvraag en problemen op het gebied van functies, activiteiten, participatie en problemen op het gebied van persoonlijke factoren en/of externe factoren (overweeg bij WPB-niveau 3-4).
- En mits voldoende belastbaar om een intensief (poli)klinisch revalidatietraject te volgen.
Verwijs patiënten met een lage belastbaarheid maar wel geïndiceerd voor (poli)klinische multidisciplinaire revalidatie naar de geriatrische revalidatiezorg (GRZ), gespecialiseerde dagbehandeling of organiseer behandeling aan huis.
Screen en inventariseer de problemen op de verschillende domeinen van het dagelijks functioneren. Bij hulpvragen op meerdere domeinen verwijs naar passende multidisciplinaire behandeling.
Zorg voor afstemming in een multidisciplinair overleg indien meerdere disciplines betrokken zijn en prioriteer de behandeldoelen.
Overweeg bij complexe problematiek een multidisciplinair behandelteam in te schakelen voor een multidisciplinaire analyse.
Evalueer gemeenschappelijk de voortgang van de behandelingen met de betrokken behandelaars.
Informeer de verwijzers en andere partners in de zorg- en welzijnsketen over het te voeren behandelbeleid op het moment dat de patiënt wordt terug- of doorverwezen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De literatuursamenvatting includeerde primair vergelijkend onderzoek naar de effectiviteit van multidisciplinaire revalidatiebehandelingen in vergelijking met controle-interventies. Alle studies hebben een gerandomiseerd onderzoeksdesign. In geen van de studies konden de patiënten geblindeerd worden voor de groepstoewijzing, dit is inherent aan het type behandeling dat de patiënten hebben gekregen. Daar waar dit mogelijk risico op bias introduceert is middels de GRADE-methode afgewaardeerd. Belangrijk is te realiseren dat dergelijk onderzoek ongelofelijk complex is, waardoor er weinig studies te vinden zijn naar de effecten van multidisciplinaire revalidatiebehandelingen in de huidige literatuur.
De controle-interventie was in de meeste studies geen revalidatie of paramedische interventie. Uitzondering was de studie van Monticone (2015) waarbij een alternatief fysiek oefenprogramma werd aangeboden, waar beide groepen verbetering lieten zien. De effectiviteit van multidisciplinaire revalidatiebehandeling in vergelijking met een controle-interventie is onder verschillende condities en settingen onderzocht. Zo zijn multidisciplinaire interventies onderzocht in een klinische setting (Ferrazzoli, 2018; Frazzitta, 2015; Monticone, 2015 en Wade, 2003); in een poliklinische setting (Tickle Degnen, 2010; Van der Marck, 2013); of in de thuissituatie (Gage, 2014).
Een belangrijke kanttekening is dat de studies opgenomen in de literatuursamenvatting zijn uitgevoerd in Italië (Frazitta, 2015; Minticone, 2015), de USA (Tickle Degnen, 2010) en UK (Wade, 2015; Gage, 2014). Met name Italië en de USA hebben een heel andere organisatie van Parkinsonzorg dan Nederland. Er is daar geen of nauwelijks multidisciplinaire zorg in de eerste lijn. In Nederland is er veel meer aanbod en samenwerking van paramedische zorg. In Nederland kan multidisciplinaire behandeling geboden worden in de kliniek, polikliniek of eerstelijnszorg. Belangrijk voor alle settingen is dat behandelaars specifieke kennis en expertise hebben over passende interventies bij de ziekte van Parkinson.
Monodisciplinaire behandelingen zijn effectief gebleken voor mensen met de ziekte van Parkinson. Voor paramedische behandelaars (fysio- en oefentherapie (Cesar/Mensendieck), ergotherapie, logopedie en diëtetiek) bestaan monodisciplinaire behandelrichtlijnen. Voor een volledig overzicht van verwijscriteria naar deze disciplines, zie module Verwijscriteria. In Parkinson gespecialiseerde zorgverleners die werken conform deze behandelrichtlijnen zijn te vinden op https://www.parkinsonzorgzoeker.nl/#/.
Voor een medisch-specialistisch multidisciplinair traject is er keus voor een revalidatiecentrum, geriatrische revalidatiezorg, een ziekenhuisafdeling revalidatiegeneeskunde, verpleeghuis (short-stay parkinsonunit) of WLZ instellingen met een specifiek Parkinson programma voor thuiswonende ouderen. De huidige literatuur biedt nog geen duidelijke richting voor het maken van deze keuzes. Voordeel van een interventie in een revalidatiecentrum en/of ziekenhuissetting is dat intensievere multidisciplinaire behandeling mogelijk is (vooral in de revalidatiekliniek) en dat multidisciplinaire samenwerking onderdeel is van het werkproces. In de eerste lijn is het vaak lastiger om tot onderlinge afstemming te komen, voornamelijk omdat behandelaars elkaar niet automatisch treffen of regulier overleggen. Niet onderschat mag worden – vooral bij patiënten met meerdere of meer complexe hulpvragen op meerdere gebieden – met hoeveel behandelaars een patiënt te maken heeft, en hoeveel er van de patiënt zelf wordt gevraagd terzake van informatieverstrekking en regievoering. Een multidisciplinaire aanpak zou dit deels kunnen ondervangen. In een revalidatiesetting is vaak meer expertise op het gebied van complexe mobiliteitsproblemen en cognitieve revalidatie. In de eerste lijn is het voordeel dat de behandeling aan huis geboden kan worden. Vanuit een klinische of poliklinische setting is de toepassing van geleerde vaardigheden en strategieën in de thuissituatie minder geborgd en is het lastiger de context van thuis na te bootsen. Juist bij de ziekte van Parkinson zijn de invloed van de context en generalisatie naar andere situaties specifieke aandachtspunten. Bij multidisciplinaire behandeling in een centrum dient hier expliciet aandacht voor te zijn en is overdracht naar en/of follow-up door de eerste lijn belangrijk. Tevens dient aandacht te zijn voor de voortgang van het revalidatietraject van de individuele patiënt, mogelijk halverwege het traject, om de meerwaarde van multidisciplinaire revalidatie (opnieuw) te bepalen.
De huidige beschikbare literatuur laat onvoldoende bewijs zien dat multidisciplinaire programma’s de algehele kwaliteit van leven, gemeten op de PDQ-39, verbeteren ten opzichte van controle-interventies. Kanttekening is dat vaak óók de controlegroep een interventie kreeg, en die groep ook verbetering liet zien; daardoor is het effect tussen de groepen minder zuiver. Het feit dat er geen verschil werd gevonden op kwaliteit van leven heeft mogelijk ook te maken met het feit dat de PDQ-39 uit meerdere onderdelen bestaat (8 sub-schalen) en relatief ongevoelig is voor veranderingen op subdomeinen. De literatuur geeft geen uitsluitsel over de effectiviteit van een multidisciplinair revalidatieprogramma in verschillende settingen (klinisch, poliklinisch, aan huis). Parkinsonpatiënten met een combinatie van problemen (of meerdere hulpvragen) op verschillende domeinen waarvoor verschillende disciplines tegelijkertijd ingeschakeld moeten worden, hebben waarschijnlijk baat bij een multidisciplinair revalidatieprogramma maar dat kan niet op basis van de huidige literatuur worden aangetoond.
Een recent ontwikkeld programma voor patiënten met de ziekte van Parkinson is de Lee Silverman Voice Treatment (LSVT)-Big (McDonnel, 2018). Deze therapie wordt door speciaal opgeleide fysio- en ergotherapeuten aangeboden. Echter, deze training heeft niet het multidisciplinaire karakter waar de werkgroep nu de zoekvraag op heeft gericht waar meerdere disciplines naast elkaar aan gezamenlijke behandeldoelen werken, maar kan mogelijk wel in een multidisciplinaire setting geïncorporeerd worden. Deze therapie is niet opgenomen in de literatuursamenvatting.
Parkinsonpatiënten worden vaak door meerdere disciplines gezien, waaronder de neuroloog. De kwaliteit van afstemming en samenwerking is wisselend. Coördinatie van zorg is hiervoor belangrijk (zie Module netwerkzorg) Lang niet alle patiënten hoeven door een revalidatiearts gezien te worden. Omdat er geen onderzoek is gedaan naar indicatiestelling voor verwijzing naar de revalidatiearts, en verwijscriteria niet altijd eenduidig zijn, kan het behandelkader ‘ziekte van Parkinson en aanverwante bewegingsstoornissen’ (Nederlandse Vereniging van Revalidatieartsen, VRA) richting geven met betrekking tot verwijzing naar de medisch-specialistische revalidatie.
Zoals beschreven in dit behandelkader, worden de eisen die aan het revalidatie behandelaanbod bij de ziekte van Parkinson worden gesteld, enerzijds bepaald door de veelheid aan problemen op de verschillende domeinen en anderzijds door de ernst van de problematiek per domein. De diversiteit aan problematiek en de ernst ervan maken het moeilijk een eenduidige indeling te maken. Binnen de revalidatiegeneeskunde wordt de patiënt aan de hand van de aard en complexiteit van de problematiek en de functionele gevolgen in bij één van de subgroepen; Werkgroep Parkinson en aanverwante Bewegingsstoornissen (WPB)-niveau’s. Bij WPB-niveau 1 heeft de patiënt een enkelvoudige hulpvraag en lichte, niet complexe functiestoornissen. Patiënten met WPB-niveau 2 hebben een meervoudige hulpvraag en problemen op het gebied van functies en activiteiten. Een WPB-niveau 3 patiënt heeft een meervoudige hulpvraag en problemen op het gebied van functies, activiteiten, participatie en lichte problemen op het gebied van persoonlijke factoren en/of externe factoren. Patiënten met een WPB-niveau 4 hebben een meervoudige hulpvraag en problemen op het gebied van functies, activiteiten, participatie, persoonlijke factoren en externe factoren. In het behandelkader wordt gesteld dat het behandelbeleid afhankelijk is van het WPB-niveau; patiënten met WPB-niveau 1 worden behandeld in de eerstelijnszorg, patiënten met WPB-niveau 2 krijgen multidisciplinaire poliklinische revalidatie, patiënten met WPB-niveau 3 krijgen multidisciplinaire poliklinische revalidatie en patiënten met WPB-niveau 4 multidisciplinaire klinische revalidatie. Het is met name bij patiënten met WPB-niveau 4 van belang om een zorgvuldige triage plaats te laten vinden om te bepalen of patiënten voldoende belastbaar zijn voor adequate revalidatie.
Waarden en voorkeuren van patiënten
Het is altijd van belang om in samenspraak met de patiënt en diens naaste(n) te komen tot een ideale behandelvorm en setting die past bij de wensen en behoeften van de patiënt en naaste(n). Vanuit het patiëntperspectief kan een multidisciplinair revalidatietraject in een centrum een behoorlijke verstoring betekenen van het normale dagelijks leven, vooral wanneer het een klinisch traject betreft. Maar ook bij poliklinische behandeling moeten mensen meerdere dagdelen per week, afhankelijk van zorgbehoefte, blokkeren voor behandeling. Ook een reeds bestaande behandelaar-patiënt relatie in de eerste lijn is van belang om mee te nemen in deze afweging. Echter, een revalidatieprogramma kan ook helpen om in relatief korte tijd alle aandacht en energie te richten op de behandeldoelen en oefensessies. Houdt bij de afweging tussen een poliklinische of klinische revalidatie rekening met de beschikbaarheid van faciliteiten; klinische revalidatie bij de ziekte van Parkinson wordt nog maar op een paar plekken in Nederland aangeboden. In het geval van een verre reisafstand bij een patiënt met een indicatie voor multidisciplinaire revalidatie dient een klinische opname overwogen te worden.
Kosten
Een multidisciplinair revalidatietraject is een tijdelijke maar intensievere behandeling en daarmee een behandelvorm met tijdelijk de nodige kosten. De vraag is hoe deze kosten zich verhouden tegenover behaalde effecten. Er zijn nog geen kosteneffectiviteitsstudies gedaan die de kosten van verschillende vormen met elkaar vergelijken.
Rationale/ balans tussen de argumenten voor en tegen de interventie
De literatuur geeft geen sterke conclusies over de meerwaarde van een multidisciplinair revalidatietraject bij patiënten met de ziekte van Parkinson. Er is ook geen uitsluitsel over welke patiënten het meest baat hebben bij een multidisciplinair revalidatietraject in een centrum. Gezien bovenstaande overwegingen (voorkeuren van de patiënt, kosten en beschikbaarheid van goede eerstelijns zorg) adviseren wij een multidisciplinair revalidatieprogramma/traject indien patiënten een combinatie van meerdere problemen hebben zoals neurologische en orthopedische problemen, maar ook bij complexe problematiek ten gevolgen van co-morbide aandoeningen zoals: hersenbloeding (of CVA), diabetische voetproblematiek, status na totale heupprothese, rugklachten, degeneratieve afwijkingen, chronische pijnklachten of complexe cognitieve problematiek die drukken op de kwaliteit van leven en participatie van de patiënt. De indeling in WPB-niveaus kan richting geven aan de keuze. Ook kan een multidisciplinair team gebruikt worden voor een analyse van een complex probleem als gevolg van co-morbide aandoeningen zoals bijvoorbeeld bij vallen wat een multifactorieel probleem kan zijn.
Onderbouwing
Achtergrond
De ziekte van Parkinson levert toenemend problemen op verschillende functionele domeinen. Enkelvoudige problemen (zich uitende in hulpvragen) rondom mobiliteit, communicatie en zelfzorg kunnen behandeld worden door bijvoorbeeld fysiotherapie, diëtetiek, logopedie en ergotherapie. Voor deze verschillende disciplines zijn monodisciplinaire behandelrichtlijnen beschikbaar waarin de evidentie en effectieve behandelvormen worden beschreven. In de voorliggende richtlijn worden verwijscriteria voor deze disciplines gegeven (zie module Verwijscriteria).
Bij combinaties van problemen op verschillende functionele domeinen tegelijkertijd of wanneer sprake is van comorbiditeiten (bijvoorbeeld ziekte van Parkinson en orthopedische problematiek, chronische pijnklachten of bijkomende andere neurologische problematiek) kan gekozen worden voor een multidisciplinair revalidatietraject. Ook bij specifieke problemen met betrekking tot werk of complexere cognitieve problemen, of voor analyse van een complexe hulpvraag kan voor een multidisciplinair revalidatietraject gekozen worden. Verwijscriteria voor poliklinische revalidatie zijn echter niet duidelijk beschreven in de bestaande richtlijnen. Duidelijke verwijscriteria kunnen leiden tot een betere afstemming tussen behandelaars binnen de Parkinsonzorg en kunnen richting geven aan relevante vragen als: Wat is de haalbaarheid van deze revalidatieprogramma’s? Wat is de haalbaarheid van deze programma’s vanuit kosteneffectiviteit? En hoe borg je de continuïteit van deze trajecten?
Een poliklinisch medisch-specialistisch revalidatietraject (MSRT) beslaat een afgebakende periode waarbij meerdere disciplines tegelijkertijd worden ingeschakeld. Aan de hand van SMART (Specifiek, Meetbaar, Acceptabel, Realistisch, Tijdsgebonden) opgestelde behandeldoelen en klinimetrie wordt de voortgang van het behandeltraject geëvalueerd. Tot nu toe is er echter nog onvoldoende effectiviteit aangetoond van een poliklinisch, kortdurend, laagfrequent multidisciplinair revalidatieprogramma in vergelijking met een intensief klinisch revalidatietraject of een multidisciplinair revalidatietraject in de eerste lijn. In deze module wordt beschreven wat bekend is over de effectiviteit van multidisciplinaire revalidatieprogramma’s - die als geheel worden aangeboden - in de behandeling van patiënten met de ziekte van Parkinson.
Herkenning van patiënten
|
Er bestaat geen instrument om patiënten voor wie een multidisciplinair revalidatieprogramma van meerwaarde is, te herkennen. De werkgroep is van mening dat een deel van de patiënten met de ziekte van Parkinson met complexe problematiek, co-morbide aandoeningen en meerdere hulpvragen, en die voldoende belastbaar zijn voor intensieve revalidatie, in aanmerking komt voor een multidisciplinair revalidatieprogramma. Echter, welk specifiek revalidatieprogramma effectief is voor welke patiënt(engroep) is niet duidelijk. Criteria die helpen bij het vaststellen van deze indicatie zouden behulpzaam zijn bij het verwijzen van mensen voor een multidisciplinair revalidatieprogramma. |
Conclusies / Summary of Findings
Kwaliteit van leven
|
Laag1 GRADE
Laag2 GRADE
|
Een multidisciplinair (poli)klinisch revalidatieprogramma verbetert mogelijk de kwaliteit van leven van patiënten met de ziekte van Parkinson.1
Een multidisciplinair revalidatieprogramma aan huis laat mogelijk geen verbetering zien in kwaliteit van leven van patiënten met de ziekte van Parkinson.2
Bronnen: (Ferrazzoli, 2018; Tickle-Degnen, 2010; van der Marck, 2013; Wade, 2003)1 Bronnen: (Gage, 2014)2 |
Mobiliteit (TUG)
|
Zeer laag GRADE1
Laag GRADE2
|
Het is onduidelijk of een multidisciplinair (poli)klinisch revalidatieprogramma de mobiliteit (TUG) ten gevolge van ziekteprogressie vertraagt.1
Een multidisciplinair revalidatieprogramma aan huis lijkt de mobiliteit (TUG) van patiënten met de ziekte van Parkinson niet te verbeteren.2
Bronnen: (Frazzitta, 2015)1 Bronnen: (Gage, 2014)2 |
ADL
|
Zeer laag GRADE1
Laag GRADE2
|
Het is onduidelijk of een multidisciplinair (poli)klinisch revalidatieprogramma de achteruitgang in ADL-functie (UPDRS-II) ten gevolge van ziekteprogressie vertraagt.
Een multidisciplinair revalidatieprogramma aan huis lijkt het ADL-functioneren (Barthel ADL) van patiënten met de ziekte van Parkinson niet te verbeteren.2
Bronnen: (Frazzitta, 2015)1 Bronnen: (Gage, 2014)2 |
Motorisch functioneren (UPDRS-III)
|
Zeer laag GRADE1
Zeer laag GRADE2
|
Het is onduidelijk of een multidisciplinair (poli)klinisch revalidatieprogramma het motorisch functioneren (UPDRS-III) bij patiënten met de ziekte van Parkinson verbetert.1
Het is onduidelijk of een multidisciplinair (poli)klinisch revalidatieprogramma de achteruitgang in motorisch functioneren (UPDRS-III) ten gevolge van ziekteprogressie vertraagt.2
Bronnen: (Ferrazzali, 2018; Monticone, 2015)1 Bronnen: (Frazitta, 2015)2 |
Balans (Berg Balance Scale, BBS)
|
Zeer laag GRADE |
Het is onduidelijk of een multidisciplinair (poli)klinisch revalidatieprogramma de balans (BBS) verbetert bij patiënten met de ziekte van Parkinson.
Bronnen: (Monticone, 2015) |
Functionele onafhankelijkheid (Functional Independence Measure, FIM)
|
Zeer laag GRADE |
Het is onduidelijk of een multidisciplinair (poli)klinisch revalidatieprogramma de functionele onafhankelijkheid (FIM) bij patiënten met de ziekte van Parkinson verbetert.
Bronnen: (Monticone, 2015) |
Dagelijks functioneren (Assessed Parkinson’s Disease Disability Scale, PDDS)
|
Zeer laag GRADE1
Laag GRADE2 |
Het is onduidelijk of een multidisciplinair (poli)klinisch revalidatieprogramma de achteruitgang in dagelijks functioneren ten gevolge van ziekteprogressie vertraagt (PDSS).1
Een multidisciplinair revalidatieprogramma aan huis lijkt het dagelijks functioneren (PDSS) van patiënten met de ziekte van Parkinson niet te verbeteren.2
Bronnen: (Frazzitta, 2015)1 Bronnen: (Gage, 2014)2 |
Samenvatting literatuur
Beschrijving studies
Multidisciplinaire (poli)klinische revalidatie
De literatuurzoekactie leverde een systematische review op naar de effectiviteit van multidisciplinaire interventies bij patiënten met de ziekte van Parkinson (Tan, 2014). Tan (2014) includeerde studies waarin primair vergelijkend onderzoek wordt beschreven naar de effectiviteit van multidisciplinaire interventies gericht op het verbeteren van de kwaliteit van leven van patiënten met de ziekte van Parkinson. De systematische review includeerde meta- analyses, RCT’s, quasi-experimenteel onderzoek, cohortstudies en observationeel onderzoek zonder controlegroep (pre-post metingen). Alleen studies met een vergelijkend onderzoeksdesign worden bruikbaar geacht voor de uitwerking van de literatuur. Multidisciplinaire interventies zonder verpleegzorg werden niet meegenomen in de analyse. Tan (2014) dekt de literatuur tot maart 2011. Studies gepubliceerd na maart 2011 worden in deze literatuursamenvatting toegevoegd aan de literatuuranalyse. Tan (2014) includeert drie vergelijkende onderzoeken (A’Campo, 2010; Lindskov, 2007; Wade, 2003). De studie van A’Campo (2010) werd wel geïncludeerd in de studie van Tan (2014) maar omdat deze studie geen multidisciplinair programma beschrijft zal deze niet worden meegenomen in de uitwerking van de literatuur. De studie van Lindskov (2007) wordt ook niet meegenomen omdat deze voornamelijk is gericht op multidisciplinaire educatie en niet op multidisciplinaire behandeling. In aanvulling op Tan (2014), zijn vijf studies toegevoegd die het effect van multidisciplinaire revalidatie interventies, klinisch of poliklinisch, onderzochten bij patiënten met de ziekte van Parkinson (Ferrazoli, 2018; Frazzitta, 2015; Monticone, 2015, Tickle-Degnen, 2010; Van der Marck, 2013).
De studie van Ferrazoli (2018) onderzocht de effectiviteit van een multidisciplinaire, aerobe, motor-cognitieve, intensieve klinische revalidatiebehandeling (MIRT, n=186) en vergeleek deze met standaard zorg (n=48) in patiënten met de ziekte van Parkinson. Het doel van de MIRT-behandeling was om opnieuw om te leren gaan met stoornissen in het bewegen als gevolg van de ziekte door het gebruik van expliciete en impliciete leerstrategieën. Patiënten werden gerandomiseerd verdeeld over twee groepen (single-blind RCT). Het MIRT-programma duurde vier weken, bestaande uit vier dagelijkse revalidatiesessies van ieder één uur gedurende vijf dagen en één uur lichaamsbeweging op de zesde dag. Betrokken disciplines waren fysiotherapie, ergotherapie en logopedie en waar nodig neuropsychologie. De volgende patiënten werden geïncludeerd: diagnose van idiopathische ziekte van Parkinson (volgens UK Brain Bank criteria), Hoehn and Yahr-stadia II-IV en stabiele parkinsonmedicatie in de voorafgaande 6 weken. De PDQ-39 vragenlijst werd na twee en tien weken na start van de behandeling afgenomen. Naast de voor de werkgroep relevante uitkomstmaat kwaliteit van leven, zijn in Ferrazoli (2018) ook relevante secundaire uitkomsten zoals de Unified Parkinson’s Disease Rating Scale (UPDRS), Parkinson’s Disease Disability Scale (PDDS), Timed Up and Go Test (TUG) en de Berg Balance Scale meegenomen.
De studie van Monticone (2015) onderzocht de effectiviteit van een multidisciplinaire klinische interventie in vergelijking met een controle-interventie. De multidisciplinaire interventie omvatte motorische training, cognitieve training en educatie. Motorische training werd uitgevoerd door fysiotherapeuten en betrof goal-oriented oefeningen, transfers, balans- en looptraining. De cognitieve training werd uitgevoerd door een psycholoog, inclusief specifieke oefeningen gewijd aan aandacht en werkgeheugen, psychomotorische snelheid, executieve functies, visuo-ruimtelijke vaardigheden en rekenvaardigheden. Educatie werd uitgevoerd door een ergotherapeut en richtte zich op het vergemakkelijken van de ADL-functies, het aanleren van nieuwe vaardigheden, alternatieve of adaptieve vaardigheden en advies over hulpmiddelen. De controle-interventie omvatte neuro-motorische training, passieve en actieve mobilisatie, rek- en strekoefeningen van de wervelkolom en ledematen en balansoefeningen door middel van proprioceptieve training en staan- en loopoefeningen. Tijdens de interventie van acht weken werden patiënten individueel begeleid door een fysiotherapeut. Patiënten kregen dagelijks 90 minuten het toegewezen beweegprogramma, en de experimentele groep kreeg additioneel één sessie per week, 30 minuten per sessie, psychologische begeleiding en iedere week 30 minuten ergotherapie. De volgende, voor de werkgroep relevante uitkomstmaten werden meegenomen in de analyse: kwaliteit van leven (PDQ-39), ADL-functie (Functional Idependence Measure, FIM), balans (Berg Balance scale) en motorische stoornissen volgens de UPDRS.
De studie van Tickle-Degnen (2010) onderzocht de effectiviteit van een multidisciplinaire poliklinische revalidatiebehandeling bij patiënten met de ziekte van Parkinson, en evalueerde daarbij of de revalidatie effectiever is naarmate patiënten meer behandeluren krijgen. De volgende inclusiecriteria werden gehanteerd: diagnose van idiopathische parkinson (volgens de UK Brain Bank-criteria), Hoehn and Yahr stadium: 2, 2,5 of 3 (bij ‘on’), een leeftijd ouder dan 40 jaar, MMSE-score >25, geen depressieve klachten (Geriatrische Depressie Schaal Score < 21), stabiele dosis van de parkinsonmedicatie, geen andere vorm van revalidatie gevolgd in de voorafgaande twee maanden, zelfstandig kunnen lopen zonder hulpmiddel, geen andere medische complicaties. Patiënten werden gerandomiseerd verdeeld over drie groepen. Groep 1 kreeg standaardzorg zonder revalidatie. Groep 2 kreeg in totaal 18 uur groepstherapie en 9 uur een niet-therapie gerichte groep (sociaal bijeenkomen). De therapie bestond uit 3 uur per week multidisciplinaire revalidatie in twee groepssessies van 90 minuten voor een periode van 6 weken). De groepssessies werden begeleid door een fysiotherapeut, ergotherapeut en logopedist en omvatte oefeningen voor mobiliteit, dagelijks functioneren en communicatie en discussies over de toepassing van probleemoplossende vaardigheden. Groep 3 kreeg 27 uur therapie (4,5 uur revalidatie per week in twee van bovengenoemde groepssessies van 90 minuten en één individuele sessie van 90 minuten aan huis of in de eerste lijn voor een periode van 6 weken). In totaal werden 117 patiënten gerandomiseerd verdeeld over de controlegroep (n=41), middel intensieve groep (n=37) en intensieve revalidatie groep (n=39). Merendeel van de deelnemers was man (70%) met een gemiddelde leeftijd van 66,3 jaar (SD=9,0). De primaire uitkomstmaat was de kwaliteit van leven gemeten met de PDQ-39 summary index. Effecten werden gemeten direct na interventie (6 weken) en op 2 en 6 maanden follow up.
De studie van Frazitta (2015) beschrijft een gerandomiseerd onderzoek naar de effecten van intensieve multidisciplinaire klinische revalidatie (‘MIRT’) op het vertragen van ziekteprogressie in patiënten met nieuw-gediagnosticeerde parkinson. Patiënten werden geïncludeerd wanneer zij waren gediagnosticeerd met idiopathische ziekte van Parkinson, een Hoehn-Yahr stadium van 1 tot 1,5, zelfstandig konden lopen zonder hulpmiddel, een MMSE-score ≥ 26, geen ernstige comorbiditeit of beperking in lopen of balans. Alle patiënten startten met rasalgiline voor een periode van vier weken en werden daarna gerandomiseerd verdeeld over twee groepen, de ene groep kreeg een intensieve multidisciplinaire revalidatiebehandeling voor een periode van vier weken (n= 20) en de andere groep kreeg standaardzorg (medicamenteus). De multidisciplinaire revalidatiebehandeling werd één jaar na start van de studie herhaald. De voor de werkgroep relevante uitkomstmaten waren: motorisch functioneren (UPDRS), mobiliteit (Timed Up and Go Test, TUG) en uitvoeren van ADL-functies (Self Assessment Parkinson’s Disaese Disability Scale). Alle patiënten werden voor een periode van twee jaar gevolgd en onderzoekmetingen vonden plaats op: 6, 12, 18 en 24 maanden na start van het onderzoek.
De studie van Van der Marck (2013) beschrijft een gerandomiseerd onderzoek naar het effect van een multidisciplinaire poliklinische zorg interventie, in vergelijking met standaardzorg, in de behandeling van patiënten met de ziekte van Parkinson. Patiënten werden telefonisch gescreend voor deelname. Patiënten werden geïncludeerd wanneer ze gediagnosticeerd zijn met de ziekte van Parkinson (volgens de UK Brain Bank Criteria), voldoende belastbaar zijn om de vragenlijst in te vullen, en waarbij een mantelzorger aanwezig was die ook kon participeren in het onderzoek. Exclusiecriteria waren: MMSE-score < 24 en patiënten die onder behandeling waren bij een professional gespecialiseerd in bewegingsstoornissen. Patiënten werden gerandomiseerd over twee groepen; de interventiegroep (n=51) werd gezien door een specialist op het gebied van bewegingsstoornissen en werd begeleid door parkinsonverpleegkundigen en maatschappelijk werkers voor psychosociale hulp, zelfredzaamheid thuis, veranderingen in symptomen en medicatie en andere Parkinson gerelateerde problematiek. De controlegroep kreeg standaardzorg, dat wil zeggen dat zij geen toegang hadden tot deze specialistische zorg (n=49). De voor de werkgroep relevante uitkomstmaten die werden meegenomen in de analyse zijn: kwaliteit van leven (PDQ-39) en motorisch functioneren (UPDRS III).
Voor het poolen van studieresultaten werden waar mogelijk de afzonderlijke gestandaardiseerde gemiddelde verschilscore berekend, waarbij gebruik werd gemaakt van de standaardafwijking. Op deze manier kan het behandeleffect uitgedrukt worden in standaardeenheden welke nodig zijn om het gepoolde effect te analyseren en het verschil in effect tussen de multidisciplinaire interventies en conventionele therapie te duiden.
Resultaten Multidisciplinair (poli)klinisch revalidatieprogramma
Kwaliteit van leven (PDQ-39)
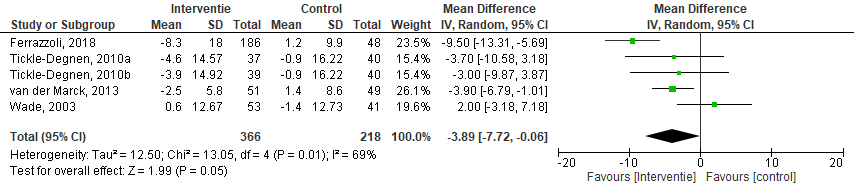
Algehele kwaliteit van leven aan het eind van de interventie is in vier RCT’s onderzocht (Ferrazzoli, 2018; Tickle-Degnen, 2010a; Van der Marck, 2013; Wade, 2003). Tickle-Degnen (2010) beschrijft twee vergelijkingen, waarin de interventie verschilde in intensiteit (vergelijking groep a: 18 uur therapie en vergelijking groep b: 27 uur therapie). Allen maakten gebruik van de PDQ-39. Het gemiddelde verschil in kwaliteit van leven tussen de groep patiënten in de multidisciplinaire interventiegroep en controlegroep was -3,89 punten (95%BI -7,72 tot -0,06; p=0,05; n=630), statistisch significant in het voordeel van de multidisciplinaire interventiegroep.
Figuur 1 Meta-analyse en forest plot van het gestandaardiseerde gemiddelde verschil in kwaliteit van leven na multidisciplinaire revalidatiebehandeling of na conventionele behandeling
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat kwaliteit van leven is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met één niveau vanwege imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is laag.
Mobiliteit (TUG)
Het effect van een multidisciplinaire interventie op de vertraging van de ziekteprogressie is onderzocht in één RCT (Frazitta,2015). Deze RCT neemt mobiliteit mee als indicator voor ziekteprogressie. Mobiliteit is gemeten met de Timed Up and Go (TUG)-test. De tijdsverandering op TUG-test was significant kleiner in de multidisciplinaire behandelgroep dan in de controlegroep. Het interactie-effect (Time x Group) liet zien dat de tijdsverandering in TUG test gemiddeld 4,0 seconden kleiner was in de multidisciplinaire behandelgroep in vergelijking met de controlegroep (F(4, 124)=4,0 punten; p<0,0044), statistisch significant minder achteruitgang in mobiliteit in de multidisciplinaire behandelgroep.
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat mobiliteit, gemeten met de TUG test is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met twee niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is zeer laag.
ADL (UPDRS-II)
Het effect van een multidisciplinaire interventie op de vertraging van ziekteprogressie is onderzocht in één RCT (Frazitta, 2015). Deze RCT neemt ADL-functie mee als indicator voor ziekteprogressie. ADL-functie is gemeten met de UPDRS sectie II over een periode van 2 jaar. De verbetering in UPDRS II-score was significant hoger in de multidisciplinaire behandelgroep dan in de groep met alleen medicatiebehandeling. Het interactie-effect (Time x Group) liet zien dat de UPDRS II-score over de periode van 2 jaar gemiddeld 5,2 punten minder toenam in de multidisciplinaire behandelgroep in vergelijking met de conventionele therapiegroep (F(4, 124)=5,2 punten; p=0,0007), statistisch significant minder achteruitgang in ADL-functie in de multidisciplinaire behandelgroep.
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ADL-functie, gemeten met de UPDRS II, is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met twee niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is zeer laag.
Motorisch functioneren (UPDRS-III)
Het pre-post verschil in motorische functioneren in de multidisciplinaire behandelgroep en controlegroep (monodisciplinaire behandeling door fysiotherapeut) is onderzocht in één RCT (Monticone, 2015). Motorisch functioneren is gemeten met de UPDRS III. De gemiddelde afname in UPDRS III-score was -42,20 (SD=20,3) in de multidisciplinaire behandelgroep en -17,60 (SD=19,0) in de conventionele behandelgroep. Het gemiddelde verschil in afname tussen de groepen was -24,60 (95%BI -33,8 tot -15,40); p<0,001; n=70), statistisch significant in het voordeel van de multidisciplinaire behandelgroep.
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat motorisch functioneren, gemeten met de UPDRS III, is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met twee niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is zeer laag.
Ziekteprogressie op motorisch functioneren (UPDRS-III)
Het effect van een multidisciplinaire interventie op de vertraging van ziekteprogressie is onderzocht in één RCT (Frazitta, 2015). Deze RCT neemt motorisch functioneren mee als indicator voor ziekteprogressie. Motorisch functioneren is gemeten met de UPDRS-sectie III. De toename in UPDRS III-score was significant lager in de multidisciplinaire behandelgroep dan in de controlegroep. Het interactie-effect (Time x Group) liet zien een gemiddeld UPDRS III-score zien van 11,7 punten over een periode van 2 jaar (alleen medicatie) (F(4, 124)= 11,7 punten; p<0,001), statistisch significant in het voordeel van de multidisciplinaire behandelgroep.
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ziekteprogressie motorisch functioneren is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met twee niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is zeer laag.
Balansvaardigheden (Berg Balance Scale)
Het pre-post verschil in balans tussen de multidisciplinaire behandelgroep en controle behandelgroep (monodisciplinaire behandeling door fysiotherapeut) is onderzocht in één RCT (Monticone, 2015). Balans is gemeten met de Berg Balance Scale. De gemiddelde verbetering in BBS-score was +11,4 (SD 10,1) in de multidisciplinaire behandelgroep en +3,1 (SD 10,7) in de controle behandelgroep. Het gemiddelde verschil in verbetering tussen de groepen was +8,3 punten (95%BI 3,43 tot 13,17; p<0,001; n=70), statistisch significant in het voordeel van de multidisciplinaire behandelgroep.
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat balans is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met twee niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is zeer laag.
Functionele onafhankelijkheid (FIM)
Het pre-post verschil in functionele onafhankelijkheid tussen de multidisciplinaire behandelgroep en controle behandelgroep (monodisciplinaire behandeling door fysiotherapeut) is onderzocht in één RCT (Monticone, 2015). Functionele onafhankelijkheid is gemeten met de Functional Independence Measure (FIM). De gemiddelde verbetering in FIM-score was +40,4 punten (SD=12,2) in de multidisciplinaire behandelgroep en +20,2 (SD=11,8) in de controle behandelgroep. Het gemiddelde verschil in verbetering op FIM tussen de groepen was +20,2 (95%BI 14,58 tot 25,82; p<0,001; n=70), statistisch significant in het voordeel van de multidisciplinaire behandelgroep.
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat functionele onafhankelijkheid is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met twee niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is zeer laag.
Dagelijks functioneren (PDDS)
Het effect van een multidisciplinaire interventie op de progressie van de ziekte op het dagelijks functioneren in de tijd is onderzocht in één RCT (Frazitta,2015). Deze RCT neemt de PDDS-score mee als indicator voor ziekteprogressie. De verandering in PDDS-score was significant minder in de multidisciplinaire behandelgroep dan in de controle behandelgroep. Het interactie-effect (Time x Group) liet zien dat de PDDS-score gemiddeld over een periode van 2 jaar 9,2 punten minder toenam in de multidisciplinaire behandelgroep in vergelijking met de controle behandelgroep (F(4, 124)=9,2 punten; p<0,001).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat dagelijks functioneren is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met twee niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is zeer laag.
Multidisciplinair revalidatieprogramma aan huis
De studie van Gage (2014) onderzoekt de effectiviteit van drie multidisciplinaire interventies in de behandeling van patiënten met de ziekte van Parkinson. Patiënten met een klinische diagnose ziekte van Parkinson die thuiswonend zijn kwamen in aanmerking voor de studie mits zij in de afgelopen zes maanden niet hadden deelgenomen aan revalidatieonderzoek. Gage (2014) gebruikte een gerandomiseerd onderzoeksdesign met drie parallelle groepen: Groep A kreeg een multidisciplinaire behandeling waarin patiënten vanuit huis werden begeleid door een Parkinsonverpleegkundige, fysiotherapeut, ergotherapeut en een logopedist (n= 102). De multidisciplinaire behandeling werd voor een periode van zes weken gevolgd; 9 uur individuele therapie per week welke pragmatisch werd afgestemd op de behoefte van de patiënt. Groep B kreeg dezelfde training als Groep A, additioneel werden zij voor een periode van 4 maanden begeleid door een parkinsonverzorgende (één uur per week) aansluitend aan de 6-weekse multidisciplinaire revalidatiebehandeling (n=101). Patiënten in Groep C kregen algemene informatie over de ziekte van Parkinson en standaardzorg (geen structurele multidisciplinaire revalidatiebehandeling) (n=103). Patiënten in groep C kregen aan het eind van de studieperiode, waar nodig een verwijzing voor additionele therapie. In totaal werden drie meetmomenten georganiseerd, op 6 weken, 24 weken en 36 weken na start van de behandeling. De voor de werkgroep relevante, uitkomsten waren: Self Assessment Parkinson’s Disease Disability Scale (SPDDS), ziekte-gerelateerde kwaliteit van leven (EQ-5D, SF-36), motorisch functioneren (UPDRS) en het uitvoeren van ADL-activiteiten (Barthel index en Fenchay Activity Index).
Resultaten Multidisciplinair revalidatieprogramma aan huis
Kwaliteit van leven (PDQ-8)
Het pre-post verschil in kwaliteit van leven tussen Groep A+B (multidisciplinair) en Groep C (controlezorg) is onderzocht in één RCT (Gage, 2014). Kwaliteit van leven is gemeten met de PDQ-8. De gemiddelde verandering in PDQ-8 score was -0,37 (95%BI -2,03 tot 1,29; p=0,66) in de multidisciplinaire behandelgroep (A+B) en +0,98 (95%BI -1,73 tot 3,69; p=0,47) in de controlegroep C. Het gemiddelde verschil in verandering op de PDQ-8 score tussen de groepen was statistisch niet significant verschillend (MD= -1,35; 95%BI -4,33 tot 1,63; p=0,37).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat kwaliteit van leven is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met één niveau vanwege imprecisie (geringe studieomvang). De bewijskracht is laag.
Dagelijks functioneren (PDDS)
Het pre-post verschil in zelfgerapporteerd dagelijks functioneren tussen Groep A+B (multidisciplinair) en Groep C (controle zorg) is onderzocht in één RCT (Gage, 2014). Zelf gerapporteerd dagelijks functioneren was gemeten met de Self-Assessed Parkinson’s Disease Disability Scale (PDDS). De gemiddelde verandering in PDDS-score was -2,8 (95%BI -4,31 tot -1,37; p<0,001) in de multidisciplinaire behandelgroep (A+B) en -0,72 (95%BI -2,67 tot 1,23; p=0,46) in de controleroep C. Het gemiddelde verschil in verandering op de PDDS-score tussen de groepen was statistisch niet significant verschillend (MD= -2,12; 95%BI 4,54 tot 0,31; p=0,09).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat dagelijks functioneren is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met één niveau vanwege imprecisie (te geringe studieomvang). De bewijskracht is laag.
ADL (Barthel ADL)
Het pre-post verschil in ADL-functie tussen Groep A+B (multidisciplinair) en Groep C (controle zorg) is onderzocht in één RCT (Gage, 2014). De ADL-functie was gemeten met de Barthel ADL. De gemiddelde verandering in Barthel ADL-score was -0,06 (95%BI -0,35 tot 0,22; p=0,66) in de multidisciplinaire behandelgroep (A+B) en -0,27 (95%BI -0,60 tot 0,07; p=0,12) in de controleroep C. Het gemiddelde verschil in verandering op de Barthel ADL-score tussen de groepen was statistisch niet significant verschillend (MD= 0,20; 95%BI -0,25 tot 0,65; p=0,37).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ADL-functie is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met één niveau vanwege imprecisie (geringe studieomvang). De bewijskracht is laag.
Mobiliteit (TUG)
Het pre-post verschil in mobiliteit tussen Groep A+B (multidisciplinair) en Groep C (controle zorg) is onderzocht in één RCT (Gage, 2014). De mobiliteit was gemeten met de Timed Up and Go (TUG)-test, UPDRS (item ‘houding’) en UPDRS (item ‘gangbeeld’). Geen van de instrumenten liet een verschil zien tussen de groepen. De gemiddelde tijdsverandering op de TUG test was +0,26 seconden (95%BI -1,68 tot 2,19; p=0,79) in de multidisciplinaire behandelgroep (A+B) en -1,35 seconden (95%BI -3,25 tot 0,55; p=0,16) in de controleroep C. Het gemiddelde verschil in tijdsverandering op de TUG tussen de groepen was statistisch niet significant verschillend (MD=1,61 seconden; 95%BI -1,29 tot 4,51; p=0,28). De gemiddelde verandering op UPDRS (houding) was -0,25 (95%BI -0,36 tot -0,14; p<0,001) in de multidisciplinaire behandelgroep (A+B) en -0,15 (95%BI -0,34 tot 0,03; p=0,10) in de controleroep C. Het gemiddelde verschil in UPDRS-score tussen de groepen was statistisch niet significant verschillend (MD= -0,10; 95%BI -0,30 tot 0,10; p=0,33). De gemiddelde verandering op UPDRS (item ‘gangbeeld’) was -0,28 (95%BI -0,10 tot -0,16; p<0,001) in de multidisciplinaire behandelgroep (A+B) en -0,17 (95%BI -0,33 tot -0,01; p=0,04) in de controleroep C. Het gemiddelde verschil in UPDRS-score tussen de groepen was statistisch niet significant verschillend (MD= -0,12; 95%BI -0,32 tot 0,009; p=0,26).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat mobiliteit is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (single blind RCT, geen blindering van deelnemers) en met één niveau vanwege imprecisie (te geringe studieomvang). De bewijskracht is laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van multidisciplinaire revalidatieprogramma’s voor bij patiënten met de ziekte van Parkinson?
P: patiënten met de ziekte van Parkinson;
I: multidisciplinaire interventies, revalidatie, behandeling, interdisciplinair, multimodaal, specialistische revalidatie, medisch specialistische revalidatie;
C: reguliere zorg, placebo-interventie;
O: ADL-activiteiten, gezondheidsgerelateerde kwaliteit van leven, kwaliteit van leven, onafhankelijk functioneren, fysiek functioneren, participatie, fitheid, participatie in werk, sociale participatie.
Relevante uitkomstmaten
De werkgroep achtte ziekteprogressie een voor de besluitvorming cruciale uitkomstmaat en ADL-functie, balans, UPDRS, participatie en kwaliteit van leven voor de besluitvorming belangrijke uitkomstmaten. De werkgroep hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 14 september 2018 met relevante zoektermen gezocht naar studies die multidisciplinaire interventies beschrijven bij patiënten met de ziekte van Parkinson. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 91 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: Studiedesign RCT’s of ander primair vergelijkend onderzoek naar de effectiviteit van multidisciplinaire interventies bij patiënten met de ziekte van Parkinson (vergelijkbaar met de Nederlandse setting), gepubliceerd na 2009, beschrijving van minimaal één van bovengenoemde uitkomstmaten, beschreven in het Engels of in het Nederlands. Op basis van titel en abstract werden onafhankelijk, door twee beoordelaars in eerste instantie 26 studies geselecteerd voor full-tekst selectie. Na raadpleging van de volledige tekst, werden vervolgens 19 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en zes studies definitief geselecteerd. De belangrijkste studiekarakteristieken en resultaten van deze zes geïncludeerde studies zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen. Vijf onderzoeken zijn opgenomen in de literatuuranalyse.
Referenties
- Ferrazzoli D, Ortelli P, Riboldazzi G, Maestri R, Frazzitta G. Effectiveness of Rotigotine plus intensive and goal-based rehabilitation versus Rotigotine alone in "de-novo" Parkinsonian subjects: a randomized controlled trial with 18-month follow-up. J Neurol. 2018 Apr;265(4):906-916. doi: 10.1007/s00415-018-8792-0. Epub 2018 Feb 13. Erratum in: J Neurol. 2018 Aug 17; PubMed PMID: 29442177; PubMed Central PMCID: PMC5878188.
- Frazzitta G, Maestri R, Bertotti G, Riboldazzi G, Boveri N, Perini M, Uccellini D, Turla M, Comi C, Pezzoli G, Ghilardi MF. Intensive rehabilitation treatment in early Parkinson's disease: a randomized pilot study with a 2-year follow-up. Neurorehabil Neural Repair. 2015 Feb;29(2):123-31. doi: 0.1177/1545968314542981. Epub 2014 Jul 18. PubMed PMID: 25038064.
- Gage H, Grainger L, Ting S, Williams P, Chorley C, Carey G, Borg N, Bryan K, Castleton B, Trend P, Kaye J, Jordan J, Wade D. Specialist rehabilitation for people with Parkinson’s disease in the community: a randomised controlled trial. Southampton (UK): NIHR Journals Library; 2014 Dec.PubMed PMID: 25642574.
- McDonnell MN, Rischbieth B, Schammer TT, Seaforth C, Shaw AJ, Phillips AC. Lee Silverman Voice Treatment (LSVT)-BIG to improve motor function in people with Parkinson's disease: a systematic review and meta-analysis. Clin Rehabil. 2018 May;32(5):607-618. doi: 10.1177/0269215517734385. Epub 2017 Oct 5. PubMed PMID: 28980476.
- Monticone M, Ambrosini E, Laurini A, Rocca B, Foti C. In-patient multidisciplinary rehabilitation for Parkinson's disease: A randomized controlled trial. Mov Disord. 2015 Jul;30(8):1050-8. doi: 10.1002/mds.26256. Epub 2015 Jun 11. PubMed PMID: 26095443.
- Tan SB, Williams AF, Kelly D. Effectiveness of multidisciplinary interventions to improve the quality of life for people with Parkinson's disease: a systematic review. Int J Nurs Stud. 2014 Jan;51(1):166-74. doi: 10.1016/j.ijnurstu.2013.03.009. Epub 2013 Apr 20. Review. Erratum in: Int J Nurs Stud. 2014 Oct;51(10):1418-9. PubMed PMID: 23611510.
- Van der Marck MA, Bloem BR, Borm GF, Overeem S, Munneke M, Guttman M. Effectiveness of multidisciplinary care for Parkinson's disease: a randomized, controlled trial. Mov Disord. 2013 May;28(5):605-11. doi: 10.1002/mds.25194. Epub 2012 Nov 19. PubMed PMID: 23165981.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 29-10-2020
Beoordeeld op geldigheid : 14-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk vijf jaar na de autorisatiedatum besluit het bestuur van de NVN om de richtlijn te updaten. In principe zullen de modules jaarlijks beoordeeld worden of deze nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Naast de ontwikkelde modules, is een aantal onderwerpen niet uitgewerkt in de huidige richtlijn. De werkgroep adviseert om deze op korte termijn alsnog te ontwikkelen omdat hier in de praktijk vraag naar is, te weten:
- urogenitale stoornissen;
- seksuele gezondheid;
- interacties tussen medicijnen ;
- visusstoornissen;
- orthostatische hypotensie;
- mond- en keelklachten;
- obstipatie.
Tabel 1 Geldigheid en onderhoud richtlijnmodules
|
Module |
Regiehou-der(s) |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Diagnostiek |
NVN |
NVN |
Nieuwe inzichten, veranderingen in zorg |
|
Medicamenteuze behandeling de Novo patiënt |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Medicamenteuze behandeling van motorische klachten en responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Geavanceerde therapieën voor responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN, NVvN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling houdingsproblematiek bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling valrisico bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Impulscontrolestoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Dopamine dysregulatie-stoornis bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Angststoornissen bij de ziekte van Parkinson |
NVN |
NVvP, NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Apathie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Depressie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Wanen en hallucinaties bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVKG |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Cognitieve stoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vermoeidheid bij de ziekte van Parkinson |
NVN |
NVN, NIP, NVKG |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Slaapstoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Pijnklachten bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Coping met de ziekte van Parkinson |
NVN |
NVN, V&VN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Werk en arbeidsongeschiktheid |
NVN |
NVAB |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Rijgeschiktheid |
NVN, VRA |
NVN, VRA |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Mantelzorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medicinale cannabis bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Mucuna Pruriens bij de ziekte van Parkinson |
NVN |
NVN, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vitamine B12 of D-suppletie bij de ziekte van Parkinson |
NVN |
NVN, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Multidisciplinaire revalidatieprogramma’s bij de ziekte van Parkinson |
VRA |
VRA, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Palliatieve zorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Advance care planning |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medische symptoombehandeling in de stervensfase |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
eHealth bij de ziekte van Parkinson |
NVN |
NVN |
Veranderingen in zorg |
|
Netwerkzorg, casemanagement en verwijscriteria |
NVN, VRA |
NVN, ParkinsonNet |
Veranderingen in zorg |
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlands Huisartsen Genootschap (NHG)
- Parkinson Vereniging (PV)
- Vereniging van Specialisten Ouderengeneeskunde (Verenso)
- Verpleegkundigen & Verzorgenden Nederland (V&VN)
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- Ergotherapie Nederland (EN)
- Nederlands Instituut van Psychologen (NIP)
- Nederlandse Vereniging van Diëtisten (NVD)
- ParkinsonNet, beroepsvereniging van professionals in sociaal werk (BPSW)
- Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB)
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVvS)
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
- Nederlandse Associatie Physician Assistants (NAPA)
- ParkinsonNet
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om een richtlijn te verkrijgen waarin de meeste recente (para)medische kennis omtrent de zorg voor patiënten met ziekte van Parkinson wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson te maken hebben.
Werkgroep
- Prof. dr. T. (Teus) van Laar (voorzitter), neuroloog, NVN
- Dr. A.J.W. (Agnita) Boon, neuroloog, NVN
- Dr. J.I. (Jorrit) Hoff, neuroloog, NVN
- Dr. M.L. (Mark) Kuijf, neuroloog, NVN
- Dr. A.G. (Alexander) Munts, neuroloog, NVN
- Dr. B. (Bart) Post, neuroloog, NVN
- Dr. G. (Gerrit) Tissingh, neuroloog, NVN (tot ..)
- Dr. F.J. (Erik) Slim, vicevoorzitter, revalidatiearts, VRA
- Drs. W.J. (Willem) Oudegeest, , revalidatiearts, VRA
- Drs. S.P. (Susan) Meuleman, revalidatiearts, VRA
- Prof. dr. O.A. (Odile) van den Heuvel, psychiater, NVvP
- Prof. dr. A.F.G. (Albert) Leentjens, psychiater, NVvP
- Dr. G. (Bert) Ziere, klinisch geriater, NVKG
- Drs. H.J. (Hannie) Scheper, specialist Ouderengeneeskunde, Verenso
- Dr. A.L. (Abram) Rutgers, huisarts, NHG
- Dr. A.A. (Annelien) Duits, klinisch neuropsycholoog, NIP
- H.H. (Herma) Lennaerts – Kats MSc, Parkinsonverpleegkundige, V&VN, ParkinsonNet
- T. (Tiny) van Wieren-Beerda MSc, verpleegkundig specialist parkinson, V&VN
- Drs. M.M. (Masja) van het Hoofd, beleidsmedewerker, Parkinson Vereniging
- Drs. K.C. (Kaie) Klaassen, patiënt-onderzoeker, Parkinson Vereniging
- Drs. M. (Marianne) Luinstra, ziekenhuisapotheker, NVZA
- Dr. M. (Marlies) van Nimwegen, fysiotherapeut (niet praktiserend), KNGF, ParkinsonNet
- Dr. I.H.W.M. (Ingrid) Sturkenboom, ergotherapeut, EN, ParkinsonNet
- K. (Karin) Overbeek-Dekker, diëtist, NVD, ParkinsonNet
- Dr. M. (Marten) Munneke, ParkinsonNet
Klankbordgroep
- Dr. J.G. (Hanneke) Kalf, logopedist, NVLF, ParkinsonNet
- K. (Klaas) Kooistra MSc, apotheker, KNMP
- P.R.I. (Paul) Rabsztyn, verpleegkundig seksuoloog SH (seksuologische hulpverlening) &VPO (voorlichting preventie en onderwijs), NVvS
- Dr. F.J.A. (Anton) Meijer, Neuro- en hoofd-hals radioloog, NVvR
- Prof. Dr. Y. (Yasin) Temel, neurochirurg, NVvN
- Drs. J.P. (Jacqueline) Janssen, Bedrijfsarts, klinisch arbeidsgeneeskundige, NVAB
- M. (Marlinda) Bakker, Geriatrisch maatschappelijk werker, BPSW
- Drs. A.L.A.J. (Danny) Hommel, specialist ouderengeneeskunde, Verenso
- Drs. H. (Hajo) Jongepier, huisarts, NHG
Met ondersteuning van
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. ir. N.L. (Nikita) van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Linda) Niesink-Boerboom, literatuurspecialist, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Guiterrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- S. (Sonja) Wouters, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Parkinson Vereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door stakeholderpartijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn ziekte van Parkinson (NVN, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens de invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). De zekerheid van het bewijs wordt beïnvloed door beperkingen in studieopzet- of uitvoering (risk of bias), imprecisie, inconsistentie, indirectheid en publicatiebias.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De formulering van de conclusies hangt af van de bewijskracht. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Netwerkzorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten in de bijlagen).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
