Medicamenteuze behandeling van motorische klachten en beginnende responsfluctuaties bij de ziekte van Parkinson
Uitgangsvraag
Hoe kunnen motorische klachten en beginnende responsfluctuaties bij de ziekte van Parkinson medicamenteus worden behandeld?
Deze uitgangsvraag omvat de volgende deelvragen:
- Wat is de effectiviteit van COMT-remmers bij beginnende responsfluctuaties?
- Wat is de effectiviteit van MAO-B-remmers bij beginnende responsfluctuaties?
- Wat is de effectiviteit van dopamine-agonisten bij beginnende responsfluctuaties?
- Wat is de effectiviteit van amantadine bij beginnende responsfluctuaties?
- Wat is effectiviteit van rivastigmine en selegiline bij freezing en balansstoornissen?
Aanbeveling
Overweeg dopamine-agonisten, COMT-remmers of MAO-B-remmers als adjuvante behandeling van beginnende responsfluctuaties bij patiënten met de ziekte van Parkinson. De keuze is afhankelijk van individuele patiëntkarakteristieken en -voorkeuren (zie ook de tabel in de overwegingen).
Bij het toevoegen van dopamine-agonisten dient de dosering levodopa te worden verlaagd indien hyperkinesieën optreden. Op geleide van het klinische effect kunnen de doseringen van beide medicamenten worden aangepast.
Entacapon is de COMT-remmer van eerste keuze.
Het voorschrijven van MAO-B-remmers moet worden afgewogen tegen de kosten die voor de patiënt hoger zijn dan bij andere adjuvante behandelingen (met uitzondering van selegiline dat volledig vergoed wordt).
MAO-B-remmers zijn gecontra-indiceerd bij patiënten met een cognitieve stoornis vanwege het risico op hallucinaties en verwardheid, en voorzichtigheid is geboden bij gelijktijdig gebruik van anti-depressiva (SSRI’s).
Schrijf niet routinematig rivastigmine voor bij loop- en balansstoornissen. Indien er bijkomende cognitieve stoornissen zijn, is orale toediening van rivastigmine een behandelmogelijkheid.
Overweeg amantadine in hogere doses (tot 400 mg/dag) voor de behandeling van dyskinesieën bij patiënten met de ziekte van Parkinson.
Bij oudere patiënten met de ziekte van Parkinson en patiënten met matige/ernstige cognitieve klachten moet amantadine met grote voorzichtigheid worden voorgeschreven risico op hallucinaties/ psychose.
Overwegingen
De ziekte van Parkinson is een progressieve ziekte waardoor een deel van de patiënten te maken zal krijgen met inadequate symptoombestrijding als gevolg van het sneller uitwerken van de dopaminerge medicatie. Daarnaast is er een aantal motorische klachten zoals tremor, peak-dose dyskinesie en freezing waarvoor adjuvante medicamenteuze behandeling mogelijk is.
Responsfluctuaties zijn vooral geassocieerd met levodopapreparaten vanwege de kortere halfwaarde tijd van deze middelen. Verschillende strategieën om responsfluctuaties tegen te gaan worden in de praktijk toegepast. Voordat nieuwe medicatie bijgestart wordt, zal meestal eerst gekeken worden of aanpassen van de dosis-intervallen een verbetering oplevert voor de patiënt, evenals optimaliseren van de resorptie van levodopa in het geval van klinisch relevante obstipatie. Het bijstarten van nieuwe medicatie zal een individuele afweging zijn die per patiënt verschilt op basis van (verwachte) bijwerkingen en patiëntkarakteristieken. Indien niet-motorische klachten zoals wearing-off gerelateerde angstklachten een rol spelen kan daar aandacht aan worden besteed. Wanneer medicamenteuze aanpassingen er niet toe leiden dat responsfluctuaties adequaat bestreden worden is een geavanceerde behandeling mogelijk (zie module Geavanceerde therapie).
Uit de bovenstaande literatuuranalyses blijkt dat zowel dopamineagonisten, MAO-B remmers als COMT-remmers effectief lijken in het verminderen van responsfluctuaties (afname off-tijd en verbetering motorische functies). Uit eerdere literatuuranalyses is ook gebleken dat dopamine-agonisten en andere COMT-remmers en MAO-B remmers effectief lijken ten aanzien van afname van off-tijd en verbetering van motorisch functioneren. Nieuw ten opzichte van de richtlijn uit 2010 is dat er bewijs is toegevoegd voor effectiviteit voor entacapon, safinamide en rotigotine.
Dopamine-agonisten als adjuvante therapie bij responsfluctuaties
De conclusies zijn gebaseerd op korte termijnstudies. Er is tot op heden weinig onderzoek gedaan naar de langetermijneffecten van adjuvante behandeling met dopamine-agonisten.
Een uitzondering hierop vormt een studie naar de effectiviteit en veiligheid van pramipexol op lange termijn (Moller, 2005). Uit dit onderzoek bleek dat door langdurige adjuvante behandeling (< 57 maanden) met pramipexol een verbetering op de UPDRS deel II en III werd bereikt en een vermindering optrad van het aantal off-fases per dag (gemiddelde reductie in off-tijd was ongeveer 2,5 uur per dag). De effectiviteit van de verschillende dopamine-agonisten onderling is vergelijkbaar zonder een duidelijke voorkeur van het ene middel boven het andere. Bij ernstige gastroparese of maagdarmstoornissen, of wanneer medicatie niet oraal voorgeschreven kan worden is rotigotine een behandeloptie aangezien dit transdermaal wordt toegediend. Met het beschikbaar komen van de vertraagde afgifte preparaten voor de verschillende dopamine-agonisten is er een voorkeur boven de kortwerkende preparaten. De behandelend specialist moet bij het voorschrijven van dopamine-agonisten beducht zijn op de voorkomende bijwerkingen, zoals impulscontrolestoornissen, een en ander afhankelijk van leeftijd en comorbiditeit van de patiënt. Bij het toevoegen van dopamine-agonisten aan de medicatie dient de levodopadosering per gift verlaagd te worden indien hyperkinesieën optreden (Goetz, 2004. Op geleide van de motorische symptomen kunnen vervolgens de doseringen van beide medicamenten worden aangepast. Indien er veel off-fases blijven optreden, kan de dosering van dopamine-agonisten of levodopa worden verhoogd.
COMT-remmers als adjuvante therapie bij responsfluctuaties
COMT-remmers in combinatie met levodopa zijn een goede keuze ter reductie van de off-tijd als zich voorspelbare off-fases voordoen. Hiermee kan een toename van de frequentie van doseren van levodopa worden voorkomen. Het geven van een combinatiepreparaat (entacapon + levodopa/carbidopa) kan worden overwogen wanneer de patiënt een goede en stabiele respons vertoont op de niet-combinatiepreparaten. De behandeling met dit laatste middel gaat gepaard met hogere kosten, het aantal pillen dat echter moet worden ingenomen, wordt dan gereduceerd. Bij het gebruik van entacapon is het goed om te wijzen op meer voorkomende bijwerkingen waaronder (oranje) verkleuring van de urine en diarree.
Er zijn de laatste jaren enkele nieuwe studies voor entacapon die aantonen dat er redelijk bewijs is dat de off-tijd afneemt en daarmee de motorische functies verbeteren, gemeten aan de hand van UDPRS-III. Een goede onderbouwing voor verbetering van de kwaliteit van leven is door tegenstrijdige studieresultaten onvoldoende gebleken. Tolcapon wordt alleen in uitzonderlijke gevallen nog voorgeschreven vanwege het optreden hepatotoxiciteit waarbij eens per 2 weken de leverfuncties vervolgd dient te worden gedurende het 1e jaar. De nieuwe COMT-remmer opicapone dat met een eenmalige dagdosering kan worden gebruikt is in Nederland nog niet beschikbaar en om die reden niet meegenomen in de richtlijn. In de studie van Ferreira (2016) werden verschillende doses opicapon (5, 25 en 50 mg) en entacapon (200mg) vergeleken met placebo. Er werd geen significant verschil gevonden tussen de interventies. Indien dit middel op de Nederlands markt komt zal bij een volgende update van de richtlijn dit opgenomen worden.
MAO-B remmers als adjuvante therapie bij responsfluctuaties
Selegiline en rasagiline zijn beide effectief als adjuvante therapie bij de ziekte van Parkinson in een gevorderd stadium. Safinamide is een MAO-B remmer en tevens een veratridine-remmer waardoor naast verminderde afbraak van levodopa het vrijkomen van glutamaat geremd zou worden. In enkele studies wordt een verbetering in de kwaliteit van leven gezien, evenals afname in off-tijd en verbetering van on-tijd zonder dyskinesieën. Er is geen goed bewijs voor verbetering in de dagelijkse functies. Safinamide is niet vergeleken met COMT-remmers, andere MAO-B remmers of dopamine-agonisten. Verder is er voor alle MAO-B remmers, behalve selegiline, een bijbetaling voor patiënten nodig waardoor afgewogen moet worden wat de meerwaarde is ten opzichte van de beschikbare adjuvante behandelingen waarvoor geen bijbetaling nodig is. Gelijktijdig gebruik met MAO-A remmers wordt afgeraden vanwege de kans op het ontwikkelen van een serotonerg syndroom, het gebruik van serotonerge anti-depressiva is om dezelfde reden relatief gecontraindiceerd. MAO-B-remmers kunnen bij oudere patiënten, vooral bij hen die een cognitieve stoornis hebben, aanleiding geven tot het ontstaan van hallucinaties en verwardheid, al of niet gepaard gaande met slapeloosheid, op basis van het amfetamine-effect (Fernandez, 2007). Daarnaast kan het amfetamine-effect van selegiline worden gebruikt om de slaperigheid overdag en de inactiviteit te verbeteren (Thorpy, 2005).
Medicamenteuze behandelingen van peak-dose dyskinesieën
Amantadine kan als adjuvante therapie effectief zijn als anti-dyskineticum. Meer recente meta-analyses bij wat meer gevorderde Parkinsonpatiënten bevestigen het anti-dyskinetisch effect naast ook een gering effect op verbetering van off-klachten en meer on-tijd zonder dyskinesieën. Het anti-dyskinetisch effect is groter bij hogere doseringen amantadine. Een nieuw gereguleerde-afgifte preparaat voor amantadine (ADS-5102) is ontwikkeld dat in Nederland vooralsnog niet op de markt is. In twee recente studies werd dit middel onderzocht en werd het anti-dyskinetisch effect en de afname in off-tijd eveneens bevestigd (Oertel, 2017; Pahwa, 2017). Vanwege het glutamaatantagonisme kan amantadine psychosen luxeren, vooral als al cognitieve klachten en verschijnselen aanwezig zijn. Het risico hierop is het grootst bij oudere patiënten met de ziekte van Parkinson waarbij voorzichtigheid dus geboden is met hogere doseringen amantadine (Thomas, 2004). Tevens is voorzichtigheid geboden bij bekende nierfunctiestoornissen of kan een lagere dosering worden voorgeschreven. Voor de behandeling van peak-dose dyskinesieën kunnen ook geavanceerde behandelingen worden overwogen, beschreven in de module Geavanceerde therapieën.
Medicamenteuze behandelingen van loop- en balansstoornissen
Er wordt verondersteld dat loop- en balansproblemen bij parkinson samenhangen met non-dopaminerge stoornissen en andere neurotransmittersystemen meer betrokken zijn zoals cholinerge en noradrenerge systemen. Rivastigmine is een acetylcholine-esterase remmer en om die reden onderzocht bij loop- en balansstoornissen bij parkinson. Er is maar 1 studie gevonden die een matig effect van orale behandeling met rivastigmine heeft aangetoond op balansproblematiek bij Parkinsonpatiënten met responsfluctuaties. De orale behandeling met rivastigmine kent veel bijwerkingen in de vorm van maagdarmklachten en misselijkheid. Transdermale toediening van rivastigmine heeft minder kans op bijwerkingen maar een lagere biologische beschikbaarheid en is niet onderzocht op loop- en balansstoornissen. Het routinematig voorschrijven van rivastigmine bij loop- en balansstoornissen wordt beperkt hierdoor en het voorschrijven dient daarom weloverwogen te worden. Indien er bijkomende cognitieve stoornissen zijn is het voorschrijven van rivastigmine bij loop- en balansstoornissen mogelijk van waarde omdat dit middel een gunstig effect kan hebben op aandachtsfuncties en cognitie. Vermeldingswaard is dat alleen de orale toedieningsvorm formeel is geregistreerd voor de ziekte van Parkinson.
Rationale voor aanbevelingen
De beschreven medicamenteuze behandelingen voor beginnende responsfluctuaties, te weten COMT-remmers, dopamine-agonisten en MAO-B-remmers lijken allen effectief in het verminderen van motorische klachten. De keuze voor een bepaald middel hangt vooral af van individuele patiëntkarakteristieken. Zo is enige terughoudendheid op zijn plaats bij het starten van dopamine-agonisten bij reeds aanwezige cognitieve klachten vanwege de grotere kans bij het optreden van hallucinaties en zal dit ook gelden bij jongere mannen met een verhoogde neiging tot verslavingsgedrag vanwege de hogere kans op impulscontrolestoornissen zoals hyperseksualiteit, punding en gok-/ koopverslaving. Anderzijds zijn er aanwijzingen dat het dopaminerge effect van dopamine-agonisten in het algemeen wat sterker is dan de MAO-B remmers. Bijkomende overmatige slaperigheid of freezing kan er juist toe leiden om eerder voor een MAO-B remmer te kiezen vanwege een remmend effect op de afbraak van noradrenerge neurotransmitters. COMT-remmers geven een 30% verhoging van de effectieve levodopaconcentraties en worden vaak ingezet bij wearing-off. De voor- en nadelen van de behandelingen (zie onderstaande tabel 1) worden met de patiënt besproken, zodat er een gezamenlijk besluit genomen wordt.
Tabel 1 Voor- en nadelen van adjuvante therapie voor beginnende responsfluctuaties (geadapteerd van de NICE-guideline, 2017)
|
Klachten |
Dopamine-agonisten |
MAO-B-remmers |
COMT-remmers |
|
Motorische klachten |
Verbetering van motorische symptomen |
Verbetering van motorische symptomen |
Verbetering van motorische symptomen |
|
ADL |
Verbetering van dagelijkse activiteiten |
Verbetering van dagelijkse activiteiten |
Verbetering van dagelijkse activiteiten |
|
Off-tijd |
Meer reductie van off-tijd |
Reductie van off-tijd |
Reductie van off-tijd |
|
Bijwerkingen |
Gemiddeld risico op bijwerkingen, waaronder impulscontrolestoornissen |
Minder risico op bijwerkingen. Relatieve contraindicatie bij SSRI gebruik |
Meer risico op bijwerkingen |
|
Hallucinaties |
Meer risico op hallucinaties |
Minder risico op hallucinaties |
Minder risico op hallucinaties |
Flowchart

Onderbouwing
Achtergrond
Wanneer patiënten met de ziekte van Parkinson medicamenteus behandeld worden voor motorische klachten kan er na verloop tijd sprake zijn van inadequate symptoombestrijding. De belangrijkste kenmerken hierbij zijn tekenen van het uitwerken van de dopaminerge medicatie (wearing-off) en toename van de motorische klachten. In de vorige richtlijn zijn de belangrijkste uitgangsvragen hierin beschreven als medicamenteuze behandeling van motorische symptomen in de gecompliceerde fase en grotendeels nog actueel. Omdat iedere fase zijn eigen complexiteit kent wordt deze definitie vervangen in de huidige richtlijn naar de behandeling van (beginnende) responsfluctuaties. Hieronder verstaan we zowel wearing-off als “peak-dose” dyskinesieën. Peak-dose dyskinesieën worden vooral geassocieerd met progressie van de ziekte waarbij de therapeutische breedte van levodopa kleiner is geworden en er tijdens de peak-concentraties van dopaminerge medicatie dyskinesieën kunnen optreden. In de praktijk gaat het om de vraag of een adjuvante medicamenteuze behandeling zinvol is voor de patiënt. Doel van medicamenteuze behandeling bij Parkinsonpatiënten met responsfluctuaties is functiebehoud. Voor een aantal behandelmogelijkheden, te weten entacapon, safinamide, rotigotine en amantadine zijn er nieuwe studies bekend die meegenomen worden in de nieuwe richtlijn. Adjuvante medicamenteuze behandelingen voor specifieke motorische klachten waaronder peak-dose dyskinesieën en freezing en/of balansstoornissen worden hier besproken. Diepe hersenstimulatie (deep brain stimluation, DBS) als behandelmogelijkheid bij vroege responsfluctuaties is in 2013 ook onderzocht maar dit zal bij de geavanceerde behandelingen aan bod komen omdat het geen medicamenteuze behandeling betreft. Ook zullen dan de overige geavanceerde behandelingen aan bod komen die ingezet worden voor responsfluctuaties.
Een deel van de tekst over de effectiviteit en de overige overwegingen is overgenomen uit de richtlijn ziekte van Parkinson uit 2010.
Conclusies / Summary of Findings
|
Laag GRADE |
Entacapon als aanvullende therapie lijkt de kwaliteit van leven nauwelijks te verbeteren bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Stowe, 2010; Tolosa, 2014; Olanow, 2004) |
|
Redelijk GRADE |
Safinamide als aanvullende therapie verbetert waarschijnlijk de kwaliteit van leven (gemeten met de PDQ-39) bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Schapira, 2017; Borgohain, 2014a; Borgohain, 2014b) |
|
Laag GRADE |
Rotigotinepleisters verbeteren mogelijk de kwaliteit van leven (gemeten met de PDQ-39 en PDQ-8) bij patiënten met de ziekte van Parkinson en (beginnende) responsfluctuaties.
Bronnen: (Poewe, 2007; Trenkwalker, 2011) |
Reductie off-tijd
|
Redelijk GRADE |
Entacapon als aanvullende therapie vermindert waarschijnlijk de off-tijd bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Stowe, 2010; Olanow, 2004; Rascol, 2004) |
|
Redelijk GRADE |
Safinamide als aanvullende therapie vermindert waarschijnlijk de off-tijd bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Schapira, 2017; Borgohain, 2014a; Borgohain, 2014b) |
|
Redelijk GRADE |
Rotigotinepleisters verbeteren waarschijnlijk de off-tijd bij patiënten met de ziekte van Parkinson en (beginnende) responsfluctuaties.
Bronnen: (Poewe, 2007; LeWitt, 2007; Mizuno, 2014; Nicholas, 2014; Nomoto, 2014) |
|
Redelijk GRADE |
Amantadine verbetert waarschijnlijk de off-time bij patiënten met de ziekte van Parkinson met (beginnende) responsfluctuaties.
Bronnen: (Ory-Magne, 2014; Thomas, 2004; Pahwa, 2016; Wolf, 2010) |
Toename on-tijd zonder hinderlijke dyskinesieën
|
Laag/ Zeer laag GRADE |
Het is onzeker of entacapon als aanvullende therapie effect heeft op de on-tijd zonder dyskinesieën bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Rascol, 2012) |
|
Redelijk GRADE |
Safinamide als aanvullende therapie verbetert waarschijnlijk de on-time zonder hinderlijke dyskinesieën bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Schapira, 2017; Borgohain, 2014a; Borgohain, 2014b) |
|
Redelijk GRADE |
Rotigotinepleisters verbeteren waarschijnlijk de on-tijd zonder hinderlijke dyskinesieën bij patiënten met de ziekte van Parkinson en (beginnende) responsfluctuaties.
Bronnen: (Poewe, 2007; LeWitt, 2007; Mizuno, 2014; Nicholas, 2014) |
|
Redelijk GRADE |
Amantadine verbetert waarschijnlijk de on-tijd zonder hinderlijke dyskinesieën bij patiënten met de ziekte van Parkinson en (beginnende) responsfluctuaties.
Bronnen: (Ory-Magne, 2014; Thomas, 2004; Pahwa, 2016; Wolf, 2010) |
Motorische functies (UPDRS-III)
|
Redelijk GRADE |
Entacapon als aanvullende therapie verbetert waarschijnlijk de motorische functies (gemeten met de UPDRS-III) bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Stowe, 2010; Olanow, 2004) |
|
Redelijk GRADE |
Safinamide als aanvullende therapie verbetert waarschijnlijk de motorische functies (gemeten met de UPDRS-III) bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Stocchi, 2004; Stocchi, 2012; Borgohain, 2014a; Borgohain, 2014b) |
|
Redelijk GRADE |
Rotigotinepleisters als aanvullende therapie verbeteren waarschijnlijk de motorische functies (UPDRS-III) bij patiënten met de ziekte van Parkinson en (beginnende) responsfluctuaties.
Bronnen: (Poewe, 2007; LeWitt, 2007; Trenkwalker, 2011; Mizuno, 2014; Nicholas, 2014; Nomoto, 2014) |
|
Redelijk GRADE |
Amantadine als aanvullende therapie geeft waarschijnlijk een kleine verbetering op de UPDRS III- score in vergelijking met placebo bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Del Dotto, 2001; Luginger, 2000; Ory-Magne, 2014; Sawada, 2010; Silva-Junior, 2005; Snow, 2000; Thomas, 2004; Verhagen Metman, 1998; Wolf, 2010) |
Dagelijkse functies (UPDRS-II)
|
Redelijk GRADE |
Entacapon als aanvullende therapie verbetert waarschijnlijk de dagelijkse functies (ADL) (gemeten met de UPDRS-II) bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Stowe, 2010; Olanow, 2004) |
|
Laag GRADE |
Safinamide als aanvullende therapie verbetert mogelijk de dagelijkse functies (gemeten met de UPDRS-II) bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Schapira, 2017; Borgohain, 2014a; Stocchi, 2012) |
|
Redelijk GRADE |
Rotigotinepleisters verbeteren waarschijnlijk de dagelijkse functies (ADL, gemeten met de UPDRS-II) bij patiënten met de ziekte van Parkinson en (beginnende) responsfluctuaties.
Bronnen: (Poewe, 2007; LeWitt, 2007; Trenkwalker, 2011; Mizuno, 2014; Nicholas, 2014; Nomoto, 2014) |
|
Redelijk GRADE |
Amantadine als aanvullende therapie geeft waarschijnlijk een afname van dyskinesieën in vergelijking met placebo bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Kong, 2017) |
Bijwerkingen
|
Redelijk GRADE |
Safinamide lijkt niet meer bijwerkingen te geven dan een placebotablet bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Stocchi, 2004; Stocchi, 2012; Borgohain, 2014a; Borgohain, 2014b) |
|
Redelijk GRADE |
Rotigotinepleisters lijken geen ernstige bijwerkingen te geven bij patiënten met de ziekte van Parkinson en (beginnende) responsfluctuaties.
Bronnen: (Poewe, 2007; LeWitt, 2007; Trenkwalker, 2011; Mizuno, 2014; Nicholas, 2014; Nomoto, 2014) |
|
Redelijk GRADE |
Amantadine als aanvullende therapie geeft mogelijk een toename in ernstige bijwerkingen in vergelijking met placebo bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Del Dotto, 2001; Goetz, 2013; Luginger, 2000; Pahwa, 2010; Sawada, 2010; Verhagen Metman, 1998; Wolf, 2010) |
Freezing
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van rivastigmine als aanvullende therapie op ‘freezing of gait’ bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Henderson, 2016) |
Loopsnelheid
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van rivastigmine als aanvullende therapie op loopsnelheid bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Henderson, 2016) |
Balans
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van rivastigmine als aanvullende therapie op de balans bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties.
Bronnen: (Henderson, 2016) |
Samenvatting literatuur
Beschrijving studies entacapon (COMT-remmer)
In het Cochrane review van Stowe (2010) werd het effect en de veiligheid van adjuvante therapie bij levodopatherapie onderzocht bij patiënten met de ziekte van Parkinson en motorische klachten. Er werden RCT’s geïncludeerd die dopamine-agnosten, COMT-remmers of MAO-B remmers versus placebo onderzochten. Alle patiënten werden reeds behandeld met levodopa. Er werden 18 studies geïncludeerd die COMT-remmers onderzochten, waarvan 11 naar het effect van entacapon. In totaal werden 2990 patiënten geïncludeerd. Entacapon werd gegeven in een een dosering van 200 mg 2 tot max 10 keer per dag en werd vergeleken met een placebotablet. Studieduur was in de meeste studies 24 weken (range 8 tot 26 weken).
Katsailti (2018) onderzocht in een systematisch review het effect en de veiligheid van COMT-remmers (entacapon, tolcapon en opicapon) versus placebo als een aanvullende therapie op levodopa in patiënten met de ziekte van Parkinson. Alle patiënten gebruikten reeds levodopa. Er werden 12 RCT’s geïncludeerd, waarvan zes studies het effect onderzochten van entacapon. Eén studie Olanow (2004) onderzocht het effect van entacapon en was additief aan de review van Stowe (2010). Omdat de geïncludeerde studies veelal overeen kwamen met het review van Stowe (2010), hebben we de review van Stowe (2010) als uitgangspunt genomen en aangevuld.
Fox (2018) voerde een systematisch review uit naar behandeling van motorische klachten bij de ziekte van Parkinson. Uit deze search kwamen nog eens 2 studies (Rascol, 2012; Tolosa, 2014). Rascol (2012) voerde een dubbelblind RCT uit met drie onderzoeksgroepen: perampanel (4 mg/d), entacapon (200 mg met elke dosis van levodopa) en een placebo. In totaal werden 723 Parkinsonpatiënten geïncludeerd die reeds met levodopa werden behandeld en die off-problemen ervaarden. De studie werd voortijdig gestopt nadat negatieve resultaten bekend werden van twee andere trials. In totaal voltooiden 480 patiënten (66%) de studie die een mediane follow-up duur van 126 dagen. Tolosa (2014) onderzocht de effectiviteit van entacapon als adjuvante therapie op levodopa/carbidopa bij patiënten met vroege parkinson die milde wearing-off klachten ervaarden. In totaal werden 95 patiënten geïndiceerd en 3 maanden gevolgd. De interventie bestond uit levodopa/carbidopa/entacapon (100/25/200 mg of 150/37,5/200 mg). De placebogroep kreeg alleen levodopa/carbidopa (100/25 mg of 100/25 mg).
Resultaten entacapone (COMT-remmer)
Kwaliteit van leven (PDQ-39)
Uit de reviews werden vier studies gevonden die kwaliteit van leven als uitkomstmaat meenamen. Reichmann (2004) gebruikte de PDQ-39 en Fenelon (2003) gebruikte de SF-36. Er werd geen significant verschil gevonden tussen entacapon en de placebogroep. Ook Tolosa (2014) vond geen significant verbetering van entacapon ten opzichte van placebo. In de studie van Olanow (2004) had de groep die entacapon 200 mg kreeg, een significant grotere verbetering van kwaliteit van leven ten opzichte van placebo, gemeten met de PDQ-39.
Afname van off-time
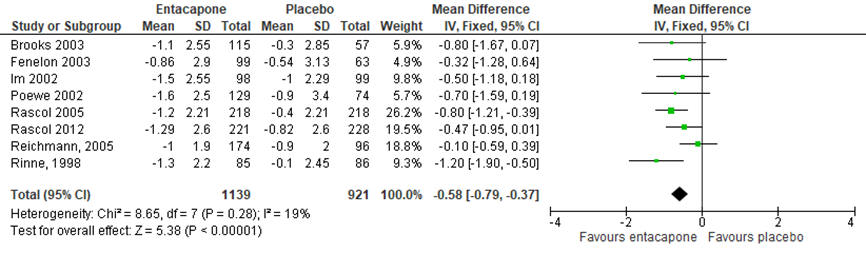
De meta-analyse van Stowe (2010) includeerde 7 RCT’s (n=1611) en kwam tot een gepooled verschil van -0,61 (-0,85 tot -0,39, I2=29%), in het voordeel van entacapon. Met de RCT van Rascol (2012) erbij werd het gepoolde effect -0,58 (95%BI -0,79 tot -0,37) (Figuur 1).
Figuur 1 Meta-analyse entacapon versus placebo op off-tijd (overgenomen uit Stowe, 2010 en aangevuld met Rascol, 2012)
Toename van on-time zonder dyskinesieën
Rascol (2012) zag geen significant verschil tussen de dagelijkse on-tijd (met of zonder dyskinesieën) tussen de entacapongroep en de placebogroep (1,10 versus 0,88 uur).
Motorisch functioneren (UPDRS-III)
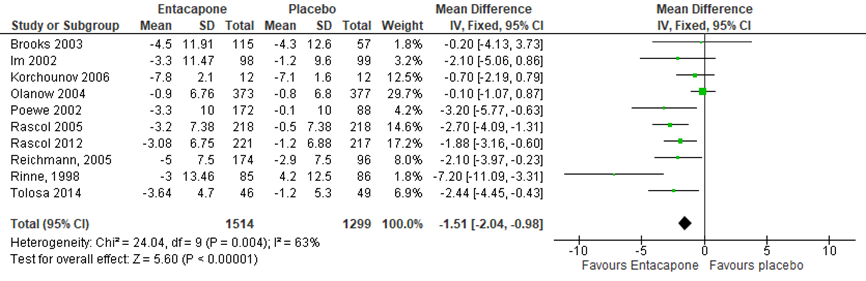
Stowe (2010) voerde een meta-analyse uit naar de effecten van COMT-remmers op de UPDRS-III. In de analyse werden 7 studies meegenomen: het gepoolde effect was -2.41 (95%BI -2,92 tot -1,36) in het voordeel van entacapon (I2=51%) (Stowe, 2011) (Figuur 2). De RCT van Olanow (2004) vond geen significant effect. Rascol (2012) vond een significant grotere verbetering op de motorische functies gedurende on-tijd (UPDRS III) in de entacapongroep (-3,08, 95%BI -3,97 tot -2,19) vergeleken met de placebogroep (-1,20 tot 95%BI -2,12 tot -0,29) (p=0,001). Ook Tolosa (2014) vond een significant grotere verbetering in de entacapongroep vergeleken met de placebo (p=0,01).
Figuur 2 Meta-analyse entacapone versus placebo op UPDRS-III (motorische klachten) (overgenomen uit Stowe, 2010 en aangevuld met Rascol, 2012; Olanow, 2004; Tolosa, 2014)
Dagelijks functioneren (UPDRS-II)
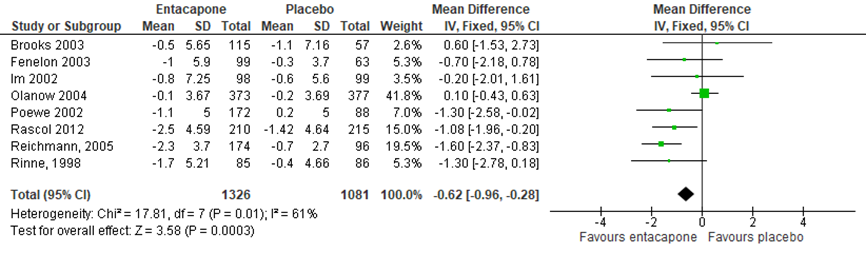
Stowe (2010) voerde een meta-analyse uit naar de effecten van entacapon op de UPDRS-II (ADL). In de analyse werden 6 studies meegenomen; het gepoolde effect was -1.16 (95%BI -1,68 tot -0,64), in het voordeel van entacapon (I2=8%). Met de RCT’s van Olanow (2004) en Rascol (2014) erbij, werd het gepoolde effect -0,62, 95%BI -0,96 tot -0,28), in het voordeel van entacapone. Ook Tolosa (2014) vond een significant grotere verbetering in de entacapongroep vergeleken met de placebo op de UPDRS II (p=0,005).
Figuur 3 Meta-analyse entacapone versus placebo op UPDRS-II (ADL) (overgenomen uit Stowe, 2010 en aangevuld met Rascol, 2012; Olanow, 2004)
Bijwerkingen
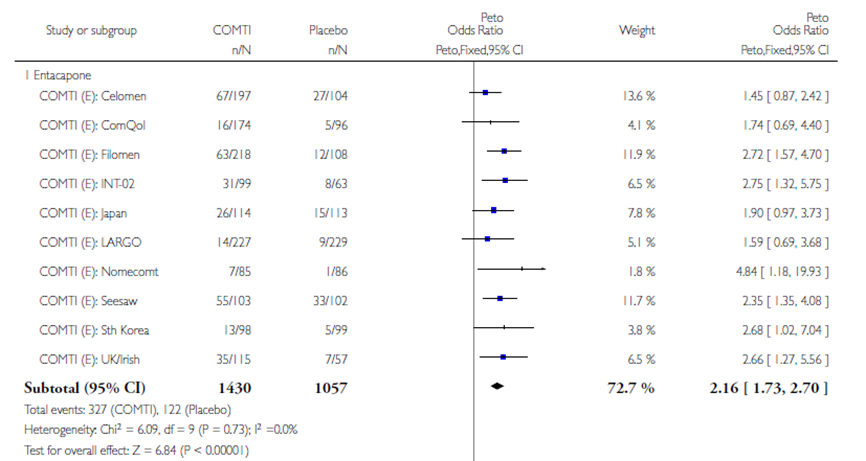
Stowe (2010) voerde een meta-analyse uit naar de bijwerkingen bij entacapon. Het gepoolde effect kwam uit op een odds ratio (OR) van 1,85 (95%BI 1,47 tot 2,33) ten opzicht van placebo. Het aantal dyskinesieën was hoger bij mensen die entacapon kregen dan bij placebo (zie figuur 4).
Figuur 4 Meta-analyse entacapone versus placebo op aantal dyskinesieën (Stowe, 2010)
Bewijskracht van de literatuur entacapon
De bewijskracht voor de uitkomstmaten off-tijd, motorische functies en ADL is met 1 niveau verlaagd gezien het niet behalen van de klinische besluitvormingsgrens (imprecisie). De bewijskracht is gegradeerd als redelijk.
De bewijskracht voor de uitkomstmaten on-tijd en kwaliteit van leven zijn met 2 niveaus verlaagd gezien het geringe aantal patiënten (imprecisie) en inconsistentie. De bewijskracht is gegradeerd als laag.
Beschrijving studies safinamide (MAO-B remmer)
In de systematische review van Binde (2018) werd het effect en de veiligheid van MAO-B remmers onderzocht. In totaal werden vijf studies geïncludeerd die de effectiviteit van safinamide onderzochten (Stocchi, 2004; Stocchi, 2012; Borgohain, 2014a; Borgohain, 2014b (vervolg van Borgohain 2014a); Schapira, 2017). De studies gebruikten 50 mg of 100 mg safinamide per dag als adjuvante therapie op levodopa. Patiënten hadden fluctuaties in motorische functies. Follow-up was bij vier studies 24 weken. Borgohain (2014b) zette een eerdere studie voort en volgde patiënten gedurende 2 jaar. In totaal werden 1731 patiënten geïncludeerd. In de review werden geen meta-analyses uitgevoerd, daarom worden de studies apart besproken.
Resultaten safinamide (MAO-B remmer)
Kwaliteit van leven (PDQ-39)
Na 24 weken was er een significant effect op de PDQ-39 in de 100 mg safinamidegroep, maar niet in de 50 mg-groep (Borgohain, 2014a). Na 2 jaar werd dit effect nog steeds gezien (Borgohain, 2014b). Ook Schapira (2017) zag een significant verschil tussen de interventiegroep (100 mg safinamide) en de placebogroep, in het voordeel van safinamide.
Afname van off-time
Schapira (2017) vond een significant grotere afname in de off-tijd in de safinamidegroep (verschil ten opzichte van baseline -1,56, SD=2,35) vergeleken met de placebogroep (-0,54, SD=2,21) (p<0,01). Ook Borgohain (2014a) zag een significante afname in off-time bij zowel 50 als 100 mg safinamide ten opzichte van placebo. Dit effect bleek stabiel na 2 jaar (Borgohain, 2014b).
Toename van on-time zonder dyskinesieën
Schapira (2017) vond een significant grotere toename in de on-tijd zonder hinderlijke dyskinesieën in de safinamegroep (verschil 1,42, SD=2,80) vergeleken met de placebogroep (0,57, SD=2,47) (p<0,01). Ook Borgohain (2014a) zag een significante toename in on-time zonder enige of zonder hinderlijke dyskinesieën bij zowel 50 als 100 mg safinamide ten opzichte van placebo. Dit effect bleek stabiel na 2 jaar (Borgohain, 2014b).
Motorisch functioneren (UPDRS-III)
Na 24 weken lieten alle studies een significant positief effect zien op de UPDRS-III in zowel de 50 mg safinamidegroepals de 100 mg safinamidegroep, ten opzichte van placebo (Borgohain, 2014b; Schapira (2017). Na 2 jaar werd dit effect nog steeds gezien (Borghogain, 2014b).
Stocchi (2012) vond alleen een positief effect bij 100 mg ten opzichte van placebo, en niet bij 200 mg, welke de primaire vergelijking was. Daarom noemen de auteurs het explorerende analyses. Stocchi (2004) vond alleen een significant verschil in de groep die 1,0 mg/kg kreeg (mediane doses 70 mg/dag) (verschil ten opzichte van baseline 20%) vergeleken met placebo (3,4%).
Dagelijks functioneren (UPDRS-II)
Borgohain (2014a) zag in de groep met 100 mg/dag een positief effect op dagelijks functioneren (gemeten met de UPDRS-II), maar niet in de 50 mg-groep. Na 2 jaar werd dit effect nog steeds gezien (Borghogain, 2014b). Schapira (2017) zag geen verschil tussen de groepen bij 100 mg/dag safinamide.
Stocchi (2012) vond een significante verbetering in de groep die 100 mg/dag safinamide kreeg (verschil ten opzichte van baseline -2,2) vergeleken met placebo (verschil met baseline= -1,2) (p=0,025). De groep met 200 mg/dag verschilde niet van placebo.
Bijwerkingen
De studies laten geen duidelijk verschil zien tussen het aantal bijwerkingen bij patiënten die safinamide kregen of een placebo (Borgohain, 2014; Schapira, 2017; Stocchi, 2004; Stocchi, 2012). Schapira (2017) noteerde bijwerkingen bij 68% van de patiënten in de safinamidegroep en bij 69% in de placebogroep. De meest voorkomende bijwerking was dyskinesie (14,6% in de safinamidegroep en 5,5% in de placebogroep) (Schapira, 2017). Deze getallen komen overeen met die van Borgohain (2014a). In de studie van Stocchi (2012) werden als meest voorkomende bijwerkingen genoemd (< 10% in iedere groep): misselijkheid, hoofdpijn, buikpijn, overgeven, zuurbranden, hoesten, hypertensie, wazig zien, gastritis, perifeer oedeem, nasofaryngitis, duizeligheid, rugpijn en tremor.
Bewijskracht van de literatuur safinamide
De bewijskracht voor de uitkomstmaten kwaliteit van leven, off-tijd, on-tijd en motorische functies is met 1 niveau verlaagd gezien het niet behalen van de klinische besluitvormingsgrens (imprecisie). De bewijskracht is gegradeerd als redelijk.
De bewijskracht voor de uitkomstmaat ADL is met 2 niveaus verlaagd gezien het geringe aantal patiënten (imprecisie) en inconsistentie. De bewijskracht is gegradeerd als laag.
Effectiviteit MAO-B-remmers - overgenomen uit richtlijn 2010
In de NICE-richtlijn zijn tien dubbelblinde RCT’s beschreven betreffende de effectiviteit van MAO-B-remmers als adjuvante therapie bij levodopa bij patiënten met de ziekte van Parkinson in het latere stadium (Presthus, 1987; PSG, 2005; Brodersen, 1985; Golbe, 1987; Golbe, 1988; Hubble, 1993; Lieberman, 1987; Rascol, 2005; Sivertsen, 1989; Waters, 2004). Belangrijke methodologische beperkingen van de trials waren het ontbreken van powerberekeningen, een kleine omvang van de onderzoekspopulaties (variërend van 19 tot 96 personen met een gemiddelde van 54,6 personen) en een korte duur van de studies (variërend van 3 tot 8 weken, gemiddeld 6,7 weken). Het merendeel van de studies onderzocht de gebruikelijke dosering van selegiline van 10 mg/dag. Twee studies richtten zich op het effect van rasagiline. Rasagiline werd in een studie (n=687) vergeleken met entacapon en placebo over een periode van 18 weken (Kostic, 2002). Twee verschillende doses rasagiline (0,5 of 1 mg) werden in de andere studie (n=472) met een duur van 26 weken, vergeleken met een placebo (Cooper, 1992). Een vergelijking van de resultaten van MAO-B-remmers met placebo is in tabel 2 weergegeven.
Conclusie
Selegiline en rasagiline zijn beide effectief als adjuvante therapie bij de ziekte van Parkinson in een gevorderd stadium (niveau 2).
B Presthus, 1978; PRESTO study, 2005; Brodersen, 1985; Golbe, 1987; Golbe, 1988; Hubble, 1993; Lieberman, 1987; Rascol, 2005; Sivertsen, 1989; Waters, 2004; Lew, 2007; Ondo, 2007.
Tabel 2 MAO-B remmer vergeleken met placebo

Beschrijving studies rotigotine (dopamine-agonist)
In de richtlijn ziekte van Parkinson uit 2010 werden twee studies geïncludeerd die het effect van rotigotinepleisters onderzochten (Poewe, 2007; LeWitt, 2007). Uit de huidige literatuursearch kwamen daar nog drie studies bij):
- Poewe (2007) voerde een dubbelblind 3-armige RCT uit, waarbij patiënten rotigotinepleisters (maximaal 16 mg/24uur; n=204), pramipexol (maximaal 4,5 mg/dag oraal; n=201) of een placebo (n=101) kregen toegewezen gedurende 6 maanden. In totaal voltooiden 427 patiënten de studie (84%).
- LeWitt (2007) voerde een dubbelblinde RCT uit bij patiënten met de ziekte van Parkinson en die ≥ 2,5uur per dag off-tijd ervaarden. Patiënten werden gerandomiseerd naar rotigotinepleisters met 8mg/24 uur (n=120), rotigotinepleisters met 12 mg/24 uur (n=111) of placebopleisters (n=120). De studie duurde 24 weken.
- Trenkwalker (2011) includeerde patiënten die motorisch klachten hadden in de vroege morgen. In totaal kregen 190 patiënten rotigotine (2 tot 16 mg/24uur) en 97 patiënten een placebo. De dosis werd gedurende 8 weken geoptimaliseerd en constant gehouden tijdens de daarop volgende 4 weken. In totaal voltooiden 246 (86%) de studie.
- Mizuno (2014) voerde een dubbelblinde 3-armige RCT uit naar het effect van rotigotine en ropinirol. Patiënten met responsfluctuaties werden gerandomiseerd naar rotigotine pleisters (2 tot 16 mg/24uur; n=169), ropinirol tabletten (0,75 tot 15 mg/dag; n=167) of placebo (n=85). Gedurende maximaal 12 weken werden patiënten ingesteld, waarna een stabiele fase van ten minste 4 weken volgde en een afbouwfase van nog eens 4 weken.
- In de dubbelblinde, internationale RCT van Nicholas (2014) werden patiënten geïncludeerd die ≥2,5 uur per dag off-tijd ervaarden met stabiele doses van levodopa. Patiënten werden gerandomiseerd naar een van de vier doses van rotigotine - 2 mg/24u (n=101), 4 mg/24u (n=107), 6 mg/24u (n=104) of 8 mg/24u (n=94) - of een placebo (n=108). Na 12 weken had 80% van de gerandomiseerde patiënten de studie voltooid.
- Nomoto (2014) voerde een dubbelblinde RCT uit bij Japanse Parkinsonpatiënten met motorische complicaties. In totaal werden 174 patiënten gerandomiseerd naar rotigotine- of placebopleisters. Rotigotine werd gedurende 8 weken opgehoogd van 2 mg/24 uur naar een maximum van 16 mg/24 uur. De titratieperiode werd gevolgd door een stabiele fase van 4 weken, een afbouwfase van 2 weken en een follow-up periode van 1 week.
Resultaten rotigotine
Kwaliteit van leven (PDQ-39)
In totaal namen 2 studies kwaliteit van leven als uitkomstmaat mee. Poewe (2007) vond een significante verbetering van de kwaliteit van leven ten opzichte van placebo (gemeten met de PDQ-39) in zowel de rotigotinegroep (gemiddelde verandering = -4,7, SD=9,2; p=0,001) als in de pramipexolgroep (gemiddelde verandering = -5,1, SD=10,1; p=0,003). Beide behandelingen verschilden niet van elkaar in effect. Trenkwalker (2011) gebruikte de PDQ-8 om kwaliteit van leven te meten. De rotigotinegroep verbeterde significant meer (-6,9, SD=11,9) dan de placebogroep (-1,2, SD=13,7) (gemiddeld verschil = -5,74, 95%BI -8,74 tot -2,75; p=0,002).
Afname van off-tijd
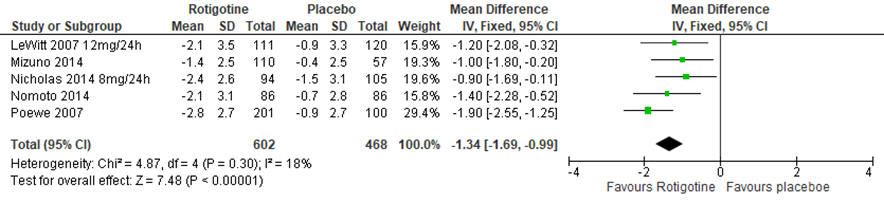
De 5 studies die off-tijd meenamen als uitkomstmaat, rapporteerden allemaal een grotere afname van off-tijd in de rotigotinegroep vergeleken met de placebogroep. Het gepoolde verschil kwam neer op: 1,34 (95%BI -1,69 tot -0,99) in het voordeel van rotigotine (zie figuur 5) (Poewe, 2007; LeWitt, 2007; Mizuno, 2014; Nicholas, 2014; Nomoto, 2014).
Figuur 5 Forestplot met meta-analyse voor de uitkomstmaat Off-tijd
Toename van on-tijd zonder hinderlijke dyskinesieën
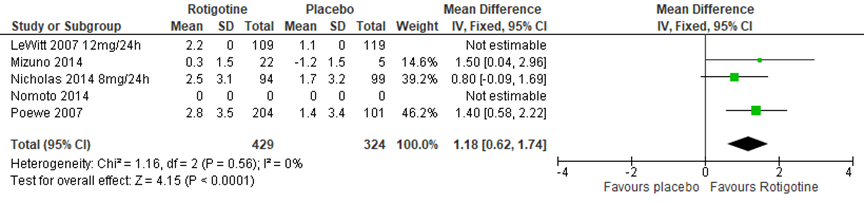
Vijf studies namen on-tijd zonder hinderlijke dyskinesieën mee als uitkomstmaat, 4 daarvan rapporteerden een grotere toename van on-tijd in de rotigotinegroep vergeleken met de placebogroep. Het gepoolde verschil was: 1,18 (95%BI 0,62 tot 1,74) in het voordeel van rotigotine (zie figuur 6) (Poewe, 2007; Mizuno, 2014; Nicholas, 2014). LeWitt (2007) zag ook een verbetering van on-tijd (p=0,008), maar vanwege het ontbreken van variatiematen, kon het gemiddelde verschil niet worden berekend.
Figuur 6 Forestplot met meta-analyse voor de uitkomstmaat on-tijd zonder hinderlijke dyskinesieën
Motorische klachten - UPDRS-III
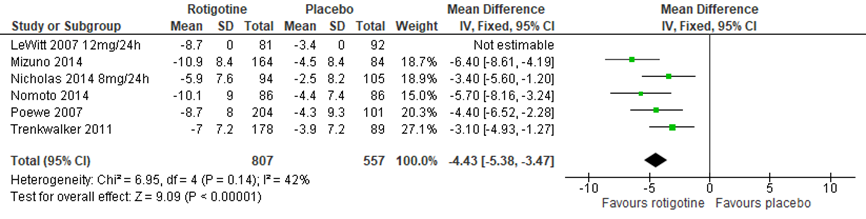
De 6 geïncludeerde studies namen de UPDRS-III mee als uitkomstmaat voor motorische functies. Ze zagen allemaal een significante verbetering in de rotigotinegroep ten opzichte van de placebogroep. Het gepoolde effect was -4,43 (95%BI -5,38 tot -3,47) (Poewe, 2007; Trenkwalker, 2011; Mizuno, 2014; Nomoto, 2014). LeWitt (2007) zag ook een verbetering op de UPDRS-III (p<0,001), maar vanwege het ontbreken van variatiematen, kon het gemiddelde verschil niet worden berekend.
Figuur 7 Forestplot met meta-analyse voor de uitkomstmaat UPDRS-III
Dagelijks functioneren (UPDRS-II)
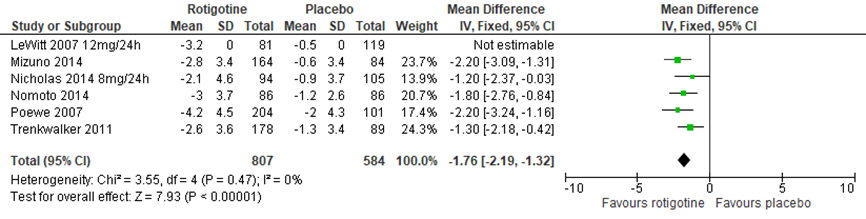
De 6 geïncludeerde studies namen de UPDRS-II mee als uitkomstmaat voor dagelijks functioneren. Ze zagen allemaal een significante verbetering in de rotigotinegroep ten opzichte van de placebogroep. Het gepoolde effect was -1,76 (95%BI -2,19, -1,32) (figuur 8) (Poewe, 2007; Trenkwalker, 2011; Mizuno, 2014; Nomoto, 2014). LeWitt (2007) zag ook een verbetering op de UPDRS-II (p=0,002), maar vanwege het ontbreken van variatiematen, kon het gemiddelde verschil niet worden berekend.
Figuur 8 Forestplot met meta-analyse voor de uitkomstmaat UPDRS-II
Bijwerkingen
- Poewe (2007) rapporteerde behandelingsgerelateerde complicaties bij 66% in de placebogroep, bij 69% in de rotigotinegroep en 69% in de pramipexolegroep. De volgende bijwerkingen werden gemeld die vaker van 5% voorkwamen: misselijkheid, huidreacties op de toedieningsplaats (erytheem en pruritis), rugpijn, slapeloosheid, dyskinesieën, duizeligheidheid, hoofdpijn, hallucinaties, orthostatische hypotensie.
- LeWitt (2007) concludeerde dat rotigotine goed werd verdragen. Tijdens de titratieperiode waren de meest genoemde bijwerkingen: misselijkheid, braken, constipatie, duizeligheid, dyskinesieën en hoofdpijn. Tijdens de stabiele fase werden er minder bijwerkingen gemeld.
- De meest gerapporteerde bijwerkingen (> 5%) in de studie van Trenkwalker (2011) waren misselijkheid, huidreacties op de toedieningsplaats, duizeligheid, dyskinesieën, hoofdpijn. De meeste bijwerkingen waren licht of matig van intensiteit (placebo 96%, rotigotine 97%). Ernstige bijwerkingen werden in beide groepen bij 5% van de patiënten gerapporteerd.
- Mizuno (2014) rapporteerde bijwerkingen meer bijwerkingen in de rotigotinegroep (89%) dan in de placebogroep (69%; p<0,001) en meer dan in de ropinirolgroep (78%, p=0,008) De meest gerapporteerde bijwerkingen (≥ 3%) waren: huidreacties op de toedieningsplaats, nasofaryngitis, dyskinesieën, misselijkheid, braken, slapeloosheid, kneuzing, orthostatische hypotensie, verhoogde bloed-creatinekinasewaarden, hallucinaties, rugpijn, cystitis, bovenste luchtweginfectie, perifeer oedeem.
- Het aantal gerapporteerde bijwerkingen in de studie van Nicholas (2014) leek gelijk over de groepen (rotigotine 2 mg/24u: 70%; rotigotine 4 mg/24u: 73%; rotigotine 6 mg/24u: 74%; rotigotine 8 mg/24u: 73%; placebo: 72%). De meest gerapporteerde bijwerkingen (≥ 5%) waren: huidreacties op de toedieningsplaats, misslijkheid, dyskinesieën, duizeligheid, hoofdpijn, slaperigheid, vallen, slapeloosheid, vermoeidheid, droge mond, constipatie, tremor, verwardheid, arthralgia, rugpijn, urineweginfectie, bovenste luchtweginfectie, orthostatische hypotensie.
- In de studie van Nomoto (2014) rapporteerde 94% van de patiënten in de rotigotinegroep en 88,5% in de placebogroep bijwerkingen. De meestgenoemde bijwerkingen (≥ 5%) waren: misselijkheid, constipatie, braken, huidreacties op de toedieningsplaats, erythema en pruritus, nasofaryningitis, vallen, kneuzing, verhoogde bloed creatinefosfokinasewaarden, gewichtsverlies, dyskinesieën, duizeligheid, hoofdpijn, slapeloosheid, hallucinaties.
Bewijskracht van de literatuur rotigotine
De bewijskracht voor de uitkomstmaten kwaliteit van leven, off-tijd, on-tijd en motorische functies is met 1 niveau verlaagd gezien het niet behalen van de klinische besluitvormingsgrens (imprecisie). De bewijskracht is gegradeerd als redelijk.
De bewijskracht voor de uitkomstmaat ADL is met 2 niveaus verlaagd gezien het geringe aantal patiënten (imprecisie) en inconsistentie. De bewijskracht is gegradeerd als laag.
Dopamine-agonisten -overgenomen uit richtlijn 2010
In de NICE-richtlijn werden veertien studies gevonden waaronder zeven Cochrane reviews (Clarke, 2000a; Clarke, 2000b; Clarke, 2000c; Clarke 2000d; Clarke, 2001a; Clarke, 2001b; Van Hilten, 2000) en zeven additionele RCT’s (Mizuno, 2003; Pogarell, 2002; Wong, 2003; Barone, 2007; LeWitt, 2007; Pahwa, 2007; Poewe, 2007), waarin de effectiviteit van het toevoegen van dopamine-agonisten in vergelijking met een placebo werd onderzocht. In de Cochrane-reviews werden ook fase-II- en -III-studies en ongepubliceerde studies opgenomen. Tevens werden ongepubliceerde gegevens verkregen van onderzoekers of fabrikanten. De drie RCT’s waren methodologisch van een goede kwaliteit daar er sprake was van een adequate blindering van toewijzing, de studie dubbel geblindeerd was en er een intention-to-treat-analyse plaatsvond.
Met betrekking tot de kwaliteit van leven werden in twee trials, waarvan één geïncludeerd in de Cochrane-review180 en de andere gepubliceerd nadat de review was verschenen, significante uitkomsten met pramipexol gerapporteerd. De eindpunten bestonden uit functionele status, mentale gesteldheid, kwaliteit van leven, ADL en de ernst van de tremor. Bij de behandeling met dopamine-agonisten bromocriptine, pergolide, pramipexol en ropinirol werd een verbetering in motorische complicaties waargenomen en de dopamine-agonisten maakten reductie van levodopadoseringen mogelijk: off-tijdreducties met twee uur werden gerapporteerd en een reductie van de levodopadosering tot ruim 230 mg vond plaats.
Ropinirol als add-on-therapie werd in een RCT (n=243) met een follow-upduur van 16 weken onderzocht. Er was een gemiddelde reductie in de UPDRS motorische score in het voordeel van ropinirol in vergelijking met placebo (-9,5 versus -4,5, p<0,05) (Mizuno, 2003).
In een andere RCT met een follow-upduur van 24 weken (n=393) werd een vergelijking gemaakt tussen ropinirol als add-on en placebo. Na 24 weken was er een reductie in dagelijkse off-tijd van 2,1 uur in de ropinirolgroep in vergelijking met 0,3 uur in de placebogroep (verschil 1,7 uur (95% BI -2,34 tot 1,09).189 In alle bovenstaande studies werden dopaminerge bijwerkingen beschreven maar over het algemeen waren deze licht van aard en veroorzaakten bij slechts een klein percentage van de deelnemers het stoppen van deelname aan de studie.
Conclusie
Adjuvante behandeling met dopamine-agonisten reduceert de off-tijd met één tot twee uur en de dosering van levodopa met ruim 230 mg. Dit gaat soms gepaard met een toename van dopaminerge bijwerkingen waaronder hallucinaties en orthostatische hypotensie (niveau 1).
A1: Van Hilten, 1998; Clarke, 1999; Clarke, 1999; Clarke, 2000; Clarke, 2001.
A2: Pogarell, 2002; Wong, 2003; Mizuno, 2003; Poewe, 2007; Barone, 2007; LeWitt, 2007; Pahwa, 2007.
Beschrijving studies amantadine
De systematische review van Kong (2017) is als basis gebruikt voor de uitwerking van de literatuur. Kong (2017) dekt de literatuur tot 2016. In totaal werden elf studies geïncludeerd in de meta-analyse waarvan er zeven een gerandomiseerd onderzoeksdesign gebruikten met parallelle groepen en drie een gerandomiseerd cross-over design gebruikten waarbij participanten afwisselend amantadine of placebo kregen. In totaal werden 356 mensen met die ziekte van Parkinson geïncludeerd. Alle deelnemers hadden dyskinesieën, de ziekteduur varieerde tussen de studies van 7,9 tot 16,8 jaar en de leeftijd varieerde van 59,7 tot 67 jaar. De UPDRS-IV werd gebruikt om dyskinesie vast te stellen. De aanwezigheid van dyskinesieën werd onderzocht nadat de laatste dosis medicatie werd gegeven (welke varieerde van 0 tot 12 maanden tussen de studies). De dosis amantadine varieerde tussen de studies van 100 mg/dag tot 350 mg/dag, de behandelduur varieerde van drie uur tot drie maanden. De volgende voor de werkgroep relevante uitkomstmaten zijn meegenomen in de analyse: Dyskinesia Rating scale (DRS) en de UPDRS III.
Resultaten amantadine
Kwaliteit van leven (PDQ-39)
Het effect van amantadine op de kwaliteit van leven is niet onderzocht.
Off-tijd
Het effect van amantadine op de off-time werd in vier RCT’s onderzocht (Ory-Magne, 2014; Thomas, 2004; Pahwa, 2016; Wolf, 2010). Het verschil in de gemiddelde off-time was MD= -0,97 uur (95%BI -1,64 tot -0,31), statistisch significant in het voordeel van de amantadine-groep vergeleken met de placebogroep, p=0,004; n=169 mensen met de ziekte van Parkinson) (figuur 9).
Figuur 9 Forestplot met meta-analyse voor de uitkomstmaat off-time
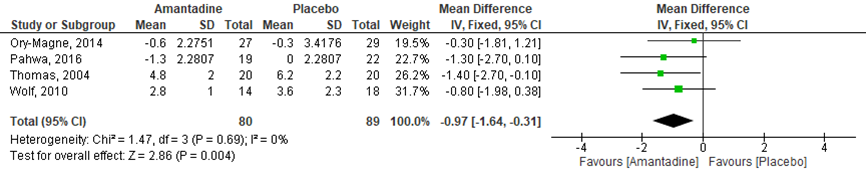
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2 statistische heterogeniteit; CI: betrouwbaarheidsinterval
Toename van on-tijd zonder dyskinesieën
Het effect van amantadine op de on-tijd zonder hinderlijke dyskinesieën werd in vier RCT’s onderzocht (Ory-Magne, 2014; Thomas, 2004; Pahwa, 2016; Wolf, 2010). Het verschil in de gemiddelde on-tijd was MD= 1,33 uur (95%BI 0,47 tot 2,18), statistisch significant in het voordeel van de amantadine-groep vergeleken met de placebogroep, p=0,002; n=169 mensen met de ziekte van Parkinson) (figuur 10).
Figuur 10 Forestplot met meta-analyse voor de uitkomstmaat on-tijd
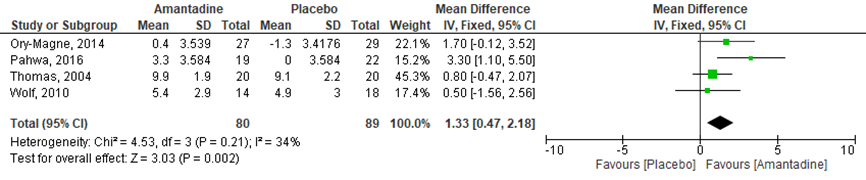
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2 statistische heterogeniteit; CI: betrouwbaarheidsinterval
Dyskinesie (Dyskinesie Rating Scale)
Het effect van amantadine op de DRS werd in tien RCT’s onderzocht (Del Dotto, 2001; Luginger, 2000; Ory-Magne, 2014; Pahwa, 2010; Sawada, 2010; Silva-Junior, 2005; Snow, 2000; Thomas, 2004; Verhagen Metman, 1998; Wolf, 2010). Het verschil in de gemiddelde DRS III-score was -6,02 punten (95%BI -9,30 tot -2,74), statistisch significant in het voordeel van de amantadine-groep vergeleken met de placebogroep (p<0,001; n=375). De subgroepanalyse laat zien dat zowel de studies die een hoge dosis amantadine (> 200 mg per dag) als een lage dosis amantadine (≤ 200 mg per dag) een statistisch grotere afname laten zien in de DRS-score, respectievelijk -6,25 punten (95%BI -10,26 tot -2,24) en -4,56 punten (95%BI -6,69 tot -2,42), statistisch significant in het voordeel van de amantadinegroep (figuur 11).
Figuur 11 Forestplot met meta-analyse voor de uitkomstmaat
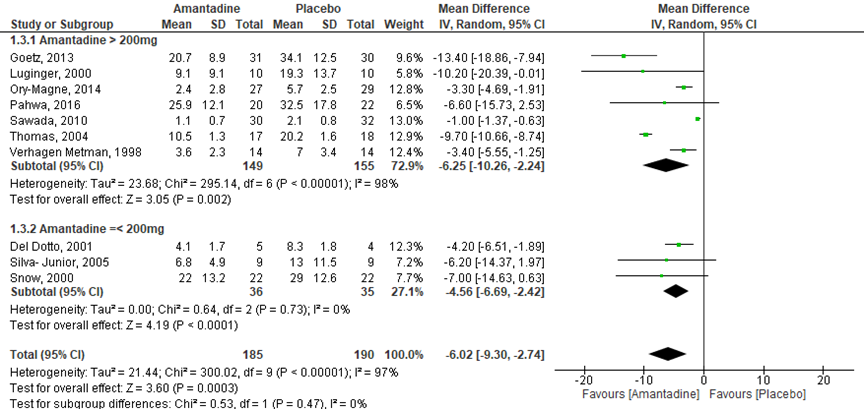
DRS-score. Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2 statistische heterogeniteit; CI: betrouwbaarheidsinterval
Motorisch functioneren - (UPDRS-III)
Het effect van amantadine op de UPDRS-III werd in negen RCT’s onderzocht (Del Dotto, 2001; Luginger, 2000; Ory-Magne, 2014; Sawada, 2010; Silva-Junior, 2005; Snow, 2000; Thomas, 2004; Verhagen Metman, 1998; Wolf, 2010). Het verschil in de gemiddelde UPDRS-III-score was -0,29 punt (95%BI -0,52 tot -0,06), statistisch significant in het voordeel van de amantadine-groep vergeleken met de placebogroep, p=0,001; n=303 mensen met de ziekte van Parkinson) (figuur 12).
Figuur 12 Forestplot met meta-analyse voor de uitkomstmaat UPDRS III-score.
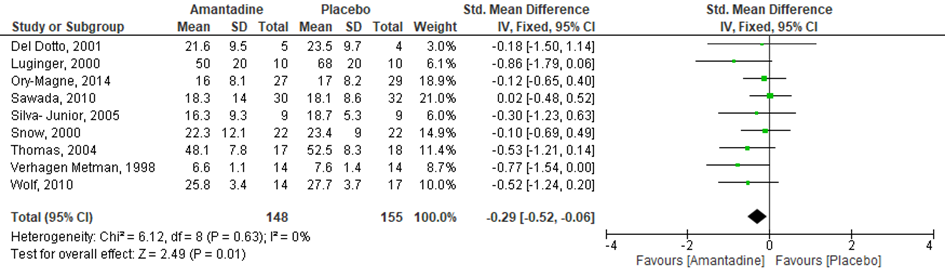
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2 statistische heterogeniteit; CI: betrouwbaarheidsinterval
Dagelijks functioneren (UPDRS-II)
Het effect van amantadine op de UPDRS-II score is niet onderzocht.
Bijwerkingen/Adverse events
Het aantal mensen met de ziekte van Parkinson met ernstige bijwerkingen tijdens de behandeling werd in zeven RCT’s onderzocht (Del Dotto, 2001; Goetz, 2013; Luginger, 2000; Pahwa, 2010; Sawada, 2010; Verhagen Metman, 1998; Wolf, 2010). Het percentage mensen met de ziekte van Parkinson met ernstige bijwerkingen was 48% in de amantadinegroep (n=60) versus 24,8% in de placebogroep (n=32). Het gemiddelde relatieve risico op ernstige bijwerkingen was hoger in de amantadinegroep vergeleken met de placebogroep (RR=1,86; 95%BI 1,38 tot 2,52; p<0,00001; n=254) (figuur 13).
Figuur 13 Forestplot met meta-analyse voor de uitkomstmaat ernstige bijwerkingen
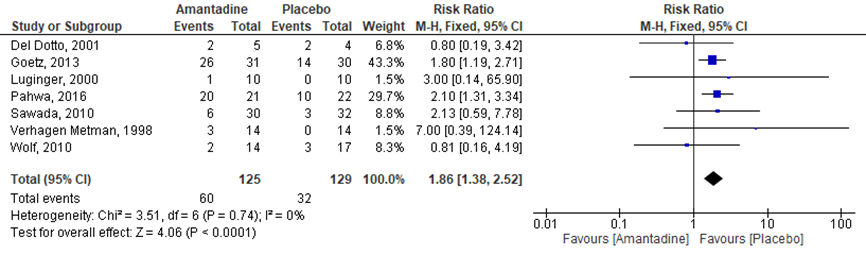
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2 statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur amantadine
De bewijskracht voor de uitkomstmaten off-tijd, on-tijd zonder hinderlijke dyskinesieën en motorische functies (UPDRS-III), dyskinesieën (DRS) en ernstige bijwerkingen is met 1 niveau verlaagd gezien het geringe aantal patiënten (imprecisie). De bewijskracht is gegradeerd als redelijk.
Beschrijving studies rivastigmine (acetylcholinesterase-remmer)
In de review van Fox (2018) werd één studie geïncludeerd die het effect van rivastigmine onderzocht bij patiënten met de ziekte van Parkinson en beginnende responsfluctuaties (Henderson, 2016). In deze dubbelblinde fase 2-studie werd rivastigmine vergeleken met een placebocapsule. Rivastigmine werd getitreerd van 3 mg per dag naar 12 mg per dag gedurende 12 weken. Totale studieduur was 32 weken. Patiënten werden geïncludeerd als ze ten minste een keer waren gevallen het afgelopen jaar. In totaal werden 130 patiënten geïncludeerd, 88% voltooide de studie.
Resultaten rivastigmine
Lopen
De loopsnelheid (m/s) was significant beter in de rivastigminegroep dan in de placebogroep, zowel bij een normale looptest (gecorrigeerd verschil tussen de groepen: 0,11, 95%BI 0,04 tot 0,18), een looptest met een simpele cognitieve taak (gecorrigeerd verschil 0,08, 95%BI 0,00 tot 0,16) als een looptest met een complexe cognitieve taak (gecorrigeerd verschil 0,08, 95%BI 0,00, 0,16) (Henderson, 2016).
Freezing of gait
Het aantal patiënten dat freezing of gait in de maand voorafgaan aan de eindmeting ervaarde, verschilde niet tussen de rivastigminegroep (63%) dan in de placebogroep (76%). Het gecorrigeerd verschil tussen de groepen was 0,46 (95%BI 0,13 tot 1,60, p=0,22) (Henderson, 2016).
Balans
Henderson (2016) zag een verbetering in de balans (controlled leaning balance) in de rivastigminegroep vergeleken met de controlegroep.
Bewijskracht van de literatuur rivastigmine
De bewijskracht voor alle uitkomstmaten is met 2 niveaus verlaagd gezien het geringe aantal patiënten (imprecisie). De bewijskracht is gegradeerd als laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
P: patiënten met de ziekte van Parkinson en beginnende responsfluctuaties;
I: medicamenteuze behandeling: entacapon, selegiline, safinamide, rivastigmine, rotigotine, amantadine;
C: andersoortige behandeling, placebo;
O: QoL (PDQ, PDQ8), UPDRS-III, lopen, bijwerkingen, ADL, timed-up and go test (TUG), reductie in off-tijd, toename in on-tijd zonder dyskinesieën.
Relevante uitkomstmaten
De werkgroep achtte kwaliteit van leven en reductie van off-tijd voor de besluitvorming cruciale uitkomstmaten; en toename van on-tijd, motorische functies, dagelijks functioneren, loopsnelheid en time up and go test voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt:
- Parkinson’s Disease Quality of Life Scale (PDQ-39): de werkgroep definieerde een verbetering van -4,22 punten of een achteruitgang van +4,72 punten als een klinisch (patiënt) relevant verschil. (Horvath, 2017).
- Afname van (motorische) off-time: de werkgroep definieerde iedere significante afname van off-time als klinisch (patiënt) relevant verschil.
- Toename van on-time zonder dyskinesieën: de werkgroep definieerde iedere significante toename ten opzichte van baseline als klinisch (patiënt) relevant verschil.
- Motorisch functioneren: de werkgroep definieerde een verbetering van 5 punten op de UPDRS-III als een klinisch (patiënt) relevant verschil.
- Dagelijks functioneren: de werkgroep definieerde een verbetering van 5 punten op de UPDRS-II als een klinisch (patiënt) relevant verschil.
- Loopsnelheid (alleen bij selegeline en rivastigmine).
- Time up and go test (alleen bij selegeline en rivastigmine).
- Bijwerkingen.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is 30 november 2018 met relevante zoektermen gezocht naar systematische reviews en vergelijkend onderzoek dat de zoekvraag kon beantwoorden. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 552 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCT’s bij patiënten met parkinson en beginnende responsfluctuaties, waarbij een adjuvant medicament werd onderzocht. Op basis van titel en abstract werden in eerste instantie 27 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 24 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 3 studies definitief geselecteerd. Van een review (Seppi, 2013) was een update bekend (Fox, 2018); deze is toegevoegd aan de geïncludeerde studies.
Voor de effectiviteit van rotigotine, dopamine-agonisten en amantadine zijn geen nieuwe literatuuranalyses uitgevoerd maar is de tekst integraal overgenomen uit de richtlijn uit 2010. Voor selegiline werden geen studies gevonden die na de oude richtlijn gepubliceerd waren. Daarom is voor selegiline ook de tekst van de richtlijn uit 2010 overgenomen.
Amantadine was per abuis niet als zoekterm in de huidige search opgenomen, maar wel in de search over geavanceerde therapieën. De studies over amantadine (n=2) zijn in de voorliggende module uitgewerkt.
Resultaten
Drie systematische reviews zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Barone P, Lamb J, Ellis A, Clarke Z. Sumanirole versus placebo or ropinirole for the adjunctive treatment of patients with advanced Parkinson’s disease. Mov Disord. 2007;22(4):483-9.
- Binde CD, Tvete IF, Gåsemyr J, Natvig B, Klemp M. A multiple treatment comparison meta-analysis of monoamine oxidase type B inhibitors for Parkinson's disease. 2018; British Journal of Clinical Pharmacology. 84(9):1917-27.
- Clarke CE, Davies P. Systematic review of acute levodopa and apomorphine challenge tests in the diagnosis of idiopathic Parkinson’s disease. J Neurol Neurosurg Psychiatry. 2000;69(5):590-4.
- Clarke CE, Speller JM. Lisuride for levodopa-induced complications in Parkinson’s disease. Cochrane Database Syst Rev. 2000;(2):CD001515.179. Clarke CE, Speller JM. Pergolide versus bromocriptine for levodopa-induced motor complications in Parkinson’s disease. Cochrane Database Syst Rev. 2000;(2):CD000236.180. Clarke CE, Speller JM, Clarke JA. Pramipexole for levodopa-induced complications in Parkinson’s disease.
- Clarke CE, Deane KH. Cabergoline for levodopa-induced complications in Parkinson’s disease. Cochrane Database Syst Rev. 2001;(1):CD001518.182.
- Clarke CE, Deane KH. Ropinirole for levodopa-induced complications in Parkinson’s disease. Cochrane Database Syst Rev. 2001;(1):CD001516.
- Cooper JA, Sagar HJ, Doherty SM, Jordan N, Tidswell P, Sullivan EV. Different effects of dopaminergic and anticholinergic therapies on cognitive and motor function in Parkinson’s disease. A follow-up study of untreated patients. Brain. 1992;115:1701-25.
- Fernandez HH, Chen JJ. Monoamine oxidase-B inhibition in the treatment of Parkinson’s disease. Pharmacother.2007;27:174S-85.
- Fox SH, Katzenschlager R, Lim S-Y, Barton B, et al on behalf of the Movement Disorder Society Evidence-Based Medicine Committee. International Parkinson and Movement Disorder Society Evidence-Based Medicine Review: Update on Treatments for the Motor Symptoms of Parkinson’s Disease. 2018 Movement Disorders. 33 (8): 1248-1266.
- Goetz CG, Poewe W, Rascol O, Sampaio C. Evidence-based medical review update: pharmacological and surgical treatments of Parkinson’s disease: 2001 to 2004. Mov Disord. 2005;20(5):523-39.
- Golbe LI, Lieberman AN, Muenter MD, Ahlskog JE, Gopinathan G, Neophytides AN, et al. Deprenyl in the treatment of symptom fluctuations in advanced Parkinson’s disease. Clin Neuropharmacol. 1988;11(1):45-55.
- Hubble JP, Koller WC, Waters C. Effects of selegiline dosing on motor fluctuations in Parkinson’s disease. Clin Neuropharmacol. 1993;16(1):83-7.
- Kostic VS, Marinkovic J, Svetel M, Stefanova E, Przedborski S. The effect of stage of Parkinson’s disease at the onset of levodopa therapy on development of motor complications. Eur J Neurol. 2002;9(1):9-14.
- LeWitt PA, Lyons KE, Pahwa R. Advanced Parkinson disease treated with rotigotine transdermal system: PREFER Study. Neurology. 2007;68(16):1262-7.
- Lieberman AN, Gopinathan G, Neophytides A, Foo SH. Deprenyl versus placebo in Parkinson disease: a doubleblind study. N Y State J Med. 1987;87(12):646-9.
- Mizuno Y, Nomoto M, Hasegawa K, Hattori N, Kondo T, Murata M, et al. Rotigotine versus ropinirole in advanced stage Parkinson's disease: Adouble-blind study. 2014; Parkinsonism and Related Disorders. 20(12):1388-93.
- Mizuno Y, Yanagisawa N, Kuno S, Yamamoto M, Hasegawa K, Origasa H, et al. Randomized, double-blind study of pramipexole with placebo and bromocriptine in advanced Parkinson’s disease. Mov Disord. 2003;18(10):1149-56.
- Möller, J. C., Oertel, W. H., Köster, J., Pezzoli, G., & Provinciali, L. (2005). Long‐term efficacy and safety of pramipexole in advanced Parkinson's disease: results from a European multicenter trial. Movement disorders: official journal of the Movement Disorder Society, 20(5), 602-610.
- Nicholas AP, Borgohain R, Chana P, Surmann E, Thompson EL, Bauer L, et al. A randomized study of rotigotine dose response on 'off' time in advanced Parkinson's disease. 2014; Journal of Parkinsons Disease Print. 4(3):361-73.
- Nomoto M, Mizuno Y, Kondo T, Hasegawa K, Murata M, Takeuchi M, et al. Transdermal rotigotine in advanced Parkinson’s disease: A randomized, double-blind, placebo-controlled trial. 2014; Journal of Neurology. 261(10):1887-93.
- Rascol O, Barone P, Behari M, et al. Perampanel in Parkinson disease fluctuations: a double-blind randomized trial with placebo and entacapon. Clin Neuropharmacol 2012;35:15-20.
- Pahwa R, Stacy MA, Factor SA, Lyons KE, Stocchi F, Hersh BP, et al. Ropinirole 24-hour prolonged release:randomized, controlled study in advanced Parkinson disease. Neurology. 2007;68(14):1108-15.
- Parksinon Study Group. A randomized placebo-controlled trial of rasagiline in levodopa-treated patients with Parkinson disease andcmotor fluctuations: the PRESTO study. Arch Neurol. 2005;62(2):241-8.194. Brodersen P, Philbert A, Gulliksen G, Stigard A. The effect of L-Deprenyl on on-off phenomena in Parkinson’s disease. Acta Neurol Scand. 1985;71(6):494-7.195. Golbe LI, Duvoisin RC. Double-blind trial of R-(-)-deprenyl for the “on-off” effect complicating Parkinson’s disease. J Neural Transm Suppl. 1987;25:123-9.7994_multidisciplin_rl_parkinson_20.indd 240 09-03-11 12:00.
- Poewe WH, Rascol O, Quinn N, Tolosa E, Oertel WH, Martignoni E, et al. Efficacy of pramipexole and transdermal rotigotine in advanced Parkinson’s disease: a double-blind, double-dummy, randomised controlled trial. Lancet Neurol. 2007;6(6):513-20
- Pogarell O, Gasser T, van Hilten JJ, Spieker S, Pollentier S, Meier D, et al. Pramipexole in patients with Parkinson’s disease and marked drug resistant tremor: a randomised, double blind, placebo controlled multicentre study. J Neurol Neurosurg Psychiatry. 2002;72(6):713-20.
- Presthus J, Berstad J, Lien K. Selegiline (1-deprenyl) and low-dose levodopa treatment of Parkinson’s disease. A double-blind crossover trial. Acta Neurol Scand. 1987;76(3):200-3.
- Rascol O, Brooks DJ, Melamed E, Oertel W, Poewe W, Stocchi F, et al. Rasagiline as an adjunct to levodopa in patients with Parkinson’s disease and motor fluctuations (LARGO, Lasting effect in Adjunct therapy with Rasagiline Given Once daily, study): a randomised, double-blind, parallel-group trial. Lancet.2005;365(9463):947-54.
- Sivertsen B, Dupont E, Mikkelsen B, Mogensen P, Rasmussen C, Boesen F, et al. Selegiline and levodopa in early or moderately advanced Parkinson’s disease: a double-blind controlled short- and long-term study. Acta Neurol Scand Suppl. 1989;126:147-52.
- Stocchi F, Arnold G, OnofrjM, Kwiecinski H, Szczudlik A, Thomas A, et al. Improvement of motor function in early Parkinson disease by safinamide. Neurology 2004; 63: 746–8.
- Stocchi F, Borgohain R, Onofrj M, Schapira AH, Bhatt M, Lucini V, et al. A randomized, double-blind, placebo-controlled trial of safinamide as add-on therapy in early Parkinson’s disease patients. Mov Disord 2012; 27: 106–12.
- Stowe R, Ives N, Clarke CE, Deane K, van H, Wheatley K, et al. Evaluation of the efficacy and safety of adjuvant treatment to levodopa therapy in Parkinson s disease patients with motor complications. 2010; Cochrane database of systematic reviews (Online). 7:CD007166.
- Thorpy MJ, Adler CH. Parkinson’s disease and sleep. Neurol Clin. 2005;23(4):1187-1208.
- van Hilten JJ, Ramaker C, Van de Beek WJ, Finken MJ. Bromocriptine for levodopa-induced motor complications in Parkinson’s disease. Cochrane Database Syst Rev. 2000;(2):CD001203.
- Waters CH, Sethi KD, Hauser RA, Molho E, Bertoni JM. Zydis selegiline reduces off time in Parkinson’s disease patients with motor fluctuations: a 3-month, randomized, placebo-controlled study. Mov Disord.2004;19(4):426-32.
- Wong KS, Lu CS, Shan DE, Yang CC, Tsoi TH, Mok V. Efficacy, safety, and tolerability of pramipexole in untreated and levodopa-treated patients with Parkinson’s disease. J Neurol Sci. 2003;216(1):81-7.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 14-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk vijf jaar na de autorisatiedatum besluit het bestuur van de NVN om de richtlijn te updaten. In principe zullen de modules jaarlijks beoordeeld worden of deze nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Naast de ontwikkelde modules, is een aantal onderwerpen niet uitgewerkt in de huidige richtlijn. De werkgroep adviseert om deze op korte termijn alsnog te ontwikkelen omdat hier in de praktijk vraag naar is, te weten:
- urogenitale stoornissen;
- seksuele gezondheid;
- interacties tussen medicijnen ;
- visusstoornissen;
- orthostatische hypotensie;
- mond- en keelklachten;
- obstipatie.
Tabel 1 Geldigheid en onderhoud richtlijnmodules
|
Module |
Regiehou-der(s) |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Diagnostiek |
NVN |
NVN |
Nieuwe inzichten, veranderingen in zorg |
|
Medicamenteuze behandeling de Novo patiënt |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Medicamenteuze behandeling van motorische klachten en responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Geavanceerde therapieën voor responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN, NVvN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling houdingsproblematiek bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling valrisico bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Impulscontrolestoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Dopamine dysregulatie-stoornis bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Angststoornissen bij de ziekte van Parkinson |
NVN |
NVvP, NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Apathie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Depressie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Wanen en hallucinaties bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVKG |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Cognitieve stoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vermoeidheid bij de ziekte van Parkinson |
NVN |
NVN, NIP, NVKG |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Slaapstoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Pijnklachten bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Coping met de ziekte van Parkinson |
NVN |
NVN, V&VN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Werk en arbeidsongeschiktheid |
NVN |
NVAB |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Rijgeschiktheid |
NVN, VRA |
NVN, VRA |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Mantelzorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medicinale cannabis bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Mucuna Pruriens bij de ziekte van Parkinson |
NVN |
NVN, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vitamine B12 of D-suppletie bij de ziekte van Parkinson |
NVN |
NVN, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Multidisciplinaire revalidatieprogramma’s bij de ziekte van Parkinson |
VRA |
VRA, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Palliatieve zorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Advance care planning |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medische symptoombehandeling in de stervensfase |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
eHealth bij de ziekte van Parkinson |
NVN |
NVN |
Veranderingen in zorg |
|
Netwerkzorg, casemanagement en verwijscriteria |
NVN, VRA |
NVN, ParkinsonNet |
Veranderingen in zorg |
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlands Huisartsen Genootschap (NHG)
- Parkinson Vereniging (PV)
- Vereniging van Specialisten Ouderengeneeskunde (Verenso)
- Verpleegkundigen & Verzorgenden Nederland (V&VN)
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- Ergotherapie Nederland (EN)
- Nederlands Instituut van Psychologen (NIP)
- Nederlandse Vereniging van Diëtisten (NVD)
- ParkinsonNet, beroepsvereniging van professionals in sociaal werk (BPSW)
- Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB)
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVvS)
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
- Nederlandse Associatie Physician Assistants (NAPA)
- ParkinsonNet
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om een richtlijn te verkrijgen waarin de meeste recente (para)medische kennis omtrent de zorg voor patiënten met ziekte van Parkinson wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson te maken hebben.
Werkgroep
- Prof. dr. T. (Teus) van Laar (voorzitter), neuroloog, NVN
- Dr. A.J.W. (Agnita) Boon, neuroloog, NVN
- Dr. J.I. (Jorrit) Hoff, neuroloog, NVN
- Dr. M.L. (Mark) Kuijf, neuroloog, NVN
- Dr. A.G. (Alexander) Munts, neuroloog, NVN
- Dr. B. (Bart) Post, neuroloog, NVN
- Dr. G. (Gerrit) Tissingh, neuroloog, NVN (tot ..)
- Dr. F.J. (Erik) Slim, vicevoorzitter, revalidatiearts, VRA
- Drs. W.J. (Willem) Oudegeest, , revalidatiearts, VRA
- Drs. S.P. (Susan) Meuleman, revalidatiearts, VRA
- Prof. dr. O.A. (Odile) van den Heuvel, psychiater, NVvP
- Prof. dr. A.F.G. (Albert) Leentjens, psychiater, NVvP
- Dr. G. (Bert) Ziere, klinisch geriater, NVKG
- Drs. H.J. (Hannie) Scheper, specialist Ouderengeneeskunde, Verenso
- Dr. A.L. (Abram) Rutgers, huisarts, NHG
- Dr. A.A. (Annelien) Duits, klinisch neuropsycholoog, NIP
- H.H. (Herma) Lennaerts – Kats MSc, Parkinsonverpleegkundige, V&VN, ParkinsonNet
- T. (Tiny) van Wieren-Beerda MSc, verpleegkundig specialist parkinson, V&VN
- Drs. M.M. (Masja) van het Hoofd, beleidsmedewerker, Parkinson Vereniging
- Drs. K.C. (Kaie) Klaassen, patiënt-onderzoeker, Parkinson Vereniging
- Drs. M. (Marianne) Luinstra, ziekenhuisapotheker, NVZA
- Dr. M. (Marlies) van Nimwegen, fysiotherapeut (niet praktiserend), KNGF, ParkinsonNet
- Dr. I.H.W.M. (Ingrid) Sturkenboom, ergotherapeut, EN, ParkinsonNet
- K. (Karin) Overbeek-Dekker, diëtist, NVD, ParkinsonNet
- Dr. M. (Marten) Munneke, ParkinsonNet
Klankbordgroep
- Dr. J.G. (Hanneke) Kalf, logopedist, NVLF, ParkinsonNet
- K. (Klaas) Kooistra MSc, apotheker, KNMP
- P.R.I. (Paul) Rabsztyn, verpleegkundig seksuoloog SH (seksuologische hulpverlening) &VPO (voorlichting preventie en onderwijs), NVvS
- Dr. F.J.A. (Anton) Meijer, Neuro- en hoofd-hals radioloog, NVvR
- Prof. Dr. Y. (Yasin) Temel, neurochirurg, NVvN
- Drs. J.P. (Jacqueline) Janssen, Bedrijfsarts, klinisch arbeidsgeneeskundige, NVAB
- M. (Marlinda) Bakker, Geriatrisch maatschappelijk werker, BPSW
- Drs. A.L.A.J. (Danny) Hommel, specialist ouderengeneeskunde, Verenso
- Drs. H. (Hajo) Jongepier, huisarts, NHG
Met ondersteuning van
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. ir. N.L. (Nikita) van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Linda) Niesink-Boerboom, literatuurspecialist, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Guiterrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- S. (Sonja) Wouters, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Parkinson Vereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door stakeholderpartijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn ziekte van Parkinson (NVN, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens de invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). De zekerheid van het bewijs wordt beïnvloed door beperkingen in studieopzet- of uitvoering (risk of bias), imprecisie, inconsistentie, indirectheid en publicatiebias.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De formulering van de conclusies hangt af van de bewijskracht. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Netwerkzorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten in de bijlagen).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.

