Postoperatieve traject bij de ziekte van Dupuytren
Uitgangsvraag
Wat is het postoperatieve beleid?
Aanbeveling
Postoperatieve informatie voor de patiënt
Informeer patiënt over de intensiteit van het postoperatieve traject, duur van wondgenezing en littekenvorming en vergoeding van fysiotherapie/ergotherapie.
Postoperatieve instructies voor de patiënt
Geef aan patiënten postoperatieve instructies en adviezen ten aanzien van:
- Preventie/reductie van zwelling
- Wondverzorging en littekenbehandeling
- Belasting en belastbaarheid
- Inschakelen van de pols/hand tijdens dagelijkse activiteiten en het werk
- Specifieke hulpmiddelen
Postoperatieve spalktherapie
- Pas postoperatieve spalktherapie niet routinematig toe.
- Overweeg postoperatieve spalktherapie alleen in selecte gevallen zoals bij een capsulogene flexiecontractuur, na artrolyse of bij een progressieve extensiebeperking.
Wanneer postoperatieve spalktherapie is geïndiceerd:
- Gebruik weinig redressiekracht.
- Draag de spalk 's nachts gedurende 6-24 weken. Op indicatie kan de spalk ook voor een beperkte periode overdag gedragen worden.
- Evalueer de spalktherapie. Pas het spalkbeleid indien nodig aan.
- Stop spalktherapie wanneer het postoperatief littekenweefsel niet meer contraheert of wanneer de artrogene beperking niet meer te beïnvloeden is.
Postoperatieve oefentherapie
- Oefentherapie is altijd geïndiceerd.
- Start bij voorkeur tussen 3-5 dagen postoperatief.
- De oefentherapie bestaat uit: passieve en actieve flexie van de vingers; passieve en actieve extensie van de vingers; actieve peesglijoefeningen; rekken van de intrinsieke handspieren; opbouw kracht en functionaliteit.
- Laat de oefeningen met een frequentie van 3-6 keer per dag uitvoeren.
- Evalueer de oefentherapie en pas deze indien nodig aan.
- Pas postoperatieve oefentherapie toe gedurende 3 tot 12 weken.
- Stop postoperatieve oefentherapie wanneer postoperatief littekenweefsel niet meer contraheert en er geen (grote) beperkingen meer zijn op functie en activiteiten- en/of participatieniveau.
Nota bene: twee initiële aanbevelingen zijn geschrapt. Het betreft onderstaande aanbevelingen. Redenen voor het schrappen zijn: de soort spalk (volair of dorsaal) zal individueel worden bepaald, respectievelijke aanbeveling is niet specifiek voor Dupuytren:
- Aanbeveling 1: wanneer postoperatieve spalktherapie geïndiceerd is bij patiënten met een goede wondgenezing én met goede chirurgische correctie van de kromstand van de vingers, breng een volaire spalk aan.
- Aanbeveling 2: bevorder actieve mobilisatie van de pols en onderarm naar alle richtingen.
Overwegingen
Kwaliteit van bewijs
De kwaliteit van bewijs varieert van laag tot zeer laag. Met andere woorden, de mate van zekerheid van de (grootte van de) verschillen in effect tussen handtherapie alleen en handtherapie plus spalktherapie is gering.
Waarden en voorkeuren (met name relatief belang van uitkomstmaten)
Volgens de werkgroep vinden vrijwel alle goed geïnformeerde patiënten het voorkómen van een recidief flexiecontractuur, toename van de mobiliteit (flexie en extensie) en knijpkracht een cruciale uitkomst én eventuele complicaties zoals een drukplek ten gevolge van een eventueel aangebrachte spalk, en het verminderen van pijn, een belangrijke uitkomstmaat. Daarom zijn velen van hen, mits goed geïnformeerd, bereid tot een intensief postoperatief traject.
Het geven van goede informatie over het postoperatieve traject, en het bespreken van verwachtingen en uitkomsten zodat patiënten een compleet beeld hebben van het postoperatieve traject, is volgens de werkgroep dan ook van groot belang.
Er zijn meerdere behandelopties mogelijk (zie professioneel perspectief). Daarom is het belangrijk de opties met de patiënt te bespreken en hem/haar te betrekken in de uiteindelijke keuze.
Professioneel perspectief
Postoperatieve handtherapie bij patiënten met M. Dupuytren heeft als doel de mobiliteit van de vingers te behouden of te verbeteren en de handfunctie en handvaardigheid te optimaliseren (Herweijer et al, 2007).
Hierbij richt postoperatieve handtherapie zich op:
- Oedeempreventie/ oedeemvermindering
- Wondverzorging, littekenherstel
- Functioneel herstel van de mobiliteit (zowel flexie als extensie) van de vingers en /of duim
- Volledig of optimaal herstel van de inzetbaarheid en belastbaarheid van de betreffende hand.
Handtherapie wordt algemeen beschouwd als belangrijk om verklevingen/contracturen van littekenweefsel en de daarmee gepaard gaande beperkingen op zowel functie, activiteiten en participatie niveau te voorkomen ondanks het ontbreken van direct-vergelijkende studies naar handtherapie vs. niets doen. De uitgangsvraag van de werkgroep is dus gericht op de meerwaarde van spalktherapie bovenop handtherapie.
Postoperatieve instructies voor de patiënt
Het doel van postoperatieve instructies is de patiënt te informeren over hoe deze dient om te gaan met de geopereerde hand ter preventie / reductie van zwelling, en over een goede wondverzorging en littekenbehandeling. Daarnaast is het belangrijk om informatie te geven over het bewegen, en over belasting en belastbaarheid / specifieke hulpmiddelen om te zorgen voor een optimaal herstel.
Postoperatieve spalktherapie
Het doel van postoperatieve spalktherapie is om de geopereerde vingers recht te houden en te voorkomen dat opnieuw een flexiecontractuur optreedt door postoperatief littekenweefsel (Huisstede et al., 2013).
Op basis van eigen expertise meent de werkgroep dat een spalk het effect van handtherapie, namelijk behoud of optimalisering van de operatief verkregen extensie, kan versterken in onderstaande situaties:
- in geval van capsulogene flexiecontracturen
- na een peroperatief uitgevoerde artrolyse
- bij progressieve extensiebeperking.
Daarnaast meent de werkgroep dat in onderstaande situaties een postoperatieve (nacht-)spalk bij patiënten de wond meer rust kan geven:
- bij gebruik van split skin graft of full thickness graft,
- bij grote wonden met veel spanning op de wondranden.
In bovenstaande situaties is overleg met patiënt aangewezen (zie onder ‘waarden en voorkeuren’).
Type postoperatieve spalk
Indien spalktherapie geïndiceerd is adviseert de werkgroep een spalk te vervaardigen met weinig redressiekracht en die, in het geval van capsulogene of dermatogene verkortingen, een optimale trekkracht verzorgt op het betreffende weefsel. De aanbeveling om geen of weinig redressiekracht te gebruiken is gebaseerd op onderzoek dat laat zien dat dat langdurige belasting bij een lage ‘dosis’ (d.w.z. een dagelijkse ‘total end range time’ van 6 tot 12 uur) de voorkeur heeft bij het gebruik van spalken om contracturen te verminderen (Glasgow, Wilton en Tooth, 2003; Flowers, 2002; Kottke, Pauley en Ptak, 1966). Mede hierom ligt het toepassen van een nachtspalk met weinig redressiekracht voor de hand. Daarbij komt dat de eerder besproken studies (Collis et al., 2013, Jerosch-Herold et al., 2011) met name de effectiviteit van een nachtspalk hebben onderzocht.
Tijdstip van starten postoperatieve spalktherapie
Het precieze tijdstip is afhankelijk van de indicatie en het klinisch beeld.
Duur van het dragen van de spalk
De duur van het dragen van de spalk is afhankelijk van de indicatie en het klinisch beeld.
Evaluatie en stoppen postoperatieve spalktherapie
Stop spalktherapie wanneer het postoperatief littekenweefsel niet meer contraheert of wanneer de artrogene beperking niet meer te beïnvloeden is.
Postoperatieve oefentherapie
Het doel van oefentherapie is om de geopereerde vingers recht te houden en te voorkomen dat opnieuw een flexiecontractuur optreedt door postoperatief littekenweefsel.
Verder wordt dit gebruikt om postoperatief oedeem te verminderen en de normale gewrichtsmobiliteit van de vingers te herstellen. Oefentherapie is in principe hetzelfde na elke chirurgische techniek, maar moet worden aangepast aan de omvang van de wond en het stadium van genezing (Huisstede et al., 2013). De oefentherapie bestaat uit: passieve en actieve flexie van de vingers; passieve en actieve extensie van de vingers; peesglijoefeningen; rekken van de intrinsieke handspieren; optimaliseren van kracht en functionaliteit.
Starten postoperatieve oefentherapie
Het bij voorkeur tussen 3-5 dagen postoperatief starten is omdat de acute ontstekingsfase van het wondherstel voorbij is.
Duur oefentherapie
Postoperatieve oefentherapie wordt gedurende 3 tot 12 weken toegepast. De variatie in duur van de therapie hangt af van:
- de peroperatieve toestand (ernst en duur van kromstand, omvang van strengen)
- de omvang van de operatie (een of meerdere vingers/verwijdering van veel of weinig bindweefselstrengen,
- de postoperatieve resultaten t.a.v. de mobiliteit van de geopereerde gewrichten
- de activiteit en grootte van de wond/litteken,
- verloop van het herstel van de wond/litteken
- leefstijlfactoren (bijv. roken) / comorbiditeit (bijv. diabetes mellitus)
- instrueerbaarheid en motivatie patiënt.
Frequentie van oefentherapie
In het algemeen raadt de werkgroep voor een optimaal herstel van de mobiliteit een frequentie van 3-6 keer per dag aan om oefeningen uit te voeren. Op indicatie kan deze frequentie worden aangepast. Indien er bijvoorbeeld sprake is van een grote mate van gewrichtsstijfheid kan de frequentie worden verhoogd.
Evalueren en stoppen oefentherapie
Stop postoperatieve oefentherapie wanneer postoperatief littekenweefsel niet meer contraheert en er geen (grote) beperkingen meer zijn op functie-, activiteiten- en/of participatieniveau.
Balans van gewenste en ongewenste effecten
Handtherapie:
Op grond van eigen expertise van de werkgroep en algemeen aanvaarde opvattingen leidt postoperatieve handtherapie tot meer reductie van zwelling en littekenvorming en een beter functioneel herstel van de mobiliteit van de vingers en/of duim evenals tot een beter herstel van de inzetbaarheid en belastbaarheid van de betreffende hand dan het natuurlijk herstel.
Spalktherapie + handtherapie:
Het ontbreken van een verschil in baten tussen handtherapie alleen en handtherapie plus spalktherapie, de extra kosten van spalktherapie en het ongemak bij het dragen van een spalk, maken dat het routinematige gebruik van spalktherapie wordt afgeraden. In specifieke situaties is er plaats voor spalktherapie. Wat betreft de indicaties voor een spalktherapie zie hiervoor de toelichting onder professioneel perspectief.
Kosten en middelen
Volgens de werkgroep leiden de geformuleerde aanbevelingen niet tot een grote verandering van de huidige kosten van een postoperatieve behandeling.
Aanvaardbaarheid en haalbaarheid
De werkgroep verwacht in het algemeen geen problemen ten aanzien van de aanvaardbaarheid en haalbaarheid van de aanbevelingen aangezien deze grotendeels aansluiten bij de huidige praktijk. Wat betreft de aanbeveling ten aanzien van spalktherapie verwacht de werkgroep niet dat deze zonder meer aanvaardbaar is gezien de (grote) omvang waarin spalktherapie momenteel wordt toegepast. In het Implementatieplan (zie bijlage) wordt hierop nader ingegaan (bijv.: denk aan een artikel in één van de door de relevante beroepsverenigingen uitgegeven tijdschriften).
Rationale
Volgens de werkgroep wegen de baten van postoperatieve handtherapie (exclusief spalktherapie) op tegen de kosten en tijdsinvestering van de patiënt. Volgens de werkgroep wegen de baten van spalktherapie, voor zover deze op indicatie wordt gegeven, op tegen de kosten en het door de patiënt ervaren ongemak van het dragen van een spalk.
Onderbouwing
Achtergrond
Na de chirurgische behandeling van de ziekte van Dupuytren is het gebruikelijk dat patiënten verwezen worden voor handtherapie (fysiotherapie of ergotherapie) (Au-Yong et al, 2005; Mason 1992; Salim 2006). Een handtherapeut is een erkende fysiotherapeut of ergotherapeut die zich middels nascholing en klinische ervaring heeft gespecialiseerd in de behandeling en begeleiding van personen met een letsel of aandoening van de hand of pols.
Postoperatieve handtherapie bij patiënten met de ziekte van Dupuytren heeft als doel de mobiliteit van de vingers te behouden of verbeteren en de handfunctie en handvaardigheid te optimaliseren (Herweijer et al, 2007). Naast oedeempreventie, wondverzorging, littekenbehandeling en oefentherapie die gericht is op het verbeteren van de vingermobiliteit, wordt er vaak een (nacht)spalk voorgeschreven (Larson & Jerosch-Herold, 2008; Herweijer et al, 2007; Del Frari 2005; Page, 2000; Peterson-Bethea, 1997).
Het doel van de spalk is om op de lange termijn de extensie van de vingergewrichten te behouden. Spalktherapie wordt al aanbevolen sinds de eerste publicaties over de behandeling van de ziekte van Dupuytren. Er is echter geen eenduidigheid over het type spalk dat gebruikt dient te worden, noch over de toe te passen redressiekracht (Evans et al, 2002) noch over de draagduur (Abbott 1987). Daarnaast staat de effectiviteit van postoperatieve spalktherapie bij de ziekte van Dupuytren ter discussie (Larson & Jerosch-Herold, 2008; Glassey 2001; Herweijer et al, 2007; Clare, 2004; Ebskov et al, 2000; Rives et al, 1992). Het is de vraag of in de postoperatieve fase een behandeling met een spalk geïndiceerd is om tot een optimale handfunctie te komen.
Definities:
- Postoperatieve handtherapie: deze therapie kan bestaan uit postoperatieve instructies, oefentherapie (mobiliteit, kracht), ADL adviezen, maar ook spalktherapie.
- Oefentherapie: deze bestaat uit passieve en actieve flexie van de vingers; passieve en actieve extensie van de vingers; peesglijoefeningen; rekken van de intrinsieke handspieren; optimaliseren van kracht en functionaliteit.
- Postoperatieve spalktherapie: met behulp van een spalk (dynamisch of statisch verstelbaar) de passieve ‘range of motion’ verbeteren bij aanwezigheid van gewrichtsstijfheid.
Conclusies / Summary of Findings
1. Ten aanzien van PICO 1 handtherapie versus niets doen
|
Niet te beoordelen met GRADE
|
Er werden geen studies gevonden die aan de selectiecriteria voldeden waarin het effect werd onderzocht van handtherapie ten opzichte van ‘niets doen' bij patiënten met Dupuytren, met of zonder restkromstand van de vinger, die zijn geopereerd of een naaldbehandeling hebben gehad. |
2. Ten aanzien van PICO 2 handtherapie plus spalktherapie versus niets doen[1]
|
Niet te beoordelen met GRADE
|
Er werden geen studies gevonden die aan de selectiecriteria voldeden waarin het effect werd onderzocht van handtherapie plus spalktherapie ten opzichte van ‘niets doen' bij patiënten met Dupuytren, met of zonder restkromstand van de vinger, die zijn geopereerd of een naaldbehandeling hebben gehad. |
3. Ten aanzien van PICO 3 handtherapie + spalktherapie versus handtherapie
|
Laag
GRADE |
Effectiviteit Reductie van totale actieve extensiebeperking 12 maanden na therapie bij patiënten met de ziekte van Dupuytren, al of niet met een kromstand van de vinger Handtherapie plus spalktherapie lijkt wat betreft effect op vermindering van de totale actieve extensiebeperking na 12 maanden niet of nauwelijks te verschillen van handtherapie.
Bronnen: Jerosch-Herold et al., 2011; Kemler et al., 2012 |
|
Laag
GRADE |
Effectiviteit Totale actieve extensie en flexie bij patiënten met de ziekte van Dupuytren 3 maanden na therapie Handtherapie plus spalktherapie lijkt wat betreft effect op vermindering van de totale actieve extensiebeperking na 3 maanden niet of nauwelijks te verschillen van handtherapie.
Bron: Jerosch-Herold et al., 2011; Collis et al., 2013 |
|
Zeer laag
GRADE |
Effectiviteit Knijpkracht bij patiënten met de ziekte van Dupuytren 3 maanden na therapie Handtherapie plus spalktherapie lijkt wat betreft effect op knijpkracht na 3 maanden niet of nauwelijks te verschillen van handtherapie, maar het bewijs is zeer onzeker.
Bron: Collis et al., 2013 |
|
Zeer laag
GRADE |
Complicaties Pijn na 6 weken bij patiënten met de ziekte van Dupuytren na therapie Handtherapie plus spalktherapie lijkt wat betreft effect op pijn na 6 weken niet of nauwelijks te verschillen van handtherapie, maar het bewijs is zeer onzeker.
Bron: Kemler et al., 2012 |
|
Laag
GRADE |
Patient reported outcome measures Patiënttevredenheid bij patiënten met de ziekte van Dupuytren 12 maanden na therapie Handtherapie plus spalktherapie lijkt wat betreft effect op patiënttevredenheid na 12 maanden niet of nauwelijks te verschillen van handtherapie.
Bron: Jerosch-Herold et al., 2011 |
|
Zeer laag
GRADE |
Patient reported outcome measures Door patiënt met de ziekte van Dupuytren gepercipieerd behandeleffect na 12 maanden therapie Handtherapie plus spalktherapie lijkt wat betreft effect op “het ervaren van veel verbetering” na 12 maanden niet of nauwelijks te verschillen van handtherapie, maar het bewijs is zeer onzeker.
Bron: Kemler et al., 2012 |
|
Laag
GRADE |
Patient reported outcome measures DASH-score bij patiënten met de ziekte van Dupuytren 3 maanden na therapie Handtherapie plus spalktherapie lijkt wat betreft effect op functioneren van de hand, zoals geïndiceerd door de DASH-score na 3 maanden, niet of nauwelijks te verschillen van handtherapie.
Bron: Jerosch-Herold et al., 2011; Collis et al., 2013 |
|
---------
GRADE |
Effectiviteit en patient reported outcome measures Recidief flexiecontractuur/extensiebeperking; drukplekken ten gevolge van spalk; werkhervatting door patiënten met de ziekte van Dupuytren na therapie Recidief extensiecontractuur, drukplekken ten gevolge van spalk en werkhervatting in relatie tot handtherapie met of zonder aanvullende spalktherapie werden niet onderzocht.
Bronnen: Jerosch-Herold et al., 2011; Kemler et al., 2012; Collis et al., 2013 |
[1] Momenteel loopt een gerandomiseerde studie (Aglen et al., 2019) met de genoemde PICO-vraagstelling. Deze studie staat geregistreerd als https://clinicaltrials.gov/ct2/show/NCT03580213. Deze studie betreft handtherapie bij patiënten met de ziekte van Dupuytren die een collagenase behandeling hebben ondergaan en bij wie het MCP- of PIP-gewricht is aangedaan. Een deel krijgt handtherapie en een deel geen behandeling. Handtherapie bestaat uit oedeem en litteken management, spalktherapie, bewegingsoefeningen, en oefenen van activiteiten dagelijks leven (ADL). Uitkomstmaten zijn onder andere mate van functioneren (ADL), tevredenheid hierover en actief/passief strekken van behandelde gewrichten. April 2024 staat vermeld als datum van voltooiing van de studie.
Samenvatting literatuur
1. Ten aanzien van PICO 1 handtherapie versus niets doen
-
2. Ten aanzien van PICO 2 handtherapie plus spalktherapie versus niets doen[1]
-
3. Ten aanzien van PICO 3 handtherapie + spalktherapie versus handtherapie
In de 2012 richtlijn werd ten aanzien van de relatieve effectiviteit geconcludeerd:
<<Het is waarschijnlijk dat het routinematig gebruik van een postoperatieve nachtspalk naast handtherapie bij de ziekte van Dupuytren niet leidt tot een betere mobiliteit (flexie/extensie) van de vingers, tot minder beperkingen in activiteiten en tot betere patiënttevredenheid dan handtherapie alleen [toevoeging in cursief door werkgroep]>>.
Deze conclusie is gebaseerd op de in opzet vergelijkende studie van Jerosch-Herold et al. (2011). Na 2011 werden nog twee gerandomiseerde studies gepubliceerd (Kemler et al., 2012; Collis et al., 2013). Deze zijn in onderstaand samengevat. Volledigheidshalve is de samenvatting van Jerosch-Herold et al. (2011) overgenomen uit de richtlijn uit 2012, en waar nodig aangevuld.
Jerosch-Herold et al., 2011
In een multicenter, pragmatic randomized trial (Jerosch-Herold et al, 2011) werd het gebruik van een nachtspalk (n=77) plus handtherapie vergeleken met het niet-gebruiken van een nachtspalk (n=77) c.q. alleen handtherapie na selectieve fasciëctomie of dermatofasciëctomie. De Initiële totale actieve flexie van het MCP-, PIP- en DIP-gewricht was gemiddeld 223.8 - 226.2 graden; de initiële totale actieve extensie van het MCP-, PIP- en DIP-gewricht was 50.7 - 51.1 graden.
De exacte vorm van chirurgie en handtherapie werden niet gespecificeerd. Het betrof een nachtspalk van thermoplastisch materiaal die door een handtherapeut op maat werd gemaakt en die 6 maanden gebruikt moest worden. De geopereerde MCP and PIP gewrichten werden in maximale extensie gezet zonder kracht op de wond uit te oefenen. De controlegroep ontving geen spalk, behalve wanneer er een snelle postoperatieve toename van de contractuur optrad. Resultaten: 148 patiënten (96%) konden 12 maanden worden vervolgd. De studie liet geen significante verschillen tussen handtherapie ten opzichte van handtherapie plus spalk zien in de ervaren beperkingen in activiteiten (vastgesteld met de DASH = Disability of Arm, Shoulder and Hand questionnaire; schaal 0-100) (-0.66; p=0.703), de mobiliteit van de vingers (flexie: 2.02 graden; p=0.493 en extensiebeperking: -5.11 graden; p=0.172) en in patiënttevredenheid (schaal 0-10; 0.35, p=0.315). Dertien patiënten kregen in de ‘geen spalk’ groep uiteindelijk toch een spalk op basis van het ontstaan van een flexie contractuur. 25 procent van de patiënten die handtherapie plus spalktherapie kregen, hebben de spalk niet volgens de instructies kunnen dragen gedurende de eerste 3 maanden. Redenen hiervoor waren: stijfhand van de hand, ongemak of pijn, op advies van de behandelend chirurg, verstoorde slaap, slecht zittende spalk, of huiduitslag ten gevolge van de spalk. Alle studiekarakteristieken staan vermeld in de evidence tabellen.
Kemler et al., 2012
In een RCT werden twee groepen vergeleken van totaal 54 patiënten die waren geopereerd vanwege de ziekte van Dupuytren met een flexiecontractuur van minimaal 30 graden in het PIP gewricht. Onder supervisie van een handtherapeut kreeg de ene groep (n=28) gedurende 3 maanden handtherapie + spalktherapie en de andere groep (n=26) alleen handtherapie. Alle patiënten hadden een selectieve fasciëctomie ondergaan. Zij waren gemiddeld 63 jaar oud; 85% was van het mannelijk geslacht. De gemiddelde leeftijd waarop de ziekte zich manifesteerde was 49 jaar. Handtherapie werd aan beide groepen gegeven en bestond uit een standaard programma van stapsgewijze opgevoerde oefeningen om kracht, mobiliteit en functioneren van de aangedane hand te verbeteren. Handtherapie startte op de 10e dag na de operatie en vond gedurende 3 maanden 2x per week plaats in sessies van 30 minuten. Geselecteerde handtherapeuten gaven de handtherapie om standaardisatie van de therapie te borgen. De thermoplastische dorsale spalk werd gemaakt door een handtherapeut. De spalk had tot doel om pols en MCP, PIP- en DIP-gewricht in nul graden extensie te houden. Patiënten werd gevraagd de spalk gedurende 4 weken dag en nacht te dragen. Vanaf week 6 tot 3 maanden postoperatief werd de spalk alleen ’s nachts gedragen.
De primaire uitkomstmaat betrof de extensiebeperking van het PIP-gewricht. Andere uitkomstmaten waren door patiënt gepercipieerd effect, pijnintensiteit, comfort en complicaties/neveneffecten. Deze werden geëvalueerd één jaar na de chirurgische behandeling. Voor het bepalen van de extensiebeperking werd een goniometer gebruikt. Alle studiekarakteristieken staan vermeld in de evidence tabellen.
Resultaten voor effectiviteit, functioneren en complicaties zijn in tabel 1 weergegeven. Er werden geen drukplekken gezien in de groep met een spalk. De meeste uitkomsten lijken te wijzen in de richting van een licht voordeel van handtherapie in vergelijking met handtherapie plus spalktherapie. Wat de primaire uitkomstmaat betreft – vermindering van extensiebeperking van het PIP gewricht in graden – is het verschil van 8 graden geen ‘klinisch relevant’ verschil volgens Witthaut et al. (2011). Pas bij een verschil van minimaal 13.5 graden zou er sprake zijn van een klinisch relevant verschil.
Tabel 1. Uitkomsten na handtherapie met en zonder aanvullende spalktherapie; follow-up duur 12 maanden
|
|
Handtherapie alleen |
Spalk plus handtherapie
|
[Handtherapie alleen] – [spalk + handtherapie] (verschil en 95% BI)* |
|
Vermindering van extensiebeperking van het PIP gewricht in graden |
29 |
21 |
+8 (-3.76; 19.76) |
|
Percentage patiënten die minimaal “veel verbetering” percipieerden** |
73 |
64 |
+9 (-16; +31) |
|
Pijn na 6 weken behandeling (10 cm VAS-schaal) |
2.1 |
1.9 |
+0.2 (-1.0; 1.4) |
|
Flexiebeperking (%) |
15 |
29 |
-14 (-34; +9) |
*berekend door werkgroep; **: In Kemler et al. (2012): “much improved” plus “immense improved”.
Recidief extensiecontractuur, patiënttevredenheid en werkhervatting werden niet onderzocht.
Collis et al., 2013
In een RCT werden spalktherapie plus handtherapie (n=26) vergeleken met handtherapie alleen (n=30) bij in totaal 56 patiënten die waren geopereerd vanwege de ziekte van Dupuytren met een flexiecontractuur van minimaal 30 graden in het PIP gewricht. Patiënten waren gemiddeld 67 jaar oud; 80% was van het mannelijk geslacht. 90% had fasciëctomie ondergaan, 10% dermofasciëctomie. Beide groepen kregen standaard handtherapie die werd gegeven door een ergotherapeut, fysiotherapeut of geregistreerde handtherapeut. Handtherapie bestond uit een of meer van de volgende onderdelen: actieve peesglijoefeningen, voorlichting, wondzorg, oedeembehandeling, littekenzorg, begeleiding bij geleidelijke terugkeer naar dagelijkse activiteiten, passief doorbewegen met of zonder warmte om het buigen en strekken van de vinger te doen toenemen, versterken van grip en intermitterend gebruik van een dynamische vingerspalk voor extensie van het PIP gewricht voor overdag. Patiënten in de spalktherapie-groep kregen een thermoplastische spalk aangemeten die op maat werd gemaakt door een therapeut bij de 1e afspraak na de operatie. Deze werd geplaatst aan de dorsale zijde van de hand in een zo comfortabel mogelijke positie zonder onnodige spanning op de wond te zetten. Patiënten werden verzocht de spalk gedurende 3 maanden ’s nachts te dragen.
De primaire uitkomstmaat betrof totale actieve extensie van de geopereerde vingers, in graden uitgedrukt. Dit is de som van de actieve extensie van de MCP-, PIP- en DIP-gewrichten.
Secundaire uitkomstmaten waren totale actieve flexie (som van de flexie van de MCP-, PIP- en DIP-gewrichten) van de geopereerde vingers (°), actieve distale palmaire plooi (cm), knijpkracht (kg) en functioneren van de hand met behulp van de DASH (schaal: 0–100). Alle studiekarakteristieken staan vermeld in de evidence tabellen.
Resultaten, gemiddeld over 3 maanden, staan vermeld in tabel 2 en 3. Wat betreft de totale extensie zou voor de pink en middelvinger handtherapie plus spalk iets gunstiger uitkomsten opleveren dan alleen handtherapie. Volgens Witthaut et al. (2011) zou echter pas bij een verschil van minimaal 13.5 graden sprake zijn van een ‘klinisch relevant’ verschil. Wat betreft de totale flexie lijken de verschillen wat groter, namelijk in het voordeel van de groep die alleen handtherapie kreeg, maar ook in dit geval zijn de verschillen niet ‘klinisch relevant’.
Tabel 2. Range of motion uitkomsten na handtherapie met en zonder aanvullende spalktherapie; follow-up duur 3 maanden
|
Range of motion |
Verschil: [Handtherapie alleen] – [handtherapie plus spalk] (95% BI) |
|
Pink – TAE (graden) |
-10 (-20; <1) |
|
Ringvinger – TAE (graden) |
+1 (-12; +13) |
|
Middelvinger – TAE (graden) |
-10 (-24; + 7) |
|
|
|
|
Pink – TAF (graden) |
+13 (- 2; +27) |
|
Ringvinger – TAF(graden) |
+12 (-10; +34) |
|
Middelvinger – TAF (graden) |
+5 (-14; +23) |
|
|
|
TAE: totale actieve extensie; TAF: totale actieve flexie; N.B.: primaire uitkomstmaten zijn cursief weergegeven.
Wat betreft knijpkracht is er een klein verschil tussen handtherapie alleen en handtherapie plus spalktherapie (zie tabel 3). Volgens Rodrigues et al. (2015) is pas bij een verschil van minimaal 5 tot 6.5 kg sprake van een klinisch relevant verschil. De DASH-score laat geen betekenisvol verschil zien tussen beide therapievormen.
Tabel 3. Knijpkracht en functioneren van hand (DASH) na handtherapie met en zonder aanvullende spalktherapie; follow-up duur 3 maanden
|
|
Verschil: [Handtherapie alleen] – [handtherapie plus spalk] (95% BI) |
|
Knijpkracht – links (kg) |
+3 (-2; +7) |
|
Knijpkracht – rechts(kg) |
+3 (-1; +6) |
|
DASH (0-100) |
-1 (-5; +3) |
Recidief extensiecontractuur, patiënttevredenheid en werkhervatting werden niet onderzocht. Evenmin werden complicaties/neveneffecten onderzocht.
Meta-analysen voor diverse uitkomstmaten
Kemler et al. (2012) en Collis et al. (2013) rekruteerden patiënten met aanzienlijk ernstiger contracturen dan Jerosch-Herold et al. (2011). Dit kan een reden zijn om geen meta-analysen te verrichten en zich te beperken tot een kwalitatieve weergave van de resultaten, zoals Samargandi et al., (2017) in hun review te werk gingen. Volgens Ioannidis et al. (2008) hebben kwalitatieve en semi-kwantitatieve methoden echter ook (aanzienlijke) nadelen.[2] Daarbij komt dat de GRADE-benadering expliciet rekening houdt met de factoren ‘indirect bewijs’ en ernstige inconsistentie die verschillen in studiepopulaties kunnen verdisconteren. Om deze redenen heeft de werkgroep toch enkele meta-analysen verricht.
Jerosch-Herold et al. (2011) en Collis et al. (2013) rapporteerden verschil in DASH-scores bij een follow-up duur van 3 maanden.[3] Deze scores geven de mate van functioneren van de aangedane hand aan zoals gepercipieerd door de patiënt. Combineren van de uitkomsten van beide studies laat zien dat er niet of nauwelijks verschil is in functioneren van de hand als spalktherapie wordt toegevoegd aan handtherapie (zie figuur 1). Ter informatie: het verschil is 0.36 punt op een schaal die loopt van 0 tot 100 punten. Beide studies rapporteerden ook het verschil in totale actieve extensie en totale actieve extensie tussen handtherapie alleen en handtherapie plus spalk (figuur 2 en figuur 3). Afgerond op een geheel getal bedraagt dit verschil 4 graden. Dit is aanzienlijk minder dan wat volgens Witthaut et al. (2011) een klinisch relevant verschil (minimaal ca. 13.5 graden) zou zijn.
Figuur 1. Verschil in DASH-score na 3 maanden voor vergelijking van handtherapie alleen versus handtherapie plus spalk

Figuur 2. Verschil in totale actieve extensie (graden) na 3 maanden voor vergelijking handtherapie alleen versus handtherapie plus spalk
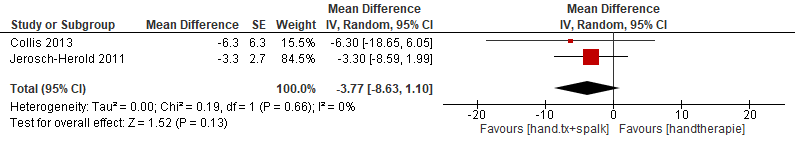
Figuur 3. Verschil in totale actieve flexie (graden) na 3 maanden voor vergelijking handtherapie alleen versus handtherapie plus spalk

Jerosch-Herold et al. (2011) en Kemler et al. (2012) rapporteerden het verschil in reductie van de totale actieve extensiebeperking bij een follow-up duur van 12 maanden.[4] Combineren van de uitkomsten van beide studies laat een verschil van 1.22 graden voor de reductie van de totale actieve extensiebeperking zien tussen handtherapie alleen en handtherapie plus spalk (zie figuur 4). Dit verschil is aanzienlijk minder dan wat als een klinisch relevant verschil zou kunnen worden getypeerd.
Figuur 4. Verschil in reductie van totale actieve extensiebeperking (in graden) na 12 maanden voor vergelijking handtherapie alleen versus handtherapie plus spalk

Kwaliteit van bewijs
In geval van een RCT start de kwaliteit van bewijs conform de GRADE-methodiek voor een uitkomstmaat hoog en kan vervolgens worden afgewaardeerd voor één van de volgende factoren: ernstige kans op vertekening (risk of bias), indirect bewijs, onnauwkeurigheid, inconsistentie en publicatiebias.
Reductie van totale actieve extensiebeperking na 12 maanden
De kwaliteit van bewijs is laag. Er werd met één niveau afgewaardeerd voor ernstige kans op vertekening. Zie de evidence tabellen (risk of bias beoordeling). Daarnaast werd met één niveau afgewaardeerd voor indirect bewijs: in sommige RCTs hadden de patiënten een ernstiger flexiecontractuur of extensiebeperking dan in andere.[5] Hoewel het aantal patiënten in totaal slechts 208 bedraagt, is niet afgewaardeerd voor ernstige onnauwkeurigheid: bovengrens en ondergrens van het betrouwbaarheidsinterval zijn kleiner dan de drempelwaarde voor een klinisch relevant verschil (minimaal circa 13.5 graden verschil). M.a.w., het is waarschijnlijk dat er geen klinisch relevant verschil is. Er werd niet afgewaardeerd voor ernstige inconsistentie ondanks een I2 van 72% (zie figuur 4): deze inconsistentie is wellicht een gevolg van verschillen in de patiëntenpopulatie (meer versus minder ernstige extensiebeperkingen), waarvoor onder de noemer indirect bewijs reeds is afgewaardeerd.
Totale actieve extensie en flexie na 3 maanden
De kwaliteit van bewijs is laag. Er werd met één niveau afgewaardeerd voor ernstige kans op vertekening. Zie de evidence tabellen (risk of bias beoordeling). Daarnaast werd met één niveau afgewaardeerd voor indirect bewijs: in sommige RCTs hadden de patiënten een ernstiger flexiecontractuur of extensiebeperking dan in andere. Hoewel het aantal patiënten in totaal slechts 200 bedraagt, is niet afgewaardeerd voor ernstige onnauwkeurigheid: bovengrens en ondergrens van het betrouwbaarheidsinterval zijn kleiner dan de drempelwaarde voor een klinisch relevant verschil (minimaal circa 13.5 graden). M.a.w., het is zeer waarschijnlijk dat er geen minimaal relevant verschil is.
Knijpkracht na 3 maanden
De kwaliteit van bewijs is zeer laag. Er werd met één niveau afgewaardeerd voor ernstige kans op vertekening. Zie de evidence tabellen (risk of bias beoordeling). Daarnaast werd met twee niveaus voor zeer ernstige onnauwkeurigheid afgewaardeerd: het aantal patiënten (n=56) is zeer veel minder dan de optimal information size van 400.
Pijn na 6 weken
De kwaliteit van bewijs is zeer laag. Er werd met één niveau afgewaardeerd voor ernstige kans op vertekening. Zie de evidence tabellen (risk of bias beoordeling). Daarnaast werd met twee niveaus voor zeer ernstige onnauwkeurigheid afgewaardeerd: het aantal patiënten (n=54) is zeer veel minder dan de optimal information size van 400.
Patiënttevredenheid (schaal 0-10) na 12 maanden
De kwaliteit van bewijs is laag. Er werd met één niveau afgewaardeerd voor ernstige kans op vertekening. Zie de evidence tabellen (risk of bias beoordeling). Daarnaast werd met één niveau voor ernstige onnauwkeurigheid afgewaardeerd: het aantal patiënten (n=154) is minder dan de optimal information size van 400.
Door patiënt gepercipieerd behandeleffect na 12 maanden
De kwaliteit van bewijs is zeer laag. Er werd met één niveau afgewaardeerd voor ernstige kans op vertekening. Zie de evidence tabellen (risk of bias beoordeling). Daarnaast werd met twee niveaus voor zeer ernstige onnauwkeurigheid afgewaardeerd: het aantal patiënten (n=54) is zeer veel minder dan de optimal information size van 400.
DASH-scores (schaal: 0-100) na 3 maanden
De kwaliteit van bewijs is laag. Er werd met één niveau afgewaardeerd voor ernstige kans op vertekening. Zie de evidence tabellen (risk of bias beoordeling). Daarnaast werd met één niveau afgewaardeerd voor indirect bewijs: in sommige RCTs hadden de patiënten een ernstiger flexiecontractuur of extensiebeperking dan in andere. Hoewel het aantal patiënten in totaal slechts 200 bedraagt, is niet afgewaardeerd voor ernstige onnauwkeurigheid: bovengrens en ondergrens van het betrouwbaarheidsinterval zijn kleiner dan de drempelwaarde voor een klinisch relevant verschil (minimaal circa 15 punten). M.a.w., het is waarschijnlijk dat er geen klinisch relevant verschil is.
[1] Momenteel loopt een gerandomiseerde studie (Aglen et al., 2019) met de genoemde PICO-vraagstelling. Deze studie staat geregistreerd als https://clinicaltrials.gov/ct2/show/NCT03580213. Deze studie betreft handtherapie bij patiënten met de ziekte van Dupuytren die een collagenase behandeling hebben ondergaan en bij wie het MCP- of PIP-gewricht is aangedaan. Een deel krijgt handtherapie en een deel geen behandeling. Handtherapie bestaat uit oedeem en litteken management, spalktherapie, bewegingsoefeningen, en oefenen van activiteiten dagelijks leven (ADL). Uitkomstmaten zijn onder andere mate van functioneren (ADL), tevredenheid hierover en actief/passief strekken van behandelde gewrichten. April 2024 staat vermeld als datum van voltooiing van de studie.
[2] Ionnadis et al. (2008; pag. 1415): If the limitations of these methods are properly acknowledged, the use of quantitative synthesis may be preferable to qualitative interpretation of the results, or hidden quasi-quantitative analysis—for example, judging studies based on P values of single studies being above or below 0.05 [zoals Samargandi et al. (2017) hebben gedaan]. Such an approach can actually lead to the wrong conclusion, especially when statistical power is low.
[3] Collis et al. (2013) rapporteerden TAF’s van pink, ringvinger en middelvinger. De werkgroep berekenende hiervan het gemiddelde. Daarnaast werd van de gerapporteerde standaardfouten de mediaan berekend. Jerosch-Herold et al. (2011) rapporteerden een 95% betrouwbaarheidsinterval. Hiervan berekende de werkgroep de standaardfout als volgt: 95% BI / 3.92 (= 2 * 1.96).
[4] Kemler et al. (2012) rapporteerden standaarddeviaties. De werkgroep berekende de standardfout als de wortel uit (SD12/n1 + SD22/n2); SD1=22; SD2=21. Kemler et al. berekenden een en ander voor het PIP-gewricht.
[5] De werkgroep meent dat een situatie van ernstiger contractuurbeperkingen het meest overeenkomt met de Nederlandse situatie.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep drie systematische literatuuranalyses verricht met de volgende PICO-vraagstelling:
- Wat is na een operatie of naaldbehandeling van patiënten met Dupuytren, met of zonder restkromstand van de vinger, het effect van handtherapie versus niets doen?
- Wat is na een operatie of naaldbehandeling van patiënten met Dupuytren, met of zonder restkromstand van de vinger, het effect van handtherapie plus spalktherapie versus niets doen?
- Wat is na een operatie of naaldbehandeling van patiënten met Dupuytren, met of zonder restkromstand van de vinger, het effect van handtherapie plus spalktherapie versus alleen handtherapie?
Zie onderstaande tabel voor uitkomstmaten.
Selectiecriteria
|
Type studies |
|
|
Type patiënten |
|
|
Interventie/control |
PICO 1 handtherapie versus niets doen PICO 2 handtherapie plus spalktherapie versus niets doen PICO 3 handtherapie plus spalktherapie versus alleen handtherapie |
|
Type uitkomstmaten |
handfunctie:
complicaties/neveneffecten
patient reported outcome measures:
|
|
Type setting |
|
|
Exclusiecriteria |
|
Ten aanzien van review PICO 1
Deze PICO-vraagstelling (handtherapie versus ‘niets doen’) werd in de richtlijn 2012 niet onderzocht. In de database PubMed/Medline en vervolgens in Scopus werd een exploratieve search verricht. De zoekverantwoording is weergegeven in de zoekverantwoording. Er is in PubMed/Medline gezocht naar studies die de laatste 10 jaar werden gepubliceerd, met beperking naar studieontwerp: alleen ‘vergelijkende studies’. In Scopus werd gezocht zonder limitering naar studieontwerp maar met limitering naar publicatiejaar (vanaf 2015) en taal (Engels).
De literatuurzoekactie leverde 493 treffers op: PubMed/Medline (119), Scopus (374). Van de 119 treffers in PubMed/Medline werden zes studies geselecteerd op basis van titel en samenvatting (Ball et al., 2016; Roll & Hardison, 2017; Rodrigues et al., 2015; Huisstede et al., 2018; Samargandi et al., 2017; Cantero-Téllez et al., 2015). Van de 374 treffers in Scopus werden vijf studies geselecteerd op basis van titel en samenvatting (Ferrara et al., 2020; Dutta et al., 2020; Mahapatra et al., 2018; Grazina et al., 2018; Denkler et al., 2017). Geen van de studies blijkt na lezing van de volledige tekst de PICO ‘handtherapie versus niets doen’ te hebben onderzocht. Wellicht is de reden van het ontbreken van vergelijkende studies voor ‘handtherapie versus niets doen’, dat postoperatieve handtherapie de gebruikelijke praktijk is sedert Dupuytren zijn naam aan de ziekte verbond, en het onthouden van handtherapie aan de patiënt als onethisch wordt beschouwd.[1]
Zie voor de redenen van exclusie de evidence tabellen.
Ten aanzien van review PICO 2
Deze PICO-vraagstelling (handtherapie plus spalktherapie versus ‘niets doen’) werd in de richtlijn 2012 niet expliciet genoemd maar er werden wel studies geïncludeerd die deze interventie onderzocht (lijken te) hebben: Rives et al. (1992); Ebskov et al. (2000). De laatste studie beschrijft alleen de spalktherapie. Tijdens de revisie in 2020/21 werden de selectiecriteria voor alle PICOs in de gehele richtlijn aangescherpt: niet-gerandomiseerde studies werden alleen nog meegenomen op voorwaarde dat deze vergelijkend waren opgezet. Dit betekent dat er expliciet aandacht moest zijn besteed aan verstorende variabelen, zoals het vermelden van de gehanteerde toewijzingscriteria van de verschillende behandelgroepen of het gebruik van statistische technieken voor de correctie van confounding etc. Zie hiervoor ROBINS-I tool (https://methods.cochrane.org/bias/risk-bias-non-randomized-studies-interventions).
Vanwege het aanscherpen van de selectiecriteria werden de twee artikelen die in 2012 wel werden geïncludeerd, nu geëxcludeerd: Rives et al, 1992, Ebskov et al., 2000. Gedetailleerde informatie hierover vindt u in de evidence tabellen.
De literatuurzoekactie is identiek aan die voor PICO 1. Geen van de gevonden studies onderzocht het effect van de interventie ‘handtherapie plus spalktherapie versus niets doen’. Daarnaast werden de resultaten van de zoekactie voor PICO 3 bestudeerd. Hierbij werden dezelfde studies geselecteerd voor bestudering van de volledige tekst. Geen van de studies betrof PICO 2.
Ten aanzien van review PICO 3
Deze PICO-vraagstelling (handtherapie plus spalktherapie versus handtherapie) werd in de richtlijn 2012 niet expliciet genoemd, maar er werden wel studies geïncludeerd die deze interventie onderzochten: Glassey et al. (2001); Jerosch-Herold et al. (2011). Tijdens de revisie in 2020/21 werden de selectiecriteria voor alle PICOs in de gehele richtlijn aangescherpt: niet-gerandomiseerde studies werden alleen nog meegenomen op voorwaarde dat deze vergelijkend waren opgezet. Dit betekent dat er expliciet aandacht moest zijn besteed aan verstorende variabelen, zoals het vermelden van de gehanteerde toewijzingscriteria van de verschillende behandelgroepen of het gebruik van statistische technieken voor de correctie van confounding etc. Zie hiervoor ROBINS-I tool (https://methods.cochrane.org/bias/risk-bias-non-randomized-studies-interventions).
Vanwege het aanscherpen van de selectiecriteria werd een artikel dat in 2012 wel werd geïncludeerd, nu geëxcludeerd: Glassey et al., 2001. Gedetailleerde informatie hierover vindt u in de evidence tabellen. In 2021 is met een systematische search de literatuur ge-updatet via Medline (OVID), Embase, Cinahl en de Cochrane library. Er is gezocht naar studies die vanaf het jaar 2010 zijn gepubliceerd. De search is beperkt wat betreft talen (Nederlands, Duits, Engels, Frans) (zie de zoekverantwoording). De literatuurzoekactie leverde 57 treffers op: Medline (21), Embase (17), Cinahl (11), Cochrane Library (8).
Vier studies werden geselecteerd op basis van titel en samenvatting. Na het lezen van de volledige artikelen voldeden twee primaire studies (Kemler et al., 2012; Collis et al., 2013) aan de inclusiecriteria. De derde primaire studie (Kitridis et al., 2018) bleek niet te voldoen aan de selectiecriteria. De vierde studie (Samargandi et al., 2017) betrof een goed opgezette en uitgevoerde systematisch review van gerandomiseerde en niet-gerandomiseerde studies waarvan de vraagstelling exact overeenkomt met de PICO van de werkgroep. Deze review bevat de studies van Kemler et al. (2012) en van Collis et al. (2013) evenals de studie van Jerosch-Herold et al. (2011), die in de richtlijn uit 2012 werd besproken. Deze systematische review heeft de werkgroep gebruikt voor de (detail-) beschrijving van geïncludeerde studies en de risk of bias beoordeling van de eerdergenoemde studies.[2] Zie de bijlage 'Beoordeling van de methodologische kwaliteit'.
[1] Herweijer et al. (2007) schrijven: “Prior to this study, a randomized clinical trial evaluating the effects of postoperative hand therapy compared to a control or placebo group did not seem feasible because postoperative
Hand therapy is common medical practice. Withholding patients’ ‘correct’ aftercare was assumed unethical”.
[2] In deze review is de GRADE benadering onvolledig / onjuist toegepast en daarom niet overgenomen. De onvolledigheid betreft met name het niet-toepassen van de GRADE-factoren indirect bewijs, inconsistentie en ernstige onnauwkeurigheid. Kwaliteit van bewijs is daarom per uitkomstmaat door de werkgroep zelf beoordeeld. Eveneens heeft de werkgroep per uitkomstmaat gegradeerde conclusies geformuleerd.
Referenties
- Abbott, K., Denney, J., Burke, F. D., & McGrouther, D. A. (1987). A review of attitudes to splintage in Dupuytren's contracture. Journal of hand surgery (Edinburgh, Scotland), 12(3), 326–328. https://doi.org/10.1016/0266-7681(87)90182-3
- Clare, T., Hazari, A., Belcher, H. (2004). Post-operative splinting to maintain full extension of the PIPJ after fasciectomy. British Journal of Plastic Surgery 57;(2),179-80.
- Collis, J., Collocott, S., Hing, W., & Kelly, E. (2013). The effect of night extension orthoses following surgical release of Dupuytren contracture: a single-center, randomized, controlled trial. The Journal of hand surgery, 38(7), 1285–94.e2. https://doi.org/10.1016/j.jhsa.2013.04.012
- Del Frari, B., Estermann, D., & Piza-Katzer, H. (2005). Die Dupuytrensche Kontraktur - Rezidiveingriffe [Dupuytren's contracture -- surgery of recurrencies]. Handchirurgie, Mikrochirurgie, plastische Chirurgie: Organ der Deutschsprachigen Arbeitsgemeinschaft fur Handchirurgie: Organ der Deutschsprachigen Arbeitsgemeinschaft fur Mikrochirurgie der Peripheren Nerven und Gefasse: Organ der V..., 37(5), 309–315. https://doi.org/10.1055/s-2005-872820
- Ebskov, L.B., Boeckstyns, M.E., Sorensen, A.I., Soe-Nielsen, N. (2000). Results after surgery for severe Dupuytren's contracture: does a dynamic extension splint influence outcome? Scandinavian Journal of Plastic & Reconstructive Surgery & Hand Surgery 34;(2),155-60.
- Evans, R. B., Dell, P. C., & Fiolkowski, P. (2002). A clinical report of the effect of mechanical stress on functional results after fasciectomy for Dupuytren's contracture. Journal of hand therapy: official journal of the American Society of Hand Therapists, 15(4), 331–339. https://doi.org/10.1016/s0894-1130(02)80004-7
- Flowers KR (2002). A proposed decision hierarchy for splinting the stiff joint, with an emphasis on force application parameters. J Hand Ther. 15(2):158-62. doi: 10.1053/hanthe.2002.v15.015015. PMID: 12086026.
- Glasgow C, Wilton J, Tooth L (2003). Optimal daily total end range time for contracture: resolution in hand splinting. J Hand Ther. 16(3):207-18. doi: 10.1016/s0894-1130(03)00036-x. PMID: 12943123.
- Glassey, N. (2001). A Study of the Effect of Night Extension Splintage on Post-Fasciectomy Dupuytren's Patiënts. British Journal of Hand Therapy;6,89-94.
- Herweijer, H., Dijkstra, P. U., Nicolai, J. P., & Van der Sluis, C. K. (2007). Postoperative hand therapy in Dupuytren's disease. Disability and rehabilitation, 29(22), 1736–1741. https://doi.org/10.1080/09638280601125106
- Ioannidis, J. P., Patsopoulos, N. A., & Rothstein, H. R. (2008). Reasons or excuses for avoiding meta-analysis in forest plots. BMJ (Clinical research ed.), 336(7658), 1413–1415. https://doi.org/10.1136/bmj.a117
- Jerosch-Herold, C., Shepstone, L., Chojnowski, A. J., Larson, D., Barrett, E., & Vaughan, S. P. (2011). Night-time splinting after fasciectomy or dermo-fasciectomy for Dupuytren's contracture: a pragmatic, multi-centre, randomised controlled trial. BMC musculoskeletal disorders, 12, 136. https://doi.org/10.1186/1471-2474-12-136.
- Kemler, M. A., Houpt, P., & van der Horst, C. M. (2012). A pilot study assessing the effectiveness of postoperative splinting after limited fasciectomy for Dupuytren's disease. The Journal of hand surgery, European volume, 37(8), 733–737. https://doi.org/10.1177/1753193412437631
- Kottke FJ, Pauley DL, Ptak RA (1966). The rationale for prolonged stretching for correction of shortening of connective tissue. Arch Phys Med Rehabil. 47(6):345-52. PMID: 5940624.
- Larson, D., & Jerosch-Herold, C. (2008). Clinical effectiveness of post-operative splinting after surgical release of Dupuytren's contracture: a systematic review. BMC musculoskeletal disorders, 9, 104. https://doi.org/10.1186/1471-2474-9-104
- Page C. (2000). Postoperative Management of Dupuytren's Contracture. Techniques in hand & upper extremity surgery, 4(2), 141–145. https://doi.org/10.1097/00130911-200006000-00012
- Peterson-Bethea D. (1997). A static progressive splint for Dupuytren's release. Journal of hand therapy: official journal of the American Society of Hand Therapists, 10(4), 312–313. https://doi.org/10.1016/s0894-1130(97)80047-6
- Rives, K., Gelberman, R., Smith, B., Carney, K. (1992). Severe contractures of the proximal interphalangeal joint in Dupuytren's disease: results of a prospective trial of operative correction and dynamic extension splinting. Journal of Hand Surgery - American Volume;17(6),1153-9.
- Rodrigues, J. N., Becker, G. W., Ball, C., Zhang, W., Giele, H., Hobby, J., Pratt, A. L., & Davis, T. (2015). Surgery for Dupuytren's contracture of the fingers. The Cochrane database of systematic reviews, 2015(12), CD010143. https://doi.org/10.1002/14651858.CD010143.pub2
- Samargandi, O. A., Alyouha, S., Larouche, P., Corkum, J. P., Kemler, M. A., & Tang, D. T. (2017). Night Orthosis After Surgical Correction of Dupuytren Contractures: A Systematic Review. The Journal of hand surgery, 42(10), 839.e1–839.e10. https://doi.org/10.1016/j.jhsa.2017.06.100
- Witthaut, J., Bushmakin, A. G., Gerber, R. A., Cappelleri, J. C., & Le Graverand-Gastineau, M. P. (2011). Determining clinically important changes in range of motion in patients with Dupuytren's Contracture: secondary analysis of the randomized, double-blind, placebo-controlled CORD I study. Clinical drug investigation, 31(11), 791–798. https://doi.org/10.1007/BF03256918.
Evidence tabellen
|
Study ID |
Study type |
Patients (P) |
Intervention (I1) |
Control Intervention (I2)
|
Funding |
Outcomes measures and follow-up duration |
Results |
|
Collis et al, 2013 |
RCT, single center |
56 patients Mean age: 63y
|
Night thermoplastic dorsal Extension orthoses protocol with hand therapy |
Any or all of the Following treatments: active tendon gliding range of motion exercises, education, wound and scar therapy, passive stretch with or without heat to increase finger extension and/or flexion, intermittent use of daytime finger-based dynamic PIP joint extension orthoses, and grip strengthening |
None declared |
TAE of operated fingers, total active flexion of operated fingers, DASH score; FU: 3 months |
No statistically significant differences were found on
|
|
Kemler et al, 2012 |
RCT, 2-center |
54 patients Mean age, 67y |
Thermoplastic dorsal static finger Extension orthosis protocol with hand therapy (day and night for 4 wk, followed by night only up to 3 mo) |
Standardized program of graded exercises (no further details). |
None declared. |
The mean extension deficit, patients rated global Perceived effect, and VAS for pain and comfort; FU: 12 months |
No statistically significant differences were found on
|
|
Jerosch- Herold et al, 2011 |
RCT, multicenter |
154 patients Mean age: 67.2y |
Static night orthosis with concomitant hand therapy (for 6 mo) |
No detail provided |
Nonindustrial Funding was received |
TAE of operated fingers, total active flexion of operated fingers, DASH score; FU: 12 months |
No statistically significant differences were found on
|
Risk of bias beoordeling
|
Trial |
Random sequence generation |
Allocation concealment |
Blinding of participants and personnel |
Blinding of outcome assessment |
Incomplete outcome data |
Selective reporting |
||
|
Collis J, 2013 |
Unclear risk |
Unclear risk |
High risk |
High risk |
Low risk |
Low risk |
||
|
Kemler M, 2012 |
Low risk |
Unclear risk |
High risk |
High risk |
Low risk |
High risk |
||
|
Jerosch-Herold et al., 2011 |
High risk |
Low risk |
High risk |
High risk |
Low risk |
High risk |
||
Source: Samargandi et al. (2017; table 4). TABLE 4. Risk of Bias of the Included Randomized Trials Using the Cochrane Collaboration’s Tool for
Redenen van exclusie van studies
|
Studie_ID |
Studieontwerp |
Reden exclusie |
|
Ball et al., 2016 |
Systematic review |
Betreft geen postoperatieve therapie |
|
Cantero-Téllez et al., 2015 |
RCT |
Ziekte van Dupuytren is exclusiecriterium. Bovendien worden twee actieve interventies onderling vergeleken. |
|
Denkler et al., 2017 |
Narratieve review |
Beschrijft studies waarin handtherapie + spalktherapie versus handtherapie wordt beschreven (=PICO 3) |
|
Dutta et al., 2020 |
Systematic review |
Beschrijft studies waarin handtherapie + spalktherapie versus handtherapie wordt beschreven (=PICO 3) |
|
Ebskov et al., 2000 |
Prospectieve cohort studie |
Geen controle voor confounders |
|
Ferrara et al., 2020 |
Systematic review |
Betreft geen postoperatieve therapie |
|
Glassey et al., 2001 |
Retrospectieve cohort studie |
Retrospectief |
|
Grazina et al., 2018 |
Narratieve review |
Beschrijft studies waarin handtherapie + spalktherapie versus handtherapie wordt beschreven (=PICO 3) Bovendien geen systematische review |
|
Huisstede et al., 2018 |
Systematic review |
Beschrijft studies waarin handtherapie + spalktherapie versus handtherapie wordt beschreven (=PICO 3)
Beschrijft studie waarin intermitterende compressie wordt vergeleken met constante compressie (beantwoordt noch PICO 1 noch PICO 2) |
|
Mahapatra et al., 2018 |
Patiëntenserie |
Geen studie met direct vergelijkende opzet |
|
Rives et al., 1992 |
Prospectieve cohort studie |
Geen controlegroep |
|
Rodrigues et al., 2015 |
Cochrane Review |
Beschrijft studies waarin handtherapie + spalktherapie versus handtherapie wordt beschreven (=PICO 3) |
|
Roll & Hardison, 2017 |
Systematic review |
Beschrijft studies waarin handtherapie + spalktherapie versus handtherapie wordt beschreven (=PICO 3) |
|
Samargandi et al., 2017 |
Systematic review |
Beschrijft studies waarin handtherapie + spalktherapie versus handtherapie wordt beschreven (=PICO 3) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-04-2022
Beoordeeld op geldigheid : 15-02-2022
Uiterlijk in 2026 bepaalt het bestuur van de Nederlandse Vereniging voor Plastische Chirurgie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Plastische Chirurgie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van het project is het herzien van de huidige richtlijn ‘Ziekte van Dupuytren’ die dateert uit 2012. Afgezien van het verstrijken van de reguliere termijn voor herziening is er onderzoek verricht waarin partiële fasciëctomie vergeleken is met naaldfasciotomie. Mogelijk kan er een antwoord worden gegeven in welke situatie de voorkeur moet worden gegeven aan een van de twee behandelingen.
Doelgroep
De richtlijn is met name bedoeld voor alle leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen en overige zorgverleners die de ziekte van Dupuytren behandelen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2020 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van Dupuytren in alle stadia. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. M.A. Kemler (voorzitter), plastisch chirurg, Martini Ziekenhuis, Groningen
- Drs. R.S. de Wijn, plastisch chirurg, Rode Kruis Ziekenhuis, Beverwijk en het Spaarne Gasthuis, Haarlem/Hoofddorp
- Dr. A.L. Van Rijssen, plastisch chirurg, Isala, Zwolle
- Mevr. Y.E van Kooij, MSc, CHT-NL, handtherapeut / fysiotherapeut, Xpert Handtherapie, Zeist
- Mevr. M.P.M. Ottenhof, CHT-NL handtherapeut/fysiotherapeut, Hand & Pols Centrum Amsterdam
- dr. M. van Heijl, traumachirurg, Hand en Pols Centrum Diakonessenhuis, Utrecht/Zeist/Doorn en Traumazorgnetwerk Midden Nederland, Utrecht
- dr. R.J.H.M. Steenbakkers, radiotherapeut, Universitair Medisch Centrum, Groningen
- Drs. J.B.J. Geise, Stichting Dupuytren Nederland, Dronten
Meelezers
- de Werkgroep Hand- en Polsrevalidatie van de VRA
Met ondersteuning van
- Drs. B.S. Niël-Weise, arts-microbioloog (n.p.), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
- Mw. Drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Plastische Chirurgie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Intellectuele belangen en reputatie |
Extern gefinancierd onderzoek |
Overige belangen |
|
|
Kemler |
Plastisch chirurg in Martini Ziekenhuis Groningen en Wilhelmina Ziekenhuis Assen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
|
De Wijn |
Plastisch chirurg: Spaarne Gasthuis, Rode Kruis Ziekenhuis Beverwijk en Kliniek Blooming |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
|
Van Rijssen |
Plastisch Chirurg Isala & St Jansdal |
|
Geen |
Geen |
Geen |
Geen |
Geen |
|
|
van Kooij |
Fysiotherapeut/ Handtherapeut - Xpert Handtherapie |
Betaalde neven functies:
Onbetaalde nevenfuncties
|
Geen |
Geen |
Geen
|
Geen |
Geen |
|
|
Ottenhof |
Fysiotherapeut/handtherapeut Hand & Pols Centrum Amsterdam |
Docent handtherapiie opleiding NPI: onderwerp: klinimetrie |
geen |
geen |
geen |
geen |
geen |
|
|
van Heijl |
4 dagen per week: Traumachirurg, aandachtsgebied hand/pols letsel Hand-pols centrum Diakonessenhuis Utrecht/Zeist/Doorn
1 dag per week: traumanetwerk midden Nederland t.b.v. begeleiding wetenschappelijk onderzoek |
|
geen |
geen |
geen |
geen |
geen |
|
|
Steenbakkers |
Radiotherapeut-oncoloog, Universitair Medisch Centrum Groningen |
geen |
geen |
geen |
geen |
ZonMW: onderzoek naar effectiviteit radiotherapie bij ziekte van Lederhose |
geen |
|
|
Geise |
Als gepensioneerd chemicus heb ik geen werkgever. Mijn participatie aan deze NVPC commissie geschiedt vanuit mijn bestuurslidmaatschap van de Stichting Dupuytren Nederland. |
Mijn bestuursfunctie bij de Stichting Dupuytren Nederland betreft de behartiging van de belangen van patiënten met de ziekte van Dupuytren. Deze functie is onbetaald. |
geen |
geen |
Mogelijk (en hopelijk) zullen patiënten met de ziekte van Dupuytren baat hebben bij het opstellen van de nieuwe richtlijn. Voor zover dat door hen beschouwd zou kunnen worden als mede tot stand gebracht door mijn participatie in deze commissie dan slaat dat terug op het gehele stichtingsbestuur, waarvan ik zelf de afgevaardigde ben. |
geen |
geen |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Stichting Dupuytren Nederland en de Patiëntenfederatie te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Patiënten werden tevens in de werkgroep vertegenwoordigd door één afgevaardigde van de Stichting Dupuytren Nederland. Ook werd er gebruik gemaakt van de resultaten van een enquête die de Stichting Dupuytren Nederland in 2020 onder Dupuytren patiënten heeft uitgezet.
Tijdens de commentaarfase werd de Stichting Dupuytren Nederland en de Patiëntenfederatie gevraagd om input.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie de bijlage Implementatieplan).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen (https://www.zorginstituutnederland.nl/).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseurs welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Zorgverzekeraars Nederland, Patiëntenfederatie Nederland, Stichting Dupuytren Nederland, Nederlands Huisartsen Genootschap, Nederlandse Vereniging voor Plastische Chirurgie, Nederlandse Vereniging van Revalidatieartsen, Nederlandse Vereniging voor Heelkunde, Koninklijk Nederlands Genootschap voor Fysiotherapie, Nederlandse Vereniging voor Radiotherapie en Oncologie, en de Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde.
Bijna tegelijkertijd werd ook de NHG-Standaard Hand- en polsklachten (beperkt) herzien. Met betrekking tot het onderwerp ‘Dupuytren in de eerste lijn’ hebben de verschillende werkgroepen onderling afgestemd, zodat de richtlijnen op elkaar aansluiten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
In de databases Ovid Medline en Embase werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews (zie de zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
In de richtlijn 2012 werd de EBRO classificatie gebruikt voor het bepalen van de bewijskracht (“opzet en uitvoering”) van individuele studies en voor het bewijsniveau van de conclusies. Bij de revisie werd de EBRO-gradatie van de conclusies (“kwaliteit van bewijs”) vervangen door de GRADE-gradatie. Hiertoe zijn, waar nodig, de opzet en uitvoering van de individuele studies opnieuw beoordeeld.
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Redelijk |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De wenselijke en onwenselijke uitkomsten van de onderzochte interventies, de mate van zekerheid (‘bewijskracht’) hiervan (zie onder Beoordelen van de kracht van het wetenschappelijke bewijs) en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen (zie onder Overwegingen) bepalen samen de sterkte en richting van de aanbeveling. GRADE onderscheidt op basis hiervan vier categorieën van aanbevelingen: sterk (1A) en zwak (1B) voor een bepaalde interventie en sterk (2A) en zwak (2B) tegen een bepaalde interventie. Conform de GRADE-methodiek sluit een (zeer) geringe bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, de aard van de gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Ter informatie: de hiervoor genoemde aanduidingen voor de sterkte van een aanbeveling (1A, 1B etc.) wordt in Nederlandse richtlijnen, zo ook hier, niet gebruikt. In Nederland komt de sterkte van een aanbeveling terug in de bewoording. Zo worden bijvoorbeeld de termen ‘dienen’en ‘moeten’ gebruikt bij een sterke aanbeveling, ‘overwegen’ en ‘bij voorkeur’ bij een zwakke aanbeveling.
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Referenties
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Met betrekking tot PICO 1 en 2:
Database: PubMed/Medline
"dupuytren contracture"[MeSH Terms] OR ("dupuytren"[All Fields] AND "contracture"[All Fields]) OR "dupuytren contracture"[All Fields] OR ("dupuytren s"[All Fields] AND "contracture"[All Fields]) OR "dupuytren s contracture"[All Fields] OR ("dupuytren contracture"[MeSH Terms] OR ("dupuytren"[All Fields] AND "contracture"[All Fields]) OR "dupuytren contracture"[All Fields])
Filters: Clinical Trial, Comparative Study, Randomized Controlled Trial, Systematic Review, in the last 10 years.
Database: Scopus
TITLE-ABS-KEY (dupuytren) AND (LIMIT-TO (PUBYEAR, 2021) OR LIMIT-TO (PUBYEAR, 2020) OR LIMIT-TO (PUBYEAR, 2019) OR LIMIT-TO (PUBYEAR, 2018) OR LIMIT-TO (PUBYEAR, 2017) OR LIMIT-TO (PUBYEAR, 2016) OR LIMIT-TO (PUBYEAR, 2015)) AND (LIMIT-TO (PUBSTAGE, "final")) AND (LIMIT-TO (DOCTYPE, "ar")) AND (LIMIT-TO (EXACTKEYWORD, "Human")) AND (LIMIT-TO (LANGUAGE, "English")) AND (LIMIT-TO (SRCTYPE, "j"))
Met betrekking tot PICO 3:
Database: Ovid MEDLINE(R) ALL <1946 to October 01, 2020>
Search Strategy:
--------------------------------------------------------------------------------
1 "spalktherapie".ti. (0)
2 "collis$".fc_auts. and "The Effect of Night Extension Orthoses Following Surgical Release of Dupuytren Contracture".fc_titl. (1)
3 "A pilot study assessing the effectiveness of postoperative splinting after limited fasciectomy for Dupuytren’s".fc_titl. (1)
4 2 or 3 (2)
5 "ziekte van Dupuytren".ti. (0)
6 Dupuytren Contracture/ (2703)
7 dupuytren*.tw. (2884)
8 dupuytren*.kf. (756)
9 (fibromatosis adj3 palmar*).tw. (96)
10 (fibromatosis adj3 palmar*).kf. (10)
11 or/6-10 (3383)
12 11 (3383)
13 limit 12 to yr="2012 -Current" (920)
14 (dutch or english or german or french).la. (28824971)
15 guideline/ or practice guideline/ (34662)
16 guideline?.ti,kf. (87799)
17 15 or 16 (107819)
18 13 and 14 and 17 (3)
19 "filter systematic reviews".ti. (0)
20 meta analysis.pt. (120242)
21 (meta-anal$ or metaanal$).tw,kf. (185272)
22 (quantitativ$ adj10 (review$ or overview$)).tw. (9791)
23 (systematic$ adj10 (review$ or overview$)).tw. (203520)
24 (methodologic$ adj10 (review$ or overview$)).tw. (12356)
25 (quantitativ$ adj10 (review$ or overview$)).kf. (79)
26 (systematic$ adj10 (review$ or overview$)).kf. (21297)
27 (methodologic$ adj10 (review$ or overview$)).kf. (77)
28 medline.tw. and review.pt. (80412)
29 (pooled adj3 analy*).tw. (20717)
30 (pooled adj3 analy*).kf. (278)
31 "cochrane$".fc_jour. (15018)
32 or/20-31 (373721)
33 13 and 14 and 32 (45)
34 "rodrigues$".fc_auts. and "surgery for".fc_titl. (297)
35 "dupuytr*".fc_titl. (2428)
36 34 and 35 (3)
37 "soreide$".fc_auts. and "treatment ".fc_titl. and "2018".fc_pubyr. and "1138".fc_pg. (1)
38 from 36 keep 3 (1)
39 from 37 keep 1 (1)
40 from 36 keep 3 (1)
41 Fasciotomy/ (3735)
42 Fascia/ (6973)
43 fasci*.tw,kw. (83648)
44 Dupuytren Contracture/su [Surgery] (1011)
45 Orthopedic Procedures/mt [Methods] (10218)
46 or/41-45 (97694)
47 11 and 14 and 46 (1337)
48 47 (1337)
49 limit 48 to yr="2011 -Current" (484)
50 32 and 49 (32)
51 Skin Transplantation/ (35547)
52 (skin adj2 (graft* or transplant*)).tw,kw. (21115)
53 46 or 51 or 52 (140108)
54 11 and 14 and 53 and 32 (35)
55 54 (35)
56 limit 55 to yr="2011 -Current" (32)
57 (dermofasc* or dermatofas*).tw,kw. (97)
58 46 or 51 or 52 or 57 (140118)
59 44 or 58 (140118)
60 11 and 14 and 59 (1356)
61 60 (1356)
62 limit 61 to yr="2011 -Current" (492)
63 32 and 62 (32)
64 "Filter observationele studies".ti. (0)
65 epidemiologic studies/ (8413)
66 exp case-control studies/ (1106726)
67 exp cohort studies/ (2036161)
68 cross-sectional studies/ (338460)
69 (case adj3 control).tw,kf. (136496)
70 (cohort adj5 (study or studies or analy$)).tw,kf. (281370)
71 (follow-up adj5 (study or studies)).tw,kf. (92803)
72 (longitudinal or retrospective or prospective or (cross adj5 sectional)).tw,kf. (1633636)
73 (observational adj5 (study or studies)).tw,kf. (152201)
74 or/65-73 (3285400)
75 "medline rct filter".ti. (0)
76 controlled-clinical-trial.pt. (93863)
77 randomized-controlled-trial.pt. (514078)
78 randomized controlled trial/ (514078)
79 randomi?ed controlled trial?.tw. (184395)
80 randomi?ed controlled trial?.kf. (11803)
81 random-allocation.tw,kf. (1756)
82 double-blind-method.tw,kf. (504)
83 single-blind-method.tw,kf. (93)
84 (random adj8 (selection? or sample?)).kf,tw. (46540)
85 random*.tw,kf. (1178631)
86 or/76-85 (1388461)
87 11 and 14 and 59 (1356)
88 limit 87 to yr="2011 -Current" (492)
89 (88 and 86) not 32 (47)
90 (87 and 74) not (32 or 86) (328)
91 mt.fs. (3842405)
92 clinical decision-making/ or prognosis/ (522195)
93 exp Recurrence/ (184567)
94 Postoperative Complications/ (366845)
95 Postoperative Care/ (59487)
96 exp Patient Satisfaction/ (90291)
97 Dupuytren Contracture/rh (57)
98 "Hand Deformities, Acquired"/ (2689)
99 "Hand Deformities, Acquired"/rh (123)
100 Rehabilitation/ (18297)
101 Return to Work/ (2629)
102 91 or 92 or 93 or 94 or 95 or 96 or 97 or 99 or 100 or 101 (4751614)
103 ((patient adj2 reported adj2 outcome) or (patient adj2 satifac*) or rehabilitat* or benefit? or harm?).tw,kw. (893040)
104 ((patient adj2 reported adj2 outcome) or (patient adj2 satifac*) or rehabilitat* or benefit? or harm? or complicat*).tw,kw. (1946115)
105 102 or 104 (6091146)
106 90 and 105 (206)
107 exp Propensity Score/ or Propensity.mp. (64576)
108 13 and 14 and 107 (6)
109 physical therapy modalities/ or manipulation, orthopedic/ or motion therapy, continuous passive/ or therapy, soft tissue/ (41315)
110 Dupuytren Contracture/rh (57)
111 11 and rh.fs. (69)
112 Dupuytren Contracture/th (248)
113 (hand adj2 therap*).tw,kw. (1400)
114 11 and 109 (48)
115 (hand adj2 exercise).tw,kw. (425)
116 Orthotic Devices/ (6465)
117 external fixators/ or splints/ (14522)
118 Occupational Therapy/ (13336)
119 ((orthotic adj2 device?) or splint? or (occupational adj2 therap*) or (physical adj2 therap*) or physiotherap*).tw,kw. (71089)
120 or/110-119 (94377)
121 11 (3383)
122 limit 121 to yr="2010 -Current" (1094)
123 14 and 120 and 122 (192)
124 comparative study/ (1871367)
125 123 and (32 or 86 or 74 or 124) (111)
126 110 or 111 or 112 or 113 or 114 or 115 (2117)
127 125 and 126 (95)
128 116 or 117 or 119 (87059)
129 127 and 128 (24)
Database: Embase <1974 to 2020 October 02>
Search Strategy:
--------------------------------------------------------------------------------
1 "spalktherapie".ti. (0)
2 "collis$".fc_auts. and "The Effect of Night Extension Orthoses Following Surgical Release of Dupuytren Contracture".fc_titl. (1)
3 "A pilot study assessing the effectiveness of postoperative splinting after limited fasciectomy for Dupuytren’s".fc_titl. (1)
4 2 or 3 (2)
5 Dupuytren contracture/ (3059)
6 dupuytren*.tw. (2800)
7 dupuytren*.kw. (708)
8 (contracture adj2 palmar).tw. (39)
9 (fibromatosis adj3 palmar*).tw. (114)
10 (contracture adj2 palmar).kw. (7)
11 (fibromatosis adj3 palmar*).kw. (26)
12 or/5-11 (3533)
13 12 (3533)
14 limit 13 to yr="2012 -Current" (1307)
15 (dutch or english or german or french).la. (31661491)
16 practice guideline/ (430672)
17 14 and 15 and 16 (20)
18 "filter systematic reviews & meta-analyses Embase ".ti. (0)
19 meta analysis/ (197095)
20 "systematic review"/ (262794)
21 (meta-analy$ or metaanaly$).tw. (238786)
22 (meta-analy$ or metaanaly$).kw. (57863)
23 (systematic$ adj4 (review$ or overview$)).tw. (248265)
24 (systematic$ adj4 (review$ or overview$)).kw. (31390)
25 (quantitativ$ adj5 (review? or overview?)).tw,kw. (5634)
26 (methodologic adj5 (overview? or review?)).tw,kw. (389)
27 (review$ adj3 (database? or medline or embase or cinahl)).tw,kw. (29169)
28 (pooled adj3 analy$).tw,kw. (31664)
29 (extensive adj3 review$ adj3 literature).tw,kw. (3853)
30 (meta or synthesis or (literature adj8 database?) or extraction).tw,kw. (1496934)
31 review.pt. (2629072)
32 30 and 31 (166869)
33 or/19-29,32 (591217)
34 14 and 15 and 33 (73)
35 fascia disease/su [Surgery] (77)
36 Dupuytren contracture/su [Surgery] (897)
37 fasciotomy/ (4968)
38 fascia/su [Surgery] (680)
39 fasci*.tw,kw. (102278)
40 exp skin transplantation/ (54037)
41 (skin adj2 (graft* or transplant*)).tw,kw. (24271)
42 or/35-41 (160920)
43 12 and 15 and 33 and 42 (45)
44 43 (45)
45 limit 44 to yr="2011 -Current" (36)
46 "filter randomised controlled trials Embase".ti. (0)
47 randomization/ (88306)
48 exp randomized controlled trial/ (623560)
49 exp controlled clinical trial/ (810346)
50 Major Clinical Study/ (3874058)
51 random$.tw. (1580845)
52 random$.kw. (50006)
53 Double Blind Procedure/ (176401)
54 or/47-53 (5265855)
55 "filter observationele studies emb sign".ti. (0)
56 Clinical study/ (155907)
57 Case control study/ (161407)
58 Family study/ (26089)
59 Longitudinal study/ (145193)
60 Retrospective study/ (969641)
61 Prospective study/ (630435)
62 Randomized controlled trials/ (187393)
63 61 not 62 (623637)
64 Cohort analysis/ (620310)
65 (Cohort adj (study or studies)).tw,kw. (317909)
66 (Case control adj (study or studies)).tw,kw. (138791)
67 (follow up adj (study or studies)).tw,kw. (67492)
68 (observational adj (study or studies)).tw,kw. (174832)
69 (epidemiologic$ adj (study or studies)).tw,kw. (110306)
70 (cross sectional adj (study or studies)).tw,kw. (230034)
71 56 or 57 or 58 or 59 or 60 or 63 or 64 or 65 or 66 or 67 or 68 or 69 or 70 (2817481)
72 12 and 15 and 42 (1301)
73 72 (1301)
74 limit 73 to yr="2011 -Current" (608)
75 (74 and 54) not 33 (112)
76 exp comparative study/ (1427469)
77 major clinical study/ (3874058)
78 76 or 77 (5053180)
79 75 and 78 (84)
80 (74 and 71) not (33 or 54) (83)
81 75 not (43 or 79 or 80) (28)
82 propensity score/ (30900)
83 propensity.tw,kw. (88715)
84 82 or 83 (91063)
85 14 and 15 and 84 (6)
86 Dupuytren contracture/th (217)
87 Dupuytren contracture/rh (57)
88 physiotherapy/ (85662)
89 exp home physiotherapy/ (324)
90 soft tissue therapy/ or manipulative medicine/ (11076)
91 (hand adj2 therap*).tw,kw. (2020)
92 (hand adj2 exercise).tw,kw. (616)
93 Occupational Therapy/ (22009)
94 ((occupational adj2 therap*) or (physical adj2 therap*) or physiotherap*).tw,kw. (98975)
95 or/86-94 (154532)
96 exp splint/ or orthosis/ or finger splint/ (15231)
97 external fixator/ (5804)
98 ((orthotic adj2 device?) or othosis or splint?).tw,kw. (11325)
99 or/96-98 (27320)
100 12 (3533)
101 limit 100 to yr="2010 -Current" (1568)
102 15 and 101 (1517)
103 95 and 99 and 102 (32)
104 103 and (33 or 54 or 71 or 76) (20)
105 limit 104 to (embase and embase status) (15)
106 limit 103 to (embase and embase status) (23)
107 106 not 104 (8)
108 splinting.od. (4134)
109 95 and (99 or 108) and 102 (49)
110 109 and (33 or 54 or 71 or 76) (29)
111 110 not 104 (9)
Cochrane
Last Saved: 05/10/2020 14:27:45
Comment: search oktober 2020
ID Search
#1 Dupuytren*:ti,ab,kw
#2 MeSH descriptor: [Dupuytren Contracture] this term only
#3 MeSH descriptor: [Fibroma] this term only
#4 Fibromatosis:ti,ab,kw
#5 MeSH descriptor: [Fascia] explode all trees
#6 palmar NEAR/3 (fibromatosis or fascia):ti,ab,kw
#7 #1 or #2 or #3 or #4 or #5 or #6
#8 (Fasciotom* OR surgery or fasciect* or collagenas*):ti,ab,kw
#9 MeSH descriptor: [Fasciotomy] this term only
#10 MeSH descriptor: [Microbial Collagenase] this term only
#11 collagenas*:ti,ab,kw
#12 #8 OR #9 OR #10 OR #11
#13 #7 AND #12
#14 #10 or #11
#15 #8 OR #9
#16 #7 AND #14 AND #15
#17 MeSH descriptor: [Radiotherapy] explode all trees
#18 MeSH descriptor: [Radiofrequency Therapy] explode all trees
#19 MeSH descriptor: [Radiation] explode all trees
#20 (radiation or radiother*):ti,ab,kw
#21 #17 or #18 or #19 or #20
#22 #7 and #21
#23 lipofilling:ti,ab,kw
#24 (fat near/2 transplant*):ti,ab,kw
#25 #23 or #24
#26 #7 and #25
#27 MeSH descriptor: [Dupuytren Contracture] explode all trees and with qualifier(s): [rehabilitation - RH, therapy - TH]
#28 (hand NEAR/2 (therap* or exercis*)):ti,ab,kw
#29 MeSH descriptor: [Occupational Therapy] explode all trees
#30 (occupational near/2 therap*):ti,ab,kw
#31 MeSH descriptor: [Orthotic Devices] explode all trees
#32 MeSH descriptor: [External Fixators] explode all trees
#33 splint*:ti,ab,kw
#34 #27 or #28 or #29 or #30
#35 #31 or #32 or #33
#36 #7 and #34 and #35 aantal gevonden refs 9
Cinahl 05/10/2020
|
# |
Query |
Results |
|
S36 |
S33 and (S28 or S18) and S29 |
11 |
|
S35 |
S33 and S28 and S29 |
7 |
|
S34 |
S33 and S28 and S29 |
12 |
|
S33 |
S2 or S3 |
334 |
|
S32 |
S15 AND S31 |
1,213 |
|
S31 |
S29 AND S30 |
3,098 |
|
S30 |
S18 OR S20 OR S28 |
190,572 |
|
S29 |
S21 OR S22 OR S23 |
16,957 |
|
S28 |
S24 OR S25 OR S26 OR S27 |
190,157 |
|
S27 |
TI (((occupational or physical) N2 therap*)) OR AB (((occupational or physical) N2 therap*)) |
44,827 |
|
S26 |
TI (hand N2 (exercise* or therap*)) OR AB (hand N2 (exercise* or therap*)) |
1,510 |
|
S25 |
(MH "Occupational Therapy+") |
27,060 |
|
S24 |
(MH "Physical Therapy+") |
143,899 |
|
S23 |
TI ((orthotic N2 device*) or splint*) OR AB ((orthotic N2 device*) or splint*) |
4,214 |
|
S22 |
(MH "External Fixators+") |
4,480 |
|
S21 |
(MH "Orthoses+") |
10,498 |
|
S20 |
S5 AND S19 |
715 |
|
S19 |
SU rehabilitation OR SU therapy |
1,358,428 |
|
S18 |
(MH "Dupuytren's Contracture/RH/TH") |
99 |
|
S17 |
(S6 AND S15) AND (S2 OR S3) |
Display |
|
S16 |
S6 AND S15 |
Display |
|
S15 |
S7 OR S8 OR S9 OR S10 OR S11 OR S12 OR S13 OR S14 |
Display |
|
S14 |
(MH "Placebos") OR (MH "Quantitative Studies") OR TX allocat* random* |
Display |
|
S13 |
TX random* allocat* OR TX placebo* |
Display |
|
S12 |
(MH "Random Assignment") |
Display |
|
S11 |
TX randomi* control* trial* |
Display |
|
S10 |
TX ((singl* n1 blind*) or (singl* n1 mask*)) or TX ((doubl* n1 blind*) or (doubl* n1 mask*)) or TX ((tripl* n1 blind*) or (tripl* n1 mask*)) or TX ((trebl* n1 blind*) or (trebl* n1 mask*)) |
Display |
|
S9 |
TX clinic* n1 trial* |
Display |
|
S8 |
PT Clinical trial |
Display |
|
S7 |
(MH "Clinical Trials+") |
Display |
|
S6 |
S2 OR S3 OR S4 |
Display |
|
S5 |
S1 OR S2 OR S3 OR S4 |
2,485 |
|
S4 |
(MH "Fascia") |
Display |
|
S3 |
AB "Dupuytren's Contracture" OR TI "Dupuytren's Contracture" OR MH "Dupuytren's |
142 |
|
S2 |
(MM "Dupuytren's Contracture") |
290 |
|
S1 |
(MH "Dupuytren's Contracture") |
Display |
